Alexeev V.N., Martynova E.B., Sadkov V.I., Samusenko I.A.
State Medical Academy named after Mechnikov I.M.
Departments of ophthalmology and pathological anatomy
St.- Petersburg
Purpose: to evaluate retina condition of rabbit eye in experimental glaucoma.
Materials and methods: trial was performed on 20 rabbits. The main group included 10 animals, in which adrenalin Р induced glaucoma (AIG) was generated. Control group included 10 animals. Histologic, histochemical and immunohistochemical examinations were performed in 3 months after the onset of experiment.
Results: In comparison with control group total amount of ganglionary neurons decreased from 509,67?12,35 to 279,00?5,18. That is the loss was 45,3% on average, and formed 0,5% every day. Mainly decreased the amount of minor neurons. The sickness of axon layer of ganglionary cells decreased. In group of AIG animals single cases of apoptosis were detected with histochemical methods. Immunohistochemical analysis showed increasing of glutamin synthetase synthesis in AIG animals. Besides, in these animals slight expression of NO-sythetase and GFAP, vimentin and GRABP I were found.
Conclusions: Loss of ganglionary neurons is observed already in early stages of glaucoma. This neuron loss predominantly depends on apoptosis. Increasing of Muller cells functional activity is observed in AIG.
Глиальные макрофаги впервые были описаны Мюллером и поэтому названы радиальными мюллеровскими клетками сетчатки. Долгое время их функции были не до конца понятны. Изучение этих образований активно продолжается и на сегодняшний день.
Мюллеровские клетки были найдены в сетчатке всех позвоночных, где они являлись преобладающими клетками офтальмоглии. Исходя из современных представлений, мюллеровские клетки выполняют сразу несколько функций: опорную – они проходят через все слои сетчатки в виде стержня. Их ядра лежат на уровне биполярных клеток, а отростки достигают наружной и внутренней пограничных мембран (Хэм А., Кормак Д., 1983). Мюллеровские клетки окружают своими аксонами все нейроны сетчатки и их дендриты. Кроме того, они выполняют метаболическую и трофическую функцию – нейтрализуют избыток таких нейротрансмиттеров, как L–глутамат и L–аспартат, регулируют количество оксида азота (Izumi Y., Kirby C.O., Benz A.M. et al., 1999; Winkler B.S., Matthew J.A., Brassel M.A. et al., 2000).
Нужно отметить, что в обычных концентрациях глутамат является нейротрансмиттером и участвует в передаче нервных импульсов путем активации NMDA (N–метил D–аспартат) рецепторов. Эти рецепторы особенно выражены в ганглиозных и амакринных клетках сетчатки (Luo X., Heidinger V., Picaud S. et al., 2001). При повышенной концентрации экстрацеллюлярного глутамата происходит перевозбуждение NMDA–рецепторов, неконтролируемый вход ионов кальция в клетку и ее гибель. Гибель ганглиозных клеток сетчатки приводит к выбросу содержащегося в них глутамата, что, в свою очередь, влечет гибель соседних ганглиозных клеток.
Мюллеровские клетки могут регулировать концентрацию внеклеточного глутамата при помощи специфического фермента глутамин синтетазы, который переводит глутамат в нетоксичный, даже в высоких концентрациях, глутамин (Березов Т. Т., Коровкин Б. Ф., 1990). Повышенная концентрация активных форм кислорода может угнетать действие глутамин синтетазы.
Другим соединением, воздействующим на ганглиозные клетки сетчатки, является NO (оксид азота). Оксид азота в глазном яблоке образуется под влиянием фермента NO–синтазы (NOS), который обнаружен в мюллеровских клетках всех позвоночных и имеет три изоформы. Оксид азота, с одной стороны, является мощным вазодилятатором и дезагрегантом, поддерживая гомеостаз и улучшая региональную гемодинамику, но, с другой стороны, он может, соединяясь с супероксиданионом, образовывать стойкое и очень токсичное соединение – пероксинитрит, которое способно приводить к гибели ганглиозные клетки (Neufeld A. H.,1999). Этот факт, по нашему мнению, говорит о том, что стимуляция продукции NO может проводиться только при условии хорошей антиоксидантной защиты.
Гибель любой клетки в организме может происходить как путем апоптоза, так и путем некроза. На наш взгляд, при рассмотрении вопроса патогенеза глаукомы должны учитываться оба механизма. Ускорение апоптоза при глаукоме приводит к повышению концентрации внеклеточного глутамата и связанного с этим некроза прилежащих клеток (вторичная клеточная смерть) (Schwartz M., Belkin M., Yoles E et al.,1996).
Считается, что путем апоптоза в норме в глазу ежегодно погибает 5 тысяч ганглиозных клеток (Jonas J., Schmidt A., Muller–Bergh J et al., 1990), при глаукоме это количество может увеличиваться вдвое (Jay J., 1997). Как указывают некоторые авторы (Хьюбел Д., 1990), в сетчатке имеется один миллион ганглиозных клеток. Ежедневно здоровый глаз теряет 0,014 % популяции, а глаз с ПОУГ – 0,028 %. Учитывая толщину среза гистологического препарата (3–5 мкм) в норме апоптоз может быть зарегистрирован с вероятностью 0,0006 %, а при глаукоме – 0,0012 %, что практически невозможно обнаружить даже в серийных срезах.
Мы провели исследование сетчатой оболочки глаз кроликов с экспериментальной адреналин–индуцированной глаукомой (АИГ), которая воспроизводилась по применяемой в нашей стране методике (Липовецкая Е.М., 1966).
Гистологическое, гистохимическое и иммуногистохимическое исследования сетчатки проводились в светооптическом микроскопе МИКМЕД–1 при различном увеличении, иммуногистохимическое исследование проводили в микроскопах МИКМЕД–1, Axioskop – Zeiss, морфометрические показатели оценивались с помощью окуляр–и–объект – микрометров «Reichert». Толщина слоя аксонов ганглиозных клеток сетчатки оценивалась при увеличении 400 на расстоянии 350 мкм от края решетчатой пластинки, а количество и распределение ганглиозных клеток в сетчатке – при увеличении от 400 до 750. Математическую обработку полученных морфологических данных проводили методами вариационной статистики на персональном компьютере IBM–PC Pentium II i 440 LX с пакетом прикладных программ и использованием программы «Microsoft Excel». Определяли среднее значение (Х), стандартное отклонение (s), дисперсию (s2), ошибку среднего (m), достоверность различий между группами сравнения с вычислением критерия Стьюдента (t) и уровня значимости (a), доверительный интервал (р), который для медицинской статистики равен 0,05.
Кролики выводились из опыта через 3 месяца после начала эксперимента. Нами исследовалась назальная часть сетчатки кролика от цилиарного тела до решетчатой пластинки. Эта часть была менее подвержена артефициальной отслойке и фрагментации в процессе изготовления гистологических препаратов. Исследования были проведены у 10 интактных животных и у 10 с адреналин–индуцированной глаукомой.
В сетчатой оболочке ганглиозного слоя интактных животных клетки в зависимости от размеров ядра различались, как крупные, средние и мелкие. Цитоплазма клеток была слабоэозинофильна, ядра хорошо прокрашивались гематоксилином в синий цвет. Количество их распределялось следующим образом: всего клеток – 509,67±12,35, из них – мелких – 184,00±5,00; средних – 229,17±12,41; крупных – 96,50±3,58. Толщина слоя аксонов ганглиозных клеток равнялась 129,15±1,86 мкм.
В контрольной группе кроликов (АИГ) наблюдалось разрежение клеток в ганглиозном слое: они значительно дальше располагались друг от друга, на некотором протяжении слой выглядел, как безъядерный, цитоплазма клеток не визуализировалась. Общее количество ганглиозных клеток было статистически достоверно снижено (р<0,001) по сравнению с группой интактных кроликов и составило 279,00±5,18. Из них количество мелких – 93,50±2,74; средних – 123,83±1,82; крупных – 61,67±3,91. Выяснилось, что при развитии глаукомы снижение количества ганглиозных клеток сетчатки происходило за счет мелких, что согласовывалось с данными отечественной литературы (Фельман Н.Г., 1951), но противоречило исследованию некоторых зарубежных авторов (Osborne N., Cazevieille C., Carvalho A., 1996). Резкая атрофия клеток в ганглиозном слое с потерей их аксонов заметно отразилась на толщине слоя аксонов, формировавших зрительный нерв. Его толщина статистически достоверно (р<0,001) снижена по сравнению с нормой и составляла 78,85±1,86 мкм. Важно заметить, что при развитии глаукомы и атрофии ганглиозного слоя не страдал слой биполярных клеток и фоторецепторов (рис. 1,2), что признается некоторыми авторами (Фельдман Н.Г., 1951; Мартынова Е.Б., Аничков Н.М., Алексеев В.Н. и др., 2000).
Таким образом, потеря ганглиозных клеток в нашем эксперименте за три месяца составила 45,3 %, что соответствует 0,5 % ежедневно. Эти данные существенно превышают расчетные данные для здоровых (0,014 %) и глаукомных (0,028 %) человеческих глаз. Такая большая разница может объясняться только «форсированным» формированием экспериментального глаукоматозного процесса на фоне введения значительных доз адреналина. Формирование ПОУГ идет значительно медленнее, что очень хорошо известно из клинической практики.
Попытка выявить апоптоз в сетчатке гистохимически по методу Мозер не удалась. Для обнаружения апоптоза был применен TUNEL–метод (Terminal desoxynucleotidyl transferase – mediated desoxyuridine triphosphate (UTP) – nick end – labeling), который позволял регистрировать межнуклеосомные повреждения ДНК с помощью меченых нуклеотидов. Наши исследования, проведенные в объеме 30 парафиновых гистологических срезов, позволили выявить следующее: только в группе АИГ были обнаружены 2 ганглиозные клетки в разных препаратах, гибнущие путем апоптоза. В группе интактных животных этого явления зарегистрировано не было. Следовательно:
– апоптоз в ганглиозных клетках при хроническом течении такого заболевания, как глаукома, пусть даже и экспериментальная, – явление,чрезвычайно трудно регистрируемое;
– возможно, что интенсивность апоптоза при глаукоме, (вопреки данным литературы), имеет большие показатели, чем увеличение его в 2 раза.
Следующим этапом работы было иммуногистохимическое исследование активности мюллеровских клеток сетчатки с помощью моно– и поликлональных антител для ферментов глутамин синтетазы (Glutamin synthetase), индуцибельной фракции NO–синтазы (iNOS), которые специфичны для мюллеровских, ганглиозных и амакринных клеток, а также: глиального фибриллярного кислого белка (Glial Fibrillary Acidic Protein – GFAP), виментина – белка промежуточных нитей в клетках мезенхимального происхождения, белка, связывающего клеточную ретиноевую кислоту – Cellular Retinoic Acid Binding Protein I (CRABP I), являющихся маркерами мюллеровских клеток.
Исследование глутамин синтетазы.
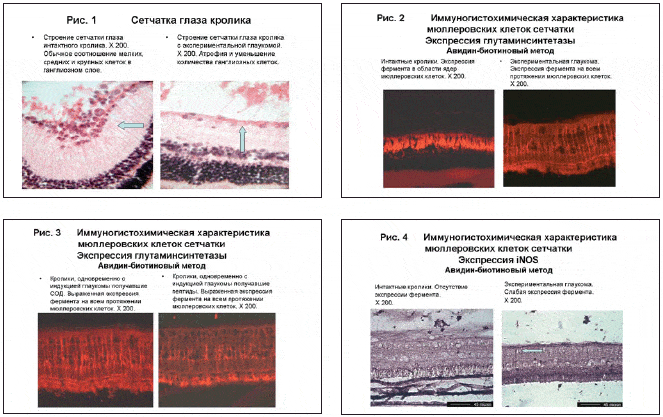
Флюоресцентное иммуногистохимическое исследование на глутамин синтетазу проводилось с использованием моноклональных мышиных антител в разведении 1:600.
В группе интактных кроликов мюллеровские клетки прокрасились и имели слабое флюоресцентное свечение во всей сетчатке. В группе АИГ клетки прокрасились интенсивнее, чем в группе интактных кроликов на экваторе глаза, а в заднем полюсе глаза имелось лишь очаговое окрашивание ядер мюллеровских клеток (рис.3,4).
Таким образом, эти данные позволяли говорить об увеличении активности мюллеровских клеток за счет повышенного синтеза глутамин синтетазы при экспериментальной глаукоме, особенно на экваторе глаза. Незначительная экспрессия фермента в заднем полюсе глаза, возможно, косвенно свидетельствовала о низком содержании здесь мюллеровских клеток. А высокое содержание здесь глутамата влекло увеличенный расход глутамин синтетазы, например, в данном случае в «критическом» месте – в области деформации решетчатой пластинки.
Исследование iNOS.
Для этого применялись поликлональные кроличьи антитела в разведении 1:500.
В группе интактных кроликов iNOS не обнаружено. В группе АИГ выявлялась слабая экспрессия фермента в мюллеровских клетках на экваторе глаза. Экспрессия индуцибельной NO–синтазы, которая катализировала выработку оксида азота, оказывает положительное влияние на тонус сосудов при возбуждении адренорецепторов.
Увеличенная экспрессия iNOS и повышенный синтез NO, имели положительное влияние на снижение уровня ВГД, увеличение коэффициента легкости оттока водянистой влаги и снижение ее минутного объема в группе АИГ. Нейротоксический же эффект NO в сетчатке, очевидно, не имел столь тяжелых последствий.
NO сам по себе оказывает положительное влияние на гемо– и гидродинамику глаукоматозного глаза. Однако наличие избыточного количество активных форм кислорода могут переводить оксид азота в пероксинитрит – стойкое токсическое соединение. Этот факт еще раз подчеркивает целесообразность применения антиоксидантной терапии при глаукомном процессе (рис. 5).
Исследование GFAP.
При окрашивании препаратов поликлональными антителами в разведении 1:1500 получены следующие результаты: В группе интактных кроликов экспрессии глиального фибриллярного кислого белка не выявлено. В группе АИГ получена слабая экспрессия GFAP в мюллеровских клетках, расположенных на экваторе глаза.
Исследование виментина.
При выявлении виментина моноклональными антителами в титре 1:1500 установленно, что в группе интактных кроликов его экспрессии не обнаружено. В группе АИГ имелось слабое окрашивание мюллеровских клеток.
Исследование GRABP I.
При выявлении GRABP I с помощью кроличьих антител в титре 1:3000 в группе интактных кроликов выявлена слабая экспрессия GRABP I. В группе АИГ GRABP I экспрессировался на экваторе в стволах мюллеровских клеток, в заднем полюсе в области ядер мюллеровских клеток.
По результатам исследования сетчатки глаза на содержание GFAP, виментина и GRABP I наблюдалась общая тенденция: усиление экспрессии субстратов, специфичных для мюллеровских клеток при индукции глаукомы; экспрессия белков GFAP, виментина и GRABP I была выражена в области экватора глаза, где, возможно, представлено наибольшее количество клеток данной популяции.
Заключение: в эксперименте установлено, что гибель ганглиозных клеток сетчатки развивалась на ранних этапах формирования глаукомы. Одной из форм гибели клеток в глазу являлся апоптоз, усиление интенсивности которого резко возрастало при заболевании. Обнаруженная иммуногистохимическим исследованием экспрессия маркерных ферментов и белков мюллеровских клеток свидетельствовала о топографии их распределения в сетчатке глаза и увеличении их функциональной активности при АИГ.