S.N. Basinskii
Author describes the experimentally and clinically proved method of drugs’ delivery in posterior eye segment diseases. He called his new technic trophic sclerectomia. The technic includes sclera trepanation in the region of suprachorioidal area with following covering of sclerectomia aperture with collagen sponge with subsequent drug introduction in to sponge for creation of drug depot. Experimental and clinical studies showed that new method of drug introduction allows to create significant drug concentrations in the posterior segment tissues.
The improvement of visual functions is observed in patients with POAG and maculodystrophy on the background of this method.
В настоящее время большинство офтальмологов придерживается точки зрения, что более предпочтительной в ходе лечения заболеваний сетчатки и зрительного нерва является «адресная» доставка лекарственных препаратов (А.П. Нестеров и соавт., 2000).
Основной задачей, которую мы ставили перед собой, была разработка новых, более эффективных методов подведения лекарств к пораженным тканям. Особенности анатомии глазного яблока и зрительного нерва не позволяют быстро создать оптимальную концентрацию лекарственного препарата в пораженных тканях введением лекарств традиционными методами (подконъюнктивальное, парабульбарное, внутривенное).
Ряд авторов проводили сравнительные исследования эффективности воздействия на глаз лекарств при введении их разными способами. Так, при анализе концентрации препаратов в тканях глаза после перорального, внутримышечного и внутривенного введения более эффективным оказалось внутривенное введение (B.J. Curtin, 1987). Сравнение концентрации препаратов в тканях глаза при внутривенном и подконъюнктивальном способе введения выявило, что концентрация выше при подконъюнктивальном введении (V.D. Shiose, 1989).
Анализируя основной недостаток традиционных методов введения лекарств (пара– и ретробульбарные инъекции) при лечении патологии заднего отдела глазного яблока и зрительного нерва, мы все больше убеждались, что при таком способе введения препаратов терапевтическая концентрация в пораженных тканях создается всего на несколько минут, так как основная часть препаратов попадает в богатые сосудами ткани орбиты и с кровью быстро уносится из области глаза. Проведенные нами исследования с помощью радиофармпрепаратов (С.Н. Басинский, 1991) показали, что в среднем через 22 минуты активность последних снижается до уровня, не регистрируемого датчиками излучения.
В связи с этим мы пришли к выводу, что препараты целесообразнее вводить в пространство между склерой и теноновой капсулой (теноново пространство). В этом случае лекарства будут определенное время удерживаться у глазного яблока теноновой капсулой и терапевтическая концентрация будет сохраняться более длительное время. Пролонгировать этот эффект можно введением к заднему полюсу полоски коллагеновой губки.
Таким образом, в 1989 году нами совместно с А.П. Нестеровым был предложен новый метод введения лекарственных препаратов в теноново пространство глаза, который мы назвали субтеноновой имплантацией коллагеновой инфузионной системы (СИКИС). Для пролонгации действия лекарственных препаратов мы использовали введение в теноново пространство коллагеновой губки, которая депонирует препарат, а в последующем стимулирует образование дополнительной сосудистой сети и улучшение трофики заднего отдела глаза.
Клинические наблюдения (1991–2001) показали более высокую эффективность предложенного метода введения лекарственных препаратов по сравнению с традиционными при лечении больных с нестабилизированной глаукомой, макулодистрофиями, миопическими хориоретинодистрофиями, частичными атрофиями зрительного нерва различного генеза, центральными серозными хориоретинитами, пигментными абиотрофиями сетчатки и другой патологией заднего отдела глазного яблока и зрительного нерва.
Наши данные подтверждаются исследованиями, проведенными Т.О. Елисеевой, Н.А. Бишеле (2000). Сравнительные исследования эффективности вазоактивных препаратов при внутривенном, парабульбарном и инфузионном введении в теноново пространство глаза показали более высокую эффективность лечения при использовании коллагеновой инфузионной системы.
Однако несмотря на эффективность метода субтеноновой инфузии лекарственных препаратов действие его ограничено тем, что место введения препарата и ткани мишени (сосудистая оболочка, сетчатка и зрительный нерв) разделяет склера, что требует более длительных сроков лечения и создания более высокой концентрации лекарственных веществ. Кроме того, использование трубочки, выводимой на область лба, не позволяет проводить амбулаторное лечение таких пациентов.
В связи с этим была поставлена цель: для повышения функциональных результатов лечения и возможности проведения основного этапа лечения в амбулаторных условиях разработать метод подведения лекарственных препаратов непосредственно к хориоидее.
Нами была предложена операция трофической склерэктомии. Методика операции заключается в выполнении трепанации склеры в области супрахориоидального пространства с покрытием склерэктомического отверстия коллагеновой губкой с последующим введением лекарственных препаратов в область губки для создания депо препарата.
Методика операции
После анестезии в верхне–наружном квадранте на расстоянии 5–6 мм от лимба производили разрез конъюнктивы и теноновой капсулы длиной 5–6 мм. В 7 мм от лимба склеру иссекали до супрахориоидального пространства в виде трепанационного отверстия размером 2x2 мм. В субтеноново пространство укладывали коллагеновую губку так, что ее край частично прикрывал трепанационное окно. На конъюнктиву накладывали непрерывный шов. В послеоперационом периоде в течение 10 дней больным в теноново пространство, в область коллагеновой губки (участок, расположенный вне трепанационного отверстия) утром вводились препараты, адекватные заболеванию, по поводу которого лечился больной.
Для оценки эффективности трофической склерэкомии, как метода введения лекарственных препаратов, скорости проникновения препарата и концентрации его в тканях глаза мы провели эксперимент на животных.
Эксперимент выполнен на 15 кроликах (30 глаз) породы «шиншилла» серой масти в возрасте 1–1,5 лет, весом 2,7–3,2 кг. В качестве вещества маркера использовали 1% раствор флюоресцеина, имеющий максимум поглощения при 490 нм. Для оценки концентрации маркера в тканях глаза использовали спектрофотометр Shimadzu–770, с помощью которого измеряли интенсивность поглощения света флюоресцеином в биологическом материале.
Техника операции
Кроликов фиксировали. После обезболивания в верхне–наружном квадранте на расстоянии 5–6 мм от лимба производили разрез конъюнктивы и теноновой капсулы длиной 6–7 мм. В склере иссекали глубокие слои до супрахориоидального пространства в виде трепанационного отверстия размером 2х2 мм, на которое укладывали коллагеновую губку размером 6х8 мм. На рану накладывали непрерывный шелковый шов. Данную операцию выполняли 10 кроликам (20 глаз) – I группа. Остальные 5 кроликов (10 глаз) составили контрольную группу (II группа). Во время операции у кроликов II группы склерэктомия не выполнялась, а в теноново пространство вводилась полоска коллагеновой губки таких же размеров, как и в первой группе, на рану накладывали непрерывный шелковый шов.
После операции всем кроликам под конъюнктиву вводили 1,0 мл 1% раствора флюоресцеина.
Спустя 1, 2, 3, 4 и 5 часов после операции умертвляли по 3 животных (1 из контрольной группы) методом воздушной эмболии и производили энуклеацию.
В каждом случае, включая контроль, глаза после энуклеации промывали под проточной водой. Вскрывали роговицу по лимбу, хрусталик удаляли. В пронумерованные пробирки отдельно помещали стекловидное тело и сетчатку с сосудистой оболочкой. Сетчатку и сосудистую оболочку в каждой пробирке гомогенизировали, затем проводили водную экстракцию красителя. Общий объем экстракта – 3 мл. Для удаления мутности добавляли хлороформ и центрифуриговали. Стекловидное тело растворяли Н2О, доведя объем до 3 мл.
Затем пробирки с содержимым поочередно помещали в спектрофотоколориметр и производили исследование светопоглощения стекловидного тела при 490 нм (что соответствовало максимуму поглощения флюоресцеина).
Результаты эксперимента. Сравнительный анализ оптической плотности вещества–маркера в тканях и средах глаза показал следующее: наибольшая концентрация флюоресцеина в стекловидном теле наблюдается спустя 2 часа после его введения под конъюнктиву, затем она постепенно уменьшается; трепанационное отверстие способствует более активному проникновению препарата в стекловидное тело, при этом концентрация препарата в стекловидном теле в 1,8 раза была выше, чем в контрольной группе (0,15±0,02 и 0,08±0,01 соответственно). Через 5 часов при снижении концентрации красителя в первой группе и контроле соотношение было даже выше, чем в более ранние сроки (0,08±0,01 и 0,04±0,01 соответственно).
Анализ оптической плотности флюоресцеина в сетчатке и сосудистой оболочке I группы показал, что спустя 4 часа после трофической склерэктомии и введения препарата наблюдалась наибольшая концентрация вещества–маркера (0,54±0,04) – в 2,6 раза больше, чем в контрольной группе (0,21±0,04).
Результаты эксперимента показали, что скорость проникновения и концентрация вещества–маркера в различных тканях глаза после трофической склерэктомии значительно выше по сравнению с обычным введением под конъюктиву. Кроме того, анализ изменения концентрации препарата в стекловидном теле, хориоидее и сетчатке с течением времени свидетельствует о более высоком содержании флюоресцеина в них именно после склерэктомии.
Таким образом, эксперимент показал, что склерэктомия является более эффективным способом доставки препаратов к тканям заднего отдела глаза и позволяет создать более высокую концентрацию вводимого препарата.
Предложенный метод введения лекарственных препаратов был апробирован в клинической практике, на двух группах больных с нестабилизированной глаукомой с «нормальным» давлением (23 пациента, 33 глаза, средний возраст больных 67,5±2,3 года) и у больных с макулодистрофией (30 пациентов, 48 глаз), средний возраст 63±2,1 года. Пациентам с макулодистрофией в послеоперационном периоде вводили препараты мексидол и никотиновую кислоту 1%, больным с нестабилизированной глаукомой – компламин 15% и эмоксипин 1%.
У больных с макулодистрофиями эффективность трофической склерэктомии сравнивали с группой больных (14 пациентов, 25 глаз), которым лечение проводили парабульбарным введением препаратов. Всем больным проводили исследование остроты зрения, полей зрения (кинетическая периметрия, сумма по 8 меридианам), офтальмоскопию, реоофтальмографию измерялась электрочувствительность сетчатки.
Все больные глаукомой имели далекозашедшую стадию открытоугольной глаукомы с «нормальным» давлением (ранее перенесли не менее одной операции по поводу глаукомы). Средний уровень ВГД в указанной группе колебался от 20 до 26 мм рт. ст. До и после операции больным выполнялась визометрия, офтальмометрия, тонометрия, компьютерная периметрия, электроретинография (ЭРГ) и оценка зрительно вызванных кортикальных потенциалов (ЗВКП).
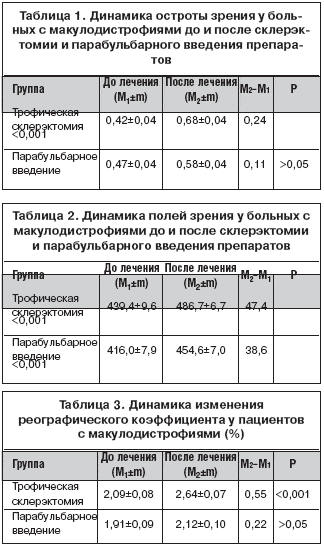
Динамика зрительных функций пациентов с макулодистрофией представлена в таблицах 1, 2 и 3.
Реографический коэффициент Rq после проведенного курса увеличился в группе больных с трофической склерэктомией; после парабульбарного введения увеличение гемодинамики было менее существенным, разница статистически не достоверна.
Из этого следует, что трофическая склерэктомия с последующим курсом лечения приводит к улучшению гемодинамики у больных с макулодистрофией непосредственно после лечения. После курса парабульбарных инъекций эффект менее значительный.
Показатель электрочувствительности уменьшился в группе c трофической склерэктомией в среднем на 57,0 мкА (р<0,001), а после курса парабульбарных инъекций на 31,6 мкА (р<0,05). Таким образом, электрочувствительность сетчатки после трофической склерэктомии улучшилась в 1,8 раза, по сравнению с консервативным лечением.
Таким образом, полученные результаты у больных макулодистрофией свидетельствуют о более высокой эффективности введения лекарственных препаратов после трофической склерэктомии.
В результате лечения больных глаукомой мы получили следующие результаты: непосредственно после проведенного лечения мы не получили достоверного улучшения остроты зрения.
Поля зрения непосредственно после лечения улучшились у 29% больных, в 51% случаев поля зрения не изменились, в 20% случаев ухудшились.
Аналогичным образом распределились и результаты электрофизиологических методов исследования: у 30% больных амплитуда a и b волны электроретинограммы и Р100 вызванных кортикальных потенциалов достоверно повышалась. В 50% случаев она не изменялась и в 20% случаев уменьшалась.
Интересны наблюдения, полученные через 3 месяца после операции. Результат уже весьма отличался от данных, полученных непосредственно после операции. Состояние полей зрения и данные ЭФИ улучшились у 87% больных, не изменились в 10% случаев и ухудшились у 3% больных.
Расширение полей зрения происходило за счет исчезновения относительных скотом и перехода абсолютных скотом в относительные. Количество нормально воспринимаемых точек возрастало на 60–250%, в среднем на 90%, уменьшение абсолютных скотом происходило на 40–120%, в среднем на 70%.
По данным ЭФИ: ЭРГ – увеличение амплитуды на 10–60 мкВ, в среднем на 20 мкВ. Зрительно вызванные кортикальные потенциалы – амплитуда увеличивалась на 3–15 мкВ, в среднем на 10 мкВ.
Таким образом, полученные результаты лечения свидетельствуют, что подведение лекарственных препаратов непосредственно к хориоидее приводит к улучшению зрительных функций и, как минимум, к временной стабилизации процесса. По нашему мнению, это связано с воздействием ряда факторов, таких как:
– фармакологическое воздействие препаратов на хориоидею, что приводит к усилению гемодинамики в сосудистой оболочке;
– рефлекторному воздействию на сосудисто–нервный аппарат хориоидеи;
– биостимулирующее воздействие коллагеновой губки на хориоидею и окружающие ткани с элементами дозированного асептического воспаления [4];
– формирование в послеоперационном периоде, в области склерэктомии, выраженной сосудистой сети, которая приводит к реваскуляризации хориоидеи.
Сравнительный анализ эффективности парабульбарного введения препаратов и непосредственное подведение к хориоидее показывает преимущество последнего. Новый метод лечения позволяет сократить сроки пребывания больных в стационаре с 7–10 до 1–2 дней. После выполнения склерэктомии больной может лечиться амбулаторно. Эффект лечения больных с трофической склерэктомией нарастает к 6 месяцам наблюдения, когда завершается формирование анастомозов между хориоидеей и эписклеральными тканями в области имплантации коллагеновой губки. В последующем эффект может снижаться.
Таким образом, предложенный метод введения препаратов является методом выбора и может применяться в лечении любой сосудистой и дистрофической патологии заднего отдела глаз.
Литература
1. Елисеева Т.О., Бишеле Н.А.Применение вазоактивных препаратовдля лечения ишемических заболеваний зрительного нерва и сетчатки.// Русский медицинский журнал (специальный выпуск). 2000.– №1.– С. 16–19
2. Нестеров А.П., Басинский С.Н. Новый метод введения лекарственных препаратов в задний отдел тенонова пространства //Вестн. офтальмол. – 1991. – №5. – С.11–14.
3. Нестеров А.П., Егоров Е.А., Егоров А.Е., Калабухова Л.В. и др //Новый путь введения лекарственных веществ при заболеваниях заднего отрезка глаза и использование его для лечения глаукомной оптической нейропатии..// Клиническая офтальмология.– 2000.– №2.– том 1.– С. 39–41.
4. Нестеров А.П., Егоров Е.А., Егоров А.Е. Свирин А.В. Ограниченное и контролируемое воспаление как метод лечения ишемических и гипоксических заболеваний заднего сегмента глаза // Клиническая офтальмология. – 2002. – №1. – том 3. – С. 3–5.
5. Curtin B.J., Whitmore W.G. Long–term results of scleral reinforcement surgery //Amer. J. Ophthalmol. –1987.–V.103, (4.–P.544–548.
6. Shiose V.D. Complex thretment chronic glaucoma //Glaucoma.– 1989.–V.I, (3. –P.41–49.












