A.A. Yarovoi, L.F. Linnik, D.A. Magaramov,
T.S. Semikova, E.Ae. Noileva, E.S. Bulgakova
RU MNTK Eye Microsergery of Fedorov S.N. Moscow
Autonomous transpupillary diode–laser thermotherapy (TTT) of small melanoma of chorioidea (MC) allowed to reach tumor regression without signs of prolonged growth in 27 from 33 cases (81.8%) during observation period from 6 months to 4.5 years (15.5 months in average). In all cases eye was successfully saved, and there were no signs of metastasis during this period.
Possibilities of TTT of MC for saving of functions were comparatively good: average visual acuity was 0.54±0.34 before treatment and 0.5±0.41 after the treatment ( p>0.05). In 7 patients (21.2%) visual acuity improved (by 0.2–0.5) and in 14 (42.4%) worsened (by 0.1–0.4).
Thus, this data show high efficiency of TTT for MC both in medicinal and functional aspects.
Further dynamic observation after TTT is necessary to evaluate stability of local tumour control and remote results of treatment.
Меланома хориоидеи (МХ), являясь редким глазным заболеванием (встречается у 2 – 13,3 человек на 1 миллион [3,4]), представляет собой актуальную проблему офтальмологии, поскольку прогноз заболевания оценивается не только с точки зрения сохранения глаза как функционального и косметического органа, но и с точки зрения сохранения жизни пациента.
Сегодня ликвидационный метод лечения внутриглазных опухолей – энуклеация – отошла на второй план, поскольку прочные позиции заняли органосохранные методы лечения: транссклеральная брахитерапия, наружное облучение глаза различными источниками излучения, лазеркоагуляция, криодеструкция, хирургическое удаление [3,14,27] и др. Учитывая необходимость сохранения зрительных функций для улучшения качества жизни и профессиональной трудоспособности пациентов, современные задачи офтальмоонкологов расширяются и включают в себя не только повышение эффективности органосохранного лечения, но и поиск функционально–сберегающих методов терапии МХ.
Особого подхода при определении тактики лечения требуют пациенты с МХ малых размеров (высотой до 3,5 мм), поскольку являются наиболее перспективными в плане лучшего прогноза для жизни [5,18,25,26,28,29,32] и зрительных функций.
Более частая локализация малых новообразований сосудистой оболочки в заднем полюсе глаза объясняется тем, что, во–первых, центральное расположение МХ раньше приводит к каким–либо значимым качественным расстройствам центрального зрения (появление скотомы, фотопсий, локального искажения предметов и пр.), чем локализация в периферической, «немой» в этом отношении зоне, во–вторых, центральная локализация новообразований, равно как и любого другого патологического процесса в этой зоне, легче и чаще выявляется офтальмологом даже при отсутствии жалоб. Следует отметить тот факт, что малым МХ присуща большая сохранность зрительных функций до лечения, нежели при выявлении опухолей на стадии средних и больших размеров.
Арсенал методов лечения МХ достаточно широк, однако применительно к малым МХ все виды терапии имеют свои особенности.
В настоящее время наиболее широкое распространение в мире (и в том числе в МНТК «МГ») по праву имеет брахитерапия, как метод, обладающий высокой эффективностью – до 70–83% [3,14] и широкими показаниями. В то же время облучение оказывает повреждающее действие и на здоровые ткани глаза, вызывая такие осложнения, как хориоретинопатия, нейропатия, лучевая частичная атрофия зрительного нерва (ЧАЗН), экссудативная отслойка сетчатки, реже – гемофтальм, осложненная катаракта, вторичная глаукома и др. [2,3,27]. Следствием этого нередко является стойкое снижение зрительных функций [31]. Это особенно чувствительно для пациентов с локализацией новообразования малых размеров в заднем полюсе глаза без вовлечения в процесс макулярной области, поскольку именно в этих случаях до операции зрительные функции сохраняются, как правило, относительно высокими.
Большая частота развития макулопатии – до 40–87% [21,17,20] – связана с особой повышенной чувствительностью сосудов макулярной зоны к лучевой энергии [24,34].
Следует упомянуть об особенностях брахитерапии юкстапапиллярных МХ. Локализация патологического процесса вне зоны папилло–макулярного пучка, как правило, сопровождается высокой исходной остротой зрения. В случае применения у этой категории пациентов брахитерапии вероятность снижения зрительных функций несколько выше, чем при других локализациях МХ, поскольку при этом вследствие близкого расположения офтальмоаппликатора в большом проценте случаев развивается лучевая атрофия зрительного нерва. Кроме того, эффективность бета–терапии юкстапапиллярных новообразований в ряде случаев оказывается несколько ниже по сравнению с результатами лечения опухолей другой локализации. Это находит объяснение в том, что, во–первых, фиксация офтальмоаппликатора с секторальной выемкой при юкстапапиллярных меланомах сопровождается некоторыми техническими трудностями. Во–вторых, закономерным является неполное прилегание офтальмоаппликатора к проекции опухоли из–за наличия вдоль его края «мертвой зоны» (место шва между пластиной с активной матрицей и защитной фольгой). В–третьих, увеличение толщины зрительного нерва с 1,5 мм (внутриглазная часть) до 4,5 мм (внутриорбитальная часть) сразу по выходе за решетчатую пластинку [13] анатомически не позволяет точно сопоставить рабочую поверхность офтальмоаппликатора с проекцией опухоли на склеру.
Использование лазеркоагуляции у пациентов с МХ ограничено небольшой глубиной проникновения лазерного излучения (до 0,2–1,0 мм) [15,22], малым диаметром пятна и нежелательным в лечении такой высоко злокачественной опухоли, как МХ, наличием взрывного эффекта.
Глубина воздействия транссклеральной криодеструкции на МХ достигает 3,5–4,0 мм [1,14]. Однако работы многих авторов говорят о заметной реактогенности метода [1,14]: он сопровождается выраженной перифокальной реакцией с экссудацией в стекловидное тело и сетчатку с последующими грубыми изменениями в них [1], а в отдаленном периоде в зоне криовоздействия выявлена потеря всех слоев сетчатой оболочки и большинства хориоидальных сосудов. Воздействие же холода на зрительный нерв приводит к его полной атрофии и потере зрения [35].
Привнести в систему лечения малых МХ новое качество, в частности, расширить ее функционально–сберегающие возможности с сохранением сравнительно высокой эффективности может позволить использование девитализирующего действия гипертермии (45–55°С), а именно – транспупиллярной диод–лазерной термотерапии (ТТТ), интерес к которой неуклонно растет. Метод является достаточно молодым: за рубежом он применяется с 1995 года [16,23,30,33], в нашей стране первые шаги по использованию этого вида лечения были предприняты в 1999 году на базе ГУ МНТК «МГ» им. С.Н. Федорова [6,7,8,9,10,11,12].
Гипертермическое (45–55°С) влияние ТТТ индуцирует, по данным зарубежных авторов, локальный некроз опухоли глубиной до 3,9 мм [23]. По нашим данным, однократное воздействие инфракрасным излучением диодного лазера вызывает некроз МХ до 2,2 мм [12], не повреждает структуры, расположенные на пути следования лазерного луча, и дает возможность точного дозирования.
Будучи неинвазивной, щадящей по отношению к здоровым тканям методикой, и, следовательно, обладая функционально–сберегающими возможностями, она имеет перспективу стать методом выбора в лечении МХ малых размеров.
Достоинством ТТТ является также возможность ее проведения в амбулаторных условиях и сравнительно быстрая реабилитация пациентов.
Цель работы – изучить возможности применения ТТТ в лечении МХ малых размеров (до 3,5 мм высотой), определить ее эффективность и влияние на зрительные функции при сроке наблюдения до 4,5 лет.
Материал и методы
Методом самостоятельной ТТТ было пролечено 33 пациента (33 глаза) с МХ. Высота МХ была от 0,8 до 3,4 мм (в среднем 2 мм), протяженность от 4 до 13,2 мм (в среднем 7,8 мм). Возраст пациентов составлял от 35 до 79 лет (в среднем 55,4 года). Женщин было 19, мужчин 25. Срок наблюдения – до 4,5 лет. Локализация опухолей и острота зрения до лечения приведены в таблице 1.
Диагноз МХ во всех случаях был подтвержден данными прямой и обратной офтальмоскопии, двухмерного ультразвукового исследования, транссклеральной диафаноскопии, флюоресцентной ангиографии и документально зафиксирован фото– и цифровыми снимками глазного дна. Степень пигментации опухоли оценивали методом компьютерной колориметрии. Всем больным проводили полное общесоматическое обследование, признаков метастазирования не выявлено.
Все пациенты были пролечены методом ТТТ с использованием инфракрасного лазерного излучения (длина волны 810 нм), генерируемого отечественной диод–лазерной установкой МЛ–200, адаптированной к щелевой лампе. Лазерное воздействие проводили с использованием трехзеркальной линзы Гольдмана. Диаметр светового пятна изменяли от 1,5 до 3–х мм в зависимости от площади опухоли и ее локализации: близость макулярной зоны и папилломакулярного пучка диктовала необходимость использования меньшего диаметра пятна во избежание необоснованного повреждения этих структур. Количество аппликаций составляло 4–26 в зависимости от площади новообразования. Их наносили на всю поверхность опухоли с захватом здоровых тканей на 1–2 мм (с учетом данных ФАГ). Мощность оптимально подбирали во время сеанса путем постепенного увеличения до появления едва заметного побеления опухоли. Плотность мощности во время лечебной процедуры составила от 3,9 до 24,15 Вт/см2. С целью оптимизировать методику нами разработан способ определения начальной плотности мощности при проведении ТТТ в зависимости от колориметрических параметров поверхности опухоли, определяемых объективным методом в количественном выражении*. В соответствии с ним проведение ТТТ темно–пигментированных МХ начинали с 4,2 Вт/см2, средне–пигментированных – с 7,8 Вт/см2, а беспигментных – с 11,4 Вт/см2. Диаметр пятна динамично меняли в течение одного сеанса, он зависел от площади новообразования, близости функционально–значимых структур (макула и папилло–макулярный пучок) и положения сосудов на поверхности опухоли. Время воздействия составляло 60 секунд в непрерывном режиме.
Учитывая данные гистологического изучения влияния однократного термотерапевтического воздействия на структуру МХ, продемонстрировавших развитие некроза глубиной до 2,2 мм [12], а также данные клинических наблюдений, нами сделан вывод о, как правило, необходимости проведения повторных сеансов ТТТ. Условно они разделены на плановые и неплановые. Плановые сеансы проводили с интервалом 2–3 месяца и более после первого сеанса при признаках частичной регрессии опухоли, тогда как неплановые – при признаках продолженного роста МХ. Их количество зависело от степени регрессии опухоли и составляло 1–6 с интервалом в 1–9 месяцев.
Результаты и обсуждение
Главной целью лечения злокачественных новообразований сосудистой оболочки глаза является регрессия опухоли и сохранение жизни больного. Чрезвычайно важным представляется и сохранение исходно высоких зрительных функций.
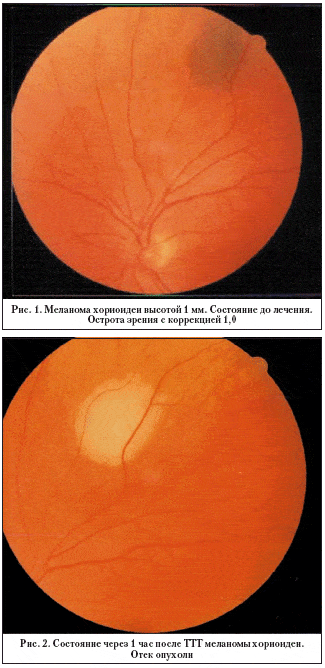
При использовании ТТТ, как самостоятельного первичного метода лечения МХ, регрессия новообразования отмечена у 32 из 33 пациентов (рис. 1,2,3) в среднем с 2±0,14 до 0,97±0,11 мм, т.е. больше, чем на 50% (р<0,01). Высота опухоли уменьшалась постепенно. Нами отмечено, что в первые месяцы после ТТТ темпы и степень резорбции наиболее высокие (по данным УЗИ). С увеличением срока наблюдения происходит их некоторое замедление, что, возможно, связано с постепенным замещением опухоли фиброзной тканью, которая, вероятно, и составляет основную массу остаточного проминирующего очага при частичной резорбции: это подтверждается офтальмоскопической картиной, данными ФАГ и динамическим наблюдением.
Из 32 пациентов, у которых произошла регрессия опухоли, в 5 случаях отмечен продолженный рост. Дальнейшая тактика ведения и судьба этих пациентов, включая пациента с отсутствием эффекта, представлена в таблице 2. К признакам продолженного роста мы относили офтальмоскопически видимую прогрессию опухолевой ткани по протяженности (расширение границ опухоли, оцениваемое объективным методом с помощью фотоснимков глазного дна, появление нечеткости контуров остаточного очага), прогрессирование патологической флюоресценции из сосудов опухоли и увеличение проминенции новообразования.
Нами отмечено, что продолженный рост новообразования происходит, как правило, по протяженности. Мы проводили в данных ситуациях повторные сеансы ТТТ, считая ее методом выбора. Дополнительное лечение в виде подшивания офтальмоаппликатора может привести к гораздо большей площади повреждающего эффекта, нежели это необходимо для локального разрушения оставшейся опухоли. Отсутствие взрывного эффекта, присущего лазеркоагуляции и возможность нанесения меньшего количества коагулятов (из за большего диаметра пятна) является преимуществом ТТТ перед ЛК.
За указанный срок наблюдения – от 6 месяцев до 4,5 лет (в среднем 15,5 месяцев) признаков метастазирования не выявлено, все пациенты живы.
При проведении ТТТ у всех 33 пациентов в течение первых суток после воздействия развивался перифокальный отек тканей, что связано с влиянием тепла на структуру опухоли и развитием в ней некротических процессов с асептическим воспалением. В ряде случаев (n = 13) он сопровождался вторичной транзиторной локальной отслойкой сетчатой оболочки. В срок до 1–3 месяцев экссудат резорбировался, сетчатка прилегла.
У 9 пациентов имели место ретинальные кровоизлияния точечного и перистого вида. Причиной их было термическое повреждение капиллярной сети самой опухоли либо сосудов сетчатки в зоне лазерного воздействия. Прямое термическое повреждение ретинальных сосудов происходило в тех случаях, когда опухоль располагалась в их проекции, несмотря на максимальное щажение зон пролегания сосудов. Этими же причинами, по–видимому, объясняется и картина частичной окклюзии ветви центральной вены сетчатки (n = 1).
Тракции окружающей опухоль сетчатки (n=3), включая макулярную и парамакулярную зоны, возникали вследствие рубцовых изменений в зоне новообразования после ТТТ. Особую значимость они приобретали в случае распространения на фовеолярную зону, поскольку были причиной не только снижения центрального зрения, но и вели к его нарушениям в виде искажения предметов (n=1). Следует подчеркнуть, что этот дефект зрительных функций был одним из наиболее значимых для пациента, вызывая головокружения, астенопию и мучительные головные боли. Наблюдая за пациентами, мы отметили, что тракционные складки сетчатки обычно появляются в период от 6 до 8 месяцев после ТТТ и практически не имеют тенденции к увеличению в процессе дальнейшего фиброзирования основного очага. В настоящее время с целью сохранения зрительных функций нами разработан способ профилактики отека и тракций сетчатки макулярной зоны при ТТТ методом предварительной (за 2 недели) отграничительной аргонлазерной коагуляции в виде дуги между опухолью и макулярной зоной для протекции последней*.
У 3 пациентов на 2 день после ТТТ развился перифокальный витреит. Во всех случаях опухоль располагалась на крайней периферии, близко к цилиарному телу, реакцией которого, по–видимому, и объясняется появление данной картины. В срок до 3–4 месяцев витреит полностью купировался на фоне проведения противовоспалительной, противоотечной и десенсибилизирующей терапии.
У 1 пациента с опухолью в парафовеолярной зоне через 3 месяца после 2 сеанса ТТТ имела место вторичная центральная хориоретинальня дистрофия с развитием субретинальной неоваскулярной мембраны с геморрагическим компонентом, что повлекло за собой резкое снижение зрительных функций.
Хориоретинальная дистрофия (с атрофией или гиперплазией пигментного эпителия) имела место во всех случаях и была ограничена зоной теплового воздействия диодного лазера. При расположении опухоли вне fovea центральное зрение не снижалось, хотя имело место появление парацентральной скотомы. В случаях расположения опухоли в макулярной зоне (n = 8) именно процессы хориоретинальной дистрофии с явлениями фиброза служили основной причиной снижения зрения.
Из 33 пролеченных пациентов у 7 (21,2%) острота зрения улучшилась (на 0,2–0,5), у 12 (36,4%) осталась прежней и у 14 (42,4%) ухудшилась (на 0,1–0,4). Средняя острота зрения понизилась на 7,4%: с 0,54±0,06 до 0,5±0,07 (р>0,05). При распределении пациентов по функциональным группам (рис. 4), выявлено, что после лечения количество больных с остротой зрения 1,0–0,5 снизилось на 15,1%, с остротой зрения 0,4–0,2 не изменилось, а с остротой зрения 0,1 и меньше выросло на 15,1%. Причинами улучшения зрения, по нашему мнению, является уменьшение туморассоциированного перифокального отека в процессе резорбции опухоли.
Особо заметно зрение снизилось у пациентов с макулярной локализацией опухоли (в среднем с 0,43±0,1 до 0,17±0,04, р<0,05) за счет развития хориоидальной атрофии и, как следствие – вторичной ретинопатии в этой наиболее функционально значимой зоне глаза.
В отличие от опухолей, расположенных в макулярной зоне, лечение юкстапапиллярных новообразований сопровождалось повышением средней остроты зрения с 0,59±0,12 до 0,71±0,08 (р>0,05).
При сравнении динамики изменений полей зрения отмечено расширение области скотомы: до лечения средний процент сохранного поля зрения составил 86,7, после он оказался равным 68,6. Увеличилась и площадь абсолютного дефекта – с 7,2 до 29,4%. Однако область дефекта во всех случаях строго соответствовала зоне новообразования, окружающие сектора поля зрения оставались интактными. Эти данные подтверждаются картинами ФАГ, где на месте новообразования визуализируется очаг (с остаточной флюоресценцией или без нее), четко отграниченный от окружающей сетчатки.
Заключение
Полученные нами результаты ТТТ малых МХ у 33 пациентов продемонстрировали возможность их лечения с положительным местным результатом без признаков продолженного роста в 27 случаях (81,8%) при сроке наблюдения до 4,5 лет. Глаз удалось сохранить во всех случаях, признаков метастазирования за указанный срок наблюдения не выявлено.
Возможности ТТТ малых МХ в функционально сберегающем аспекте оказались сравнительно высокими: средняя острота зрения составила 0,54±0,06 до лечения и 0,5±0,05 после лечения (р>0,05). При этом максимально она снизилась у больных с распространением опухоли на fovea, что является закономерным результатом прямого и опосредованного влияния ИК излучения диодного лазера на фоторецепторы этой зоны.
Таким образом, полученные результаты свидетельствуют о высокой эффективности разработанной методики ТТТ малых МХ как в лечебном, так и в функциональном отношении.
Необходимо дальнейшее динамическое наблюдение за пациентами, пролеченными методом самостоятельной ТТТ для оценки стабильности локального контроля опухоли и отдаленных результатов.


Литература
1. Бровкина А.Ф., Зиангирова Г.Г., Комаров Б.А. О криоразрушении меланом хориоидеи //Вестн. Офтальмол. – 1977. – № 2. – С. 61–63.
2. Бровкина А.Ф., Г.Д. Зарубей, Вальский В.В. Критерии оценки эффективности брахитерапии увеальных меланом, осложнения, их профилактика // Вестн. Офтальмол. – 1997. – № 3. – С. 14 – 15.
3. Бровкина А. Ф. Офтальмоонкология. – М.: Медицина, 2002.– 424 с.
4. Иойлев Э.Н., Фрадкина И.А. Анализ злокачественных опухолей глазного яблока // Опухоли и опухолеподобные заболевания органа зрения: Тез.докл.– М.,1998.– С. 28–31.
5. Либман Е.С., Бровкина А.Ф., Безруков А.В. Отдаленные результаты лечения увеальных меланом. Сравнительная оценка энуклеации и органосохранных методов лечения // Офтальмол. Журнал. – 1989. – № 6. – С. 336 – 338.
6. Линник Л.Ф., Магарамов Д.А., Яровой А.А., Семикова Т.С. Транспупиллярная лазерная термотерапия опухолей хориоидеи // Съезд офтальмологов России, 7 – й. – М., 2000. – С. 114.
7. Линник Л.Ф., Магарамов Д.А., Яровой А.А., Семикова Т.С. Лазерная транспупиллярная термотерапия меланом хориоидеи // Офтальмохирургия. – 2002. – № 3. – С. 45 –50.
8. Линник Л.Ф., Магарамов Д.А., Яровой А.А, Семикова Т.С., Булгакова Е.С. Сравнительная оценка состояния зрительных функций у больных с меланомой хориоидеи после брахитерапии и транспупиллярной диод–лазерной термотерапии. – Материалы lll Евро–Азиатской конференции по офтальмохирургии.– г. Екатеринбург – 2003. – Часть 2. – С. 16 –17.
9. Линник Л.Ф., Магарамов Д.А., Яровой А.А., Семикова Т.С., Булгакова Е.С., Павлова Е.С. Об осложнениях транспупиллярной диод–лазерной термотерапии увеальных меланом. – Материалы научно–практической конференции, посвященной 15–летию Хабаровского филиала ГУ МНТК. – Хабаровск. – 2003.
10. Линник Л.Ф., Магарамов Д.А., Яровой А.А., Семикова Т.С., Булгакова Е.С., Павлова Е.С. Возможности транспупиллярной диод–лазерной термотерапии как органо– и функционально–сохранного метода лечения увеальных меланом малых размеров. – Тезисы докладов юбилейного симпозиума «Актуальные проблемы офтальмологии» ГУ НИИ Глазных болезней РАМН. – Москва. – 2003. – С. 86 – 87.
11. Линник Л.Ф., Магарамов Д.А., Яровой А.А., Семикова Т.С., Булгакова Е.С. Патоморфологические изменения увеальной меланомы при транспупиллярном диод–лазерном термотерапевтическом воздействии. – Тезисы докладов юбилейного симпозиума «Актуальные проблемы офтальмологии» ГУ НИИ Глазных болезней РАМН. – Москва. – 2003. – С. 377 – 378.
12. Линник Л.Ф., Магарамов Д.А., Яровой А.А., Семикова Т.С., Булгакова Е.С. Трехлетний опыт использования транспупиллярной диод–лазерной термотерапии как самостоятельного метода лечения увеальных меланом. – Офтальмохирургия.– 2003.– № 4.– С.
13. Петров С.Ю. Анатомия глаза и его придаточного аппарата / Под редакцией Аветисова С.Э. – М.: Издательский дом Гэотар–Мед, 2003. – 152 с.
14. Семикова Т.С. Комплексный метод диагностики и лучевой терапии меланомы сосудистой оболочки глаза: Дис. ... канд. мед. наук. – М., 1997. – 115 с.
15. Appel D.J., Goldberg M.F., Wyhinny G., Levi S. Argon laser photocoagulation of choroidal malignant melanoma: tissue effects after a single treatment // Arch. Ophthalmol. – 1973. – Vol. 90. – P. 97 – 101.
16. Currie Z.I., Rennie I.G., Talbot J.F. Retinal vascular changes associated with transpupillary thermotherapy for choroidal melanomas // Retina. – 2002. – Vol. 20, N 6. – P. 620 – 626.
17. De Potter P., Shields. C.L., Shields. J.A., Cater J.R. et al. Plaque radiotherapy for juxtapapillary choroidal melanoma: visual acuity and survival outcome // Arch. Ophthalmol. – 1996. – Vol. 114. – P. 1357 – 1365.
18. Diener – West M., Hawkins B.S., Markowitz J.A., Schachat A.P. A review of mortality from choroidal melanoma. II. A meta – analysis of 5 – year mortality rates following enucleation, 1966 through 1988 // Arch. Ophthalmol. – 1992. – Vol. 110. – P. 245 – 250.
19. Godfrey D.G., Waldron R.G. Transpupillary thermotherapy for smoll choroidal melanoma // Amer. J. Ophthal. – 1999. – Vol. 128, N 1. – P. 88 – 93.
20. Gunduz K., Shields. C.L., Shields. J.A., Cater J. et al. Radiation retinopathy following plaque radiotherapy for posterior uveal melanoma // Arch. Ophthalmol. – 1999. – Vol. 117. – P. 609 – 614.
21. Gunduz K., Shields. C.L., Shields. J.A., Cater J.R. Radiation complications and tumor control after plaque radiotherapy of choroidal melanoma with macular involvement // Am. J. Ophthalmol. – 1999. – Vol. 127, N 5. – P. 579 – 589.
22. Hepler R.S., Allen R.A., Straatsma B.R. Photocoagulation of choroidal melanoma: early and late histopathologic consequences // Arch. Ophthalmol. – 1968. – Vol. 79. – P. 177 – 181.
23. Journee–de Korver J.G., Oosterhuis J.A., De Wolff–Rouendaal D., Kemme H. Histopathological findings in human choroidal melanomas after transpupillary thermotherapy // Brit. J. Ophthal. – 1997. – Vol. 81. – P. 234 – 239.
24. Keunen J.E.E., Journee–de Korver J.G., Oosterhuis J.A. Transpupillary thermotherapy of choroidal melanoma with or without brachytherapy: a dilemma // Br. J. Ophthalmol. – 1999. – Vol. 83. – P. 1212 – 1213.
25. McLean I.W., Foster W.D., Zimmerman L.E., Prognostic factors in small malignant melanomas of choroid and ciliary body // Arch. Ophthalmol. – 1977. – Vol. 95. – P. 48 – 58.
26. Mortality in patients with small choroidal melanoma. COMS report no. 4. The Collaborative Ocular Melanoma Study Group // Arch. Ophthalmol. – 1997. – Vol. 115. – P. 886 – 893.
27. Paul T. F. Radiation Therapy for Choroidal Melanoma // Serv. Ophthalmol.– 1997.– Vol. 42, N 3. – P. 215 – 232.
28. Seregard S. Long – term survival after ruthenium plaque radiotherapy for uveal melanoma. A meta – analysis of studies including 1066 patients // Acta. Ophthalmol. Scand. – 1999. – Vol. 77, N 4. – P. 414 – 417.
29. Shields. C.L., Shields. J.A., Kiratli H., De Potter P. et al. Risk factors for growth and metastasis of small choroidal melanocytic lesions // Ophthalmol. – 1995. – Vol. 102, N 9. – P. 1351 – 1361.
30. Shields C.L., Shields J.A., Cater J. et al. Transpupillary Thermotherapy for Choroidal Melanoma: tumor control and visual results in 100 consecutive cases // Ophthalmology. – 1998. – Vol. 105, N 4. – P. 581– 590.
31. Shields C.L., Shields J.A., Cater J. Plaque radiotherapy for uveal melanoma: long–term visual outcome in 1106 consecutive patients // Arch. Ophthal. – 2000. – Vol. 118. – P. 1219 – 1228.
32. Shields. C.L., Shields. J.A. Clinical features of small choroidal melanoma // Curr. Opin. Ophthalmol. – 2002. – Vol. 13, N 3. – P. 135 – 141.
33. Shields. C.L; Shields. J.A. Perez N. et al. Primary transpupillary thermotherapy for small choroidal melanoma in 256 consecutive cases: outcomes and limitations // Ophthalmology. – 2002. – Vol. 109, N 2. – P. 225 – 234.
34. Viebahn M., Barricks M.E., Osterloh M.D. Synergism between diabetic and radiation retinopathy // Br. J. Ophthalmol. – 1991. – Vol. 75. – P. 629 –632.
35. Wilson D.J., Klein M.L. Choroidal melanoma treated with cryotherapy // Arch. Ophthalmol. – 2002. – Vol. 120. – P. 393 – 395.












