in patients with proliferative vitreoretinopathy
S.N .Solonina, M.M. Shishkin,
Ae.V. Boiko, R.L. Troyanovskyi, N.N. Zybina
Leningrad regional clinical hospital
National medical and surgical Center named after Pirogov N.I.
Military Medical Academy
All–Russian Center of urgent and radiation medicine
St.–Petersburg
Purpose: to evaluate influence of antioxidant treatment on peroxidation and blood antioxidant activity in patients with proliferative vitreoretinopathy (PVR) of different etiology which had vitreoretinal surgical treatment (VRS).
Methods: For biochemical examination the venous blood was drawn prior the operation and in 21–30 days after it. Level of active forms of oxygen, malonic aldehyde in blood serum was detected. Antioxidant activity was evaluated by concentration of oxidated and reduced glutathione, activity of catalase in erythrocytes.
Results: Biochemical indices were studied in 47 patients with PVR (main group) which were prescribed Tanakan 3 times per day and vitamins A, E. Treatment was started 7–12 days before VRS and lasted to 21–30 days after it. Control group consisted of 43 patients with PVR. They also underwent VRS but no antioxidants were administered. All received data of biochemical examination was compared to these in healthy subjects (n=37).
Conclusion: PVR develops on the background of decrease of antioxidant activity of blood serum and blood cells and rising of concentration of peroxidation products. Complex antioxidant treatment leads to reliable decrease of malonic aldehyde and active oxygen forms in blood serum and blood cells and increase of antioxidant activity of erythrocytes in patients with OVR.
Проблемы пролиферативной витреоретинопатии (ПВР) привлекают пристальное внимание офтальмологов, т.к. лежат в основе патогенеза многих заболеваний, имеющих большое социальное и медицинское значение. В последние десятилетия сохраняется тенденция к увеличению частоты отслоек сетчатки. Нарастает частота тяжелых травм органа зрения, особенно прободных ранений и тяжелых контузий. Локальные военные конфликты характеризуются возрастанием частоты боевых повреждений органа зрения от 5 до 11,2%. Причем показания к различным типам витреоретинальной хирургии (ВРХ) возникают в 37,4–62,2%.
Лечение больных с ПВР, осложняющей течение травматических повреждений глаз и их последствий, различных форм отслоек сетчатки, увеитов и их последствий, системных заболеваний, пролиферативной диабетической ретинопатии является одной из ведущих проблем современной офтальмологии. Рецидивы и прогрессирование ПВР являются основной причиной неудач, требующих многократных повторных хирургических вмешательств. Частота рецидивов ПВР составляет от 11 до 30%.
Несмотря на значительные достижения технологии современной витреоретинальной хирургии, развитие пролиферативной витреоретинопатии после успешно проведенной витрэктомии регистрируется в 10–30% наблюдений [21]. Одной из причин, которая способствует развитию ПВР после ВРХ, может быть сама операция, в ходе которой на интраокулярные структуры воздействуют такие факторы, как интенсивное освещение, воздействие ирригационного раствора, тяжелых перфторорганических жидкостей, лазерной энергии, интра– и послеоперационная офтальмогипертензия. Экспериментальные исследования показали, что витрэктомия приводит к нарушению динамического равновесия прооксидантных и антиоксидантных систем в сетчатке [4]. В свою очередь, развитие ПВР происходит на фоне истощения антиоксидантных резервов интраокулярных структур [3,6,11,21]. Положительное влияние антиоксидантов на течение послеоперационного процесса в системе хирургического лечения больных с травматической ПВР было подтверждено клиническими исследованиями [8–10,18].
Известно, что ишемия сетчатки при последующей реперфузии способствует накоплению в сетчатке натрия и кальция, потере калия. Предварительное введение крысам супероксиддисмутазы (СОД), аллопуринола и Танакана (EGB 761, стандартизированный экстракт гинкго билоба) значительно уменьшало эти изменения [15]. Экспериментальными исследованиями установлена положительная роль Танакана в снижении образования продуктов перекисного окисления липидов (ПОЛ) и увеличении активности СОД и каталазы в структурах головного мозга [12]. Применение Танакана при заболеваниях, связанных с ишемией глаза, способствует улучшению зрительных функций и показателей местного кровообращения [2].
Действие препарата обусловлено характером влияния на процессы обмена в клетке, реологические свойства крови и микроциркуляцию. Он нормализует метаболические процессы, оказывая антигипоксическое влияние на ткани, препятствует образованию свободных радикалов и ПОЛ в клеточных мембранах. Антиоксидантное действие препарата во многом определяется наличием большого числа флавоноидов, способных ингибировать продукты ПОЛ на всех этапах развития [5,17]. Доказана способность биофлавоноидов образовывать комплексы с металлами переменной валентности [1]. Установлена возможность биофлавоноидов ингибировать активность миелопероксидазы (источник гипохлорида) [14], снижать уровень фактора некроза опухолей альфа TNF–α в фибробластах линии L929 [13].
Цель. Оценить влияние антиоксидантной терапии на перекисное окисление липидов и антиоксидантную активность крови пациентов с ПВР различной этиологии, которым выполнялись витреоретинальные вмешательства (ВРХ) .
Материалы и методы. Исследованы биохимические показатели крови у 47 пациентов с ПВР различной этиологии (основная группа), которым выполняли комплексную антиоксидантную терапию: Танакан внутрь 40 мг 3 раза в сутки и, витамины С и Е – парентерально. Танакан представляет собой лекарственный препарат, который содержит экстракт гинкго билоба (Egb 761), выпускается французской фирмой «Ipsen Pharma». Лечение начинали за 7–12 сут. до выполнения ВРХ и продолжали в течение 21–30 сут. после операции. В качестве контрольной группы были взяты 43 пациента с такой же патологией, которым выполняли ВРХ в таком же объеме, но без применения антиоксидантов.
Для биохимических исследований брали кровь из вены непосредственно перед началом ВРХ и через 21–30 сут. после операции. Об интенсивности свободно–радикальных процессов судили по уровню продукции нейтрофилами и мононyклeарами периферической крови активных форм кислорода (АФК), продуктов пероксидации липидов (малоновый диальдегид – МДА) в сыворотке крови, лейкоцитах и тромбоцитах периферической крови у исследуемых пациентов. Об антиоксидантной защите судили по содержанию окисленного и восстановленного глутатиона (ВГ), активности каталазы в эритроцитах [19]. Полученные биохимические показатели сравнивали с такими же в группе здоровых лиц (n=37).
Результаты. Показатели проведенных исследований в основной и контрольной группах до ВРХ и в группе здоровых лиц приведены в таблице 1.
После комплексного применения антиоксидантов у пациентов основной группы отмечено уменьшение показателей пероксидации липидов и повышение антиоксидантной активности в эритроцитах. Так, спонтанный уровень МДА в сыворотке крови основной группы был существенно ниже, чем у пациентов контрольной группы (3,32±0,09 против 3,81±0,17, р<0,05) и совсем незначительно отличался от уровня МДА сыворотки крови в группе здоровых лиц (рис. 1).
Уровень МДА в нейтрофилах и мононуклеарах в обеих группах был достоверно выше, чем в группе здоровых лиц, но в основной группе эти показатели были ниже, чем в контрольной: 0,203±0,1 против 0,258±0,1 и 0,141±0,19 против 0,173±0,01 соответственно (р<0,01) (рис. 2 и 3).
Уровень малонового диальдегида в тромбоцитах пацентов контрольной группы был повышен почти в 2 раза, в то время как данный показатель среди пациентов основной группы после применения комплексной антиоксидантной терапии остался повышенным незначительно при сравнении с величиной МДА в тромбоцитах в группе здоровых лиц. Графически данные изменения изображены на рисунке 4.
Продукция перекиси водорода в мононуклеарах у пациентов контрольной группы также была повышеной по сравнению с нормальными величинами более, чем в 2,6 раза. Продукция АФК мононуклеарами у больных основной группы оказалась ниже данного показателя в контрольной группе больных, но оставалась повышенной (в 1,7 раза) при сравнении этого показателя в группе здоровых лиц. Графически указанные изменения изображены на рисунке 5.
Содержание восстановленного глутатиона, являющегося донором атома водорода для инактивации свободных радикалов, было сниженным в эритроцитах у пациентов контрольной группы по сравнению с величиной нижней границы нормы в группе здоровых лиц. У пациентов основной группы после применения комплексной антиоксидантной терапии наблюдалось увеличение содержания восстановленного глутатиона в эритроцитах крови по сравнению с данными показателями в контрольной группе больных. Различия между группами были статистически значимыми. Графическое изображение указанных изменений изображено на рисунке 6.
Уровень окисленного глутатиона в эритроцитах пациентов и основной и контрольной групп сохранялся в пределах нормальных величин.
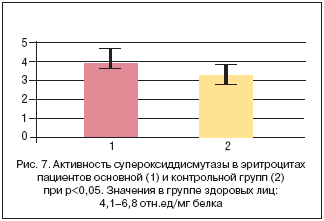
Активность супероксиддисмутазы в эритроцитах пациентов контрольной группы, не получавших антиоксидантную терапию, оказалась сниженной по сравнению с данными показателями в группе здоровых лиц. У пациентов основной группы после комплекса антиоксидантной терапии в эритроцитах отмечали более высокую активность супероксиддисмутазы, приближающуюся к нижней границе нормы, что изображено на рисунке 7.
Обсуждение результатов. Результаты проведенных биохимических исследований свидетельствуют о том, что развитие ПВР происходит на фоне выраженного «окислительного стресса» на системном уровне. Это характеризуется повышенным свободнорадикальным окислением в исследуемых клеточных элементах, сыворотке и сниженной антиоксидантной активностью (по содержанию восстановленного глутатиона и активности СОД) в эритроцитах. Показатели ПОЛ были выше в клеточных элементах крови (в 2,3 раза) по сравнению с сывороткой (в 1,2 раза). Параметры свободнорадикального окисления были самыми высокими в мононуклеарах, как по уровню МДА (в 3 раза), так и по продукции АФК (в 2,6 раза) [7,19,20].
У больных, получавших комплексную антиоксидантную терапию (основная группа), параметры свободнорадикального окисления были заметно ниже, в среднем в 1,3 раза. Показатели антиоксидантного статуса в эритроцитах – по содержанию восстановленного глутатиона и активности СОД – превысили величины данных параметров по сравнению с контрольной группой. Комплексное применение антиоксидантов по указанной методике обеспечило достоверно низкую продукцию ПОЛ и более высокую антиоксидантную активность, что в значительной степени уменьшило проявления «окислительного стресса» в крови у больных с ПВР.
Заключение. Результаты проведенного исследования свидетельствуют о том, что развитие ПВР происходит на фоне снижения антиоксидантной активности в сыворотке и клетках крови и повышения содержания в них продуктов пероксидации липидов. Комплексная антиоксидантная терапия с применением Танакана приводит к достоверному снижению уровня МДА и АФК в сыворотке и клеточных элементах крови и повышению антиоксидантной активности в эритроцитах крови у больных с пролиферативной витреоретинопатией.







Литература
1. Барабой В.А. Биологическое действие растительных фенольных соединений. – Киев: Наук. думка, 1976. 260 с.
2. Бишеле Н.Н. Диагностика и патогенетическое лечение состояний, приводящих к ишемии и гипоксии заднего сегмента глаза: Автореф. дис. канд. мед. наук. – М., 2001. – 40 с.
3. Бойко Э.В., Шишкин М.М., Солонина С.Н., Зыбина Н.Н., Давыдова Н.И. Влияние антиоксидантной терапии на показатели «окислительного стресса», антиоксидантной защиты и локального звена иммунитета в аспиратах стекловидного тела у больных с пролиферативной витреоретинопатией (ПВР) при комбинированном хирургическом лечении // Юбил. научн. конф., посвящ. 185–летию основания первой в России кафедры офтальмологии «Боевые повреждения органа зрения». – СПб., 2003. С. 117.
4. Салимжанова Г.В., Шишкин М.М. Антиокидантная защита сетчатки при витреоретинальной хирургии // Офтальмология на рубеже веков. – СПб., 2001. – С. 267.
5. Сокольчик И. Г., Кухта В. К., Морозкина Т. С., Захаревский А. С., Гронская Н.И., Шестаков В.Л., Ребкало П.В., Рутковская Ж.А. Влияние некоторых биофлавоноидов на неферментативную антиоксидантную защиту организма // Здравоохранение Белоруссии. – Минск. –1992, № 2. – С. 47–49.
6. Солонина С.Н. Анализ биохимических и иммунологических показателей у больных с пролиферативной витреоретинопатией // Съезд офтальмологов России, 8–й (1–4 июня 2005 г.): Тез. докл. – М.: Издательский центр МНТК «Микрохирургия глаза», 2005. – С. 306–307.
7. Солонина С.Н., Трояновский Р.Л., Синявский О.А., Зыбина Н.Н. Иммуно–биохимические критерии при различной степени и протяженности пролиферативной витреоретинопатии (ПВР)/ Пролиферативный синдром в офтальмологии: IV Международная научно–практическая конференция (29–30 ноября 2006 г.). Сборник научных трудов.– М., 2006. – С. 24–27.
8. Солонина С.Н., Шишкин М.М. Антиоксиданты – как один из компонентов комбинированного лечения пациентов с витреоретинальной патологией // Волжские зори. Регион. конф.: Тез. докл. – Самара, 1998. – С. 209–210.
9. Шишкин М.М., Солонина С.Н., Антонюк В.Д. Комплексное применение антиоксидантов в системе хирургического лечения травматической пролиферативной витреоретинопатии // Офтальмолохирургия.–1999.– № 3. – С. 31–36.
10. Шишкин М.М., Солонина С.Н., Зыбина Н.Н. Влияние антиоксидантной терапии на биохимические показатели крови и стекловидного тела у пациентов с витреоретинальной патологией // Материалы науч. конф. «Боевые повреждения органа зрения». – СПб., 1999. – С. 219–220.
11. Boker T., Augustin A.J., Breipohl W., Spitznas M., Lutz J. Increased lipid peroxide level and myeloperoxidase activity in the vitreous of patients suffering from proliferative vitreoretinopathy // Graefe’s Arch. Clin. Exp.Ophthalmol. – 1994. – Vol. 232, № 11. – P. 652–656.
12. Bridi R., Crossetti F.P., Steffen Y.M., Henriques A.T. The antioxydant activity of standardized exctract of Gingo biloba (Egb 761) in rats. // Phytother. – 2001. – Vol. 15, № 5. – P. 449–451.
13. Habtemanam S. Fflavonoids as inhibitors or enhancers of the citotoxicity of tumor necrosis–alpha in L–929 tumor cells // J. Nat. Prod. – 1997. – Vol. 60. – № 8. – P. 775–778.
14. Hart T.B.A., Ip Via Ching T.R., Van Dijk H., Labadie RP. Haw flavonoids inhibit the generation of luminol–dependent chemiluminescence by activated human neutrophils // Chem. Biol. Interact. – 1990. – Vol. 73, № 2. – P. 323–335.
15. Nayak M.S., Kita M., Marmow M.F. Protection of rabbit retina from ishemic injury by superoxide dismutase and catalase // Invest. Ophtalmol. Vis. Sci. – 1993. – Vol. 34. – № 6. – P. 2018–2022.
16. Pieramici D.J., Capone A.Jr., Aaberg T.M.Sr. Surgical management of proliferative vitreoretinopathy // Retina, vitreous, macula / [Ed. by D.R. Guyer et al. –.город: – Saunders Company. 1999. – Vol. 2. – P. 1350–1369.
17. Ratty A.K., Sunamoto J., Das N.P. Interaction of flavonoids with 1,1–diphenyl–2–picrylhydrazyl free radical, liposomal membranes and soybean lipoxygenase–1 // Biochem. Pharmacol.– 1988 – Vol. 37, № 6. – P. 989–995.
18. Solonina S., Shishkin M.M., Boiko E. The role of antioxidants in complex treatment of proliferative vitreoretinopathy // Abstract Book of XII Congress European Society of Ophthalm. – Stockholm, 1999. – P. 327.
19. Solonina S.N., Sinyavsky O.A., Troyanovsky R.L., Baranov A.V., Zybina N.N.. Immuno–biochemical status in surgical treatment of patients with proliferative vitreoretinopathy (PVR) / 7th EURETINA. Congress, Monte Carlo, 17–20 May 2007. Book abstracts. P. 97.
20. Solonina S.N., Zybina N., Sinyavsky O.А., Kuznetsova K.S. Increased hydrogen peroxide production in monocytes and superoxide dismutase activity in the vitreous in surgical treatment of patients suffering from retinal detachment (RD) with marked proliferative vitreoretinopathy (PVR) // 15th SOE Congress European Society of Ophthalmology. 103rd DOG Congress Deutsche Ophthalmologische Gesellschaft. Basic Sciences and Clinical Application. Scientific Programme. Abstracts and Videos. 25–29 September 2005, Berlin,Germany, ICC. Joint Meeting. 2.12 S, 0144_e.doc
21. Takano S., Ishiwata S., Nakazawa M., Mizugaki M., Tamai M. Determination of ascorbic acid in human vitreous humor by high–performance liquid chromatography with UV detection // Curr. Eye. Res – 1997. – Vol. 16, № 6. – P. 589–594.












