The review deals with the problems of screening, new diagnostic potentialities and treatment of resectable and unresectable hepatocellular carcinoma(HCC). The authors note that the proportion of early detectable HCC becomes high, thus increasing the numer of patients who may undergo curative resection.In tumors, less than 5cm in dimeter, potresectonal chances of recovery are goo. In small unresectable HCC limited by the liver, there may be orthotopic hepatic transplataton which in combination with adjuvant chemotherapy may also yield relatively good results. Transcatheter lipidol embolization of the hepatic artery may be used as palliative treatment; transcutaneous injection of ethnol into the thet umor and its adjacent tissues is a good alternativ to the above method.
Г-жа C.M.J. van Nieuwkerk, специалист по внутренним болезням; д-р. E.A.J. Rauws
и проф. д-р. G.N.J. Tytgat, гастроэнтерологи; д-р. J.W.A.J. Reeders, радиодиагност;
д-р. A.E. Jones, гепатолог; проф. д-р. D.J. Gouma, хирург.
University of Amsterdam, Academic Medical Centre, dep. of Gastrointestinal and Hepatic Diseases, Meibergdreef 9, 1105 AZ Amsterdam, Netherlands.
Гепатоцеллюлярная карцинома (ГЦК) - одна из гастроинтестинальных опухолей с плохим прогнозом. Распространенность варьирует от 2 на 100 000 населения в год в регионах с низким риском (Северо-Западная Европа и Северная Америка) до 30 на 100 000 населения в год в регионах с высоким риском (Юго-Восточная Азия и Южная Африка). Приблизительно в 70% случаев ГЦК сопровождается циррозом и, как правило, является следствием гепатита В или С. При естественном течении очень быстро наступает фатальный исход. Средняя выживаемость после постановки диагноза составляет в Азии всего 7 нед, в Европе - 15 нед, однолетняя выживаемость - 13%. При асимптоматической ГЦК диаметром менее 3 см естественное течение менее неблагоприятно; в некоторых наблюдения 2-летняя выживаемость составила 44 - 55%, 3-летняя - 13%. Благодаря интенсивному скринингу больных циррозом доля пациентов с резецируемыми опухолями возросла до 30%. В последние годы также появилось много данных о новых куративных и паллиативных возможностях лечения.
Цель данного обзора - показать, что ГЦК имеет менее фатальный прогноз, чем до сих пор было принято считать. Мы рассматриваем скрининг, новые диагностические возможности и лечение резецируемой и нерезецируемой ГЦК.
Скрининг
Благодаря интенсивному скринингу больных циррозом ГЦК все чаще выявляется в ранней стадии. Ежегодная заболеваемость ГЦК при циррозе составляет 3 - 6%; в исследовании Eurohep при компенсированном циррозе типа В по классификации Child через 5 лет после постановки диагноза частота ГЦК составила 6%. Согласно классификации Child, тяжесть болезни печени, определяемая на основании лабораторных показателей (уровень билирубина, альбумина и протромбиновое время) и клинического состояния (асцит и энцефалопатия), последовательно возрастает от класса А к классу С. У пациентов с циррозом степени А по Child, у которых в принципе возможна куративная резекция, рекомендуется каждые 6 мес проводить эхографию и определять концентрацию a-фетопротеина (АФП) в сыворотке. Как показало исследование Pateron и соавт., чувствительность и специфичность определения АФП составляют при уровне более 100 нг/мл соответственно 21 и 93%. Большой размер опухоли не всегда соответствует более высоким показателям, а уровень АФП от 50 до 400 нг/мл часто свидетельствует о наличии еще не обнаруживаемой ГЦК (однако может также указывать на регенерационную активность), в связи с чем частое проведение скрининга оправдано. Эхография - более чувствительный и специфичный метод: эти показатели составляют соответственно 78 и 93%. Данные литературы свидетельствуют о том, что 31% ГЦК диаметром менее 2 см не обнаруживаются при эхографическом исследовании. Дес-гамма-карбоксипротромбин (ДКП) является новым маркером опухоли для ГЦК.
Пока еще неясно, снижается ли смертность благодаря скринингу, представляется целесообразным осуществлять скрининговые обследования пациентов с высоким риском посредством эхографии, определения уровня АФП и, возможно, ДКП.
Диагностика
При эхографически выявленном очаге в печени и повышенном уровне АФП можно с уверенностью диагностировать ГЦК. В случае сомнения может быть выполнена цитологическая пункция. Для оценки точной локализации и распространенности опухоли обычно выполняют спиральную компьютерную томографию (КТ). Также может быть выполнена контрастная ангиография в сочетании с КТ. Для этого используется маслосодержащее контрастное вещество (йодированный жирно-кислотный этиловый эфир, липиoдол), которое селективно впрыскивается в a. hepatica, а затем задерживается в ткани ГЦК. В течение 3 нед липиодол вымывается из нормальных тканей, после чего проводится повторная контрольная КТ (см. рисунок). Этот метод не обладал 100% специфичностью, однако характеризуется высокой чувствительностью и является важным диагностическим средством для выявления мультифокальных и очень маленьких ГЦК. Для исключения наличия отдаленных метастазов должны быть выполнены рентгенограмма грудной клетки и сканирование костей. Если опухоль резецируема и резекция возможна у данного пациента (учитывая операционный риск, метастазы и состояние больного), может быть выполнена диагностическая лапароскопия с интраабдоминальной эхографией для исключения перитонеальных метастазов и мелких патологических очагов на противоположной стороне, а также для оценки степени тяжести цирроза, который часто уже определен по классификации Child. Стадию опухоли определяют по TNM или Okuda (табл.1).
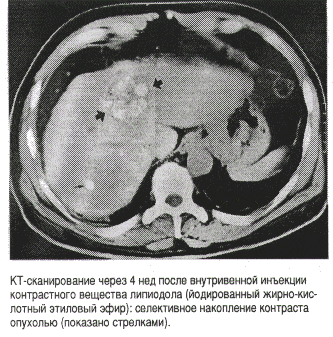
Лечение резецируемых опухолей
Частичная резекция печени. Выживаемость после резекции определяется не только наличием или отсутствием оболочки опухоли и ее толщиной, величиной, числом, местом и прорастанием очагов, которые определяют объем резекции, но также функциональной остаточной способностью печени. Цирроз имеется у 70% больных с ГЦК. Оперативная смертность составляет менее 3% у пациентов без цирроза и 7 - 25% у пациентов с циррозом. При циррозе стадии Child A остаточная способность печени достаточна для выполнения резекции. При лечении пациентов с циррозом отдается предпочтение ограниченным сегментарным или клиновидным резекциям. Резекция противопоказана пациентам с циррозом степени Сhild C из-за высокого оперативного риска и короткой ожидаемой продолжительности жизни. В табл. 2 перечислены отдельные исследования, в которых изучали различные факторы риска, а также отражена выживаемость после частичной резекции печени. Однолетняя выживаемость составляет от 56 до 92%, а 5-летняя - от 22 до 66%. Однако необходимо помнить, что неясно, имеет ли ГЦК в Западной Европе такое же естественное течение, как и в Юго-Восточной Азии.
ГЦК резецируема лишь у 3 - 30% пациентов, и после резекции сохраняется высокий процент рецидива (57), вероятно, частично вследствие мультифокальности опухоли или наличия предзлокачественных очагов. Японские исследователи оценили эффект периоперативной селективной эмболизации a. hepatica, целью которой было уменьшение объема опухоли и ограничение объема резекции; предполагалось также, что таким образом можно уменьшить риск рецидива опухоли. Результаты не оправдали ожиданий. Эффективность пре- или постоперативной химиоэмболизации еще должна быть исследована.
Ортотопная трансплантация печени. В настоящее время в Европе приблизительно 12% пересадок печени (около 200 в год) проводится в связи со злокачественными опухолями, послеоперационная смертность составляет 8%. Культурные различия и малое количество доступных органов являются соопределяющими факторами при определении показаний к пересадке. Другим определяющим фактором является необходимость иммуносупрессии, которая, вероятно, связана с повышенным риском рецидива опухоли. Таким образом, показания к пересадке остаются противоречивыми и критерии для нее еще однозначно не определены. Общепринятыми показаниями к ортотопной пересадке печени являются маленькие опухоли (диаметр менее 3 см), которые не могут быть резецированы по анатомическим причинам (локализация в толще печени), а также маленькие ГЦК, которые технически можно резецировать, однако этому препятствуют функциональные ограничения (больные с циррозом).
Данные литературы трудно интерпретировать из-за плохой сравнимости групп пациентов. Выживаемость пациентов с маленькими уни- или бинодулярными опухолями (менее 3 см) после ортотопной трансплантации печени лучше, чем после резекции (5-летняя выживаемость составляет 83% против 18%; р < 0,001). С учетом этого уже были расширены показания к трансплантации. Недавно сообщалось о благоприятных результатах местной интраартериальной или системной химиотерапии, применявшейся в качестве дополнительного лечения, предшествовавшего трансплантации. Вероятно, в будущем показания к пересадке печени при ГЦК станут еще шире.
Лечение нерезецируемых опухолей
Большинство ГЦК обнаруживаются в поздней стадии, когда резекция часто уже невозможна из-за распространенности опухоли, прорастания в сосуды, тромбоза воротной вены, метастазов, возраста, общего состояния больного, наличия других внепеченочных заболеваний или недостаточного функционального резерва оставшейся неповрежденной части печени. Для этой группы пациентов возможно лишь паллиативное лечение. Ранее описаны многочисленные методы лечения; результаты их применения сильно различались, главным образом в неконтролированных исследованиях.
Таблица 1. Определение стадий ГЦК по системе Okuda
| Критерий | Баллы |
| Величина опухоли более 50% объема печени | 1 |
| Асцит | 1 |
| Уровень альбумина менее 30 г/л | 1 |
| Уровень общего билирубина выше 30 мкмоль/л | 1 |
| Стадия: | |
| I | 0 |
| II | 1 или 2 |
| III | 3 |
Таблица 2. Выживаемость пациентов с ГЦК после частичной резекции печени
| Выживаемость, % | |||||
| Автор | Число больных | Диаметр опухоли, см | через 1 год | через 3 года | через 5 лет |
| Franco: | 72 | 68 | 51 | ||
| Child A | 80 | 57 | |||
| Child B/C | 56 | 12 | |||
| Nagao | 23 | < 3 | 90 | 79 | 61 |
| Kinami | 17 | < 5 | 53 | ||
| 18 | > 5 | 0 | |||
| Nagasue: | |||||
| с циррозом (-) | 14 | 81 | 81 | ||
| без цирроза (+) | 80 | 72 | 35 | ||
| Chen | 120 | 56 | 25 | 22 | |
| > 10 | 40 | 7 | 7 | ||
| 6-10 | 58 | 30 | 30 | ||
| < 5 | 85 | 60 | 60 | ||
| Nagao | 45 | < 6 | 80 | 60 | 27 |
| 30 | > 5 | 60 | 23 | 20 | |
| Ikeda | 83 | 92 | 66 | 66 | |
| Tobe | 2236 | 2 | 87 | 75 | 61 |
| 2-5 | 79 | 57 | 39 | ||
| 5-10 | 74 | 48 | 27 | ||
Таблица 3. Выживаемость пациентов с ГЦК (1 очаг) после лечения чрескожными инъекциями этанол
| Выживаемость, % | |||||
| Автор | Диаметр опухоли, см | Стадия по Child | через 1 год | через 2 года | через 3 года |
| Shiina | < 3 | А/В | 89 | 74 | 68 |
| Ebara | < 3 | А/В | 93 | 81 | 65 |
| Vilana | < 4 | А/В | 87 | 70 | |
| Livraghi | < 5 | А | 97 | 92 | 76 |
| В | 88 | 68 | 42 | ||
Эмболизация (химиоэмболизация) a. hepatica. Кровоснабжение опухоли почти на 100 % осуществляется печеночной артерией. Иногда при ГЦК производится перевязка а. hepatica, но это не приводит к явному улучшению выживаемости. Химиотерапевтические средства, введенные в печеночную артерию селективно и одновременно с липидолом, накапливаются в ткани опухоли. Их медленное выделение обеспечивает более продолжительное действие. Сосуд в конце операции закупоривается пенно-гелевыми хлопьями (так называемая транскатетерная липидоловая артериальная химиоэмболизация -ТЛАХЭ). С помощью этого метода могут быть также уничтожены маленькие необнаруживаемые неопластические очаги в зоне кровоснабжения. Поскольлку ГЦК часто мультифокальна, этот метод должен быть очень эффективным способом лечения. Однако в четырех рандомизированных исследованиях химиоэмболизация посредством ТЛАХЭ с применением доксорубицина или цисплатина при нерезецируемой ГЦК не привела к увеличению выживаемости. Лишь в исследовании Bronowicki и соавт. наблюдалось значительное увеличение выживаемости пациентов с ГЦК I и II стадий по классификации Okuda. Часто возникает постэмболизационный синдром: повышается температура, отмечаются боль в животе, тошнота, рвота и увеличение активности трансаминаз сыворотки; описаны даже инфаркт желчного пузыря, панкреатит и фатальный исход. Адекватные рандомизированные исследования, результаты которых оправдывали бы применение химиоэмболизации в качестве рутинного лечения, отсутствуют. Если решение о химиоэмболизации все же принято, то лучшим вариантом является суперселективная эмболизация. Она легче переносится и несет с собой меньший риск осложнений.
Чрескожное инъекционное лечение с применением этанола. Под эхографическим контролем в опухоль чрескожно может быть введена тонкая игла (калибра 22). 99,5% раствор этанола впрыскивают в опухоль и вокруг нее с целью некротизирования опухоли. По данным Livraghi и соавт., 1-, 2- и 3-летняя выживаемость пациентов с 1 узлом составляет соответственно 90, 80 и 63% (для пациентов со стадией Child A соответственно 97, 92 и 76%; со стадией Child B - 88, 68 и 42%; со стадией Child C - 40 и 0%). При двух или трех очагах 1-, 2- и 3-летняя выживаемость после этаноловой терапии составляла соответственно 90, 67 и 31%. Всего было проведено 2485 курсов амбулаторного лечения 207 пациентам без тяжелых осложнений. В 7% случаев возникал рецидив, у 64% пациентов появлялись новые очаги, по поводу которых они вновь получили лечение. В трех других контролированных исследованиях (табл. 3) были получены аналогичные результаты. 3-летняя выживаемость при унифокальной патологии была равна таковой после хирургической резекции. По данным Tanikawa и соавт., 5-летняя выживаемость в группе из 133 пациентов с ГЦК диаметром менее 3 см составила 46%. К сожалению, у этих пациентов через 5 лет частота рецидива составляла 96%. Следовательно, этот метод, несмотря на хорошие кратковременные результаты, должен рассматриваться как паллиативный. Большое положительное влияние на выживаемость оказывают проводимые каждые 3 мес контрольные эхографические обследования и лечение возникающих рецидивов инъекциями этанола. Этаноловая терапия при больших ГЦК (диаметр более 5 см) не даст хороших результатов в плане регрессии опухоли и выживаемости. Таким образом, инъекции этанола лишь у неоперабельных пациентов с тремя или менее очагами диаметром менее 5 см дают хороший паллиативный результат и обеспечивают более длительную выживаемость.
Другие методы лечения. Системная химиотерапия применялась во многих неконтролированных исследованиях и в одном контролированном, причем во всех работах частота ответов на лечение была очень низкой. Показания к такому виду лечения отсутствуют. Эффективность облучения при ГЦК мала, однако протонное облучение и чрескожная микроволновая коагуляционная терапия положительно влияют на выживаемость при нерезецируемых ГЦК. Многообещающие результаты в отношении уменьшения величины опухоли на короткий промежуток времени получены при внутривенном или через a. hepatica введении 131I-antihuman ГЦК-изоферритин-IgG в дозе 20 - 55 мКи. Разные авторы также сообщают, что это лечение в комбинации с другими методами дает возможность удалять прежде нерезецируемые ГЦК. В Японии проводятся исследования с внутриопухолевыми инъекциями стрептококкового препарата ОК-432 пациентам с нерезецируемой ГЦК, благодаря чему достигаются лучший клеточный иммунитет против опухоли, а также лизис опухолевых клеток. Место этих иммунологических методов лечения еще неясно, однако результаты обнадеживают. В исследованиях с использованием гормональных методов лечения нерезецируемых ГЦК получены противоречивые результаты.
Выводы
Благодаря все более широкому проведению интенсивного скрининга больных циррозом доля ГЦК, обнаруживаемых в ранней стадии, растет. Ежегодная заболеваемость ГЦК при циррозе составляет 3 - 6%. У пациентов с циррозом стадии Child A, у которых в принципе возможна куративная резекция, рекомендуется каждые 6 мес проводить эхографическое обследование и определять уровень АФП. При уровне АФП от 50 до 400 нг/мл без обнаруживаемой ГЦК оправдан более частый эхографический скрининг. В качестве дополнительного метода обследования в большинстве случаев выполняется спиральная КТ. В диагностике сателлитной патологии важную роль играет липидоловая ангио-КТ. Диагностическая лапароскопия в комбинации с лапароскопической эхографией дает важную дополнительную информацию перед резекцией в отношении сателлитных опухолей в другой половине печени, перитонеальных метастазов и цирроза. Резекция показана жизнеспособным больным с резецируемыми ГЦК и с хорошей функциональной способностью остаточной части печени. При опухолях диаметром менее 5 см шансы на излечение после резекции хорошие.
При циррозе стадии Child B может быть выполнена ограниченная резекция, например сегментов II/III слева или периферийно справа (разделение на функциональные сегменты печени по Couinaud). Ортотопная трансплантация печени является альтернативным методом лечения при нерезецируемых ГЦК (маленьких), ограниченных печенью, главным образом, при циррозе стадии Child B. При таком лечении в комбинации с дополнительной химиотерапией прогноз относительно хороший. В качестве паллиативного лечения не всегда следует прибегать к транскатетерной липидоловой артериальной химиоэмболизации. Чрескожные инъекции этанола, характеризующиеся низкой частотой осложнений, представляются хорошей альтернативой. При нерезецируемых маленьких опухолях (менее 5 см) без внепеченочных проявлений при циррозе стадии Child A/B 3-летняя выживаемость при использовании этого метода составляет около 70%. При наличии нескольких мелких очагов (3 или менее) и при рецидивах после резекций этаноловая терапия также является хорошим выбором. Химио- и радиотерапия не дают хороших результатов, однако будущее, возможно, принадлежит иммунотерапии.
Возможности лечения как резецируемых, так и нерезецируемых ГЦК явно расширились. Новые методы лечения характеризуются гораздо меньшими заболеваемостью и смертностью, причем достигается более длительная выживаемость. Таким образом, прогноз при ГЦК не всегда столь безнадежен, как многие все еще думают.
Адрес для корреспонденции: г-жа C.M.J. van Nieuwkerk.
Взято из Ned Tijdschr Geneeskd 1996;140(17):922-6 с разрешения главной редакции и авторов.
Литература:
1. De Bac C, Stroffolini T, Gaeta GB, Taliani G, Giusti G. Pathogenic factors in cirrhosis with and without hepatocellular carcinoma: a multicenter Italian study. Hepatology1994;20:1225 - 30.
2. Cottoe M, Turri M, Caltagirone M, Parisi P, Orlando A, Fiorentino G, et al. Screening for hepatocellular carcinoma in patients with Child`s A cirrhosis: an 8-year prospective study by ultrasound and alphfetoprotein. J Hepatol 1994;21:1029 - 34.
3. Colombo M, de Franchis R, Del Ninno E, Sangiovanni A, De Fazio C, Tommasini M, et al. Hepatocellular carcinoma in Italian patients with cirrhosis. N Engl J Med 1991;325:675 - 80.
4. Pateron D, Ganne N, Trinchet JC, Aurousseau MH, Mal F, Meicler C, et al. Prospective study of screening for hepatocellular carcinoma in Caucasian patients with cirrhosis. J Hepatol 1994;20:65 - 71.
5. Fattovich G, Giustina G, Schalm SW, Hadziyannis S, Sanchez-Tapias J, Almasio P, et al. Occurrence of hepatocellular carcinoma and decompensation in western European patients with cirrhosis typeB. Hepatology 1995;21:77-82.
6. Sato Y, Nakata K, Kato Y, Shima M, Ishii N, Koji T, et al. Early recognition of hepatocellular carcinoma based on altered profiles of lpha-fetoprotein. N Engl J Med 1993;328:1802 - 6.
7. Ngan H. Lipiodol computerized tomography: how sensitive and specific is the technique in the diagnosis of hepatocellular carcinoma? Br J Radiol 1990;63:771 - 5.
8. Takayasu K, Shima Y, Muramatsu Y, Goto H, Moriyama N, YmadaT, et al. Angiography of small hepatocellular carcinomas: analysis of 105 resected tumors. AJR Am J Roentgenol 1986;147:525 - 9.
9. Lipiodol computed tomography for small hepatocellular carcinomas. Lancet 1991;337:333 - 4.
10. Okuda K, Ohtsuki T, Obata H, Tomimatsu M, Okazaki N, Hasegawa H, et al. Natural history of hepatocellular carcinoma and prognosis in relation to treatment. Study of 850 patients. Cancer 1985;56:18 - 28.
11. The Liver Cancer Study Group of Japan. Predictive factors for long term prognosis after partial hepatectomy for patients with hepatocellular carcinoma in Japan. Cancer 1994;74:2772 - 80.
12. Ikeda K, Saitoh S, Tsubota A, Arase Y, Chayama K, Kumada H, et al. Risk factors for tumor reccurrence and prognosis after curative resection of hepatocellular carcinoma. Cancer 1993;71:19 - 25.
13. Franco D, Capussotti L, Smadja C, Bouzari H, Meakins J, Kemeny F, et al. Resection of hepatocellular carcinomas. Results in 72 European patients with cirrhosis. Gastroenterology 1990;98:733 - 8.
14. Kinami Y, Takashima S, Miyazaki I. Hepatic resection for hepatocellular carcinoma associated with liver cirrhosis. World J Surg 1986;10:294 - 301.
15. Nagao T, Nagashima I, Inoue S, Omori Y, Kawano N, Morioka Y. Hepatic resection for minute hepatocellular carcinoma. Surg Tolay 1992;22:110 - 4.
16. Nagasue N, Yukaya H, Ogawa Y, Sasaki Y, Chang YC, Niimi K. Clinical experience with 118 hepatic resections for hepatocellular carcinoma. Surgery 1986;99:694 - 701.
17. Chen MF, Hwang TL, Jeng LB, Jan YY, Wang CS, Chou FF, Hepatic resection in120 patients with hepatocellular carcinoma. Arch Surg 1989;124:1025 - 8.
18. Nagao T, Inoue S, Goto S, Mizuta T, Omori Y, Kawano N, et al. Hepatic resection for hepatocellular carcinoma. Clinical features and long-term prognosis. Ann Surg 1987;205:33 - 40.
19. Tobe T, Arii S. Improving survival after resection of hepatocellular carcinoma: characteristics and current status of surgical treatment of primary liver cancer in Japan: Tobe T, Kameda H, Ohto M, editors. Primary liver cancer in Japan. Tokyo: Springer, 1992.
20. Nerenstone SR, Ihde DC, Friedman MA. Clinical trials in primary hepatocellular carcinoma: current status and future directions. Cancer Treat Rev 1988;15:1 - 31.
21. Pichlmayr R, Weimann A, Ringe B. Indications for liver transplantation in hepatobiliary malignancy. Hepatology 1994;20:33S - 40S.
22. Stone MJ, Klintmalm GB, Polter D, Husberg BS, Mennel RG, Ramsay MA, et al. Neoadjuvant chemotherapy and liver transplantation for hepatocellular carcinoma: a pilot study in 20 patients. Gastroenterology 1993;104:196 - 202.
23. Carr B, Selby R, Madriaga J, Iwatsuki S, Starz T. Prolonged survival after liver transplantation and cancer chemotherapy for advacedstage hepatocellular carcinoma. Transplant Proc 1993;25:1128 - 9.
24. Bruix J, Castells A, Montanya X, Calvet X, Bru C, Ayuso C, et al. Phase II stydy of transarterial embolization in European patients with hepatocellular carcinoma: need for controlled trials. Hepatology 1994;20:643 - 50.
25. Madden MV, Krige JE, Bailey S, Beningfield SJ, Geddes C, Werner ID, et al. Randomised trial of targeted chemotherapy with lipiodol and 5-epidoxorubicin compared with symptomatic treatment for hepatoma. Gut 1993;34:1598 - 600.
26. Palletier G, Roche A, Ink O, Anciaux ML, Derhy S, Rougier P, et al. A randomized trial of hepatic arterial chemoembolization in patients with unresectable hepatocellular carcinoma. J Hepatol 1990;11:181 - 4.
27. Chang J, Tzeng W, Pan H, Yang C, Lai K. Transcatheter arterial embolization with or without cisplatin treatment of hepatocellular carcinoma. Cancer 1994;74:2449 - 53.
28. Groupe d'Etude et de treatment du Carcinome Hepatocellulare. A comparison of lipiodol chemoembolization and conservative treatment for unresectable hepatocellular carcinoma. N Engl J Med 1995;332:1256 - 61.
29. Bronowicki JP, Vetter D, Dumas F, Boudjema K, Bader R, Weiss AM, et al. Transcatheter oily chemoembolization for hepatocellular carcinoma. A 4-year study of 127 French patients. Cancer 1994;74:16 - 24.
30. Malsui O, Kadoya M, Yoshikawa J, Gabata T, Arai K, Demachi H, et al. Small hepatocellular carcinoma: treatment with subsegmental transcatheter arterial embolization. Radiology 1993;188:79 - 83.
31. Livraghi T, Bolondi L, Lazzaroni S, Marin G, Morabito A, Repaccini GL, et al. Percutancous ethanol injection in the treatment of hepatocellular carcinoma in cirrhosis. A study on 207 patients. Cancer 1992;69:925 - 9.
32. Ebara M, Ohto M, Sugiura N, Kita K, Yoshikawa M, Okuda K, et al. Percutaneous ethanol injection for the treatment of small hepatocellular carcinoma. Study of 95 patients. J Gastroenterol Hepatol 1990;5:616 - 26.
33. Shiina S, Yasuda H, Muto H, Tagawa K, Unuma T, Ibukuro K, et al. Percutaneous ethanol injection in the treatment of liver neoplasms. AJR Am J Roentgenol 1987;149:949 - 52.
34. Vilana R, Bruix J, Bru C, Ayuso C, Sole M, Rodes J. Tumor size determines the efficacy of percutaneous ethanol injection for the treatment of small hepatocellular carcinoma. Hepatology 1992;16:353 - 7.
35. Tanikawa K, Majima Y. Percutancous ethanol injection therapy for recurrent hepatocellular carcinoma. Hepatogastroenterology 1993;40:324 - 7.
36. Matsuzaki Y, Osuga T, Saito Y, Chuganji Y, Tanaka N, Shoda J, et al. A new. effective, and safe therapeutic option using Proton irradiation for hepatocellular carcinoma. Gastroenterology 1994;106:1032 - 41.
37. Seki T, Wakabayashi M, Nakagawa T, Itho T, Shiro T, Kunieda K, et al. Ultrasonically guided percutanceous microwave coagulation therapy for small hepatocellular carcinoma. Cancer 1994;74:817 - 25.
38. Da L, You T, Ming B, Zhen L, Feng O, Na Y, et al. Radioimmunotherapy for hepatocellular carcinoma (HCC) using 131 I-anti HCCo isoferritin IgG: preliminary results of experimental and clinical studies. Int J Radiat Oncol Biol Phys 1989;16:319 - 23.
39. Bismuth H, Sherloek DJ. Revolution in liver surgery. J Gastroenterol Hepatol 1990;5(1 suppl);95 - 109.












