–Я–∞—Ж–Є–µ–љ—В—Л –Є –Љ–µ—В–Њ–і—Л
–Я—А–Њ–∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ—Л –і–∞–љ–љ—Л–µ 44 –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є I (n=25), II (n=13) –Є III —Д–∞–Ј (n=6). –Я—А–Њ—В–Њ–Ї–Њ–ї –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –±—Л–ї –Њ–і–Њ–±—А–µ–љ –љ–∞–±–ї—О–і–∞—В–µ–ї—М–љ—Л–Љ–Є –Ї–Њ–Љ–Є—В–µ—В–∞–Љ–Є –ї–µ—З–µ–±–љ—Л—Е —Г—З—А–µ–ґ–і–µ–љ–Є–є. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ—А–Њ–≤–Њ–і–Є–ї–Є—Б—М –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –•–µ–ї—М—Б–Є–љ–Ї—Б–Ї–Њ–є –і–µ–Ї–ї–∞—А–∞—Ж–Є–µ–є –Є –њ—А–Є–љ—Ж–Є–њ–∞–Љ–Є –Ъ–∞—З–µ—Б—В–≤–µ–љ–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–Є, –њ—А–Є–љ—П—В—Л–Љ–Є –љ–∞ –Ь–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–Њ–є –Ї–Њ–љ—Д–µ—А–µ–љ—Ж–Є–Є –њ–Њ –≥–∞—А–Љ–Њ–љ–Є–Ј–∞—Ж–Є–Є. –Т –њ–µ—А–Є–Њ–і —Б 5 —П–љ–≤–∞—А—П 2001 –≥. –њ–Њ 30 —Б–µ–љ—В—П–±—А—П 2006 –≥. –±—Л–ї–Њ –Њ—В–Њ–±—А–∞–љ–Њ 4990 –Є—Б–њ—Л—В—Г–µ–Љ—Л—Е, –Є–Ј –Ї–Њ—В–Њ—А—Л—Е 3689 –њ–∞—Ж–Є–µ–љ—В–∞–Љ (74%) –±—Л–ї –љ–∞–Ј–љ–∞—З–µ–љ –ї–∞–њ–∞—В–Є–љ–Є–±. –Ю—Б—В–∞–≤—И–Є–Љ—Б—П –±–Њ–ї—М–љ—Л–Љ (n=1301) –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –ї–µ—З–µ–љ–Є–µ –њ–Њ –і—А—Г–≥–Є–Љ —Б—Е–µ–Љ–∞–Љ, –љ–µ –≤–Ї–ї—О—З–∞–≤—И–Є–Љ –ї–∞–њ–∞—В–Є–љ–Є–± (—Н—В–Є –ї—О–і–Є —Б–Њ—Б—В–∞–≤–Є–ї–Є –Ї–Њ–љ—В—А–Њ–ї—М–љ—Г—О –≥—А—Г–њ–њ—Г). –Ш–Ј 3689 –ї–Є—Ж, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –ї–∞–њ–∞—В–Є–љ–Є–±, 376 –±—Л–ї–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Ј–і–Њ—А–Њ–≤—Л–Љ–Є –і–Њ–±—А–Њ–≤–Њ–ї—М—Ж–∞–Љ–Є (10%), –∞ —Г 3313 (90%) –±—Л–ї–Є –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ—Л —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–µ –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–µ –Њ–њ—Г—Е–Њ–ї–Є – –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л (2275 —З–µ–ї–Њ–≤–µ–Ї, 69%) –Є–ї–Є –њ–Њ—З–Ї–Є, —В–Њ–ї—Б—В–Њ–є –Є –њ—А—П–Љ–Њ–є –Ї–Є—И–Ї–Є, –ї–µ–≥–Ї–Є—Е, –Њ–±–ї–∞—Б—В–Є –≥–Њ–ї–Њ–≤—Л –Є —И–µ–Є. –Т—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л –і–∞–≤–∞–ї–Є –і–Њ–±—А–Њ–≤–Њ–ї—М–љ–Њ–µ –Є–љ—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–љ–Њ–µ —Б–Њ–≥–ї–∞—Б–Є–µ –≤ –њ–Є—Б—М–Љ–µ–љ–љ–Њ–Љ –≤–Є–і–µ.
1991 –њ–∞—Ж–Є–µ–љ—В—Г (54%) –ї–∞–њ–∞—В–Є–љ–Є–± –љ–∞–Ј–љ–∞—З–∞–ї–Є –≤ –Ї–∞—З–µ—Б—В–≤–µ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є, 1502 –±–Њ–ї—М–љ—Л–Љ (41%) – –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–µ–є –Є–ї–Є –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–µ–є, 196 –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л–Љ (5%) – –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б —В—А–∞—Б—В—Г–Ј—Г–Љ–∞–±–Њ–Љ (—Б —В–∞–Ї—Б–∞–љ–Њ–Љ –Є–ї–Є –±–µ–Ј –љ–µ–≥–Њ). –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є –Ј–і–Њ—А–Њ–≤—Л–µ –і–Њ–±—А–Њ–≤–Њ–ї—М—Ж—Л –њ—А–Є–љ–Є–Љ–∞–ї–Є –ї–∞–њ–∞—В–Є–љ–Є–± –≤ –і–Њ–Ј–µ 10–250 –Љ–≥/—Б—Г—В., –∞ –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –±–Њ–ї—М–љ—Л–µ – –≤ –і–Њ–Ј–µ 75–1800 –Љ–≥/—Б—Г—В.; –њ—А–Є–Љ–µ—А–љ–Њ 2700 –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л—Е –њ—А–Є–љ–Є–Љ–∞–ї–Є –±–Њ–ї–µ–µ 1000 –Љ–≥/—Б—Г—В. –ї–∞–њ–∞—В–Є–љ–Є–±–∞. –Ф–∞–љ–љ—Л–µ –Њ –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є —В–µ—А–∞–њ–Є–Є –ї–∞–њ–∞—В–Є–љ–Є–±–Њ–Љ —Г–і–∞–ї–Њ—Б—М –њ–Њ–ї—Г—З–Є—В—М –њ–Њ 2492 –њ–∞—Ж–Є–µ–љ—В–∞–Љ: 1708 —З–µ–ї–Њ–≤–µ–Ї (69%) –ї–µ—З–Є–ї–Є—Б—М –Љ–µ–љ–µ–µ 3 –Љ–µ—Б—П—Ж–µ–≤, 510 –±–Њ–ї—М–љ—Л—Е (20%) – –Њ—В 3 –і–Њ 6 –Љ–µ—Б—П—Ж–µ–≤, 126 –ї–Є—Ж (5%) – –Њ—В 6 –і–Њ 9 –Љ–µ—Б—П—Ж–µ–≤, 81 –њ–∞—Ж–Є–µ–љ—В (3%) – –Њ—В 9 –і–Њ 12 –Љ–µ—Б—П—Ж–µ–≤, 67 –Є—Б–њ—Л—В—Г–µ–Љ—Л—Е (3%) – –±–Њ–ї–µ–µ 12 –Љ–µ—Б—П—Ж–µ–≤. –Х—Б–ї–Є –њ—А–Є–Љ–µ–љ—П–ї–∞—Б—М —Б—Е–µ–Љ–∞ –ї–µ—З–µ–љ–Є—П –±–µ–Ј –ї–∞–њ–∞—В–Є–љ–Є–±–∞, —В–Њ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М —В–µ—А–∞–њ–Є–Є (—Б–Њ–≥–ї–∞—Б–љ–Њ –і–Њ—Б—В—Г–њ–љ—Л–Љ –і–∞–љ–љ—Л–Љ) —Б–Њ—Б—В–∞–≤–Є–ї–∞ –Љ–µ–љ–µ–µ 3 –Љ–µ—Б—П—Ж–µ–≤ —Г 208 —З–µ–ї–Њ–≤–µ–Ї (53%), –Њ—В 3 –і–Њ 6 –Љ–µ—Б—П—Ж–µ–≤ – —Г 104 –±–Њ–ї—М–љ—Л—Е (27%), –Њ—В 6 –і–Њ 9 –Љ–µ—Б—П—Ж–µ–≤ – —Г 44 –ї–Є—Ж (11%), –Њ—В 9 –і–Њ 12 –Љ–µ—Б—П—Ж–µ–≤ – —Г 20 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (5%) –Є –±–Њ–ї–µ–µ 12 –Љ–µ—Б—П—Ж–µ–≤ – —Г 14 –Є—Б–њ—Л—В—Г–µ–Љ—Л—Е (4%).
–Ь–Њ–љ–Є—В–Њ—А–Є–љ–≥ —Б–µ—А–і–µ—З–љ–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є
–Ъ—А–Є—В–µ—А–Є—П–Љ–Є –≤–Ї–ї—О—З–µ–љ–Є—П —П–≤–ї—П–ї–Є—Б—М:
• –≤–µ–ї–Є—З–Є–љ–∞ —Д—А–∞–Ї—Ж–Є–Є –≤—Л–±—А–Њ—Б–∞ –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞ (–§–Т–Ы–Ц) 40% –Є –±–Њ–ї–µ–µ (–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Д–∞–Ј—Л I) –Є–ї–Є –≤ –њ—А–µ–і–µ–ї–∞—Е —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ–Њ–є –љ–Њ—А–Љ—Л (–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Д–∞–Ј—Л II –Є —Д–∞–Ј—Л III);
• –Њ—В—Б—Г—В—Б—В–≤–Є–µ –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ —Н–њ–Є–Ј–Њ–і–Њ–≤ –љ–µ–Ї—Г–њ–Є—А—Г–µ–Љ–Њ–є —Б—В–µ–љ–Њ–Ї–∞—А–і–Є–Є, –∞—А–Є—В–Љ–Є–є –Є–ї–Є –Ј–∞—Б—В–Њ–є–љ–Њ–є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є (–Ч–°–Э).
–Я—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є –Љ–Њ–љ–Є—В–Њ—А–Є–љ–≥ –Є –Љ–Њ–љ–Є—В–Њ—А–Є–љ–≥ –§–Т–Ы–Ц –њ—А–Њ–≤–Њ–і–Є–ї–Є –≤ –Ї–∞–±–Є–љ–µ—В–∞—Е —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Є—Е —Ж–µ–љ—В—А–Њ–≤, —Г—З–∞—Б—В–≤—Г—О—Й–Є—Е –≤ –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –Є—Б–њ–Њ–ї—М–Ј—Г—П —А–µ–≥–Є—Б—В—А–Є—А—Г—О—Й–Є–µ —Б–Ї–∞–љ–Є—А—Г—О—Й–Є–µ –њ—А–Є–±–Њ—А—Л, —Б–љ–∞–±–ґ–µ–љ–љ—Л–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є–Љ–Є –≤—Е–Њ–і–∞–Љ–Є, –Є–ї–Є —Н—Е–Њ–Ї–∞—А–і–Є–Њ–≥—А–∞—Д. –Р–љ–∞–ї–Њ–≥–Є—З–љ—Л–є —Б–њ–Њ—Б–Њ–± –±—Л–ї —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ –±–Њ–ї—М–љ—Л–Љ –і–ї—П –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ–≥–Њ –Љ–Њ–љ–Є—В–Њ—А–Є–љ–≥–∞ –§–Т–Ы–Ц –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е —Д–∞–Ј—Л II –Є —Д–∞–Ј—Л III –§–Т–Ы–Ц –Њ—Ж–µ–љ–Є–≤–∞–ї–Є –њ—А–Є –Є—Б—Е–Њ–і–љ–Њ–Љ —Б–Ї—А–Є–љ–Є–љ–≥–µ (–Ј–∞ 4 –љ–µ–і–µ–ї–Є –і–Њ –љ–∞—З–∞–ї–∞ –ї–µ—З–µ–љ–Є—П), –Ї–∞–ґ–і—Л–µ 8 –љ–µ–і–µ–ї—М –≤–Њ –≤—А–µ–Љ—П –њ—А–Њ–≤–µ–і–µ–љ–Є—П —В–µ—А–∞–њ–Є–Є –Є –њ–Њ—Б–ї–µ –њ—А–µ–Ї—А–∞—Й–µ–љ–Є—П –ї–µ—З–µ–љ–Є—П –љ–∞ –і–ї–Є—В–µ–ї—М–љ—Л–є —Б—А–Њ–Ї. –С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ–ї—Г—З–∞–ї–Є –њ—А–µ–њ–∞—А–∞—В—Л –≤ —В–µ—З–µ–љ–Є—П —Б—А–Њ–Ї–∞ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є–ї–Є –≤–њ–ї–Њ—В—М –і–Њ —Б–≤–Њ–µ–є —Б–Љ–µ—А—В–Є. –Т —Е–Њ–і–µ —Б–Ї—А–Є–љ–Є–љ–≥–∞ –Є –њ—А–Є –і–∞–ї—М–љ–µ–є—И–Є—Е –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–ї–Є –і–Є–љ–∞–Љ–Є–Ї—Г –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–Є, –≤ —В.—З. —В–∞–Ї–Є–µ —Б–Њ—Б—В–Њ—П–љ–Є—П, –Ї–∞–Ї –∞—А—В–µ—А–Є–∞–ї—М–љ–∞—П –≥–Є–њ–µ—А—В–Њ–љ–Є—П, —Б–µ—А–і–µ—З–љ—Л–µ –∞—А–Є—В–Љ–Є–Є, –Є–љ—Д–∞—А–Ї—В –Љ–Є–Њ–Ї–∞—А–і–∞ –Є —Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В; –њ—А–Њ—В–Є–≤–Њ–Њ–њ—Г—Е–Њ–ї–µ–≤–Њ–µ –ї–µ—З–µ–љ–Є–µ –љ–∞ –њ—А–µ–і—Л–і—Г—Й–Є—Е —Н—В–∞–њ–∞—Е; —Б–њ–µ–Ї—В—А –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–≤, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е—Б—П –Ј–∞ –њ–Њ—Б–ї–µ–і–љ–Є–µ 4 –љ–µ–і–µ–ї–Є –њ–µ—А–µ–і –љ–∞—З–∞–ї–Њ–Љ —В–µ—А–∞–њ–Є–Є.
–Ш–Ј–Љ–µ–љ–µ–љ–Є—П —Б–µ—А–і–µ—З–љ–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є –Ї–ї–∞—Б—Б–Є—Д–Є—Ж–Є—А–Њ–≤–∞–ї–Є—Б—М –Ї–∞–Ї –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Љ–∞–љ–Є—Д–µ—Б—В–Є—А—Г—О—Й–Є–µ (—Б—В–∞–і–Є—П 3 –Є–ї–Є 4 —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є –Ы–Ц —Б–Њ–≥–ї–∞—Б–љ–Њ –Ю–±—Й–Є–Љ —В–µ—А–Љ–Є–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –Ї—А–Є—В–µ—А–Є—П–Љ –Э–∞—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ –Є–љ—Б—В–Є—В—Г—В–∞ —А–∞–Ї–∞ –і–ї—П –њ–Њ–±–Њ—З–љ—Л—Е —П–≤–ї–µ–љ–Є–є, –≤–µ—А—Б–Є—П 3.0) [13] –Є–ї–Є –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ—Л–µ (—Б–љ–Є–ґ–µ–љ–Є–µ –§–Т–Ы–Ц –љ–∞ 20% –Є –±–Њ–ї–µ–µ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –Є—Б—Е–Њ–і–љ–Њ–≥–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –Є –љ–Є–ґ–µ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ—Л—Е –≥—А–∞–љ–Є—Ж –љ–Њ—А–Љ—Л; –Њ—В—Б—Г—В—Б—В–≤–Є–µ –њ—А–Њ—П–≤–ї–µ–љ–Є–є). –Ъ—А–Є—В–µ—А–Є–Є, –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –Ї–Њ—В–Њ—А—Л—Е –і–µ–ї–∞–ї–Њ—Б—М –Ј–∞–Ї–ї—О—З–µ–љ–Є–µ –Њ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–Є –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є —А–∞–±–Њ—В—Л —Б–µ—А–і—Ж–∞, —Д–Њ—А–Љ—Г–ї–Є—А–Њ–≤–∞–ї–Є—Б—М –љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л–Љ –Ї–∞—А–і–Є–Њ–ї–Њ–≥–Њ–Љ. –Ю –њ–Њ–ї–љ–Њ–Љ –≤—Л–Ј–і–Њ—А–Њ–≤–ї–µ–љ–Є–Є –≥–Њ–≤–Њ—А–Є–ї–Є –≤ —В–Њ–Љ —Б–ї—Г—З–∞–µ, –µ—Б–ї–Є –§–Т–Ы–Ц –≤–Њ—Б—Б—В–∞–љ–∞–≤–ї–Є–≤–∞–ї–∞—Б—М –і–Њ –Є—Б—Е–Њ–і–љ–Њ–≥–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –≤ –њ—А–µ–і–µ–ї–∞—Е 5% –≤ —В–µ—З–µ–љ–Є–µ 90 –і–љ–µ–є —Б –Љ–Њ–Љ–µ–љ—В–∞ –њ–∞–і–µ–љ–Є—П –§–Т–Ы–Ц. –Я—А–Є —З–∞—Б—В–Є—З–љ–Њ–Љ –≤—Л–Ј–і–Њ—А–Њ–≤–ї–µ–љ–Є–Є –§–Т–Ы–Ц –≤–Њ–Ј—А–∞—Б—В–∞–ї–∞ –±–Њ–ї–µ–µ —З–µ–Љ –љ–∞ 5%, –љ–Њ –Њ—Б—В–∞–≤–∞–ї–Є—Б—М –љ–Є–ґ–µ –Є—Б—Е–Њ–і–љ–Њ–≥–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –љ–∞ 5%. –Т—Л–Ј–і–Њ—А–Њ–≤–ї–µ–љ–Є—П –љ–µ –±—Л–ї–Њ, –µ—Б–ї–Є –≤ —В–µ—З–µ–љ–Є–µ 90 –і–љ–µ–є –≤–µ–ї–Є—З–Є–љ–∞ –§–Т–Ы–Ц –љ–µ –њ—А–µ–≤—Л—И–∞–ї–∞ 5% –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –љ–Є–Ј—И–µ–є —В–Њ—З–Ї–Њ–є –µ–µ –њ–∞–і–µ–љ–Є—П. –Ф–∞–љ–љ—Л–µ —Б—З–Є—В–∞–ї–Є—Б—М –љ–µ–њ–Њ–ї–љ—Л–Љ–Є, –µ—Б–ї–Є –≤ —В–µ—З–µ–љ–Є–µ —Б—А–Њ–Ї–∞ –Љ–µ–љ–µ–µ 90 –і–љ–µ–є —Б –Љ–Њ–Љ–µ–љ—В–∞ –њ–∞–і–µ–љ–Є—П –§–Т–Ы–Ц –µ–µ –≤–µ–ї–Є—З–Є–љ–∞ –љ–µ –њ—А–µ–≤—Л—И–∞–ї–∞ 5% –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Љ–Є–љ–Є–Љ–∞–ї—М–љ—Л–Љ –Ј–љ–∞—З–µ–љ–Є–µ–Љ.
–°–Њ–≥–ї–∞—Б–љ–Њ –і–Є–Ј–∞–є–љ—Г –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –њ—А–µ–Ї—А–∞—В–Є—В—М –њ—А–Є–µ–Љ –ї–∞–њ–∞—В–Є–љ–Є–±–∞ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–ї–Є –±–Њ–ї—М–љ—Л–Љ —Б —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є–Љ–Є –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є —Б–µ—А–і–µ—З–љ–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є. –Я—А–Є –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ–Њ–Љ –љ–∞—А—Г—И–µ–љ–Є–Є —А–∞–±–Њ—В—Л —Б–µ—А–і—Ж–∞ –Є—Б–њ—Л—В—Г–µ–Љ—Л–µ –њ—А–Њ–і–Њ–ї–ґ–∞–ї–Є –њ—А–Є–љ–Є–Љ–∞—В—М –ї–∞–њ–∞—В–Є–љ–Є–±, –љ–Њ –≤ —В–µ—З–µ–љ–Є–µ 2 –љ–µ–і–µ–ї—М –њ—А–Њ–і–Њ–ї–ґ–∞–ї—Б—П –Љ–Њ–љ–Є—В–Њ—А–Є–љ–≥ –§–Т–Ы–Ц. –Х—Б–ї–Є —Д–∞–Ї—В –љ–∞—А—Г—И–µ–љ–Є–є —Б–µ—А–і–µ—З–љ–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є –њ–Њ–і—В–≤–µ—А–ґ–і–∞–ї—Б—П, —В–Њ –ї–∞–њ–∞—В–Є–љ–Є–± –Њ—В–Љ–µ–љ—П–ї–Є –і–Њ –Љ–Њ–Љ–µ–љ—В–∞ –≤—Л–Ј–і–Њ—А–Њ–≤–ї–µ–љ–Є—П, –∞ –Ј–∞—В–µ–Љ –љ–∞–Ј–љ–∞—З–∞–ї–Є –≤–љ–Њ–≤—М, –љ–Њ –≤ –Љ–µ–љ—М—И–µ–є –і–Њ–Ј–Є—А–Њ–≤–Ї–µ –Є –њ—А–Є —Г—Б–ї–Њ–≤–Є–Є –µ–ґ–µ–Љ–µ—Б—П—З–љ–Њ–≥–Њ –Љ–Њ–љ–Є—В–Њ—А–Є–љ–≥–∞ –§–Т–Ы–Ц. –Т —В–µ—Е —Б–ї—Г—З–∞—П—Е, –Ї–Њ–≥–і–∞ –њ—А–Є –њ–Њ–≤—В–Њ—А–љ–Њ–Љ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –і–Є–∞–≥–љ–Њ–Ј –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є —А–∞–±–Њ—В—Л —Б–µ—А–і—Ж–∞ –≤–µ—А–Є—Д–Є—Ж–Є—А–Њ–≤–∞–ї—Б—П, –њ–∞—Ж–Є–µ–љ—В—Л –њ—А–µ–Ї—А–∞—Й–∞–ї–Є –ї–µ—З–Є—В—М—Б—П —Н—В–Є–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ.
–°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–ї–Є–Ј
–І–∞—Б—В–Њ—В—Г –љ–∞—А—Г—И–µ–љ–Є–є —Б–µ—А–і–µ—З–љ–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є –њ–Њ–і—Б—З–Є—В—Л–≤–∞–ї–Є, –Ї–∞–Ї —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ —З–Є—Б–ї–∞ –ї–Є—Ж —Б –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Љ–∞–љ–Є—Д–µ—Б—В–Є—А—Г—О—Й–Є–Љ –Є –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ—Л–Љ –љ–∞—А—Г—И–µ–љ–Є–µ–Љ —А–∞–±–Њ—В—Л —Б–µ—А–і—Ж–∞ –Ї –Њ–±—Й–µ–Љ—Г –Ї–Њ–ї–Є—З–µ—Б—В–≤—Г –Є—Б–њ—Л—В—Г–µ–Љ—Л—Е, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –ї–∞–њ–∞—В–Є–љ–Є–±. –І—В–Њ–±—Л –Њ—В–і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞—В—М –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ —Б–µ—А–і–µ—З–љ—Г—О –і–µ—П—В–µ–ї—М–љ–Њ—Б—В—М –њ—А–Њ—В–Є–≤–Њ–Њ–њ—Г—Е–Њ–ї–µ–≤–Њ–є —В–µ—А–∞–њ–Є–Є, –њ—А–Њ–≤–Њ–і–Є–≤—И–µ–є—Б—П –љ–∞ –њ—А–µ–і—Л–і—Г—Й–Є—Е —Н—В–∞–њ–∞—Е, –≤—Б–µ –≤–Є–і—Л –љ–∞—А—Г—И–µ–љ–Є–є —А–∞–±–Њ—В—Л —Б–µ—А–і—Ж–∞ —А–∞—Б–њ—А–µ–і–µ–ї–Є–ї–Є –њ–Њ –Ї–∞—В–µ–≥–Њ—А–Є—П–Љ –Є –∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–ї–Є –≤ —Б–ї–µ–і—Г—О—Й–Є—Е –Ї–Њ–≥–Њ—А—В–∞—Е –±–Њ–ї—М–љ—Л—Е: 1) –њ–Њ–ї—Г—З–∞–≤—И–Є–µ —В–Њ–ї—М–Ї–Њ –∞–љ—В—А–∞—Ж–Є–Ї–ї–Є–љ—Л; 2) –њ–Њ–ї—Г—З–∞–≤—И–Є–µ —В—А–∞—Б—В—Г–Ј—Г–Љ–∞–± –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б –∞–љ—В—А–∞—Ж–Є–Ї–ї–Є–љ–∞–Љ–Є –Є–ї–Є –±–µ–Ј; 3) –љ–µ –њ–Њ–ї—Г—З–∞–≤—И–Є–µ –љ–Є –Њ–і–љ–Њ–≥–Њ –Є–Ј —Г–Ї–∞–Ј–∞–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –Т–µ–ї–Є—З–Є–љ—Л –§–Т–Ы–Ц –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л —Б 95% –і–Њ–≤–µ—А–Є—В–µ–ї—М–љ—Л–Љ –Є–љ—В–µ—А–≤–∞–ї–Њ–Љ (—Г–Ї–∞–Ј–∞–љ –≤ –Ї—А—Г–≥–ї—Л—Е —Б–Ї–Њ–±–Ї–∞—Е). –†–∞–Ј–љ–Є—Ж—Г –Љ–µ–ґ–і—Г –Ї–Њ–≥–Њ—А—В–∞–Љ–Є –њ–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ –∞–±—Б–Њ–ї—О—В–љ–Њ–≥–Њ –Є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ–∞–і–µ–љ–Є—П –§–Т–Ы–Ц –∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–ї–Є —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Ї—А–Є—В–µ—А–Є—П –Ъ—А–∞—Б–Ї–µ–ї––£–Њ–ї–ї–Є—Б–∞ [14]. –Т–љ–µ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Б—Е–µ–Љ—Л —В–µ—А–∞–њ–Є–Є –≤—Б–µ —Д–Њ—А–Љ—Л –љ–∞—А—Г—И–µ–љ–Є–є —А–∞–±–Њ—В—Л —Б–µ—А–і—Ж–∞, –≤–Њ–Ј–љ–Є–Ї—И–Є–µ —Г 1826 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ —Г—З–∞—Б—В–≤–Њ–≤–∞–ї–Є –≤ —Б–ї–µ–њ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є, –±—Л–ї–Є –Њ—В–љ–µ—Б–µ–љ—Л –љ–∞ —Б—З–µ—В –ї–∞–њ–∞—В–Є–љ–Є–±–∞. –Т—А–µ–Љ—П –і–Њ –њ–Њ—П–≤–ї–µ–љ–Є—П –љ–∞—А—Г—И–µ–љ–Є–є —Б–µ—А–і–µ—З–љ–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є –≤—Л—З–Є—Б–ї—П–ї–Є –Ї–∞–Ї –њ—А–Њ–Љ–µ–ґ—Г—В–Њ–Ї –Њ—В –Љ–Њ–Љ–µ–љ—В–∞ –њ—А–Є–µ–Љ–∞ –њ–µ—А–≤–Њ–є –і–Њ–Ј—Л –ї–µ–Ї–∞—А—Б—В–≤–∞ –і–Њ –≤–µ—А–Є—Д–Є–Ї–∞—Ж–Є–Є –і–Є–∞–≥–љ–Њ–Ј–∞, –∞ –Є—Е –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М – –Ї–∞–Ї –њ—А–Њ–Љ–µ–ґ—Г—В–Њ–Ї –Њ—В –Љ–Њ–Љ–µ–љ—В–∞ –њ–Њ—Б—В–∞–љ–Њ–≤–Ї–Є –і–Є–∞–≥–љ–Њ–Ј–∞ –і–Њ —А–∞–Ј—А–µ—И–µ–љ–Є—П.
–Р–љ–∞–ї–Є–Ј –њ—А–Њ–≤–µ–і–µ–љ –Є —Б–њ–Њ–љ—Б–Є—А–Њ–≤–∞–љ –Ї–Њ–Љ–њ–∞–љ–Є–µ–є GlaxoSmithKline. –Т —А–∞–Ј—А–∞–±–Њ—В–Ї–µ –і–Є–Ј–∞–є–љ–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ—А–Є–љ–Є–Љ–∞–ї–Є —Г—З–∞—Б—В–Є–µ –Ї–∞–Ї —Н–Ї—Б–њ–µ—А—В—Л –Є–Ј–≤–љ–µ, —В–∞–Ї –Є –Ї–ї–Є–љ–Є—Ж–Є—Б—В—Л –Є–Ј –Ї–Њ–Љ–њ–∞–љ–Є–Є–—Б–њ–Њ–љ—Б–Њ—А–∞. –Ф–∞–љ–љ—Л–µ —Б–Њ–±—А–∞–љ—Л –Є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –Ї–Њ–љ–Ї—А–µ—В–љ—Л–Љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—П–Љ–Є.
–†–µ–Ј—Г–ї—М—В–∞—В—Л
–≠–њ–Є–Ј–Њ–і—Л –љ–∞—А—Г—И–µ–љ–Є–є —Б–µ—А–і–µ—З–љ–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є –љ–∞–±–ї—О–і–∞–ї–Є—Б—М –Ї–∞–Ї –љ–∞ —Д–Њ–љ–µ –ї–µ—З–µ–љ–Є—П –ї–∞–њ–∞—В–Є–љ–Є–±–Њ–Љ, —В–∞–Ї –Є –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л—Е.
–ѓ–≤–ї–µ–љ–Є—П —Б–Њ —Б—В–Њ—А–Њ–љ—Л —Б–µ—А–і—Ж–∞
–≤ –≥—А—Г–њ–њ–µ –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –ї–∞–њ–∞—В–Є–љ–Є–±
–Э–∞—А—Г—И–µ–љ–Є—П –≤ —А–∞–±–Њ—В–µ —Б–µ—А–і—Ж–∞ –≤–Њ–Ј–љ–Є–Ї–ї–Є —Г 60 —З–µ–ї–Њ–≤–µ–Ї –Є–Ј 3689 (2%), –њ—А–Є—З–µ–Љ —Г 2 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —А–∞–Ј–≤–Є–ї–Њ—Б—М –њ–Њ 2 —Н–њ–Є–Ј–Њ–і–∞, —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≤—Б–µ–≥–Њ –Њ—В–Љ–µ—З–µ–љ–Њ 62 —В–∞–Ї–Є—Е —П–≤–ї–µ–љ–Є—П. –£ 53 –±–Њ–ї—М–љ—Л—Е (1%) –Њ–љ–Є –њ—А–Њ—В–µ–Ї–∞–ї–Є –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ–Њ, –≤ 7 —Б–ї—Г—З–∞—П—Е —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–Є—Б—М –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–Њ–є (—В–∞–±–ї. 1). –Э–Є–Ї—В–Њ –Є–Ј 53 –Є—Б–њ—Л—В—Г–µ–Љ—Л—Е —Б –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ—Л–Љ–Є –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є —Б–µ—А–і–µ—З–љ–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є —А–∞–љ–µ–µ –љ–µ –ї–µ—З–Є–ї—Б—П –Ї–∞—А–і–Є–Њ—В—А–Њ–њ–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є. –°–ї—Г—З–∞–µ–≤ —Б–µ—А–і–µ—З–љ–Њ–є —Б–Љ–µ—А—В–Є, –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л—Е —Б –њ—А–Є–µ–Љ–Њ–Љ –ї–∞–њ–∞—В–Є–љ–Є–±–∞, –љ–µ –±—Л–ї–Њ.
–Ш–Ј 60 –±–Њ–ї—М–љ—Л—Е, —Г –Ї–Њ—В–Њ—А—Л—Е –≤–Њ–Ј–љ–Є–Ї–ї–Є –љ–∞—А—Г—И–µ–љ–Є—П –≤ —А–∞–±–Њ—В–µ —Б–µ—А–і—Ж–∞, —Г 41 —З–µ–ї–Њ–≤–µ–Ї–∞ (68%) –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ —А–∞–Ї –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л, —Г 19 (32%) – –і—А—Г–≥–Є–µ –Њ–њ—Г—Е–Њ–ї–Є. –°—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В —Б–Њ—Б—В–∞–≤–Є–ї 60 –ї–µ—В (–Њ—В 31 –і–Њ 81 –≥–Њ–і–∞), —З—В–Њ –∞–љ–∞–ї–Њ–≥–Є—З–љ–Њ —Б—А–µ–і–љ–µ–Љ—Г –≤–Њ–Ј—А–∞—Б—В—Г –≤ –Є–Ј—Г—З–∞–µ–Љ–Њ–є –њ–Њ–њ—Г–ї—П—Ж–Є–Є. 25 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (42%) –њ–Њ–ї—Г—З–∞–ї–Є –ї–∞–њ–∞—В–Є–љ–Є–± –≤ –Ї–∞—З–µ—Б—В–≤–µ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є, 35 (58%) – –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б –і—А—Г–≥–Є–Љ –ї–µ—З–µ–љ–Є–µ–Љ. –Ш—Б—Е–Њ–і–љ–∞—П –≤–µ–ї–Є—З–Є–љ–∞ –§–Т–Ы–Ц —Б–Њ—Б—В–∞–≤–Є–ї–∞ 61,6%±8,4% (95% –Ф–Ш, 37–78%), –∞ –њ–∞–і–µ–љ–Є–µ –§–Т–Ы–Ц –љ–∞ –Љ–Њ–Љ–µ–љ—В –њ–Њ—П–≤–ї–µ–љ–Є—П —Б–µ—А–і–µ—З–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є – 43,0±6,7% (95% –Ф–Ш, 20,0–54,5%). –£ 3 –Є—Б–њ—Л—В—Г–µ–Љ—Л—Е –Є—Б—Е–Њ–і–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –§–Т–Ы–Ц –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М –Љ–µ–љ–µ–µ 50% (37%, 47% –Є 48%), –Є–Ј –Ї–Њ—В–Њ—А—Л—Е 2 –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –љ–∞—Е–Њ–і–Є–ї–Є—Б—М –≤ –≥—А–∞–љ–Є—Ж–∞—Е —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ–Њ–є –љ–Њ—А–Љ—Л. –•–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –±–Њ–ї—М–љ—Л—Е —Б —Б–µ—А–і–µ—З–љ—Л–Љ–Є —П–≤–ї–µ–љ–Є—П–Љ–Є —А–∞—Б—Ж–µ–љ–Є–≤–∞–ї–Є—Б—М –Ї–∞–Ї —А–µ–њ—А–µ–Ј–µ–љ—В–∞—В–Є–≤–љ—Л–µ –і–ї—П –Є–Ј—Г—З–∞–µ–Љ–Њ–є –њ–Њ–њ—Г–ї—П—Ж–Є–Є –≤ —Ж–µ–ї–Њ–Љ. –Я—А–Є –∞–љ–∞–ї–Є–Ј–µ —Н—В–Є—Е –і–∞–љ–љ—Л—Е –љ–µ —Г–і–∞–ї–Њ—Б—М –≤—Л—П–≤–Є—В—М –љ–Є–Ї–∞–Ї–Є—Е –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —Б–љ–Є–ґ–µ–љ–Є—П –§–Т–Ы–Ц (—В–∞–±–ї. 2 –Є 3).
–£ 274 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –ї–∞–њ–∞—В–Є–љ–Є–± –љ–µ –Љ–µ–љ–µ–µ 6 –Љ–µ—Б—П—Ж–µ–≤, –љ–µ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –љ–Є–Ї–∞–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є –Ї—Г–Љ—Г–ї—П—В–Є–≤–љ–Њ–є –Є–ї–Є –і–Њ–Ј–Њ–Ј–∞–≤–Є—Б–Є–Љ–Њ–є —В–Њ–Ї—Б–Є—З–љ–Њ—Б—В–Є. –Ф–ї—П –∞–љ—В—А–∞—Ж–Є–Ї–ї–Є–љ–Њ–≤, –љ–∞–њ—А–Њ—В–Є–≤, —В–∞–Ї–∞—П —В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М –±—Л–ї–∞ —Е–∞—А–∞–Ї—В–µ—А–љ–∞.
–Ф–Њ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П —Н–њ–Є–Ј–Њ–і–∞ –љ–∞—А—Г—И–µ–љ–Є–є —Б–µ—А–і–µ—З–љ–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є –њ—А–Њ—И–ї–Њ –≤ —Б—А–µ–і–љ–µ–Љ 13±9 –љ–µ–і–µ–ї—М (95% –Ф–Ш, 2–54 –љ–µ–і–µ–ї–Є). –Т –∞–±—Б–Њ–ї—О—В–љ–Њ–Љ –≤—Л—А–∞–ґ–µ–љ–Є–Є –≤–µ–ї–Є—З–Є–љ–∞ –§–Т–Ы–Ц —Б–љ–Є–Ј–Є–ї–∞—Б—М –≤ —Б—А–µ–і–љ–µ–Љ –љ–∞ 18,8±5,2% (95% –Ф–Ш, 11–32%), –∞ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –Є—Б—Е–Њ–і–љ–Њ–≥–Њ –Ј–љ–∞—З–µ–љ–Є—П – –љ–∞ 30,0±7,4% (95% –Ф–Ш, 20–52%). –°—А–µ–і–Є –ї–Є—Ж, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е —В–µ—А–∞–њ–Є—О –љ–∞ –њ—А–µ–і—Л–і—Г—Й–Є—Е —Н—В–∞–њ–∞—Е, –љ–µ –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ —А–∞–Ј–љ–Є—Ж—Л –Љ–µ–ґ–і—Г –∞–±—Б–Њ–ї—О—В–љ—Л–Љ (p=0,15) –Є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ—Л–Љ (p=0,29) –њ–∞–і–µ–љ–Є–µ–Љ –§–Т–Ы–Ц. –£ 35 –±–Њ–ї—М–љ—Л—Е (58%) —Б –њ–Њ–ї–љ—Л–Љ (n=19) –Є–ї–Є —З–∞—Б—В–Є—З–љ—Л–Љ (n=16) –≤—Л–Ј–і–Њ—А–Њ–≤–ї–µ–љ–Є–µ–Љ –≤ –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–Љ (—В–∞–±–ї. 1) —Н—В–Њ—В –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –Њ—Б—В–∞–≤–∞–ї—Б—П —Б–љ–Є–ґ–µ–љ–љ—Л–Љ –≤ —В–µ—З–µ–љ–Є–µ 7,6±10,4 –љ–µ–і–µ–ї—М (95% –Ф–Ш, 0,3–46,0 –љ–µ–і–µ–ї—М). –Т 5 —Б–ї—Г—З–∞—П—Е (8%) –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ —В–µ—З–µ–љ–Є–µ –Њ—Б—В–∞–≤–∞–ї–Њ—Б—М –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ—Л–Љ, –∞ –Ј–∞ –њ–µ—А–Є–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є–є –≤—Л–Ј–і–Њ—А–Њ–≤–ї–µ–љ–Є—П –љ–µ –њ—А–Њ–Є–Ј–Њ—И–ї–Њ. –Я–Њ 20 –Є—Б–њ—Л—В—Г–µ–Љ—Л–Љ (33%) –љ–µ —Г–і–∞–ї–Њ—Б—М –њ–Њ–ї—Г—З–Є—В—М –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –і–∞–љ–љ—Л—Е –і–ї—П –≤–µ—А–Є—Д–Є–Ї–∞—Ж–Є–Є –≤—Л–Ј–і–Њ—А–Њ–≤–ї–µ–љ–Є—П – 8 —З–µ–ї–Њ–≤–µ–Ї (13%) —Б–Ї–Њ–љ—З–∞–ї–Є—Б—М –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –Њ—Б–љ–Њ–≤–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –∞ –µ—Й–µ 12 (20%) –ї–Є–±–Њ –љ–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–ї–Є—Б—М –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ, –ї–Є–±–Њ –і–Њ—Б—А–Њ—З–љ–Њ –њ—А–µ–Ї—А–∞—В–Є–ї–Є —Г—З–∞—Б—В–Є–µ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є, –ї–Є–±–Њ –Є—Б—З–µ–Ј–ї–Є –Є–Ј –њ–Њ–ї—П –Ј—А–µ–љ–Є—П –≤—А–∞—З–µ–є.
–Т —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –њ—А–Њ—В–Њ–Ї–Њ–ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є 35 –±–Њ–ї—М–љ—Л—Е (58%) –њ—А–µ–Ї—А–∞—В–Є–ї–Є –ї–µ—З–µ–љ–Є–µ –ї–∞–њ–∞—В–Є–љ–Є–±–Њ–Љ –Є–ї–Є –і—А—Г–≥–Є–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ, –≤—Л–і–∞–≤–∞–≤—И–Є–Љ—Б—П –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –њ—А–Є–љ—Ж–Є–њ–Њ–Љ –Њ—Б–ї–µ–њ–ї–µ–љ–Є—П (—А–Є—Б. 1). –Ю–і–љ–∞–Ї–Њ –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ 25 —З–µ–ї–Њ–≤–µ–Ї (42%) –≤–Њ–Ј–Њ–±–љ–Њ–≤–Є–ї–Є –њ—А–Є–µ–Љ –ї–∞–њ–∞—В–Є–љ–Є–±–∞, —Е–Њ—В—П —Б–Њ–≥–ї–∞—Б–љ–Њ —Г–Ї–∞–Ј–∞–љ–љ—Л–Љ –≤ –њ—А–Њ—В–Њ–Ї–Њ–ї–µ –Ї—А–Є—В–µ—А–Є—П–Љ —В–µ—А–∞–њ–Є—О —Б–ї–µ–і–Њ–≤–∞–ї–Њ –±—Л –њ—А–µ—А–≤–∞—В—М. 31 –Є—Б–њ—Л—В—Г–µ–Љ—Л–є (89%) –Њ–Ї–Њ–љ—З–∞—В–µ–ї—М–љ–Њ –Ј–∞–Ї–Њ–љ—З–Є–ї –ї–µ—З–Є—В—М—Б—П –ї–∞–њ–∞—В–Є–љ–Є–±–Њ–Љ, –µ—Й–µ 4 (11%) –њ–Њ–≤—В–Њ—А–љ–Њ –љ–∞—З–∞–ї–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –њ—А–µ–њ–∞—А–∞—В –њ–Њ—Б–ї–µ –њ–Њ–ї–љ–Њ–≥–Њ (n=3) –Є–ї–Є —З–∞—Б—В–Є—З–љ–Њ–≥–Њ (n=1) –≤—Л–Ј–і–Њ—А–Њ–≤–ї–µ–љ–Є—П –њ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –Њ—Ж–µ–љ–Ї–Є –§–Т–Ы–Ц.
–Х—Б–ї–Є –≥–Њ–≤–Њ—А–Є—В—М –Њ –±–Њ–ї—М–љ—Л—Е, –Ї–Њ—В–Њ—А—Л–Љ –Њ–Ї–Њ–љ—З–∞—В–µ–ї—М–љ–Њ –Њ—В–Љ–µ–љ–Є–ї–Є –ї–∞–њ–∞—В–Є–љ–Є–± (n=31), —В–Њ –≤ 13 —Б–ї—Г—З–∞—П—Е (42%) —Б—А–Њ–Ї –љ–∞–±–ї—О–і–µ–љ–Є—П –Њ–Ї–∞–Ј–∞–ї—Б—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ—Л–Љ –і–ї—П –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –Є—Б—Е–Њ–і–∞, –≤ 10 —Б–ї—Г—З–∞—П—Е (32%) –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М –њ–Њ–ї–љ–Њ–µ –≤—Л–Ј–і–Њ—А–Њ–≤–ї–µ–љ–Є–µ, –≤ 4 (13%) – —З–∞—Б—В–Є—З–љ–Њ–µ, –∞ –µ—Й–µ —Г 4 –ї–Є—Ж (13%) –§–Т–Ы–Ц –Њ—Б—В–∞–≤–∞–ї–∞—Б—М —Б–љ–Є–ґ–µ–љ–љ–Њ–є. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є –Љ–∞–љ–Є—Д–µ—Б—В–љ–Њ–µ —В–µ—З–µ–љ–Є–µ –Њ—В–Љ–µ—З–µ–љ–Њ —Г 4 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–Ј 31 (13%); 2 –Є—Б–њ—Л—В—Г–µ–Љ—Л—Е –≤—Л–Ј–і–Њ—А–Њ–≤–µ–ї–Є, 1 – –љ–µ—В, –≤ 1 —Б–ї—Г—З–∞–µ –±—Л–ї–Њ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ –і–∞–љ–љ—Л—Е –і–ї—П –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –Є—Б—Е–Њ–і–∞.
–°—А–µ–і–Є —В–µ—Е –±–Њ–ї—М–љ—Л—Е, –њ–Њ –Ї–Њ—В–Њ—А—Л–Љ —Г–і–∞–ї–Њ—Б—М —Б–Њ–±—А–∞—В—М –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—О –Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞—Е –њ–Њ–≤—В–Њ—А–љ–Њ–є –Њ—Ж–µ–љ–Ї–Є –§–Т–Ы–Ц –њ–Њ—Б–ї–µ –Њ—В–Љ–µ–љ—Л –ї–∞–њ–∞—В–Є–љ–Є–±–∞, –µ–µ –≤–µ–ї–Є—З–Є–љ–∞ –њ—А–Њ–і–Њ–ї–ґ–∞–ї–∞ –Њ—Б—В–∞–≤–∞—В—М—Б—П —Б–љ–Є–ґ–µ–љ–љ–Њ–є –±–Њ–ї–µ–µ —З–µ–Љ –љ–∞ 5% –ї–Є—И—М —Г 1 –њ–∞—Ж–Є–µ–љ—В–∞ —Б –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–µ–Ј–љ—М—О —Б–µ—А–і—Ж–∞ –Є –Є–љ—Д–∞—А–Ї—В–Њ–Љ –Љ–Є–Њ–Ї–∞—А–і–∞ –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ.
–Э–∞—А—Г—И–µ–љ–Є—П —Б–µ—А–і–µ—З–љ–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є
—Б —А–∞–Ј–≤–Є—В–Є–µ–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–Є
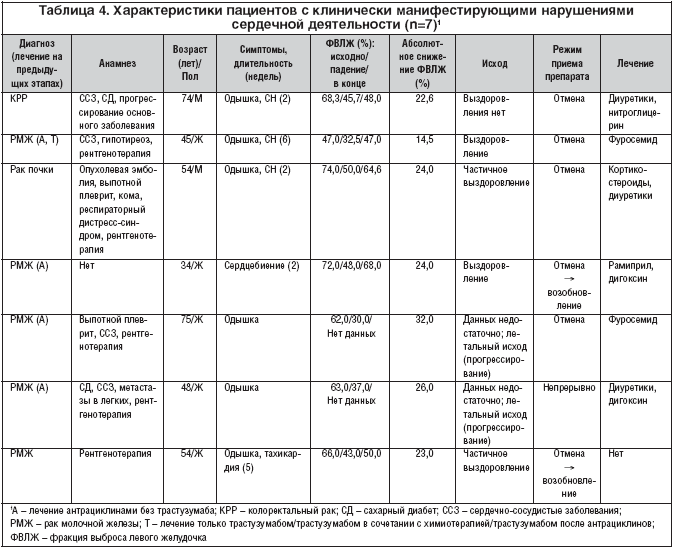
–Э–∞—А—Г—И–µ–љ–Є—П –≤ —А–∞–±–Њ—В–µ —Б–µ—А–і—Ж–∞ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–Є—Б—М –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–Њ–є –≤ 7 —Б–ї—Г—З–∞—П—Е, –њ—А–Є—З–µ–Љ 5 —З–µ–ї–Њ–≤–µ–Ї (71%) –њ–Њ–ї—Г—З–∞–ї–Є –ї–∞–њ–∞—В–Є–љ–Є–± –≤ –Ї–∞—З–µ—Б—В–≤–µ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є –Є –µ—Й–µ 2 (29%) – –≤ —Б–Њ—Б—В–∞–≤–µ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е —Б—Е–µ–Љ –ї–µ—З–µ–љ–Є—П —Б –ї–µ—В—А–Њ–Ј–Њ–ї–Њ–Љ –Є–ї–Є –њ–∞–Ї–ї–Є—В–∞–Ї—Б–µ–ї–Њ–Љ (—Б–ї–µ–њ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П). –Т—Б–µ —П–≤–ї–µ–љ–Є—П —Б–Њ —Б—В–Њ—А–Њ–љ—Л —Б–µ—А–і—Ж–∞, –≤–Њ–Ј–љ–Є–Ї—И–Є–µ –≤ —Е–Њ–і–µ —Б–ї–µ–њ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –±—Л–ї–Є —А–∞—Б—Ж–µ–љ–µ–љ—Л –Ї–∞–Ї —А–µ–Ј—Г–ї—М—В–∞—В –њ–Њ–±–Њ—З–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П –ї–∞–њ–∞—В–Є–љ–Є–±–∞, –љ–Њ –љ–µ –Є—Б–Ї–ї—О—З–µ–љ–Њ, —З—В–Њ –љ–µ–Ї–Њ—В–Њ—А—Л–Љ –±–Њ–ї—М–љ—Л–Љ –љ–µ –љ–∞–Ј–љ–∞—З–∞–ї–Є —Н—В–Њ—В –њ—А–µ–њ–∞—А–∞—В. –Я–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Є—Б—Е–Њ–і–љ—Л–Љ –Ј–љ–∞—З–µ–љ–Є–µ–Љ –§–Т–Ы–Ц —Б–љ–Є–Ј–Є–ї–∞—Б—М –љ–∞ 23,7±5,2% (95% –Ф–Ш, 14,5–32,0%), –∞ –≤ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–Љ –≤—Л—А–∞–ґ–µ–љ–Є–Є – –љ–∞ 35,5±8,6% (95% –Ф–Ш, 25,0–51,6%). –Э–∞—А—Г—И–µ–љ–Є—П —Б–µ—А–і–µ—З–љ–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є –њ—А–Њ—П–≤–ї—П–ї–Є—Б—М –≤ –≤–Є–і–µ –Њ–і—Л—И–Ї–Є, —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –Є–ї–Є —Б–µ—А–і—Ж–µ–±–Є–µ–љ–Є—П. –£ 2 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–Њ–ї–љ—Л–Љ –≤—Л–Ј–і–Њ—А–Њ–≤–ї–µ–љ–Є–µ–Љ –≤ –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–Љ —Н–њ–Є–Ј–Њ–і—Л –љ–∞—А—Г—И–µ–љ–Є–є –≤ —А–∞–±–Њ—В–µ —Б–µ—А–і—Ж–∞ —Б–Њ—Е—А–∞–љ—П–ї–Є—Б—М –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є 2 –Є 6 –љ–µ–і–µ–ї—М. –Т 2 —Б–ї—Г—З–∞—П—Е –љ–µ –±—Л–ї–Њ —Б–Њ–±—А–∞–љ–Њ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –і–∞–љ–љ—Л—Е –і–ї—П –Њ—Ж–µ–љ–Ї–Є –Є—Б—Е–Њ–і–∞ – –±–Њ–ї—М–љ—Л–µ —Б–Ї–Њ–љ—З–∞–ї–Є—Б—М –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –Њ—Б–љ–Њ–≤–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –£ 2 –ї–Є—Ж –Њ—В–Љ–µ—З–µ–љ–Њ —З–∞—Б—В–Є—З–љ–Њ–µ –≤—Л–Ј–і–Њ—А–Њ–≤–ї–µ–љ–Є–µ, —Г 1 —З–µ–ї–Њ–≤–µ–Ї–∞ –≤—Л–Ј–і–Њ—А–Њ–≤–ї–µ–љ–Є—П –љ–µ –њ—А–Њ–Є–Ј–Њ—И–ї–Њ (—В–∞–±–ї. 4).
–Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –њ–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ –і–∞–љ–љ—Л–Љ —Г 3 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–∞–±–ї—О–і–∞–ї–Є—Б—М —Б–Є–Љ–њ—В–Њ–Љ—Л, –љ–∞–њ–Њ–Љ–Є–љ–∞–≤—И–Є–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П –њ–Њ–±–Њ—З–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –ї–∞–њ–∞—В–Є–љ–Є–±–∞ –љ–∞ —Б–µ—А–і–µ—З–љ—Г—О –Љ—Л—И—Ж—Г, –Њ–і–љ–∞–Ї–Њ –Њ–±—К–µ–Ї—В–Є–≤–љ—Л–µ –њ—А–Є–Ј–љ–∞–Ї–Є –њ–∞—В–Њ–ї–Њ–≥–Є–Є (—Б–љ–Є–ґ–µ–љ–Є–µ –§–Т–Ы–Ц, –Є–Ј–Љ–µ–љ–µ–љ–Є—П –љ–∞ —Н–ї–µ–Ї—В—А–Њ–Ї–∞—А–і–Є–Њ–≥—А–∞–Љ–Љ–µ, –∞—А–Є—В–Љ–Є—П) –Њ—В—Б—Г—В—Б—В–≤–Њ–≤–∞–ї–Є. –Э–µ –Є—Б–Ї–ї—О—З–µ–љ–Њ, —З—В–Њ —Г —Н—В–Є—Е –±–Њ–ї—М–љ—Л—Е –Є–Љ–µ–ї–Є—Б—М —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –ї–µ–≥–Ї–Є—Е –Є–ї–Є –љ–∞—А—Г—И–µ–љ–Є–µ –Њ–±–Љ–µ–љ–∞ –≤–µ—Й–µ—Б—В–≤, –љ–Њ –њ–Њ –Є–Љ–µ–≤—И–Є–Љ—Б—П –і–∞–љ–љ—Л–Љ –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ–Љ—Л–µ –і–Є–∞–≥–љ–Њ–Ј—Л –≤–µ—А–Є—Д–Є—Ж–Є—А–Њ–≤–∞—В—М –±—Л–ї–Њ –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ. –І—В–Њ–±—Л —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ—А–Є–љ—П–ї–Є –Ј–∞–Ї–Њ–љ—З–µ–љ–љ—Л–є –≤–Є–і, —Н—В–Є—Е –Є—Б–њ—Л—В—Г–µ–Љ—Л—Е —В–∞–Ї–ґ–µ –≤–Ї–ї—О—З–Є–ї–Є –≤ –∞–љ–∞–ї–Є–Ј.
–Э–∞—А—Г—И–µ–љ–Є—П —Б–µ—А–і–µ—З–љ–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є —Г –ї–Є—Ж,
–љ–µ –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –ї–∞–њ–∞—В–Є–љ–Є–±
–Т –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ –љ–∞—А—Г—И–µ–љ–Є—П —А–∞–±–Њ—В—Л —Б–µ—А–і—Ж–∞ –≤–Њ–Ј–љ–Є–Ї–ї–Є –≤ 9 —Б–ї—Г—З–∞—П—Е (0,7%; —А–Є—Б. 1). –Ш—Б—Е–Њ–і–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –§–Т–Ы–Ц –≤–∞—А—М–Є—А–Њ–≤–∞–ї–Њ –≤ –њ—А–µ–і–µ–ї–∞—Е –Њ—В 52 –і–Њ 75%, –∞ –≤–µ–ї–Є—З–Є–љ–∞, –і–Њ –Ї–Њ—В–Њ—А–Њ–є —Б–љ–Є–Ј–Є–ї—Б—П —Н—В–Њ—В –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –Ї –Љ–Њ–Љ–µ–љ—В—Г –њ–Њ—П–≤–ї–µ–љ–Є—П —Н–њ–Є–Ј–Њ–і–∞, —Б–Њ—Б—В–∞–≤–Є–ї–∞ 34,0–51,0%. –£ 1 –Є–Ј 199 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–∞–Ї–Њ–Љ –њ–Њ—З–Ї–Є (0,5%) –љ–∞—А—Г—И–µ–љ–Є–µ —Б–µ—А–і–µ—З–љ–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є –љ–µ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–Њ—Б—М –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–Њ–є. –ѓ–≤–ї–µ–љ–Є—П —Б–Њ —Б—В–Њ—А–Њ–љ—Л —Б–µ—А–і—Ж–∞ –љ–∞–±–ї—О–і–∞–ї–Є—Б—М —Г 8 –Є–Ј 1075 –±–Њ–ї—М–љ—Л—Е —Б —А–∞–Ї–Њ–Љ –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л (0,7%), –њ—А–Є—З–µ–Љ –≤ 2 —Б–ї—Г—З–∞—П—Е (–љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –њ–∞–Ї–ї–Є—В–∞–Ї—Б–µ–ї–∞) –њ–Њ—П–≤–Є–ї–∞—Б—М —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–∞—П —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–∞ – –Ч–°–Э –Є –Њ–і—Л—И–Ї–∞. 3 —З–µ–ї–Њ–≤–µ–Ї–∞ (38%) –њ–Њ–ї–љ–Њ—Б—В—М—О –≤—Л–Ј–і–Њ—А–Њ–≤–µ–ї–Є, 1 (13%) –љ–µ –≤—Л–Ј–і–Њ—А–Њ–≤–µ–ї, –∞ –њ–Њ 4 –Є—Б–њ—Л—В—Г–µ–Љ—Л–Љ (50%) –і–∞–љ–љ—Л—Е –±—Л–ї–Њ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ. –£ 1 –±–Њ–ї—М–љ–Њ–є —Б —А–∞–Ї–Њ–Љ –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л, –Ї–Њ—В–Њ—А–∞—П –њ–Њ–ї—Г—З–∞–ї–∞ —В—А–∞—Б—В—Г–Ј—Г–Љ–∞–± –љ–∞ –њ—А–µ–і—Л–і—Г—Й–Є—Е —Н—В–∞–њ–∞—Е, –Њ—В–Љ–µ—З–µ–љ —Н–њ–Є–Ј–Њ–і –љ–∞—А—Г—И–µ–љ–Є–є –≤ —А–∞–±–Њ—В–µ —Б–µ—А–і—Ж–∞ –љ–∞ —Д–Њ–љ–µ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є –Ї–∞–њ–µ—Ж–Є—В–∞–±–Є–љ–Њ–Љ. –≠—В–Њ–є –њ–∞—Ж–Є–µ–љ—В–Ї–µ –љ–∞–Ј–љ–∞—З–Є–ї–Є –ї–∞–њ–∞—В–Є–љ–Є–± –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б –Ї–∞–њ–µ—Ж–Є—В–∞–±–Є–љ–Њ–Љ, –Є —Г –љ–µ–µ —А–∞–Ј–≤–Є–ї—Б—П –µ—Й–µ –Њ–і–Є–љ —В–∞–Ї–Њ–є —Н–њ–Є–Ј–Њ–і.
–Ю–±—Б—Г–ґ–і–µ–љ–Є–µ
–Я—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ –њ–Њ 3689 –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л–Љ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ —В–Њ–Љ, —З—В–Њ –њ—А–Є–µ–Љ –ї–∞–њ–∞—В–Є–љ–Є–±–∞ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ —Б –Њ—З–µ–љ—М –љ–Є–Ј–Ї–Њ–є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М—О –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Љ–∞–љ–Є—Д–µ—Б—В–Є—А—Г—О—Й–µ–є –Ч–°–Э (0,2%) –Є –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є —Б–µ—А–і–µ—З–љ–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є (1,4%). –І–∞—Б—В–Њ—В–∞ –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є —Н—В–Є—Е —П–≤–ї–µ–љ–Є–є –≤ –Ї–Њ–≥–Њ—А—В–µ –ї–µ—З–Є–≤—И–Є—Е—Б—П –Є–Ј—Г—З–∞–µ–Љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –Њ–Ї–∞–Ј–∞–ї–∞—Б—М —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ–∞ —Б —В–∞–Ї–Њ–≤–Њ–є –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ –ї–Є—Ж, –љ–µ –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –ї–∞–њ–∞—В–Є–љ–Є–± (n=1301). –Ф–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П –Ї–∞—А–і–Є–Њ—В—А–Њ–њ–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –ї–∞–њ–∞—В–Є–љ–Є–±–∞ –≤ –Њ—В–і–∞–ї–µ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї–Њ—Б—М –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ; –∞–љ–∞–ї–Є–Ј –і–∞–љ–љ—Л—Е –њ–Њ 274 –±–Њ–ї—М–љ—Л–Љ, –љ–∞—Е–Њ–і–Є–≤—И–Є–Љ—Б—П –љ–∞ —В–µ—А–∞–њ–Є–Є –ї–∞–њ–∞—В–Є–љ–Є–±–Њ–Љ 6 –Љ–µ—Б—П—Ж–µ–≤ –Є –±–Њ–ї–µ–µ, –њ–Њ–Ј–≤–Њ–ї–Є–ї —Г—Б—В–∞–љ–Њ–≤–Є—В—М, —З—В–Њ –љ–Є–Ї–∞–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є –Ї—Г–Љ—Г–ї—П—В–Є–≤–љ–Њ–є –Є–ї–Є –і–Њ–Ј–Њ–Ј–∞–≤–Є—Б–Є–Љ–Њ–є —В–Њ–Ї—Б–Є—З–љ–Њ—Б—В–Є (—Е–∞—А–∞–Ї—В–µ—А–љ–Њ–є, –љ–∞–њ—А–Є–Љ–µ—А, –і–ї—П –∞–љ—В—А–∞—Ж–Є–Ї–ї–Є–љ–Њ–≤) –љ–µ –љ–∞–±–ї—О–і–∞–µ—В—Б—П.
–Т –≥–µ—В–µ—А–Њ–≥–µ–љ–љ–Њ–є –њ–Њ–њ—Г–ї—П—Ж–Є–Є –Є–Ј –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –ї–∞–њ–∞—В–Є–љ–Є–± 60 —З–µ–ї–Њ–≤–µ–Ї, —Г –Ї–Њ—В–Њ—А—Л—Е –≤–Њ–Ј–љ–Є–Ї–ї–Є —Н–њ–Є–Ј–Њ–і—Л –љ–∞—А—Г—И–µ–љ–Є–є –≤ —А–∞–±–Њ—В–µ —Б–µ—А–і—Ж–∞, –љ–µ —Г–і–∞–ї–Њ—Б—М –≤—Л—П–≤–Є—В—М –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —Б–љ–Є–ґ–µ–љ–Є—П –§–Т–Ы–Ц. –°—А–µ–і–љ–µ–µ –≤—А–µ–Љ—П, –њ—А–Њ—И–µ–і—И–µ–µ –і–Њ —А–∞–Ј–≤–Є—В–Є—П —В–∞–Ї–Њ–≥–Њ —Н–њ–Є–Ј–Њ–і–∞, —Б–Њ—Б—В–∞–≤–Є–ї–Њ 13 –љ–µ–і–µ–ї—М, –њ—А–Є—З–µ–Љ —А–µ–Ј–Ї–Њ–µ –њ–∞–і–µ–љ–Є–µ –§–Т–Ы–Ц –њ—А–Њ–Є—Б—Е–Њ–і–Є–ї–Њ —А–µ–і–Ї–Њ. –І–∞—Б—В–Њ—В–∞ –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є —П–≤–ї–µ–љ–Є–є —Б–Њ —Б—В–Њ—А–Њ–љ—Л —Б–µ—А–і—Ж–∞ –Є –≤–µ–ї–Є—З–Є–љ–∞ –∞–±—Б–Њ–ї—О—В–љ–Њ–≥–Њ —Б–љ–Є–ґ–µ–љ–Є—П –§–Т–Ы–Ц –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Є—Б—Е–Њ–і–љ—Л–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–Љ –Њ–Ї–∞–Ј–∞–ї–Є—Б—М –Њ–і–Є–љ–∞–Ї–Њ–≤—Л–Љ–Є –≤–љ–µ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Д–∞–Ї—В–∞ –ї–µ—З–µ–љ–Є—П –∞–љ—В—А–∞—Ж–Є–Ї–ї–Є–љ–∞–Љ–Є –Є/–Є–ї–Є —В—А–∞—Б—В—Г–Ј—Г–Љ–∞–±–Њ–Љ –љ–∞ –њ—А–µ–і—Л–і—Г—Й–Є—Е —Н—В–∞–њ–∞—Е. –Э–µ –њ—А–Њ—Б–ї–µ–ґ–Є–≤–∞–ї–Њ—Б—М –љ–Є–Ї–∞–Ї–Њ–є –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј–Є –Љ–µ–ґ–і—Г –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –∞–љ—В—А–∞—Ж–Є–Ї–ї–Є–љ–Њ–≤ –љ–∞ –њ—А–µ–і—Л–і—Г—Й–µ–Љ —Н—В–∞–њ–µ –Є –њ–Њ—П–≤–ї–µ–љ–Є–µ–Љ –љ–∞—А—Г—И–µ–љ–Є–є —Б–µ—А–і–µ—З–љ–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ—Л—Е –ї–∞–њ–∞—В–Є–љ–Є–±–Њ–Љ. –Х—Б–ї–Є –±—Л –њ—А–Є –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –Ї–∞—А–і–Є–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤—Л—П–≤–Є–ї–∞—Б—М –і–∞–ґ–µ –Љ–Є–љ–Є–Љ–∞–ї—М–љ–∞—П –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–∞—П –Ї—Г–Љ—Г–ї—П—В–Є–≤–љ–∞—П —В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М, —В–Њ –њ–Њ—А–Њ–≥–Њ–≤—Л–µ –Ј–љ–∞—З–µ–љ–Є—П —В–Њ–Ї—Б–Є—З–љ–Њ—Б—В–Є –Њ–Ї–∞–Ј–∞–ї–Є—Б—М –±—Л –њ—А–µ–≤—Л—И–µ–љ–љ—Л–Љ–Є. –Э–Њ –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г —Н—В–Є –њ–Њ—А–Њ–≥–Њ–≤—Л–µ –Ј–љ–∞—З–µ–љ–Є—П –њ—А–µ–≤—Л—И–µ–љ—Л –љ–µ –±—Л–ї–Є, —В–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–Є –≤—Л–і–∞–ї–Є –Ј–∞–Ї–ї—О—З–µ–љ–Є–µ –Њ–± –Њ—В—Б—Г—В—Б—В–≤–Є–Є —Г –њ—А–µ–њ–∞—А–∞—В–∞ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–є –Ї—Г–Љ—Г–ї—П—В–Є–≤–љ–Њ–є —В–Њ–Ї—Б–Є—З–љ–Њ—Б—В–Є.
–Т –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ —П–≤–ї–µ–љ–Є—П —Б–Њ —Б—В–Њ—А–Њ–љ—Л —Б–µ—А–і—Ж–∞ –Њ–Ї–∞–Ј–∞–ї–Є—Б—М –Њ–±—А–∞—В–Є–Љ—Л–Љ–Є, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ —Б–і–µ–ї–∞—В—М –њ—А–µ–і–њ–Њ–ї–Њ–ґ–µ–љ–Є–µ –Њ–± —Г—З–∞—Б—В–Є–Є –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ —Н—В–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞ –Ї–ї–µ—В–Њ—З–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є, –Є–Ј–≤–µ—Б—В–љ–Њ–є –Ї–∞–Ї –Ї–∞—А–і–Є–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М II —В–Є–њ–∞. –Я—А–Є —Н—В–Њ–є —Д–Њ—А–Љ–µ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П —Б–Њ–Ї—А–∞—В–Є—В–µ–ї—М–љ—Л–µ —Н–ї–µ–Љ–µ–љ—В—Л –Љ–Є–Њ—Д–Є–±—А–Є–ї–ї —В–µ—А—П—О—В —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Ї –Ї–Њ–Њ—А–і–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є, —В.–µ. –≤–µ–і—Г—Й–Є–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–Љ –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є —Б–µ—А–і–µ—З–љ–Њ–є –Љ—Л—И—Ж—Л —П–≤–ї—П–µ—В—Б—П –Њ—В–љ—О–і—М –љ–µ –≥–Є–±–µ–ї—М –Ї–∞—А–і–Є–Њ–Љ–Є–Њ—Ж–Є—В–Њ–≤. –Р–љ—В—А–∞—Ж–Є–Ї–ї–Є–љ—Л –ґ–µ, –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –ї–∞–њ–∞—В–Є–љ–Є–±–∞, –њ—А–Њ–≤–Њ—Ж–Є—А—Г—О—В –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–µ –∞–љ–Њ–Љ–∞–ї–Є–є –Ї–∞—А–і–Є–Њ–Љ–Є–Њ—Ж–Є—В–Њ–≤ –љ–∞ —Г–ї—М—В—А–∞—Б—В—А—Г–Ї—В—Г—А–љ–Њ–Љ —Г—А–Њ–≤–љ–µ, —З—В–Њ –≤–µ–і–µ—В –Ї –≥–Є–±–µ–ї–Є –Ї–ї–µ—В–Њ–Ї (–Ї–∞—А–і–Є–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М I —В–Є–њ–∞) [11]. –Ъ–Њ–≥–і–∞ –љ–∞ —Д–Њ–љ–µ —В–µ—А–∞–њ–Є–Є –ї–∞–њ–∞—В–Є–љ–Є–±–Њ–Љ —Г–і–∞–≤–∞–ї–Њ—Б—М –Њ–њ—А–µ–і–µ–ї–Є—В—М –≤–∞—А–Є–∞–љ—В –Є—Б—Е–Њ–і–∞, —В–Њ –≤—Л—П—Б–љ—П–ї–Њ—Б—М, —З—В–Њ –њ–∞–і–µ–љ–Є–µ –§–Т–Ы–Ц —Б–Њ—Е—А–∞–љ—П–ї–Њ—Б—М –љ–µ–њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ–µ –≤—А–µ–Љ—П, –∞ –Ј–љ–∞—З–µ–љ–Є—П –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –њ–Њ–ї–љ–Њ—Б—В—М—О –Є–ї–Є —З–∞—Б—В–Є—З–љ–Њ –≤–Њ—Б—Б—В–∞–љ–∞–≤–ї–Є–≤–∞–ї–Є—Б—М –≤ —Б—А–µ–і–љ–µ–Љ —З–µ—А–µ–Ј 7,3 –љ–µ–і–µ–ї–Є (—З—В–Њ –і–Њ–Ї–∞–Ј—Л–≤–∞–µ—В –≥–Є–њ–Њ—В–µ–Ј—Г –Њ –Љ–µ—Е–∞–љ–Є–Ј–Љ–µ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П II —В–Є–њ–∞).
–Ш—Б—Е–Њ–і—Л –±—Л–ї–Є –Њ–і–Є–љ–∞–Ї–Њ–≤—Л –≤–љ–µ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —В–Њ–≥–Њ, –Њ—В–Љ–µ–љ—П–ї–Є –ї–Є –ї–∞–њ–∞—В–Є–љ–Є–± –Њ–Ї–Њ–љ—З–∞—В–µ–ї—М–љ–Њ (—Б–Њ–≥–ї–∞—Б–љ–Њ –њ—А–Њ—В–Њ–Ї–Њ–ї—Г –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є) –Є–ї–Є –ґ–µ —В–Њ–ї—М–Ї–Њ –љ–∞ –≤—А–µ–Љ—П —Б –≤–Њ–Ј–Њ–±–љ–Њ–≤–ї–µ–љ–Є–µ–Љ –њ—А–Є–µ–Љ–∞ –њ—А–µ–њ–∞—А–∞—В–∞ –њ–Њ —Г—Б–Љ–Њ—В—А–µ–љ–Є—О –≤—А–∞—З (—А–Є—Б. 1). –°–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, –Ї–∞–Ї –Є –≤ —Б–ї—Г—З–∞–µ —В—А–∞—Б—В—Г–Ј—Г–Љ–∞–±–∞, –ї–∞–њ–∞—В–Є–љ–Є–± –Љ–Њ–ґ–љ–Њ –љ–∞–Ј–љ–∞—З–Є—В—М –њ–Њ–≤—В–Њ—А–љ–Њ –њ–Њ—Б–ї–µ –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–Є –§–Т–Ы–Ц.
–Я–Њ–ї—Г—З–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ —Б–ї–µ–і—Г–µ—В –Є–љ—В–µ—А–њ—А–µ—В–Є—А–Њ–≤–∞—В—М –≤ –Ї–Њ–љ—В–µ–Ї—Б—В–µ –і—А—Г–≥–Є—Е –і–∞–љ–љ—Л—Е, –∞ –Є–Љ–µ–љ–љ–Њ: 1) —З–∞—Б—В–Њ—В–∞ –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є –љ–∞—А—Г—И–µ–љ–Є–є —Б–µ—А–і–µ—З–љ–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ –љ–µ –њ—А–µ–≤—Л—И–∞–µ—В 0,7%; 2) –њ–Њ–і–Њ–±–љ—Л–µ —П–≤–ї–µ–љ–Є—П –≤–Њ–Ј–љ–Є–Ї–∞—О—В –Є –љ–∞ —Д–Њ–љ–µ –ї–µ—З–µ–љ–Є—П –і—А—Г–≥–Є–Љ–Є –њ—А–Њ—В–Є–≤–Њ–Њ–њ—Г—Е–Њ–ї–µ–≤—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є; 3) –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є —В–∞–Ї–ґ–µ –≤–Њ–Ј–Љ–Њ–ґ–љ—Л –љ–∞—А—Г—И–µ–љ–Є—П –≤ —А–∞–±–Њ—В–µ —Б–µ—А–і—Ж–∞ [15–18].
–Ґ–∞–Ї, —Б–љ–Є–ґ–µ–љ–Є–µ –§–Т–Ы–Ц –Є —А–∞–Ј–≤–Є—В–Є–µ –Ч–°–Э –Љ–Њ–≥—Г—В –љ–∞–±–ї—О–і–∞—В—М—Б—П –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –Є –і—А—Г–≥–Є—Е –њ—А–Њ—В–Є–≤–Њ–Њ–њ—Г—Е–Њ–ї–µ–≤—Л—Е —Б—А–µ–і—Б—В–≤ [5–9,19–22]. Kerkela –Є —Б–Њ–∞–≤—В. [19] –Њ–њ–Є—Б—Л–≤–∞—О—В 10 –±–Њ–ї—М–љ—Л—Е —Б –Є—Б—Е–Њ–і–љ–Њ –љ–Њ—А–Љ–∞–ї—М–љ—Л–Љ–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ–Є —Д—Г–љ–Ї—Ж–Є–є –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞, —Г –Ї–Њ—В–Њ—А—Л—Е –≤ –њ—А–Њ—Ж–µ—Б—Б–µ —В–µ—А–∞–њ–Є–Є –Є–Љ–∞—В–Є–љ–Є–±–Њ–Љ –њ–Њ—П–≤–Є–ї–Є—Б—М –њ—А–Є–Ј–љ–∞–Ї–Є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є –Ы–Ц –Є –Ч–°–Э. –Я–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е —Г 2 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –±—Л–ї–∞ –≤—Л—П–≤–ї–µ–љ–∞ –Ї–∞—А—В–Є–љ–∞ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–є –Ї–∞—А–і–Є–Њ–Љ–Є–Њ—Ж–Є—В–Њ–≤, —Е–∞—А–∞–Ї—В–µ—А–љ–∞—П –і–ї—П —В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А–і–Є–Њ–Љ–Є–Њ–њ–∞—В–Є–Є. –Т —Е–Њ–і–µ III —Д–∞–Ј—Л –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Ї–∞–њ–µ—Ж–Є—В–∞–±–Є–љ–∞ –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б –±–µ–≤–∞—Ж–Є–Ј—Г–Љ–∞–±–Њ–Љ –Є–ї–Є –±–µ–Ј –љ–µ–≥–Њ –±—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ —Г 7 –Є–Ј 229 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (3%) —Б –Љ–µ—В–∞—Б—В–∞–Ј–Є—А—Г—О—Й–Є–Љ —А–∞–Ї–Њ–Љ –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л, —А–∞–љ–µ–µ –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –∞–љ—В—А–∞—Ж–Є–Ї–ї–Є–љ—Л –Є —В–∞–Ї—Б–∞–љ—Л, –љ–∞ —Д–Њ–љ–µ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П —А–∞–Ј–≤–Є–ї–∞—Б—М –Ч–°–Э –Є–ї–Є –Ї–∞—А–і–Є–Њ–Љ–Є–Њ–њ–∞—В–Є—П [20]. –Я—А–Є–µ–Љ —Б—Г–љ–Є—В–Є–љ–Є–±–∞ –њ—А–Є —Б—В—А–Њ–Љ–∞–ї—М–љ—Л—Е –Њ–њ—Г—Е–Њ–ї—П—Е –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –њ–∞–і–µ–љ–Є–µ–Љ –§–Т–Ы–Ц –≤ 11% —Б–ї—Г—З–∞–µ–≤ (–≤ –≥—А—Г–њ–њ–µ –њ–ї–∞—Ж–µ–±–Њ – –≤ 3% —Б–ї—Г—З–∞–µ–≤) [21]. –£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Љ–µ—В–∞—Б—В–∞–Ј–Є—А—Г—О—Й–Є–Љ —А–∞–Ї–Њ–Љ –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л —В—А–∞—Б—В—Г–Ј—Г–Љ–∞–± –њ—А–Њ–≤–Њ—Ж–Є—А—Г–µ—В –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П —Б–µ—А–і–µ—З–љ–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є –≤ 3–27% —Б–ї—Г—З–∞–µ–≤ –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є —В–µ—А–∞–њ–Є–Є [21]. –°–Њ–≥–ї–∞—Б–љ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –∞–і—К—О–≤–∞–љ—В–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —В—А–∞—Б—В—Г–Ј—Г–Љ–∞–±–∞, –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є —Б—В–∞–љ–і–∞—А—В–љ–Њ–є —Б—Е–µ–Љ—Л —Б –∞–љ—В—А–∞—Ж–Є–Ї–ї–Є–љ–∞–Љ–Є —З–∞—Б—В–Њ—В–∞ –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є —Б–µ—А—М–µ–Ј–љ—Л—Е –њ–Њ–±–Њ—З–љ—Л—Е —П–≤–ї–µ–љ–Є–є —Б–Њ —Б—В–Њ—А–Њ–љ—Л —Б–µ—А–і—Ж–∞ (III –Є–ї–Є IV —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–є –Ї–ї–∞—Б—Б –Ч–°–Э –њ–Њ –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є –Э—М—О––Щ–Њ—А–Ї—Б–Ї–Њ–є –Ї–∞—А–і–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є –Є–ї–Є –≤–µ—А–Њ—П—В–љ–∞—П/–≤–Њ–Ј–Љ–Њ–ґ–љ–∞—П —Б–µ—А–і–µ—З–љ–∞—П —Б–Љ–µ—А—В—М) –≤–∞—А—М–Є—А—Г–µ—В –≤ –њ—А–µ–і–µ–ї–∞—Е –Њ—В 1,7 –і–Њ 4,1% [5–7]. –Ф–∞–љ–љ—Л–µ, –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ –≤ —Е–Њ–і–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П 006, –Ї–Њ—В–Њ—А–Њ–µ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –њ–Њ–і —Н–≥–Є–і–Њ–є –Ь–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–Њ–є –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М—Б–Ї–Њ–є –≥—А—Г–њ–њ—Л –њ–Њ —А–∞–Ї—Г –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л (BCIRG), —Г–Ї–∞–Ј—Л–≤–∞—О—В –љ–∞ —В–Њ, —З—В–Њ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ –њ–Њ —Б—Е–µ–Љ–µ –∞–љ—В—А–∞—Ж–Є–Ї–ї–Є–љ + —В—А–∞—Б—В—Г–Ј—Г–Љ–∞–± –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–Њ —Б –≥–Њ—А–∞–Ј–і–Њ –±–Њ–ї—М—И–µ–є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М—О –Ч–°–Э –Є –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ –њ–∞–і–µ–љ–Є–µ–Љ –§–Т–Ы–Ц; –≤ –≥—А—Г–њ–њ–µ –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –і–Њ–Ї—Б–Њ—А—Г–±–Є—Ж–Є–љ + —Ж–Є–Ї–ї–Њ—Д–Њ—Б—Д–∞–Љ–Є–і —Б –њ–µ—А–µ—Е–Њ–і–Њ–Љ –љ–∞ –і–Њ—Ж–µ—В–∞–Ї—Б–µ–ї + —В—А–∞—Б—В—Г–Ј—Г–Љ–∞–± –Є –≤ –Ї–Њ–≥–Њ—А—В–µ –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –і–Њ—Ж–µ—В–∞–Ї—Б–µ–ї + –Ї–∞—А–±–Њ–њ–ї–∞—В–Є–љ + —В—А–∞—Б—В—Г–Ј—Г–Љ–∞–± –Ч–°–Э –Є–Љ–µ–ї–∞ –Љ–µ—Б—В–Њ —Г 20 –Є 4 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ (—А=0,002), –∞ –њ–∞–і–µ–љ–Є–µ –§–Т–Ы–Ц –±–Њ–ї–µ–µ —З–µ–Љ –љ–∞ 10% –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –Є—Б—Е–Њ–і–љ–Њ–≥–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –Њ—В–Љ–µ—З–∞–µ—В—Б—П —Г 18,0 –Є 8,6% –±–Њ–ї—М–љ—Л—Е —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ (—А<0,001) [9].
Zambetti –Є —Б–Њ–∞–≤—В. [23] –љ–∞–±–ї—О–і–∞–ї–Є –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ–Њ–µ –љ–∞—А—Г—И–µ–љ–Є–µ —Б–µ—А–і–µ—З–љ–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є —Г 1000 —З–µ–ї–Њ–≤–µ–Ї, –Ї–Њ—В–Њ—А–Њ–µ –≤–Њ–Ј–љ–Є–Ї–ї–Њ –љ–∞ —Д–Њ–љ–µ –∞–і—К—О–≤–∞–љ—В–љ–Њ–є —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є –±–µ–Ј –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –∞–љ—В–Є–HER2 –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –Т –њ–Њ–і–≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –±–µ–Ј —А–µ—Ж–Є–і–Є–≤–∞ –≤ —В–µ—З–µ–љ–Є–µ 11 –ї–µ—В (–Љ–µ–і–Є–∞–љ–∞) —З–∞—Б—В–Њ—В–∞ –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є –њ—А–Є –ї–µ—З–µ–љ–Є–Є –і–Њ–Ї—Б–Њ—А—Г–±–Є—Ж–Є–љ–Њ–Љ –Є –њ–Њ —Б—Е–µ–Љ–µ —Ж–Є–Ї–ї–Њ—Д–Њ—Б—Д–∞–Љ–Є–і + –Љ–µ—В–Њ—В—А–µ–Ї—Б–∞—В + —Д–ї—Г–Њ—А–Њ—Г—А–∞—Ж–Є–ї —Б–Њ—Б—В–∞–≤–Є–ї–∞ 8 –Є 2%, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ. –†–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –Ч–°–Э –≤ –Ї–Њ–≥–Њ—А—В–µ –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –і–Њ–Ї—Б–Њ—А—Г–±–Є—Ж–Є–љ –Њ–Ї–∞–Ј–∞–ї–∞—Б—М –љ–Є–Ј–Ї–Њ–є (1%), –љ–Њ –њ–Њ—Б–ї–µ –Њ–±–ї—Г—З–µ–љ–Є—П –ї–µ–≤–Њ–є —Б—В–Њ—А–Њ–љ—Л –≥—А—Г–і–љ–Њ–є –Ї–ї–µ—В–Ї–Є —А–Є—Б–Ї –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –Ч–°–Э –≤–Њ–Ј—А–∞—Б—В–∞–ї –≤ 3 —А–∞–Ј–∞. –†–µ–Ј—Г–ї—М—В–∞—В—Л —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –Њ–±–Ј–Њ—А–∞ –µ—Й–µ –Њ–і–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ –∞–і—К—О–≤–∞–љ—В–љ–Њ–є —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є –њ—А–Є —А–∞–Ї–µ –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ —В–Њ–Љ, —З—В–Њ —Г—Е—Г–і—И–µ–љ–Є–µ –§–Т–Ы–Ц –≤—Б—В—А–µ—З–∞–µ—В—Б—П –љ–µ —В–∞–Ї —Г–ґ –Є —А–µ–і–Ї–Њ –і–∞–ґ–µ –≤ –Њ—В—Б—Г—В—Б—В–≤–Є–µ –њ—А–Є–µ–Љ–∞ –∞–љ—В—А–∞—Ж–Є–Ї–ї–Є–љ–Њ–≤ [24]. –І–µ—А–µ–Ј 60 –Љ–µ—Б—П—Ж–µ–≤ –њ–∞–і–µ–љ–Є–µ –§–Т–Ы–Ц –±–Њ–ї–µ–µ —З–µ–Љ –љ–∞ 10% –љ–∞ —Д–Њ–љ–µ —В–µ—А–∞–њ–Є–Є –њ–Њ —Б—Е–µ–Љ–µ —Ж–Є–Ї–ї–Њ—Д–Њ—Б—Д–∞–Љ–Є–і + –Љ–µ—В–Њ—В—А–µ–Ї—Б–∞—В + —Д–ї—Г–Њ—А–Њ—Г—А–∞—Ж–Є–ї —Б–Њ—Е—А–∞–љ—П–µ—В—Б—П —Г 10% –±–Њ–ї—М–љ—Л—Е, –∞ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Ї—Г–Љ—Г–ї—П—В–Є–≤–љ–Њ–є –і–Њ–Ј—Л —Н–њ–Є—А—Г–±–Є—Ж–Є–љ–∞ 720 –Љ–≥/–Љ2 – —Г 25%. –Ю–і–љ–∞–Ї–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Ј–љ–∞—З–Є–Љ–Њ—Б—В—М –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л—Е –і–∞–љ–љ—Л—Е –њ–Њ–Ї–∞ –љ–µ –Њ–њ—А–µ–і–µ–ї–µ–љ–∞. –Я–Њ—Б–Ї–Њ–ї—М–Ї—Г –њ—А–Њ—В–Є–≤–Њ–Њ–њ—Г—Е–Њ–ї–µ–≤–Њ–µ –ї–µ—З–µ–љ–Є–µ –Њ–±–ї–∞–і–∞–µ—В –њ—А—П–Љ—Л–Љ –Є –Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–љ—Л–Љ —В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є–Љ –≤–ї–Є—П–љ–Є–µ–Љ, –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М —А–∞–Ј–≤–Є—В–Є—П –њ–∞—В–Њ–ї–Њ–≥–Є–Є —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Є—Б—В–µ–Љ—Л –љ–∞ –њ–Њ–Ј–і–љ–Є—Е —Н—В–∞–њ–∞—Е –≥–Њ—А–∞–Ј–і–Њ –≤—Л—И–µ —Г –ї–Є—Ж, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –∞–і—К—О–≤–∞–љ—В–љ—Г—О —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є—О –њ–Њ –њ–Њ–≤–Њ–і—Г —А–∞–Ї–∞ –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л, —З–µ–Љ —Г –Є—Б–њ—Л—В—Г–µ–Љ—Л—Е –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ—Л —В–Њ–≥–Њ –ґ–µ –≤–Њ–Ј—А–∞—Б—В–∞ [25]. –Э–∞–Ј–љ–∞—З–∞—П –њ—А–Њ—В–Є–≤–Њ–Њ–њ—Г—Е–Њ–ї–µ–≤—Л–µ –∞–≥–µ–љ—В—Л —Б –љ–Є–Ј–Ї–Њ–є —В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М—О (–Њ—Б–Њ–±–µ–љ–љ–Њ –≤ —Б–Њ—Б—В–∞–≤–µ –∞–і—К—О–≤–∞–љ—В–љ—Л—Е —Б—Е–µ–Љ), –Љ–Њ–ґ–љ–Њ –ї—Г—З—И–µ –Ї–Њ–љ—В—А–Њ–ї–Є—А–Њ–≤–∞—В—М —З–∞—Б—В–Њ—В—Г –њ–Њ–Ј–і–љ–Є—Е —В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є—Е —Н—Д—Д–µ–Ї—В–Њ–≤.
–Ю—Ж–µ–љ–Ї–∞ –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є –њ—А–Њ—В–Є–≤–Њ–Њ–њ—Г—Е–Њ–ї–µ–≤–Њ–є —В–µ—А–∞–њ–Є–Є –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –≤–∞–ґ–љ—Л–є –∞—Б–њ–µ–Ї—В –Ї–∞–Ї —Б —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –Ї–∞–ґ–і–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞ –≤ –Њ—В–і–µ–ї—М–љ–Њ—Б—В–Є, —В–∞–Ї –Є –і–ї—П –Њ–±—Й–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Ј–і—А–∞–≤–Њ–Њ—Е—А–∞–љ–µ–љ–Є—П –≤ —Ж–µ–ї–Њ–Љ. –Я–Њ –Љ–µ—А–µ –≤—Л—Е–Њ–і–∞ –љ–∞ —Д–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–µ—Б–Ї–Є–є —А—Л–љ–Њ–Ї –љ–Њ–≤—Л—Е –њ—А–Њ—В–Є–≤–Њ–Њ–њ—Г—Е–Њ–ї–µ–≤—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –∞–љ–∞–ї–Є–Ј –Є—Е –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –і–ї—П –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є —А–∞–±–Њ—В—Л —Б–µ—А–і—Ж–∞ –Є –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л–є –Љ–Њ–љ–Є—В–Њ—А–Є–љ–≥ —Б–µ—А–і–µ—З–љ–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є –њ—А–Є–Њ–±—А–µ—В–∞–µ—В –Ї–ї—О—З–µ–≤–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ. –Т —Е–Њ–і–µ –≤—Б–µ—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –ї–∞–њ–∞—В–Є–љ–Є–±–∞ –њ—А–Њ–≤–Њ–і–Є–ї—Б—П —А–µ–≥—Г–ї—П—А–љ—Л–є –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л–є –Љ–Њ–љ–Є—В–Њ—А–Є–љ–≥ —Б–µ—А–і–µ—З–љ–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є. –Э–µ –Є—Б–Ї–ї—О—З–µ–љ–Њ, —З—В–Њ –≤ –љ–∞—Б—В–Њ—П—Й–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Є—Б—В–Є–љ–љ–∞—П —З–∞—Б—В–Њ—В–∞ –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є –љ–∞—А—Г—И–µ–љ–Є–є –≤ —А–∞–±–Њ—В–µ —Б–µ—А–і—Ж–∞ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Ј–∞–≤—Л—И–µ–љ–∞ –Є–ї–Є –Ј–∞–љ–Є–ґ–µ–љ–∞. –Ю–љ–Њ –≤–Ї–ї—О—З–∞–µ—В —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ—А–Њ–і–Њ–ї–ґ–∞—О—Й–Є—Е—Б—П —Б–ї–µ–њ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ—А–Њ–≤–Њ–і—П—Й–Є—Е—Б—П –≤ –≥—А—Г–њ–њ–∞—Е –±–Њ–ї—М–љ—Л—Е, –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–≥–ї–Є –Є –љ–µ –њ–Њ–ї—Г—З–∞—В—М –ї–∞–њ–∞—В–Є–љ–Є–±, –љ–Њ –Ї–ї–∞—Б—Б–Є—Д–Є—Ж–Є—А–Њ–≤–∞–ї–Є—Б—М, –Ї–∞–Ї –њ—А–Є–љ–Є–Љ–∞–≤—И–Є–µ —Н—В–Њ—В –њ—А–µ–њ–∞—А–∞—В. –Ъ—А–Є—В–µ—А–Є–µ–Љ –≤–µ—А–Є—Д–Є–Ї–∞—Ж–Є–Є –љ–∞—А—Г—И–µ–љ–Є–є —Б–µ—А–і–µ—З–љ–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є —П–≤–ї—П–ї–Њ—Б—М —Б–љ–Є–ґ–µ–љ–Є–µ –≤–µ–ї–Є—З–Є–љ—Л –§–Т–Ы–Ц –љ–∞ 20% –Є –±–Њ–ї–µ–µ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Є—Б—Е–Њ–і–љ—Л–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–Љ –Є –µ–µ –Ј–љ–∞—З–µ–љ–Є–µ –љ–Є–ґ–µ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ–Њ–є –≥—А–∞–љ–Є—Ж—Л –љ–Њ—А–Љ—Л. –Ю–і–љ–∞–Ї–Њ –љ–µ–њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ—Б—В—М –≤ –Њ—Ж–µ–љ–Ї–µ –§–Т–Ы–Ц –Љ–Њ–≥–ї–∞ –њ—А–Є–≤–µ—Б—В–Є –Ї —В–Њ–Љ—Г, —З—В–Њ –≤ —Б–ї—Г—З–∞–µ —Б–ї–∞–±–Њ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–≥–Њ —В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –і–∞–љ–љ—Л–µ –љ–µ–Ї–Њ—В–Њ—А—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–µ –≤–Ї–ї—О—З–∞–ї–Є—Б—М –≤ –∞–љ–∞–ї–Є–Ј. –Ф–∞–ї–µ–µ, —А–µ–Ј—Г–ї—М—В–∞—В—Л –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –§–Т–Ы–Ц –љ–µ–ї—М–Ј—П —Б—З–Є—В–∞—В—М —Б–∞–Љ—Л–Љ –Њ–њ—В–Є–Љ–∞–ї—М–љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ –і–ї—П –Њ—Ж–µ–љ–Ї–Є –Ї–Њ—А—А–µ–ї—П—Ж–Є–Є –Љ–µ–ґ–і—Г –њ—А–Є–љ–Є–Љ–∞–µ–Љ—Л–Љ –ї–µ–Ї–∞—А—Б—В–≤–Њ–Љ –Є –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–µ–Љ –љ–∞—А—Г—И–µ–љ–Є–є –≤ —А–∞–±–Њ—В–µ —Б–µ—А–і—Ж–∞, –њ–Њ—В–Њ–Љ—Г —З—В–Њ –Њ–љ–Є –љ–µ –њ–Њ–Ј–≤–Њ–ї—П—О—В –Њ—В–і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞—В—М —Н—Д—Д–µ–Ї—В—Л –њ—А–µ–њ–∞—А–∞—В–∞ –Њ—В –і—А—Г–≥–Є—Е –≤–ї–Є—П–љ–Є–є (–љ–∞–њ—А–Є–Љ–µ—А, –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е) –Є–ї–Є –Ї–Њ–ї–µ–±–∞–љ–Є–є –Є—Б—В–Є–љ–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є–є —Д—А–∞–Ї—Ж–Є–Є –≤—Л–±—А–Њ—Б–∞ –≤ —А–∞–Љ–Ї–∞—Е –Њ–і–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П.
–Ъ–∞–Ї –Є –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –њ–Њ–њ—Г–ї—П—Ж–Є–Є –ї–Є—Ж, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –њ—А–Њ—В–Є–≤–Њ–Њ–њ—Г—Е–Њ–ї–µ–≤–Њ–µ –ї–µ—З–µ–љ–Є–µ, —П–≤–ї–µ–љ–Є—П —Б–Њ —Б—В–Њ—А–Њ–љ—Л —Б–µ—А–і—Ж–∞ –≤ –Ї–Њ–≥–Њ—А—В–µ –Є—Б–њ—Л—В—Г–µ–Љ—Л—Е, –Ї–Њ—В–Њ—А—Л–Љ –љ–∞–Ј–љ–∞—З–Є–ї–Є –ї–∞–њ–∞—В–Є–љ–Є–±, –±—Л–ї–Є —А–µ–і–Ї–Є–Љ–Є –Є –≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –Њ–±—А–∞—В–Є–Љ—Л–Љ–Є [26,27]. –Т –ї—О–±–Њ–Љ —Б–ї—Г—З–∞–µ, —Б–ї–µ–і—Г–µ—В –і–Њ–ґ–і–∞—В—М—Б—П —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –і—А—Г–≥–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ—А–µ–ґ–і–µ —З–µ–Љ —Д–Њ—А–Љ—Г–ї–Є—А–Њ–≤–∞—В—М –Њ–Ї–Њ–љ—З–∞—В–µ–ї—М–љ—Л–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ —З–∞—Б—В–Њ—В–µ –Њ—Ж–µ–љ–Ї–Є –§–Т–Ы–Ц —Г –±–Њ–ї—М–љ—Л—Е, –љ–∞—Е–Њ–і—П—Й–Є—Е—Б—П –љ–∞ —В–µ—А–∞–њ–Є–Є –ї–∞–њ–∞—В–Є–љ–Є–±–Њ–Љ. –Я–Њ–Ї–∞ –ґ–µ –Љ—Л –њ—А–µ–і–ї–∞–≥–∞–µ–Љ –њ—А–Њ–≤–Њ–і–Є—В—М –Љ–Њ–љ–Є—В–Њ—А–Є–љ–≥ —Б–µ—А–і–µ—З–љ–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є –Ї–∞–ґ–і—Л–µ 3 –Љ–µ—Б—П—Ж–∞ –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –∞–і—К—О–≤–∞–љ—В–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –ї–∞–њ–∞—В–Є–љ–Є–±–Њ–Љ.
–Т 2007 –≥. –±—Л–ї–Њ –Ј–∞–њ—Г—Й–µ–љ–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ III —Д–∞–Ј—Л ALTTO (–Ю–њ—В–Є–Љ–Є–Ј–∞—Ж–Є—П –∞–і—К—О–≤–∞–љ—В–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –ї–∞–њ–∞—В–Є–љ–Є–±–Њ–Љ –Є/–Є–ї–Є —В—А–∞—Б—В—Г–Ј—Г–Љ–∞–±–Њ–Љ), –і–ї—П –Ї–Њ—В–Њ—А—Л—Е –±—Л–ї–Њ –Њ—В–Њ–±—А–∞–љ–Њ 8000 –њ–∞—Ж–Є–µ–љ—В–Њ–Ї. –Ф–Є–Ј–∞–є–љ —Н—В–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–ї –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ–µ —Б—А–∞–≤–љ–µ–љ–Є–µ –ї–∞–њ–∞—В–Є–љ–Є–±–∞ –Є —В—А–∞—Б—В—Г–Ј—Г–Љ–∞–±–∞ —Б —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –Є—Е –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –і–ї—П —Б–µ—А–і–µ—З–љ–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є. –Ф–ї—П –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –њ—А–Њ—Д–Є–ї—П –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –≤ —Н—В–Њ–є –њ–Њ–њ—Г–ї—П—Ж–Є–Є –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ—В—Б—П –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –Ї–∞—А–і–Є–Њ–Љ–Њ–љ–Є—В–Њ—А–Є–љ–≥–∞, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –Є –љ–∞ –Њ—В–і–∞–ї–µ–љ–љ—Л—Е —Б—А–Њ–Ї–∞—Е.
–Я—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л–µ –і–∞–љ–љ—Л–µ –њ–Њ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –ї–∞–њ–∞—В–Є–љ–Є–±–∞ –і–ї—П —А–∞–±–Њ—В—Л —Б–µ—А–і—Ж–∞, —Б–Њ–±—А–∞–љ–љ—Л–µ –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е —Б –Љ–µ—В–∞—Б—В–∞–Ј–Є—А—Г—О—Й–Є–Љ —А–∞–Ї–Њ–Љ, –≤–µ—Б—М–Љ–∞ –Њ–±–љ–∞–і–µ–ґ–Є–≤–∞—О—В. –С–µ–Ј—Г—Б–ї–Њ–≤–љ–Њ, –љ–Є–Ј–Ї–∞—П —З–∞—Б—В–Њ—В–∞ –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є —П–≤–ї–µ–љ–Є–є —Б–Њ —Б—В–Њ—А–Њ–љ—Л —Б–µ—А–і—Ж–∞ (60 –Є–Ј 3689 –Є—Б–њ—Л—В—Г–µ–Љ—Л—Е, –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–≤—И–Є—Е –ї–∞–њ–∞—В–Є–љ–Є–±) –Њ–≥—А–∞–љ–Є—З–Є–≤–∞–µ—В –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –Є–Ј—Г—З–µ–љ–Є—П –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ –Є–ї–Є —Б—А–∞–≤–љ–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ–Њ–є –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Љ–∞–љ–Є—Д–µ—Б—В–Є—А—Г—О—Й–µ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–µ–є –Ы–Ц. –Ю—В—Б—Г—В—Б—В–≤–Є–µ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П (–Ј–∞—З–∞—Б—В—Г—О –≤—Б–ї–µ–і—Б—В–≤–Є–µ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –Њ—Б–љ–Њ–≤–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –∞ –љ–µ –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –њ–Њ–ї—Г—З–Є—В—М —А–µ–Ј—Г–ї—М—В–∞—В—Л –љ–∞–±–ї—О–і–µ–љ–Є–є –≤ —В–µ—З–µ–љ–Є–µ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ–≥–Њ —Б—А–Њ–Ї–∞) —В–∞–Ї–ґ–µ –љ–µ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –≤—Л—П–≤–Є—В—М —Д–∞–Ї—В–Њ—А—Л, –і–µ—В–µ—А–Љ–Є–љ–Є—А—Г—О—Й–Є–µ —Б–њ–Њ–љ—В–∞–љ–љ–Њ–µ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ –љ–Њ—А–Љ–∞–ї—М–љ–Њ–≥–Њ —Д—Г–љ–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –Ы–Ц, —Б–Њ—Е—А–∞–љ–µ–љ–Є–µ –µ–≥–Њ —А–∞–±–Њ—В—Л –љ–∞ –њ—А–µ–ґ–љ–µ–Љ —Г—А–Њ–≤–љ–µ –Є–ї–Є –і–∞–ї—М–љ–µ–є—И–µ–µ —Г—Е—Г–і—И–µ–љ–Є–µ.
–°–Њ–≥–ї–∞—Б–љ–Њ –њ–Њ–ї—Г—З–µ–љ–љ—Л–Љ –і–∞–љ–љ—Л–Љ –љ–∞—А—Г—И–µ–љ–Є—П —Б–µ—А–і–µ—З–љ–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є –≤—Б—В—А–µ—З–∞–ї–Є—Б—М —А–µ–і–Ї–Њ, –∞ –њ–∞–і–µ–љ–Є–µ –§–Т–Ы–Ц –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–Є–Ї–Њ–≥–і–∞ –љ–µ –±—Л–ї–Њ —А–µ–Ј–Ї–Є–Љ. –≠—В–Є —П–≤–ї–µ–љ–Є—П –љ–µ –Є–Љ–µ–ї–Є —В–µ–љ–і–µ–љ—Ж–Є–Є –Ї —Г—Е—Г–і—И–µ–љ–Є—О, –Є –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М —З–∞—Б—В–Є—З–љ–Њ–µ –Є–ї–Є –њ–Њ–ї–љ–Њ–µ –≤—Л–Ј–і–Њ—А–Њ–≤–ї–µ–љ–Є–µ. –Я–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –±–Њ–ї—М–љ—Л–µ, —А–∞–љ–µ–µ –њ–Њ–ї—Г—З–∞–≤—И–Є–µ –∞–љ—В—А–∞—Ж–Є–Ї–ї–Є–љ—Л, –љ–µ –Є–Љ–µ–ї–Є –њ—А–µ–і—А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ–Њ—Б—В–Є –Ї –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ—Л–Љ, –±–Њ–ї–µ–µ —З–∞—Б—В—Л–Љ –Є–ї–Є –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ –љ–∞—А—Г—И–µ–љ–Є—П–Љ –≤ —А–∞–±–Њ—В–µ —Б–µ—А–і—Ж–∞, —З–µ–Љ –њ–∞—Ж–Є–µ–љ—В—Л, –Ї–Њ—В–Њ—А—Л–Љ –љ–∞–Ј–љ–∞—З–∞–ї–Є —В—А–∞—Б—В—Г–Ј—Г–Љ–∞–± –Є–ї–Є –Є–љ—Л–µ –≤–Є–і—Л —В–µ—А–∞–њ–Є–Є.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Р–љ–∞–ї–Є–Ј —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ 44 –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –ї–∞–њ–∞—В–Є–љ–Є–±–∞ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ –љ–Є–Ј–Ї–Њ–Љ —Г—А–Њ–≤–љ–µ –µ–≥–Њ –Ї–∞—А–і–Є–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В–Є. –Э–∞—А—Г—И–µ–љ–Є—П —Б–µ—А–і–µ—З–љ–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є —З–∞—Й–µ –≤—Б–µ–≥–Њ –њ—А–Њ—В–µ–Ї–∞–ї–Є –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ–Њ –Є –њ—А–Њ—П–≤–ї—П–ї–Є—Б—М –Њ–±—А–∞—В–Є–Љ—Л–Љ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –§–Т–Ы–Ц. –І–∞—Б—В–Њ—В–∞ –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є —Н—В–Є—Е —П–≤–ї–µ–љ–Є–є –±—Л–ї–∞ –Њ–і–Є–љ–∞–Ї–Њ–≤–Њ–є –≤–љ–µ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –ї–µ—З–µ–љ–Є—П –љ–∞ –њ—А–µ–і—Л–і—Г—Й–Є—Е —Н—В–∞–њ–∞—Е –∞–љ—В—А–∞—Ж–Є–Ї–ї–Є–љ–∞–Љ–Є –Є–ї–Є —В—А–∞—Б—В—Г–Ј—Г–Љ–∞–±–Њ–Љ.
–†–µ—Д–µ—А–∞—В –њ–Њ–і–≥–Њ—В–Њ–≤–ї–µ–љ –Х.–С. –Ґ—А–µ—В—М—П–Ї
–њ–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞–Љ —Б—В–∞—В—М–Є
E.A. Perez, M. Koehler, J. Byrne et al.
«Cardiac Safety of Lapatinib: Pooled Analysis of 3689 Patients
Enrolled in Clinical Trials”
Mayo Clinic Proc. June 2008, 83(6): 679–686



–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. Tykerb [package insert]. Research Triangle Park, NC: GlaxoSmithKline; 2007. http://us.gsk.com/ products/assets/us_tykerb.pdf. Accessed April 30, 2008.
2. Geyer CE, Forster J, Lindquist D, et al. Lapatinib plus capecitabine for HER2–postitive advanced breast cancer [published correction appears in N Engl J Med. 2007;356(14):1487]. N Engl J Med. 2006;355(26):2733–2743.
3. Chien KR. Stress pathways and heart failure. Cell. 1999;98(5):555–558.
4. Crone SA, Zhao YY, Fan L, et al. ErbB2 is essential in the prevention of dilated cardiomyopathy. Nat Med. 2002;8(5):459–465.
5. Piccart–Gebhart MJ, Procter M, Leyland–Jones B, et al, Herceptin Adjuvant (HERA) Trial Study Team. Trastuzumab after adjuvant chemotherapy in HER2–positive breast cancer. N Engl J Med. 2005;353(16):1659–1672.
6. Romond EH, Perez EA, Bryant J, et al. Trastuzumab plus adjuvant chemotherapy for operable HER2–positive breast cancer. N Engl J Med. 2005; 353(16):1673–1684.
7. Tan–Chiu E, Yothers G, Romond E, et al. Assessment of cardiac dysfunction in a randomized trial comparing doxorubicin and cyclophosphamide followed by paclitaxel, with or without trastuzumab as adjuvant therapy in node–positive, human epidermal growth factor receptor 2–overexpressing breast cancer: NSABP B–31. J Clin Oncol. 2005;23(31):7811–7819.
8. Herceptin [package insert]. South San Francisco, CA: Genentech, Inc; 2006. http://www.fda.gov/ medwatch/safety/2005/Herceptin_Promo_PDF_Feb_2005.pdf. Accessed April 30, 2008.
9. Slamon D, Eiermann W, Robert N, et al, for the Breast Cancer International Research Group. Phase III trial comparing AC–T with AC–TH and with TCH in the adjuvant treatment of HER2 positive early breast cancer patients: second interim efficacy analysis. Abstract presented at: 29th Annual San Antonio Breast Cancer Symposium; San Antonio, TX; December 14–17; 2006.
10. Perez EA, Suman VJ, Davidson NE, et al. Cardiac safety analysis of doxorubicin and cyclophosphamide followed by paclitaxel with or without trastuzumab in the North Central Cancer Treatment Group N9831 Adjuvant Breast Cancer Trial. J Clin Oncol. 2008;26(8):1231–1238.
11. Ewer MS, Lippman, SM. Type II chemotherapy–related cardiac dysfunction: time to recognize a new entity. J Clin Oncol. 2005;23(13):2900–2902.
12. Perez EA. Cardiac toxicity of ErbB2–targeted therapies: what do we know? Clin Breast Cancer. 2008;8(suppl 3):S114–S120.
13. National Cancer Institute. Cancer Therapy Evaluation Program: common terminology criteria for adverse events, v3.0. (CTCAE) Aug 9, 2006. http://ctep.cancer.gov/forms/CTCAEv3.pdf. Accessed December 17, 2007.
14. Kruskal WH, Wallis WA. Use of ranks in one–criterion variance analysis.J Am Statistical Assoc. 1952;47(260):583–621.
15. Braga S, dal Lago L, Bernard C, Cardoso F, Piccart M. Use of trastuzumab for the treatment of early stage breast cancer. Expert Rev Anticancer Ther. 2006;6(8):1153–1164.
16. Kabe KL, Kolesar JM. Role of trastuzumab in adjuvant therapy for locally invasive breast cancer. Am J Health Syst Pharm. 2006;63(6):527–533.
17. Ng R, Better N, Green MD. Anticancer agents and cardiotoxicity. Semin Oncol. 2006;33(1): 2–14.
18. Yeh ET. Cardiotoxicity induced by chemotherapy and antibody therapy. Annu Rev Med. 2006;57: 485–498.
19. Kerkela R, Grazette L, Yacobi R, et al. Cardiotoxicity of the cancer therapeutic agent imatinib mesylate. Nat Med. 2006 Aug 12;12(8):908–916. Epub 2006 Jul 23.
20. Miller KD, Chap LI, Holmes FA, et al. Randomized phase III trial of capecitabine compared with bevacizumab plus capecitabine in patients with previously treated metastatic breast cancer. J Clin Oncol. 2005;23(4):792–799.
21. Sutent [package insert]. New York, NY: Pfizer Inc; 2006. http://www.pfizer.com/files/products/ uspi_sutent.pdf. Accessed April 30, 2008.
22. Seidman A, Hudis C, Pierri MK, et al. Cardiac dysfunction in the trastuzumab clinical trials experience. J Clin Oncol. 2002;20(5):1215–1221.
23. Zambetti M, Moliterni A, Materazzo C, et al. Long–term cardiac sequelae in operable breast cancer patients given adjuvant chemotherapy with or without doxorubicin and breast irradiation. J Clin Oncol. 2001;19(1):37–43.
24. Shepherd LE, Parulekar W, Pritchard KI, et al. Left ventricular function following adjuvant chemotherapy for breast cancer: the NCIC CTG MA5 experience [abstract 522]. J Clin Oncol. 2006;24(June 20)(suppl):18s.
25. Jones LW, Haykowsky M, Peddle CJ, et al. Cardiovascular risk profile of breast cancer patients treated with anthracycline–taxane containing adjuvant chemotherapy and/or trastuzumab [abstract 666]. J Clin Oncol. 2006;24(June 20)(suppl):18s.
26. Yeh ET, Tong AT, Lenihan DJ, et al. Cardiovascular complications of cancer therapy: diagnosis, pathogenesis, and management. Circulation. 2004;109(25):3122–3131.
27. Youssef G, Links M. The prevention and management of cardiovascular complications of chemotherapy in patients with cancer. Am J Cardiovasc Drugs. 2005;5(4):233–243.








.gif)



