Рациональность применения адъювантной химиотерапии при раке толстой кишки основывается на представлениях о наличии микрометастазов после удаления определяемого опухолевого очага. Стандартные режимы с включением 5–фтроурацила и кальция фолината показали свою эффективность в адъювантных схемах после резекции толстой кишки по поводу рака, особенно с метастазами в регионарные лимфоузлы [1]. Так, при наличии более 5 пораженных метастазами регионарных лимфоузлов 5–летняя выживаемость составила 44% в группе с адъювантной химиотерапией против 29% в группе наблюдения (р<0,003); при поражении менее 5 лимфоузлов – 71% и 58% соответственно (р<0,001); среди пациентов без метастазов в лимфоузлы – 80% и 81% (p=1,0).
Проведенное многоцентровое исследование (MOSAIC) по изучению системной химиотерапии в виде инфузии 5–фторурацила и кальция фолината (5FU/LV) (в сочетании с Элоксатином или без него) в адъювантном режиме по поводу рака толстой кишки показало, что у пациентов с III стадией послеоперационная химиотерапия FOLFOX позволила улучшить отдаленные результаты по сравнению со схемой 5FU/LV [17]. Добавление Элоксатина к стандартной адъювантной терапии у пациентов с III стадией рака ободочной кишки при 6–летнем наблюдении снижает риск развития рецидива на 22%, риск смерти – на 20%. Аналогичные результаты получены в исследовании NSABP С–07, показавшем преимущество схемы FLOX (двухчасовая инфузия Элоксатина 85 мг/м2 в 1, 15 и 29 дни в сочетании с еженедельным болюсным введением фторурацила и двухчасовой инфузией кальция фолината) над схемой 5FU/LV [18]. Оценивалась бессобытийная выживаемость, в группе FLOX относительный риск составил 0,81 (95% ДИ 0,69–0,94).
Напротив, добавление иринотекана к фторурацилсодержащей схеме не привело к улучшению отдаленных результатов по сравнению со стандартной химиотерапией [13].
Адъювантная химиотерапия после удаления печеночных метастазов рака толстой кишки может улучшить отдаленные результаты лечения. Это показано в рандомизированном исследовании, сравнивающем результаты комбинированной терапии больных с метастазами рака толстой кишки в печени с результатами чисто хирургического лечения. Группе из 86 пациентов после хирургического этапа проведено 6 курсов химиотерапии по схеме 5–фторурацил 400 мг/м2 внутривенно струйно с предварительным введением кальция фолината 200 мг/м2 внутривенно струйно, 1–5 дни, каждые 28 дней. Токсические эффекты 3–4 степени развились у 24,7% (20 пациентов), наиболее частыми были гематологическая токсичность, стоматит, рвота, диарея, нейропатия. В контрольную группу вошли 87 больных. Пятилетняя общая и безрецидивная выживаемость составила 51,1% и 33,5% в группе больных с химиотерапией после резекции печени и 41,1% и 26,7% в группе контроля, соответственно [5]. Получено достоверное (0,028) увеличение показателей безрецидивной выживаемости при комбинированном лечении, но улучшение общей выживаемости оказалось статистически недостоверно (p=0,13).
Целесообразность регионарной химиотерапии после резекции печени обусловлена высоким уровнем изолированного внутрипеченочного рецидива. Кроме того, возможно подведение более высоких доз химиопрепаратов без увеличения системной токсичности. Проведено несколько рандомизированных исследований, показывающих эффективность внутриартериальной внутрипеченочной инфузии или комбинированной внутрипеченочной и системной химиотерапии после резекции печени, позволяющих увеличить общую и/или безрецидивную выживаемость в сравнении с системной химиотерапией или наблюдением [5–9]. Тем не менее существуют работы, опровергающие успех адъювантной регионарной терапии, что, учитывая вероятность специфических побочных эффектов (миграция катетера, склерозирующий холангит, тромбогеморрагические и инфекционные осложнения), не оправдывает, по мнению авторов, использование данного метода в рутинной клинической практике [10,11].
Материалы и методы
Материалом для работы послужили 416 историй болезни пациентов с метастазами колоректального рака в печени, находившихся на лечении в хирургическом отделении опухолей печени и поджелудочной железы ГУ «РОНЦ им Н.Н. Блохина» РАМН с 1990 по 2007 г. В анализ включены больные, которым проведено хирургическое или комбинированное лечение. У всех пациентов морфологически подтвержден рак толстой кишки.
Всего выполнено 454 операции на печени по поводу метастазов рака толстой кишки. Повторные резекции при внутрипеченочном прогрессировании выполнены 41 пациенту, два пациента трижды подвергались вмешательству на печени по поводу метастазов колоректального рака (КРР). Синхронно с первичным очагом метастазы в печени выявлены у 180 пациентов (39,6%).
Преобладали операции в объеме гемигепатэктомии и больше – 63,2%. В 31 случае, помимо резекции печени, были применены методы локальной деструкции метастазов (6,8%) – радиочастотная термоаблация и/или криодеструкция. Эмболизация правой воротной вены с целью гипертрофии левой доли и снижения риска печеночной недостаточности в послеоперационном периоде выполнена 13 пациентам.
Условно радикальные операции (Ro) удалось выполнить в 399 случаях (87,9%). Опухолевые клетки по краю резекции (R1) выявлены у 11 пациентов (2,4%). Паллиативные операции с оставлением макроскопически определяемой опухолевой ткани (R2) выполнены 44 больным (9,7%).
Мужчины и женщины подвергались резекции печени по поводу метастазов КРР в печени одинаково часто – 48,7% и 51,3%. Средний возраст пациентов составил 54,7±8,3 года (от 25 лет до 81 года).
Чаще метастазы поражали правую долю печени – 218 случаев (48,1%). В левой доле метастазы на момент операции выявлены в 81 случае (17,8%), обе доли были поражены у 155 пациентов (34,1%). Операции по поводу солитарных метастазов выполнены в 227 случаях (50,0%), единичных – в 116 (25,6%), множественных – в 111 (24,4%).
При билобарном поражении печени в случае выполнения обширной резекции на стороне большего поражения часто необходимо выполнение вмешательства на контралатеральной доле. В нашем отделении подобные операции проведены 62 пациентам (21,6%). Предпочтение отдаем экономной резекции – 42 пациента (67,7%). Локальная деструкция метастазов на стороне меньшего поражения после гемигепатэктомии выполнена 20 пациентам (32,3%).
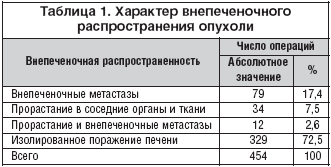
Оценено внепеченочное распространение опухоли (табл. 1). При непосредственном распространении опухоли на соседние органы и ткани выполнялась резекция пораженных структур – 46 пациентов (10,1%). У 12 из них инфильтрация рядом расположенных структур сочеталась с внепеченочными метастазами. Чаще всего производилась резекция диафрагмы – 28 случаев (6,2%), во всех случаях пластика осуществлялась местными тканями. Распространение на паранефральную клетчатку и/или надпочечник отмечено в 12 случаях (2,6%). Резекция нижней полой вены выполнена в семи случаях (1,5%), воротной – в двух (0,5%). Также дважды (0,5%) выполнялась резекция внепеченочных желчных протоков.
При наличии резектабельных внепеченочных метастазов в 73 случаях осуществлено их полное удаление, в 18 пришлось выполнить паллиативные операции с оставлением макроскопически определяемой опухоли. Наиболее частая локализация внепеченочных метастазов – 37 пациентов – лимфоузлы ворот печени, общей печеночной артерии и чревного ствола (40,7%).
У 17 пациентов на момент операции внепеченочные метастазы определялись в двух и более зонах.
Средний объем кровопотери при выполнении предельно обширной резекции печени (2235,6 мл) достоверно выше, чем при стандартной гемигепатэктомии (1439,4 мл, р=0,0001). При экономной резекции этот показатель ниже, чем при гемигепатэктомии (965,4 мл, р<0,0001). Кровопотеря вне зависимости от объема операции составила 1396,2 мл.
Переливание эритроцитарной массы проводилось 128 больным, что составило 28,2%, но этот показатель также зависит от объема операции. При экономных вмешательствах на печени переливание крови потребовалось 30 больным (18%), что ниже (р=0,019) по сравнению с частотой гемотрансфузий при выполнении стандартной гемигепатэктомии – 29%. Значительно чаще (р=0,0017) массивное кровотечение, требующее гемотрансфузии, сопровождало предельно обширные резекции печени — в 50% случаев (36 операций).
Перед предполагаемой обширной резекцией печени 13 больным в связи с небольшими размерами левой доли печени и планируемой операцией в объеме правосторонней гемигепатэктомии в стандартном или расширенном варианте, была выполнена эмболизация правой ветви воротной вены с целью гипертрофии левой доли и увеличения объема остающейся паренхимы печени (future remnant liver volume).
С 1997 г. в отделении после резекции печени стали использовать послеоперационную химиотерапию. В общей сложности ее получили 311 больных. У 136 пациентов в качестве адъювантной терапии использовали комбинацию 5–фторурацила и кальция фолината, у 149 – Элоксатина, 5–фторурацила и кальция фолината. Остальные 26 пациентов в силу разных причин получили другие схемы химиотерапии с включением ралтитрексида, капецитабина, иринотекана, бевацизумаба.
Комбинация 5–фторурацила и кальция фолината (5–фторурацил 600 мг/м2/сут. в виде 96–часовой инфузии, кальция фолинат 100 мг/м2 в сутки – струйно 1–4–й дни, каждые 28 дней) использовалась до 2004 г., в дальнейшем применяли режим FOLFOX–6 в модификации отделения клинической фармакологии и химиотерапии РОНЦ (Элоксатин 100 мг/м2 в виде двухчасовой инфузии на 5% декстрозе, кальция фолинат 200 мг/м2 – двухчасовая инфузия, 5–фторурацил 400 мг/м2 болюсное введение, с последующим введением 5–фторурацила 2400–3000 мг/м2 в виде 46–часовой инфузии). Интервал между курсами – две недели.
Химиотерапию по той или иной схеме начинали через 2–8 недель после операции на печени. Первый курс проводили регионарно, в печеночную артерию через установленный под рентгенологическим контролем катетер. Последующие курсы вводили внутривенно (при наличии внепеченочных метастазов проводилась только системная химиотерапия).
С целью профилактики тошноты и рвоты за 30–60 мин. до начала химиотерапии вводили антагонисты серотониновых рецепторов (наиболее часто — ондансетрон 8 мг внутривенно или 16 мг перорально) и глюкокортикоиды (дексаметазон 8 мг внутривенно). При развитии гастроинтестинальной токсичности в виде тошноты и рвоты также назначали блокаторы 5НТ3–рецепторов дополнительно.
Побочные эффекты и токсичность регионарной и системной химиотерапии оценивали при осмотре и опросе больного и по данным лабораторных показателей (еженедельно). Степень токсичности определяли согласно критериям National Cancer Institute Common Toxicity Criteria, третья версия. Частоту побочных эффектов рассчитывали на число пациентов.
При проведении регионарного курса, помимо нежелательного системного воздействия цитостатиков, возможно развитие местных осложнений. В связи с этим, весь период внутриартериальной инфузии больные находились под наблюдением медицинского персонала. Ангиографический контроль после установки катетера и тщательное наблюдение за больным позволяют снизить частоту осложнений, связанных с неправильной перфузией цитостатика: образование острых язв желудочно–кишечного тракта вследствие воздействия препарата в высоких концентрациях на стенку полого органа. Строгий постельный режим, контроль за состоянием кожных покровов и измерение пульсации на артериях нижних конечностей в течение всего периода регионарной химиотерапии и первых суток после удаления катетера позволяют избежать тромботических и ишемических осложнений.
Использовались стандартные критерии начала и продолжения лечения: абсолютное число нейтрофилов периферической крови ≥1500 клеток, число тромбоцитов ≥100 тыс., уровень гемоглобина выше 9 г/дл, уровень общего билирубина не превышает двукратного значения верхней границы нормы (ВГН), активность АЛТ и АСТ > 3 × ВГН, уровень креатинина > 1,25 × ВГН, диарея и стоматит отсутствуют или не более чем первой степени, другая токсичность не более второй степени.
При несоответствии критериям проведение химиотерапии откладывали до снижения токсичности до первой степени, дозы препаратов редуцировали. В течение первых двух курсов доза 5FU — 2400 мг/м2. Если не развивается токсичность более 1–й степени, к 3–му курсу доза 5FU повышалась до 3000 мг/м2.
При развитии нейтропении 4–й степени (абсолютное число нейтрофилов менее 1,5 тыс./дл), тромбоцитопении выше 1 степени (число тромбоцитов менее 100 тыс/дл), а также диареи 4–й степени или другой значительной негематологической токсичности, проведение очередного курса откладывали до момента, когда состояние пациента придет в соответствие с критериями продолжения химиотерапии. При проведении последующих курсов дозу 5–фторурацила редуцировали с 3000 мг/м2 до 2400 мг/м2, а с 2400 мг/м2 до 2000 мг/м2.
Редукцию доз Элоксатина до 75 мг/м2 производили в следующих случаях: если развивалась нейтропения 4–й степени, тромбоцитопения 3–4–й степени, диарея 4–й степени. В случае возникновения парестезии 2–й степени, дозу Элоксатина также уменьшали: вначале до 75 мг/м2, затем, если не отмечается регрессии симптомов, – до 50 мг/м2.
Каждому больному планировали проведение 6 курсов химиотерапии, а при наличии внепеченочных метастазов – не менее 8 курсов. Среднее число курсов, полученных больными, составило 4,7 (от 2 до 8). Уменьшение длительности лечения было обусловлено токсичностью (n=4), прогрессированием (n=14), отказом от продолжения лечения (n=32).
Характеристика пациентов и результаты исследования
В зависимости от вида лечения (хирургическое или комбинированное) больные разделены на две группы: резекция печени выполнена 143 пациентам, операция в сочетании с последующей химиотерапией по схеме FOLFOX или 5FU/LV – 285 человекам. Проведена сравнительная характеристика этих групп. Не получено достоверного различия в распределении больных по возрасту, полу и локализации первичной опухоли. Также не выявлено статистической разницы в распространенности метастатического процесса на момент резекции печени, но при этом в группе комбинированного лечения достоверно чаще (29,5% против 18,9%, р=0,025) выполнялись дополнительные манипуляции на печени (резекция контрлатеральной доли, РЧА, криодеструкция опухолевых узлов, сочетание методов).
В группе пациентов с послеоперационной химиотерапией у 126 пациентов (44%) расстояние от края опухоли до линии резекции было менее 10 мм, тогда как в группе хирургического лечения – в 13 случаях (9%), разница статистически достоверна, р<0,0001.
Интраоперационная кровопотеря более 2 л достоверно чаще имела место в группе хирургического лечения (25,9% против 12,3%, р=0,0007), при этом частота гемотрансфузий статистически не различалась, р=0,07.
Таким образом, можно сделать вывод, что группы хирургического и комбинированного лечения сравнимы по основным клиническим характеристикам, однако в группе с послеоперационной химиотерапией чаще выполнялись дополнительные манипуляции на печени. Также эти пациенты значительно чаще подвергались резекции печени с расстоянием от опухоли до линии резекции менее 10 мм (прогностически неблагоприятный фактор).
Группа комбинированного лечения разделена на две подгруппы в зависимости от схемы послеоперационной химиотерапии – 136 пациентам проведена химиотерапия по схеме 5FU/LV, 149 больным – FOLFOX. Группы не отличались по возрасту, полу, локализации первичной опухоли, времени выявления метастазов, размеру наибольшего метастаза, величине интраоперационной кровопотери и частоте послеоперационных осложнений. Однако следует отметить, что в группе больных, которым проводилась послеоперационная химиотерапия с использованием Элоксатина, достоверно чаще выполнялись операции при большей распространенности заболевания. Так, поражение обеих долей печени диагностировано у 44,3% против 27,2%, р=0,004, множественные метастазы выявлены у 32,9% против 16,2%, р=0,0018. На момент операции чаще определялись внепеченочные очаги (20,1% против 8,1%, р=0,006). Частота выполнения паллиативных (16,1% против 3%, р=0,0004) и повторных (9,4% против 3%, р=0,046) резекций печени также достоверно выше в этой группе.
Таким образом, у пациентов, которым проведена химиотерапия по схеме FOLFOX, достоверно чаще выявлялись прогностически неблагоприятные факторы. Это связано с тем, что внедрение этой схемы в качестве послеоперационной химиотерапии по времени совпало с расширением показаний к резекции печени в отделении. Больным в этой группе достоверно чаще выполняли дополнительные вмешательства на печени (37,6% против 20,6%, р=0,0026), гемигепатэктомии (53,7% против 39,7%, р=0,025), чаще удаляли внепеченочные метастазы.
Осложнения после вмешательств на печени по поводу метастазов рака толстой кишки выявлены в 131 случае (28,9%), погибло 16 человек (3,5%). Наиболее частое осложнение – печеночная недостаточность – развилось у 46 пациентов (10,1%), летальность составила 1,3% (6 пациентов).
При сравнении непосредственных результатов обширных и экономных операций на печени необходимо отметить большую частоту осложнений в первой группе – 36,2% против 16,2% (р<0,0001), и летальности – 4,5% и 0,6% (р=0,0063) соответственно, что объясняется, естественно, большим объемом операции. Печеночная недостаточность после обширной резекции печени развилась в 15% случаев, и именно это осложнение чаще всего является причиной смерти после операции (1,4%). После экономных резекций печеночная недостаточность отмечена в 1,8% случаев.
Выше было отмечено, что 13 пациентам в качестве предоперационной подготовки была выполнена эмболизация правой ветви воротной вены. Случаев печеночной недостаточности и летальности в этой группе пациентов не было.
Желчеистечение и желчные свищи – второе по частоте осложнение при обширных резекциях печени (29 пациентов, 10,1%). При желчеистечении более 1 мес. осложнение трактуется как желчный свищ (18 пациентов). При экономных резекциях это осложнение встречается гораздо реже (2,4%, р=0,0012), что обусловлено значительно меньшей раневой поверхностью, и, соответственно, лучшим контролем желчестаза.
Как было отмечено выше, 31 пациент помимо резекции печени подвергся методам локального воздействия на метастазы. Летальность в этой группе составила 3,2%, осложнения отмечены у 25,8% больных.
Нами изучены побочные эффекты химиотерапии с использованием 5–фторурацила и кальция фолината с добавлением Элоксатина и без него у 285 пациентов.
Из 149 больных, получавших послеоперационную химиотерапию по схеме FOLFOX–6, осложнения развились у 86 (57,7%), однако в большинстве случаев они носили невыраженный и временный характер. Токсичность 3–4–й степени была выявлена у 13 пациентов (8,7%). Наиболее часто отмечалась нейротоксичность – у 78 пациентов (52,3%), но только у 5 (3,4%) она достигла 3–4–й степени. Гастроинтестинальная токсичность была вторым по частоте осложнением, а ее проявления 3–4–й степени отмечены у 8 больных (5,4%). Гепатотоксичность развилась у 23 больных (15,4%), но только у одного пациента это осложнение имело 3–ю степень тяжести (0,7%). Гематологическая токсичность, в первую очередь нейтропения и тромбоцитопения, выявлены у 26 пациентов (17,4%), у шести – 3–й степени (4,0%). Гнойно–воспалительные осложнения отмечены у шести больных, у трех – 3–4–й степени. Отказано в продолжении адъювантного лечения из–за развития токсических эффектов четырем пациентам (2,7%).
В группе больных (n=136) с послеоперационной химиотерапией по схеме 5FU/LV осложнения развились у 17 пациентов (12,5%), токсичность 3–4–й степени отмечена у 6 пациентов (4,4%). В одном случае (0,73%) лечение прекращено в связи с тромбоэмболией ветвей легочной артерии. Частота развития побочных эффектов достоверно выше в группе больных, получавших FOLFOX–6 (р<0,0001).
Отдаленные результаты изучены у 308 пациентов (из анализа исключены нерадикально прооперированные больные и пациенты с внепеченочными метастазами). Общая пяти– и десятилетняя выживаемость составила 37,1±4,3% и 24,6±5,2%, медиана – 47 мес.
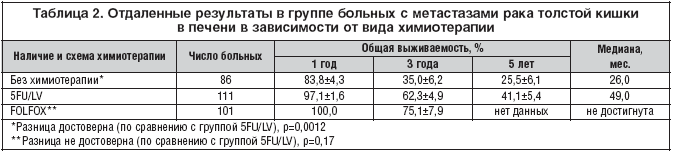
Адъювантную химиотерапию в плане комбинированного лечения больных с метастазами рака толстой кишки в печени в отделении начали применять с 1997 г. В основную группу вошли 212 пациентов, которым проведено не менее 3 курсов химиотерапии в послеоперационном периоде по схеме FU/LV (5–фторурацил, кальция фолинат – 111 больных) или FOLFOX (5–фторурацил, кальция фолинат, Элоксатин – 101 больной). Пациенты, которым проведена другая химиотерапия, исключены из анализа. При хирургическом лечении (86 пациентов) 5–летняя выживаемость составила 25,5%, 10–летняя – 18,6%, медиана 26 мес. При комбинированном подходе (с послеоперационной химиотерапией) 5–летняя и 10–летняя выживаемость составили 42,6% и 26,7%, медиана достигла 54 мес. Разница достоверна, р=0,012. Полученные результаты убедительно показывают преимущество комбинированного лечения больных с метастазами рака толстой кишки в печени по сравнению с хирургическим.
Также нами были оценены отдаленные результаты комбинированного лечения пациентов в зависимости от вида адъювантной химиотерапии (табл. 2). Медиана продолжительности жизни в основной группе (FOLFOX) не достигнута, в контрольной составила 49 мес.
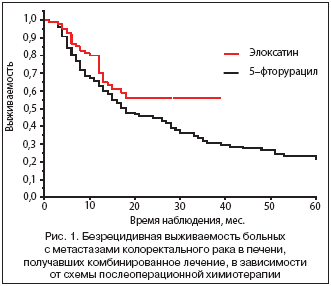
Изучена безрецидивная выживаемость в зависимости от схемы послеоперационной химиотерапии (рис. 1). Получена статистически достоверная разница (р=0,043) в безрецидивной выживаемости в группе пациентов, получивших адъювантную химиотерапию с Элоксатином (трехлетняя – 56,2%), по сравнению с группой с использованием 5–фторурацила и кальция фолината (30,6%). При хирургическом лечении трехлетняя безрецидивная выживаемость составила 26,8%. Медиана до прогрессирования в основной группе не достигнута, в группе с 5–фторурацилом составила 18,0 мес., без химиотерапии – 12,0 мес.
Полученные данные показывают преимущество схемы, содержащей Элоксатин, в качестве адъювантной химиотерапии после хирургического этапа.
Мы склонны связывать отсутствие достоверной разницы общей выживаемости в зависимости от наличия Элоксатина в схеме адъювантной химиотерапии с расширением показаний к операциям на печени по поводу метастазов рака толстой кишки в последнее время, и, соответственно, худшим прогнозом у этой группы больных. Так как внедрение химиотерапии с использованием Элоксатина по времени совпало с расширением показаний к операции на печени, то целесообразно выделить и отдельно изучить выживаемость в различных прогностических группах.
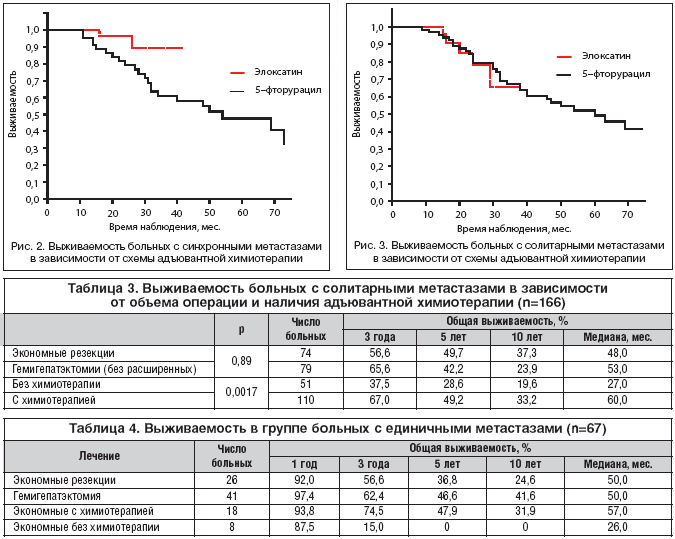
Из представленных ранее литературных данных следует, что при синхронных метастазах прогноз хуже, чем при метахронных. Рисунок 2 демонстрирует результаты комбинированного лечения пациентов с синхронными метастазами рака толстой кишки в печени в зависимости от схемы адъювантной химиотерапии. Медиана в группе пациентов, получивших химиотерапию с Элоксатином, не достигнута, трехлетняя выживаемость – 87,5%. В группе с послеоперационной химиотерапией без Элоксатина медиана достигла 54 мес., трехлетняя выживаемость составила 61,8%.
Обращает на себя внимание статистически значимое (р=0,031) увеличение выживаемости в группе больных, получивших химиотерапию по схеме FOLFOX.
Изучены отдаленные результаты хирургического и комбинированного лечения пациентов с метастазами рака толстой кишки в печени в зависимости от числа метастазов. При солитарных метастазах (166 пациентов) получены наилучше результаты: 5–летняя выживаемость составила 42,9%, медиана достигла 50,0 мес. При единичных метастазах (77 пациентов) 5–летняя выживаемость несколько хуже – 36,5% (разница статистически недостоверна, р=0,43), медиана практически такая же – 48,0 мес. Десятилетняя выживаемость в обеих группах сопоставима: 28,8% и 25,5% соответственно. При этом медиана выживаемости в группе больных с множественными метастазами (65 пациентов) в два раза ниже, чем в предыдущих группах – 27,0 мес., 5 лет прожили только двое пациентов (18,7%), десятилетней выживаемости нет.
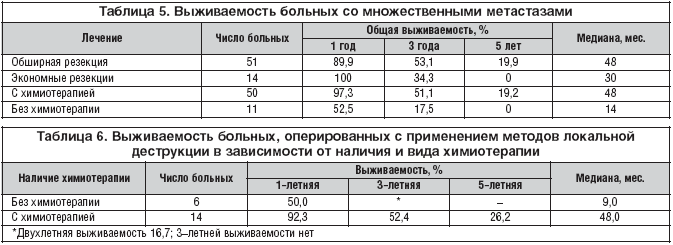
Таким образом, число метастазов в печени является важным прогностическим фактором, в связи с чем в таблицах 3, 4 и 5 показаны отдаленные результаты хирургического и комбинированного лечения пациентов с метастазами колоректального рака в печени в зависимости от числа метастазов.
Не получено статистически достоверной разницы в показателях выживаемостив зависимости от вида операции – гемигепатэктомия или экономная резекция. Следует указать, что обширные вмешательства чаще выполнялись при невозможности выполнения экономной резекции, то есть при более распространенном опухолевом поражении печени. В случае применения в группе больных с солитарными метастазами послеоперационной химиотерапии (110 пациентов) выживаемость выше, медиана достигает 60 мес. (против 27 мес. без химиотерапии). Разница статистически достоверна (р=0,0017).
Разницы в общей выживаемости в зависимости от схемы химиотерапии не получено (р=0,67), медиана в группе пациентов, получавших FOLFOX, не достигнута, в контрольной группе (5FU/LV) составила 54 мес. (рис. 3).
В группе пациентов c единичными метастазами в печени (77 человек) выполнена 51 обширная резекция печени и 26 экономных. Исключены из анализа выживаемости 10 пациентов с предельно обширной резекцией печени (табл. 4). Отмечается улучшение выживаемости при выполнении гемигепатэктомий по сравнению с экономными резекциями, однако разница статистически недостоверна (р=0,74), медиана составляет 50 мес. в обеих группах.
В группе обширных резекций (в таблице не отражено) дополнительное лечение не оказало существенного влияния на отдаленные результаты: медиана продолжительности жизни – 49,0 и 51,0 мес. (р=0,82). В случае экономных резекций химиотерапия значительно улучшила отдаленные результаты: никто не прожил 5 лет в группе без химиотерапии (8 пациентов), медиана составила 26,0 мес., при использовании адъювантного лечения (18 пациентов) 5– и 10–летняя выживаемость, соответственно, достигли 47,9% и 31,9%, медиана составила 57,0 мес. Разница статистически достоверна (р=0,007).
При использовании в качестве послеоперационной химиотерапии Элоксатина удалось увеличить общую трехлетнюю выживаемость по сравнению со стандартной химиотерапией с 60,7 до 72,4%, но разница статистически недостоверна (р=0,178), медиана в основной группе не достигнута, в контрольной составила 48 мес.
Отдаленные результаты лечения пациентов с множественными метастазами рака толстой кишки в печени отображены в таблице 5, 10–летней выживаемости в этой группе нет. При обширных резекциях получены лучшие результаты, но разница недостоверна (р=0,79). Адъювантная химиотерапия в этой группе позволила существенно улучшить отдаленные результаты (р<0,0001).
На рисунке 4 показано влияние схемы адъювантной химиотерапии на отдаленные результаты при комбинированном лечении пациентов с множественными метастазами рака толстой кишки в печени. Использование схемы FOLFOX (33 пациента) в качестве адъювантной химиотерапии позволило улучшить 3–летнюю выживаемость: 56,8% против 44,0% по сравнению со схемой 5FU/LV (17 пациентов), однако разница недостоверна (р=0,3), медиана в основной группе не достигнута, в контрольной группе медиана составила 27 мес.
Нами изучена выживаемость 46 больных, которым осуществлена паллиативная резекция печени (R1–R2). Прогноз таких пациентов крайне неблагоприятный – до 3 лет не дожил ни один человек, 2–летняя выживаемость составила 16,7% в группе без химиотерапии, 20,7% – в группе с послеоперационной терапией. Медианы продолжительности жизни – 13 и 18 мес. соответственно, то есть меньше, чем в случае применения химиотерапии с использованием современных препаратов (согласно данным литературы). Статистически достоверной разницы в зависимости от вида лечения (комбинированный или хирургический) не получено (р=0,41). Паллиативная резекция печени не может быть рекомендована для лечения пациентов с распространенным раком толстой кишки.
Прогноз пациентов, у которых, помимо метастазов в печени, определяются внепеченочные очаги (в лимфатических узлах ворот печени и по ходу сосудов чревного ствола, по брюшине, в легких и т.д.), также крайне неблагоприятен. Однако в таком случае выполнение операций при полном удалении определяемых метастазов позволяет добиться обнадеживающих результатов. В этой группе (78 пациентов) есть 5–летняя выживаемость – 8,6%. Химиотерапия после хирургического этапа проведена 53 пациентам и позволила улучшить отдаленные результаты – 3–летняя выживаемость составила 22,7% против 7,5%, 5–летняя – 15,2% (без химиотерапии никто не прожил 5 лет), медиана – 22 мес. против 16. Разница достоверна (р=0,023).
В таблице 6 показаны результаты хирургического (6 человек) и комбинированного лечения (14 человек) пациентов с изолированным поражением печени, к которым, помимо резекции печени, применены методы аблации.
Медиана выживаемости в группе пациентов без профилактической химиотерапии не достигла года. При проведении комбинированного лечения 3– и 5–летняя выживаемость составили 52,4% и 26,2%, медиана достигла 48 мес.
Нами проанализированы отдаленные результаты 60 пациентов, которым перед резекцией печени проводилась химиотерапия. Пятилетняя выживаемость при этом составила 33,2% против 39,8% (при сравнении с группой из 248 пациентов, которые подверглись резекции печени без неоадъювантного лечения), медиана в обеих группах достигла 48 мес., р=0,17. Разница в выживаемости недостоверна, относительный риск смерти 1,37 (95% ДИ 0,85–2,43).
Перед резекцией печени химиотерапия с применением современных препаратов (Элоксатин, иринотекан, ралтитрексед, таргетные препараты) проведена 36 больным, медиана продолжительности жизни составила 52 мес., в группе больных с предоперационной химиотерапией по схеме 5FU/LV (24 пациента) медиана достигла 24 мес., однако разница недостоверна, р=0,24.
Изучено влияние эффекта предоперационной химиотерапии на отдаленные результаты комбинированного лечения пациентов с метастазами колоректального рака в печени: прогрессирование отмечено у 31 пациента, стабилизация в 15 случаях, регрессия опухоли – у 14 больных. В первом случае медиана продолжительности жизни достигла 24 мес., во втором – 48, в случае регрессии – 63 мес., но разница не достигла статистической разницы – р=0,26 (при сравнении 1–й и 3–й групп). Однако ввиду небольшого числа наблюдений, необходимо дальнейшее изучение роли предоперационной химиотерапии в зависимости от перечисленных параметров при комбинированном лечении больных с метастазами колоректального рака в печени.
Заключение
Сочетание резекции печени с предоперационной эмболизацией правой ветви воротной вены, а также с методами локального воздействия на метастазы позволило увеличить операбельность пациентов с распространенным колоректальным раком. Частота побочных эффектов адъювантной химиотерапии по схеме 5FU/LV составила 12,5%. Токсичность 3–4–й степени имела место у 4,4% больных. Адъювантная химиотерапия по схеме FOLFOX, в режиме как системного, так и внутриартериального введения препаратов, применима у пациентов после резекции печени, в том числе – после обширной. Частота побочных эффектов составляет 57,7%, наиболее частое периферическая нейропатия. Токсичность 3–4–й степени отмечена у 8,7% больных.
Отмечено достоверное улучшение отдаленных результатов при комбинированном лечении (по сравнению с хирургическим). Так, медиана продолжительности жизни в группе больных с послеоперационной химиотерапией по схеме FU/LV составила 49 мес., по схеме FOLFOX – не достигнута, при хирургическом подходе – 26 мес. Пятилетняя выживаемость пациентов с внепеченочными метастазами при удалении всех определяемых очагов и послеоперационной химиотерапией составила 15,2%. В случае применения аблационных методик (помимо резекции печени) с последующей химиотерапией также достигнута 5–летняя выживаемость 26,2% .
Трехлетняя безрецидивная выживаемость достоверно (р=0,043) выше в группе пациентов, которым проведена адъювантная химиотерапия FOLFOX, по сравнению с группой 5FU/LV – 56,2%, и 30,6% соответственно, ОР=1,48; 95% ДИ (1,01–2,29). В случае применения адъювантной химиотерапии по схеме FOLFOX отмечена тенденция к улучшению 3–летней выживаемости в общей группе пациентов (75,1% против 62,3%, р=0,17), а также при единичных (72,4% против 60,7%, р=0,178) и множественных метастазах (56,8% против 44,0% р=0,3). Кроме того, послеоперационная химиотерапия с использованием Элоксатина улучшила 3–летнюю выживаемость при синхронных метастазах колоректального рака в печени – 87,5% против 61,8%, р=0,031.
Проведенный анализ сравнения хирургического и комбинированного методов лечения наглядно свидетельствует о преимуществе последнего. Международный опыт и опыт нашего отделения подтверждает Элоксатин как оптимальный выбор для больных с метастазами колоректального рака в печень.
Таким образом данным пациентам рекомендуется химиотерапия на основе современных противоопухолевых препаратов.