Ключевые слова: рак шейки матки, тегафур, цисплатин, химиолучевая терапия, патоморфоз.
Рак шейки матки (РШМ) занимает 3–е место в структуре заболеваемости женщин России злокачественными новообразованиями (после рака молочной железы и эндометрия) и 1–е место в структуре смертности от онкогинекологической патологии у женщин в возрасте от 20 до 40 лет, достигая 60%.
Четко прослеживается рост заболеваемости РШМ среди молодых женщин в возрастной группе до 40 лет. Особенно заметен прирост заболеваемости у женщин до 29 лет, составляющий около 7% в год [1]. Почти половина женщин умирают в течение первого года, как следствие выявления болезни в III–IV стадиях [2].
Лучевая терапия и хирургический метод считаются стандартными для лечения местнораспространенных форм РШМ. Но их результаты остаются неудовлетворительными.
В последние три десятилетия ведущие онкологические центры мира активно накапливают клинический опыт химиолучевой терапии рака шейки матки у первично неоперабельных больных. Кроме того, имеет место тенденция отказа от ультрарадикальных операций в связи с отсутствием увеличения продолжительности жизни больных, высокой частотой серьезных осложнений [3–5].
Применение цитостатической терапии усиливает лучевое повреждение опухолевых клеток за счет нарушения механизма репарации ДНК, синхронизации вступления опухолевых клеток в те фазы клеточного цикла, которые наиболее чувствительны к лучевому воздействию. Кроме того, цитостатики (в частности, производные платины) способствуют девитализации резистентных к лучевой терапии опухолевых клеток, находящихся в гипоксии [6].
По данным В.В. Кузнецова с соавт. (2002) и J.D. Bloss et al (1995), применение цисплатина в дозе 100 мг/м2 и лучевой терапии позволяет достигать полной регрессии первичной опухоли и патоморфоза IV степени не менее чем у 30%, регрессии более 50% и патоморфоза III степени – у 50% больных. Регрессия менее 50% при патоморфозе I–II степени достигается примерно в 20% случаев [7,8].
Исследования отечественных авторов (1998) также подтвердили достоверность значительного эффекта химиолучевой терапии по сравнению только с лучевым методом. Показатели 3–летней выживаемости составили 84% в группе химиолучевой терапии и 68% – при проведении только лучевой терапии (р=0,008). Отмечено также снижение риска смерти от РШМ на 46% при комплексном лечении.
Безрецидивная 5–летняя выживаемость у больных 1В–IV стадии, получивших одновременно с дистанционной лучевой терапией введение цисплатина и длительные инфузии 5–фторурацила, составила 67%; в контрольной группе, где проводилась только лучевая терапия – 40%. Общая 5–летняя выживаемость составила соответственно 73 и 58% (р=0,004). Частота развития отдаленных метастазов в группе получавших химиолучевое лечение была почти в 3 раза меньше по сравнению с контрольной группой (13 и 33% соответственно), что привело к снижению риска смерти больных раком шейки матки на 48% по сравнению с лучевой терапией.
По данным И.А. Косенко (2000), химиолучевая терапия РШМ с применением 5–фторурацила и цисплатина обуславливает частичную регрессию опухоли у всех больных на 20–45% от исходного объема [9].
Увеличение продолжительности жизни больных РШМ при химиолучевой терапии достигается за счет снижения частоты локорегионарных рецидивов (в 3 раза) и отдаленных метастазов (в 5 раз) по сравнению с традиционной лучевой терапией [10,11].
Наиболее частой причиной смерти больных распространенным РШМ является прогрессирование процесса в области малого таза, развитие почечной недостаточности, как следствие опухолевой обструкции и сдавления мочеточников; примерно у 4,4% больных определяются отдаленные метастазы в легких, селезенке, в головном мозге.
Таким образом, результаты лечения местнораспространенного РШМ улучшаются при применении химиолучевой терапии, однако в целом остаются неудовлетворительными.
В данном исследовании оценивалась безопасность и эффективность нового режима химиотерапии с еженедельным введением цисплатина и ежедневным приемом тегафура. Данная комбинация основана на известных данных о синергизме препаратов платины и тегафура как между собой, так и с лучевой терапией (оба препарата применяются как радиомодификаторы).
Тегафур [Фторафур®, Grindex (Латвия)] – производное 5–фторурацила (5–ФУ) для приема внутрь.
После приема превращение неактивного Фторафура в активный метаболит осуществляется двумя путями. Первый реализуется в печени путем окисления при участии цитохрома Р450. Второй – непосредственно в опухолевой ткани за счет гидролиза под действием тимидинфосфорилазы (ТФ) и уридинфосфорилазы [13,14]. Известно, что концентрация ТФ в опухоли существенно выше, чем в неизмененной ткани. Поэтому образование активного метаболита 5–ФУ происходит в значительно больших концентрациях именно в опухолевых клетках. Это определяет низкую системную токсичность и высокую противоопухолевую активность Фторафура®. Образовавшийся 5–ФУ превращается в 5–фтордезоксиуридинмонофосфат, который ингибирует тимидилатсинтетазу, лежащую в основе противоопухолевого эффекта. Фармакокинетика Фторафура® обеспечивает наличие постоянной невысокой концентрации 5–ФУ подобно таковой при длительной инфузии 5–ФУ, [12–15].
Цель исследования: улучшить непосредственные и отдаленные результаты лечения РШМ IB2–III ст. за счет применения новых режимов химиолучевой терапии (ХЛТ) в сочетании с оперативным лечением.
Задачи исследования: определение частоты местного прогрессирования, длительности безрецидивного периода и 1, 2, и 3–летней безрецидивной и общей выживаемости; побочные эффекты нового предоперационного химиолучевого режима, его влияние на осложнения в послеоперационном периоде.
Проведена сравнительная оценка морфологической структуры опухоли до начала лечения и после химиолучевой терапии, оценка лечебного патоморфоза.
Материалы и методы
С марта по октябрь 2011 года на базе Нижегородского онкологического диспансера в пилотное исследование включена 21 больная плоскоклеточным раком шейки матки Т1В2–T3N0–1M0, IВ2–III стадий.
На первом этапе проводили химиолучевую терапию, включающую еженедельное введение цисплатина (20 мг/м2) внутривенно в 1, 8,15–й дни и ежедневный прием тегафура 1200 мг/сут внутрь, дни 1–21–й. Одновременно выполняли дистанционную лучевую терапию РОД 2 Гр ежедневно 5 раз в неделю, до суммарной дозы 30 Гр. (рис. 1).
По завершении химиолучевого этапа проводили комплексную оценку эффективности проводимого лечения, у больных с положительной динамикой – радикальную гистерэктомию с двухсторонней подвздошной лимфаденэктомией по методу Вертгейма–Мейгса, ревизию поясничных лимфатических узлов, удаление увеличенных поясничных узлов. К настоящему времени прооперировано 18 больных. Последующая тактика обсуждалась индивидуально.
Критерии включения в исследование:
• больные раком шейки матки T1В2–T3NM0, IВ2–III стадий;
• устное согласие больной на любой из планируемых методов лечения;
• гистологическое подтверждение диагноза;
• возраст больных – от 18 до 70 лет;
• предполагаемая продолжительность жизни не менее 3 мес.;
• общее состояние больного по шкале ВОЗ – не более 2;
• больные, ранее не получавшие специфического лечения;
• количество нейтрофилов – более 2 000, тромбоцитов – более 150 000 в 1 мм3 крови;
• биохимические показатели: креатинин – не более 1,5 норм;
• АЛТ или АСТ не более 3 верхней границы нормы;
• общий билирубин не более 1,5 верхней границы нормы.
Критерии исключения из исследования:
• специфическое лечение по поводу рака шейки матки в прошлом;
• первично–множественные метахронные или синхронные злокачественные опухоли;
• выраженный воспалительный процесс в малом тазу;
• общее тяжелое состояние больной, обусловленное сопутствующими заболеваниями печени, почек, сердечно–сосудистой системы, нервно–психическими расстройствами и т.д.;
• язвенная болезнь желудка, 12–перстной кишки (в фазе обострения), не корригируемый сахарный диабет;
• любые интеллектуальные или другие нарушения, влияющие на способность следовать процедурам, предусмотренным протоколом;
• постоянный прием кортикостероидов или иммуносупресантов;
• беременность;
• различные неврологические заболевания (полиневрит и др.);
• кахексия;
• отдаленность места жительства больной, препятствующая регулярному наблюдению;
• аллергия к используемым лекарственным препаратам.
Клинический эффект оценивается по критериям RECIST. Оценка токсичности проводилась по критериям NCI–CTC (версия 4.03) [18].
Для оценки лечебного патоморфоза использованы количественные морфологические методики. Основу морфометрических исследований составили количественные способы методами «точечного» счета и «полей», разработанные Г.Г. Автандиловым. Количественной оценке подвергались площади зон некроза и участков с сохранившейся и неизмененной структурой, опухолевые клетки с наличием необратимых форм дистрофий и изменений ядра, раковые элементы, которые находились в состоянии митоза (при этом отдельно в данной группе определялось содержание патологических митозов). Использовались гистологические препараты ступенчатых и серийных срезов с операционного материала, подсчет проводился в 10 полях зрения с вычислением средних арифметических. Результат выражался в процентах. Полученные числовые данные подвергались статистической обработке согласно правилам медицинской статистики [19]. Полученные данные позволили объективизировать оценку патоморфоза в рамках традиционных степеней, предложенных Г.А. Лавниковой с соавт. [16,17].
Результаты
Для определения переносимости предоперационной химиолучевой терапии с использованием тегафура нами проведен анализ частоты осложнений во время лечения. К осложнениям относились дополнительные жалобы и патологические изменения, возникшие на первом этапе лечения. Все осложнения носили преходящий характер и хорошо поддавались симптоматическому лечению.
Наиболее частыми проявлениями были: диарея (I–II ст.) – 2 больных (10%), тошнота (I ст.) – 6 (29%), головокружение (I ст.) – 3 (14%), головная боль (I ст.) – 2 (10%) – как следствие приема тегафура; циститы – 7 больных (33%), иректиты – 5 (24%) – как осложнения лучевой терапии.
Распределение гематологической токсичности после проведения этапа ХЛТ отражено в таблице 1. Чаще всего отмечалась лейкопения (I–II ст.) – 9 больных, анемия (I ст.) – 5 больных. Проявлений III–IV степени токсичности не наблюдалось.
Не отмечено выраженного негативного влияния предоперационного курса химиолучевой терапии на ход и технические сложности оперативного вмешательства. При этом из субъективных особенностей оперативного компонента следует остановиться на отечности, повышенной «ранимости» и кровоточивости тканей в зоне лучевого воздействия, а также незначительном снижении дифференцировки «слоев» разделяемых тканей. Осложнений в послеоперационном периоде не наблюдалось.
Таким образом, по нашим данным, проведение предоперационного курса химиолучевой терапии с включением тегафура следует признать хорошо переносимым и безопасным.
Согласно RECIST критериям у 5 пациенток (24%) зафиксирован полный клинический эффект. Во всех этих случаях имел место ороговевающий рак. У 13 пациенток (62%) – частичный клинический эффект, из них у 10 был ороговевающий рак, у 3 – неороговевающий. У 3 пациенток (14%) отмечена стабилизация процесса, в 2 случаях ороговевающий рак, в 1 – неороговевающий.
При гистологическом изучении операционного материала выявлены нижеследующие изменения. В первую очередь следует отметить мозаичность распределения альтернативных изменений, т.е. чередование участков глубокого необратимого повреждения с более поверхностной дезорганизацией. Тем не менее это не мешает установить степень лечебного патоморфоза в рамках традиционных схем.
Оценивая полученные результаты, можно отметить, что патоморфоз в наших случаях отличался выявлением достаточно больших участков тотального некроза опухоли с потерей изначальной гистологической структуры, занимающих до 99% площади новообразования (т.е. IV степень патоморфоза) в 25% наблюдений. У этих больных был установлен полный клинический эффект.
У 14 больных (77,8%) формировались масштабные зоны некроза ткани опухоли, более выраженные в ороговевающих карциномах. Так, для ороговевающего рака (10 случаев) объемная площадь некроза составила 91,6±1,4%, в неороговевающем (4 наблюдения) – 89,8±3,5% (различия статистически достоверны, р<0,05).
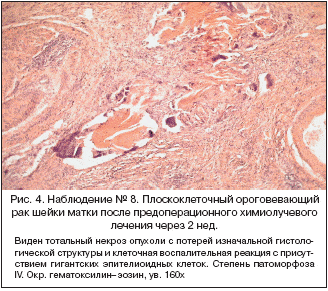
В части случаев отмечалось некоторое количество сохранившихся опухолевых элементов, однако изменения в них носили необратимый характер, а именно гиалиново–капельная и гидропическая дистрофия, кариопикноз, кариорексис, нежизнеспособные формы деления (рис. 2–5).
Таким образом, морфологические изменения позволяют сделать вывод о высокой повреждающей способности рассматриваемого метода лечения.
В качестве иллюстрации приводим описание случая эффективной предоперационной химиолучевой терапии РШМ.
Больная 50 лет, обратилась с жалобами на контактные кровянистые выделения из половых путей.
При осмотре в зеркалах: из шейки матки исходит экзофит около 3 см, при контакте кровоточит. При ректовагинальном исследовании: определяется опухоль, исходящая из шейки матки, инфильтрирующая клетчатку параметриев. Тело матки и придатки не увеличены. Стенки таза свободные. Кольпоскопия представлена на рисунке 6.
При УЗИ органов малого таза: шейка матки – размеры увеличены 40х34х42 мм, ближе к телу матки лоцируется бугристое образование пониженной эхогенности, 32х36 мм, контуры нечеткие, неровные, с обильным кровотоком.
Произведена биопсия образования. Данные гистологического исследования: умеренно дифференцированный плоскоклеточный рак с тенденцией к ороговению с инфильтративным ростом на всю толщу биоптата. Таким образом установлена стадия T2bN0M0 (рис. 7).
Пациентке проведен предоперационный курс химиолучевой терапии: СОД 30 Гр, РОД 2 Гр – 5 раз в неделю. Один раз в неделю, еженедельно цисплатин 35 мг в 1, 8 и 15–й дни, тегафур 1200 мг с 1 по 21–й день ежедневно.
При оценке эффективности лечения через 2 недели установлена полная резорбция первичной опухоли. Результаты повторной кольпоскопии представлены на рисунке 8.
УЗИ органов малого таза: шейка с четкими неровными контурами 32х26 мм. Хорошо прослеживается внешний контур, стенки однородные, местами с единичными сигналами. Эндоцервикс местами гипоэхогенный, достаточно ровный. Кровоток не усилен.
Через 2 недели, по завершении химиолучевой терапии, проведено оперативное лечение в объеме радикальной гистерэктомии с двухсторонней подвздошной лимфаденэктомией по методу Вертгейма–Мейгса, ревизией поясничных лимфатических узлов.
Морфологическое исследование операционного материала показало: плоскоклеточный рак шейки матки с ороговением с проявлениями терапевтического патоморфоза III–IV ст. Инвазия менее 1 мм. В 9 исследованных лимфоузлах метастазов не обнаружено.
В послеоперационном периоде осложнений не было. Больная выписана на 10–е сутки после операции.
С начала лечения прошло 8 месяцев, признаки рецидива болезни отсутствуют.
Обсуждение и выводы
Несмотря на визуальную локализацию, наличие сформировавшихся классических подходов к профилактике, диагностике и лечению, рак шейки матки остается одной из самых актуальных проблем современной онкогинекологии. Стандартные методы лечения (хирургический и лучевой) исчерпали свои возможности, в связи с тем возникает необходимость разработки новых, более совершенных методов комбинированного и комплексного лечения этой патологии.
Преимущества применяемого нами метода следующие:
– проведение предоперационного курса химиолучевой терапии с тегафуром позволило провести на II этапе радикальную операцию 18 (87%) больным. Радикальная операция дает возможность адекватного стадирования, что, в свою очередь, позволяет планировать адекватно адъювантную терапию (как лучевую, так и химиотерапию), улучшает качество жизни больных;
– отсутствие отрицательного влияния на качество жизни больных. Токсичности III–IV ст. не наблюдалось. В наших наблюдениях не было лучевых реакций III–IV ст. Отмечена высокая приверженность больных к лечению тегафуром, связанная с удобством и хорошей переносимостью.
Полученные нами морфологические изменения (25% – патоморфоз IV ст.), оценка клинического эффекта (24% – полный, 62% – частичный) позволяют сделать вывод о высокой лечебной эффективности рассматриваемого метода лечения и прогнозировать положительные отдаленные результаты.
За время применения нового режима (8 месяцев) рецидивов не зарегистрировано.
Данный этап работы позволяет нам сделать лишь предварительные выводы. Тем не менее, уже первый опыт показал оправданность использования предоперационной химиолучевой терапии с включением тегафура.









Литература
1. Онкология: национальное руководство под ред. В.И.Чиссова, М.И.Давыдова. –М.: ГЭОТАР-Медиа,2008, 820 с.
2. Муллагалиева А.М, Хасанов Р.Ш., Шакирова Э.Ж.. Комплексное лечение больных раком шейки матки с высоким риском прогрессирования и применением неоадъювантной химиолучевой терапии. Практическая медицина.. 4(36) июнь 2009г. с.67-70.
3. Бардычев М.С. Лучевые повреждения. Лучевая терапия злокачественных опухолей. Руководство для врачей. Под редакцией проф. Киселевой Е.С., М.: «Медицина», 1996, с.437-457.
4. Piver G., Rutlege F., Smith J. Five classes extended hysterectomy for women with cervical cancer. Obstet. Gynecol. 1974,44, p. 265
5. Yuan C., Wang P., Lai C. et al. Recurrence E analyses of 1115 cervical cancer patients treated with radical In Gynecol. Obstet. Invest., 2003,52 (2), p. 127-132
6. Максимов С.А., Гусейнов К.Д. Комбинированное лечение рака шейки матки. Журнал «Практическая онкология», 2002. т.З, №3, с.200-210
7. Лушников Е.Ф. Морфологический метод изучения лучевого патоморфоза опухолей человека. Сб. научных трудов «Современные методы оценки эффективности лучевой терапии». Обнинск, 1988, с.52-56.
8. Buskley S.L., Tritz D.M., Van Le L., Higgins R., Servin B.V. et al. Lymph node metastases and prognosis in patients with stage 1 -II cervical cancer. Gynecol. Oncology, 1996,63, P. 4-9
9. Crentzberg C., Althol V., de Hoog M. et al. Quality control study of the accuracy of patient positioning in irradiation of pelvic fields. Int.J.Radiation Oncol.Biol.Phys., 1996, Vol.34, No3, p. 697-708.
9. Косников А.Г., Бахидзе Е.В., Максимов С.Я. Патогенетическая неоднородность рака шейки матки. Вопросы онкологии 1996, № 5,45-52..
10. Костромина К.Н. Современная стратегия лучевого лечения больных раком шейки матки. Матер, научно-практической конференции «Роль лучевой терапии в гинекологической онкологии». Обнинск, 2-3 апреля 2002, с. 107-110.
11. Inoue T. Prognostic sinificance of the depth of invasion relating to nodal metastases, parametrial extension and cell types. A study of628 cases with stage IB, IIA and 11B cervical carcinoma. Cancer, 1994,54, p. 3035-3042
12. Au J.L., and SadeeW. The pharmacology of ftorafur (R,S-1-(tetrahydro-2-furanyl)-5-fluorouracil).Recent Res.Cancer Res.1981,76:100-114,.
13. Au J.L, WuA.T., Friedman M.A. and Sadee W. Pharmacokinetics and metabolism of ftorafur in man. Cancer Treat.Rep.,1979,63:343-350.
14. Antilla MI, SotaniemiE.A., KairaluomaM.I,et all .Pharmacokinetics of ftorafur after intravenous and oral administration. Cancer Chemother Pharmocal (1983)10:150-153.
15. Гуторов С.Л. Фторафур - перспективы применения в современной клинической онкологии. Клиническая онкология. Том 9, N1, 2007
16. Автандилов Г.Г. Медицинская морфология. М.: Медицина, 1990. – 382 с.
17. Лавникова Г.А. Гистологические методы количественной оценки степени терапевтического повреждения опухоли/Методические рекомендации. - Москва, 1979. – С.1-13.
18. Common Terminology Criteria for Adverse Events (CTCAE) Version 4.0. Published: May 28, 2009 (v 4.03: June 14, 2010). (http://evs.nci.nih.gov/ftp1/CTCAE/CTCAE_4.03_2010-06-14_QuickReference_5x7.pdf)
19. Банержи А. Медицинская статистика понятным языком. Изд.: Практическая медицина, 2007.












