Выделение на основании исходных прогностических факторов группы больных, имеющих низкую вероятность достижения ремиссии или высокий риск развития рецидива с целью индивидуализации лечения, является перспективным направлением в современной терапии злокачественных новообразований. Необходимость разработки индивидуальных подходов к терапии различных по прогнозу групп больных продиктована потребностями клиники. Такой подход может основываться только на углубленном изучении молекулярно–биологических особенностей опухолевой клетки. Одним из методов, раскрывающим новые перспективы в понимании антигенных, биохимических и гистогенетических характеристик клеточных структур и дающих возможность глубже понять природу опухоли, особенности ее возникновения, развития и прогрессирования, является иммунофенотипирование. С появлением высокоспецифичных реагентов – моноклональных антител (мкАТ), позволяющих определять и разграничивать специфические антигенные детерминанты, онкологи получили возможность более точного определения диагноза и прогноза заболевания, а также выбора наиболее оптимальной тактики лечения пациента. Неоспоримыми достоинствами иммунофенотипирования являются его высокая чувствительность, специфичность и относительная простота. Данный метод обеспечивает детальную характеристику фенотипа опухоли при диагностике, позволяет идентифицировать отдельные остаточные опухолевые клетки, персистирующие в организме больного во время ремиссии.
Наибольшее развитие метод иммунофенотипирования получил при опухолях крови. Основным и, пожалуй, единственным на сегодняшний день методом лечения гемобластозов является химиотерапия. На примере острых лейкозов наглядно демонстрируется возрастание роли молекулярно–биологических (иммунофенотипических) факторов прогноза по мере интенсификации программ химиотерапии. При этом стандартные прогностические факторы (клинические, гематологические, морфоцитохимические) утрачивают свое значение и отходят на второй план. Эволюция взглядов на факторы прогноза, наблюдаемая при гемобластозах человека и указывающая на возрастание роли иммунофенотипа в условиях современных схем химиотерапии, может явиться своего рода моделью и для ряда соматических опухолей, являющихся объектами химиотерапии, при которых иммунофенотипические подходы пока еще разработаны недостаточно.
Иммунофенотипирование является обязательным методом исследования при гемобластозах в целом и при острых нелимфобластных лейкозах (ОНЛЛ), в частности. Помимо диагностического аспекта, значение изучения иммунофенотипа бластных клеток при ОНЛЛ заключается в том, что наличие некоторых антигенных детерминант ассоциируется с агрессивностью течения и результатами терапии [4, 7, 8, 13, 15, 20]. На сегодняшний день решены еще не все вопросы относительно прогностической ценности экспрессии тех или иных антигенов при ОНЛЛ и последствий, которые влечет за собой их обнаружение с точки зрения лечебной тактики. Представленные в нашей работе результаты отражают общие тенденции комплексного и углубленного изучения иммунофенотипической характеристики ОНЛЛ во взаимосвязи с прогнозом заболевания, которое ведется в крупнейших клиниках мира.
Характеристика больных и методы исследования
Результаты иммунологического исследования и их сопоставление с FAB–вариантами и результатами терапии базируются на данных изучения иммунологического фенотипа бластных клеток 120 больных ОНЛЛ в возрасте от 14 до 67 лет за период с 1981 по 1996 годы, получивших лечение в отделении химиотерапии гемобластозов (руководитель – канд. мед. наук Д.Ш. Османов) РОНЦ им. Н.Н. Блохина РАМН. Все пациенты лечились по программам «3+7» стандартными дозами цитозара с различными антрациклиновыми производными – рубомицином (46), аклакуром (20), новантроном (16), идарубицином (38).
Установление диагноза ОНЛЛ и определение морфоцитохимического варианта заболевания осуществлялось в соответствии с критериями FAB–классификации.
Определение иммунологического фенотипа бластных клеток проводилось методом непрямой иммунофлюоресценции с использованием широкой панели моноклональных антител (мкАТ). Набор мкАТ варьировал в разные годы проведения исследований и в наиболее полном виде включал миелоидные (CD11b, CD13, CD14, CD15, CD33), эритроидные (HAE–3, HAE–9), линейно не рестриктированные (CD10, CD34, CD38, HLA–DR), Т–клеточные (CD2, CD4, CD5, CD7) и В–клеточные (CD19, CD22) антигены. Мегакариоцитарные маркеры (CD41, CD61) исследовались по показаниям. Оценка результатов проводилась на проточном цитометре FАСScan (Becton Dickinson, CША) в гейте бластных клеток, идентифицируемых на основании характеристик светорассеяния. Антиген–положительными считались случаи с экспрессией маркера на более чем 20% лейкемических клеток.
Сравнение влияния иммунологических маркеров на частоту полных ремиссий (ПР) больных с наличием или отсутствием экспрессии антигенов на мембране бластных клеток производилось по таблицам сопряженности признаков. Достоверность различий оценивалась по критерию Хи–квадрат. Сравнение кривых общей и безрецидивной выживаемости (ОВ и БРВ соответственно), построенных по методу Каплан–Майера, проводилось с использованием Log–Rank теста. Различия считались достоверными при р < 0,05 (95% точности).
Результаты и обсуждение
Распределение 120 больных с различными морфоцитохимическими вариантами в каждой из лечебных групп представлено в таблице 1. На основании литературных данных и опыта отделения химиотерапии гемобластозов РОНЦ морфоцитохимические варианты ОНЛЛ были разделены на прогностически благоприятные (М1, М2, М3, М4эоз) и прогностически неблагоприятные (М0, М2баз, М4, М5, М6, М7). Во всех группах, за исключением аклакур–цитарабиновой, преобладали прогностически благоприятные FAB–варианты. Статистический анализ во всех 4–х группах не выявил достоверных различий в возрасте, частоте тех или иных клинико–гематологических показателей и клинических симптомов. Результаты использования цитарабина с различными антрациклиновыми производными приведены в табл. 2.
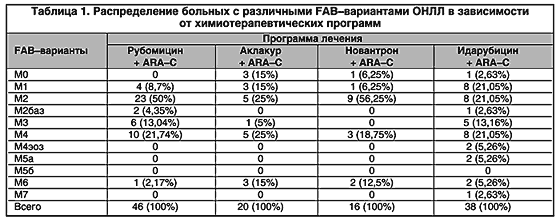


На основании проведенного клинико–иммунологического анализа нам удалось доказать неоднородность терапевтического ответа у больных ОНЛЛ с различным иммунофенотипом бластных клеток. Кроме того, были выявлены иммунологические маркеры, влияющие на отдаленные результаты лечения. Частота экспрессии различных антигенов на поверхности лейкемических клеток и достоверность их влияния на частоту достижения ПР, БРВ и ОВ представлены в табл. 4.
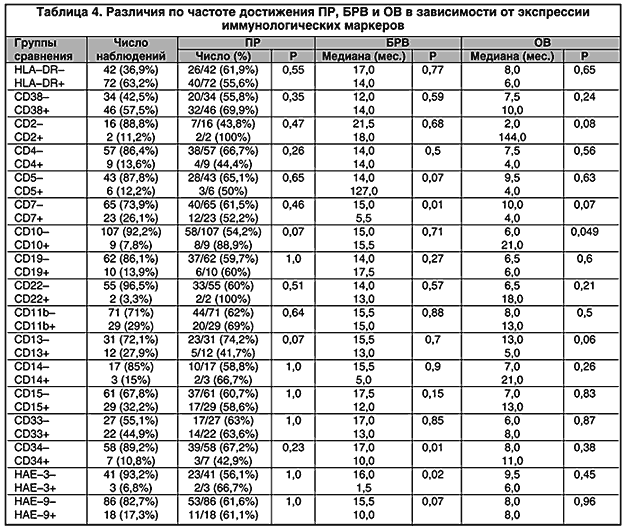

Рис. 1. Общая выживаемость больных ОНЛЛ в зависимости от экспрессии антигена CD10 на поверхности бластных клеток без учета программы терапии.
Напротив, присутствие на бластных клетках миелоидного антигена CD13 ассоциировалось с низкой вероятностью достижения ремиссии (41,7% против 74,2% ПР в CD13–негативной группе; р = 0,07) и, как следствие, со значительно более низкой выживаемостью (медиана 5 ме. против 13 мес соответственно; р = 0,06). Подобные данные есть в литературе [16]. Кроме того, наличие маркера CD13 в иммунофенотипе коррелировало с высоким показателем лейкоцитов в дебюте заболевания. Все случаи ОНЛЛ, сопровождавшиеся экспрессией CD13, характеризовались уровнем лейкоцитов свыше 50 тыс в 1 мкл крови, в то время как при отсутствии этого маркера исходный средний уровень лейкоцитов был в среднем в 2,5 раза ниже (58,8±3,07 тыс/мкл против 23,5± 6,29 тыс/мкл соответственно; р = 0,048). По–видимому, опухолевый клон клеток, характеризующийся экспрессий CD13, обладает высоким пролиферативным потенциалом и крайней агрессивностью течения. Однако значение экспрессии антигена CD13 нельзя считать окончательно установленным. Для более весомого заключения о роли данного маркера нужны дополнительные исследования.Большое внимание при ОНЛЛ привлекает антиген CD7, как наиболее часто встречающийся «лимфоидный» маркер (20–30% случаев ОНЛЛ). Обычно CD7 присутствует на Т–лимфоцитах и ЕК–клетках, и прежде его считали специфическим лимфоидным антигеном [22]. Впоследствии было установлено, что CD7 может экспрессироваться примитивными гемопоэтическими клетками, в том числе способными к миелоидной дифференцировке [14, 17]. Отсутствие антигена CD7 на бластных клетках было достоверно связано с лучшей безрецидивной выживаемостью (рис. 2). Продолжительность ПР в случаях с экспрессией CD7 составила 5,5 мес; 20 мес без рецидива прожили только 15% больных. В группе пациентов, лейкемические клетки которых не содержали данного антигена, медиана безрецидивной выживаемости составила 15 мес; 20 мес без рецидива прожили 38% больных (p = 0,01). Статистически значимые различия по возрасту, уровню лейкоцитов, количеству больных с благоприятными и неблагоприятными FAB–вариантами между CD7–позитивной и CD7–негативной группами отсутствовали (р > 0,35). Полученные нами данные полностью совпадают с результатами зарубежных исследований [10, 15, 24]. Имеются убедительные данные об ассоциации экспрессии антигена CD7 с наиболее важными факторами неблагоприятного прогноза – фенотипом множественной лекарственной устойчивости, наличием Ph–хромосомы, а также сложными нарушениями кариотипа [11, 23]. По–видимому, выделение CD7–позитивных больных ОНЛЛ в группу, требующую исходной интенсификации терапии, оправдано с клинических позиций.
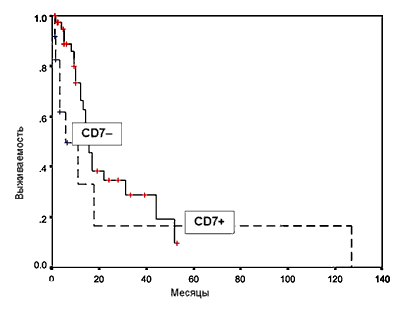
Рис. 2. Безрецидивная выживаемость больных ОНЛЛ в зависимости от экспрессии антигена CD7 на поверхности бластных клеток без учета программы терапии.
Установление экспрессии антигена CD34 позволяет диагностировать особую подгруппу ОНЛЛ, в которой злокачественная трансформация произошла на уровне полипотентной стволовой клетки. Как видно из рис. 3, экспрессия данного маркера на лейкемических бластах была статистически достоверно связана с более короткой продолжительностью ПР. Так, у больных с наличием маркера CD34 в иммунофенотипе медиана продолжительности ПР составила 10 мес. Ни у кого из больных длительность ремиссии не превысила 12 мес. В то же время в группе больных, на бластных клетках которых отсутствовала экспрессия стволовоклеточного антигена, медиана продолжительности ПР составила 17 мес; 2 года и более без рецидива прожили более 40% больных (р = 0,01). Кроме того, обнаружение CD34 антигена на мембране бластных клеток связано с более низкой частотой ремиссии (42,9%) по сравнению с CD34–негативными случаями (67,2%). Видимо, малочисленность CD34+ группы является причиной того, что выраженные различия в частоте получения ремиссий не являются статистически значимыми. Необходимо отметить, что в группе больных, лейкемические клетки которых экспрессировали стволовоклеточный антиген, отмечался более молодой возраст (30,3±7,2 лет против 40,1±2,3 лет соответственно; р = 0,3) и отсутствие экстрамедуллярных проявлений заболевания, в то время как у 8 (25,8%) из 31 CD34–негативных пациентов такие проявления были; различий по другим клиническим и гематологическим показателям отмечено не было (р > 0,95).

Рис. 3. Безрецидивная выживаемость больных ОНЛЛ в зависимости от экспрессии антигена CD34 на поверхности бластных клеток без учета программы терапии.
Ассоциация экспрессии антигена СD34 с рефрактерностью к терапии и высоким риском развития рецидива прослежена и в других наблюдениях [3, 9, 13]. Клинические данные подтверждаются данными экспериментальных исследований. Boekhonrst R.A.W. c cоавт. [6] продемонстрировали значительное снижение накопления даунорубицина в CD34+ клетках по сравнению с CD34– клетками. В экспериментах с двойной меткой CD34+ клетки значительно меньше накапливали даунорубицин, чем CD34– клетки (17% против 64%, соответственно). В исследовании Lanza F. с соавт. [18] показано, что больные ОНЛЛ, имеющие CD34+ фенотип бластных клеток, характеризуются более низким процентом Кi67–позитивных (т.е делящихся) клеток и увеличением количества «покоящихся» клеток. По–видимому, больные с СD34+ иммунофенотипом могут быть менее восприимчивы к химиотерапевтическим режимам вследствие низкого митотического уровня бластных клеток.Вопрос о прогностической роли эритроидных антигенов крайне затруднительный. Это объясняется тем, что в зарубежных клиниках гликофорин А (отечественные мкАТ – НАЕ–3) исследуется только по показаниям (для дифференциальной диагностики М6 ОНЛЛ), а экспрессия антигена эритробластов (мкАТ – НАЕ–9) не изучается (эти мкАТ получены в лаборатории акад. Г.И.Абелева РОНЦ им. Н.Н. Блохина РАМН и используются только в нашей стране). Поэтому вопрос о прогностической значимости эритроидных антигенов во многом остается открытым. В нашем наблюдении экспрессия бластными клетками гликофорина А была ассоциирована с более короткой продолжительностью ПР (медиана 1,5 мес против 16 мес; р = 0,02). Данный антиген был изучен у 44 больных и в 3–х случаях он был позитивным, что составляет 7% и соответствует частоте встречаемости острого эритробластного лейкоза, для которого он является патогномоничным. В наших более ранних исследованиях негативное влияние на БРВ обоих эритроидных маркеров оказалось взаимодополняющим [1]. Несомненно, для окончательного заключения требуется дополнительный набор материала. Однако полученная даже на небольшой выборке достоверная корреляция свидетельствует о недостаточности стандартной цитозар–антрациклиновой терапии для лечения больных с М6 вариантом ОНЛЛ.
Как видно из изложенных выше данных, нами установлен ряд факторов, ассоциированных с продолжительностью болезни и ремиссии у больных ОНЛЛ, проанализированных без учета используемого антрациклинового производного. Располагая достаточно большим клиническим материалом, накопленным за 15 лет наблюдения, в течение которых в отделении химиотерапии гемобластозов РОНЦ РАМН использовались 4 программы химиотерапии, и, принимая во внимание то, что отдельные иммунофенотипы ОНЛЛ могут иметь особенности в чувствительности к различным антрациклинам, мы попытались провести сравнительное изучение влияния иммунологического фенотипа на результаты лечения в пределах отдельных программ.
Как нами было показано (табл. 3), ни один из клинико–гематологических и морфоцитохимических факторов не оказывал влияния на прогноз ОНЛЛ в условиях применения программы лечения с включением идарубицина. По этой причине мы остановились именно на данной программе с целью демонстрации возрастающей роли иммунологических факторов прогноза у этих конкретных больных.
При использовании идарубицин–цитарабиновой комбинации, как и при других химиотерапевтических программах, сохранялось негативное прогностическое влияние на ОВ и БРВ экспрессии антигена CD7 (р = 0,03). Кривые выживаемости представлены на рис. 4. Кроме того, обнаружение на опухолевых клетках антигена CD34 ухудшало БРВ, при этом разница приближалась к достоверной (p = 0,06). Но вместе с тем выявились маркеры, присутствие которых при применении идарубицина, в отличие от других антрациклиновых производных, значительно улучшало прогноз.
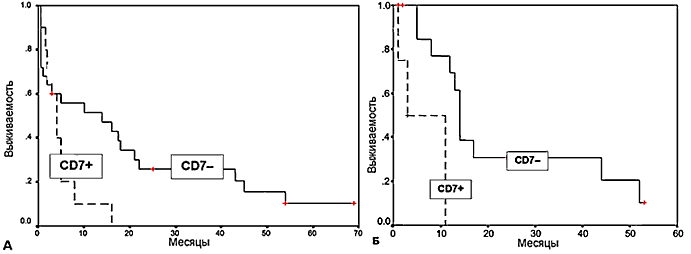
Рис. 4. Общая (А) и безрецидивная (Б) выживаемость больных ОНЛЛ в зависимости от экспрессии антигена CD7 на поверхности бластных клеток при идарубицин-цитарабиновой программе терапии.
При использовании идарубицина отмечался интересный факт: наиболее чувствительными к индукционной терапии были больные с CD38–позитивными бластными клетками. При экспрессии на бластных клетках маркера CD38 частота ПР была более чем вдвое выше, чем при CD38– ОНЛЛ: 68,2% и 33,3% соответственно (р = 0,07). Больные с наличием в иммунофенотипе бластов молекулы CD38 также имели более длительную ПР (рис. 5). Так, 44 и более месяцев без рецидива прожил каждый четвертый больной, на опухолевых клетках которых отмечалась экспрессия CD38 антигена. В то же время длительность безрецидивного периода ни у одного из CD38–негативных больных не превысила 13 меc (р = 0,013).
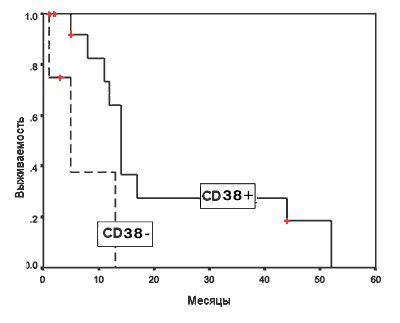
Рис. 5. Безрецидивная выживаемость больных ОНЛЛ в зависимости от экспрессии антигена CD38 на поверхности бластных клеток при идарубицин-цитарабиновой программе терапии.
Также была отмечена благоприятное прогностическое влияние на ОВ коэкспрессии миелоидных антигенов CD15 и CD33 (медиана 10 мес против 4 мес; р = 0,05) и В–клеточных маркеров CD19 и CD22 (медиана 43 мес против 5 мес; p = 0,032).Приведенные данные убедительно показывают, что снижение прогностической роли общепринятых клинико–гематологических и морфоцитохимических факторов в условиях современной химиотерапии ОНЛЛ отнюдь не отражает улучшение прогноза у всех больных. Выделить резистентную или, напротив, более благоприятную в прогностическом плане группу позволяют молекулярно–биологические особенности бластных клеток, установленные методом иммунофенотипирования.
Таким образом, приведенные в нашей статье данные свидетельствуют о том, что иммунологическое исследование является необходимым компонентом первичного обследования больных ОНЛЛ. Помимо изучения чисто клинических аспектов, иммунофенотипирование позволяет глубже понять природу этого заболевания и особенности его течения. Выделение на основании исходных прогностических факторов (включая иммунофенотип) групп больных, имеющих низкую вероятность достижения ремиссии или высокий риск развития рецидива, позволяет индивидуализировать лечение и улучшать его результаты [2]. Это перспективное направление в современной терапии злокачественных новообразований в целом и ОНЛЛ, в частности.
1. Калетин Г.И., Тупицын Н.Н., Волкова М.А. и др. // Новое в онкологии / Под ред. И.В. Поддубной и Н.А.Огнерубова. – Воронеж, 1997. – С. 11–14.
2. Маркина И.Г., Волкова М.А., Тупицын Н.Н. и др. // Новое в онкологии / Под ред. И.В. Поддубной и Н.А.Огнерубова. – Воронеж, 1999. – С. 5–11.
3. Adamczyk–Cioch M.B., Dmoszyncka A., Hus M. et al. // Pol. Arch. Med. Wewn. – 1995. – Vol. 94(1). – P. 40–46.
4. Baer M.R., Stewart C.C., Lawrence D. et al. // Blood. – 1997. – Vol. 90 (4). – P. 1643–1648.
5. Bennett J.M., Catovsky D., Daniel M.T. // Ann. Int. Med. – 1985. – Vol. 103 – P. 626–629.
6. Boekhonrst R.A.W., Leeun R., Schoester M. et al. // Blood. – 1993. – Vol. 82(10). – P. 3157–3162.
7. Bradstock K., Matthews J., Benson E. et al. // Blood. – 1994. – Vol. 84 (4). – P. 1220–1225.
8. Casasnovas R.O., Solary E., Campos L. et al. // Leuk. Lymphoma. –1994. – Vol. 13(1). – P. 109.
9. Cuneo A., Fagioli F., Passi I. et al. // Leuk. Res. – 1992. –Vol. 16 (8). – P. 789–796.
10. Del Poeta G., Stasi R., Venditti A. et al. // Leuk. Lymphoma. – 1995. – Vol. 17(2). – P. 111–119.
11. Del Poeta G., Stasi R., Venditti A. et al. // Leukemia. – 1994. – Vol. 8(3). – P. 388–394.
12. Greaves M.F. // Cancer Surveys. – 1982. – Vol.1(2). – P.189–204.
13. Guinot M., Sans G.F., Sempere A. et al. // Br. J. Haematol. – 1991. – Vol. 78. – P. 533–534.
14. Haynes B.F., Martin M.E., Kay H.H. et al. // J. Exp. Med. – 1988. – Vol. 168. – P. 1061–1080.
15. Kita K., Miwa H., Nakase K. et al. // Blood. – 1993. – Vol. 81(9). – P. 2399–2405.
16. Kristensen J.S., Hokland R. // Leuk. Res. – 1991. – Vol. 15 (8). – P. 693–700.
17. Kurtzberg J., Denning S.M., Nycum L.M et al. // Proc. Natl. Acad .Sci. USA. – 1989. – Vol. 86. – P. 7575–7579.
18. Lanza F., Rigolin G.M., Moretti S. et al. // Leuk. Lymphoma. – 1994. – Vol. 13. – P. 81–85.
19. Lowenberg B., Downing J.R., Burnett A. // New England J. Med. – 1999. – Vol. 341(14). – P. 1051–1062.
20. Paietta E., Andersen J., Yunis J. et al. // Br. J. Haematol.. – 1998. – Vol. 100(2). – P. 265–272.
21. Reading C.L., Estey E.H., Huh Y.O. et al. // Blood. – 1993. – Vol. 81. – P. 3083–3090.
22. Robertson M.J., Ritz J. // Blood. – 1990. – Vol. 76. – P. 2421–2438.
23. Venditti A., Del Poeta G., Buccisano F. et al. // Leukemia. – 1998. – Vol. 12. – P. 1056–1063.
24. Vidriales M.B., Orfao A., Gonzalez M. et al. // Leukemia. –1993. –Vol. 7(12). – P. 2026–2029.












