–Ъ–∞—Е–µ–Ї—Б–Є—П (–≥—А–µ—З. kachexia = kakos «–њ–ї–Њ—Е–Њ–є» + hexis «—Б–Њ—Б—В–Њ—П–љ–Є–µ») – —В–µ—А–Љ–Є–љ–∞–ї—М–љ–Њ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ, –Њ—Б–ї–Њ–ґ–љ—П—О—Й–µ–µ —А—П–і –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Є —З–∞—Б—В–Њ –њ—А–Є–≤–Њ–і—П—Й–µ–µ –Ї –≥–Є–±–µ–ї–Є –±–Њ–ї—М–љ–Њ–≥–Њ.
«–Я–ї–Њ—В—М –Є—Б—З–µ–Ј–∞–µ—В, –љ–∞ –µ–µ –Љ–µ—Б—В–Њ –≤—Л—Б—В—Г–њ–∞–µ—В –≤–ї–∞–≥–∞… –њ–ї–µ—З–Є, –Ї–ї—О—З–Є—Ж—Л, –≥—А—Г–і—М, –њ–∞–ї—М—Ж—Л —Б–ї–Њ–≤–љ–Њ —В–∞—О—В. –≠—В–Њ —Б–Њ—Б—В–Њ—П–љ–Є–µ – –ї–Є—Ж–Њ —Б–Љ–µ—А—В–Є» (–У–Є–њ–њ–Њ–Ї—А–∞—В).
–Э–∞ —Д–Њ–љ–µ —Г—Б–њ–µ—Е–Њ–≤ –≤ —В–µ—А–∞–њ–Є–Є –Љ–љ–Њ–≥–Є—Е –љ–µ–Є–Ј–ї–µ—З–Є–Љ—Л—Е —А–∞–љ–µ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –ї–µ—З–µ–љ–Є–µ –Ї–∞—Е–µ–Ї—Б–Є–Є –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В—Б—П –љ–µ —А–µ—И–µ–љ–љ–Њ–є –љ–∞ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–є –і–µ–љ—М –њ—А–Њ–±–ї–µ–Љ–Њ–є.
–І—В–Њ —Б—З–Є—В–∞—В—М –Ї–∞—Е–µ–Ї—Б–Є–µ–є?
–Ъ–∞—Е–µ–Ї—Б–Є—П –Љ–Њ–ґ–µ—В –±—Л—В—М —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–∞ –≤ —Б–ї–µ–і—Г—О—Й–Є—Е —Б–ї—Г—З–∞—П—Е:
• –њ—А–Є –љ–Є–Ј–Ї–Њ–є –Љ–∞—Б—Б–µ —В–µ–ї–∞ (–Љ–µ–љ–µ–µ 70% –Њ—В –Є–і–µ–∞–ї—М–љ–Њ–є) –Є–ї–Є –Є–љ–і–µ–Ї—Б–µ –Љ–∞—Б—Б—Л —В–µ–ї–∞ (–Ш–Ь–Ґ) (–Љ–µ–љ–µ–µ 16–17 –Ї–≥/–Љ2);
• –і–Њ–Ї—Г–Љ–µ–љ—В–Є—А–Њ–≤–∞–љ–љ–Њ–Љ —Б–љ–Є–ґ–µ–љ–Є–Є –Љ–∞—Б—Б—Л —В–µ–ї–∞ –±–Њ–ї–µ–µ —З–µ–Љ –љ–∞ 7,5–10% –Њ—В –Є—Б—Е–Њ–і–љ–Њ–є.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≤ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –Ї–∞—Е–µ–Ї—Б–Є–Є –≤–∞–ґ–љ–Њ —Г—З–Є—В—Л–≤–∞—В—М –љ–µ —В–Њ–ї—М–Ї–Њ –љ–Є–Ј–Ї–Є–µ –≤–µ—Б–Њ–≤—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є, –љ–Њ –Є —Б–Ї–Њ—А–Њ—Б—В—М —Б–љ–Є–ґ–µ–љ–Є—П –Љ–∞—Б—Б—Л —В–µ–ї–∞.
–Ю–і–љ–∞–Ї–Њ –Њ–і–љ–Њ–Ј–љ–∞—З–љ—Л—Е –Ї—А–Є—В–µ—А–Є–µ–≤ –Ї–∞—Е–µ–Ї—Б–Є–Є –љ–∞ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–є –і–µ–љ—М –љ–µ —Б—Г—Й–µ—Б—В–≤—Г–µ—В, –Є –≤ –ї–Є—В–µ—А–∞—В—Г—А–µ –Љ–Њ–ґ–љ–Њ –≤—Б—В—А–µ—В–Є—В—М —А–∞–Ј–ї–Є—З–љ—Л–µ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П, –Ї–∞–Ї –Є –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л–µ —Б–Є–љ–Њ–љ–Є–Љ—Л: –≥–Є–њ–Њ—В—А–Њ—Д–Є—П, –±–µ–ї–Ї–Њ–≤–Њ–—Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–∞—П, –њ–Є—В–∞—В–µ–ї—М–љ–∞—П –Є–ї–Є –љ—Г—В—А–Є—В–Є–≤–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М –Є –і—А.
–†–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –Ї–∞—Е–µ–Ї—Б–Є–Є
–Ш—Б—В–Є–љ–љ—Г—О —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –њ–Є—В–∞–љ–Є—П –Њ—Ж–µ–љ–Є—В—М –Њ—З–µ–љ—М —Б–ї–Њ–ґ–љ–Њ, –Є –≤–Є–љ–Њ–є —В–Њ–Љ—Г —Б–ї–µ–і—Г—О—Й–Є–µ –њ—А–Є—З–Є–љ—Л:
• –Ї—А–∞–є–љ–µ –љ–Є–Ј–Ї–Њ–µ –≤–љ–Є–Љ–∞–љ–Є–µ –≤—А–∞—З–µ–є –Ї —Б–Њ—Б—В–Њ—П–љ–Є—О –њ–Є—В–∞—В–µ–ї—М–љ–Њ–≥–Њ —Б—В–∞—В—Г—Б–∞; —В–∞–Ї, –Ї—А—Г–њ–љ–Њ–µ –±—А–∞–Ј–Є–ї—М—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ –Љ–∞—Б—Б—Г —В–µ–ї–∞ –Є–Ј–Љ–µ—А—П–ї–Є —В–Њ–ї—М–Ї–Њ —Г 15,1% –±–Њ–ї—М–љ—Л—Е, –њ—А–Є —Н—В–Њ–Љ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М –њ–Є—В–∞–љ–Є—П –љ–∞–±–ї—О–і–∞–ї–∞—Б—М –≤ 48,1%;
• —В—А—Г–і–љ–Њ—Б—В–Є –≤ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –њ–Њ—В–µ—А–Є –Љ—Л—И–µ—З–љ–Њ–є –Љ–∞—Б—Б—Л –њ—А–Є —Б–Њ—Е—А–∞–љ–µ–љ–Є–Є –ґ–Є—А–Њ–≤–Њ–є —В–Ї–∞–љ–Є.
–†–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –Ї–∞—Е–µ–Ї—Б–Є–Є –±—Г–і–µ—В –Ј–∞–≤–Є—Б–µ—В—М –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –Њ—В –љ–Њ–Ј–Њ–ї–Њ–≥–Є–Є. –Ґ–∞–Ї, –љ–∞–њ—А–Є–Љ–µ—А, –њ—А–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –Њ–љ–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В –Њ—В 6 –і–Њ 16% [2–4]. –Ю–і–љ–∞–Ї–Њ –≤–љ–µ–і—А–µ–љ–Є–µ –≤ –њ–Њ–≤—Б–µ–і–љ–µ–≤–љ—Г—О –њ—А–∞–Ї—В–Є–Ї—Г –±–Њ–ї–µ–µ —В–Њ–љ–Ї–Є—Е, —Е–Њ—В—П –Є –ї–µ–≥–Ї–Њ –≤—Л–њ–Њ–ї–љ–Є–Љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤, –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ –≤—Л—П—Б–љ–Є—В—М, —З—В–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –Љ—Л—И–µ—З–љ–Њ–є –Љ–∞—Б—Б—Л –њ—А–Є—Б—Г—Й–µ –≤ —В–Њ–є –Є–ї–Є –Є–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –њ—А–Є–Љ–µ—А–љ–Њ 90% –±–Њ–ї—М–љ—Л—Е —Б –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є –•–°–Э –Є –Љ–Њ–ґ–µ—В –Є–Љ–µ—В—М –Љ–µ—Б—В–Њ –њ—А–Є –љ–Њ—А–Љ–∞–ї—М–љ–Њ–Љ –Є–ї–Є –і–∞–ґ–µ –њ–Њ–≤—Л—И–µ–љ–љ–Њ–Љ –Ш–Ь–Ґ [5].
–Я–Њ –і–∞–љ–љ—Л–Љ –Ј–∞—А—Г–±–µ–ґ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –≥–Њ—Б–њ–Є—В–∞–ї—М–љ–Њ–≥–Њ –≥–Њ–ї–Њ–і–∞–љ–Є—П —З—А–µ–Ј–≤—Л—З–∞–є–љ–Њ –≤—Л—Б–Њ–Ї–∞ –Є –Ј–∞–≤–Є—Б–Є—В –Њ—В «–њ—А–Њ—Д–Є–ї—П» –Њ—В–і–µ–ї–µ–љ–Є—П:
• –Њ–±—Й–∞—П —Е–Є—А—Г—А–≥–Є—П – 40–50%;
• –Њ–љ–Ї–Њ–ї–Њ–≥–Є—П – 50%;
• –Њ–±—Й–∞—П —В–µ—А–∞–њ–Є—П – 48%;
• –≥–∞—Б—В—А–Њ—Н–љ—В–µ—А–Њ–ї–Њ–≥–Є—П – 65–75%.
–Ъ–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П –Ї–∞—Е–µ–Ї—Б–Є–Є
–Я–Њ –±–µ–ї–Ї–Њ–≤—Л–Љ –њ–Њ—В–µ—А—П–Љ
–С–µ–Ј—Г—Б–ї–Њ–≤–љ–Њ, –Њ–і–љ–Њ–є –Є–Ј —Б–∞–Љ—Л—Е –Ј–љ–∞—З–Є–Љ—Л—Е –њ—А–Є –Ї–∞—Е–µ–Ї—Б–Є–Є —П–≤–ї—П–µ—В—Б—П –њ–Њ—В–µ—А—П –±–µ–ї–Ї–∞. –Э–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —В–Њ–≥–Њ, –Ї–∞–Ї–Њ–є –±–µ–ї–Њ–Ї —В–µ—А—П–µ—В—Б—П, –Є —Б—В—А–Њ–Є—В—Б—П –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Э–∞–њ–Њ–Љ–љ–Є–Љ, —З—В–Њ –≤—Л–і–µ–ї—П—О—В 2 –Њ—Б–љ–Њ–≤–љ—Л—Е –њ—Г–ї–∞ –±–µ–ї–Ї–∞: —Б–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є–є (–њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є–є –±–µ–ї–Њ–Ї –Љ—Л—И–µ—З–љ–Њ–є —В–Ї–∞–љ–Є) –Є –≤–Є—Б—Ж–µ—А–∞–ї—М–љ—Л–є (–±–µ–ї–Ї–Є —Б—Л–≤–Њ—А–Њ—В–Ї–Є –Ї—А–Њ–≤–Є –Є –≤–љ—Г—В—А–µ–љ–љ–Є—Е –Њ—А–≥–∞–љ–Њ–≤)
–°–Њ–≥–ї–∞—Б–љ–Њ –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–Њ–є –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є –±–Њ–ї–µ–Ј–љ–µ–є, —А–∞–Ј–ї–Є—З–∞—О—В 3 —В–Є–њ–∞ –Ї–∞—Е–µ–Ї—Б–Є–Є:
• –Љ–∞—А–∞–Ј–Љ (–Є—Б—В–Њ—Й–µ–љ–Є–µ —Б–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—Г–ї–∞ –±–µ–ї–Ї–∞);
• –Ї–≤–∞—И–Є–Њ—А–Ї–Њ—А (–Є—Б—В–Њ—Й–µ–љ–Є–µ –≤–Є—Б—Ж–µ—А–∞–ї—М–љ–Њ–≥–Њ –њ—Г–ї–∞ –±–µ–ї–Ї–∞);
• —Б–Љ–µ—И–∞–љ–љ–∞—П —Д–Њ—А–Љ–∞ (–Љ–∞—А–∞–Ј–Љ––Ї–≤–∞—И–Є–Њ—А–Ї–Њ—А).
–Ъ–≤–∞—И–Є–Њ—А–Ї–Њ—А – —В—П–ґ–µ–ї–∞—П —Д–Њ—А–Љ–∞ –∞–ї–Є–Љ–µ–љ—В–∞—А–љ–Њ–є –і–Є—Б—В—А–Њ—Д–Є–Є, –≤—Б—В—А–µ—З–∞–µ—В—Б—П –≤ –†–Њ—Б—Б–Є–Є –і–Њ–≤–Њ–ї—М–љ–Њ —А–µ–і–Ї–Њ –Є –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –±–µ–ї–Ї–Њ–≤–Њ–≥–Њ –≥–Њ–ї–Њ–і–∞–љ–Є—П. –Ю—Б–љ–Њ–≤–љ—Л–Љ–Є —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞–Љ–Є –Ї–≤–∞—И–Є–Њ—А–Ї–Њ—А–∞ —П–≤–ї—П—О—В—Б—П –≥–Є–њ–Њ–њ—А–Њ—В–µ–Є–љ–µ–Љ–Є—П, –±–µ–Ј–±–µ–ї–Ї–Њ–≤—Л–µ –Њ—В–µ–Ї–Є –Є –њ–µ—З–µ–љ–Њ—З–љ–∞—П –і–Є—Б—Д—Г–љ–Ї—Ж–Є—П. –Ь–∞—Б—Б–∞ —В–µ–ї–∞ –Љ–Њ–ґ–µ—В –±—Л—В—М –і–∞–ґ–µ –њ–Њ–≤—Л—И–µ–љ–∞ –Ј–∞ —Б—З–µ—В –Њ—В–µ–Ї–Њ–≤ –Є –∞—Б—Ж–Є—В–∞. –Ъ–≤–∞—И–Є–Њ—А–Ї–Њ—А —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ –≤ —Б—В—А–∞–љ–∞—Е –Р—Д—А–Є–Ї–Є, –Ъ–∞—А–Є–±—Б–Ї–Њ–≥–Њ –Є –Ґ–Є—Е–Њ–Њ–Ї–µ–∞–љ—Б–Ї–Њ–≥–Њ —А–µ–≥–Є–Њ–љ–Њ–≤.
–Ь–∞—А–∞–Ј–Љ –≤—Л—А–∞–ґ–∞–µ—В—Б—П –≤ –Є—Б—В–Њ—Й–µ–љ–Є–Є —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Є—Е –Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е –±–µ–ї–Ї–Њ–≤—Л—Е –Ј–∞–њ–∞—Б–Њ–≤. –С–Њ–ї—М–љ—Л–µ —Б –Љ–∞—А–∞–Ј–Љ–Њ–Љ –Є–Љ–µ—О—В –њ—А–Є–Ј–љ–∞–Ї–Є –∞—В—А–Њ—Д–Є–Є —Б–Ї–µ–ї–µ—В–љ—Л—Е –Љ—Л—И—Ж –Є –њ–Њ–і–Ї–Њ–ґ–љ–Њ––ґ–Є—А–Њ–≤–Њ–є –Ї–ї–µ—В—З–∞—В–Ї–Є –њ—А–Є —Б–Њ—Е—А–∞–љ–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –њ–µ—З–µ–љ–Є –Є –і—А—Г–≥–Є—Е –≤–љ—Г—В—А–µ–љ–љ–Є—Е –Њ—А–≥–∞–љ–Њ–≤. –Ь–∞—Б—Б–∞ —В–µ–ї–∞ –Њ–±—Л—З–љ–Њ –њ–Њ–љ–Є–ґ–µ–љ–∞. –Ш–Љ–µ–љ–љ–Њ —Н—В–Њ—В —В–Є–њ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В –Љ–љ–Њ–≥–Є–µ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П.
–°–Њ—З–µ—В–∞–љ–љ–Њ–є —Д–Њ—А–Љ–µ –њ—А–Є—Б—Г—Й–Є —З–µ—А—В—Л –Ї–∞–Ї –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–≥–Њ, —В–∞–Ї –Є –≤–Є—Б—Ж–µ—А–∞–ї—М–љ–Њ–≥–Њ –±–µ–ї–Ї–Њ–≤–Њ–≥–Њ –Є —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –і–µ—Д–Є—Ж–Є—В–∞.
–Я–Њ –њ—А–Њ–Є—Б—Е–Њ–ґ–і–µ–љ–Є—О
–Ъ–∞—Е–µ–Ї—Б–Є—П –Љ–Њ–ґ–µ—В –±—Л—В—М –њ–µ—А–≤–Є—З–љ–Њ–є (–≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–≥–Њ –њ–Њ—В—А–µ–±–ї–µ–љ–Є—П –њ–Є—Й–Є) –Є –≤—В–Њ—А–Є—З–љ–Њ–є (–≤–Њ–Ј–љ–Є–Ї–∞–µ—В –Ї–∞–Ї —Б–Є–љ–і—А–Њ–Љ –љ–∞ —Д–Њ–љ–µ –і—А—Г–≥–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є).
1) –Я–µ—А–≤–Є—З–љ–∞—П (—Н–Ї–Ј–Њ–≥–µ–љ–љ–∞—П) –Ї–∞—Е–µ–Ї—Б–Є—П:
• –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –≤ —В–µ—Е —Б–ї—Г—З–∞—П—Е, –Ї–Њ–≥–і–∞ —Б–Њ—Ж–Є–∞–ї—М–љ–Њ–—Н–Ї–Њ–љ–Њ–Љ–Є—З–µ—Б–Ї–Є–µ —Д–∞–Ї—В–Њ—А—Л –і–µ–ї–∞—О—В –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ—Л–Љ –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –љ–∞—Б–µ–ї–µ–љ–Є–µ–Љ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –њ–Є—Й–Є —Е–Њ—А–Њ—И–µ–≥–Њ –Ї–∞—З–µ—Б—В–≤–∞. –Т —Н—В–Є—Е —Б–ї—Г—З–∞—П—Е –≤ –њ–Є—В–∞–љ–Є–Є –њ—А–µ–Њ–±–ї–∞–і–∞—О—В —А–∞—Б—В–Є—В–µ–ї—М–љ—Л–µ –±–µ–ї–Ї–Є —Б –љ–Є–Ј–Ї–Њ–є –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —Ж–µ–љ–љ–Њ—Б—В—М—О. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –≤ –љ–µ–Ї–Њ—В–Њ—А—Л—Е —Б—В—А–∞–љ–∞—Е —З–∞—Б—В–Њ—В–∞ –С–≠–Э –Љ–Њ–ґ–µ—В –і–Њ—Б—В–Є–≥–∞—В—М 25%.
2) –Т—В–Њ—А–Є—З–љ–∞—П (—Н–љ–і–Њ–≥–µ–љ–љ–∞—П) –Ї–∞—Е–µ–Ї—Б–Є—П:
• –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –љ–∞ —Д–Њ–љ–µ –Њ—Б—В—А—Л—Е –Є–ї–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є.
–Т –і–∞–љ–љ–Њ–є —Б—В–∞—В—М–µ –Љ—Л —Б–Њ–Ј–љ–∞—В–µ–ї—М–љ–Њ –љ–µ –±—Г–і–µ–Љ –Ї–∞—Б–∞—В—М—Б—П –њ–µ—А–≤–Є—З–љ—Л—Е –≤–∞—А–Є–∞–љ—В–Њ–≤, –Њ—Б—В–∞–љ–∞–≤–ї–Є–≤–∞—П—Б—М –љ–∞ –≤—В–Њ—А–Є—З–љ—Л—Е —Д–Њ—А–Љ–∞—Е, —Б –Ї–Њ—В–Њ—А—Л–Љ–Є —В–µ—А–∞–њ–µ–≤—В–∞–Љ –њ—А–Є—Е–Њ–і–Є—В—Б—П —Б—В–∞–ї–Ї–Є–≤–∞—В—М—Б—П –љ–∞–Љ–љ–Њ–≥–Њ —З–∞—Й–µ.
–Ю—Б–љ–Њ–≤–љ—Л–µ –њ—А–Є—З–Є–љ—Л –≤—В–Њ—А–Є—З–љ–Њ–є –Ї–∞—Е–µ–Ї—Б–Є–Є
–°–њ—А–∞–≤–µ–і–ї–Є–≤–Њ—Б—В–Є —А–∞–і–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –ї—О–±–Њ–µ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ –Љ–Њ–ґ–µ—В –њ—А–Є–≤–µ—Б—В–Є –Ї –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–є –њ–Њ—В–µ—А–µ –Љ–∞—Б—Б—Л —В–µ–ї–∞. –Ю–і–љ–∞–Ї–Њ —З–∞—Й–µ –≤—Б–µ–≥–Њ –љ–∞–Љ –њ—А–Є—Е–Њ–і–Є—В—Б—П —Б—В–∞–ї–Ї–Є–≤–∞—В—М—Б—П —Б –Ї–∞—Е–µ–Ї—Б–Є–µ–є –њ—А–Є —Б–ї–µ–і—Г—О—Й–Є—Е –±–Њ–ї–µ–Ј–љ—П—Е:
• –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П;
• –≥–µ–њ–∞—В–Є—В—Л –Є —Ж–Є—А—А–Њ–Ј—Л –њ–µ—З–µ–љ–Є;
• –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Ї–Є—И–µ—З–љ–Є–Ї–∞ (–±–Њ–ї–µ–Ј–љ—М –Ъ—А–Њ–љ–∞, –Э–ѓ–Ъ, —Н–љ—В–µ—А–Є—В—Л);
• —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–є –њ–∞–љ–Ї—А–µ–∞—В–Є—В;
• —Е—А–Њ–љ–Є—З–µ—Б–Ї–∞—П –Њ–±—Б—В—А—Г–Ї—В–Є–≤–љ–∞—П –±–Њ–ї–µ–Ј–љ—М –ї–µ–≥–Ї–Є—Е (–•–Ю–С–Ы);
• —Е—А–Њ–љ–Є—З–µ—Б–Ї–∞—П —Б–µ—А–і–µ—З–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М (–•–°–Э);
• –њ–Њ—Б–ї–µ–і—Б—В–≤–Є—П —В—А–∞–≤–Љ, –Њ–ґ–Њ–≥–Њ–≤;
• –љ–µ–Ї–Њ—В–Њ—А—Л–µ —Н–љ–і–Њ–Ї—А–Є–љ–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П;
• —Б–µ–њ—Б–Є—Б;
• —В—Г–±–µ—А–Ї—Г–ї–µ–Ј –Є –і—А—Г–≥–Є–µ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П;
• —Е—А–Њ–љ–Є—З–µ—Б–Ї–∞—П –∞–ї–Ї–Њ–≥–Њ–ї—М–љ–∞—П –Є–љ—В–Њ–Ї—Б–Є–Ї–∞—Ж–Є—П;
• –°–Я–Ш–Ф.
–° –і–∞–љ–љ—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є –Ї–ї–Є–љ–Є—Ж–Є—Б—В —Б—В–∞–ї–Ї–Є–≤–∞–µ—В—Б—П –µ–ґ–µ–і–љ–µ–≤–љ–Њ. –Ъ—А–∞–є–љ–µ –≤–∞–ґ–љ–Њ —Г–Љ–µ—В—М –≤–Њ–≤—А–µ–Љ—П —А–∞—Б–њ–Њ–Ј–љ–∞—В—М –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М –њ–Є—В–∞–љ–Є—П –Є –љ–µ –і–Њ–њ—Г—Б—В–Є—В—М —А–∞–Ј–≤–Є—В–Є—П —В–µ—А–Љ–Є–љ–∞–ї—М–љ–Њ–є –Ї–∞—Е–µ–Ї—Б–Є–Є.
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –њ–Њ—Б–ї–µ–і—Б—В–≤–Є—П –Ї–∞—Е–µ–Ї—Б–Є–Є
–Т–љ–µ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –њ—А–Є—З–Є–љ—Л, –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –њ–Њ—Б–ї–µ–і—Б—В–≤–Є—П –Ї–∞—Е–µ–Ї—Б–Є–Є –µ–і–Є–љ—Л –Є –≤–Ї–ї—О—З–∞—О—В –≤ —Б–µ–±—П —Б–ї–µ–і—Г—О—Й–Є–µ —Б–Є–љ–і—А–Њ–Љ—Л:
• –∞—Б—В–µ–љ–Њ––≤–µ–≥–µ—В–∞—В–Є–≤–љ—Л–є —Б–Є–љ–і—А–Њ–Љ;
• –Љ—Л—И–µ—З–љ–∞—П —Б–ї–∞–±–Њ—Б—В—М, —Б–љ–Є–ґ–µ–љ–Є–µ —В–Њ–ї–µ—А–∞–љ—В–љ–Њ—Б—В–Є –Ї —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–є –љ–∞–≥—А—Г–Ј–Ї–µ;
• –Є–Љ–Љ—Г–љ–Њ–і–µ—Д–Є—Ж–Є—В—Л, —З–∞—Б—В—Л–µ –Є–љ—Д–µ–Ї—Ж–Є–Є;
• –і–Є—Б–±–∞–Ї—В–µ—А–Є–Њ–Ј (–Є–ї–Є —Б–Є–љ–і—А–Њ–Љ –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є –Ї–Њ–љ—В–∞–Љ–Є–љ–∞—Ж–Є–Є —В–Њ–љ–Ї–Њ–є –Ї–Є—И–Ї–Є);
• —Б–Є–љ–і—А–Њ–Љ –њ–Њ–ї–Є–≥–ї–∞–љ–і—Г–ї—П—А–љ–Њ–є —Н–љ–і–Њ–Ї—А–Є–љ–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є;
• –ґ–Є—А–Њ–≤–∞—П –і–Є—Б—В—А–Њ—Д–Є—П –њ–µ—З–µ–љ–Є;
• –њ–Њ—В–µ—А—П –ї–Є–±–Є–і–Њ —Г –Љ—Г–ґ—З–Є–љ, –∞–Љ–µ–љ–Њ—А–µ—П —Г –ґ–µ–љ—Й–Є–љ;
• –њ–Њ–ї–Є–≥–Є–њ–Њ–≤–Є—В–∞–Љ–Є–љ–Њ–Ј—Л.
–Т–ї–Є—П–љ–Є–µ –Ї–∞—Е–µ–Ї—Б–Є–Є –љ–∞ —Б–Љ–µ—А—В–љ–Њ—Б—В—М
–£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –Љ–∞—Б—Б–∞ —В–µ–ї–∞ –Є —Б–Љ–µ—А—В–љ–Њ—Б—В—М – –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј–∞–љ–љ—Л–µ –њ–∞—А–∞–Љ–µ—В—А—Л [6]. –С—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —Б–Љ–µ—А—В–љ–Њ—Б—В—М —А–µ–Ј–Ї–Њ –≤–Њ–Ј—А–∞—Б—В–∞–µ—В –њ—А–Є –Ш–Ь–Ґ –Љ–µ–љ–µ–µ 19 –Ї–≥/–Љ2. –Ф–µ—Д–Є—Ж–Є—В –Љ–∞—Б—Б—Л —В–µ–ї–∞ 45–50% —П–≤–ї—П–µ—В—Б—П —Д–∞—В–∞–ї—М–љ—Л–Љ.
–Я–∞—В–Њ–≥–µ–љ–µ–Ј
–Ь–µ—Е–∞–љ–Є–Ј–Љ—Л —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –Ї–∞—Е–µ–Ї—Б–Є–Є
–Ь–µ—Е–∞–љ–Є–Ј–Љ—Л, –њ—А–Є–≤–Њ–і—П—Й–Є–µ –Ї –њ–Њ—В–µ—А–µ –Љ–∞—Б—Б—Л —В–µ–ї–∞, –Љ–Њ–ґ–љ–Њ —А–∞–Ј–і–µ–ї–Є—В—М –љ–∞ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –≥—А—Г–њ–њ:
• –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–µ –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–µ –љ—Г—В—А–Є–µ–љ—В–Њ–≤ (–∞–љ–Њ—А–µ–Ї—Б–Є—П, –±–Њ–ї–µ–Ј–љ–Є —А–Њ—В–Њ–≤–Њ–є –њ–Њ–ї–Њ—Б—В–Є, –≥–ї–Њ—В–Ї–Є –Є –њ–Є—Й–µ–≤–Њ–і–∞ –Є –і—А.);
• –љ–∞—А—Г—И–µ–љ–Є—П –њ–µ—А–µ–≤–∞—А–Є–≤–∞–љ–Є—П –Є/–Є–ї–Є –≤—Б–∞—Б—Л–≤–∞–љ–Є—П (—Б–Є–љ–і—А–Њ–Љ—Л –Љ–∞–ї—М–і–Є–≥–µ—Б—В–Є–Є –Є –Љ–∞–ї—М–∞–±—Б–Њ—А–±—Ж–Є–Є);
• —Г—Б–Ї–Њ—А–µ–љ–љ—Л–є –Ї–∞—В–∞–±–Њ–ї–Є–Ј–Љ (—Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–°–Э, –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є, –Є–љ—Д–µ–Ї—Ж–Є—П–Љ–Є, –≥–Є–њ–µ—А—В–Є—А–µ–Њ–Ј–Њ–Љ, —Б–∞—Е–∞—А–љ—Л–Љ –і–Є–∞–±–µ—В–Њ–Љ –Є –і—А.);
• –њ–Њ–≤—Л—И–µ–љ–љ—Л–µ –њ–Њ—В–µ—А–Є –љ—Г—В—А–Є–µ–љ—В–Њ–≤ (–њ—А–Є –љ–µ—Д—А–Њ—В–Є—З–µ—Б–Ї–Њ–Љ —Б–Є–љ–і—А–Њ–Љ–µ, –•–Ю–С–Ы, –Ї–Є—И–µ—З–љ—Л—Е —Б–≤–Є—Й–∞—Е, –њ–ї–∞–Ј–Љ–Њ—А–µ—П –њ—А–Є –Њ–ґ–Њ–≥–Њ–≤–Њ–є –±–Њ–ї–µ–Ј–љ–Є);
• –њ–Њ–≤—Л—И–µ–љ–љ–∞—П –њ–Њ—В—А–µ–±–љ–Њ—Б—В—М –≤ –љ—Г—В—А–Є–µ–љ—В–∞—Е (–≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є, –ї–∞–Ї—В–∞—Ж–Є–Є, –≤ –њ–µ—А–Є–Њ–і —А–µ–Ї–Њ–љ–≤–∞–ї–µ—Б—Ж–µ–љ—Ж–Є–Є –њ–Њ—Б–ї–µ —В—А–∞–≤–Љ –Є –Њ—Б—В—А—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–є).
–Я—А–Є –Љ–љ–Њ–≥–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е –≤ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ –Ї–∞—Е–µ–Ї—Б–Є–Є –≤–Ї–ї—О—З–∞—О—В—Б—П —Б—А–∞–Ј—Г –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤, —З—В–Њ –і–µ–ї–∞–µ—В –Є—Е –Ї–Њ—А—А–µ–Ї—Ж–Є—О –Њ—Б–Њ–±–µ–љ–љ–Њ —Б–ї–Њ–ґ–љ–Њ–є.
–Ь–µ—Е–∞–љ–Є–Ј–Љ—Л –Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–Є –њ—А–Є –≥–Њ–ї–Њ–і–∞–љ–Є–Є
–Я—А–Є –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–Љ –і–µ—Д–Є—Ж–Є—В–µ –љ—Г—В—А–Є–µ–љ—В–Њ–≤ –≤–Ї–ї—О—З–∞—О—В—Б—П –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–Є, –Ї–Њ—В–Њ—А—Л–µ –њ—А–Є–Ј–≤–∞–љ—Л –Ј–∞—Й–Є—В–Є—В—М –ґ–Є–Ј–љ–µ–љ–љ–Њ –≤–∞–ґ–љ—Л–µ –Њ—А–≥–∞–љ—Л –њ—Г—В–µ–Љ –њ–µ—А–µ—А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П –њ–ї–∞—Б—В–Є—З–µ—Б–Ї–Є—Е –Є —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Є—Е —А–µ—Б—Г—А—Б–Њ–≤. –Р–і–∞–њ—В–∞—Ж–Є—П –њ—А–Њ–Є—Б—Е–Њ–і–Є—В —З–µ—А–µ–Ј —Б–љ–Є–ґ–µ–љ–Є–µ –∞–љ–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤ (–Є–љ—Б—Г–ї–Є–љ) –Є –њ–Њ–≤—Л—И–µ–љ–Є–µ –Ї–∞—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е (—Б–Њ–Љ–∞—В–Њ—В—А–Њ–њ–Є–љ, –≥–ї—О–Ї–∞–≥–Њ–љ, –∞–і—А–µ–љ–∞–ї–Є–љ, –Ї–Њ—А—В–Є–Ј–Њ–ї)
• –Я–µ—З–µ–љ—М –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –і–Њ 75% –≥–ї—О–Ї–Њ–Ј—Л –Ј–∞ —Б—З–µ—В —А–∞—Б–њ–∞–і–∞ –≥–ї–Є–Ї–Њ–≥–µ–љ–∞.
• –Я–Њ–≤—Л—И–∞–µ—В—Б—П —Г—А–Њ–≤–µ–љ—М –≥–ї—О–Ї–Њ–љ–µ–Њ–≥–µ–љ–µ–Ј–∞, –ї–Є–њ–Њ–ї–Є–Ј–∞ –Є –Ї–µ—В–Њ–≥–µ–љ–µ–Ј–∞ (–њ—А–Є –±–Њ–ї–µ–µ –і–ї–Є—В–µ–ї—М–љ–Њ–Љ –≥–Њ–ї–Њ–і–∞–љ–Є–Є).
• –Я—А–Њ–Є—Б—Е–Њ–і–Є—В –Љ–Њ–±–Є–ї–Є–Ј–∞—Ж–Є—П —Н–љ–µ—А–≥–Њ—А–µ—Б—Г—А—Б–Њ–≤ —Б–Ї–µ–ї–µ—В–љ—Л—Е –Љ—Л—И—Ж –Є –ґ–Є—А–Њ–≤–Њ–є —В–Ї–∞–љ–Є. –Т –Ї—А–Њ–≤–Є –њ–Њ–≤—Л—И–∞—О—В—Б—П —Г—А–Њ–≤–љ–Є –Ї–Њ—А–Њ—В–Ї–Њ—Ж–µ–њ–Њ—З–µ—З–љ—Л—Е –∞–Љ–Є–љ–Њ–Ї–Є—Б–ї–Њ—В (–≤–∞–ї–Є–љ–∞, –ї–µ–є—Ж–Є–љ–∞, –Є–Ј–Њ–ї–µ–є—Ж–Є–љ–∞). –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ —Н–Ї–Њ–љ–Њ–Љ–Є—В—Б—П –±–µ–ї–Њ–Ї –≤–Є—Б—Ж–µ—А–∞–ї—М–љ—Л—Е –Њ—А–≥–∞–љ–Њ–≤.
–°–Њ–Ј–і–∞–µ—В—Б—П –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–∞—П —Б–Є—В—Г–∞—Ж–Є—П –њ–µ—А–µ—А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П —А–µ—Б—Г—А—Б–Њ–≤ –≤ –њ–Њ–ї—М–Ј—Г –Є–љ—Б—Г–ї–Є–љ–љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л—Е —В–Ї–∞–љ–µ–є (–≥–Њ–ї–Њ–≤–љ–Њ–є –Є —Б–њ–Є–љ–љ–Њ–є –Љ–Њ–Ј–≥, –≥–ї–∞–Ј–љ—Л–µ —П–±–ї–Њ–Ї–Є, –Љ–Њ–Ј–≥–Њ–≤–Њ–µ –≤–µ—Й–µ—Б—В–≤–Њ –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–Њ–≤).
–£ —З–µ–ї–Њ–≤–µ–Ї–∞ —Б –љ–Њ—А–Љ–∞–ї—М–љ—Л–Љ –њ–Є—В–∞—В–µ–ї—М–љ—Л–Љ —Б—В–∞—В—Г—Б–Њ–Љ –њ—А–Є –њ–Њ–ї–љ–Њ–Љ –≥–Њ–ї–Њ–і–∞–љ–Є–Є —Б–Њ–±—Б—В–≤–µ–љ–љ—Л—Е –Ј–∞–њ–∞—Б–Њ–≤ —Е–≤–∞—В–∞–µ—В –љ–∞ 9–10 –љ–µ–і–µ–ї—М.
–Э–∞—А—Г—И–µ–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–є –≤–љ—Г—В—А–µ–љ–љ–Є—Е –Њ—А–≥–∞–љ–Њ–≤
–Т –њ–µ—А–Є–Њ–і –і–µ–Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–Є –њ—А–Њ–Є—Б—Е–Њ–і–Є—В —Г—Б–Є–ї–µ–љ–Є–µ —А–∞—Б–њ–∞–і–∞ –±–µ–ї–Ї–Њ–≤ –≤–Є—Б—Ж–µ—А–∞–ї—М–љ–Њ–≥–Њ –њ—Г–ї–∞, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –љ–∞—А—Г—И–µ–љ–Є—О —Д—Г–љ–Ї—Ж–Є–Є –Њ—А–≥–∞–љ–Њ–≤. –£–Љ–µ–љ—М—И–µ–љ–Є–µ —Б–Є–љ—В–µ–Ј–∞ –±–µ–ї–Ї–Њ–≤ —Б—Л–≤–Њ—А–Њ—В–Ї–Є –Ї—А–Њ–≤–Є –≤ –њ–µ—З–µ–љ–Є –њ—А–Є–≤–Њ–і–Є—В –Ї —А–µ–Ј–Ї–Њ–Љ—Г —Б–љ–Є–ґ–µ–љ–Є—О —Г—А–Њ–≤–љ—П —Ж–Є—А–Ї—Г–ї–Є—А—Г—О—Й–Є—Е –±–µ–ї–Ї–Њ–≤. –Ю—Б–Њ–±–µ–љ–љ–Њ —Б—В—А–∞–і–∞—О—В –Њ—А–≥–∞–љ—Л –Є —В–Ї–∞–љ–Є, –њ—А–µ–і—Б—В–∞–≤–ї—П—О—Й–Є–µ —Б–Њ–±–Њ–є –і–µ–њ–Њ –ґ–Є—А–Њ–≤ –Є —Г–≥–ї–µ–≤–Њ–і–Њ–≤.
• –°–љ–Є–ґ–∞—О—В—Б—П —Б–µ—А–і–µ—З–љ—Л–є –≤—Л–±—А–Њ—Б –Є —Б–Њ–Ї—А–∞—В–Є—В–µ–ї—М–љ–∞—П —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Љ–Є–Њ–Ї–∞—А–і–∞. –Я—А–Є —В—П–ґ–µ–ї–Њ–є –±–µ–ї–Ї–Њ–≤–Њ–—Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є —А–∞–Ј–≤–Є–≤–∞—О—В—Б—П –∞—В—А–Њ—Д–Є—П –Є –Є–љ—В–µ—А—Б—В–Є—Ж–Є–∞–ї—М–љ—Л–є –Њ—В–µ–Ї —Б–µ—А–і—Ж–∞.
• –°–ї–∞–±–Њ—Б—В—М –Є –∞—В—А–Њ—Д–Є—П –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –Љ—Л—И—Ж –њ—А–Є–≤–Њ–і–Є—В –Ї –љ–∞—А—Г—И–µ–љ–Є—О —Д—Г–љ–Ї—Ж–Є–Є –і—Л—Е–∞–љ–Є—П –Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–є –Њ–і—Л—И–Ї–µ.
• –Я–Њ—А–∞–ґ–µ–љ–Є–µ –Ц–Ъ–Ґ –њ—А–Њ—П–≤–ї—П–µ—В—Б—П –∞—В—А–Њ—Д–Є–µ–є —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –Є –њ–Њ—В–µ—А–µ–є –≤–Њ—А—Б–Є–љ–Њ–Ї —В–Њ–љ–Ї–Њ–є –Ї–Є—И–Ї–Є, –њ—А–Є–≤–Њ–і—П—Й–Є—Е –Ї —Б–Є–љ–і—А–Њ–Љ—Г –Љ–∞–ї—М–∞–±—Б–Њ—А–±—Ж–Є–Є.
• –°–љ–Є–ґ–∞–µ—В—Б—П —З–Є—Б–ї–Њ –Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–∞—П —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Ґ––ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤, –Њ—В–Љ–µ—З–∞—О—В—Б—П —А–∞–Ј–ї–Є—З–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Б–≤–Њ–є—Б—В–≤ –Т––ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤, –≥—А–∞–љ—Г–ї–Њ—Ж–Є—В–Њ–≤, –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ї–Њ–Љ–њ–ї–µ–Љ–µ–љ—В–∞, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –і–ї–Є—В–µ–ї—М–љ–Њ–Љ—Г –Ј–∞–ґ–Є–≤–ї–µ–љ–Є—О —А–∞–љ.
• –Ю—Б–Њ–±–µ–љ–љ–Њ —Б—В—А–∞–і–∞–µ—В —Д—Г–љ–Ї—Ж–Є—П –≥–Є–њ–Њ—В–∞–ї–∞–Љ–Њ––≥–Є–њ–Њ—Д–Є–Ј–∞—А–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л, —З–µ–Љ –≤–Њ –Љ–љ–Њ–≥–Њ–Љ –Є –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ—Л –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ.
–Я–∞—В–Њ–≥–µ–љ–µ–Ј –љ–µ–Ї–Њ—В–Њ—А—Л—Е —Д–Њ—А–Љ
–≤—В–Њ—А–Є—З–љ–Њ–є –Ї–∞—Е–µ–Ї—Б–Є–Є
–Ъ–∞—Е–µ–Ї—Б–Є—П –њ—А–Є –•–°–Э
–Ю—Б–љ–Њ–≤–љ—Л–Љ–Є –њ—А–Є—З–Є–љ–∞–Љ–Є —Б–љ–Є–ґ–µ–љ–Є—П –Љ–∞—Б—Б—Л —В–µ–ї–∞ –њ—А–Є –•–°–Э —П–≤–ї—П—О—В—Б—П:
1) –∞–љ–Њ—А–µ–Ї—Б–Є—П, —В–Њ—И–љ–Њ—В–∞ –Є —А–≤–Њ—В–∞ —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–≥–Њ –њ—А–Њ–Є—Б—Е–Њ–ґ–і–µ–љ–Є—П, –∞ —В–∞–Ї–ґ–µ –≤—Б–ї–µ–і—Б—В–≤–Є–µ –і–Є–≥–Є—В–∞–ї–Є—Б–љ–Њ–є –Є–љ—В–Њ–Ї—Б–Є–Ї–∞—Ж–Є–Є;
2) –Љ–∞–ї—М–∞–±—Б–Њ—А–±—Ж–Є—П –≤—Б–ї–µ–і—Б—В–≤–Є–µ –≤–µ–љ–Њ–Ј–љ–Њ–≥–Њ –Ј–∞—Б—В–Њ—П –Є —Д–Є–±—А–Њ–Ј–∞ –≤ —В–Њ–љ–Ї–Њ–є –Ї–Є—И–Ї–µ;
3) –≥–Є–њ–µ—А–Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ. –Р–Ї—В–Є–≤–∞—Ж–Є—П —Б–Є–Љ–њ–∞—В–Њ––∞–і—А–µ–љ–∞–ї–Њ–≤–Њ–є —Б–Є—Б—В–µ–Љ—Л –љ–µ–Є–Ј–±–µ–ґ–љ–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –њ—А–µ–Њ–±–ї–∞–і–∞–љ–Є—О –≤–ї–Є—П–љ–Є—П –≥–Њ—А–Љ–Њ–љ–Њ–≤ –Ї–∞—В–∞–±–Њ–ї–Є–Ј–Љ–∞: –≤ –Ї—А–Њ–≤–Є —Г —Н—В–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ–≤—Л—И–µ–љ —Г—А–Њ–≤–µ–љ—М –Ї–∞—В–µ—Е–Њ–ї–∞–Љ–Є–љ–Њ–≤, –Ї–Њ—А—В–Є–Ј–Њ–ї–∞. –С–Њ–ї–µ–µ —В–Њ–≥–Њ, —Г –і–∞–љ–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≥–Њ—А–∞–Ј–і–Њ –Љ–µ–љ—М—И–µ, —З–µ–Љ –≤ –љ–Њ—А–Љ–µ, —Б–Њ–і–µ—А–ґ–Є—В—Б—П –Њ—Б–љ–Њ–≤–љ—Л—Е –∞–љ–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤ – –°–Ґ–У, –њ–Њ–ї–Њ–≤—Л—Е —Б—В–µ—А–Њ–Є–і–Њ–≤. –≠—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –і–Є—Б–±–∞–ї–∞–љ—Б—Г –Њ–±–Љ–µ–љ–∞ –≤–µ—Й–µ—Б—В–≤ –≤ –њ–Њ–ї—М–Ј—Г –Ї–∞—В–∞–±–Њ–ї–Є–Ј–Љ–∞.
–Ъ–∞—Е–µ–Ї—Б–Є—П –њ—А–Є –Њ–љ–Ї–Њ–њ–∞—В–Њ–ї–Њ–≥–Є–Є
–Я—А–Є–Љ–µ—А–љ–Њ –њ–Њ–ї–Њ–≤–Є–љ–∞ –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –±–Њ–ї—М–љ—Л—Е –њ–Њ–≥–Є–±–∞–µ—В –Њ—В —Б–Є–љ–і—А–Њ–Љ–∞ CACS (caner – related anorexia – cachexia). –Я—А–Є —Н—В–Њ–Љ –њ—А–Є—З–Є–љ—Л –Ї–∞—Е–µ–Ї—Б–Є–Є –Љ–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ—Л:
1) –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–µ –Њ–±–Ї—А–∞–і—Л–≤–∞–љ–Є–µ –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –Њ–њ—Г—Е–Њ–ї–µ–≤—Л–Љ–Є –Ї–ї–µ—В–Ї–∞–Љ–Є;
2) –Љ–∞–ї—М–∞–±—Б–Њ—А–±—Ж–Є—П;
3) –љ–∞—А–∞—Б—В–∞–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤ (–§–Э–Ю–a, –Ш–Ы–1, –Ш–Ы–6 –Є –Ш–§–Э–g), –њ—А–Є–≤–Њ–і—П—Й–Є—Е –Ї –≥–Є–њ–µ—А–Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ—Г. –£–≤–µ–ї–Є—З–µ–љ–Є–µ —Г—А–Њ–≤–љ—П —Н—В–Є—Е –Љ–µ–і–Є–∞—В–Њ—А–Њ–≤ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –Є—Е –њ—А–Њ–і—Г—Ж–Є—А–Њ–≤–∞–љ–Є—П –Ї–∞–Ї —Б–∞–Љ–Њ–є –Њ–њ—Г—Е–Њ–ї—М—О, —В–∞–Ї –Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–Љ –≤—Б–ї–µ–і—Б—В–≤–Є–µ –∞–Ї—В–Є–≤–∞—Ж–Є–Є –Ј–∞—Й–Є—В–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤. –Я—А–Є —Н—В–Њ–Љ —Г—А–Њ–≤–µ–љ—М –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Љ–µ–і–Є–∞—В–Њ—А–Њ–≤ –Ї–Њ—А—А–µ–ї–Є—А—Г–µ—В —Б–Њ —Б—В–µ–њ–µ–љ—М—О —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В–Є –Њ–њ—Г—Е–Њ–ї–µ–≤–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ [7].
4) –Ъ –њ–Њ—Е—Г–і–∞–љ–Є—О –њ—А–Є–≤–Њ–і–Є—В –љ–µ —В–Њ–ї—М–Ї–Њ —Б–∞–Љ–∞ –±–Њ–ї–µ–Ј–љ—М, –љ–Њ –Є –µ–µ –ї–µ—З–µ–љ–Є–µ. –Э–∞—А—Г—И–µ–љ–Є—О –њ–Є—В–∞–љ–Є—П —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—В —В–Њ—И–љ–Њ—В–∞ –Є —А–≤–Њ—В–∞, –Ї–Њ—В–Њ—А—Л–µ –Њ–±—Л—З–љ–Њ –≤—Л–Ј—Л–≤–∞—О—В—Б—П –њ—А–Њ—В–Є–≤–Њ–Њ–њ—Г—Е–Њ–ї–µ–≤—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є. –Т–Њ–Ј–љ–Є–Ї–∞–µ—В –њ–Њ—А–Њ—З–љ—Л–є –Ї—А—Г–≥: –љ–∞ —Д–Њ–љ–µ –Є—Б—В–Њ—Й–µ–љ–Є—П –њ—А–Њ—В–Є–≤–Њ–Њ–њ—Г—Е–Њ–ї–µ–≤–∞—П —В–µ—А–∞–њ–Є—П –±–Њ–ї–µ–µ —В–Њ–Ї—Б–Є—З–љ–∞ –Є –Љ–µ–љ–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–∞.
5) –Ь–µ—Б—В–љ–Њ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –Њ–њ—Г—Е–Њ–ї–Є (–і–Є—Б—Д–∞–≥–Є—П, —Б—В–µ–љ–Њ–Ј –ґ–µ–ї—Г–і–Ї–∞, –Ї–Є—И–µ—З–љ–∞—П –љ–µ–њ—А–Њ—Е–Њ–і–Є–Љ–Њ—Б—В—М).
–°—Г—Й–µ—Б—В–≤—Г–µ—В –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М –Љ–µ–ґ–і—Г –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–µ–є –Њ–њ—Г—Е–Њ–ї–Є –Є —Б—В–µ–њ–µ–љ—М—О –±–µ–ї–Ї–Њ–≤–Њ–—Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є. –Ґ–∞–Ї, –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –Ї–∞—Е–µ–Ї—Б–Є—П –≤—Л—П–≤–ї—П–µ—В—Б—П —Г –±–Њ–ї—М–љ—Л—Е —Б –љ–Њ–≤–Њ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П–Љ–Є –≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–Њ–≤ –Ц–Ъ–Ґ (–њ–Є—Й–µ–≤–Њ–і, –ґ–µ–ї—Г–і–Њ–Ї), –∞ —В–∞–Ї–ґ–µ –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л –Є –њ–µ—З–µ–љ–Є – –і–Њ 80%, –ї–µ–≥–Ї–Њ–≥–Њ – –і–Њ 60% –Є –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л – 40% [8].
–Ъ–∞—Е–µ–Ї—Б–Є—П –њ—А–Є —Б–∞—Е–∞—А–љ–Њ–Љ –і–Є–∞–±–µ—В–µ I —В–Є–њ–∞
–Т–µ–і—Г—Й–Є–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–Љ –Ї–∞—В–∞—Б—В—А–Њ—Д–Є—З–µ—Б–Ї–Њ–є –њ–Њ—В–µ—А–Є –Љ–∞—Б—Б—Л —В–µ–ї–∞ –≤ —Н—В–Њ–Љ —Б–ї—Г—З–∞–µ —П–≤–ї—П–µ—В—Б—П –≥–∞—Б—В—А–Њ–Є–љ—В–µ—Б—В–Є–љ–∞–ї—М–љ–∞—П —Д–Њ—А–Љ–∞ –∞–≤—В–Њ–љ–Њ–Љ–љ–Њ–є (–≤–Є—Б—Ж–µ—А–∞–ї—М–љ–Њ–є) –љ–µ–є—А–Њ–њ–∞—В–Є–Є, –њ—А–Њ—П–≤–ї—П—О—Й–∞—П—Б—П –і–Є—Б—Д—Г–љ–Ї—Ж–Є–µ–є –њ–Є—Й–µ–≤–Њ–і–∞, –≥–∞—Б—В—А–Њ–њ–∞—В–Є–µ–є, –Ј–∞–Љ–µ–і–ї–µ–љ–љ–Њ–є —Н–≤–∞–Ї—Г–∞—Ж–Є–Њ–љ–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–µ–є –ґ–µ–ї—Г–і–Ї–∞, –∞ —В–∞–Ї–ґ–µ –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Є–Љ–Є –Ј–∞–њ–Њ—А–Њ–Љ –Є –і–Є–∞—А–µ–µ–є.
–Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –≤—Л–њ–∞–і–∞—О—В –∞–љ–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–µ —Д—Г–љ–Ї—Ж–Є–Є –Є–љ—Б—Г–ї–Є–љ–∞ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –ї–Є–њ–Є–і–Њ–≤ –Є –±–µ–ї–Ї–Њ–≤.
–Ъ–∞—Е–µ–Ї—Б–Є—П —Г –њ–Њ–ґ–Є–ї—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤
–Т –љ–Њ—А–Љ–µ –≤–Њ–Ј—А–∞—Б—В–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –љ–µ –њ—А–Є–≤–Њ–і—П—В –Ї —А–∞–Ј–≤–Є—В–Є—О –Ї–∞—Е–µ–Ї—Б–Є–Є. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л, –ї–µ–ґ–∞—Й–Є–µ –≤ –Њ—Б–љ–Њ–≤–µ –њ—А–Њ–≥—А–µ—Б—Б–Є–≤–љ–Њ–≥–Њ —Б–љ–Є–ґ–µ–љ–Є—П –Љ–∞—Б—Б—Л —Г –њ–Њ–ґ–Є–ї—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —В–∞–Ї–ґ–µ –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В –љ–µ–Ї–Њ—В–Њ—А—Л–є –Є–љ—В–µ—А–µ—Б. –Э–∞—З–Є–љ–∞—П —Б 40–50 –ї–µ—В –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –љ–µ—Г–Ї–ї–Њ–љ–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –Љ—Л—И–µ—З–љ–Њ–є –Љ–∞—Б—Б—Л —Б –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ—Л–Љ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–є –Љ–∞—Б—Б—Л –ґ–Є—А–Њ–≤–Њ–є —В–Ї–∞–љ–Є (—Б 25% –≤ 25 –ї–µ—В –і–Њ 41% –≤ 75). –Т –Ї–∞—З–µ—Б—В–≤–µ —Д–∞–Ї—В–Њ—А–Њ–≤, —Г—Б–Ї–Њ—А—П—О—Й–Є—Е —Н—В–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П, –њ—А–Є–љ—П—В–Њ —Г–Ї–∞–Ј—Л–≤–∞—В—М —Б–Є–і—П—З–Є–є –Њ–±—А–∞–Ј –ґ–Є–Ј–љ–Є, –∞ —В–∞–Ї–ґ–µ –±–Њ–ї—М—И–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —Б–Њ—Ж–Є–∞–ї—М–љ—Л—Е –Є –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Є—Е –њ—А–Є—З–Є–љ, –њ—А–Є–≤–Њ–і—П—Й–Є—Е –Ї –љ–µ–і–Њ–µ–і–∞–љ–Є—О.
–Х–і–Є–љ—Л–µ –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л
–≤—В–Њ—А–Є—З–љ–Њ–є –Ї–∞—Е–µ–Ї—Б–Є–Є
–Ю–±–Њ–±—Й–µ–љ–Є–µ –Ї–Њ–љ–Ї—А–µ—В–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ —А–∞–Ј–≤–Є—В–Є—П –Ї–∞—Е–µ–Ї—Б–Є–Є –њ—А–Є —А–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–љ—Л—Е –љ–Њ–Ј–Њ–ї–Њ–≥–Є—П—Е –њ–Њ–Ј–≤–Њ–ї—П–µ—В –≥–Њ–≤–Њ—А–Є—В—М –Њ –µ–і–Є–љ–Њ–Љ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –і–∞–љ–љ–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞. –Ю—Б–љ–Њ–≤–Њ–њ–Њ–ї–∞–≥–∞—О—Й–Є–Љ–Є –Љ–Њ–Љ–µ–љ—В–∞–Љ–Є —П–≤–ї—П—О—В—Б—П –∞–Ї—В–Є–≤–∞—Ж–Є—П –≤—Л—А–∞–±–Њ—В–Ї–Є –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤ (–§–Э–Ю–a, –Ш–Ы–1, –Ш–Ы–6), –њ—А–Є–≤–Њ–і—П—Й–Є—Е –Ї –∞–љ–Њ—А–µ–Ї—Б–Є–Є, –њ—А–µ–Њ–±–ї–∞–і–∞–љ–Є–µ —Н—Д—Д–µ–Ї—В–Њ–≤ –Ї–∞—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤ (–≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і—Л, –Ъ–Р) –љ–∞–і –∞–љ–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–Љ–Є (–°–Ґ–У, –Є–љ—Б—Г–ї–Є–љ, –њ–Њ–ї–Њ–≤—Л–µ —Б—В–µ—А–Њ–Є–і—Л). –Я—А–Є —Н—В–Њ–Љ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –Љ–Њ–±–Є–ї–Є–Ј–∞—Ж–Є—П –ґ–Є—А–Њ–≤ –Є–Ј –і–µ–њ–Њ, –∞–Љ–Є–љ–Њ–Ї–Є—Б–ї–Њ—В – –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –Є–Ј –Љ—Л—И–µ—З–љ–Њ–є —В–Ї–∞–љ–Є –Є –∞–Ї—В–Є–≤–∞—Ж–Є—П –≥–ї—О–Ї–Њ–љ–µ–Њ–≥–µ–љ–µ–Ј–∞. –Ф–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П –±–µ–ї–Ї–Њ–≤–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞ —П–≤–ї—П—О—В—Б—П —Б–ї–µ–і—Б—В–≤–Є–µ–Љ –ї–Є–±–Њ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–≥–Њ –≤—Б–∞—Б—Л–≤–∞–љ–Є—П –љ—Г—В—А–Є–µ–љ—В–Њ–≤ (–Љ–∞–ї—М–∞–±—Б–Њ—А–±—Ж–Є—П), –ї–Є–±–Њ –Є—Е –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –њ–Њ—В–µ—А–Є.
–Ю—В–ї–Є—З–Є—В–µ–ї—М–љ—Л–µ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –њ–µ—А–≤–Є—З–љ–Њ–є
–Є –≤—В–Њ—А–Є—З–љ–Њ–є –Ї–∞—Е–µ–Ї—Б–Є–Є
–Э–µ—Б–Љ–Њ—В—А—П –љ–∞ –Њ–±—Й–љ–Њ—Б—В—М –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –Ї–∞—Е–µ–Ї—Б–Є–Є –Љ–µ–ґ–і—Г –њ–µ—А–≤–Є—З–љ–Њ–є –Є –≤—В–Њ—А–Є—З–љ–Њ–є —Д–Њ—А–Љ–∞–Љ–Є —Б—Г—Й–µ—Б—В–≤—Г—О—В –љ–µ–Ї–Њ—В–Њ—А—Л–µ –Њ—В–ї–Є—З–Є—П. –Я—А–Є –њ–µ—А–≤–Є—З–љ–Њ–Љ –≥–Њ–ї–Њ–і–∞–љ–Є–Є –∞–і–∞–њ—В–Є–≤–љ–∞—П —А–µ–∞–Ї—Ж–Є—П –њ—А–Є–≤–Њ–і–Є—В –Ї —Г–Љ–µ–љ—М—И–µ–љ–Є—О –њ–Њ—В—А–µ–±–љ–Њ—Б—В–µ–є –≤–љ—Г—В—А–µ–љ–љ–Є—Е –Њ—А–≥–∞–љ–Њ–≤ –≤ –Ї–Є—Б–ї–Њ—А–Њ–і–µ, –њ—А–Є –≤—В–Њ—А–Є—З–љ–Њ–Љ –њ–Њ—В—А–µ–±–љ–Њ—Б—В—М –≤ –Ї–Є—Б–ї–Њ—А–Њ–і–µ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П. –Ч–і–µ—Б—М –љ–µ—В –Є–Ј–≤–µ—Б—В–љ–Њ–є —Б—В–∞–і–Є–є–љ–Њ—Б—В–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Ј–∞–њ–∞—Б–Њ–≤ —Н–љ–µ—А–≥–Є–Є. –Р–Ї—В–Є–≤–Є—А—Г—О—В—Б—П —Б—А–∞–Ј—Г –≤—Б–µ –њ—А–Њ—Ж–µ—Б—Б—Л –Ї–∞—В–∞–±–Њ–ї–Є–Ј–Љ–∞. –Ш–Љ–µ–љ–љ–Њ —Н—В–Є–Љ –Њ–±—К—П—Б–љ—П–µ—В—Б—П –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–µ –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –Љ—Л—И–µ—З–љ–Њ–≥–Њ –±–µ–ї–Ї–∞ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –ґ–Є—А–Њ–≤–Њ–є —В–Ї–∞–љ—М—О.
–Ф–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –њ–Є—В–∞—В–µ–ї—М–љ–Њ–є
–љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є
–Я–∞—Ж–Є–µ–љ—В—Л —Б –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О –њ–Є—В–∞–љ–Є—П –≤—Б—В—А–µ—З–∞—О—В—Б—П –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –µ–ґ–µ–і–љ–µ–≤–љ–Њ, –Њ–і–љ–∞–Ї–Њ –µ–µ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —З–∞—Б—В–Њ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В—Б—П —В–Њ–ї—М–Ї–Њ –љ–∞ –њ–Њ–Ј–і–љ–Є—Е —Б—В–∞–і–Є—П—Е, –Ї–Њ–≥–і–∞ –Є–Љ–µ—О—В—Б—П —Г–ґ–µ –љ–µ–Њ–±—А–∞—В–Є–Љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П. –Т–Є–љ–Њ–є —В–Њ–Љ—Г –Є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–µ –≤–љ–Є–Љ–∞–љ–Є–µ –≤—А–∞—З–µ–є –Ї –њ–Є—В–∞—В–µ–ї—М–љ–Њ–Љ—Г —Б—В–∞—В—Г—Б—Г, –Є —Б–Ї—А—Л—В–Њ–µ —В–µ—З–µ–љ–Є–µ –≥–Є–њ–Њ—В—А–Њ—Д–Є–Є –љ–∞ –љ–∞—З–∞–ї—М–љ—Л—Е —Н—В–∞–њ–∞—Е.
–Т —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –Љ–µ—В–Њ–і—Л –Њ—Ж–µ–љ–Ї–Є –њ–Є—В–∞—В–µ–ї—М–љ–Њ–≥–Њ —Б—В–∞—В—Г—Б–∞ –њ–Њ–і—А–∞–Ј–і–µ–ї—П—О—В—Б—П –љ–∞ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –≥—А—Г–њ–њ:
1) –Ї–ї–Є–љ–Є–Ї–Њ––∞–љ–∞–Љ–љ–µ—Б—В–Є—З–µ—Б–Ї–Є–µ;
2) –∞–љ—В—А–Њ–њ–Њ–Љ–µ—В—А–Є—З–µ—Б–Ї–Є–µ;
3) –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–µ.
–Р–љ—В—А–Њ–њ–Њ–Љ–µ—В—А–Є—З–µ—Б–Ї–Є–µ –Љ–µ—В–Њ–і—Л
1) –Ш–Ј–Љ–µ—А–µ–љ–Є–µ –Љ–∞—Б—Б—Л —В–µ–ї–∞ (–Ь–Ґ) –Є –Є–љ–і–µ–Ї—Б–∞ –Љ–∞—Б—Б—Л —В–µ–ї–∞ (–Ш–Ь–Ґ). –Ь–Ґ —Б—А–∞–≤–љ–Є–≤–∞–µ—В—Б—П —Б —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ–Љ–Њ–є –Ь–Ґ –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б —Д–Њ—А–Љ—Г–ї–Њ–є –Х–≤—А–Њ–њ–µ–є—Б–Ї–Њ–є –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є –љ—Г—В—А–Є—Ж–Є–Њ–ї–Њ–≥–Њ–≤:
–†–Ь–Ґ (–Љ—Г–ґ—З–Є–љ—Л) = –† – 100 – (–† – 152)*0,2
–†–Ь–Ґ (–ґ–µ–љ—Й–Є–љ—Л) = –† – 100 – (–† – 152)*0,4
(–† – —А–Њ—Б—В –≤ —Б–Љ).
2) –Ю—Ж–µ–љ–Ї–∞ –њ–Њ—В–µ—А–Є –Ь–Ґ –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М —Б–Њ–≥–ї–∞—Б–љ–Њ –∞–љ–∞–Љ–љ–µ—Б—В–Є—З–µ—Б–Ї–Є–Љ –і–∞–љ–љ—Л–Љ
–Я–Њ—В–µ—А—П —Б—З–Є—В–∞–µ—В—Б—П –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є, –µ—Б–ї–Є –≤–µ–ї–Є—З–Є–љ–∞ –Њ—В–Ї–ї–Њ–љ–µ–љ–Є—П —Д–∞–Ї—В–Є—З–µ—Б–Ї–Њ–є –Љ–∞—Б—Б—Л —В–µ–ї–∞ –Њ—В –њ—А–µ–і—Л–і—Г—Й–µ–є —Б–Њ—Б—В–∞–≤–ї—П–µ—В: –Ј–∞ –љ–µ–і–µ–ї—О >2%, –Ј–∞ 1 –Љ–µ—Б. >5%, –Ј–∞ 6 –Љ–µ—Б. >6,5%.
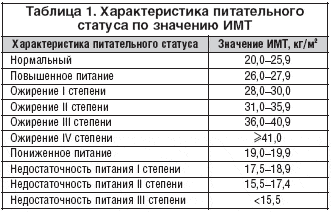
3) –Ш–Ь–Ґ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ –Ї–∞–Ї –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М —Б–Њ—Б—В–Њ—П–љ–Є—П –њ–Є—В–∞–љ–Є—П. –Ш–Ь–Ґ –≤—Л—З–Є—Б–ї—П–ї—Б—П –њ–Њ —Д–Њ—А–Љ—Г–ї–µ:
–Ш–Ь–Ґ = –≤–µ—Б (–Ї–≥)/ —А–Њ—Б—В2 (–Љ2)
–Ш–љ—В–µ—А–њ—А–µ—В–∞—Ж–Є—П —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –њ–Њ —В–∞–±–ї–Є—Ж–µ 1, —Б–Њ–≥–ї–∞—Б–љ–Њ –і–∞–љ–љ—Л–Љ –Ї–Њ—В–Њ—А–Њ–є, –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –Ј–љ–∞—З–µ–љ–Є—П –Ш–Ь–Ґ –≤—Л–і–µ–ї—П—О—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —Б—В–µ–њ–µ–љ–µ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –њ–Є—В–∞–љ–Є—П –Є –Њ–ґ–Є—А–µ–љ–Є—П.
4) –Ю—Ж–µ–љ–Ї–∞ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–љ–Њ–≥–Њ —Б–Њ—Б—В–∞–≤–∞ —В–µ–ї–∞ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Њ—Ж–µ–љ–Є—В—М –Њ—В–і–µ–ї—М–љ–Њ –Љ—Л—И–µ—З–љ—Г—О (—В–Њ—Й—Г—О) –Є –ґ–Є—А–Њ–≤—Г—О —Б–Њ—Б—В–∞–≤–ї—П—О—Й–Є–µ –Љ–∞—Б—Б—Л —В–µ–ї–∞. –≠—В–Њ –Њ—Б–Њ–±–µ–љ–љ–Њ –≤–∞–ґ–љ–Њ –≤ —Б–Є—В—Г–∞—Ж–Є—П—Е, –Ї–Њ–≥–і–∞ –њ–Њ—В–µ—А—П –±–µ–ї–Ї–∞ –Љ–∞—Б–Ї–Є—А—Г–µ—В—Б—П –Ј–∞ –Є–Ј–±—Л—В–Њ—З–љ–Њ–є –ґ–Є—А–Њ–≤–Њ–є —В–Ї–∞–љ—М—О.
–Ш–Ј–Љ–µ—А–µ–љ–Є–µ —В–Њ—Й–µ–є –Љ–∞—Б—Б—Л —В–µ–ї–∞ (–Ґ–Ь–Ґ) –њ—А–Њ–Є–Ј–≤–Њ–і—П—В –Ї–∞–ї–Є–њ–µ—А–Љ–µ—В—А–Є—З–µ—Б–Ї–Є–Љ –Љ–µ—В–Њ–і–Њ–Љ. –° –њ–Њ–Љ–Њ—Й—М—О –Ї–∞–ї–Є–њ–µ—А–∞ (–∞–і–Є–њ–Њ–Љ–µ—В—А–∞) –Є–Ј–Љ–µ—А—П—О—В—Б—П –Ї–Њ–ґ–љ–Њ––ґ–Є—А–Њ–≤—Л–µ —Б–Ї–ї–∞–і–Ї–Є (–Ъ–Ц–°) –≤ 4 —Б—В–∞–љ–і–∞—А—В–љ—Л—Е —В–Њ—З–Ї–∞—Е: –љ–∞ —Г—А–Њ–≤–љ–µ —Б—А–µ–і–љ–µ–є —В—А–µ—В–Є –њ–ї–µ—З–∞ –љ–∞–і –±–Є—Ж–µ–њ—Б–Њ–Љ, –љ–∞–і —В—А–Є—Ж–µ–њ—Б–Њ–Љ, –љ–∞ —Г—А–Њ–≤–љ–µ –љ–Є–ґ–љ–µ–≥–Њ —Г–≥–ї–∞ –ї–Њ–њ–∞—В–Ї–Є, –≤ –њ—А–∞–≤–Њ–є –њ–∞—Е–Њ–≤–Њ–є –Њ–±–ї–∞—Б—В–Є –љ–∞ 2 —Б–Љ –≤—Л—И–µ —Б—А–µ–і–љ–µ–є –њ—Г–њ–∞—А—В–Њ–≤–Њ–є —Б–≤—П–Ј–Ї–Є. –Ч–∞—В–µ–Љ –≤—Л—Б—З–Є—В—Л–≤–∞–µ—В—Б—П —Б—Г–Љ–Љ–∞ –≤—Б–µ—Е 4 —Б–Ї–ї–∞–і–Њ–Ї –Є –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –ґ–Є—А–Њ–≤–∞—П –Љ–∞—Б—Б–∞ —В–µ–ї–∞ –њ–Њ —А–∞—Б—З–µ—В–љ—Л–Љ —Д–Њ—А–Љ—Г–ї–∞–Љ.
–Ґ–Ь–Ґ –њ–Њ–і—Б—З–Є—В—Л–≤–∞–µ—В—Б—П –њ—Г—В–µ–Љ –≤—Л—З–Є—В–∞–љ–Є—П –Є–Ј –Њ–±—Й–µ–є –Љ–∞—Б—Б—Л —В–µ–ї–∞ –Љ–∞—Б—Б—Л –ґ–Є—А–Њ–≤–Њ–є —В–Ї–∞–љ–Є
–Э–Њ—А–Љ–∞–ї—М–љ—Л–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ –ґ–Є—А–∞ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ —Б—З–Є—В–∞–µ—В—Б—П –і–ї—П –Љ—Г–ґ—З–Є–љ 15–25%, –і–ї—П –ґ–µ–љ—Й–Є–љ 18–30% –Њ—В –Њ–±—Й–µ–є –Љ–∞—Б—Б—Л —В–µ–ї–∞, —Е–Њ—В—П —Н—В–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Љ–Њ–≥—Г—В –≤–∞—А—М–Є—А–Њ–≤–∞—В—М. –°–Ї–µ–ї–µ—В–љ–∞—П –Љ—Г—Б–Ї—Г–ї–∞—В—Г—А–∞ –≤ —Б—А–µ–і–љ–µ–Љ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 30% –Њ—В –Ґ–Ь–Ґ, –Љ–∞—Б—Б–∞ –≤–Є—Б—Ж–µ—А–∞–ї—М–љ—Л—Е –Њ—А–≥–∞–љ–Њ–≤ – 20%, –Ї–Њ—Б—В–љ–∞—П —В–Ї–∞–љ—М – 7%.
–Ы–∞–±–Њ—А–∞—В–Њ—А–љ—Л–µ –Љ–µ—В–Њ–і—Л –Њ—Ж–µ–љ–Ї–Є
–њ–Є—В–∞—В–µ–ї—М–љ–Њ–≥–Њ —Б—В–∞—В—Г—Б–∞
–Ы–∞–±–Њ—А–∞—В–Њ—А–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –і–∞—О—В –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –њ–Њ–ї–љ–Њ –≤—Л—П–≤–ї—П—В—М –љ–∞—А—Г—И–µ–љ–Є—П –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤, —В.–Ї. –њ–Њ–Ј–≤–Њ–ї—П—О—В –Њ—Ж–µ–љ–Є–≤–∞—В—М –Ї–∞–Ї —Б–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є–є, —В–∞–Ї –Є –≤–Є—Б—Ж–µ—А–∞–ї—М–љ—Л–є –њ—Г–ї –±–µ–ї–Ї–∞
–Ю–њ—А–µ–і–µ–ї—П—О—В —Б–ї–µ–і—Г—О—Й–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є:
• –∞–ї—М–±—Г–Љ–Є–љ;
• —В—А–∞–љ—Б—Д–µ—А—А–Є–љ;
• —В—А–∞–љ—Б—В–Є—А—А–µ—В–Є–љ;
• —А–µ—В–Є–љ–Њ–ї—Б–≤—П–Ј—Л–≤–∞—О—Й–Є–є –±–µ–ї–Њ–Ї.
–Э–∞–Є–±–Њ–ї–µ–µ –Є–љ—Д–Њ—А–Љ–∞—В–Є–≤–љ—Л–Љ–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ–Є —П–≤–ї—П—О—В—Б—П –њ–Њ—Б–ї–µ–і–љ–Є–µ —В—А–Є. –С–ї–∞–≥–Њ–і–∞—А—П –Ї–Њ—А–Њ—В–Ї–Њ–Љ—Г –њ–µ—А–Є–Њ–і—Г –њ–Њ–ї—Г—А–∞—Б–њ–∞–і–∞ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є —Н—В–Є—Е –±–µ–ї–Ї–Њ–≤ –±—Л—Б—В—А–Њ –Є–Ј–Љ–µ–љ—П–µ—В—Б—П –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –љ–∞–њ—А–∞–≤–ї–µ–љ–љ–Њ—Б—В–Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤.
–Ґ–∞–Ї–ґ–µ –Њ–њ—А–µ–і–µ–ї—П—О—В –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є:
• –∞–±—Б–Њ–ї—О—В–љ–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤;
• –Ї–Њ–ґ–љ—Г—О —А–µ–∞–Ї—Ж–Є—О –љ–∞ –≤–≤–µ–і–µ–љ–Є–µ –∞–љ—В–Є–≥–µ–љ–∞.
–°—В–µ–њ–µ–љ—М –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –њ–Є—В–∞–љ–Є—П –Њ—Ж–µ–љ–Є–≤–∞–µ—В—Б—П –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ–Є –Х–≤—А–Њ–њ–µ–є—Б–Ї–Њ–≥–Њ –Њ–±—Й–µ—Б—В–≤–∞ –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ–≥–Њ –Є —Н–љ—В–µ—А–∞–ї—М–љ–Њ–≥–Њ –њ–Є—В–∞–љ–Є—П (ESPEN) (—В–∞–±–ї. 2).
–Ы–µ—З–µ–љ–Є–µ –Ї–∞—Е–µ–Ї—Б–Є–Є
–Ъ —Б–Њ–ґ–∞–ї–µ–љ–Є—О, –і–Њ —Б–Є—Е –њ–Њ—А –љ–µ —Б—Г—Й–µ—Б—В–≤—Г–µ—В –µ–і–Є–љ–Њ–≥–Њ –њ–Њ–і—Е–Њ–і–∞ –Ї –ї–µ—З–µ–љ–Є—О –Ї–∞—Е–µ–Ї—Б–Є–Є. –С—Л–ї–Є –њ—А–µ–і–њ—А–Є–љ—П—В—Л –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л–µ –њ–Њ–њ—Л—В–Ї–Є –Ї–Њ—А—А–µ–Ї—Ж–Є–Є —Н—В–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П, –≤–Ї–ї—О—З–∞—О—Й–Є–µ –≤ —Б–µ–±—П:
1) —А–µ–Ї–Њ–Љ–±–Є–љ–∞–љ—В–љ—Л–є –≥–Њ—А–Љ–Њ–љ–∞ —А–Њ—Б—В–∞;
2) —Б—В–Є–Љ—Г–ї—П—В–Њ—А—Л –∞–њ–њ–µ—В–Є—В–∞: –∞–љ—В–∞–≥–Њ–љ–Є—Б—В—Л —Б–µ—А–Њ—В–Њ–љ–Є–љ–∞, –њ—А–Њ–≥–µ—Б—В–∞–≥–µ–љ—Л, –і—А–Њ–љ–∞–±–Є–љ–Њ–ї;
3) –∞–љ—В–Є—Ж–Є—В–Њ–Ї–Є–љ–Њ–≤—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л (–У–Ъ–°, –њ–µ–љ—В–Њ–Ї—Б–Є—Д–Є–ї–ї–Є–љ, –Љ–µ–ї–∞—В–Њ–љ–Є–љ, —В–∞–ї–Є–і–Њ–Љ–Є–і);
4) –Є–љ–≥–Є–±–Є—В–Њ—А—Л –≥–ї—О–Ї–Њ–љ–µ–Њ–≥–µ–љ–µ–Ј–∞ (–≥–Є–і—А–∞–Ј–Є–љ–∞ —Б—Г–ї—М—Д–∞—В).
–Я—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –≤—Б–µ –≤—Л—И–µ—Г–Ї–∞–Ј–∞–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –±—Л–ї–Є –Є–Ј—Г—З–µ–љ—Л –≤ –Ї—А—Г–њ–љ—Л—Е –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е, —А–µ–Ј—Г–ї—М—В–∞—В—Л –Ї–Њ—В–Њ—А—Л—Е –Њ–Ї–∞–Ј–∞–ї–Є—Б—М –≤–µ—Б—М–Љ–∞ –њ—А–Њ—В–Є–≤–Њ—А–µ—З–Є–≤—Л.
–Э—Г—В—А–Є—В–Є–≤–љ–∞—П –њ–Њ–і–і–µ—А–ґ–Ї–∞
–Я–Њ–ї–љ–Њ—Ж–µ–љ–љ–Њ–µ –њ–Є—В–∞–љ–Є–µ —Б–Њ—Б—В–∞–≤–ї—П–µ—В –Њ—Б–љ–Њ–≤—Г –ґ–Є–Ј–љ–µ–і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ —З–µ–ї–Њ–≤–µ–Ї–∞ –Є —П–≤–ї—П–µ—В—Б—П –≤–∞–ґ–љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ –Њ–±–µ—Б–њ–µ—З–µ–љ–Є—П —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Ї –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –њ—А–Њ—Ж–µ—Б—Б–∞–Љ —А–∞–Ј–ї–Є—З–љ–Њ–≥–Њ –≥–µ–љ–µ–Ј–∞. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–є –Њ–њ—Л—В —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ —В–Њ–Љ, —З—В–Њ –Њ–і–љ–Њ –Є–Ј —Ж–µ–љ—В—А–∞–ї—М–љ—Л—Е –Љ–µ—Б—В –≤ –ї–µ—З–µ–љ–Є–Є —В—П–ґ–µ–ї—Л—Е —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Ј–∞–љ–Є–Љ–∞–µ—В –Ї–Њ—А—А–µ–Ї—Ж–Є—П –Ї–∞—Е–µ–Ї—Б–Є–Є –Є –њ–Њ–ї–љ–Њ—Ж–µ–љ–љ–Њ–µ –Њ–±–µ—Б–њ–µ—З–µ–љ–Є–µ —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Є—Е –Є –њ–ї–∞—Б—В–Є—З–µ—Б–Ї–Є—Е –њ–Њ—В—А–µ–±–љ–Њ—Б—В–µ–є.
–Я—А–Є —Н—В–Њ–Љ –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–µ –њ–Є—В–∞—В–µ–ї—М–љ—Л—Е –≤–µ—Й–µ—Б—В–≤ –Љ–Њ–ґ–µ—В –Њ—Б—Г—Й–µ—Б—В–≤–ї—П—В—М—Б—П —Н–љ—В–µ—А–∞–ї—М–љ—Л–Љ –Є–ї–Є –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ—Л–Љ –њ—Г—В–µ–Љ.
1. –≠–љ—В–µ—А–∞–ї—М–љ–Њ–µ –њ–Є—В–∞–љ–Є–µ (–≠–Я)
–≠–љ—В–µ—А–∞–ї—М–љ–Њ–µ –њ–Є—В–∞–љ–Є–µ – —Б–Є—Б—В–µ–Љ–∞ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –њ–Є—В–∞—В–µ–ї—М–љ—Л—Е —Б–Љ–µ—Б–µ–є, –њ–Є—Й–µ–≤—Л—Е –њ—А–Њ–і—Г–Ї—В–Њ–≤, –њ–Њ–і–≤–µ—А–≥–љ—Г—В—Л—Е –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ–є –Њ–±—А–∞–±–Њ—В–Ї–µ –і–ї—П –Њ–±–µ—Б–њ–µ—З–µ–љ–Є—П –≤—Л—Б–Њ–Ї–Њ–є —Г—Б–≤–Њ—П–µ–Љ–Њ—Б—В–Є. –≠—В–Њ –љ–∞–Є–±–Њ–ї–µ–µ —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–љ—Л–є —Б–њ–Њ—Б–Њ–± –≤–≤–µ–і–µ–љ–Є—П –њ–Є—Й–µ–≤—Л—Е –≤–µ—Й–µ—Б—В–≤ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ.
–Я—А–Њ–≤–µ–і–µ–љ–Є–µ –≠–Я –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ per os, –∞ —В–∞–Ї–ґ–µ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –љ–∞–Ј–Њ–≥–∞—Б—В—А–∞–ї—М–љ–Њ–≥–Њ –Є–ї–Є –љ–∞–Ј–Њ–µ—О–љ–∞–ї—М–љ–Њ–≥–Њ –і–Њ—Б—В—Г–њ–∞. –Т—Л–±–Њ—А –і–Њ—Б—В—Г–њ–∞ –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –љ–∞–ї–Є—З–Є–µ–Љ —Г –±–Њ–ї—М–љ–Њ–≥–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ –њ–Є—В–∞—В—М—Б—П –Є –Њ—В—Б—Г—В—Б—В–≤–Є–µ–Љ —Г –љ–µ–≥–Њ –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –і–Є—Б—Д–∞–≥–Є–Є.
–°–Љ–µ—Б–Є –і–ї—П –≠–Я
–°–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ —Б–Љ–µ—Б–Є –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Б–Њ—Б—В–∞–≤–∞ –Є –њ—А–µ–і–љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Љ–Њ–ґ–љ–Њ —А–∞–Ј–і–µ–ї–Є—В—М –љ–∞ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –≤–Є–і–Њ–≤. [9].
–≠–ї–µ–Љ–µ–љ—В–љ—Л–µ –і–Є–µ—В—Л (—Е–Є–Љ—Г—Б–Њ–њ–Њ–і–Њ–±–љ—Л–µ), —Б–Њ—Б—В–Њ—П—Й–Є–µ –Є–Ј –Љ–Њ–љ–Њ–Љ–µ—А–Њ–≤ – –∞–Љ–Є–љ–Њ–Ї–Є—Б–ї–Њ—В, –ґ–Є—А–љ—Л—Е –Ї–Є—Б–ї–Њ—В, –≥–ї—О–Ї–Њ–Ј—Л –Є —Д—А—Г–Ї—В–Њ–Ј—Л – –Є –њ—А–µ–і–љ–∞–Ј–љ–∞—З–µ–љ–љ—Л–µ –і–ї—П –≤–љ—Г—В—А–Є–Ї–Є—И–µ—З–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П. –Э–µ–і–Њ—Б—В–∞—В–Ї–Њ–Љ —Н—В–Є—Е —Б–Љ–µ—Б–µ–є —П–≤–ї—П–µ—В—Б—П –Є—Е –≤—Л—Б–Њ–Ї–∞—П –Њ—Б–Љ–Њ–ї—П—А–љ–Њ—Б—В—М –±–Њ–ї–µ–µ 700 –Љ–Њ—Б–Љ/–ї, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –Њ—Б–Љ–Њ—В–Є—З–µ—Б–Ї–Њ–є –і–Є–∞—А–µ–µ. –°–µ–є—З–∞—Б —Н—В–Є —Б–Љ–µ—Б–Є –њ—А–Є–Љ–µ–љ—П—О—В—Б—П –Ї—А–∞–є–љ–µ —А–µ–і–Ї–Њ.
–Я–Њ–ї—Г—Н–ї–µ–Љ–µ–љ—В–љ—Л–µ —Б–Љ–µ—Б–Є, —Б–Њ—Б—В–Њ—П—Й–Є–µ –Є–Ј –±–µ–ї–Ї–Њ–≤—Л—Е –≥–Є–і—А–Њ–ї–Є–Ј–∞—В–Њ–≤ – –Њ–ї–Є–≥–Њ–њ–µ–њ—В–Є–і–Њ–≤, –і–Є– –Є –Љ–Њ–љ–Њ—Б–∞—Е–∞—А–Њ–≤, –і–ї–Є–љ–љ–Њ– –Є —Б—А–µ–і–љ–µ—Ж–µ–њ–Њ—З–µ—З–љ—Л—Е —В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–Њ–≤, –∞ —В–∞–Ї–ґ–µ –Љ–Є–Ї—А–Њ—Н–ї–µ–Љ–µ–љ—В–Њ–≤ –Є –≤–Є—В–∞–Љ–Є–љ–Њ–≤. –≠—В–Є —Б–Љ–µ—Б–Є –±—Л—Б—В—А–Њ –Є –њ–Њ–ї–љ–Њ—Б—В—М—О —Г—Б–≤–∞–Є–≤–∞—О—В—Б—П –Є –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В —Н–ї–µ–Љ–µ–љ—В–љ—Л—Е –љ–µ –њ—А–Є–≤–Њ–і—П—В –Ї —А–∞–Ј–≤–Є—В–Є—О –Њ—Б–Љ–Њ—В–Є—З–µ—Б–Ї–Њ–є –і–Є–∞—А–µ–Є.
–Т—Л—Б–Њ–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–µ —Б–±–∞–ї–∞–љ—Б–Є—А–Њ–≤–∞–љ–љ—Л–µ —Б–Љ–µ—Б–Є. –≠—В–Њ –љ–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–µ –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –њ—А–µ–њ–∞—А–∞—В—Л. –°–Њ–і–µ—А–ґ–∞—В –≤—Б–µ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В—Л –њ–Є—В–∞–љ–Є—П, —Б–±–∞–ї–∞–љ—Б–Є—А–Њ–≤–∞–љ–љ—Л–µ –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б —Б—Г—В–Њ—З–љ—Л–Љ–Є –њ–Њ—В—А–µ–±–љ–Њ—Б—В—П–Љ–Є. –£–≥–ї–µ–≤–Њ–і—Л –Њ–±—Л—З–љ–Њ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –Љ–∞–ї—М—В–Њ–і–µ–Ї—Б—В—А–Є–љ–Њ–Љ –Є –і–Є—Б–∞—Е–∞—А–Є–і–∞–Љ–Є, –ґ–Є—А—Л – —Б–Њ–µ–≤—Л–Љ –Є –і—А—Г–≥–Є–Љ–Є —А–∞—Б—В–Є—В–µ–ї—М–љ—Л–Љ–Є –Љ–∞—Б–ї–∞–Љ–Є, —П–≤–ї—П—О—Й–Є–Љ–Є—Б—П –Є—Б—В–Њ—З–љ–Є–Ї–Њ–Љ —Б—А–µ–і–љ–µ—Ж–µ–њ–Њ—З–µ—З–љ—Л—Е —В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–Њ–≤. –С–µ–ї–Ї–Є – —Ж–µ–ї—М–љ—Л–µ –Є–ї–Є –љ–Є–Ј–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–µ – –Ї–∞–Ј–µ–Є–љ–∞—В—Л, –Љ–Њ–ї–Њ—З–љ—Л–є –Є —П–Є—З–љ—Л–є –∞–ї—М–±—Г–Љ–Є–љ, —Б–Њ–µ–≤—Л–µ –Є–Ј–Њ–ї—П—В—Л.
–°–Љ–µ—Б–Є –љ–∞–њ—А–∞–≤–ї–µ–љ–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П – —А–∞—Б—Б—З–Є—В–∞–љ–љ—Л–µ –љ–∞ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–є –≤–Є–і –њ–∞—В–Њ–ї–Њ–≥–Є–Є; –њ—А–µ–і–љ–∞–Ј–љ–∞—З–∞—О—В—Б—П –і–ї—П –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є –њ—А–Є –њ–Њ—З–µ—З–љ–Њ–є, –њ–µ—З–µ–љ–Њ—З–љ–Њ–є, —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є, —Б–∞—Е–∞—А–љ–Њ–Љ –і–Є–∞–±–µ—В–µ –Є –і—А—Г–≥–Є—Е —Б–Њ—Б—В–Њ—П–љ–Є—П—Е.
–Т—Л–±–Њ—А —Б–Љ–µ—Б–Є:
–Р) –Я—А–Є —Б–Њ—Е—А–∞–љ–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –Ц–Ъ–Ґ (–љ–∞—А—Г—И–µ–љ–Є—П –њ–Є—В–∞—В–µ–ї—М–љ–Њ–≥–Њ —Б—В–∞—В—Г—Б–∞ –љ–µ —П–≤–ї—П—О—В—Б—П –Ї—А–Є—В–Є—З–љ—Л–Љ–Є) –њ—А–µ–і–њ–Њ—З—В–µ–љ–Є–µ —Б–ї–µ–і—Г–µ—В –Њ—В–і–∞–≤–∞—В—М –њ–Њ–ї—Г—Н–ї–µ–Љ–µ–љ—В–љ—Л–Љ —Б–Љ–µ—Б—П–Љ. –Ю–љ–Є –њ—А–µ–Ї—А–∞—Б–љ–Њ –њ–µ—А–µ–љ–Њ—Б—П—В—Б—П –Є —П–≤–ї—П—О—В—Б—П –љ–∞–Є–±–Њ–ї–µ–µ —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–љ—Л–Љ–Є.
–С) –Я—А–Є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –Ц–Ъ–Ґ, –Ї–Њ–≥–і–∞ —З–∞—Б—В–Є—З–љ–Њ –љ–∞—А—Г—И–µ–љ—Л –њ—А–Њ—Ж–µ—Б—Б—Л –њ–µ—А–µ–≤–∞—А–Є–≤–∞–љ–Є—П –Є–ї–Є –≤—Б–∞—Б—Л–≤–∞–љ–Є—П, –љ–∞—З–Є–љ–∞—В—М –Ї–Њ—А—А–µ–Ї—Ж–Є—О –њ–Є—В–∞–љ–Є—П –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Б –Њ–ї–Є–≥–Њ–Љ–µ—А–љ—Л—Е —Б–Љ–µ—Б–µ–є, –Њ–±–ї–∞–і–∞—О—Й–Є—Е –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О –Ї —Г—Б–≤–Њ–µ–љ–Є—О. –Ґ–∞–Ї–∞—П —Б–Є—В—Г–∞—Ж–Є—П –Љ–Њ–ґ–µ—В —Б–ї–Њ–ґ–Є—В—М—Б—П –њ—А–Є —Н–љ—В–µ—А–Є—В–∞—Е, –•–°–Э (–≤–µ–љ–Њ–Ј–љ—Л–є –Ј–∞—Б—В–Њ–є –Є —Д–Є–±—А–Њ–Ј –Ї–Є—И–µ—З–љ–Њ–є —Б—В–µ–љ–Ї–Є), –±–Њ–ї–µ–Ј–љ—П—Е –њ–µ—З–µ–љ–Є –Є –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л –Є –і—А.
–Т) –Т–Њ–њ—А–Њ—Б –Њ –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ–Љ –њ–Є—В–∞–љ–Є–Є —Б—В–∞–≤–Є—В—Б—П –њ—А–Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –Ї–∞—Е–µ–Ї—Б–Є–Є, –Ї–Њ–≥–і–∞ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –ї–Є—И—М —Н–љ—В–µ—А–∞–ї—М–љ—Л—Е —Б–Љ–µ—Б–µ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ –Є –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ.
2. –Я–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ–µ –њ–Є—В–∞–љ–Є–µ (–Я–Я)
–Я–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ–µ –њ–Є—В–∞–љ–Є–µ (–Я–Я) – —Б–њ–Њ—Б–Њ–± –Њ–±–µ—Б–њ–µ—З–µ–љ–Є—П –±–Њ–ї—М–љ–Њ–≥–Њ –њ–Є—В–∞—В–µ–ї—М–љ—Л–Љ–Є –≤–µ—Й–µ—Б—В–≤–∞–Љ–Є, –Љ–Є–љ—Г—П –Ц–Ъ–Ґ. –Я—А–Є —Н—В–Њ–Љ —Б–њ–µ—Ж–Є–∞–ї—М–љ—Л–µ –Є–љ—Д—Г–Ј–Є–Њ–љ–љ—Л–µ —А–∞—Б—В–≤–Њ—А—Л, —Б–њ–Њ—Б–Њ–±–љ—Л–µ –∞–Ї—В–Є–≤–љ–Њ –≤–Ї–ї—О—З–∞—В—М—Б—П –≤ –Њ–±–Љ–µ–љ–љ—Л–µ –њ—А–Њ—Ж–µ—Б—Б—Л –Њ—А–≥–∞–љ–Є–Ј–Љ–∞, –Љ–Њ–≥—Г—В –≤–≤–Њ–і–Є—В—М—Б—П —З–µ—А–µ–Ј –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї—Г—О –Є–ї–Є —Ж–µ–љ—В—А–∞–ї—М–љ—Г—О –≤–µ–љ—Г.
–°–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –і–Њ—Б—В–Є–ґ–µ–љ–Є—П –≤ –Њ–±–ї–∞—Б—В–Є –Я–Я –њ–Њ–Ј–≤–Њ–ї—П—О—В —И–Є—А–Њ–Ї–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М —Н—В–Њ—В –Љ–µ—В–Њ–і –љ–µ —В–Њ–ї—М–Ї–Њ –і–ї—П –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –њ–Є—В–∞—В–µ–ї—М–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –њ—А–Є –љ–∞—А—Г—И–µ–љ–Є—П—Е –Ц–Ъ–Ґ, –љ–Њ –Є –і–ї—П –і–ї–Є—В–µ–ї—М–љ–Њ–є –њ–Њ–і–і–µ—А–ґ–Ї–Є –њ–Є—В–∞—В–µ–ї—М–љ–Њ–≥–Њ —Б—В–∞—В—Г—Б–∞ —Г –±–Њ–ї—М–љ—Л—Е —Б —Б–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є–Љ–Є, –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є, –њ—Б–Є—Е–Є—З–µ—Б–Ї–Є–Љ–Є –Є–ї–Є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є, –∞ —В–∞–Ї–ґ–µ —Г –њ–Њ–ї—Г—З–∞—О—Й–Є—Е –∞–≥—А–µ—Б—Б–Є–≤–љ—Л–µ –Љ–µ—В–Њ–і—Л –ї–µ—З–µ–љ–Є—П (—Е–Є–Љ–Є–Њ–ї—Г—З–µ–≤–∞—П —В–µ—А–∞–њ–Є—П –Є —В.–і.).
–Я–Њ–љ–Є–Љ–∞–љ–Є–µ –µ–і–Є–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ —А–∞–Ј–≤–Є—В–Є—П –Ї–∞—Е–µ–Ї—Б–Є–Є, —Г—З–µ—В —П–≤–ї–µ–љ–Є–є –≥–Є–њ–µ—А–Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Є —А–∞–Ј—А–∞–±–Њ—В–∞—В—М —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ —Б–Љ–µ—Б–Є, —Б–Њ–і–µ—А–ґ–∞—Й–Є–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–є –љ–∞–±–Њ—А –Є–љ–≥—А–µ–і–Є–µ–љ—В–Њ–≤ –љ–µ —В–Њ–ї—М–Ї–Њ –і–ї—П –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –њ–Є—В–∞—В–µ–ї—М–љ–Њ–≥–Њ —Б—В–∞—В—Г—Б–∞, –љ–Њ –Є –і–ї—П –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –љ–∞ –њ–∞—В–Њ–≥–µ—В–Є—З–µ—Б–Ї–Є–µ –Ј–≤–µ–љ—М—П –Ї–∞—Е–µ–Ї—Б–Є–Є –°–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ —А–∞—Б—В–≤–Њ—А—Л –і–ї—П –Я–Я –Њ–±–ї–∞–і–∞—О—В —И–Є—А–Њ–Ї–Є–Љ —Б–њ–µ–Ї—В—А–Њ–Љ —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П –љ–∞ —Б–Є—Б—В–µ–Љ–љ–Њ–Љ, –Њ—А–≥–∞–љ–љ–Њ–Љ, –Ї–ї–µ—В–Њ—З–љ–Њ–Љ –Є —Б—Г–±–Ї–ї–µ—В–Њ—З–љ–Њ–Љ —Г—А–Њ–≤–љ—П—Е. –Я–Я –Љ–Њ–ґ–µ—В –±—Л—В—М –њ–Њ–ї–љ—Л–Љ –Є–ї–Є —З–∞—Б—В–Є—З–љ—Л–Љ.
–Я—А–Є –њ–Њ–ї–љ–Њ–Љ –Я–Я –њ—А–Є–Љ–µ–љ—П—О—В –њ—А–µ–њ–∞—А–∞—В—Л, –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—Й–Є–µ —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Є–µ –Є –њ–ї–∞—Б—В–Є—З–µ—Б–Ї–Є–µ –њ–Њ—В—А–µ–±–љ–Њ—Б—В–Є –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ – –∞–Љ–Є–љ–Њ–Ї–Є—Б–ї–Њ—В–љ—Л–µ —А–∞—Б—В–≤–Њ—А—Л, –ґ–Є—А–Њ–≤—Л–µ —Н–Љ—Г–ї—М—Б–Є–Є –Є —А–∞—Б—В–≤–Њ—А—Л —Г–≥–ї–µ–≤–Њ–і–Њ–≤.
–І–∞—Б—В–Є—З–љ–Њ–µ –Я–Я –љ–Њ—Б–Є—В –≤—Б–њ–Њ–Љ–Њ–≥–∞—В–µ–ї—М–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А, –њ—А–Є–Љ–µ–љ—П–µ—В—Б—П –і–ї—П —А–µ—И–µ–љ–Є—П –њ—А–Њ–±–ї–µ–Љ –љ–µ–і–Њ–ї–≥–Њ—Б—А–Њ—З–љ–Њ–є –љ—Г—В—А–Є—В–Є–≤–љ–Њ–є –њ–Њ–і–і–µ—А–ґ–Ї–Є –Њ—А–≥–∞–љ–Є–Ј–Љ–∞, –≤–Ї–ї—О—З–∞–µ—В –Њ—В–і–µ–ї—М–љ—Л–µ –њ–Є—В–∞—В–µ–ї—М–љ—Л–µ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В—Л
–Я—А–Є –Я–Я –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –≤–≤–µ–і–µ–љ–Є–µ –∞–Љ–Є–љ–Њ–Ї–Є—Б–ї–Њ—В, –Ї–Њ—В–Њ—А—Л–µ —Г—З–∞—Б—В–≤—Г—О—В –≤ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–µ –±–µ–ї–Ї–∞, –љ–µ–њ—А–µ—А—Л–≤–љ–Њ –њ–Њ–і–≤–µ—А–≥–∞—О—Й–µ–≥–Њ—Б—П –Њ–±–љ–Њ–≤–ї–µ–љ–Є—О. –Я–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —А—П–і –∞–Љ–Є–љ–Њ–Ї–Є—Б–ї–Њ—В, –≤—Е–Њ–і—П—Й–Є—Е –≤ —А–∞—Б—В–≤–Њ—А—Л –і–ї—П –Я–Я, –∞–Ї—В–Є–≤–љ–Њ —Б—В–Є–Љ—Г–ї–Є—А—Г—О—В –Њ—А–≥–∞–љ–љ—Л–µ –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—Ж–µ—Б—Б—Л.
–Т –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —В—П–ґ–µ—Б—В–Є –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –±–µ–ї–Ї–Є –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –Ї–∞—В–∞–±–Њ–ї–Є–Ј–Є—А—Г—О—В—Б—П –≤ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ 75–150 –≥/—Б—Г—В–Ї–Є. –†–∞–Ј—А—Г—И–µ–љ–Є–µ –±–µ–ї–Ї–Њ–≤ –≤–µ–і–µ—В –Ї –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–Љ—Г –і–µ—Д–Є—Ж–Є—В—Г –љ–µ–Ј–∞–Љ–µ–љ–Є–Љ—Л—Е –∞–Љ–Є–љ–Њ–Ї–Є—Б–ї–Њ—В, –Ї –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ–Љ—Г –∞–Ј–Њ—В–Є—Б—В–Њ–Љ—Г –±–∞–ї–∞–љ—Б—Г, –і–∞–ґ–µ –µ—Б–ї–Є –њ–Њ—В–µ—А–Є –±–µ–ї–Ї–∞ –Ї–Њ–Љ–њ–µ–љ—Б–Є—А—Г—О—В—Б—П. –Я–Њ—Б–ї–µ–і—Б—В–≤–Є—П–Љ–Є –і–µ—Д–Є—Ж–Є—В–∞ –±–µ–ї–Ї–Њ–≤ —П–≤–ї—П—О—В—Б—П –і–Є—Б—Д—Г–љ–Ї—Ж–Є—П –Њ—А–≥–∞–љ–Њ–≤ –Є —Б–Є—Б—В–µ–Љ, –Ј–∞–Љ–µ–і–ї–µ–љ–љ–Њ–µ –≤—Л–Ј–і–Њ—А–Њ–≤–ї–µ–љ–Є–µ, –Њ—Б–ї–∞–±–ї–µ–љ–Є–µ —А–µ–њ–∞—А–∞—В–Є–≤–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤, —Б–љ–Є–ґ–µ–љ–Є–µ —Б–Њ–њ—А–Њ—В–Є–≤–ї—П–µ–Љ–Њ—Б—В–Є –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –Ї –Є–љ—Д–µ–Ї—Ж–Є—П–Љ, –∞–љ–µ–Љ–Є—П.
–†–∞–Ј–ї–Є—З–∞—О—В –Ј–∞–Љ–µ–љ–Є–Љ—Л–µ –∞–Љ–Є–љ–Њ–Ї–Є—Б–ї–Њ—В—Л, –љ–µ–і–Њ—Б—В–∞—В–Њ–Ї –Ї–Њ—В–Њ—А—Л—Е –Љ–Њ–ґ–µ—В –±—Л—В—М –≤–Њ—Б–њ–Њ–ї–љ–µ–љ –Ј–∞ —Б—З–µ—В —Н–љ–і–Њ–≥–µ–љ–љ–Њ–≥–Њ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П, –Є –љ–µ–Ј–∞–Љ–µ–љ–Є–Љ—Л–µ –∞–Љ–Є–љ–Њ–Ї–Є—Б–ї–Њ—В—Л, –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –Ї–Њ—В–Њ—А—Л—Е –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –љ–µ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –Є –Ї–Њ—В–Њ—А—Л–µ –і–Њ–ї–ґ–љ—Л –њ–Њ—Б—В—Г–њ–∞—В—М –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ –Є–Ј–≤–љ–µ. –Ю–і–љ–∞–Ї–Њ —Б—Г—Й–µ—Б—В–≤—Г—О—В —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л–µ —Г—Б–ї–Њ–≤–љ–Њ –љ–µ–Ј–∞–Љ–µ–љ–Є–Љ—Л–µ –∞–Љ–Є–љ–Њ–Ї–Є—Б–ї–Њ—В—Л (–∞—А–≥–Є–љ–Є–љ –Є –≥–Є—Б—В–Є–і–Є–љ), –Ї–Њ—В–Њ—А—Л–µ –Њ–Ї–∞–Ј—Л–≤–∞—О—В –Ј–љ–∞—З–Є–Љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ —Б–Є–љ—В–µ–Ј –±–µ–ї–Ї–∞.
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —Б–Њ–Ј–і–∞–љ—Л –њ—А–µ–њ–∞—А–∞—В—Л, —Б–Њ–і–µ—А–ґ–∞—Й–Є–µ —Б–±–∞–ї–∞–љ—Б–Є—А–Њ–≤–∞–љ–љ—Г—О —Б–Љ–µ—Б—М –љ–µ–Ј–∞–Љ–µ–љ–Є–Љ—Л—Е –Є –Ј–∞–Љ–µ–љ–Є–Љ—Л—Е –∞–Љ–Є–љ–Њ–Ї–Є—Б–ї–Њ—В, –Ї–Њ—В–Њ—А—Л–µ –њ—А–Є –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–Љ –≤–≤–µ–і–µ–љ–Є–Є –≤–Ї–ї—О—З–∞—О—В—Б—П –≤ –±–Є–Њ—Б–Є–љ—В–µ–Ј –±–µ–ї–Ї–Њ–≤ –Є —Г—Б—В—А–∞–љ—П—О—В –±–µ–ї–Ї–Њ–≤—Л–є –і–µ—Д–Є—Ж–Є—В.
3. –°–Љ–µ—И–∞–љ–љ–Њ–µ –њ–Є—В–∞–љ–Є–µ
–Ю—Б–љ–Њ–≤–љ—Л–Љ –љ–µ–і–Њ—Б—В–∞—В–Ї–Њ–Љ –Я–Я —П–≤–ї—П–µ—В—Б—П —А–∞–Ј–≤–Є—В–Є–µ –і–Є—Б—В—А–Њ—Д–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –Ї–Є—И–µ—З–љ–Є–Ї–∞ –≤—Б–ї–µ–і—Б—В–≤–Є–µ –Њ—В—Б—Г—В—Б—В–≤–Є—П –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є—П –њ–Є—В–∞—В–µ–ї—М–љ—Л—Е –≤–µ—Й–µ—Б—В–≤. –≠—В–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В —А–Є—Б–Ї –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –љ–∞ —Д–Њ–љ–µ —Б–Є–љ–і—А–Њ–Љ–∞ —В—А–∞–љ—Б–ї–Њ–Ї–∞—Ж–Є–Є –±–∞–Ї—В–µ—А–Є–є. –Т–Њ–Ј–Љ–Њ–ґ–љ—Л–Љ —А–µ—И–µ–љ–Є–µ–Љ –і–∞–љ–љ–Њ–є –њ—А–Њ–±–ї–µ–Љ—Л —П–≤–ї—П–µ—В—Б—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —Д–Њ—А–Љ—Л –љ—Г—В—А–Є—В–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –Ї–Њ–≥–і–∞ –љ–∞ —Д–Њ–љ–µ –њ–Њ–ї–љ–Њ–≥–Њ –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ–≥–Њ –њ–Є—В–∞–љ–Є—П —Б–Њ—Е—А–∞–љ—П–µ—В—Б—П –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–µ –њ–Є—В–∞—В–µ–ї—М–љ—Л—Е –≤–µ—Й–µ—Б—В–≤ —З–µ—А–µ–Ј –Ц–Ъ–Ґ –і–ї—П –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є—П —А–∞–Ј–≤–Є—В–Є—П –∞—В—А–Њ—Д–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –Ї–Є—И–µ—З–љ–Є–Ї–∞.

–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. –Р—А—Г—В—О–љ–Њ–≤ –У.–Я. –Ъ–∞—Е–µ–Ї—Б–Є—П —Г –±–Њ–ї—М–љ—Л—Е —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О. –Ъ–∞–Ї–Њ–≤ –Љ–∞—Б—И—В–∞–± –њ—А–Њ–±–ї–µ–Љ—Л? –І—В–Њ –Љ—Л –Ј–љ–∞–µ–Љ –Є —З—В–Њ –љ–∞–Љ –і–µ–ї–∞—В—М? –°–µ—А–і–µ—З–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М, 2001, –Ґ2, вДЦ3.
2. Kannel W.B., Belanger A.J. Epidemiology of HF. Am Heart J 1991; 121: 951–957.
3. Carr J.G., Stevenson L.W. , Walden J.a. Prevalence and hemodynamic correlates of malnutrition in severe CHF secondary to ishemic or idiopathic dilated cardiomyopathy. Am S Card 1989; 63: 709–713.
4. Abel R.M., Fischer J, Buckley M. Malnutricion in cardiac surgical patients. Arch Surg 1976; 111: 45–50.
5. –С–µ–є—В—Г–≥–∞–љ–Њ–≤ –Р.–Р., –Т–µ—А—И–Є–љ–Є–љ –Р.–Р. –Э—Г—В—А–Є—В–Є–≤–љ–∞—П –њ–Њ–і–і–µ—А–ґ–Ї–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–°–Э –Є —Б–љ–Є–ґ–µ–љ–љ–Њ–є –Ґ–Ь–Ґ –≤ –њ–µ—А–Є–Њ–і –њ—А–Њ–≥—А–µ—Б—Б–Є–Є –±–Њ–ї–µ–Ј–љ–Є. –°–µ—А–і–µ—З–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М, —В–Њ–Љ 2, 2001. вДЦ 3.
6. –С—Г—В—А–Њ–≤–∞ –°.–Р. –Ь–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–є —Б–Є–љ–і—А–Њ–Љ: –њ–∞—В–Њ–≥–µ–љ–µ–Ј, –Ї–ї–Є–љ–Є–Ї–∞, –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞, –њ–Њ–і—Е–Њ–і—Л –Ї –ї–µ—З–µ–љ–Є—О. –†–Ь–Ц, 2001, –Ґ 9, вДЦ2.
7. Matthys P., Billiau A. Cytokines and cachexia Nutrition.– 1997.– Vol.13. P. 763 – 770.
8. Bruera E: ABC of palliative care. Anorexia, cachexia, and nutrition. BMJ. – 1997.– Vol.315, N.7117. – P. 1219–1222.
9. –†—Г–Ї–Њ–≤–Њ–і—Б—В–≤–Њ –њ–Њ –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ–Љ—Г –Є —Н–љ—В–µ—А–∞–ї—М–љ–Њ–Љ—Г –њ–Є—В–∞–љ–Є—О –њ–Њ–і —А–µ–і–∞–Ї—Ж–Є–µ–є –•–Њ—А–Њ—И–Є–ї–Њ–≤–∞ –Ш.–Х., –°–∞–љ–Ї—В––Я–µ—В–µ—А–±—Г—А–≥, 2000.












