Для многих злокачественных онкологических заболеваний в поздней стадии характерно метастазирование первичных опухолей в кости скелета [Roodman, 2004 г.]. Рост опухоли в костной ткани объясняется наличием сложного механизма взаимодействий: опухоль вырабатывает различные факторы, которые оказывают влияние на функциональную активность остеобластов и остеокластов. В свою очередь, клетки костного матрикса вырабатывают факторы роста, которые способствуют росту опухоли. Метастазы в костной ткани (МКТ) являются отличительной особенностью многих злокачественных новообразований в поздних стадиях и наблюдаются у 75% больных раком молочной железы или предстательной железы и у 15–40% больных раком легкого, толстой кишки или почки [Coleman, 2001]. МКТ вызывает развитие костных событий (КС), таких как костная боль, компрессия спинного мозга [Coleman, 2006 г.] и гиперкальциемия [Diel с соавт., 2000]. КС и в том числе костная боль ограничивают пациента в способности к передвижению и оказывают существенное негативное воздействие на качество жизни. После выявления МКТ средняя продолжительность жизни больных раком молочной железы составляет 2,5 года [Diel с соавт., 2000; Domchek с соавт., 2000]; поэтому важно найти эффективный долгосрочный метод лечения КС и, в том числе, устранения болей в костях. Хирургическое вмешательство, лучевая терапия и терапия опиоидами могут снизить интенсивность костной боли, но более 20% пациентов невосприимчивы к этим видам лечения [Yau с соавт., 2004; McPartland и Grosjean, 2004]. Лечение бисфосфонатами – стандартный способ терапии МКТ [Coleman, 2001; Diel с соавт., 2000; Mystakidou с соавт., 2005]. В настоящее время в клинической практике для лечения МКТ используют следующие бисфосфонаты: ибандроновая кислота, золедроновая кислота, памидронат и клодронат. Бондронат (ибандроновая кислота) – единственный бисфосфонат, который можно назначать как внутривенно, так и перорально без потери клинической эффективности. Результаты исследований III фазы показали сходную эффективность обеих форм ибандроновой кислоты для профилактики развития КС у больных раком молочной железы и для профилактики МКТ [Diel с соавт., 2000; Body с соавт., 2003, 2004]. Сравнительных исследований по оценке эффективности и безопасности внутривенной и пероральной форм ибандроновой кислоты прежде не проводилось. Главной целью этого исследования являлась оценка эффективности (клинического ответа) и безопасности внутривенной и пероральной форм ибандроновой кислоты у пациентов с различными типами опухолевых процессов. Второстепенной целью являлось определение степени влияния ибандроновой кислоты на частоту и количество приема анальгетиков, характер метастатической костной боли и качество жизни.
Материалы и методы
Дизайн исследования
Проспективное рандомизированное открытое исследование по оценке эффективности и переносимости внутривенной и пероральной форм Бондроната проводилось в течение 6 месяцев в рамках одного исследовательского центра, госпиталь Аретиона при Афинском Государствнном Университете. Пациенты были рандомизированы на 2 равные группы по 26 пациентов: в одной группе пациенты получали Бондронат внутрь (1 таблетка 50 мг/сут. перед завтраком), в другой – в дозе 6 мг в виде 15–минутной инфузии внутривенно каждые 28 дней. Возрастной и половой состав групп был сходным, как и показатели веса, роста, артериального давления, локализации первичной опухоли, области и объема метастазирования, а также количества областей, где применялась лучевая терапия. Исследование разрабатывалось и проводилось в соответствии с Хельсинкской декларацией и Протокол исследования получил одобрение этического комитета. Перед проведением любой процедуры исследования каждый пациент подписал информированное согласие.
В исследование включались пациенты в возрасте 18 лет и старше, с солидной злокачественной опухолью и, как минимум, одним очагом поражения костной ткани, нормальной функцией почек (уровень креатинина ≥1,5 мг/дл) и нормальной функцией печени, общесоматическим статусом по классификации ВОЗ 0, I и II, предполагаемой продолжительностью жизни ≥6 месяцев, нормокальциемией или асимптоматичной гиперкальциемией. К критериям исключения относились беременность или лактация, недавнее применение нефротоксичной терапии (например, диуретики, цисплатин) или терапии, модулирующей активность остеокластов (например, митрамицин, кальцитонин и т.д.), почечная или печеночная недостаточность, а также наличие активного инфекционного процесса.
Оценка клинического ответа
Оценка клинического ответа на внутривенную или пероральную терапию ибандроновой кислотой основывалась на изменениях, наблюдаемых при проведении сцинтиграфии костей скелета и рентгенографии скелета через 3 и 6 месяцев от начала лечения [Yahara с соавт., 2003]. Полный клинический ответ регистрировался при исчезновении или полной рекальцификации всех остеолитических метастазов. Частичный клинический ответ характеризовался исчезновением некоторых, но не всех существующих остеобластных метастазов, или ≥50%–м уменьшением размера измеряемых остеобластных метастазов и ≥30%–м уменьшением размера остеобластных метастазов, поддающихся оценке, или, как минимум, частичной рекальцификацией ≥1 остеолитического метастаза и отсутствием новых метастазов. Стабилизация заболевания констатировалась при отсутствии увеличения количества или размера метастатических поражений, а прогрессирование заболевания отмечалось при появлении новых метастазов или росте уже имеющихся метастазов. На 3 и 6 месяце проводилась оценка содержания С–концевых телопептидов коллагена I типа (S–CTX) в сыворотке крови, а также наличие других биохимических маркеров метаболизма костной ткани.
Оценка интенсивности боли и качества жизни
На 3 и 6 месяце оценивался процент пациентов, которым изменяли дозы и кратность приема анальгетиков, кроме того, определялись показатели среднего изменения интенсивности болевого синдрома и среднего изменения показателей качества жизни в процентнах. Для оценки интенсивности болевого синдрома при МКТ использовался опросник G–BPI (The Greek Brief Pain Inventory). В опроснике использовалась шкала оценки интенсивности боли, а также учитывалась степень влияния болевого синдрома на определенные виды деятельности: общую активность, способность к передвижению, работоспособность и удовлетворенность жизнью. Подсчет баллов проводился на основе 10–балльной шкалы (0 – нет боли/не влияет на активность; 10 – невыносимая боль/полностью влияет на активность). Уровень качества жизни определялся с помощью общей функциональной оценки при проведении противоопухолевой терапии (FACT–G; шкалы, оценивающие общее физическое и функциональное состояние). Обе шкалы в рамках данной системы оценки состоят из семи вопросов; каждый вопрос оценивался по 4–балльной шкале (0 – очень низкий уровень качества жизни; 4 – очень высокий уровень качества жизни). Совокупность ответов на эти семь вопросов каждой шкалы определяют общий уровень физического и функционального состояния.
Безопасность
Оценка безопасности проводилась в течение всего периода лечения на основе изучения зарегистрированных побочных явлений. При проведении развернутого клинического анализа крови контролировался уровень гемоглобина, число тромбоцитов и лейкоцитов. На 3 и 6 месяце исследования оценивался уровень мочевины, сывороточного креатинина, сывороточной g–глутамилтрансферазы, щелочной фосфатазы, гематокрита (Ht), билирубина, микроальбумина и кальция (Ca) сыворотки крови.
Результаты
Всего в исследование было включено 52 пациента, и все они в дальнейшем прошли рандомизацию. Демографические показатели пациентов двух групп не отличались между собой (табл. 1). У 17 пациентов (32%) из 52 отмечалось наличие сопутствующих заболеваний. Основные локализации первичной опухоли пациентов: молочная железа, легкое, мочевыделительная система, толстая кишка и предстательная железа (табл. 2). Наблюдалось метастатическое поражение следующих костей скелета: позвоночник (n=24), плоские кости (n=17), верхние (n=5) и нижние (n=7) конечности, череп (n=3) и крестцово–подвздошное сочленение (n=5). У 22 пациентов наблюдалось более 3 очагов метастатического поражения костной ткани. 42% пациентов прошли хирургическое лечение, а 85% ранее получали лучевую терапию (табл. 3).
Основные показатели среднего уровня болевого синдрома, использования анальгетиков и качества жизни свидетельствовали о сопоставимости показателей двух групп лечения (табл. 1). Также в обеих группах показатели биохимических маркеров оставались неизменными.
Эффективность
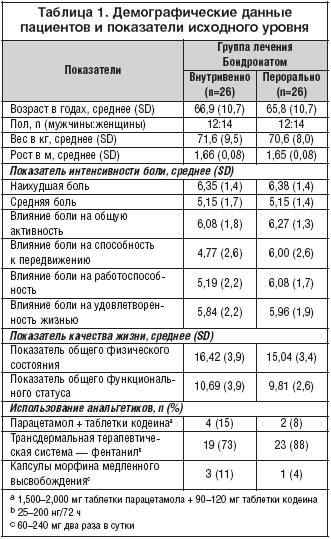
Бондронат внутрь получали всего 26 человек (в дозе 1 таблетка по 50 мг/сут.), и 26 пациентов получали Бондронат в виде 15–минутной инфузии внутривенно каждые 28 дней. По результатам 6–месячного наблюдения назначение Бондроната внутривенно и перорально характеризуется одинаковой эффективностью в отношении метастатического поражения костной ткани; у 84,6 и 88,5% пациентов отмечался полный или частичный ответ на терапию ибандроновой кислотой внутривенно или перорально соответственно (рис. 1А). Кроме того, уровень процентного снижения S–CTX после 6 месяцев терапии как в группе внутривенного назначения препарата, так и в группе перорального приема практически не отличался: –39 и –35% соответственно (рис. 1Б).
Показатели интенсивности боли
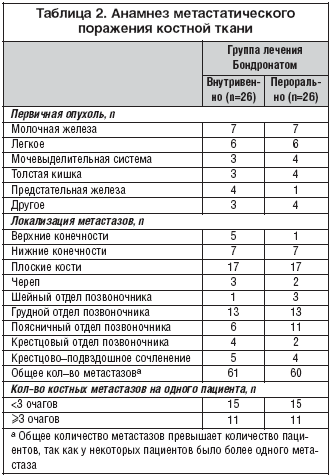
После 3–месячного курса лечения Бондронатом у 70% пациентов увеличилась потребность в приеме обезболивающих средств (рис. 2А). При этом в группе перорального приема процент пациентов с увеличением потребности в анальгетиках был несколько выше, чем в группе внутривенного введения Бондроната. В период с 3 месяца лечения по 6 месяц у 80% пациентов в двух группах лечения не наблюдалось разницы в приеме обезболивающих препаратов (рис. 2Б).
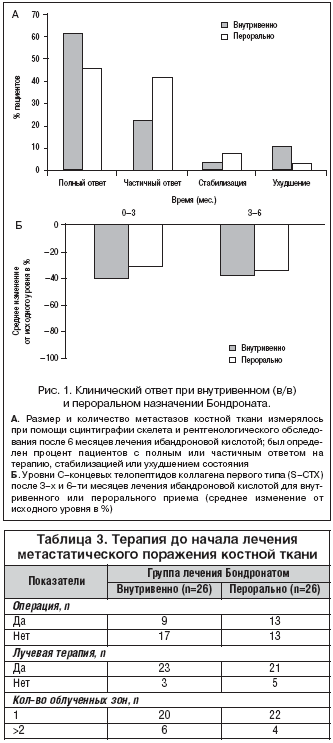
В двух группах лечения отмечалось одинаковое снижение показателей интенсивности болевого синдрома (рис. 3А). Наибольшее снижение уровня боли наблюдалось в первые 3 месяца терапии. При этом у пациентов с наивысшей степенью выраженности болевого синдрома снижение составило около 57%, а у пациентов со средней интенсивностью боли отмечалось снижение на уровне 70%. После 3 месяцев лечения Бондронатом отмечалось снижение влияния болевого синдрома на общую активность пациента на 66 и 65%, а также на удовлетворенность жизнью на 80 и 75% при внутривенном и пероральном приеме препарата, соответственно. Данные показатели сохранялись и в течение следующего 3–месячного периода лечения (рис. 3Б).
Качество жизни
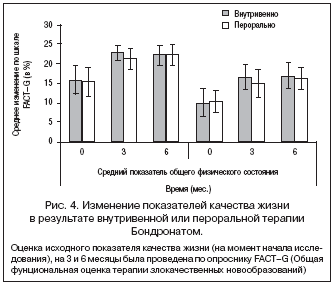
Средний показатель общего физического состояния увеличился с уровня 16 баллов на исходном визите до 24,4 и 22,5 на визите шестого месяца при внутривенном и пероральном назначении Бондроната, соответственно (рис. 4). После 6 месяцев лечения Бондронатом показатель общего функционального статуса увеличился с уровня 10 баллов до 17,2 при внутривенном назначении и до 16,3 при пероральном назначении Бондроната (рис. 4). Увеличение данных показателей демонстрирует улучшение функционального статуса пациентов, принимающих Бондронат.
Безопасность
Из 52 включенных в исследование пациентов 34 завершили весь курс лечения (18 пациентов получали внутривенное лечение и 16 пероральную терапию). Всего 9 пациентов выбыли из исследования, 6 из которых получали внутривенную форму препарата и 3 пациента проходили курс лечения пероральной формой ибандроновой кислоты. В ходе исследования не сообщалось о нежелательных явлениях, связанных с исследуемым препаратом. В ходе исследования в группе пероральной терапии наблюдалось 7 летальных исходов, а в группе внутривенного назначения препарата – 2 летальных исхода; летальные случаи не были связаны с проводимой терапией.
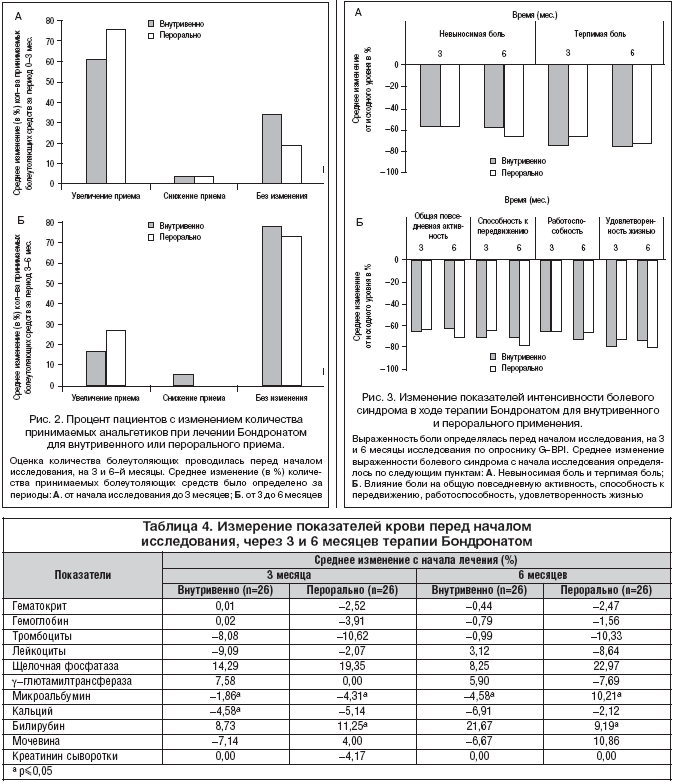
Значительного изменения средних показателей гематокрита, гемоглобина, числа тромбоцитов, лейкоцитов, щелочной фосфатазы, g–глютамилтрансферазы, мочевины и креатинина сыворотки крови с исходного визита после 3– и 6–месячного курса лечения ибандроновой кислотой не наблюдалось (табл. 4). Уровень Са снизился в обеих группах лечения после 3– и 6–месячного курса лечения, однако в группе внутривенного назначения препарата снижение Са оказалось статистически достоверным (снижение на 6,9% в ходе 6–месячного курса лечения). После 3– и 6–месячного курса лечения отмечалось повышение уровня билирубина у пациентов двух групп лечения, однако в группе перорального назначения препарата повышение билирубина оказалось достоверным (на 9,2% в ходе 6–месячного курса лечения, р<0,05). Достоверное снижение микроальбумина сыворотки крови наблюдалось после 3 и 6 месцев лечения (снижение на 4,6 и 10,2% после шести месяцев лечения внутривенной и пероральной формой Бондроната, соответственно, р<0,05).
Обсуждение
В этом прямом сравнительном исследовании перорального и внутривенного Бондроната обе формы препарата показали сходный клинический ответ у пациентов с МКТ при разных типах опухолевых процессов.
Не было отмечено достоверной зависимости полученных результатов от конкретного типа опухоли. У большинства пациентов наблюдался полный или частичный ответ, как и предполагалось при составлении протокола, согласно которому в течение 6 месяцев должна была произойти резорбция костных метастазов при отсутствии новых метастазов. В исследованиях III фазы (Бондронат внутривенного и перорального применения vs плацебо) различия в уровне маркеров ремоделирования костной ткани и интенсивности костной боли были зарегистрированы уже к 3 месяцу [Body с соавт., 2003; Body с соавт., 2004]. В течение всего исследования III фазы продолжительностью около 2 лет у 49% пациентов, принимавших Бондронат внутривенно, не наблюдалось новых костных осложнений [Body с соавт., 2003]. Данные результаты указывают на стабилизацию процесса после нескольких месяцев терапии. Следует отметить, что достигнутый результат сохраняется более 2 лет.
По данным предыдущих исследований медиана времени до возникновения первого КС составляла 50–91 неделю. В целом данные, приведенные здесь, соответствуют результатам предыдущих исследований Бондроната, указывая на стабилизацию метастатического процесса в костной ткани, которой пациенты достигают в течение нескольких месяцев после начала терапии, а достигнутый результат может сохраняться в течение нескольких лет.
Показателем клинической эффективности в исследовании являлось снижение уровня маркеров костного ремоделирования в сыворотке крови у пациентов, получающих Бондронат перорально либо внутривенно. Снижение уровня маркеров костной резорбции было сравнимо в обеих группах как на 3–м, так и на 6–м месяце терапии. Измерение уровня биохимических маркеров костного ремоделирования часто применяется в исследованиях, но еще не одобрено к применению в клинической практике. Рост концентрации маркеров резорбции костной ткани характеризует прогрессирование заболевания и позволяет предупредить (спрогнозировать) патологические переломы у пациентов с МКТ [Brown с соавт., 2005; Coleman, 2002]. Данные ряда исследований показали значимость измерения уровня маркеров костного ремоделирования при оценке клинического ответа на терапию бисфосфонатами, так как была показана взаимосвязь между снижением уровней маркеров костной резорбции и снижением риска возникновения КС, включая костную боль [Coleman с соавт., 2005; Garnero, 2001; Brown с соавт., 2003; Lipton с соавт., 1998, 2005; Berenson с соавт., 2001; Berruti с соавт., 1999]. Кроме оценки резорбции кости посредством определения концентрации концевых телопептидов коллагена первого типа в сыворотке и моче, в ходе предшествующих испытаний были определены уровни сывороточных маркеров остеогенеза, таких как костноспецифическая щелочная фосфатаза, аминоконцевой проколлаген пропептида коллагена первого типа и остеокальцин. В сравнительном исследовании Бондроната для перорального приема и золедроновой кислоты внутривенно у больных раком молочной железы и МКТ уровни маркеров костной резорбции снизились в равной степени. Следовательно Бондронат для перорального приема не уступает по эффективности внутривенным инфузиям золедроновой кислоты [Body с соавт., 2007].
В ходе данного исследования были оценены вторичные критерии эффективности, такие как костная боль, применение анальгетиков и качество жизни. Было отмечено снижение интенсивности костной боли в результате применения Бондроната и перорально, и внутривенно, при этом результат сохранялся на протяжении 6 месяцев лечения. Невозможно рассматривать влияние Бондроната на метастатические костные боли без учета влияния приема болеутоляющих средств (особенно в первые 3 месяца, когда пациенты из обеих групп увеличивали прием анальгетиков). Однако прием анальгетиков с 3 по 6 месяц оставался неизменным, а интенсивность болевого синдрома продолжала снижаться, указывая на действие Бондроната относительно снижения выраженности болевого синдрома и на положительное влияние Бондроната на общий функциональный статус. Воздействие Бондроната для перорального и внутривенного приема на выраженность боли у больных раком молочной железы и МКТ было доказано и в ходе крупномасштабного рандомизированного плацебо–контролируемого клинического исследования III фазы. Существенное снижение интенсивности костной боли наблюдалось уже на первых неделях после начала лечения, и этот эффект сохранялся в течение 2–х лет, при этом снизилась потребность в приеме анальгетиков и повысились показатели качества жизни [Yahara с соавт., 2003; Coleman с соавт., 2005]. Также обнадеживающие результаты воздействия Бондроната на костную боль наблюдали у больных раком предстательной железы, мочевого пузыря и мочевыводящей системы (Бондронат назначался в дозе по 6 мг внутривенно ежедневно в течение 3 дней, затем – стандартный, поддерживающий режим дозирования через каждые 4 недели) и при множественной миеломе (назначалась нестандартная доза объемом 2 мг внутривенно) [Heidenreich с соавт., 2003; Ohlmann и Heidenreich, 2003; Menssen с соавт., 2002]. Полное исчезновение болевого синдрома было достигнуто в результате приема Бондроната в дозе 6 мг в комбинации с лучевой терапией у пациентов с литическими, склеротическими, смешанными метастазами костной ткани при различных опухолевых процессах [Vassiliou с соавт., 2007]. В данном исследовании Бондронат продемонстрировал свою эффективность в снижении метастатической костной боли как среди 14 больных раком молочной железы, так и 38 пациентов с другими типами опухолевых процессов (рак легкого, рак мочеполовой системы, рак толстой кишки, рак предстательной железы).
В исследовании наблюдалась удовлетворительная переносимость Бондроната как в форме для перорального приема, так и для внутривенного введения. Не наблюдалось существенных изменений биохимических параметров крови за 6 месяцев терапии (показатели остались в норме), а также нежелательных явлений, которые могли бы привести к прекращению терапии. Нужно отметить, что уровень креатинина сыворотки (маркер функции почек) оставался неизменным в ходе всего исследования. В отличие от некоторых других внутривенных бисфосфонатов [Markowitz с соавт., 2002; Chang с соавт., 2003] влияние Бондроната на функцию почек сравнимо с плацебо, что подтверждают результаты 4–летнего наблюдения [Pecherstorfer с соавт., 2006]. Этот факт чрезвычайно важен для пациентов, получающих нефротоксическую противоопухолевую терапию, или для пациентов с выявленной ранее почечной патологией. Таким образом, применение Бондроната позволяет сэкономить время медицинского персонала, которое тратится на контроль нежелательных явлений со стороны почек, а так же на мониторинг функции почек перед и после каждой инфузии [Jackson, 2005].
Литература
1. Berenson JR, Rosen LS, Howell A et al (2001) Zoledronic acid reduces skeletal-related events in patients with osteolytic metastases. Cancer 91:1191–1200. doi:10.1002/1097-0142 (20010401)91:71191::AID-CNCR1119[3.0.CO;2-0
2. Berruti A, Dogliotti L, Gorzegno G et al (1999) Differential patterns of bone turnover in relation to bone pain and disease extent in bone in cancer patients with skeletal metastases. Clin Chem 45:1240–1247
3. Body JJ, Diel IJ, Lichinitser MR, for the MF 4265 Study Group et al (2003) Intravenous ibandronate reduces the incidence of skeletal complications in patients with breast cancer and bone metastases. Ann Oncol 14:1399–1405. doi:10.1093/annonc/mdg367
4. Body JJ, Diel IJ, Lichinitzer M et al (2004) Oral ibandronate reduces the risk of skeletal complications in breast cancer patients with metastatic bone disease: results from two randomised, placebocontrolled phase III studies. Br J Cancer 90:1133–1137. doi:10.1038/sj.bjc.6601663
5. Body JJ, Lichinitser M, Tjulandin S, Garnero P, Bergstrom B (2007) Oral ibandronate is as active as intravenous zoledronic acid for reducing bone turnover markers in women with breast cancer and bone metastases. Ann Oncol 18:1165–1171. doi:10.1093/ annonc/mdm119
6. Brown JE, Thomson CS, Ellis SP, Gutcher SA, Purohit OP, Coleman RE (2003) Bone resorption predicts for skeletal complications in metastatic bone disease. Br J Cancer 89:2031–2037. doi:10.1038/sj.bjc.6601437
7. Brown JE, Cook RJ, Major P et al (2005) Bone turnover markers as predictors of skeletal complications in prostate cancer, lung cancer, and other solid tumours. J Natl Cancer Inst 97:59–69
8. Chang JT, Green L, Beitz J (2003) Renal failure with the use of zoledronic acid. N Engl J Med 349:1676–1679. doi:10.1056/NEJM200310233491721
9. Coleman RE (2001) Metastatic bone disease: clinical features, pathophysiology and treatment strategies. Cancer Treat Rev 27:165–176. doi:10.1053/ctrv.2000.0210
10. Coleman RE (2002) The clinical use of bone resorption markers in patients with malignant bone disease. Cancer 94:2521–2533. doi:10.1002/cncr.10522
11. Coleman RE (2006) Clinical features of metastatic bone disease and risk of skeletal morbidity. Clin Cancer Res 12(20 suppl):6243s–6249s. doi:10.1158/1078-0432.CCR-06-0931
12. Coleman RE, Major P, Lipton A et al (2005) Predictive value of bone resorption and formation markers in cancer patients with bone metastases receiving the bisphosphonate zoledronic acid. J Clin Oncol 23:4925–4935. doi:10.1200/JCO.2005.06.091
13. Diel IJ, Solomayer EF, Bastert G (2000) Treatment of metastatic bone disease in breast cancer: bisphosphonated. Clin Breast Cancer 1:43–51
14. Domchek SM, Younger J, Finkelstein DM, Seiden MV (2000) Predictors of skeletal complications in patients with metastatic breast carcinoma. Cancer 89:363–368. doi:10.1002/1097-0142 (20000715)89:2363::AID-CNCR22[3.0.CO;2-3
15. Garnero P (2001) Markers of bone turnover in prostate cancer. Cancer Treat Rev 27:187–192. doi:10.1053/ctrv.2000.0213
16. Heidenreich A, Ohlmann C, Olbert P, Hegele A (2003) High-dose ibandronate is effective and well tolerated in the treatment of pain and hypercalcaemia due to metastatic urologic cancer. Eur J Cancer 1(Suppl 5):S270
17. Jackson GH (2005) Renal safety of ibandronate. Oncologist 10(Suppl 1):14–18. doi:10.1634/theoncologist.10-90001-14
18. Leyland-Jones B (2004) Pharmacokinetic and clinical equivalence of oral and intravenous ibandronate for metastatic bone disease. Eur J Cancer suppl 2:9–12
19. Lipton A, Demers L, Curley E et al (1998) Markers of bone resorption in patients treated with pamidronate. Eur J Cancer 34:2021–2026. doi:10.1016/S0959-8049(98)00277-9
20. Lipton A, Hei Y, Coleman R, Major P, Cook R (2005) Suppression of bone turnover markers by zoledronic acid and correlation with clinical outcome. J Clin Oncol 23(Suppl 16 S):115 Abstract 532
21. Markowitz GS, Fine PL, D’agati VD (2002) Nephrotic syndrome after treatment with pamidronate. Am J Kidney Dis 39:1118–1122. doi:10.1053/ajkd.2002.32797
22. McPartland C, Grosjean L (2004) Treatment of painful bone metastases in Europe and Canada: the role of bisphosphonates. Ann Oncol 15(Suppl 3):iii50 abstract
23. Menssen HD, Sakalova? A, Fontana A et al (2002) Effects of long-term intravenous ibandronate therapy on skeletal-related events, survival, and bone resorption markers in patients with advanced multiple myeloma. J Clin Oncol 20:2353–2359. doi:10.1200/JCO. 2002.02.032
24. Mystakidou K, Katsouda E, Stathopoulou E, Vlahos L (2005) Approaches to managing bone metastases from breast cancer: the role of bisphosphonates. Cancer Treat Rev 31:303–311. doi:10.1016/j.ctrv.2005.03.005
25. Ohlmann C, Heidenreich A (2003) Efficacy of ibandronate in the management of painful osseous metastases due to hormone refractory prostate cancer. Support Care Cancer 11:396 Abstract A–38
26. Pecherstorfer M, Rivkin S, Body JJ, Diel I, Bergstro?m B (2006) Longterm safety of intravenous ibandronic acid for up to 4 years in metastatic breast cancer: an open-label trial. Clin Drug Investig 26:315–322. doi:10.2165/00044011-200626060-00002
27. Roodman GD (2004) Mechanisms of bone metastasis. N Engl J Med 350:1655–1664. doi:10.1056/NEJMra030831
28. Vassiliou V, Kalogeropoulou C, Giannopoulou E, Leotsinidis M, Tsota I, Kardamakis D (2007) A novel study investigating the therapeutic outcome of patients with lytic, mixed and sclerotic bone metastases treated with combined radiotherapy and ibandronate. Clin Exp Metastasis 24:169–178. doi:10.1007/s10585-007-9066-x
29. Yahara J, Noguchi M, Noda S (2003) Quantitative evaluation of bone metastasis in patients with advanced prostate cancer during systemic treatment. BJU Int 92:379–384. doi:10.1046/j.1464-410X.2003.04362.x
30. Yau V, Chow E, Davis L, Holden L, Schueller T, Danjoux C (2004) Pain management in cancer patients with bone metastases remains a challenge. J Pain Symptom Manage 27:1–3. doi:D:10.1016/j.jpainsymman.2003.10.003.












