Синдром анорексии–кахексии представляет собой совокупность симптомов и характеризуется потерей веса, анорексией, быстрым насыщением, извращением вкуса, выраженной слабостью и депрессией. В той или иной степени этот синдром встречается при любой локализации опухоли, особенно при поражениях желудочно–кишечного тракта (ЖКТ), когда нарушаются процессы пищеварения [1]. Однако прямой связи между весом опухоли и потерей массы тела нет. Опухоль, объем которой не превышает 0,01% от общего веса больного, может вызвать тяжелую потерю массы тела. В то же время тяжелая кахексия при раке легкого, например, не является прямым результатом нарушенного питания или нарушенного всасывания пищи [2].
Несмотря на то, что большинство клиницистов рассматривают истощение как фактор риска возникновения различных осложнений противоопухолевого лечения и повышения смертности, питательные режимы у онкологических больных оставляют желать лучшего. Среди множества доводов, оправдывающих осторожное использование искусственного питания, основными являются следующие: недостаточная конкретность практических советов при их большом разнообразии; недостаток доказательных исследований, основанных на большом количестве клинического материала; неоднозначность рекомендаций по проведению питательной поддержки. Подобные претензии можно перечислять и дальше. Это приводит к тому, что в повседневной онкологической практике роль ПП сведена к минимуму [3,4]. Однако оценка состояния питания больного и назначение дополнительной ПП – важные пункты комплексного лечения и не должны быть прерогативой экспертов по питанию, в особенности у онкологического больного, когда патогенез истощения весьма сложен и затрагивает многие пути метаболизма.
Патогенез синдрома анорексии–кахексии
На сегодняшний день синдром анорексии–кахексии рассматривается как результат взаимодействия между опухолью и организмом, однако природа его до конца не выяснена [5,6]. Известно, что в результате специфического воздействия опухоли повышается секреция провоспалительных цитокинов, инициирующих развитие системного воспалительного ответа [7], который становится персистирующим и характеризуется повышенной продукцией фактора некроза опухоли – α (ФНО–α), интерлейкина–1β (ИЛ–1β), интерлейкина–6 (ИЛ–6) и интерферона–γ (ИФ–γ) и индукцией ответа острой фазы. Безусловно, при наличии инфекционного поражения это полезно, поскольку позволяет активизировать иммунную систему и ускорить выздоровление. Однако у онкологического больного паранеопластические процессы приводят к развитию состояния хронического воспаления, усиливающего кахексию и иммуносупрессию. Как показано в экспериментальных работах, назначение цитокинов (ФНО–α, ИЛ–1β, ИЛ–6 и ИФ–γ) приводит к появлению симптомов анорексии и истощения [8–12]. Следует отметить, что для синдрома анорексии–кахексии характерно уменьшение объема скелетной мускулатуры с относительной сохранностью массы висцерального белка [13]. Такие глобальные перемены являются отражением комплексного перестроения метаболических процессов и в скелетной мускулатуре, и в печени каждого больного. При этом скорость синтеза белка в скелетных мышцах замедляется [14], в то время как распад белка усиливается или остается неизменным, а в печени ускоряется синтез белков острой фазы (рис. 1) [15].
Как правило, у большинства онкологических больных имеется анорексия, являющаяся результатом дисбаланса между гормонами, ответственными за чувство голода и насыщения [16]. В гипоталамусе синтезируется нейропептид–Y, который является мощным стимулятором аппетита, а также проопиомеланокортин, обладающий противоположным действием. Основными периферическими регуляторами потребления пищи выступают такие гормоны, как грелин, стимулирующий аппетит, и лептин, подавляющий его [17]. В исследованиях последних лет было обнаружено, что цитокины (ИЛ–1β, ИЛ–6, ФНО–α) способны вызвать дисбаланс в этой регуляторной системе, нарушая механизм обратной связи лептина, вызывая постоянную стимуляцию анорексигенных пептидов, таких как кортикотропин–релизинг фактор, или подавляя секрецию нейропептида–g [18]. К сожалению, данные клинических исследований достаточно скудны и противоречивы.
Роль нейроэндокринной системы в развитии синдрома анорексии–кахексии изучена недостаточно хорошо. Тем не менее известно, что одной из причин развития атрофии мышечной ткани при раке является дисбаланс между продукцией анаболических и катаболических гормонов [21,22]. Обнаружено, что у онкологических больных часто выявляется резистентность к инсулину на фоне повышенного уровня сывороточного кортизола и повышенной экспрессии миостатина [21,23]. В исследованиях последних лет продемонстрирована взаимосвязь между системным воспалением и снижением анаболической гормональной активности. Показано, например, что у истощенных больных резистентность к инсулину коррелирует с повышением сывороточной концентрации ИЛ–6 [24]. В свою очередь, ФНО–α повышает резистентность к инсулину в скелетной мускулатуре, усиливая нарушения углеводного обмена [25].
Опухоль продуцирует специфические факторы, такие как протеолиз–индуцирующий фактор (ПИФ) [26] и липид–мобилизующий фактор (ЛМФ) [27], которые ускоряют распад белка и способствуют мобилизации жира из депо [28]. В экспериментальных и клинических работах последних лет показана корреляция этих факторов с величиной потери массы тела у животных и людей [29].
Известно, что онкологические больные могут терять вес даже при нормальном питании. Возможно, причиной этого феномена является повышение потребностей в энергии. Однако на практике измеряемые энергетические потребности онкологического больного могут быть как повышенными [30], так и нормальными [31] или пониженными [32]. Возможно, причина такой вариабельности заключается в различном гистологическом строении опухоли, стадии и распространенности болезни. Так, например, при раке поджелудочной железы и легких потребности в энергии возрастают [33,34], а при раке пищевода [35] и желудка, наоборот, уменьшаются [36].
Кроме того, алиментарная недостаточность (на фоне повышенных потребностей) способствует развитию дефицита микронутриентов [37] и витаминов [38,39]. Это приводит к усилению иммуносупрессии, редукции ответа лимфоцитов на митогены, перестройке клеточного иммунитета, дисфункции фагоцитов, снижению активности Т–лимфоцитов и ослаблению антиоксидантной защиты [40,41]. При этом наличие злокачественного образования уже способствует индукции анергии и апоптоза иммунокомпетентных клеток, формируя иммунодепрессию [42]. У онкологических больных состояние иммунной системы можно охарактеризовать как вторичный (приобретенный) иммунодефицит, возникающий в результате воздействия злокачественной опухоли [43].
Помимо метаболических расстройств, онкологические больные часто страдают от психологического дискомфорта и находятся в состоянии тяжелой депрессии [2]. Противоопухолевое лечение (хирургическое, химиотерапия и облучение) способствует появлению новых симптомов, влияющих на состояние питательного статуса [44]. Их влияние зависит от вида лечения и индивидуальной переносимости [45]. На фоне лечения энергетические потребности, как правило, повышаются, усиливая истощение, и ПП должна восприниматься как терапия, способная улучшить ответ на противоопухолевое лечение, снизить количество осложнений и по возможности уменьшить разницу между потребностями в нутриентах и реальным потреблением пищи.
Таким образом, в результате паранеопластического воздействия происходит сложная многоступенчатая перестройка метаболических процессов и иммунной системы, которая, безусловно, непосредственно влияет на исход противоопухолевого лечения.
Хирургическое лечение больных
Больные, поступающие на плановое оперативное вмешательство, в большинстве случаев рассматриваются как компенсированные. К примеру, у больных раком пищевода при дисфагии III–IV степени существенное изменение белковых фракций сыворотки крови (общего белка и альбумина) отмечается только на поздних стадиях болезни. Однако оперативное вмешательство и связанный с ним операционный стресс вызывают функциональную перестройку всех систем организма. Особенно это характерно для современной онкохирургии, где выполняемые расширенные комбинированные вмешательства отличаются особой травматичностью, сопровождаются резекцией нескольких органов и приводят к значительному усилению катаболических процессов в послеоперационный период. Потери азота в ранний послеоперационный период очень высоки. Например, при операциях Льюиса, по нашим данным, в сутки теряется около 25 г азота [46], при операциях по поводу новообразований толстой кишки – порядка 17 г [47]. Связано это с тем, что для осуществления анаболических процессов в ране, для поддержания синтезирующей функции печени, для обеспечения адекватной работы иммунной системы необходимо большое количество пластического и энергетического материала, которым становятся мышечные белки, жировая ткань и кожа [48]. Неиспользованные фрагменты миофибрилл выводятся почками, что способствует значительному повышению потерь азота [49]. В результате в ранний послеоперационный период отмечается резкое снижение концентрации белковых фракций крови (общий белок ≤42 г/л, альбумин ≤25 г/л) [46], что достоверно повышает летальность в критических состояниях [43]. Кроме того, в это время на фоне углубления иммунодефицита возможно развитие сепсиса [43].
Именно для адекватного обеспечения энергетических и пластических потребностей необходимо назначение искусственного питания, особенно пациентам, перенесшим оперативное вмешательство на органах ЖКТ. Катаболические процессы у этой группы больных настолько тяжелы, что даже при назначении искусственного питания справиться с ними удается только к 14 п/о суткам [50]. Показано, что у больных, не получающих в периоперационный период ПП, процессы распада белка идут с гораздо большей скоростью, чем у пациентов, ее получающих [51]. Так, за неделю неосложненного послеоперационного периода пациенты теряют от 10 до 15% массы тела (МТ). В дальнейшем, вне зависимости от радикальности операции, больные продолжают худеть, однако отмечено, что пациенты, получавшие в послеоперационный период ПП, теряют в течение последующих 3 мес. около 10 кг, а пациенты, ее не получавшие – до 18 кг. Такая потеря веса значительно усиливает астению, ухудшает качество жизни и работоспособность больного [52].
Тем не менее именно в онкохирургии при назначении ПП, а именно парентерального питания, клиницисты сталкиваются с определенными трудностями. Операционная травма, нарушение лимфооттока при выполнении расширенной лимфодиссекции, раннее развитие острого повреждения легких или ОРДС на фоне большой кровопотери, острого ДВС–синдрома, массивная трансфузия, преимущественно пожилой возраст больных, а также необходимость проведения многокомпонентной инфузионной терапии в послеоперационный период – все это уменьшает возможности для назначения ПП [53]. Относительная гиперволемия и положительный водно–солевой баланс также ухудшают течение раннего послеоперационного периода у онкологических больных [54]. Кроме того, в исследованиях последних лет было показано, что положительный водный и солевой баланс в это время отрицательно влияет на функцию кишечника. При положительном водно–солевом балансе скорость восстановления функций ЖКТ заметно замедляется и срок пребывания больного в стационаре увеличивается [55–57]. Решением проблемы обеспечения адекватного искусственного питания без развития гипергидратации может стать использование концентрированных растворов для парентерального питания, например, Аминосол–Нео 10% и 15% (производство Хемофарм А.Д. Сербия). Именно высокая концентрация аминокислот (незаменимых и заменимых), представленных в L–форме, обеспечивает высокую суточную дозу парентерально вводимого азота (до 26 г/л), не утяжеляя гиперволемию. Медленная инфузия раствора аминокислот предотвращает развитие гиперосмолярности. Кроме того, Аминосол–Нео может использоваться как инфузионная среда для введения лекарственных препаратов, поскольку раствор совместим со многими лекарствами, в частности с антибиотиками, фуросемидом, инсулином, гепарином и т.д. К тому же в раннем послеоперационном периоде флаконная методика проведения парентерального питания более предпочтительна из–за ее лучшей управляемости и лабильности.
В настоящее время применение адекватной питательной поддержки рассматривается как обязательный компонент комплексной терапии онкологических больных [58]. Обоснованием этому служат результаты нескольких мета–анализов проспективных рандомизированных исследований, опубликованных в течение последних лет. Показано, что проведение адекватного искусственного питания достоверно снижает количество инфекционных осложнений в послеоперационный период и уменьшает длительность пребывания в стационаре, снижая себестоимость лечения [59–61]. Тем не менее однозначно утверждать, что периоперационное назначение нутриентов снижает летальность, исследователи не берутся.
Большое внимание уделяется исследованию эффективности ПП у истощенных больных. К этой категории относятся больные, потерявшие более 10% от исходной МТ за последние полгода, индекс массы тела (ИМТ, отношение МТ, кг/(рост, м)2) которых меньше 18,5, а концентрация альбумина ниже 30 г/л. На большом количестве клинического материала показано значительное увеличение риска развития в ранний послеоперационный период нозокомиальных инфекций, с 7,1 до 12,3% [62], и повышение вероятности летального исхода [63]. Результаты мультицентровых рандомизированных контролируемых исследований, проведенных у больных с потерей МТ более 10%, показали, что назначение в периоперационный период искусственного питания (в течение 7 сут. до и 7 сут. после операции) достоверно снижает количество осложнений и смертность [64–66], а применение раннего послеоперационного энтерального питания (на 2–3–и сут.) позволяет уменьшить число инфекционных осложнений, снизить тяжесть и длительность послеоперационного периода [67]. Тем не менее универсальность раннего энтерального питания (ЭП) несколько преувеличена. Так, при хирургическом вмешательстве на проксимальных отделах пищеварительного тракта его рекомендуется назначать в более поздние сроки и с большой осторожностью [68].
Попытки улучшить результаты хирургического лечения у истощенных больных, используя так называемое иммунное ЭП вместо стандартных смесей, пока не принесли ощутимых результатов, и польза от его применения в периоперационный период остается предметом обсуждений. Как показывают результаты мета–анализа, опубликованного в 2006 г., при сравнении иммунного питания и стандартных смесей у истощенных онкологических больных достоверного снижения числа инфекционных осложнений не обнаружено [67]. С другой стороны, результаты нескольких мета–анализов показали, что использование иммунного ЭП у неистощенных больных (потери МТ<10%) снижает риск возникновения инфекционных осложнений и длительность госпитализации, не влияя, тем не менее, на летальность [69–71].
Возникающие в отдаленном послеоперационном периоде пострезекционные синдромы также влияют на характер и адекватность питания. Например, после резекции пищевода возникает парез желудка (как результат ваготомии), а также мальабсорбция жиров. После резекции желудка или гастрэктомии нарушается утилизация жиров, белков, кальция, витаминов, появляется демпинг–синдром, возникает анемия [48]. Удаление тонкого или толстого кишечника приводит к нарушению всасывания воды и электролитов, макро– и микронутриентов, появлению тяжелой диареи [72]. Принципы ПП при развитии пострезекционных синдромов предполагают использование, в первую очередь, дополнительного орального питания специальными смесями, а при отсутствии эффекта назначать парентеральное питание [48].
Таким образом, при наличии признаков белково–энергетической недостаточности (потеря МТ≥10%, ИМТ≤18,5, альбумин сыворотки крови ≤30 г/л) в предоперационном периоде показано проведение питательной поддержки. Преимущественным считается энтеральный путь введения нутриентов. При невозможности его использования или в случае, если предполагается голодание в течение недели и более, показано проведение парентерального питания. Следует избегать излишней водно–солевой нагрузки и по возможности быстрее возвращаться к энтеральному введениию нутриентов.
Нехирургическое лечение больных
Результаты многочисленных исследований доказывают, что состояние питания является важным прогностическим фактором при противоопухолевом лечении [73–76]. У истощенных больных чаще возникают побочные эффекты от проводимого лечения [77], они плохо отвечают на химиотерапию [78,79], долго находятся на стационарном лечении [80], в этой группе больных отмечается низкая выживаемость [81].
Стоит отметить, что на сегодняшний день опасения, касающиеся возможности бурного роста опухоли на фоне краткосрочной ПП, являются необоснованными. Посвященные этой проблеме немногочисленные клинические исследования не показали прямой зависимости роста опухоли от назначения различных режимов клинического питания [82]. Рассматривая необходимость назначения ПП пациентам, получающим нехирургическое противоопухолевое лечение, следует помнить, что методом выбора является ЭП [83]. Очень важно, что рутинное назначение питательной терапии на фоне химиотерапии не показано, т.к. она не влияет ни на эффективность основного лечения, ни на уменьшение проявлений его токсичности [84].
Еще в 1994 г. были опубликованы результаты масштабного исследования, в ходе которого анализировалась эффективность применения ЭП на фоне химиотерапии. В него были включены пациенты с различной патологией и разнообразными режимами химиотерапии и ПП. Авторами было показано, что при умеренной степени нарушения питательного статуса или при его сохранности назначение ЭП не оказывает достоверного влияния ни на выживаемость, ни на снижение проявлений токсичности полихимиотерапии [85]. Недавний мета–анализ четырех контролируемых рандомизированных исследований показал, что по сравнению с рутинным ведением дополнительное назначение зондового ЭП на фоне проведения химио– или лучевой терапии не оказывает существенного влияния на выживаемость больных. Исследователи считают безопасным и полезным назначение дополнительно к естественной диете смесей для орального питания [67]. Показанием же для зондового питания (через пункционную гастростому) служит вероятность развития на фоне противоопухолевой терапии солидных опухолей мукозитов, особенно эзофагита [84].
Рутинное назначение парентерального питания во время проведения химиотерапии или облучения не показано. Тем не менее, если пациент истощен или предполагается, что в течение недели он будет голодать, а проведение ЭП невозможно, проведение парентерального питания считается обоснованным [83].
Исследования, посвященные изучению эффективности ПП на фоне химиотерапии и облучения, показали, что назначение парентерального питания пациентам с нормальным питательным статусом и адекватным прохождением пищи по пищеводу нецелесообразно, поскольку не влияет на выживаемость, число инфекционных осложнений и тяжесть осложнений противоопухолевого лечения [86].
Нет исследований, сообщающих об удачной профилактике побочных эффектов лучевой или химиотерапии при использовании парентерального питания. Тем не менее при появлении тяжелых мукозитов или возникновении тяжелого постлучевого энтерита применение парентерального питания оправданно, причем на фоне гастроинтестинальной токсичности переносимость и эффективность краткосрочного парентерального питания выше, чем энтерального [87–89].
Суммируя вышеизложенное, следует отметить, что при нехирургическом лечении онкологических больных превентивное использование ПП нецелесообразно. Однако при выраженном истощении, при развитии гастроинтестинальной токсичности или постлучевых поражениях ЖКТ назначение искусственного питания обоснованно. Предпочтительным является ЭП, а при невозможности его проведения или перспективе голодания в течение недели и более показано проведение парентерального питания. Возможно, на фоне гипоальбуминемии и снижения коллоидно–осмотического давления предпочтительнее использовать высококонцентрированные растворы аминокислот, минимизируя объем инфузии и препятствуя развитию гиперволемии.
Заключение
Явления белково–энергетической недостаточности имеются практически у половины онкологических больных [90]. Симптомы нарушения питания особенно заметны при поражениях органов ЖКТ и легких и не так очевидны, например, при опухолях молочной железы или в онкогематологии. Тем не менее при любой нозологии питательный статус онкологического больного является важным прогностическим фактором при проведении противоопухолевого лечения [91]. Считается доказанным, что при нарушении питательного статуса повышается количество послеоперационных осложнений, отмечается высокий уровень токсичности при проведении химиотерапии или облучения, удлиняется срок госпитализации и повышается стоимость лечения, снижается работоспособность и ухудшается качество жизни [92]. Оценка питательного статуса является необходимой в комплексном обследовании каждого онкологического больного [93]. В рекомендациях американской Ассоциации парентерального и энтерального питания нарушение питательного статуса определяется как неконтролируемая потеря МТ более 10% от привычной в течение 6 мес. или потеря более 5% от привычной МТ за последний месяц [94]. В рекомендациях Европейской ассоциации парентерального и энтерального питания для хирургических больных предлагается проводить постоянный скрининг питательного статуса [95]. Нарушения питательного статуса считаются тяжелыми, если потеря МТ в течение полугода составляет 10–15% от привычной, ИМТ меньше 18,5, а концентрация альбумина ниже 30 г/л.
Однако оценка состояния питания не должна быть ограничена простым делением пациентов на истощенных и неистощенных. Главным образом, скрининг питательного статуса необходим в повседневной практике для принятия взвешенного решения о целесообразности назначения искусственного питания, сроках и режимах его проведения. Именно это поможет в достижении основной клинической цели – улучшении результатов лечения онкологических больных.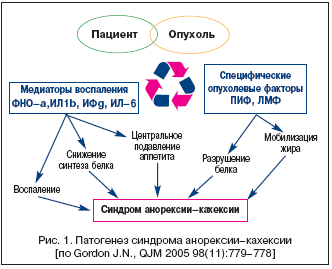
Литература
1. Bozzetti F. Basics in Clinical Nutrition: Nutritional support in cancer. Eur J Cl Nut and Met (2009) 1–5.
2. Argiles JM. Cancer–associated malnutrition. Eur J Oncol Nurs 2005;9 (Suppl 2):S39–50.
3. Spiro A, Baldwin C, Patterson A, Thomas J, Andreyev HJ. The views and practice of oncologists towards nutritional support in patients receiving chemotherapy. Br J Cancer 2006;95:431–4.
4. Kelsen DP, Ginsberg R, Pajak TF, et al. Chemotherapy followed by surgery compared with surgery alone for localized esophageal cancer. N Engl J Med 1998;339:1979–84.
5. Rubin H. Cancer cachexia: its correlations and causes. Proc Natl Acad Sci USA 2003; 100:5384–9.
6. Stewart GD, Skipworth RJ, Fearon KC. Cancer cachexia and fatigue. Clin Med 2006;6:140–3.
7. Deans DA, Wigmore SJ, Gilmour H, et all. Elevated tumour interleukin–1beta is associated with systemic inflammation: a marker of reduced survival in gastro–oesophageal cancer. Br J Cancer 2006;95:1568–75.
8. Oliff A, Defeo–Jones D, Boyer M, et al. Tumors secreting human TNF/cachectin induce cachexia in mice. Cell 1987; 50:555–63.
9. Langstein HN, Doherty GM, Fraker DL, et al. The roles of gamma–interferon and tumor necrosis factor alpha in an experimental rat model of cancer cachexia. Cancer Res 1991; 51:2302–6.
10. Strassmann G, Fong M, Kenney JS, et al. Evidence for the involvement of interleukin 6 in experimental cancer cachexia. J Clin Invest 1992; 89:1681–4.
11. Costelli P, Carbo N, Tessitore L, et al. Tumor necrosis factor–alpha mediates changes in tissue protein turnover in a rat cancer cachexia model. J Clin Invest 1993; 92:2783–9.
12. Murray S, Schell K, McCarthy DO, Albertini MR. Tumor growth, weight loss and cytokines in SCID mice. Cancer Lett 1997; 111:111–15.
13. Fearon KC, Preston T. Body composition in cancer cachexia. Infusionstherapie 1990;3(17):63–6.
14. McMillan DC, Preston T, Fearon KC, et al. Protein synthesis in cancer patients with inflammatory response: investigations with [15N]glycine. Nutrition 1994;10:232–40.
15. Bhogal AS, Lorite ML, Tisdale MJ. Changes in nucleic acid and protein levels in atrophying skeletal muscle in cancer cachexia. Anticancer Res 2006;26:4149–54.
16. Davis MP, Dreicer R, Walsh D, et al. Appetite and cancer–associated anorexia: a review. J Clin Oncol 2004; 22:1510–17.
17. Л.А.Звенигородская, Т.В.Мищенкова, Е.В.Ткаченко. Гормоны и типы пищевого поведения, эндоканнабиоидная система, пищевая аддикция в развитии метаболического синдрома. Cons. Med. Гастроэнтерология, 2009 (1), c. 73–84.
18. Langhans W, Hrupka B. Interleukins and tumor necrosis factor as inhibitors of food intake. Neuropeptides 1999; 33:415–24.
19. Inui A. Cancer anorexia–cachexia syndrome: are neuropeptides the key? Cancer Res 1999; 59:4493–501.
20. Laviano A, Russo M, Freda F, Rossi–Fanelli F. Neurochemical mechanisms for cancer anorexia. Nutrition 2002; 18:100–5.
21. Barber MD, McMillan DC, Wallace AM, et al. The response of leptin, interleukin–6 and fat oxidation to feeding in weight–losing patients with pancreatic cancer. Br J Cancer 2004;90:1129–32.
22. Costelli P, Muscaritoli M, Bossola M, et al. IGF–1 is downregulated in experimental cancer cachexia. Am J Physiol Regul Integr Comp Physiol 2006;291:R674–83.
23. McFarlane C, Plummer E, Thomas M, et al. Myostatin induces cachexia by activating the ubiquitin proteolytic system through an NF–kappaB–independent, FoxO1–dependent mechanism. J Cell Physiol 2006;209:501–14.
24. Strasser F, Palmer JL, Schover LR, et al. The impact of hypogonadism and autonomic dysfunction on fatigue, emotional function, and sexual desire in male patients with advanced cancer: a pilot study. Cancer 2006;107:2949–57.
25. Feinstein R, Kanety H, Papa MZ, et al. Tumor necrosis factor–alpha suppresses insulin–induced tyrosine phosphorylation of insulin receptor and its substrates. J Biol Chem 1993;268:26055–8.
26. Todorov P, Cariuk P, McDevitt T, et al. Characterization of a cancer cachectic factor. Nature 1996;379:739–42.
27. Hirai K, Hussey HJ, Barber MD, Price SA, Tisdale MJ. Biological evaluation of a lipid–mobilizing factor isolated from the urine of cancer patients. Cancer Res 1998;58:2359–65.
28. Tisdale MJ. The ‘cancer cachectic factor’. Support Care Cancer 2003; 11:73–8.
29. Tisdale MJ. Tumor–host interactions. J Cell Biochem 2004; 93:871–7.
30. Hyltander A, Drott C, Korner U, et al. Elevated energy expenditure in cancer patients with solid tumours. Eur J Cancer 1991;27:9–15.
31. Nixon DW, Kutner M, Heymsfield S, et al. Resting energy expenditure in lung and colon cancer. Metabolism 1988;37: 1059–64.
32. Dempsey DT, Knox LS, Mullen JL, et al. Energy expenditure in malnourished patients with colorectal cancer. Arch Surg 1986;121:789–95.
33. Staal–van den Brekel AJ, Dentener MA, Schols AM, et al. Increased resting energy expenditure and weight loss are related to a systemic inflammatory response in lung cancer patients. J Clin Oncol 1995;13:2600–5.
34. Moses AW, Slater C, Preston T, et al. Reduced total energy expenditure and physical activity in cachectic patients with pancreatic cancer can be modulated by an energy and protein dense oral supplement enriched with n–3 fatty acids. Br J Cancer 2004;90:996–1002.
35. Обухова О.А. Коррекция белковой и энергетической недостаточности у больных раком пищевода в предоперационном периоде препаратом «Изокал». Дисс. … к.м.н. М., 1998г, 122 с.
36. Fredrix EW, Soeters PB, Wouters EF, Deerenberg IM, von Meyenfeldt MF, Saris WH. Effect of different tumor types on resting energy expenditure. Cancer Res 1991;51:6138–41.
37. Розанова Н.Б. Особенности обмена микроэлементов у больных с опухолями пищевода и желудка при проведении искусственного питания. Дисс. ... д–ра мед. наук. М., 1991, 202 с
38. Кормош Н.Г. Роль антиоксидантов в комбинированном лечении рака яичников. Дисс. … канд.мед.наук. М., 1997г., с.143.
39. Furst P. Basics in clinical nutrition: Role of antioxidants in nutritional support. Eur J Cl Nutr Met 4 (2009) e105–e107
40. Langer, C.J., Hoffman, J.P., Ottery, F.D., 2001. Clinical significance of weight loss in cancer patients: rationale for the use of anabolic agents in the treatment of cancer–related cachexia. Nutrition 17 (1 Suppl), S1–S20.
41. Berger M.M., Shenkin A.. Vitamins and trace elements: Practical aspects of supplementation. Nutrition 22 (2006) 952–955.
42. Балдуева И.А. Разработка, обоснование и оценка современной биотерапии у больных солидными опухолями. Дисс. … д–ра мед. наук. С–Пб., 2008, 263с.
43. Нехаев И. В. Сепсис в торакоабдоминальной онкологии (этиология, патогенез, интенсивная терапия). Дисс. … д–ра мед.наук. М., 2008, 307с.
44. Van Cutsem E, Arends J. The causes and consequences of cancer–associated malnutrition. Eur J Oncol Nurs 2005;9(Suppl 2):S51–63.
45. Capra S, Ferguson M, Ried K. Cancer: impact of nutrition intervention outcome–nutrition issues for patients. Nutrition 2001;17:769–72.
46. Обухова О.А., Сытов А.В., Нехаев И.В., соавт. Особенности белкового обмена и питательной поддержки в послеоперационном периоде у больных раком пищевода и желудка. Вестник московского онкологического общества, 2005, с.6.
47. Мальков О.А. Нарушения метаболизма и их коррекция при колоректальном раке и сопутствующем сахарном диабете 2 типа. Дисс. … д–ра мед. наук. М., 2009, 215с.
48. Sobotka L. Basics in clinical nutriron. Prague, Czech Republic, “Galen”, 2004, 500 pp.
49. Рябов Г.А., соавт. Энергетический метаболизм при неотложных состояниях. В кн. «Искусственное питание в неотложной хирургии и травматологии», под ред. Ермолова А.С. М., НИИ СП им. НВСклиф. 2001:с.21–82.
50. Ломидзе С.В., Нехаев И.В., Свиридова С.П., соавт. Эффективность жировых эмульсий третьего поколения в составе парентерального питания оперированных онкологических больных: результаты клинического исследования. Вест. инт. тер. 2009 (2), с.68–71.
51. Lopez–Hellina J, Baena–Fustegueras JA, Vidal M, et al. Perioperative nutrition prevents the early protein losses in patients submitted to gastrointestinal surgery. Cl. Nutr.(2004) 23, 1001–1008.
52. Ryan AM, Healy LA, Power DG, et al. Short–term nutritional implications of total gastrectomy for malignancy, and the impact of parenteral nutritional support. Clinical Nutrition (2007) 26, 718–727.
53. Ломидзе С.В., Нехаев И.В., Сытов А.В., Свиридова СП. Проблема острого повреждения легких у онкологических больных после обширных хирургических вмешательств, сопровождающихся острой массивной кровопотерей. Онкохирургия, 2008 (1), с. 127.
54. Мазурина О.Г. Гипоксические состояния после операций по поводу рака пищевода и кардиального отдела желудка (этиопатогенез, клиника, лечение). Дисс. ... д–ра мед. наук. М., 1993, 265 с.
55. Lobo DN, Bostock KA, Neal KR, et al. Effect of salt and water balance on recovery of gastrointestinal function after elective colonic resection: a randomized controlled trial. Lancet 2002;359:1812–8.
56. Brandstrup B, Tonnesen H, Beier–Holgersen R, et al. Effects of intravenous fluid restriction on postoperative complications: comparison of two perioperative fluid regimens: a randomized assessor–blinded multicenter trial. Ann Surg 2003;238:641–8.
57. MacKay G, Fearon K, McConnachie A, et al. Randomized clinical trial of the effect of postoperative intravenous fluid restriction on recovery after elective colorectal surgery. Br J Surg 2006;93:1469–74.
58. Луфт В.М. Энтеральное клиническое питание в интенсивной медицине: фармаконутриентная характеристика и возможности дифференцированного выбора. Клиническая анестезиология и реаниматология, 2007, 4 (5), с.24.
59. Bozzetti F, Gianotti L, Braga M. et al. Postoperative complications in gastrointestinal cancer patients: The joint role of the nutritional status and the nutritional support. Cl. Nutr.(2007) 26, 698–709.
60. Torosian MH. Perioperative nutrition support for patients undergoing gastrointestinal surgery: critical analysis and recommendations. World J Surg 1999;23:565–9.
61. Heyland DK, Montalvo M, MacDonald S, et al. Total parenteral nutrition in the surgical patient: a metaanalysis.Can J Surg 2001;44:102–11.
62. Malone DL, Genuit T, Tracy JK, et al. Surgical site infections: reanalysis of risk factors. J Surg Res 2002;103:89–95.
63. Alves A, Panis Y, Mathieu P, et al. Postoperative mortality and morbidity in French patients undergoing colorectal surgery: results of a prospective multicenter study. Arch Surg 2005;140:278–83.
64. Klein S, Kinney J, Jeejeebhoy K, et al. Nutrition support in clinical practice: review of published data and recommendations for future research directions. Summary of a conference sponsored by the National Institutes of Health, American Society for Parenteral and Enteral Nutrition, and American Society for Clinical Nutrition. Am J Clin Nutr 1997;66:683–706.
65. Schricker Th. et al. Strategies to attenuate the catabolic response to surgery and improve perioperative outcomes. Can J Anesth; June, 2007/ 54: 6 / pp 414–419.
66. Wu GH, Liu ZH, Wu ZH, Wu ZG. Perioperative artificial nutrition in malnourished gastrointestinal cancer patients. World J Gastroenterol 2006;12:2441–4.
67. Elia M, van Bokhorst–de van der Schueren MA, Garvey J, et al. Enteral (oral or tube administration) nutritional support and eicosapentaenoic acid in patients with cancer: a systematic review. Int J Oncol 2006;28:5–23.
68. Lewis SJ, Egger M, Sylvester PA, Thomas S. Early enteral feeding versus ‘‘nil by mouth’’ after gastrointestinal surgery: systematic review and meta–analysis of controlled trials. BMJ 2001;323:773–6.
69. Heyland DK, Novak F, Drover JW, et al. Should immunonutrition become routine in critically ill patients? A systematic review of the evidence. JAMA 2001;286:944–53.
70. Heys SD, Walker LG, Smith I, Eremin O. Enteral nutritional supplementation with key nutrients in patients with critical illness and cancer: a meta–analysis of randomized controlled clinical trials. Ann Surg 1999;229:467–77.
71. Beale RJ, Bryg DJ, Bihari DJ. Immunonutrition in the critically ill: a systematic review of clinical outcome. Crit Care Med 1999;27:2799–805.
72. Barlow R.C. et al. A multicentred randomized controlled trial of early enteral nutrition versus conventional management in patients undergoing major upper gastrointestinal surgery for malignancy. Cl. Nutr., 2007, volume 2(2), p. 120.
73. Aviles A, Yanez J, Garcia EL, et al. Malnutrition as an adverse prognostic factor in patients with diffuse large cell lymphoma. Arch Med Res 1995; 26:31–4.
74. Bosaeus I, Daneryd P, Lundholm K. Dietary intake, resting energy expenditure, weight loss and survival in cancer patients. J Nutr 2002;132 (11 Suppl): 3465S–6S.
75. Mitry E, Douillard JY, Van Cutsem E, et al. Predictive factors of survival in patients with advanced colorectal cancer: an individual data analysis of 602 patients included in irinotecan phase III trials. Ann Oncol 2004;15:1013–7.
76. Ross PJ, Ashley S, Priest K, et al. Do patients with weight loss have a worse outcome when undergoing chemotherapy for lung cancers? Br J Cancer 2004;90:1905–11.
77. Kadar L, Albertson M, Areberg J, et al. The prognostic value of body protein in patients with lung cancer. Ann NY Acad Sci 2000;904:584–91.
78. Ollenschlager G, Thomas W, Konkol K, et al. Nutritional behaviour and quality of life during oncological polychemotherapy: results of a prospective study on the efficacy of oral nutrition therapy in patients with acute leukaemia. Eur J Clin Invest 1992;22(8):5–23.
79. Aslani A, Smith RC, Allen BJ, Paviakis N, Levi JA. The predictive value of body protein for chemotherapy–induced toxicity. Cancer 2000;88:796–803.
80. Correia MI, Waitzberg DL. The impact of malnutrition on morbidity, mortality,length of hospital stay and costs evaluated through a multivariate model analysis. Clin Nutr 2003;22:235–9.
81. Sarna L, Lindsey AM, Dean H, et al. Weight change and lung cancer: relationship with symptom distress, functional status, and smoking. Res Nurs Health 1994;17:371–9.
82. F. Bozzetti, Mori V. Nutritional support and tumour growth in humans: A narrative review of the literature. Cl. Nutr. 28 (2009) 226–230.
83. Bozzetti F., Arends J., Lundholm K., et al. ESPEN Guidelines on Parenteral Nutrition: Non–surgical oncology. Cl. Nutr. 28 (2009) 445–454.
84. Arends J., Bodoky G., Bozzetti F., et al. ESPEN Guidelines on Enteral Nutrition: Non–surgical oncology. Clinical Nutrition (2006) 25, 245–259.
85. Klein S, Koretz RL. Nutrition support in patients with cancer: What do the data really show? Nutr Clin Pract 1994;9:91–100.
86. Koretz RL, Lipman TO, Klein S. AGA technical review on parenteral nutrition. Gastroenterology 2001;121(4):970–1001.
87. Loiudice TA, Lang JA. Treatment of radiation enteritis: a comparison study. Am J Gastroenterol 1983;8:481–7.
88. Scolapio JS, Fleming CR, Kelly DG, Wick DM, Zinsmeister DC. Survival of home parenteral nutrition–treated patients: 20 years of experience at the Mayo Clinic. Mayo Clin Proc 1999;74:217–22.
89. Bozzetti F. Home parenteral nutrition in radiation enteropathy. In: Bozzetti F, Staun M, Van Gossum A, editors. Home parenteral nutrition. CAB International Publ; 2006. p. 95–102.
90. Muscaritoli M, Bossola M, Aversa Z, et al. Prevention and treatment of cancer cachexia: New insights into an old problem. Eur J Cancer 42(2006)31–41.
91. Detsky AS, Baker JP, O’Rourke K, et al. Predicting nutrition associated complications for patients undergoing gastrointestinal surgery. J Parenter Enteral Nutr 1987;11:440–6.
92. Kelsen DP, Ginsberg R, Pajak TF, et al. Chemotherapy followed by surgery compared with surgery alone for localized esophageal cancer. N Engl J Med 1998;339:1979–84.
93. Senesse P, Assenat E, Schneider S, et al. Nutritional support during oncologic treatment of patients with gastrointestinal cancer: Who could benefit? Cancer Treatment Reviews (2008) 34, 568– 575.
94. Guidelines for the use of parenteral and enteral nutrition in adult and pediatric patients. JPEN J Parenter Enteral Nutr 2002;26:1SA–138SA.
95. Weimann A, Braga M, Harsanyi L, et al. ESPEN guidelines on enteral nutrition: surgery including organ transplantation. Clin Nutr 2006;25:224–44.












