Внедрение в клиническую практику новых химиогормональных препаратов, а также активное развитие адъювантных методов лечения на базе знаний о прогностических и предсказывающих факторах позволило в значительной степени снизить частоту развития отдаленных метастазов, однако, несмотря на столь впечатляющие результаты, полученные в последние годы, метастатическое поражение до сих пор остается основной проблемой в этой группе больных.
Поиск ведущего пускового звена, которое отвечает за развитие метастатического поражения привел к открытию большого числа факторов, воздействие на которые, по предварительным данным, может оказать драматическое влияние на результаты дальнейшего лечения как ранних, так и метастатических форм РМЖ.
Основные исследования в этой области были направлены на идентификацию молекул, которые отвечают за возникновение и рост опухоли, с целью селективного (таргетного) воздействия на эти молекулы или на сигнальные пути, которые ими запускаются или опосредуются. Первым агентом, показавшим, в сочетании с «классической» цитотоксической терапией, способность улучшить результаты лечения больных метастатическим РМЖ, был трастузумаб, который представляет собой гуманизированное моноклональное антитело к молекуле HER–2, экспрессирующейся на поверхности клеток у части больных. В последние годы появились и другие таргетные препараты: ингибиторы тирозинкиназ, бевацизумаб, гефитиниб, эрлотиниб, сунитиниб, а также двойной (анти–HER–1 и анти–HER–2) ингибитор лапатиниб, которые также рассматриваются в качестве агентов для лечения метастатического РМЖ.
Теоретические обоснования
таргетной терапии
Онкогенез является многоступенчатым процессом, включающий генетические изменения, которые приводят к прогрессированию трансформации нормальных клеток в опухолевые. Такая трансформация характеризуется дисрегуляцией ряда молекулярных процессов, таких как клеточная пролиферация, ангиогенез и апоптоз, что открывает перспективы воздействия на эти процессы с помощью новых селективных противоопухолевых лекарственных препаратов.
С таргетной терапией, основной целью которой является не «ковровая бомбежка», как это модно сейчас говорить, а «точечное» воздействие на указанные выше причины онкогенеза, связывают большие надежды. Основное отличие таргетной терапии заключается в максимальном воздействии на измененные (опухолевые) клетки при минимальном влиянии на нормальные.
Конец 90 годов ХХ века в онкологии стал воистину временем открытия новых препаратов или по образному выражению [Chabner and Roberts, 2005] – «эрой таргетной терапии», начало которой было положено с открытия и изучения иматиниба. Однако, справедливости ради необходимо отметить, что первым таргетным препаратом для лечения РМЖ железы явился тамоксифен, синтезированный более 40 лет назад. Именно этот препарат явился прорадителем – дедушкой дальнейших поисков целенаправленного лечения РМЖ. Благодаря своим свойствам, дешевизне, высокой эффективности тамоксифен стал «золотым стандартом» в лечении РМЖ, что, естественно, привело к обязательному сравнению вновь синтезированных гормональных препаратов с «золотым стандартом». Аналогичная участь постигла и первый из современных таргетных препаратов трастузумаб, который несмотря на свой молодой возраст стал эталоном сравнения огромной группы лекарственных средств, объединенных в общую группу – препараты целевого воздействия.
Трастузумаб – это гуманизированное моноклональное антитело, которое избирательно связывается с молекулой HER–2/neu, подавляя при этом пролиферацию опухолевых клеток и вызывая их гибель за счет индукции антителозависимой клеточной цитотоксичности. Лабораторные и клинические исследования показали, что HER–2 статус (гиперэкспрессия протеина/амплификация гена) является главным предиктором ответа на трастузумаб. HER–2–тестирование с помощью иммуногистохимического метода (immunohystochemical assay, IHC) и/или флюоресцентной гибридизации in situ (FISH) является ведущим фактором в оценке целесообразности лечения трастузумабом.
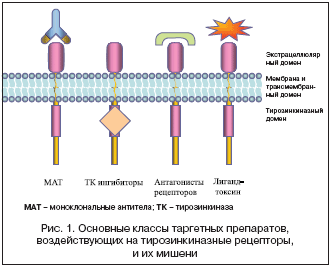
Her–2 гиперэкспрессия встречается в 20–25% больных РМЖ и входит в состав семейства рецепторов эпидермального фактора роста человека (Human Epidermal Growth Factor receptors (HER/erbB), включающего EGF рецепторы (EGFR, HER–1,erbB1, HER–2/neu (erbB–2), HER– 3 (erbB–3) и HER–4 (ErbB–4). Все четыре представителя семейства имеют похожую структуру: экстрацеллюлярный (внеклеточный) лиганд–связывающий домен, ответственный за связывание с фактором роста или другим лигандом, трансмембранный домен и интрацеллюлярный (внутриклеточный, цитоплазматический) тирозинкиназный домен, представленный тирозинкиназой С, активация которой служит отправной точкой для последующей передачи сигнала на белки–транспортеры.
В нормальных условиях ErbB рецепторы регулируют межклеточную и клеточно–стромальную взаимосвязь через систему сигнальной трансдукции, в конечном счете оказывая влияние на жизнедеятельность клетки, ее пролиферацию, ангиогенез, смерть и клеточную адгезию. Дисрегуляция этих сигнальных путей может привести к злокачественной трансформации. Многочисленные исследования показали наличие гиперэкспрессии как нормальных, так и мутированных вариантов ErbB–1 и/или ErbB–2 рецепторов, и/или их лигандов при различных опухолях [Rowinsky EK 2001, Itakura Y et al. 1994].
При связывании лиганда (например, EGF) с экстрацеллюлярной частью ErbB рецептора происходит его димеризация – объединение двух связанных с лигандом рецепторов в единый функциональный комплекс, с последующим аутофосфорилированием тирозинкиназы С – необходимым для инициации сигнального каскада и трансдукции сигнала внутрь клетки, которые и обеспечивают пролиферацию, выживаемость и/или миграцию клеток. При этом в процессе димеризации могут участвовать все представители семейства EGFR, образуя гомодимеры (например, HER–1/HER–1) или гетеродимеры (например HER–1/HER–2). И хотя в рамках семейства ErbB возможны оба типа комбинаций, существует определенная иерархия в участии тех или иных молекул в формировании димеров [Graus–Porta D et al., 1997]. Интересно, что HER–2, который, вероятнее всего, не имеет своего собственного специфического лиганда, является предпочтительным партнером в процессе образования димера для других ErbB рецепторов – наружного домена EGFR (HER–1), HER–3 и HER–4, для которых существуют специфические растворимые лиганды. Гетеродимеры, содержащие HER–2, обладают особыми свойствами, такими как более медленная диссоциация с лигандом, низкая лиганд–специфичность, медленный эндоцитоз, быстрая рециркуляция (recycling) и продленная деградация, что обеспечивает повышенную стабильность димера и способность инициировать более мощный пролиферативный сигнал [Yarden Y, Sliwkowski MX. 2001]. Молекула HER–2, таким образом, выступает в роли «корецептора», облегчающего трансдукцию сигнала.
Молекулы семейства HER (ErbB) вовлечены в патогенез многих опухолей, в том числе и РМЖ [Bacus SS et al., 1994; Gullick WJ et al., 1998], а уровни их экспрессии нередко определяют прогноз [Witton CI et al., 2003] (табл. 1).
В соответствие с целевой принадлежностью существует 2 больших класса препаратов, задача которых связать HER–рецепторы: моноклональные антитела (mAbs) и ингибиторы молекулы тирозинкиназы (TKIs). Именно это и определяет различные клинико–экспериментальные свойства mAbs и TKIs. (табл. 2).
В настоящее время, в клинической практике наибольшее распространение получили моноклональные антитела (mAbs) и ингибиторы тирозинкиназ (TKIs) (рис. 1).
Трастузумаб
Как уже отмечалось выше, одним из первых таргетных препаратов для лечения больных РМЖ с гиперэкспрессией HER2 был предложен трастузумаб, который продемонстрировал значительное улучшение показателей общей и безрецидивной выживаемости у больных распространенным/метастатическим РМЖ при его назначении в комбинации с антрациклин содержащей химиотерапией, по сравнению только с химиотерапией. Результаты лечения были высоко достоверны (p=0,01, медиана выживаемости 25,1 по сравнению с 20,3 месяцами) [Baselga et al., 1996; Slamon et al., 2001]. Эти данные оказались весьма впечатляющими, поскольку в исследование были включены пациентки с метастатическим и местнораспространенным РМЖ.
Также было показано, что комбинация трастузумаб + таксаны (паклитаксел, доцетаксел) в качестве терапии первой линии у женщин с метастатическим РМЖ достоверно увеличивает частоту объективных ответов на лечение, время до прогрессирования и медиану выживаемости по сравнению с монотерапией паклитакселом или доцетакселом.
Сравнимые по эффективности результаты были получены и при исследовании комбинации 2–х химиопрепаратов с трастузумабом. Изучались такие комбинации с трастузумабом как доцетаксел + капецитабин, паклитаксел + карбоплатин, таксаны + липосомальный доксорубицин. В исследовании Baselga et al. были представлены данные 2 фазы исследования комбинации трастузумаба с таксанами и липосомальным доксорубицином. Частота объективных ответов соответствовала 92%, а у половины больных отмечался полный клинический регресс опухоли.
Эти обнадеживающие данные позволили запланировать и провести целый каскад исследований трастузумаба в различных режимах: в адъювантном, неоадъювантном, в комбинации с различными химиопрепаратами, в различных дозировках и схемах лечения.
Фармакокинетические исследования, направленные на изучение наиболее оптимальных доз и периодичности введения трастузумаба позволили остановиться на двух наиболее выгодных схемах: 1 раз в неделю (4 мг на кг нагрузочная доза с последующим введением 2 мг на кг еженедельно) и 1 раз в 21 день (8 мг на кг нагрузочная доза с последующим введением 6 мг на кг 1 раз в три недели).
Масштабные (по количеству включенных больных) исследования HERA, B–31, N9831, BCIRG 006 в общей сложности проанализировали результаты лечения трастузумабом в адъювантном режиме у более чем 20000 женщин, с HER2 neu гиперэкспрессией опухоли и показали весьма обнадеживающие результаты. Так в исследовании В–31 и NCCTG 9831 было продемонстрировано абсолютное улучшение безрецидивной выживаемости равное 12% по сравнению с контрольной группой и 33% уменьшением риска смерти.
Несмотря на столь впечатляющие данные, к сожалению, до настоящего времени не совсем понятен механизм возникновения резистенстности как к химиопрепаратам, так и трастузумабу. Существует предположение о некой перекрестной резистентности между остальными рецепторами и рецептором HER2/neu. Данное предположение нуждается в более детальном исследовании.
Наиболее существенным проявлением токсичности трастузумаба оказалась сердечная недостаточность, особенно в комбинации с антрациклинами (доксорубицин) (до 27–28%). Частота сердечной недостаточности при лечении трастузумабом в комбинации с паклитакселом составила 9–12%, по сравнению с монотерапией паклитакселом – 1–4% и с монотерапией трастузумабом – 6–9%. Гематологическая токсичность наблюдалась чаще всего при совместном назначении трастузумаба и таксанов.
Ингибиторы EGFR/HER–1
Гиперэкспрессия EGFR/HER–1 встречается в 14–91% случаев РМЖ [Klijn JG et al., 1992] и ассоциируется с агрессивным фенотипом, включая высокий потенциал инвазивного роста и метастазирования. Прогностическая значимость EGFR противоречива: по мнению ряда авторов, высокие уровни EGFR не являются предикторами эффективности лечения, а степень ингибирования EGFR, индуцированного лекарственным препаратом не определяет ответ на терапию [Arteaga CL et al., 2004].
Гефитиниб представляет собой пероральный низкомолекулярный селективный ингибитор тирозинкиназы EGFR, который блокирует трансдукцию сигнала, ответственного за пролиферацию опухолевых клеток. Эффективность и переносимость гефитиниба в сочетании с цитотоксическими препаратами оценивалась в нескольких исследованиях фазы I–II. Оказалось, что хотя гефитиниб хорошо переносится, он не показал себя активным препаратом при его назначении пациентам, ранее получавшим химиотерапию, например, таксаны и антрациклины. Однако при его назначении в дозе 250 мг в сутки в комбинации с паклитакселом и карбоплатином в качестве первой линии, удалось добиться 46% уровня объективных ответов [Fountzilas?G. et al., 2003].
Исследования другого перорального ингибитора тирозинкиназы – эрлотиниба – при метастатическом РМЖ, проводившиеся до настоящего времени, не показали убедительных результатов, ни в комбинации с другими препаратами (например, с гемцитабином [Graham DL et al., 2005]), ни в качестве монотерапии [Tan AR et al., 2004; Winer E. et al., 2002]. Возможно, это связано с мутацией тирозинкиназного домена EGFR, которая, по мнению некоторых авторов, может оказывать влияние на чувствительность опухоли к эрлотинибу и гефитинибу [Pao W. et al., 2004].
Лапатиниб – новый двойной
ингибитор тирозинкиназы
Лапатиниб – новый пероральный двойной ингибитор, действующий сразу на две критические мишени: EGFR (ErbB1/HER–1) и HER–2. Первые сведения о лапатинибе были опубликованы в 2001 году и уже к 2005 году было завершено и проводится более 20 исследований. Синтез молекулы лапатиниба базировался на теоретических предпосылках, указанных выше. Теоретически ингибиция одного ТК (тирозинкиназа) домена может быть менее эффективна, чем гетеродимера (ЕrbB–1/ErbB–2). В дополнении двойная киназная ингибиция и, следовательно, превосходство лапатиниба над трастузумабом может встречаться в укороченных формах ЕrbB–1/ErbB–2, которые потеряли экстрацеллюлярный домен. Такие формы не распознают антитела, что приводит к отсутствию эффекта на лечение. В ранних исследованиях лапатиниб продемонстрировал способность к подавлению роста и индукции апоптоза EGFR/HER–2 позитивных клеточных линий. In vitro была показана синергичная активность лапатиниба и трастузумаба в отношении HER–2 позитивных клеток РМЖ.
Предварительные данные исследования фазы II говорят об активности лапатиниба при трастузумаб–резистентном РМЖ, а Burris et al. сообщают об уровне ответов 22,5% при назначении лапатиниба в дозе 1000 мг в сутки в комбинации с трастузумабом в группе из 54 пациенток, ранее получавших химиотерапию (из них 93% ранее получали трастузумаб); при этом не отмечалось ни одного случая кардиотоксичности.
В рандомизированном исследовании фазы II сравнивали две схемы назначения лапатиниба – в дозе 500 мг два раза в сутки (n=19) и в дозе 1500 мг один раз в сутки (n=21) – в качестве первой линии терапии пациенток с FISH–документированным HER–2 позитивным РМЖ. Полной ремиссии удалось добиться у 35% (n=14) пациентов, а стабилизации болезни – у 32,5% (n=13). В рамках данного исследования был проведен анализ экспрессии ErbB1/ErbB2 и молекулярного фенотипа опухолевых клеток с тем, чтобы идентифицировать предикторы ответа на лапатиниб. Начальные уровни экспрессии экстрацеллюлярных доменов ErbB1 и ErbB2 не отличались в группах респондеров и не–респондеров. Однако, 22% (6/27) больных, не ответивших на терапию, имели уровни ErbB2 > 100 нг/мл, по сравнению с 36% (4/11) в группе респондеров.
К настоящему времени закончено и опубликовано международное рандомизированное мультицентровое исследование фазы III по сравнению комбинации лапатиниба в дозе 1250 мг в сутки ежедневно и капецитабина в дозе 2000 мг/м2 1–14 день каждые 21 день и капецитабина в качестве монотерапии в дозе 2500 мг/м2 1–14 каждые 21 день. В исследование было включено 324 больных, ранее получавших антрациклины, таксаны и трастузумаб. Оказалось, что комбинация лапатиниб + капецитабин достоверно превосходит по эффективности монотерапию капецитабином: медиана времени до прогрессии составила 8,4 месяцев в группе комбинированной терапии и 4,4 месяца в группе монотерапии (p<0,001). Данного значительного улучшения результатов терапии удалось добиться без увеличения частоты встречаемости серьезных нежелательных явлений или кардиотоксичности.
Важная особенность лапатиниба – это активность в отношении метастазов в головной мозг, в частности, в исследовании Lin et al., 2006 было включено 39 пациенток, которые ранее получали полихимиотерапию + трастузумаб и у которых были выявлены метастазы в головной мозг.
Больным назначался лапатиниб в дозе 750 мг 2 раза в сутки. Из них у 5% удалось добиться частичного ответа метастазов в головной мозг и у 25% метастазов не центральной нервной системы. У 8 больных отмечалась стабилизация опухолевого процесса в течение 16 недель.
Что касается комбинации лапатиниб + трастузумаб, то преклинические данные говорят о синергизме действия обоих препаратов на HER–2 позитивные клетки РМЖ. Более того, лапатиниб показал активность в отношении трастузумаб–резистентных клеток, что заставляет предположить об отсутствии перекрестной резистентности между двумя агентами. Клинические исследования, которые проводятся в настоящее время, возможно, подтвердят эту гипотезу. Убедительные результаты, полученные в исследованиях с включением пациенток, ранее получавших химиотерапию и/или трастузумаб, обусловили интерес авторов к оценке роли лапатиниба в лечении ранних стадий HER–2 позитивного РМЖ.
Данные Cristofanilli et al., 2006, показали активность комбинации лапатиниб + паклитаксел, назначаемой в качестве неоадъювантной терапии при воспалительной форме РМЖ. В исследовании удалось добиться 95% уровня ответа (у 20 из 21 пациентки). Однако, для того, чтобы объективно оценить роль лапатиниба и других таргетных препаратов в лечении РМЖ, необходимо продолжать проведение кооперированных международных исследований.
Выводы
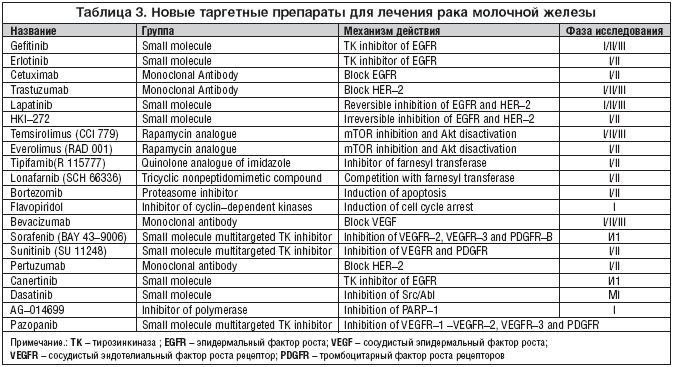
Таргетная терапия является крайне важным и чрезвычайно перспективным направлением в лечении не только рака молочной железы, но и в целом любого онкологического заболевания. Прицельно воздействуя только на основную причину, мы можем излечить заболевание не оказывая влияние на здоровые ткани и органы тем самым улучшить качество жизни больных. Однако в погоне за синтезом новых таргетных препаратов (табл. 3), а также открытием новых точек приложения этих препаратов мы можем оказаться в роли доктора у которого на каждый симптом найдется своя таблетка, купирующая этот симптом, что приведет к полипрагмазии не 2–3 лекарственными средствами, а 10–20 препаратами. Поэтому перспектива таргетной терапии, вероятнее всего, лежит в синтезе новых препаратов, которые оказывают многоцелевое воздействие на заболевание.

Литература
1. Arteaga CL, Truica CI. Challenges in the development of anti–epidermal growth factor receptor therapies in breast cancer. Semin Oncol. 2004 Feb;31(1 Suppl 3):3–8.
2. Bacus SS, Zelnick CR, Plowman G, Yarden Y. Expression of the erbB–2 family of growth factor receptors and their ligands in breast cancers. Implication for tumor biology and clinical behavior. Am J Clin Pathol 1994; 102(4 Suppl 1): S13–24.
3. Baselga J, Tripathy D, Mendelsohn J, et al. Phase II study of weekly intravenous recombinant humanized anti–p185HER2 monoclonal antibody in patients with HER2/neu–overexpressing metastatic breast cancer. J Clin Oncol 1996; 14:737–44.
4. Blackwell KL, Kaplan EH, Franco SX, Marcom PK, Malesi JE, Sorensen MJ, et al. A phasae II, open label, multicenter study of GW572016 in patients with trastuzumab refractory metastatic breast cancer. Proc Am Soc Clin Oncol 2004; 22(Suppl 14): 196 (abstract 3006).
5. Burris H, Hurwitz H, Dees C, et al. EGF 10004: a randomized, multicenter, phase Ib study of the safety, biologic activity and clinical efficacy of the dual kinase inhibitor GW572016 [abstract #39]. (SABCS Oral Presentation) Breast Cancer Res Treat. 2003;82 (suppl1):S18
6. Christianson TA, Doherty JK, Lin YJ, et al. NH2–terminally truncated HER–2/neu protein: relationship with shedding of the extracellular domain and with prognostic factors in breast cancer. Cancer Res 1998; 58:5123–9.
7. Clark GM, Sledge GW, Osborne CK et al. Survival from first recurrence; relative importance of prognostic factors in 1,015 breast cancer patients. J Clin Oncol. 1987; 5: 55–61.
8. Cobleigh MA, Vogel CL, Tripathy D, et al. Multinational study of the efficacy and safety of humanized anti–HER2 monoclonal antibody in women who have HER2–overexpressing metastatic breast cancer that has progressed after chemotherapy for metastatic disease. J Clin Oncol 1999; 17:2639–48.
9. Colomer R, Montero S, Lluch A, et al. Circulating HER2 extracellular domain and resistance to chemotherapy in advanced breast cancer. Clin Cancer Res 2000; 6:2356–62.
10. Ferrara N, Davis–Smyth T. The biology of vascular endothelial growth factor. Endocr Rev 1997; 18(1): 4–25.
11. Ferrara N, Kerbel RS. Angiogenesis as a therapeutic target. Nature 2005; 438:967–74.
12. Foekens JA, Peters HA, Grebenchtchikov N et al. High tumor levels of vascular endothelial growth factor predict poor response to systemic therapy in advanced breast cancer. Cancer Res 2001;61:5407–5414.
13. Foekens JA, Peters HA, Grebenchtchikov N et al. High tumor levels of vascular endothelial growth factor predict poor response to systemic therapy in advanced breast cancer. Cancer Res 2001;61:5407–5414.
14. Folkman J. Angiogenesis in cancer, vascular, rheumatoid and other disease. Nat Med 1995;1:27–31.
15. Fountzilas G, Pectasides D, Skarlos DV, Kalofonos HP, Papadimitriou C, Linardou H, et al. Paclitaxel, carboplatin and gefitinib (Iressa, ZD1839) as first–line chemotherapy in patients with advanced breast cancer: a phase II study. Breast Cancer Res Treat 2003; 82(Suppl 1): S85 (abstract 357).
16. Gasparini G, Longo R, Torino F, Morabito A. Therapy of breast cancer with molecular targeting agents. Ann Oncol 2005; 16(Suppl 4): iv28–iv36.
17. Geyer CE, Forster J, Lindquist D, Chan S, Romieu CG, Pienkowski T, Jagiello–Gruszfeld A, Crown J, Chan A, Kaufman B, Skarlos D, Campone M, Davidson N, Berger M, Oliva C, Rubin SD, Stein S, Cameron D. Lapatinib plus capecitabine for HER2–positive advanced breast cancer. N Engl J Med. 2006 Dec 28;355(26):2733–43.
18. Gomez HL, Chavez MA, Doval DC, Nag S, Chow LW, Ang PC, et al. Biomarker results from a phase II randomized study of lapatinib (GW572016) as first–line treatment for patients with ErbB2 FISH amplified advanced or metastatic breast cancer. Breast Cancer Res Treat 2005; 94(Suppl 1): S63 (abstract 1071).
19. Graham DL, Hillman DW, Hobday TJ, Rousey SR, Nair SG, Soori GS, et al. N0234: Phase II study of erlotinib plus gemcitabine as first– or second line therapy for metastatic breast cancer. Proc Am Soc Clin Oncol 2005; 23: 39S (abstract 644).
20. Graus–Porta D, Beerli RR, Daly JM, et al. ErbB–2, the preferred heterodimerization partner of all ErbB receptors, is a mediator of lateral signaling. EMBO J 1997; 16:1647–55.
21. Gullick WJ, Srinivasan R. The type 1 growth factor receptor family: new ligands and receptors and their role in breast cancer. Breast Cancer Res Treat 1998; 52(1–3): 43–53.
22. Itakura J, Ishiwata T, Shen B, Kornmann M, Korc M. Concomitant over–expression of vascular endothelial growth factor and its receptors in pancreatic cancer. Int J Cancer 2000; 85(1): 27–34.
23. Itakura Y, Sasano H, Shiga C, et al. Epidermal growth factor receptor overexpression in esophageal carcinoma. An immunohistochemical study correlated with clinicopathologic findings and DNA amplification. Cancer 1994; 74:795–804.
24. Jain RK. Normalizing tumor vasculature with anti–angiogenic therapy: a new paradigm for combination therapy. Nat Med 2001; 7(9): 987–9.
25. Jain RK. Normalizing tumor vasculature with anti–angiogenic therapy: a new paradigm for combination therapy. Nat Med 2001; 7(9): 987–9.
26. Lin NU, Carey LA, Liu MC, Younger J, Come SE, Bullitt E et al., Phase II trial of lapatinib for brain metastases in patients with HER2 + breast cancer., J. Clin. Oncol. 24 (18S) (2006) abstract 503.
27. Liu CD, Tilch L, Kwan D, McFadden DW. Vascular endothelial growth factor is increased in ascites from metastatic pancreatic cancer. J Surg Res 2002; 102(1): 31–4.
28. McArthur HL, Chia S. Cardiotoxicity of trastuzumab in clinical practice. N Engl J Med 2007 Jul 5;357(1):94–5.
29. Miller K, Gradishar W, Moisa C, et al. Capecitabine plus bevacizumab in first line metastatic breast cancer: an interim safety and efficacy report of the first phase of xeloda plus avastin 1st line metastatic breast cancer trial. Breast Cancer Res Treat 2006; 100(suppl 1):S103 (abstract 2068).
30. Miller KD, Chap LI, Holmes FA, et al. Randomized phase III trial of capecitabine compared with bevacizumab plus capecitabine in patients with previously treated metastatic breast cancer. J Clin Oncol 2005; 23:792–9.
31. Molina MA, Saez R, Ramsey EE, et al. NH(2)–terminal truncated HER–2 protein but not full–length receptor is associated with nodal metastasis in human breast cancer. Clin Cancer Res 2002; 8:347–53.
32. Nahta R, Hortobagyi GN, Esteva FJ. Growth factor receptors in breast cancer: potential for therapeutic intervention. Oncologist 2003; 8:5–17.
33. Nicholson RI, Gee JM, Harper ME. EGFR and cancer prognosis. Eur J Cancer 2001; 37(suppl 4):S9–15.
34. Normanno N, Bianco C, De Luca A, et al. Target–based agents against ErbB receptors and their ligands: a novel approach to cancer treatment. Endocr Relat Cancer 2003; 10:1–21.
35. Obermair A, Kucera E, Mayerhofer K, et al. Vascular endothelial growth factor (VEGF) in human breast cancer: correlation with disease–free survival. Int J Cancer 1997; 74: 455–458
36. Olayioye MA, Neve RM, Lane HA, et al. The ErbB signaling network: receptor heterodimerization in development and cancer. EMBO J 2000; 19:3159–67.
37. Pao W, Miller V, Zakowski M, Doherty J, Politi K, Sarkaria I, et al. EGF receptor gene mutations are common in lung cancers from ‘never smokers’ and are associated with sensitivity of tumors to gefitinib and erlotinib. Proc Natl Acad Sci USA 2004; 101: 13306–11.
38. Pegram M, Chan D, Dichmann RA, et al. Phase II combined biological therapy targeting the HER2 proto–oncogene and the vascular endothelial growth factor using trastuzumab (T) and bevacizumab (B) as first line treatment of HER2–amplified breast cancer. Breast Cancer Res Treat 2006; 100(suppl 1):S28 (abstract 301).
39. Pegram MD, Reese DM. Combined biological therapy of breast cancer using monoclonal antibodies directed against HER2/neu protein and vascular endothelial growth factor. Semin Oncol 2002;29(supplll):29–37.
40. Pegram MD, Yeon C, Ku NC, et al. Phase I combined biological therapy of breast cancer using two humanized monoclonal antibodies directed against HER2 proto–oncogene and vascular endothelial growth factor (VEGF). Breast Cancer Res Treat 2004; 88(suppl 1):S124 (abstract 3039).
41. Piccart–Gebhart MJ, Procter M, Leyland–Jones B, et al. Trastuzumab after adjuvant chemotherapy in HER2–positive breast cancer. N Engl J Med 2005;353:1659–1672.
42. Presta LG, Chen H, O’Conner SJ, Chisholm V, Meng YG, Krummen L, et al. Humanization of an anti–Vascular endothelial growth factor monoclonal antibody for the therapy of solid tumors and the other disorders. Cancer Research 1997; 57: 4593–4599.
43. Pupa SM, Menard S, Morelli D, et al. The extracellular domain of the c–erbB–2 oncoprotein is released from tumor cells by proteolytic cleavage. Oncogene 1993; 8:2917–23.
44. Relf M, LeJeune S, Scott PA et al. Expression of the angio–genic factors vascular endothelial cell growth factor, acidic and basic fibroblast growth factor, tumor growth factor beta–1, platelet–derived endothelial cell growth factor, placenta growth factor, and pleiotrophin in human primary breast cancer and its relation to angiogenesis. Cancer Res 1997;57:963–969.
45. Rond EH, Perez EA, Bryant J, et al. Trastuzumab plus adjuvant chemotherapy for operable HER2–positive breast cancer. N Engl J Med 2005;353:1673–1684.
46. Rowinsky E. The erbB receptor family as a target for therapeutic development. Horiz Cancer Ther 2001; 2:3–35.
47. Rusnak DW, Lackey K, Affleck K, et al. The effects of the novel, reversible epidermal growth factor receptor/ErbB–2 tyrosine kinase inhibitor, GW2016, on the growth of human normal and tumor–derived cell lines in vitro and in vivo. Mol Cancer Ther 2001; 1:85–94.
48. Somlo G, Koczywas M, Luu T, McNamara M, Russell C, Morgan R. A phase I–II study of trastuzumab, gefitinib, and docetaxel as first line chemotherapy in patients with HER–2 overexpressing stage IV breast carcinoma. Breast Cancer Res Treat 2005; 94(Suppl 1): S95 (abstract 2035).
49. Spector NL, Xia W, Burris III H, Hurwitz W, Dees EC and Dowlati A et al., Study of the biologic effects of lapatinib, a reversible inhibitor of ErbB1 and ErbB2 tyrosine kinases, on tumor growth and survival pathways in patients with advanced malignancies, J. Clin. Oncol. 23 (11) (2005), pp. 2502–2512.
50. Tan AR, Yang X, Hewitt SM, Berman A, Lepper ER, Sparreboom A, et al. Evaluation of biologic end points and pharmacokinetics in patients with metastatic breast cancer after treatment with erlotinib, an epidermal growth factor receptor tyrosine kinase inhibitor. J Clin Oncol 2004; 22: 3080–90
51. Vogel CL, Cobleigh MA, Tripathy D, et al. Efficacy and safety of trastuzumab as a single agent in first–line treatment of HER2–overexpressing metastatic breast cancer. J Clin Oncol 2002; 20:719–26.
52. Widakowich C, de Azambuja E, Gil T, Cardoso F, Dinh P, AwadaA, Piccart–Gebhart M. Molecular targeted therapies in breast cancer: Where are we now? The Intern J Biochemistry and Cell Biol 2007; 39 (7–8):1375–1387 doi:10.1016/j.biocel.2007.04.015 (Last access: 19.07.2007)
53. Winer E, Cobleigh M, Dickler M, Miller K, Fehrenbacher L, Jones C, et al. Phase II multicenter study to evaluate the efficacy and safety of Tarceva (erlotinib, OSI–774) in women with previously treated locally advanced or metastatic breast cancer. Breast Cancer Res Treat 2002; 76: S115 (abstract 445).
54. Witton CJ, Reeves JR, Going JJ, et al. Expression of the HER1–4 family of receptor tyrosine kinases in breast cancer. J Pathol 2003; 200:290–7.
55. Xia W, Mullin RJ, Keith BR, et al. Anti–tumor activity of GW572016: a dual tyrosine kinase inhibitor blocks EGF activation of EGFR/erbB2 and downstream Erk1/2 and AKT pathways. Oncogene 2002; 21:6255–63.
56. Yamauchi H, O’Neill A, Gelman R, et al. Prediction of response to antiestrogen therapy in advanced breast cancer patients by pretreatment circulating levels of extracellular domain of the HER–2/c–neu protein. J Clin Oncol 1997; 15:2518–25.
57. Yang JC, Haworth L, Sherry RM, Hwu P, Schwartzentruber DJ, Topalian SL, Steinberg SM, Chen HX, Rosenberg SA, A randomized trial of bevacizumab, an antivascular endothelial growth factor antibody, for metastatic renal cancer. N Engl J Med 2003, 349(5):427–434.
58. Yarden Y, Sliwkowski MX. Untangling the ErbB signalling network. Nat Rev Mol Cell Biol 2001; 2:127–37.
58. Zon R, Miller KD, Wang M, Gralow J et al. A randomized phase III trial of paclitaxel with or without bevacizumab as first–line therapy for locally recurrent or metastatic breast cancer: Eastern Cooperative Oncology Group Trial E2100. Eur J Cancer Supplements 2006; 2 (Vol.4): 46.












