–Р–Ї—В—Г–∞–ї—М–љ–Њ—Б—В—М
–Ц–µ–ї–µ–Ј–Њ–і–µ—Д–Є—Ж–Є—В–љ—Л–µ —Б–Њ—Б—В–Њ—П–љ–Є—П (–Ц–Ф–°) вАФ —Б–∞–Љ—Л–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–µ –і–µ—Д–Є—Ж–Є—В–љ—Л–µ —Б–Њ—Б—В–Њ—П–љ–Є—П –≤ —З–µ–ї–Њ–≤–µ—З–µ—Б–Ї–Њ–є –њ–Њ–њ—Г–ї—П—Ж–Є–Є, –Ї–Њ—В–Њ—А—Л–µ –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –≤—Б—В—А–µ—З–∞—О—В—Б—П —Г –і–µ—В–µ–є –Є –ґ–µ–љ—Й–Є–љ —А–µ–њ—А–Њ–і—Г–Ї—В–Є–≤–љ–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ [1вАУ7]. –Ґ–∞–Ї, —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ —П–≤–љ—Л–є –Є–ї–Є —Б–Ї—А—Л—В—Л–є –і–µ—Д–Є—Ж–Є—В –ґ–µ–ї–µ–Ј–∞ –Є–Љ–µ–µ—В –Љ–µ—Б—В–Њ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є —Г –њ–Њ–ї–Њ–≤–Є–љ—Л –і–µ—В–µ–є –і–Њ—И–Ї–Њ–ї—М–љ–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –Є –±–µ—А–µ–Љ–µ–љ–љ—Л—Е –ґ–µ–љ—Й–Є–љ [8]. –Я—А–Є —Н—В–Њ–Љ –Њ—В–Љ–µ—З–µ–љ–Њ, —З—В–Њ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –Ц–Ф–° –љ–µ–Њ–і–Є–љ–∞–Ї–Њ–≤–∞ –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е —Б—В—А–∞–љ–∞—Е –Є –Ј–∞–≤–Є—Б–Є—В –Њ—В —Б–Њ—Ж–Є–∞–ї—М–љ—Л—Е –Є —Н–Ї–Њ–љ–Њ–Љ–Є—З–µ—Б–Ї–Є—Е —Г—Б–ї–Њ–≤–Є–є [1].–Ю—Б–Њ–±–Њ —Б–ї–µ–і—Г–µ—В –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М, —З—В–Њ –≤–Њ–њ—А–Њ—Б—Л —Б–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Є –∞–і–µ–Ї–≤–∞—В–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –Ц–Ф–° –Є–Љ–µ—О—В –љ–∞–Є–±–Њ–ї—М—И—Г—О –Њ—Б—В—А–Њ—В—Г –≤ –і–µ—В—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ. –Я—А–Є —Н—В–Њ–Љ –∞–Ї—В—Г–∞–ї—М–љ–Њ—Б—В—М –њ—А–Њ–±–ї–µ–Љ—Л –Ц–Ф–° –≤ –њ–µ–і–Є–∞—В—А–Є–Є –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–∞ –љ–µ —В–Њ–ї—М–Ї–Њ —И–Є—А–Њ–Ї–Є–Љ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є–µ–Љ, –љ–Њ –Є —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–Љ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–Љ –≤–ї–Є—П–љ–Є–µ–Љ –і–µ—Д–Є—Ж–Є—В–∞ –ґ–µ–ї–µ–Ј–∞ –љ–∞ —Б–Њ—Б—В–Њ—П–љ–Є–µ –Ј–і–Њ—А–Њ–≤—М—П –і–µ—В–µ–є. –Ф–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –Ц–Ф–° —П–≤–ї—П–µ—В—Б—П –њ—А–Є—З–Є–љ–Њ–є –љ–∞—А—Г—И–µ–љ–Є—П —Д—Г–љ–Ї—Ж–Є–є –Љ–љ–Њ–≥–Є—Е –Њ—А–≥–∞–љ–Њ–≤ –Є —Б–Є—Б—В–µ–Љ –Њ—А–≥–∞–љ–Є–Ј–Љ–∞. –≠—В–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ —В–µ–Љ, —З—В–Њ –ґ–µ–ї–µ–Ј–Њ –≤—Е–Њ–і–Є—В –≤ —Б–Њ—Б—В–∞–≤ –Љ–љ–Њ–≥–Є—Е –±–µ–ї–Ї–Њ–≤ (–≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ, –Љ–Є–Њ–≥–ї–Њ–±–Є–љ, —Ж–Є—В–Њ—Е—А–Њ–Љ—Л, –ґ–µ–ї–µ–Ј–Њ—Б–µ—А–Њ–њ—А–Њ—В–µ–Є–і—Л, –Њ–Ї—Б–Є–і–∞–Ј—Л, –≥–Є–і—А–Њ–Ї—Б–Є–ї–∞–Ј—Л, —Б—Г–њ–µ—А–Њ–Ї—Б–Є–і–і–Є—Б–Љ—Г—В–∞–Ј—Л –Є –і—А.), –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—Й–Є—Е —Б–Є—Б—В–µ–Љ–љ—Л–є –Є –Ї–ї–µ—В–Њ—З–љ—Л–є –∞—Н—А–Њ–±–љ—Л–є –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ –Є –Њ–Ї–Є—Б–ї–Є—В–µ–ї—М–љ–Њ-–≤–Њ—Б—Б—В–∞–љ–Њ–≤–Є—В–µ–ї—М–љ—Л–є –≥–Њ–Љ–µ–Њ—Б—В–∞–Ј –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –≤ —Ж–µ–ї–Њ–Љ. –Ґ–∞–Ї, —Ж–Є—В–Њ—Е—А–Њ–Љ—Л –Є –ґ–µ–ї–µ–Ј–Њ—Б–µ—А–Њ–њ—А–Њ—В–µ–Є–і—Л –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л –і–ї—П —В—А–∞–љ—Б–њ–Њ—А—В–∞ —Н–ї–µ–Ї—В—А–Њ–љ–Њ–≤, –∞ –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ вАФ –і–ї—П —В—А–∞–љ—Б–њ–Њ—А—В–∞ –Ї–Є—Б–ї–Њ—А–Њ–і–∞. –Т —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М, —В–∞–Ї–Є–µ –ґ–µ–ї–µ–Ј–Њ—Б–Њ–і–µ—А–ґ–∞—Й–Є–µ –±–µ–ї–Ї–Є, –Ї–∞–Ї –Њ–Ї—Б–Є–і–∞–Ј—Л, –≥–Є–і—А–Њ–Ї—Б–Є–ї–∞–Ј—Л –Є —Б—Г–њ–µ—А–Њ–Ї—Б–Є–і–і–Є—Б–Љ—Г—В–∞–Ј—Л, –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—В –∞–і–µ–Ї–≤–∞—В–љ—Л–є —Г—А–Њ–≤–µ–љ—М –Њ–Ї–Є—Б–ї–Є—В–µ–ї—М–љ–Њ-–≤–Њ—Б—Б—В–∞–љ–Њ–≤–Є—В–µ–ї—М–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ [9, 10]. –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –ґ–µ–ї–µ–Ј–∞ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ —Б–Ї–∞–Ј—Л–≤–∞–µ—В—Б—П –љ–∞ –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–∞—Е, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –љ–∞—А—Г—И–µ–љ–Є—О —Д—Г–љ–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П —А–∞–Ј–ї–Є—З–љ—Л—Е –Њ—А–≥–∞–љ–Њ–≤ –Є —Б–Є—Б—В–µ–Љ. –Я—А–Є —Н—В–Њ–Љ –і–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–µ –Ц–Ф–° —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –∞–љ–µ–Љ–Є–µ–є, –љ–∞—А—Г—И–µ–љ–Є–µ–Љ —А–Њ—Б—В–∞ –Є —А–∞–Ј–≤–Є—В–Є—П –і–µ—В–µ–є, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є –њ—Б–Є—Е–Њ–Љ–Њ—В–Њ—А–љ–Њ–≥–Њ —А–∞–Ј–≤–Є—В–Є—П, –Є–Ј–Љ–µ–љ–µ–љ–Є–µ–Љ –њ–Њ–≤–µ–і–µ–љ–Є—П, —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –Є–љ—В–µ–ї–ї–µ–Ї—В–∞, –і–Є—Б—Д—Г–љ–Ї—Ж–Є—П–Љ–Є –Є–Љ–Љ—Г–љ–Є—В–µ—В–∞ –Є –і—А—Г–≥–Є–Љ–Є –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є [1вАУ9, 11вАУ13].
–Я—А–Є—З–Є–љ—Л —А–∞–Ј–≤–Є—В–Є—П –Ц–Ф–°
–Ю—Б–љ–Њ–≤–љ—Л–Љ–Є –њ—А–Є—З–Є–љ–∞–Љ–Є –Ц–Ф–° —П–≤–ї—П—О—В—Б—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–µ –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–µ –ґ–µ–ї–µ–Ј–∞ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ, –њ–ї–Њ—Е–Њ–µ –µ–≥–Њ –≤—Б–∞—Б—Л–≤–∞–љ–Є–µ –≤ –Ї–Є—И–µ—З–љ–Є–Ї–µ –Є –њ–Њ–≤—Л—И–µ–љ–љ—Л–µ –њ–Њ—В–µ—А–Є. –Я—А–Є —Н—В–Њ–Љ —Б–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –і–ї—П –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л—Е —Н—В–∞–њ–Њ–≤ —А–Њ—Б—В–∞ –Є —А–∞–Ј–≤–Є—В–Є—П –і–µ—В—Б–Ї–Њ–≥–Њ –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –Є–Љ–µ—О—В—Б—П —Е–∞—А–∞–Ї—В–µ—А–љ—Л–µ —Д–∞–Ї—В–Њ—А—Л —А–Є—Б–Ї–∞ –Ц–Ф–°. –Ґ–∞–Ї, –≤ –∞–љ—В–µ–љ–∞—В–∞–ї—М–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ –Ї –і–µ—Д–Є—Ж–Є—В—Г –ґ–µ–ї–µ–Ј–∞ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –њ–ї–Њ–і–∞ –Є –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ–Њ–≥–Њ –њ—А–Є–≤–Њ–і—П—В: –љ–∞—А—Г—И–µ–љ–Є–µ –Љ–∞—В–Њ—З–љ–Њ-–њ–ї–∞—Ж–µ–љ—В–∞—А–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П, —Д–µ—В–Њ–њ–ї–∞—Ж–µ–љ—В–∞—А–љ—Л–µ –Є —Д–µ—В–Њ–Љ–∞—В–µ—А–Є–љ—Б–Ї–Є–µ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П, —Д–µ—В–Њ—Д–µ—В–∞–ї—М–љ–∞—П —В—А–∞–љ—Б—Д—Г–Ј–Є—П –њ—А–Є –Љ–љ–Њ–≥–Њ–њ–ї–Њ–і–љ–Њ–є –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є, –≤–љ—Г—В—А–Є—Г—В—А–Њ–±–љ–∞—П –Љ–µ–ї–µ–љ–∞, –љ–µ–і–Њ–љ–Њ—И–µ–љ–љ–Њ—Б—В—М, –∞ —В–∞–Ї–ґ–µ –і–µ—Д–Є—Ж–Є—В –ґ–µ–ї–µ–Ј–∞ —Г –Љ–∞—В–µ—А–Є (–і–ї–Є—В–µ–ї—М–љ—Л–є –ї–∞—В–µ–љ—В–љ—Л–є). –§–∞–Ї—В–Њ—А–∞–Љ–Є —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Ц–Ф–° –≤ –Є–љ—В—А–∞–љ–∞—В–∞–ї—М–љ—Л–є –њ–µ—А–Є–Њ–і —П–≤–ї—П—О—В—Б—П: –њ—А–µ–ґ–і–µ–≤—А–µ–Љ–µ–љ–љ–∞—П –њ–µ—А–µ–≤—П–Ј–Ї–∞ –њ—Г–њ–Њ–≤–Є–љ—Л, —Д–µ—В–Њ–њ–ї–∞—Ж–µ–љ—В–∞—А–љ–∞—П —В—А–∞–љ—Б—Д—Г–Ј–Є—П, –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є–є —Б–Є–љ–і—А–Њ–Љ —А–∞–Ј–ї–Є—З–љ–Њ–≥–Њ –≥–µ–љ–µ–Ј–∞ (–Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П –Є–Ј-–Ј–∞ —В—А–∞–≤–Љ–∞—В–Є—З–љ—Л—Е –∞–Ї—Г—И–µ—А—Б–Ї–Є—Е –њ–Њ—Б–Њ–±–Є–є –Є–ї–Є –∞–љ–Њ–Љ–∞–ї–Є–є —А–∞–Ј–≤–Є—В–Є—П –њ–ї–∞—Ж–µ–љ—В—Л –Є —Б–Њ—Б—Г–і–Њ–≤ –њ—Г–њ–Њ–≤–Є–љ—Л) [1, 6].–Т –њ–Њ—Б—В–љ–∞—В–∞–ї—М–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ –≤–µ–і—Г—Й–∞—П —А–Њ–ї—М –≤ —А–∞–Ј–≤–Є—В–Є–Є –Ц–Ф–° —Г –і–µ—В–µ–є –њ—А–Є–љ–∞–і–ї–µ–ґ–Є—В –∞–ї–Є–Љ–µ–љ—В–∞—А–љ–Њ–Љ—Г —Д–∞–Ї—В–Њ—А—Г. –Ґ–∞–Ї, –љ–∞ –њ–µ—А–≤–Њ–Љ –≥–Њ–і—Г –ґ–Є–Ј–љ–Є –љ–µ–∞–і–µ–Ї–≤–∞—В–љ–Њ–µ –≤—Б–Ї–∞—А–Љ–ї–Є–≤–∞–љ–Є–µ —А–µ–±–µ–љ–Ї–∞ (–Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –љ–µ–∞–і–∞–њ—В–Є—А–Њ–≤–∞–љ–љ—Л—Е –Љ–Њ–ї–Њ—З–љ—Л—Е –Ј–∞–Љ–µ–љ–Є—В–µ–ї–µ–є –≥—А—Г–і–љ–Њ–≥–Њ –Љ–Њ–ї–Њ–Ї–∞, –њ–Њ–Ј–і–љ–µ–µ –≤–≤–µ–і–µ–љ–Є–µ –Љ—П—Б–љ—Л—Е –њ—А–Њ–і—Г–Ї—В–Њ–≤, –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –ґ–µ–ї–µ–Ј–∞ –≤ —А–∞—Ж–Є–Њ–љ–µ –і–µ—В–µ–є —Б —Г—Б–Ї–Њ—А–µ–љ–љ—Л–Љ–Є —В–µ–Љ–њ–∞–Љ–Є —А–Њ—Б—В–∞ вАФ –љ–µ–і–Њ–љ–Њ—И–µ–љ–љ—Л–µ, –Љ–∞–Ї—А–Њ—Б–Њ–Љ–∞—В–Є–Ї–Є, –ї–Є–Љ—Д–∞—В–Є–Ї–Є) –њ—А–Є–≤–Њ–і–Є—В –Ї –Ц–Ф–°. –Т –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–µ –њ–µ—А–Є–Њ–і—Л –і–µ—В—Б—В–≤–∞ –∞–ї–Є–Љ–µ–љ—В–∞—А–љ—Л–є —Д–∞–Ї—В–Њ—А —В–∞–Ї–ґ–µ –Љ–Њ–ґ–µ—В –Є–≥—А–∞—В—М –≤–µ–і—Г—Й—Г—О —А–Њ–ї—М –≤ —А–∞–Ј–≤–Є—В–Є–Є –Ц–Ф–° (–љ–∞—А—Г—И–µ–љ–Є–µ –њ–Є—Й–µ–≤–Њ–≥–Њ –њ–Њ–≤–µ–і–µ–љ–Є—П, –≤–µ–≥–∞–љ—Б—В–≤–Њ, –≤–µ–≥–µ—В–∞—А–Є–∞–љ—Б—В–≤–Њ). –Ю—Б–Њ–±–Њ–µ –≤–љ–Є–Љ–∞–љ–Є–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ–±—А–∞—В–Є—В—М –љ–∞ —В–Њ, —З—В–Њ —Д–∞–Ї—В–Њ—А–Њ–Љ —А–Є—Б–Ї–∞ –Ц–Ф–° –Љ–Њ–ґ–µ—В —Б—В–∞—В—М –љ–µ—Б–±–∞–ї–∞–љ—Б–Є—А–Њ–≤–∞–љ–љ–Њ–µ –њ–Є—В–∞–љ–Є–µ —Б –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ—Л–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ –Љ—П—Б–љ—Л—Е –њ—А–Њ–і—Г–Ї—В–Њ–≤ –≤ —А–∞—Ж–Є–Њ–љ–µ –і–µ—В–µ–є, –њ—А–Њ—Д–µ—Б—Б–Є–Њ–љ–∞–ї—М–љ–Њ –Ј–∞–љ–Є–Љ–∞—О—Й–Є—Е—Б—П —Б–њ–Њ—А—В–Њ–Љ [1, 6].
–Э–∞—А—Г—И–µ–љ–Є–µ –≤—Б–∞—Б—Л–≤–∞–љ–Є—П –ґ–µ–ї–µ–Ј–∞ –Є–Ј –Ї–Є—И–µ—З–љ–Є–Ї–∞ –Љ–Њ–ґ–µ—В –±—Л—В—М –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є –Ц–Ъ–Ґ (–љ–∞—Б–ї–µ–і—Б—В–≤–µ–љ–љ—Л–µ –Є –њ—А–Є–Њ–±—А–µ—В–µ–љ–љ—Л–µ —Б–Є–љ–і—А–Њ–Љ—Л –Љ–∞–ї—М–∞–±—Б–Њ—А–±—Ж–Є–Є, —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–µ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Ї–Є—И–µ—З–љ–Є–Ї–∞, –њ–∞—А–∞–Ј–Є—В–∞—А–љ—Л–µ –Є–љ–≤–∞–Ј–Є–Є). –°—А–µ–і–Є –Њ—Б–љ–Њ–≤–љ—Л—Е –њ—А–Є—З–Є–љ –Ц–Ф–°, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ–Є –њ–Њ—В–µ—А—П–Љ–Є –ґ–µ–ї–µ–Ј–∞ –Є–Ј –Њ—А–≥–∞–љ–Є–Ј–Љ–∞, —Б–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М –і–ї–Є—В–µ–ї—М–љ—Л–є –ї–µ–≥–Ї–Є–є –≥–µ–Љ–Њ—А—А–∞–ґ –Є–Ј –Ц–Ъ–Ґ –њ—А–Є –≥–∞—Б—В—А–Њ–Є–љ—В–µ—Б—В–Є–љ–∞–ї—М–љ—Л—Е –њ—А–Њ—П–≤–ї–µ–љ–Є—П—Е –њ–Є—Й–µ–≤–Њ–є –∞–ї–ї–µ—А–≥–Є–Є (—Г –і–µ—В–µ–є —А–∞–љ–љ–µ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ вАФ –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –љ–∞ –±–µ–ї–Ї–Є –Ї–Њ—А–Њ–≤—М–µ–≥–Њ –Љ–Њ–ї–Њ–Ї–∞), –∞ —В–∞–Ї–ґ–µ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П —А–∞–Ј–ї–Є—З–љ–Њ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є –Є —Н—В–Є–Њ–ї–Њ–≥–Є–Є. –Я—А–Є —Н—В–Њ–Љ –≥—А—Г–њ–њ–Њ–є –Њ—Б–Њ–±–Њ –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞ –њ–Њ —А–∞–Ј–≤–Є—В–Є—О –Ц–Ф–° —П–≤–ї—П—О—В—Б—П –і–µ–≤—Г—И–Ї–Є –≤ –њ–µ—А–Є–Њ–і —Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –Љ–µ–љ—Б—В—А—Г–∞–ї—М–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є [1, 6].
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Ї–∞—А—В–Є–љ–∞ –Ц–Ф–°
–†–∞–Ј–≤–Є—В–Є–µ –Ц–Ф–° –Є–Љ–µ–µ—В —Б—В–∞–і–Є–є–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А. –Я—А–Є —Н—В–Њ–Љ —Б–љ–∞—З–∞–ї–∞ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –Њ–њ—Г—Б—В–Њ—И–µ–љ–Є–µ —В–Ї–∞–љ–µ–≤—Л—Е –Ј–∞–њ–∞—Б–Њ–≤ –ґ–µ–ї–µ–Ј–∞, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –≤ –Њ—А–≥–∞–љ–∞—Е –Ї—А–Њ–≤–µ—В–≤–Њ—А–µ–љ–Є—П –µ–≥–Њ —Г—А–Њ–≤–µ–љ—М –Њ—Б—В–∞–µ—В—Б—П –≤ –њ—А–µ–і–µ–ї–∞—Е –љ–Њ—А–Љ–∞—В–Є–≤–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є–є. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ —Г–Љ–µ–љ—М—И–µ–љ–Є—П —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –ґ–µ–ї–µ–Ј–∞ –≤ —В–Ї–∞–љ—П—Е —Б–љ–Є–ґ–∞–µ—В—Б—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –ґ–µ–ї–µ–Ј–Њ—Б–Њ–і–µ—А–ґ–∞—Й–Є—Е —Д–µ—А–Љ–µ–љ—В–Њ–≤, —З—В–Њ –њ—А–Њ—П–≤–ї—П–µ—В—Б—П —Б–Є–Љ–њ—В–Њ–Љ–∞–Љ–Є —Б–Є–і–µ—А–Њ–њ–µ–љ–Є–Є. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є –њ—А–Є —Н—В–Њ–Љ –Љ–Њ–ґ–љ–Њ –Њ—В–Љ–µ—В–Є—В—М —Б—Г—Е–Њ—Б—В—М –Ї–Њ–ґ–Є; –ї–Њ–Љ–Ї–Њ—Б—В—М, —Б–ї–Њ–Є—Б—В–Њ—Б—В—М, –њ–Њ–њ–µ—А–µ—З–љ—Г—О –Є—Б—З–µ—А—З–µ–љ–љ–Њ—Б—В—М –Є –ї–Њ–ґ–Ї–Њ–Њ–±—А–∞–Ј–љ—Г—О —Д–Њ—А–Љ—Г –љ–Њ–≥—В–µ–є; –≥–ї–Њ—Б—Б–Є—В, –≥–Є–љ–≥–Є–≤–Є—В, —Б—В–Њ–Љ–∞—В–Є—В, –і–Є—Б—Д–∞–≥–Є—О, –і–Є—Б–њ–µ–њ—Б–Є—З–µ—Б–Ї–Є–µ –љ–∞—А—Г—И–µ–љ–Є—П. –°–ї–µ–і—Г–µ—В –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М, —З—В–Њ –љ–∞ —А–∞–љ–љ–Є—Е —Б—В–∞–і–Є—П—Е –Ц–Ф–° –Ј–љ–∞—З–Є–Љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є —Н—А–Є—В—А–Њ–њ–Њ—Н–Ј–∞ –љ–µ—В, —З—В–Њ –Є –Њ–њ—А–µ–і–µ–ї—П–µ—В –Њ—В—Б—Г—В—Б—В–≤–Є–µ –∞–љ–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –≤ —Н—В–Њ—В –њ–µ—А–Є–Њ–і. –°–Њ—Б—В–Њ—П–љ–Є–µ, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–Љ –љ–µ–і–Њ—Б—В–∞—В–Њ–Ї –ґ–µ–ї–µ–Ј–∞ –≤ —В–Ї–∞–љ—П—Е –Є –Њ—А–≥–∞–љ–∞—Е –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –љ–µ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –∞–љ–µ–Љ–Є–µ–є, –њ—А–Є–љ—П—В–Њ –љ–∞–Ј—Л–≤–∞—В—М –ї–∞—В–µ–љ—В–љ—Л–Љ –ґ–µ–ї–µ–Ј–Њ–і–µ—Д–Є—Ж–Є—В–Њ–Љ. –Т —Б–ї—Г—З–∞–µ –і–∞–ї—М–љ–µ–є—И–µ–≥–Њ –љ–∞—А–∞—Б—В–∞–љ–Є—П –і–µ—Д–Є—Ж–Є—В–∞ –ґ–µ–ї–µ–Ј–∞ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П –µ–≥–Њ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –Є –≤ –Њ—А–≥–∞–љ–∞—Е –Ї—А–Њ–≤–µ—В–≤–Њ—А–µ–љ–Є—П. –≠—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —Б–љ–Є–ґ–µ–љ–Є—О —Б–Є–љ—В–µ–Ј–∞ –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –Є —А–∞–Ј–≤–Є—В–Є—О –∞–љ–µ–Љ–Є–Є. –Э–∞ –і–∞–љ–љ–Њ–Љ —Н—В–∞–њ–µ –Ї –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ —Б–Є–і–µ—А–Њ–њ–µ–љ–Є–Є –і–Њ–±–∞–≤–ї—П–µ—В—Б—П —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–∞ –∞–љ–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ (–≤—П–ї–Њ—Б—В—М, —Б–ї–∞–±–Њ—Б—В—М, –±—Л—Б—В—А–∞—П —Г—В–Њ–Љ–ї—П–µ–Љ–Њ—Б—В—М, —Б–љ–Є–ґ–µ–љ–Є–µ —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є, —В–∞—Е–Є–Ї–∞—А–і–Є—П, –њ—А–Є–≥–ї—Г—И–µ–љ–љ–Њ—Б—В—М —Б–µ—А–і–µ—З–љ—Л—Е —В–Њ–љ–Њ–≤ –Є —В. –і.). –°—В–∞–і–Є—О –Ц–Ф–°, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–є —Г–Љ–µ–љ—М—И–µ–љ–Є–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –ґ–µ–ї–µ–Ј–∞ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –љ–∞—А—Г—И–µ–љ–Є–µ–Љ —Н—А–Є—В—А–Њ–њ–Њ—Н–Ј–∞ —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ –≥–Є–њ–Њ—Е—А–Њ–Љ–љ–Њ–є –Љ–Є–Ї—А–Њ—Ж–Є—В–∞—А–љ–Њ–є –∞–љ–µ–Љ–Є–Є, —В–µ—А–Љ–Є–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –Њ–њ—А–µ–і–µ–ї—П—О—В –Ї–∞–Ї –ґ–µ–ї–µ–Ј–Њ–і–µ—Д–Є—Ж–Є—В–љ—Г—О –∞–љ–µ–Љ–Є—О (–Ц–Ф–Р) [1вАУ7].
–Ф–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –Ц–Ф–°
–Я—А–Є–љ–Є–Љ–∞—П –≤–Њ –≤–љ–Є–Љ–∞–љ–Є–µ –љ–Є–Ј–Ї—Г—О —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є —Б–Є–і–µ—А–Њ–њ–µ–љ–Є–Є –Є –∞–љ–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞, –Ї—А–Є—В–µ—А–Є—П–Љ–Є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –ї–∞—В–µ–љ—В–љ–Њ–≥–Њ –ґ–µ–ї–µ–Ј–Њ–і–µ—Д–Є—Ж–Є—В–∞ (–Ы–Ц–Ф–°) –Є –Ц–Ф–Р —П–≤–ї—П—О—В—Б—П —Е–∞—А–∞–Ї—В–µ—А–љ—Л–µ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–µ –њ—А–Є–Ј–љ–∞–Ї–Є. –Я—А–Є —Н—В–Њ–Љ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –і–ї—П –≤–µ—А–Є—Д–Є–Ї–∞—Ж–Є–Є –Ц–Ф–° –Љ–Њ–≥—Г—В –±—Л—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ—Л —А—Г—В–Є–љ–љ—Л–µ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–µ –Љ–µ—В–Њ–і—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –Ї–Њ—В–Њ—А—Л–µ –і–Њ—Б—В—Г–њ–љ—Л –і–ї—П —И–Є—А–Њ–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–Є (–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–ї–Є–Ј –Ї—А–Њ–≤–Є, –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –ґ–µ–ї–µ–Ј–∞, —Д–µ—А—А–Є—В–Є–љ–∞ –Є –Њ–±—Й–µ–є –ґ–µ–ї–µ–Ј–Њ—Б–≤—П–Ј—Л–≤–∞—О—Й–µ–є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ –≤—Л—З–Є—Б–ї–µ–љ–Є–µ–Љ –Ї–Њ—Н—Д—Д–Є—Ж–Є–µ–љ—В–∞ –љ–∞—Б—Л—Й–µ–љ–Є—П —В—А–∞–љ—Б—Д–µ—А—А–Є–љ–∞ –ґ–µ–ї–µ–Ј–Њ–Љ). –Ю—Б–Њ–±–Њ —Б–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г —Д–µ—А—А–Є—В–Є–љ –Њ—В–љ–Њ—Б–Є—В—Б—П –Ї –њ—А–Њ—В–µ–Є–љ–∞–Љ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П, —В–Њ –µ–≥–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ –і–Њ–ї–ґ–љ–Њ –њ—А–Њ–≤–Њ–і–Є—В—М—Б—П –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–љ–Њ —Б –°-—А–µ–∞–Ї—В–Є–≤–љ—Л–Љ –±–µ–ї–Ї–Њ–Љ (–°–†–С) [1вАУ7, 14, 15].–Я—А–Є —Н—В–Њ–Љ —Б–ї–µ–і—Г–µ—В –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М, —З—В–Њ –і–ї—П –Ї–Њ—А—А–µ–Ї—В–љ–Њ–є —В—А–∞–Ї—В–Њ–≤–Ї–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ –Ї—А–Њ–≤–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ—Ж–µ–љ–Є—В—М –≤—Б–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є, –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л–µ –≤ –≥–µ–Љ–Њ–≥—А–∞–Љ–Љ–µ. –Э–µ–ї—М–Ј—П –Њ–≥—А–∞–љ–Є—З–Є–≤–∞—В—М—Б—П —В–Њ–ї—М–Ї–Њ –∞–љ–∞–ї–Є–Ј–Њ–Љ —Г—А–Њ–≤–љ—П –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞, –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–≤ –Є –°–Ю–≠. –Ф–Њ–ї–ґ–љ—Л –±—Л—В—М –Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ –Є–љ—В–µ—А–њ—А–µ—В–Є—А–Њ–≤–∞–љ—Л —В–∞–Ї–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є, –Ї–∞–Ї –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ –Є —А–µ—В–Є–Ї—Г–ї–Њ—Ж–Є—В–Њ–≤, —Н—А–Є—В—А–Њ—Ж–Є—В–∞—А–љ—Л–µ –Є–љ–і–µ–Ї—Б—Л, ¬Ђ–ї–µ–є–Ї–Њ—Ж–Є—В–∞—А–љ–∞—П —Д–Њ—А–Љ—Г–ї–∞¬ї, –∞–±—Б–Њ–ї—О—В–љ—Л–µ –Ј–љ–∞—З–µ–љ–Є—П –љ–µ–є—В—А–Њ—Д–Є–ї–Њ–≤, –ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤, –Љ–Њ–љ–Њ—Ж–Є—В–Њ–≤, —Н–Њ–Ј–Є–љ–Њ—Д–Є–ї–Њ–≤, —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤, –∞ —В–∞–Ї–ґ–µ —В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ—Л–µ –Є–љ–і–µ–Ї—Б—Л [14вАУ16].
–Ы–∞–±–Њ—А–∞—В–Њ—А–љ—Л–Љ –Ї—А–Є—В–µ—А–Є–µ–Љ –∞–љ–µ–Љ–Є–Є —П–≤–ї—П–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –љ–Є–ґ–µ –≤–Њ–Ј—А–∞—Б—В–љ–Њ–є –љ–Њ—А–Љ—Л. –Я—А–Є —Н—В–Њ–Љ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –љ–Є–ґ–љ–µ–є –≥—А–∞–љ–Є—Ж–µ–є –љ–Њ—А–Љ—Л –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –і–ї—П –і–µ—В–µ–є –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 1 –Љ–µ—Б. –і–Њ 5 –ї–µ—В —П–≤–ї—П–µ—В—Б—П —Г—А–Њ–≤–µ–љ—М 110 –≥/–ї, –і–ї—П –і–µ—В–µ–є 6вАУ12 –ї–µ—В вАФ 115 –≥/–ї, –і–ї—П –і–µ—В–µ–є —Б—В–∞—А—И–µ 12 –ї–µ—В –Є –њ–Њ–і—А–Њ—Б—В–Ї–Њ–≤ вАФ 120 –≥/–ї. –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ —Г–ґ–µ –љ–∞ –њ–µ—А–≤–Њ–Љ —Н—В–∞–њ–µ —А–∞—Б—И–Є—Д—А–Њ–≤–Ї–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ –Ї—А–Њ–≤–Є –Љ–Њ–ґ–љ–Њ –љ–µ —В–Њ–ї—М–Ї–Њ –≤—Л—П–≤–Є—В—М –∞–љ–µ–Љ–Є—О, –љ–Њ –Є –Њ–њ—А–µ–і–µ–ї–Є—В—М –µ–µ —В—П–ґ–µ—Б—В—М. –Ъ—А–Є—В–µ—А–Є–µ–Љ —В—П–ґ–µ—Б—В–Є –∞–љ–µ–Љ–Є–Є —П–≤–ї—П–µ—В—Б—П —Б—В–µ–њ–µ–љ—М —Б–љ–Є–ґ–µ–љ–Є—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ (–Эb). –Ґ–∞–Ї, —Г –і–µ—В–µ–є —Б—В–∞—А—И–µ –Њ–і–љ–Њ–≥–Њ –Љ–µ—Б—П—Ж–∞ –ґ–Є–Ј–љ–Є –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П —Б–ї–µ–і—Г—О—Й–Є–µ –њ–Њ–і—Е–Њ–і—Л: —Б–љ–Є–ґ–µ–љ–Є–µ –Эb –і–Њ 90 –≥/–ї вАФ –њ—А–Є–Ј–љ–∞–Ї –ї–µ–≥–Ї–Њ–є –∞–љ–µ–Љ–Є–Є, —Г—А–Њ–≤–µ–љ—М –Эb –≤ –њ—А–µ–і–µ–ї–∞—Е 70вАУ90 –≥/–ї вАФ –Љ–∞—А–Ї–µ—А —Б—А–µ–і–љ–µ—В—П–ґ–µ–ї–Њ–є –∞–љ–µ–Љ–Є–Є, —Б–љ–Є–ґ–µ–љ–Є–µ –Эb –љ–Є–ґ–µ 70 –≥/–ї вАФ –Ї—А–Є—В–µ—А–Є–є —В—П–ґ–µ–ї–Њ–є –∞–љ–µ–Љ–Є–Є [6].
–Т—Л—П–≤–ї–µ–љ–Є–µ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –∞–љ–µ–Љ–Є–Є –Њ–њ—А–µ–і–µ–ї—П–µ—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ–є –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є –Њ—Ж–µ–љ–Ї–Є –Ј–љ–∞—З–µ–љ–Є–є –Є –і—А—Г–≥–Є—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –≥–µ–Љ–Њ–≥—А–∞–Љ–Љ—Л. –Х—Б–ї–Є –њ—А–Є —Н—В–Њ–Љ –∞–љ–µ–Љ–Є—П —Б–Њ—З–µ—В–∞–µ—В—Б—П —Б –і—А—Г–≥–Є–Љ–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–Љ –∞–љ–∞–ї–Є–Ј–µ –Ї—А–Њ–≤–Є (–ї–µ–є–Ї–Њ–њ–µ–љ–Є—П, –∞–≥—А–∞–љ—Г–ї–Њ—Ж–Є—В–Њ–Ј, —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є—П), –Ї –Ї—Г—А–∞—Ж–Є–Є –њ–∞—Ж–Є–µ–љ—В–∞ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ—А–Є–≤–ї–µ–Ї–∞—В—М –≥–µ–Љ–∞—В–Њ–ї–Њ–≥–∞. –Т —В–µ—Е –ґ–µ —Б–ї—Г—З–∞—П—Е, –Ї–Њ–≥–і–∞ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–Љ –∞–љ–∞–ї–Є–Ј–µ –Є–Љ–µ—О—В –Љ–µ—Б—В–Њ —В–Њ–ї—М–Ї–Њ –Љ–∞—А–Ї–µ—А—Л –∞–љ–µ–Љ–Є–Є, –≤—А–∞—З-–њ–µ–і–Є–∞—В—А –Љ–Њ–ґ–µ—В –њ—А–Њ–і–Њ–ї–ґ–Є—В—М –њ–Њ–Є—Б–Ї –њ—А–Є—З–Є–љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ. –Ф–ї—П —Н—В–Њ–≥–Њ —Б–ї–µ–і—Г—О—Й–Є–Љ –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–Љ —И–∞–≥–Њ–Љ —П–≤–ї—П–µ—В—Б—П –Њ—Ж–µ–љ–Ї–∞ —Н—А–Є—В—А–Њ—Ж–Є—В–∞—А–љ—Л—Е –Є–љ–і–µ–Ї—Б–Њ–≤, –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л—Е –≤ –∞–љ–∞–ї–Є–Ј–µ –Ї—А–Њ–≤–Є (—А–Є—Б. 1). –Я—А–Є —Н—В–Њ–Љ –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М –Њ–±—А–∞—Й–∞—О—В –≤–љ–Є–Љ–∞–љ–Є–µ –љ–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–Є–µ —Б—В–µ–њ–µ–љ—М –љ–∞—Б—Л—Й–µ–љ–Є—П —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–Њ–Љ. –Ъ –љ–Є–Љ –Њ—В–љ–Њ—Б—П—В—Б—П —Ж–≤–µ—В–Њ–≤–Њ–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М (–¶–Я) –Є —Б—А–µ–і–љ–µ–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –≤ —Н—А–Є—В—А–Њ—Ж–Є—В–µ вАФ MCH (Mean Corpuscular Hemoglobin). –Т –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Б—В–µ–њ–µ–љ–Є –љ–∞—Б—Л—Й–µ–љ–Є—П —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–Њ–Љ —А–∞–Ј–ї–Є—З–∞—О—В –∞–љ–µ–Љ–Є–Є –љ–Њ—А–Љ–Њ—Е—А–Њ–Љ–љ—Г—О (–∞–і–µ–Ї–≤–∞—В–љ–Њ–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –Эb –≤ —Н—А–Є—В—А–Њ—Ж–Є—В–∞—Е), –≥–Є–њ–Њ—Е—А–Њ–Љ–љ—Г—О (–љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –Эb –≤ —Н—А–Є—В—А–Њ—Ж–Є—В–∞—Е) –Є –≥–Є–њ–µ—А—Е—А–Њ–Љ–љ—Г—О (–Є–Ј–±—Л—В–Њ—З–љ–Њ–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –Эb –≤ —Н—А–Є—В—А–Њ—Ж–Є—В–∞—Е).
–Я—А–Є —Б–љ–Є–ґ–µ–љ–Є–Є –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –љ–Є–ґ–µ –≤–Њ–Ј—А–∞—Б—В–љ–Њ–є –љ–Њ—А–Љ—Л –Є –Њ–±–љ–∞—А—Г–ґ–µ–љ–Є–Є –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –≥–Є–њ–Њ—Е—А–Њ–Љ–Є–Є —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ (–¶–Я<0,85, MCH<26 –њ–≥) –і–µ–ї–∞—О—В –≤—Л–≤–Њ–і –Њ –љ–∞–ї–Є—З–Є–Є –≥–Є–њ–Њ—Е—А–Њ–Љ–љ–Њ–є –∞–љ–µ–Љ–Є–Є. –Ю–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ—Л–є –∞–љ–∞–ї–Є–Ј –Ј–љ–∞—З–µ–љ–Є–є —Б—А–µ–і–љ–µ–≥–Њ –Њ–±—К–µ–Љ–∞ —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ вАФ MCV (Mean –°orpusculare Volume) –њ–Њ–Ј–≤–Њ–ї—П–µ—В –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –Њ—Е–∞—А–∞–Ї—В–µ—А–Є–Ј–Њ–≤–∞—В—М –≤—Л—П–≤–ї–µ–љ–љ—Г—О –∞–љ–µ–Љ–Є—О –Ї–∞–Ї –Љ–Є–Ї—А–Њ—Ж–Є—В–∞—А–љ—Г—О, –љ–Њ—А–Љ–Њ—Ж–Є—В–∞—А–љ—Г—О –Є–ї–Є –Љ–∞–Ї—А–Њ—Ж–Є—В–∞—А–љ—Г—О. –Т —В–µ—Е —Б–ї—Г—З–∞—П—Е, –Ї–Њ–≥–і–∞ –Є–Љ–µ—О—В—Б—П –њ—А–Є–Ј–љ–∞–Ї–Є –≥–Є–њ–Њ—Е—А–Њ–Љ–љ–Њ–є –Љ–Є–Ї—А–Њ—Ж–Є—В–∞—А–љ–Њ–є –∞–љ–µ–Љ–Є–Є, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ—А–Њ–≤–Њ–і–Є—В—М –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ—Л–є –і–Є–∞–≥–љ–Њ–Ј –Љ–µ–ґ–і—Г –Ц–Ф–Р, —Б–Є–і–µ—А–Њ–±–ї–∞—Б—В–Њ–Ј–Њ–Љ –Є —В–∞–ї–∞—Б—Б–µ–Љ–Є–µ–є. –Ф–ї—П —Н—В–Њ–≥–Њ –љ–∞ —Б–ї–µ–і—Г—О—Й–µ–Љ —Н—В–∞–њ–µ —А–∞—Б—И–Є—Д—А–Њ–≤–Ї–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –≥–µ–Љ–Њ–≥—А–∞–Љ–Љ—Л –Њ—Ж–µ–љ–Є–≤–∞—О—В —Г—А–Њ–≤–µ–љ—М —А–µ—В–Є–Ї—Г–ї–Њ—Ж–Є—В–Њ–≤ (—Б–Љ. —А–Є—Б. 1). –Х—Б–ї–Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —А–µ—В–Є–Ї—Г–ї–Њ—Ж–Є—В–Њ–≤ –њ—А–Є —Н—В–Њ–Љ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В –љ–Њ—А–Љ–∞—В–Є–≤–љ—Л–Љ –Ј–љ–∞—З–µ–љ–Є—П–Љ (1вАУ2%), —Н—В–Њ –Ј–љ–∞—З–Є—В, —З—В–Њ –∞–љ–µ–Љ–Є—П –Є–Љ–µ–µ—В –љ–Њ—А–Љ–Њ—А–µ–≥–µ–љ–µ—А–∞—В–Њ—А–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А. –Т —Н—В–Њ–Љ —Б–ї—Г—З–∞–µ –≤—Б–µ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –∞–љ–µ–Љ–Є–Є вАФ –≥–Є–њ–Њ—Е—А–Њ–Љ–Є—П (–¶–Я<0,85, MCH<26 –њ–≥) –Є –Љ–Є–Ї—А–Њ—Ж–Є—В–Њ–Ј (MCV<80 —Д–ї) —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤, –љ–Њ—А–Љ–Њ—А–µ–≥–µ–љ–∞—А–∞—Ж–Є—П (—А–µ—В–Є–Ї—Г–ї–Њ—Ж–Є—В—Л 1вАУ2%) вАФ –њ–Њ–Ј–≤–Њ–ї—П—О—В —Б–і–µ–ї–∞—В—М –≤—Л–≤–Њ–і –Њ –љ–∞–ї–Є—З–Є–Є —Г –њ–∞—Ж–Є–µ–љ—В–∞ –Ц–Ф–Р (—Б–Љ. —А–Є—Б. 1). –Я—А–Є —Н—В–Њ–Љ –Њ—Б–Њ–±–Њ —Б–ї–µ–і—Г–µ—В –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М, —З—В–Њ –≥–Є–њ–Њ—Е—А–Њ–Љ–љ—Л–є –Љ–Є–Ї—А–Њ—Ж–Є—В–∞—А–љ—Л–є –љ–Њ—А–Љ–Њ—А–µ–≥–µ–љ–µ—А–∞—В–Њ—А–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А –∞–љ–µ–Љ–Є–Є —В–Є–њ–Є—З–µ–љ –і–ї—П –Ц–Ф–Р –∞–ї–Є–Љ–µ–љ—В–∞—А–љ–Њ–≥–Њ –≥–µ–љ–µ–Ј–∞, –∞ —В–∞–Ї–ґ–µ –і–ї—П —В–µ—Е –≤–∞—А–Є–∞–љ—В–Њ–≤ –Ц–Ф–Р, –Ї–Њ—В–Њ—А—Л–µ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ—Л –љ–∞—А—Г—И–µ–љ–Є–µ–Љ –≤—Б–∞—Б—Л–≤–∞–љ–Є—П –ґ–µ–ї–µ–Ј–∞ –≤ –Ї–Є—И–µ—З–љ–Є–Ї–µ (—Б–Є–љ–і—А–Њ–Љ –Љ–∞–ї—М–∞–±—Б–Њ—А–±—Ж–Є–Є, –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Ї–Є—И–µ—З–љ–Є–Ї–∞, –≥–µ–ї—М–Љ–Є–љ—В–Њ–Ј—Л).
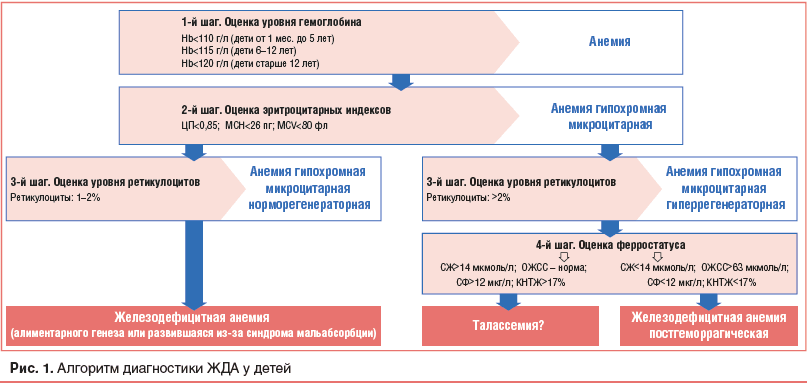
–Т —В–µ—Е –ґ–µ —Б–ї—Г—З–∞—П—Е, –Ї–Њ–≥–і–∞ –≥–Є–њ–Њ—Е—А–Њ–Љ–љ–∞—П –Љ–Є–Ї—А–Њ—Ж–Є—В–∞—А–љ–∞—П –∞–љ–µ–Љ–Є—П —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —Г—А–Њ–≤–љ—П —А–µ—В–Є–Ї—Г–ї–Њ—Ж–Є—В–Њ–≤ (>2%), –Ї–Њ–љ—Б—В–∞—В–Є—А—Г—О—В –≥–Є–њ–µ—А—А–µ–≥–µ–љ–µ—А–∞—В–Њ—А–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А –∞–љ–µ–Љ–Є–Є. –Я—А–Є —Н—В–Њ–Љ —Б–ї–µ–і—Г–µ—В –њ–Њ–Љ–љ–Є—В—М, —З—В–Њ —Г–Ї–∞–Ј–∞–љ–љ—Л–µ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –∞–љ–µ–Љ–Є–Є –Љ–Њ–≥—Г—В –±—Л—В—М –Ї–∞–Ї –њ—А–Є –Ц–Ф–Р, —А–∞–Ј–≤–Є–≤—И–µ–є—Б—П –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –Ї—А–Њ–≤–Њ–њ–Њ—В–µ—А–Є (–њ–Њ—Б—В–≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–∞—П –Ц–Ф–Р), —В–∞–Ї –Є –њ—А–Є —В–∞–ї–∞—Б—Б–µ–Љ–Є–Є. –Э–∞–њ–Њ–Љ–љ–Є–Љ, —З—В–Њ —В–∞–ї–∞—Б—Б–µ–Љ–Є–Є вАФ —Н—В–Њ –≥—А—Г–њ–њ–∞ –љ–∞—Б–ї–µ–і—Б—В–≤–µ–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–µ–Љ
—Б–Є–љ—В–µ–Ј–∞ –∞–ї—М—Д–∞- –Є–ї–Є –±–µ—В–∞-—Ж–µ–њ–µ–є –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞, –њ—А–Є –Ї–Њ—В–Њ—А—Л—Е —Г—А–Њ–≤–µ–љ—М –ґ–µ–ї–µ–Ј–∞ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –љ–µ —В–Њ–ї—М–Ї–Њ –љ–µ —Б–љ–Є–ґ–∞–µ—В—Б—П, –љ–Њ –≤ —А—П–і–µ —Б–ї—Г—З–∞–µ–≤ –і–∞–ґ–µ –њ–Њ–≤—Л—И–µ–љ. –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ —В–∞–ї–∞—Б—Б–µ–Љ–Є—П –Є–Љ–µ–µ—В —З–µ—В–Ї—Г—О —Н—В–љ–Є—З–µ—Б–Ї—Г—О —Б–≤—П–Ј—М. –Ґ–∞–Ї, –±–µ—В–∞-—В–∞–ї–∞—Б—Б–µ–Љ–Є—П —З–∞—Й–µ –≤—Б–µ–≥–Њ –≤—Б—В—А–µ—З–∞–µ—В—Б—П —Г –≤—Л—Е–Њ–і—Ж–µ–≤ –Є–Ј –°—А–µ–і–Є–Ј–µ–Љ–љ–Њ–Љ–Њ—А—М—П, –°—А–µ–і–љ–µ–≥–Њ –Т–Њ—Б—В–Њ–Ї–∞ –Є –Ш–љ–і–Є–Є, –∞ –∞–ї—М—Д–∞-—В–∞–ї–∞—Б—Б–µ–Љ–Є—П вАФ —Г –≤—Л—Е–Њ–і—Ж–µ–≤ –Є–Ј –Р—Д—А–Є–Ї–Є –Є –Ѓ–≥–Њ-–Т–Њ—Б—В–Њ—З–љ–Њ–є –Р–Ј–Є–Є. –£—З–Є—В—Л–≤–∞—П —Н—В–Њ, –њ—А–Є –≤—Л—П–≤–ї–µ–љ–Є–Є –≥–Є–њ–Њ—Е—А–Њ–Љ–љ–Њ–є –Љ–Є–Ї—А–Њ—Ж–Є—В–∞—А–љ–Њ–є –∞–љ–µ–Љ–Є–Є —Г —А–µ–±–µ–љ–Ї–∞ —Б —Г–Ї–∞–Ј–∞–љ–љ–Њ–є —Н—В–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–Є–љ–∞–і–ї–µ–ґ–љ–Њ—Б—В—М—О, –њ–Њ–Љ–Є–Љ–Њ –њ–Њ–Є—Б–Ї–∞ —В–Є–њ–Є—З–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е (–ї–µ–≥–Ї–∞—П –Є–Ї—В–µ—А–Є—З–љ–Њ—Б—В—М, –≥–µ–њ–∞—В–Њ—Б–њ–ї–µ–љ–Њ–Љ–µ–≥–∞–ї–Є—П) –Є –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е (–Љ–Є—И–µ–љ–µ–≤–Є–і–љ–Њ—Б—В—М —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤) –њ—А–Њ—П–≤–ї–µ–љ–Є–є —В–∞–ї–∞—Б—Б–µ–Љ–Є–Є, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –і–µ—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞—В—М —Б–µ–Љ–µ–є–љ—Л–є –∞–љ–∞–Љ–љ–µ–Ј, –Њ–±—А–∞—Й–∞—П –Њ—Б–Њ–±–Њ–µ –≤–љ–Є–Љ–∞–љ–Є–µ –љ–∞ —Б–Њ—Б—В–Њ—П–љ–Є–µ –Ј–і–Њ—А–Њ-–≤—М—П –±–ї–Є–ґ–∞–є—И–Є—Е —А–Њ–і—Б—В–≤–µ–љ–љ–Є–Ї–Њ–≤ (—Е—А–Њ–љ–Є—З–µ—Б–Ї–∞—П –∞–љ–µ–Љ–Є—П, –≥–µ–њ–∞—В–Њ—Б–њ–ї–µ–љ–Њ–Љ–µ–≥–∞–ї–Є—П, —Е–Њ–ї–µ–ї–Є—В–Є–∞–Ј —Б –Љ–Њ–ї–Њ–і–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –Є –і—А.) [17вАУ20].
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ—А–Є –≤—Л—П–≤–ї–µ–љ–Є–Є –≥–Є–њ–Њ—Е—А–Њ–Љ–љ–Њ–є –Љ–Є–Ї—А–Њ—Ж–Є—В–∞—А–љ–Њ–є –≥–Є–њ–µ—А—А–µ–≥–µ–љ–µ—А–∞—В–Њ—А–љ–Њ–є –∞–љ–µ–Љ–Є–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ—А–Њ–≤–Њ–і–Є—В—М –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ—Л–є –і–Є–∞–≥–љ–Њ–Ј –Љ–µ–ґ–і—Г –Ц–Ф–Р –њ–Њ—Б—В–≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –≥–µ–љ–µ–Ј–∞ –Є —В–∞–ї–∞—Б—Б–µ–Љ–Є–µ–є (—Б–Љ. —А–Є—Б. 1). –Я–Њ—Б–Ї–Њ–ї—М–Ї—Г –њ—А–Є —В–∞–ї–∞—Б—Б–µ–Љ–Є–Є, –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –Ц–Ф–Р, —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –ґ–µ–ї–µ–Ј–∞ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –љ–µ —Б–љ–Є–ґ–∞–µ—В—Б—П, —В–Њ –і–ї—П —Г—В–Њ—З–љ–µ–љ–Є—П –≥–µ–љ–µ–Ј–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –≤ —Н—В–Њ–Љ —Б–ї—Г—З–∞–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В—М —Д–µ—А—А–Њ—Б—В–∞—В—Г—Б —А–µ–±–µ–љ–Ї–∞. –Ф–ї—П —Н—В–Њ–≥–Њ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –Њ–њ—А–µ–і–µ–ї—П—О—В —Г—А–Њ–≤–µ–љ—М –ґ–µ–ї–µ–Ј–∞ (–°–Ц), —Д–µ—А—А–Є—В–Є–љ–∞ (–§–°), –Њ–±—Й–µ–є –ґ–µ–ї–µ–Ј–Њ—Б–≤—П–Ј—Л–≤–∞—О—Й–µ–є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є (–Ю–Ц–°–°), –∞ —В–∞–Ї–ґ–µ –≤—Л—З–Є—Б–ї—П—О—В –Ї–Њ—Н—Д—Д–Є—Ж–Є–µ–љ—В –љ–∞—Б—Л—Й–µ–љ–Є—П —В—А–∞–љ—Б—Д–µ—А—А–Є–љ–∞ –ґ–µ–ї–µ–Ј–Њ–Љ (–Ъ–Э–Ґ–Ц). –Ю–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ —Б –§–° —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В—М –°–†–С, —В. –Ї. —Д–µ—А—А–Є—В–Є–љ –Њ—В–љ–Њ—Б–Є—В—Б—П –Ї –±–µ–ї–Ї–∞–Љ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –Є –µ–≥–Њ –Ј–љ–∞—З–µ–љ–Є–µ –Љ–Њ–ґ–µ—В –Є–Љ–µ—В—М –ї–Њ–ґ–љ–Њ–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–є —Г—А–Њ–≤–µ–љ—М –њ—А–Є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–Љ –њ—А–Њ—Ж–µ—Б—Б–µ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ.
–Х—Б–ї–Є –њ—А–Є –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —А–µ–±–µ–љ–Ї–∞ —Б –≥–Є–њ–Њ—Е—А–Њ–Љ–љ–Њ–є –Љ–Є–Ї—А–Њ—Ж–Є—В–∞—А–љ–Њ–є –≥–Є–њ–µ—А—А–µ–≥–µ–љ–µ—А–∞—В–Њ—А–љ–Њ–є –∞–љ–µ–Љ–Є–µ–є –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–µ—В—Б—П –љ–Њ—А–Љ–∞–ї—М–љ—Л–є –Є–ї–Є –њ–Њ–≤—Л—И–µ–љ–љ—Л–є —Г—А–Њ–≤–µ–љ—М –Ц–°, –§–° (–њ—А–Є –љ–Њ—А–Љ–∞–ї—М–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є—П—Е –°–†–С) –Є –Ъ–Э–Ґ–Ц, —В–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В—М –љ–∞–ї–Є—З–Є–µ —В–∞–ї–∞—Б—Б–µ–Љ–Є–Є. –Ф–ї—П —Н—В–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞ –љ–∞–њ—А–∞–≤–ї—П—О—В –љ–∞ –Ї–Њ–љ—Б—Г–ї—М—В–∞—Ж–Є—О –Ї –≥–µ–Љ–∞—В–Њ–ї–Њ–≥—Г, –Ї–Њ—В–Њ—А—Л–є –њ—А–Њ–≤–Њ–і–Є—В –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Њ—Б–Љ–Њ—В–Є—З–µ—Б–Ї–Њ–є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤, —Н–ї–µ–Ї—В—А–Њ—Д–Њ—А–µ–Ј –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞, –∞ –њ—А–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ. –Х—Б–ї–Є –≥–Є–њ–Њ—Е—А–Њ–Љ–љ–∞—П –Љ–Є–Ї—А–Њ—Ж–Є—В–∞—А–љ–∞—П –≥–Є–њ–µ—А—А–µ–≥–µ–љ–µ—А–∞—В–Њ—А–љ–∞—П –∞–љ–µ–Љ–Є—П —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –°–Ц (<14 –Љ–Ї–Љ–Њ–ї—М/–ї), –§–° (<12 –Љ–Ї–≥/–ї), –Ъ–Э–Ґ–Ц (<17%) –Є –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ—Л–Љ –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ –Ю–Ц–°–° (>63 –Љ–Ї–Љ–Њ–ї—М/–ї), —В–Њ –Є–Љ–µ–µ—В –Љ–µ—Б—В–Њ –Ц–Ф–Р –њ–Њ—Б—В–≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –≥–µ–љ–µ–Ј–∞ (—Б–Љ. —А–Є—Б. 1).
–Ф–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –ї–∞—В–µ–љ—В–љ—Л—Е –Ц–Ф–°
–Ы–∞–±–Њ—А–∞—В–Њ—А–љ—Л–µ –Ї—А–Є—В–µ—А–Є–Є —Б–љ–Є–ґ–µ–љ–Є—П —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –ґ–µ–ї–µ–Ј–∞ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ (–°–Ц<14 –Љ–Ї–Љ–Њ–ї—М/–ї, –§–°<12 –Љ–Ї–≥/–ї, –Ъ–Э–Ґ–Ц<17%, –Ю–Ц–°–°>63 –Љ–Ї–Љ–Њ–ї—М/–ї) –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –љ–µ —В–Њ–ї—М–Ї–Њ –і–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Ц–Ф–Р, –љ–Њ –Є –і–ї—П –≤–µ—А–Є—Д–Є–Ї–∞—Ж–Є–Є –Ы–Ц–Ф–° (—В–∞–±–ї. 1). –°–ї–µ–і—Г–µ—В –љ–∞–њ–Њ–Љ–љ–Є—В—М, —З—В–Њ –Ы–Ц–Ф–° вАФ —Н—В–Њ –љ–∞—З–∞–ї—М–љ–∞—П —Б—В–∞–і–Є—П –і–µ—Д–Є—Ж–Є—В–∞, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–є –Є—Б—В–Њ—Й–∞—О—В—Б—П —В–Ї–∞–љ–µ–≤—Л–µ –Ј–∞–њ–∞—Б—Л –ґ–µ–ї–µ–Ј–∞ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ, –љ–Њ –µ—Й–µ –Њ—В—Б—Г—В—Б—В–≤—Г—О—В –≥–ї—Г–±–Њ–Ї–Є–µ –љ–∞—А—Г—И–µ–љ–Є—П —Н—А–Є—В—А–Њ–њ–Њ—Н–Ј–∞, —З—В–Њ –Є –Њ–±—К—П—Б–љ—П–µ—В –Њ—В—Б—Г—В—Б—В–≤–Є–µ –∞–љ–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ —Н—В–Њ–≥–Њ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –њ—А–Є –Ы–Ц–Ф–° —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—В—Б—П —В–Њ–ї—М–Ї–Њ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П–Љ–Є —Д–µ—А—А–Њ—Б—В–∞—В—Г—Б–∞, —В–Є–њ–Є—З–љ—Л–Љ–Є –і–ї—П –ґ–µ–ї–µ–Ј–Њ–і–µ—Д–Є—Ж–Є—В–∞, –Є –љ–µ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—В—Б—П –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є –∞–љ–µ–Љ–Є–Є. –Я–Њ—Б–Ї–Њ–ї—М–Ї—Г –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Є–Ј–љ–∞–Ї–Є –Ы–Ц–Ф–° –љ–µ—Б–њ–µ—Ж–Є—Д–Є—З–љ—Л, –∞ –∞–љ–µ–Љ–Є—З–µ—Б–Ї–Є–є —Б–Є–љ–і—А–Њ–Љ –љ–∞ —А–∞–љ–љ–Є—Е —Б—В–∞–і–Є—П—Е –ґ–µ–ї–µ–Ј–Њ–і–µ—Д–Є—Ж–Є—В–∞ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В, —В–Њ –≤ –њ–Њ–і–∞–≤–ї—П—О—Й–µ–Љ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ –Ы–Ц–Ф–° –љ–µ –і–Є–∞–≥–љ–Њ—Б—В–Є—А—Г–µ—В—Б—П. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ –Є—Б—В–Є–љ–љ–∞—П —З–∞—Б—В–Њ—В–∞ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В–Є –Ы–Ц–Ф–° –≤ –і–µ—В—Б–Ї–Њ–є –њ–Њ–њ—Г–ї—П—Ж–Є–Є (–≤ —В. —З. –≤ –†–Њ—Б—Б–Є–Є) –Њ—Б—В–∞–µ—В—Б—П –љ–µ—Г—В–Њ—З–љ–µ–љ–љ–Њ–є. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е –њ–Є–ї–Њ—В–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ —В–Њ–Љ, —З—В–Њ –≤ —Ж–µ–ї–µ–≤—Л—Е –≥—А—Г–њ–њ–∞—Е –Є/–Є–ї–Є –≤ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л—Е —А–µ–≥–Є–Њ–љ–∞—Е –љ–∞—И–µ–є —Б—В—А–∞–љ—Л —З–∞—Б—В–Њ—В–∞ –Ы–Ц–Ф–° –Љ–Њ–ґ–µ—В –і–Њ—Б—В–Є–≥–∞—В—М 40% [5вАУ7, 20вАУ24]. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ –∞–Ї—В—Г–∞–ї—М–љ–Њ—Б—В—М –њ—А–Њ–≤–µ–і–µ–љ–Є—П —Б–Ї—А–Є–љ–Є–љ–≥–∞ –і–ї—П —Б–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ–Њ–≥–Њ –≤—Л—П–≤–ї–µ–љ–Є—П –Ы–Ц–Ф–° –љ–µ –≤—Л–Ј—Л–≤–∞–µ—В —Б–Њ–Љ–љ–µ–љ–Є–є. –Ю–і–љ–∞–Ї–Њ –њ–Њ–љ—П—В–љ–Њ, —З—В–Њ –≤ —Г—Б–ї–Њ–≤–Є—П—Е —А—Г—В–Є–љ–љ–Њ–є –њ–µ–і–Є–∞—В—А–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–Є —Б–Ї—А–Є–љ–Є–љ–≥ –Ц–Ф–°, –Њ—Б–љ–Њ–≤–∞–љ–љ—Л–є –љ–∞ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–Є –≤ –≤–µ–љ–Њ–Ј–љ–Њ–є –Ї—А–Њ–≤–Є —Д–µ—А—А–Њ—Б—В–∞—В—Г—Б–∞, –≤ –њ–Њ–і–∞–≤–ї—П—О—Й–µ–Љ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ –љ–µ –Љ–Њ–ґ–µ—В –±—Л—В—М —А–µ–∞–ї–Є–Ј–Њ–≤–∞–љ. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –∞–Ї—В–Є–≤–љ–Њ –Є–Ј—Г—З–∞—О—В—Б—П –∞–ї—М—В–µ—А–љ–∞—В–Є–≤–љ—Л–µ —Б–њ–Њ—Б–Њ–±—Л —А–∞–љ–љ–µ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Ы–Ц–Ф–°, –Њ—Б–љ–Њ–≤–∞–љ–љ—Л–µ –љ–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –љ–Њ–≤—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ –Ї—А–Њ–≤–Є [6, 16, 23, 24].![–Ґ–∞–±–ї–Є—Ж–∞ 1. –Ы–∞–±–Њ—А–∞—В–Њ—А–љ—Л–µ –Ї—А–Є—В–µ—А–Є–Є –Ц–Ф–° —Г –і–µ—В–µ–є [6] –Ґ–∞–±–ї–Є—Ж–∞ 1. –Ы–∞–±–Њ—А–∞—В–Њ—А–љ—Л–µ –Ї—А–Є—В–µ—А–Є–Є –Ц–Ф–° —Г –і–µ—В–µ–є [6]](/upload/medialibrary/5ee/2-2.png)
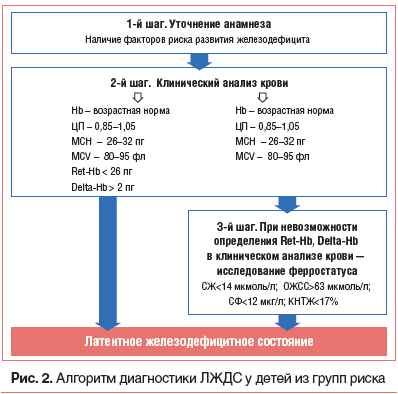
–Я–Њ—П–≤–ї–µ–љ–Є–µ –≤ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–Љ –Ј–і—А–∞–≤–Њ–Њ—Е—А–∞–љ–µ–љ–Є–Є –≥–µ–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –∞–љ–∞–ї–Є–Ј–∞—В–Њ—А–Њ–≤ –њ–Њ—Б–ї–µ–і–љ–µ–≥–Њ –њ–Њ–Ї–Њ–ї–µ–љ–Є—П –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ—А–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ –Ї—А–Њ–≤–Є –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –Њ–њ—А–µ–і–µ–ї–Є—В—М —Б—В–µ–њ–µ–љ—М –љ–∞—Б—Л—Й–µ–љ–Є—П —А–µ—В–Є–Ї—Г–ї–Њ—Ж–Є—В–Њ–≤ –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–Њ–Љ (–њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М Ret-Hb) –Є —А–∞–Ј–љ–Є—Ж—Г –Љ–µ–ґ–і—Г —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –≤ –Ј—А–µ–ї—Л—Е —Н—А–Є—В—А–Њ—Ж–Є—В–∞—Е –Є –≤ —А–µ—В–Є–Ї—Г–ї–Њ—Ж–Є—В–∞—Е (–њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М Delta-Hb) [25]. –Я—А–Є —Н—В–Њ–Љ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ —Б –њ–Њ–Љ–Њ—Й—М—О –Ї–Њ—А—А–µ–Ї—В–љ–Њ–є –Њ—Ж–µ–љ–Ї–Є —Г–Ї–∞–Ј–∞–љ–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Љ–Њ–ґ–љ–Њ –≤—Л—П–≤–Є—В—М –љ–∞—З–∞–ї—М–љ—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П —Б–Є–љ—В–µ–Ј–∞ –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –њ—А–Є –Ы–Ц–Ф–°. –Ґ–∞–Ї, –µ—Б–ї–Є —Г –і–µ—В–µ–є –Є–Ј –≥—А—Г–њ–њ —А–Є—Б–Ї–∞ –њ–Њ —А–∞–Ј–≤–Є—В–Є—О –ґ–µ–ї–µ–Ј–Њ–і–µ—Д–Є—Ж–Є—В–∞ –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В –∞–љ–µ–Љ–Є—П (–Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П Hb –≤ –њ—А–µ–і–µ–ї–∞—Е –љ–Њ—А–Љ—Л), –∞ —Н—А–Є—В—А–Њ—Ж–Є—В—Л —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—В—Б—П –љ–Њ—А–Љ–Њ—Е—А–Њ–Љ–Є–µ–є (MCH=26вАУ32 –њ–≥) –Є –љ–Њ—А–Љ–Њ—Ж–Є—В–Њ–Ј–Њ–Љ (MCV=80вАУ95 —Д–ї), —В–Њ –Њ—Б–Њ–±–Њ–µ –≤–љ–Є–Љ–∞–љ–Є–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Г–і–µ–ї–Є—В—М –Њ—Ж–µ–љ–Ї–µ —В–∞–Ї–Є—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є, –Ї–∞–Ї Ret-Hb –Є Delta-Hb. –Я—А–Є —Н—В–Њ–Љ –≤—Л—П–≤–ї–µ–љ–Є–µ —Б–љ–Є–ґ–µ–љ–Є—П —Б—А–µ–і–љ–µ–≥–Њ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –≤ —А–µ—В–Є–Ї—Г–ї–Њ—Ж–Є—В–∞—Е (Ret-Hb <26 –њ–≥) –Є —Г–≤–µ–ї–Є—З–µ–љ–Є—П —А–∞–Ј–ї–Є—З–Є–є –≤ –љ–∞—Б—Л—Й–µ–љ–Є–Є –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–Њ–Љ —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ –Є —А–µ—В–Є–Ї—Г–ї–Њ—Ж–Є—В–Њ–≤ (Delta-Hb >2 –њ–≥) –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Б–і–µ–ї–∞—В—М –≤—Л–≤–Њ–і –Њ —В–Њ–Љ, —З—В–Њ —Г —А–µ–±–µ–љ–Ї–∞ –Є–Љ–µ–µ—В –Љ–µ—Б—В–Њ –Ј–љ–∞—З–Є–Љ–Њ–µ –Ы–Ц–Ф–° —Б –љ–∞—З–∞–ї—М–љ—Л–Љ–Є –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є –љ–∞—А—Г—И–µ–љ–Є–є —Н—А–Є—В—А–Њ–њ–Њ—Н–Ј–∞. –Ф–∞–љ–љ–Њ–µ –Ј–∞–Ї–ї—О—З–µ–љ–Є–µ –Њ—Б–љ–Њ–≤–∞–љ–Њ –љ–∞ —В–Њ–Љ, —З—В–Њ —А–µ—В–Є–Ї—Г–ї–Њ—Ж–Є—В—Л –љ–µ—Б—Г—В ¬Ђ—Б–∞–Љ—Г—О —Б–≤–µ–ґ—Г—О¬ї –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—О –Њ —Б–Њ—Б—В–Њ—П–љ–Є–Є —Н—А–Є—В—А–Њ–њ–Њ—Н–Ј–∞, —В. –Ї. –Њ–љ–Є –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞—О—В—Б—П –≤ –Ї—А–Њ–≤–Њ—В–Њ–Ї–µ —В–Њ–ї—М–Ї–Њ –≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤—Л—Е —Б—Г—В–Њ–Ї –њ–Њ—Б–ї–µ –≤—Л—Е–Њ–і–∞ –Є–Ј –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, —Б—А–µ–і–љ—П—П –ґ–µ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –ґ–Є–Ј–љ–Є —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 120 –і–љ–µ–є. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≤—Л—П–≤–ї–µ–љ–Є–µ –љ–Є–Ј–Ї–Є—Е –Ј–љ–∞—З–µ–љ–Є–є –љ–∞—Б—Л—Й–µ–љ–Є—П —А–µ—В–Є–Ї—Г–ї–Њ—Ж–Є—В–Њ–≤ –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–Њ–Љ (Ret-Hb <26 –њ–≥) –Є —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Г—А–Њ–≤–љ—П Delta-Hb, –њ—А–Є –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–Љ –Њ—В—Б—Г—В—Б—В–≤–Є–Є –∞–љ–µ–Љ–Є–Є, –≥–Є–њ–Њ—Е—А–Њ–Љ–Є–Є –Є –Љ–Є–Ї—А–Њ—Ж–Є—В–Њ–Ј–∞ —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤, —П–≤–ї—П–µ—В—Б—П –Љ–∞—А–Ї–µ—А–Њ–Љ –Ы–Ц–Ф–° (—А–Є—Б. 2). –Т –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є —Б–ї–Њ–ґ–љ—Л—Е —Б–ї—Г—З–∞—П—Е –і–ї—П –≤–µ—А–Є—Д–Є–Ї–∞—Ж–Є–Є –Ц–Ф–° –Љ–Њ–≥—Г—В –±—Л—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ—Л —В–∞–Ї–Є–µ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є, –Ї–∞–Ї —Ж–Є–љ–Ї-–њ—А–Њ—В–Њ–њ–Њ—А—Д–Є—А–Є–љ –Є —А–∞—Б—В–≤–Њ—А–Є–Љ—Л–µ —В—А–∞–љ—Б—Д–µ—А—А–Є–љ–Њ–≤—Л–µ —А–µ—Ж–µ–њ—В–Њ—А—Л, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–Є–µ—Б—П –≤—Л—Б–Њ–Ї–Њ–є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М—О –Є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М—О, –Њ–і–љ–∞–Ї–Њ –Є—Е –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ –Љ–∞–ї–Њ–і–Њ—Б—В—Г–њ–љ–Њ –і–ї—П —И–Є—А–Њ–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–Є [26, 27].
–Ґ–µ—А–∞–њ–Є—П –Ц–Ф–°
–Т –Њ—Б–љ–Њ–≤–µ —В–µ—А–∞–њ–Є–Є –Ц–Ф–°, –Ї–∞–Ї –ї–∞—В–µ–љ—В–љ—Л—Е, —В–∞–Ї –Є –Љ–∞–љ–Є—Д–µ—Б—В–љ—Л—Е, –ї–µ–ґ–Є—В —А–∞—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –ґ–µ–ї–µ–Ј–∞. –Т –њ–Њ–і–∞–≤–ї—П—О—Й–µ–Љ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ –і–ї—П –ї–µ—З–µ–љ–Є—П –Ц–Ф–° –Є—Б–њ–Њ–ї—М–Ј—Г—О—В –њ–µ—А–Њ—А–∞–ї—М–љ—Л–µ —Д–Њ—А–Љ—Л –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –ґ–µ–ї–µ–Ј–∞. –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –≤ —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–Љ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–Љ –∞—А—Б–µ–љ–∞–ї–µ –≤—А–∞—З–∞-–њ–µ–і–Є–∞—В—А–∞ –Є–Љ–µ—О—В—Б—П —А–∞–Ј–ї–Є—З–љ—Л–µ –њ–Њ —Б–Њ—Б—В–∞–≤—Г (—Б–Њ–ї–µ–≤—Л–µ, –≥–Є–і—А–Њ–Ї—Б–Є–і –њ–Њ–ї–Є–Љ–∞–ї—М—В–Њ–Ј–љ—Л–µ –Ї–Њ–Љ–њ–ї–µ–Ї—Б—Л) –Є —Д–Њ—А–Љ–µ –≤—Л–њ—Г—Б–Ї–∞ (—В–∞–±–ї–µ—В–Ї–Є, –Ї–∞–њ—Б—Г–ї—Л, —Б–Є—А–Њ–њ—Л, –Ї–∞–њ–ї–Є) –њ—А–µ–њ–∞—А–∞—В—Л –ґ–µ–ї–µ–Ј–∞. –†–∞—Б—З–µ—В –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л—Е –і–Њ–Ј –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ—А–Є —Н—В–Њ–Љ, –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В —Д–Њ—А–Љ—Л –≤—Л–њ—Г—Б–Ї–∞, –і–Њ–ї–ґ–µ–љ –њ—А–Њ–≤–Њ–і–Є—В—М—Б—П —Б —Г—З–µ—В–Њ–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П —Н–ї–µ–Љ–µ–љ—В–∞—А–љ–Њ–≥–Њ –ґ–µ–ї–µ–Ј–∞ –≤ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–Љ —Б—А–µ–і—Б—В–≤–µ. –Ґ–∞–Ї, –µ—Б–ї–Є –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –њ—А–µ–њ–∞—А–∞—В—Л –ґ–µ–ї–µ–Ј–∞ –≤ –≤–Є–і–µ –≥–Є–і—А–Њ–Ї—Б–Є–і –њ–Њ–ї–Є–Љ–∞–ї—М—В–Њ–Ј–љ–Њ–≥–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞, —В–Њ —Б—Г—В–Њ—З–љ–∞—П –і–Њ–Ј–∞ —Н–ї–µ–Љ–µ–љ—В–∞—А–љ–Њ–≥–Њ –ґ–µ–ї–µ–Ј–∞ –і–Њ–ї–ґ–љ–∞ —Б–Њ—Б—В–∞–≤–ї—П—В—М 5 –Љ–≥/–Ї–≥ –≤ —Б—Г—В–Ї–Є. –Т —В–µ—Е —Б–ї—Г—З–∞—П—Е, –Ї–Њ–≥–і–∞ –њ—А–Є–Љ–µ–љ—П—О—В —Б–Њ–ї–µ–≤—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –ґ–µ–ї–µ–Ј–∞, —А–µ–Ї–Њ–Љ–µ–љ–і—Г—О—В—Б—П —Б–ї–µ–і—Г—О—Й–Є–µ —Б—Г—В–Њ—З–љ—Л–µ –і–Њ–Ј—Л —Н–ї–µ–Љ–µ–љ—В–∞—А–љ–Њ–≥–Њ –ґ–µ–ї–µ–Ј–∞: –і–µ—В—П–Љ –≤ –≤–Њ–Ј—А–∞—Б—В–µ –і–Њ 3-—Е –ї–µ—В вАФ 3 –Љ–≥/–Ї–≥ –≤ —Б—Г—В–Ї–Є; –і–µ—В—П–Љ —Б—В–∞—А—И–µ 3-—Е –ї–µ—В вАФ 45вАУ60 –Љ–≥/—Б—Г—В; –њ–Њ–і—А–Њ—Б—В–Ї–∞–Љ вАФ –і–Њ 120 –Љ–≥/—Б—Г—В. –Я—А–Є —Н—В–Њ–Љ —Г –і–µ—В–µ–є –љ–∞—З–Є–љ–∞—П —Б 6 –ї–µ—В –Є —Г –њ–Њ–і—А–Њ—Б—В–Ї–Њ–≤ –і–ї—П –ї–µ—З–µ–љ–Є—П –Ы–Ц–Ф–° –Є –Ц–Ф–Р –Љ–Њ–ґ–µ—В —Б —Г—Б–њ–µ—Е–Њ–Љ –њ—А–Є–Љ–µ–љ—П—В—М—Б—П –Њ–±–љ–Њ–≤–ї–µ–љ–љ–∞—П —Д–Њ—А–Љ—Г–ї–∞ —Е–Њ—А–Њ—И–Њ –Є–Ј–≤–µ—Б—В–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –Ґ–∞—А–і–Є—Д–µ—А–Њ–љ [28].–Ґ–∞—А–і–Є—Д–µ—А–Њ–љ —П–≤–ї—П–µ—В—Б—П –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ, –≤ –Ї–Њ—В–Њ—А–Њ–Љ –ґ–µ–ї–µ–Ј–Њ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Њ –≤ –≤–Є–і–µ —Б—Г–ї—М—Д–∞—В–∞ –і–≤—Г—Е–≤–∞–ї–µ–љ—В–љ–Њ–≥–Њ –ґ–µ–ї–µ–Ј–∞ [28]. –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є –Њ–±–љ–Њ–≤–ї–µ–љ–љ–Њ–є —Д–Њ—А–Љ—Г–ї—Л –њ—А–µ–њ–∞—А–∞—В–∞ –Ґ–∞—А–і–Є—Д–µ—А–Њ–љ [29, 30] —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є–Є –ґ–µ–ї–µ–Ј–∞ –≤ –ґ–µ–ї—Г–і–Њ—З–љ–Њ-–Ї–Є—И–µ—З–љ–Њ–Љ —В—А–∞–Ї—В–µ. –Я—А–Є —Н—В–Њ–Љ –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ–µ –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є–µ –ґ–µ–ї–µ–Ј–∞ –Є–Ј –њ—А–µ–њ–∞—А–∞—В–∞ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –µ–≥–Њ –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–є –∞–±—Б–Њ—А–±—Ж–Є–Є –Є —Е–Њ—А–Њ—И–µ–є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є [29, 30]. –Я–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є–µ —Е–Њ—А–Њ—И–µ–є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В–∞ –Ґ–∞—А–і–Є—Д–µ—А–Њ–љ, –∞ —В–∞–Ї–ґ–µ –µ–≥–Њ –≤—Л—Б–Њ–Ї–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ-—Н–Ї–Њ–љ–Њ–Љ–Є—З–µ—Б–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ–Њ–ї—Г—З–µ–љ–Њ –Є –≤ —Б–µ—А–Є–Є –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є [31, 32]. –Т 1 —В–∞–±–ї–µ—В–Ї–µ –њ—А–µ–њ–∞—А–∞—В–∞ –Ґ–∞—А–і–Є—Д–µ—А–Њ–љ —Б–Њ–і–µ—А–ґ–Є—В—Б—П 80 –Љ–≥ —Н–ї–µ–Љ–µ–љ—В–∞—А–љ–Њ–≥–Њ –ґ–µ–ї–µ–Ј–∞, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞—В—М —Б–ї–µ–і—Г—О—Й–Є–є —А–µ–ґ–Є–Љ –і–Њ–Ј–Є—А–Њ–≤–∞–љ–Є—П: –і–µ—В—П–Љ 6вАУ10 –ї–µ—В вАФ 1 —В–∞–±–ї–µ—В–Ї–∞ –≤ —Б—Г—В–Ї–Є; –і–µ—В—П–Љ —Б—В–∞—А—И–µ 10 –ї–µ—В –Є –њ–Њ–і—А–Њ—Б—В–Ї–∞–Љ вАФ 1вАУ2 —В–∞–±–ї–µ—В–Ї–Є –≤ —Б—Г—В–Ї–Є [28]. –Я—А–µ–њ–∞—А–∞—В –Ґ–∞—А–і–Є—Д–µ—А–Њ–љ –њ—А–Є–љ–Є–Љ–∞—О—В –њ–µ—А–µ–і –µ–і–Њ–є (–љ–µ —А–∞–Ј–ґ–µ–≤—Л–≤–∞—П), –Ј–∞–њ–Є–≤–∞—П –≤–Њ–і–Њ–є, –Є–ї–Є –≤–Њ –≤—А–µ–Љ—П –њ—А–Є–µ–Љ–∞ –њ–Є—Й–Є. –°–ї–µ–і—Г–µ—В –њ–Њ–Љ–љ–Є—В—М, —З—В–Њ –њ—А–µ–њ–∞—А–∞—В –Ґ–∞—А–і–Є—Д–µ—А–Њ–љ –љ–µ —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –њ—А–Є–Љ–µ–љ—П—В—М –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ —Б –∞–љ—В–∞—Ж–Є–і–∞–Љ–Є –Є —В–µ—В—А–∞—Ж–Є–Ї–ї–Є–љ–∞–Љ–Є. –Ъ—А–Њ–Љ–µ —Н—В–Њ–≥–Њ, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Г—З–Є—В—Л–≤–∞—В—М, —З—В–Њ –≤—Б–∞—Б—Л–≤–∞–љ–Є–µ –≤ –Ї–Є—И–µ—З–љ–Є–Ї–µ –ґ–µ–ї–µ–Ј–∞ —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П –њ—А–Є –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–Љ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –њ—А–Њ–і—Г–Ї—В–Њ–≤, —Б–Њ–і–µ—А–ґ–∞—Й–Є—Е –њ–Њ–ї–Є—Д–µ–љ–Њ–ї—Л (–±–Њ–±—Л, –Њ—А–µ—Е–Є, —З–∞–є, –Ї–Њ—Д–µ), —Д–Є—В–∞—В—Л (–Ј–µ—А–љ–Њ–≤—Л–µ, –±–Њ–±–Њ–≤—Л–µ, –Њ–≤–Њ—Й–Є, –Њ—А–µ—Е–Є) –Є –±–Њ–ї—М—И–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –њ–Є—Й–µ–≤—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ.
–Я—А–Є –њ—А–∞–≤–Є–ї—М–љ–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ–Њ–Љ –і–Є–∞–≥–љ–Њ–Ј–µ –Ц–Ф–Р, –∞–і–µ–Ї–≤–∞—В–љ–Њ–Љ –≤—Л–±–Њ—А–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –ґ–µ–ї–µ–Ј–∞ –Є –Ї–Њ—А—А–µ–Ї—В–љ–Њ –њ–Њ–і–Њ–±—А–∞–љ–љ–Њ–є –і–Њ–Ј–µ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–Љ –∞–љ–∞–ї–Є–Ј–µ –Ї—А–Њ–≤–Є –љ–∞ 10вАУ14-–є –і–µ–љ—М
—В–µ—А–∞–њ–Є–Є –Њ—В–Љ–µ—З–∞–µ—В—Б—П —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —А–µ—В–Є–Ї—Г–ї–Њ—Ж–Є—В–Њ–≤, –∞ –Ї –Ї–Њ–љ—Ж—Г 3вАУ4-–є –љ–µ–і–µ–ї–Є –ї–µ—З–µ–љ–Є—П вАФ –њ—А–Є—А–Њ—Б—В –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –љ–∞ 10 –≥/–ї. –Э–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є—П —Г—А–Њ–≤–љ—П –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –і–Њ—Б—В–Є–≥–∞–µ—В—Б—П —З–µ—А–µ–Ј
4вАУ8 –љ–µ–і. –Њ—В –љ–∞—З–∞–ї–∞ —В–µ—А–∞–њ–Є–Є. –Т —В–µ—Е —Б–ї—Г—З–∞—П—Е, –Ї–Њ–≥–і–∞ –љ–∞ —Д–Њ–љ–µ –∞–і–µ–Ї–≤–∞—В–љ–Њ –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–є —В–µ—А–∞–њ–Є–Є –≤ –і–µ–Ї—А–µ—В–Є—А—Г–µ–Љ—Л–µ —Б—А–Њ–Ї–Є –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–Љ –∞–љ–∞–ї–Є–Ј–µ –Ї—А–Њ–≤–Є –Њ—В—Б—Г—В—Б—В–≤—Г—О—В –Њ–ґ–Є–і–∞–µ–Љ—Л–µ –њ–Њ–Ј–Є—В–Є–≤–љ—Л–µ —Б–і–≤–Є–≥–Є, —Б–ї–µ–і—Г–µ—В —Г—Б–Њ–Љ–љ–Є—В—М—Б—П –≤ –њ—А–∞–≤–Є–ї—М–љ–Њ—Б—В–Є –і–Є–∞–≥–љ–Њ–Ј–∞. –£—З–Є—В—Л–≤–∞—П, —З—В–Њ –≥–Є–њ–Њ—Е—А–Њ–Љ–Є—П —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ —Е–∞—А–∞–Ї—В–µ—А–љ–∞ –љ–µ —В–Њ–ї—М–Ї–Њ –і–ї—П –Ц–Ф–Р, –љ–Њ –Є –і–ї—П —Б–Є–і–µ—А–Њ–±–ї–∞—Б—В–Њ–Ј–∞ –Є —В–∞–ї–∞—Б—Б–µ–Љ–Є–Є, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ—В–Љ–µ–љ–Є—В—М –њ—А–µ–њ–∞—А–∞—В—Л –ґ–µ–ї–µ–Ј–∞ –Є –≤–µ—А–љ—Г—В—М—Б—П –Ї –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–Љ—Г –њ–Њ–Є—Б–Ї—Г –њ—А–Є—З–Є–љ –∞–љ–µ–Љ–Є–Є.
–°—З–Є—В–∞–µ–Љ –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–Љ –Њ–±—А–∞—В–Є—В—М –≤–љ–Є–Љ–∞–љ–Є–µ –µ—Й–µ –љ–∞ –Њ–і–Є–љ –Њ—З–µ–љ—М –≤–∞–ґ–љ—Л–є –∞—Б–њ–µ–Ї—В вАФ —Б—В—А–Њ–≥–Њ–µ —Б–Њ–±–ї—О–і–µ–љ–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–љ–Њ–є –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –ґ–µ–ї–µ–Ј–∞ –њ—А–Є –ї–µ—З–µ–љ–Є–Є –Ц–Ф–°. –Ъ —Б–Њ–ґ–∞–ї–µ–љ–Є—О, –љ–∞ –њ—А–∞–Ї—В–Є–Ї–µ —Н—В–Є —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –љ–µ –≤—Б–µ–≥–і–∞ —Б—В—А–Њ–≥–Њ —Б–Њ–±–ї—О–і–∞—О—В—Б—П. –Э–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є—П —Г—А–Њ–≤–љ—П –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞, –Ї–Њ—В–Њ—А–∞—П, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –Њ—В–Љ–µ—З–∞–µ—В—Б—П –≤ —В–µ—З–µ–љ–Є–µ 1вАУ2 –Љ–µ—Б. –Њ—В –љ–∞—З–∞–ї–∞ –ї–µ—З–µ–љ–Є—П, –љ–µ –і–Њ–ї–ґ–љ–∞ –±—Л—В—М –њ–Њ–≤–Њ–і–Њ–Љ –і–ї—П –Њ—В–Љ–µ–љ—Л –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –ґ–µ–ї–µ–Ј–∞. –≠—В–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ —В–µ–Љ, —З—В–Њ –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є–µ –∞–љ–µ–Љ–Є–Є —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В —В–Њ–ї—М–Ї–Њ –Њ –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–Є —Н—А–Є—В—А–Њ–њ–Њ—Н–Ј–∞, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –і–µ—Д–Є—Ж–Є—В –ґ–µ–ї–µ–Ј–∞ –≤ —В–Ї–∞–љ–µ–≤—Л—Е –і–µ–њ–Њ –≤—Б–µ –µ—Й–µ —Б–Њ—Е—А–∞–љ—П–µ—В—Б—П. –Ш–љ—Л–Љ–Є —Б–ї–Њ–≤–∞–Љ–Є, –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є–µ –Ц–Ф–Р вАФ —Н—В–Њ —Г—Б—В—А–∞–љ–µ–љ–Є–µ —В–Њ–ї—М–Ї–Њ –≤–µ—А—Е—Г—И–Ї–Є –∞–є—Б–±–µ—А–≥–∞, —В–Њ–≥–і–∞ –Ї–∞–Ї –µ–≥–Њ –Њ—Б–љ–Њ–≤–љ–∞—П —З–∞—Б—В—М (–Ы–Ц–Ф–°) —Б–Ї—А—Л—В–∞ –њ–Њ–і –≤–Њ–і–Њ–є. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —З–µ—В–Ї–Њ –њ—А–Є–і–µ—А–ґ–Є–≤–∞—В—М—Б—П —Б–ї–µ–і—Г—О—Й–µ–≥–Њ –њ—А–∞–≤–Є–ї–∞: –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –ґ–µ–ї–µ–Ј–∞ –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М—О –Ц–Ф–° –Є —Б—В–µ–њ–µ–љ—М—О —В—П–ґ–µ—Б—В–Є –∞–љ–µ–Љ–Є–Є. –Ґ–∞–Ї, –њ—А–Є –ї–µ–≥–Ї–Њ–є —Б—В–µ–њ–µ–љ–Є –Ц–Ф–Р –Ї—Г—А—Б –ї–µ—З–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –ґ–µ–ї–µ–Ј–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 3 –Љ–µ—Б., –њ—А–Є —Б—А–µ–і–љ–µ—В—П–ґ–µ–ї–Њ–є вАФ 4,5 –Љ–µ—Б., –њ—А–Є —В—П–ґ–µ–ї–Њ–є —Б—В–µ–њ–µ–љ–Є вАФ –і–Њ 6 –Љ–µ—Б. [6].











