–Ф–Њ–ї–≥–Є–µ –≥–Њ–і—Л –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤ –≤ –љ–µ–Њ–љ–∞—В–∞–ї—М–љ—Л–є –њ–µ—А–Є–Њ–і —Б–≤—П–Ј—Л–≤–∞–ї–Є —Б –і–µ—Д–Є—Ж–Є—В–Њ–Љ –≤–Є—В–∞–Љ–Є–љ –Ъ-–Ј–∞–≤–Є—Б–Є–Љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —Б–≤–µ—А—В—Л–≤–∞–љ–Є—П (–≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–∞—П –±–Њ–ї–µ–Ј–љ—М –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ–Њ–≥–Њ), –Ф–Т–°-—Б–Є–љ–і—А–Њ–Љ–Њ–Љ, —В—П–ґ–µ–ї—Л–Љ–Є –≤—А–Њ–ґ–і–µ–љ–љ—Л–Љ–Є –Є –њ–Њ—Б—В–љ–∞—В–∞–ї—М–љ—Л–Љ–Є –Є–љ—Д–µ–Ї—Ж–Є—П–Љ–Є, –љ–∞—Б–ї–µ–і—Б—В–≤–µ–љ–љ—Л–Љ–Є –Ї–Њ–∞–≥—Г–ї–Њ–њ–∞—В–Є—П–Љ–Є. –Т –і–∞–ї—М–љ–µ–є—И–µ–Љ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є (1970вАУ1990 –≥–≥.) –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –њ—А–Є—З–Є–љ–∞–Љ–Є –љ–µ–Њ–љ–∞—В–∞–ї—М–љ–Њ–≥–Њ –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –Љ–Њ–≥—Г—В –±—Л—В—М –Є –і—А—Г–≥–Є–µ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Б–Њ—Б—В–Њ—П–љ–Є—П, –≤ —В. —З. –Є –Є–Љ–Љ—Г–љ–Њ-–Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–љ—Л–µ —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–Є [4].
–†–∞–љ–µ–µ –љ–∞–Љ–Є —Б–Њ–≤–Љ–µ—Б—В–љ–Њ —Б —Б–Њ—В—А—Г–і–љ–Є–Ї–∞–Љ–Є –ї–∞–±–Њ—А–∞—В–Њ—А–Є–Є –Є–Љ–Љ—Г–љ–Њ–≥–µ–Љ–∞—В–Њ–ї–Њ–≥–Є–Є –У–µ–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –љ–∞—Г—З–љ–Њ–≥–Њ —Ж–µ–љ—В—А–∞ –†–Р–Ь–Э –±—Л–ї –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ –∞–ї–≥–Њ—А–Є—В–Љ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Є–Љ–Љ—Г–љ–љ—Л—Е —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–є —Г –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л—Е –і–µ—В–µ–є [5, 6]. –Ю–і–љ–∞–Ї–Њ –∞–љ–∞–ї–Є–Ј –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –љ–∞–±–ї—О–і–µ–љ–Є–є –Є —А–µ–Ј—Г–ї—М—В–∞—В—Л —В–µ—Б—В–Є—А–Њ–≤–∞–љ–Є—П –≤—А–∞—З–µ–є, –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–≥–Њ –љ–∞–Љ–Є –≤ —А–∞–Љ–Ї–∞—Е —Ж–Є–Ї–ї–Њ–≤ –њ–Њ–≤—Л—И–µ–љ–Є—П –Ї–≤–∞–ї–Є—Д–Є–Ї–∞—Ж–Є–Є, —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ —В–Њ–Љ, —З—В–Њ –њ—А–∞–Ї—В–Є–Ї—Г—О—Й–Є–µ –љ–µ–Њ–љ–∞—В–Њ–ї–Њ–≥–Є –Є –њ–µ–і–Є–∞—В—А—Л –≤—Б–µ –µ—Й–µ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ –Є–љ—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ—Л –Њ —А–Њ–ї–Є –Є–Љ–Љ—Г–љ–љ–Њ-–Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–љ—Л—Е —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–є –≤ —А–∞–Ј–≤–Є—В–Є–Є –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ —Г –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л—Е. –Э–µ–і–Њ–Њ—Ж–µ–љ–Ї–∞ —Н—В–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Ј–љ–∞—З–µ–љ–Є—П –Є–Љ–Љ—Г–љ–љ–Њ–є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–Є –≤ –≥–µ–љ–µ–Ј–µ –љ–µ–Њ–љ–∞—В–∞–ї—М–љ—Л—Е –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є –Љ–Њ–ґ–µ—В —Б—В–∞—В—М –њ—А–Є—З–Є–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–є –Њ—И–Є–±–Ї–Є –Є –љ–µ–∞–і–µ–Ї–≤–∞—В–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П. –Т –Ї–∞—З–µ—Б—В–≤–µ –њ—А–Є–Љ–µ—А–∞ –њ—А–Є–≤–Њ–і–Є–Љ —Б–Њ–±—Б—В–≤–µ–љ–љ–Њ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ.
–†–µ–±–µ–љ–Њ–Ї –Ь. (–і–µ–≤–Њ—З–Ї–∞). –Я–Њ—Б—В—Г–њ–Є–ї–∞ –≤ –Ґ—Г—И–Є–љ—Б–Ї—Г—О –і–µ—В—Б–Ї—Г—О –±–Њ–ї—М–љ–Є—Ж—Г (–≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П вАУ –Ф–У–Ъ–С –Є–Љ. –Ч.–Р. –С–∞—И–ї—П–µ–≤–Њ–є –Ф–Ч –≥. –Ь–Њ—Б–Ї–≤—Л) –≤ –≤–Њ–Ј—А–∞—Б—В–µ 3-—Е —Б—Г—В —Б –љ–∞–њ—А–∞–≤–ї—П—О—Й–Є–Љ –і–Є–∞–≥–љ–Њ–Ј–Њ–Љ ¬Ђ–≤–љ—Г—В—А–Є—Г—В—А–Њ–±–љ–∞—П —Ж–Є—В–Њ–Љ–µ–≥–∞–ї–Њ–≤–Є—А—Г—Б–љ–∞—П –Є–љ—Д–µ–Ї—Ж–Є—П (–¶–Ь–Т–Ш) —Б —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–µ–є –Є –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ¬ї. –†–µ–±–µ–љ–Њ–Ї –Њ—В –Љ–Њ–ї–Њ–і—Л—Е, –Ј–і–Њ—А–Њ–≤—Л—Е —А–Њ–і–Є—В–µ–ї–µ–є. –С–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В—М –њ–µ—А–≤–∞—П, –ґ–µ–ї–∞–љ–љ–∞—П, –њ—А–Њ—В–µ–Ї–∞–ї–∞ –±–µ–Ј –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є. –†–Њ–і—Л –љ–∞ 39вАУ40 –љ–µ–і., —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ, –≤ –≥–Њ–ї–Њ–≤–љ–Њ–Љ –њ—А–µ–і–ї–µ–ґ–∞–љ–Є–Є. –Ь–∞—Б—Б–∞ –њ—А–Є —А–Њ–ґ–і–µ–љ–Є–Є вАУ 3450 –≥, –і–ї–Є–љ–∞ —В–µ–ї–∞ вАУ 53 —Б–Љ. –Ю—Ж–µ–љ–Ї–∞ –њ–Њ –Р–њ–≥–∞—А вАУ 8/9 –±–∞–ї–ї–Њ–≤. –Ъ –≥—А—Г–і–Є –њ—А–Є–ї–Њ–ґ–µ–љ–∞ —Б—А–∞–Ј—Г –њ–Њ—Б–ї–µ —А–Њ–ґ–і–µ–љ–Є—П. –У—А—Г–і—М –≤–Ј—П–ї–∞ –∞–Ї—В–Є–≤–љ–Њ. –Т 1-–µ —Б—Г—В –ґ–Є–Ј–љ–Є –љ–∞ —Д–Њ–љ–µ —Г–і–Њ–≤–ї–µ—В–≤–Њ—А–Є—В–µ–ї—М–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П —А–µ–±–µ–љ–Ї–∞ –љ–∞ –Ї–Њ–ґ–µ –њ–Њ—П–≤–Є–ї–Є—Б—М —Б–њ–Њ–љ—В–∞–љ–љ—Л–µ –њ–µ—В–µ—Е–Є–∞–ї—М–љ—Л–µ —Н–ї–µ–Љ–µ–љ—В—Л —Б—Л–њ–Є, –∞ —В–∞–Ї–ґ–µ ¬Ђ—Б–Є–љ—П—З–Ї–Є¬ї –≤ –Љ–µ—Б—В–∞—Е —Б–і–∞–≤–ї–µ–љ–Є—П –Ї–Њ–ґ–Є –њ–µ–ї–µ–љ–Ї–∞–Љ–Є. –°—А–Њ—З–љ–Њ –±—Л–ї–Є –≤–≤–µ–і–µ–љ—Л –Љ–µ–љ–∞–і–Є–Њ–љ–∞ –љ–∞—В—А–Є—П –±–Є—Б—Г–ї—М—Д–Є—В –Є —Н—В–∞–Љ–Ј–Є–ї–∞—В, –Њ—В–Њ–±—А–∞–љ—Л –њ—А–Њ–±—Л –і–ї—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ –Ї—А–Њ–≤–Є –Є –Ї–Њ–∞–≥—Г–ї–Њ–≥—А–∞–Љ–Љ—Л. –†–µ–Ј—Г–ї—М—В–∞—В—Л –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П:
вАУ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–ї–Є–Ј –Ї—А–Њ–≤–Є (1-–µ —Б—Г—В –ґ–Є–Ј–љ–Є): –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ вАУ 194 –≥/–ї, —Н—А–Є—В—А–Њ—Ж–Є—В—Л вАУ 5,12—Е1012/–ї, MCH вАУ 31 –њ–≥, MCV вАУ 99 —Д–ї, –ї–µ–є–Ї–Њ—Ж–Є—В—Л вАУ 17,5—Е109/–ї, –љ–µ–є—В—А–Њ—Д–Є–ї—Л вАУ 58%, –ї–Є–Љ—Д–Њ—Ж–Є—В—Л вАУ 32%, –Љ–Њ–љ–Њ—Ж–Є—В—Л вАУ 7%, —Н–Њ–Ј–Є–љ–Њ—Д–Є–ї—Л вАУ 2%, –±–∞–Ј–Њ—Д–Є–ї—Л вАУ 1%, —В—А–Њ–Љ–±–Њ—Ж–Є—В—Л вАУ 63—Е109/–ї, M–†V вАУ 10 —Д–ї;
вАУ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–ї–Є–Ј –Ї—А–Њ–≤–Є (2-–µ —Б—Г—В –ґ–Є–Ј–љ–Є): –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ вАУ 181 –≥/–ї, —Н—А–Є—В—А–Њ—Ж–Є—В—Л вАУ 4,25—Е1012/–ї, MCH вАУ 30 –њ–≥, MCV вАУ 100 —Д–ї, –ї–µ–є–Ї–Њ—Ж–Є—В—Л вАУ 15,1—Е109/–ї, –љ–µ–є—В—А–Њ—Д–Є–ї—Л вАУ 61%, –ї–Є–Љ—Д–Њ—Ж–Є—В—Л вАУ 28%, –Љ–Њ–љ–Њ—Ж–Є—В—Л вАУ 9%, —Н–Њ–Ј–Є–љ–Њ—Д–Є–ї—Л вАУ 2%, —В—А–Њ–Љ–±–Њ—Ж–Є—В—Л вАУ 54—Е109/–ї, M–†V вАУ 11 —Д–ї;
вАУ –Ї–Њ–∞–≥—Г–ї–Њ–≥—А–∞–Љ–Љ–∞ (1-–µ —Б—Г—В –ґ–Є–Ј–љ–Є): –∞–Ї—В–Є–≤–Є—А–Њ–≤–∞–љ–љ–Њ–µ —З–∞—Б—В–Є—З–љ–Њ–µ —В—А–Њ–Љ–±–Њ–њ–ї–∞—Б—В–Є–љ–Њ–≤–Њ–µ –≤—А–µ–Љ—П (–Р–І–Ґ–Т) вАУ 34 —Б, –њ—А–Њ—В—А–Њ–Љ–±–Є–љ–Њ–≤—Л–є –Є–љ–і–µ–Ї—Б (–Я–Ґ–Ш) вАУ 105%, —В—А–Њ–Љ–±–Є–љ–Њ–≤–Њ–µ –≤—А–µ–Љ—П вАУ 16 —Б, —Д–Є–±—А–Є–љ–Њ–≥–µ–љ вАУ 3,1 –≥/–ї;
вАУ –Њ–±—Й–Є–є –∞–љ–∞–ї–Є–Ј –Љ–Њ—З–Є, –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–ї–Є–Ј –Ї—А–Њ–≤–Є, –£–Ч–Ш –≤–љ—Г—В—А–µ–љ–љ–Є—Е –Њ—А–≥–∞–љ–Њ–≤ –Є –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ вАУ –±–µ–Ј –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є;
вАУ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Ш–§–Р: anti-CMV-IgM вАУ –љ–µ –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л, anti-CMV-IgG вАУ –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л: 10,2 (–љ–Њ—А–Љ–∞ вАУ –і–Њ 4). –Ъ –Њ—Б—В–∞–ї—М–љ—Л–Љ –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П–Љ TORCH-—Б–Є–љ–і—А–Њ–Љ–∞ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–µ –Є–Љ–Љ—Г–љ–Њ–≥–ї–Њ–±—Г–ї–Є–љ—Л (Ig) –≤—Л—П–≤–ї–µ–љ—Л –љ–µ –±—Л–ї–Є.
–Э–∞–ї–Є—З–Є–µ —Г —А–µ–±–µ–љ–Ї–∞ anti-CMV-IgG —А–∞—Б—Ж–µ–љ–Є–ї–Є –Ї–∞–Ї –њ—А–Њ—П–≤–ї–µ–љ–Є–µ –≤–љ—Г—В—А–Є—Г—В—А–Њ–±–љ–Њ–є –¶–Ь–Т–Ш, –њ—А–Њ—В–µ–Ї–∞—О—Й–µ–є —Б —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–µ–є –Є –≥–µ–Љ–Њ—А—А–∞–≥–Є—П–Љ–Є. –Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —В–µ—А–∞–њ–Є—О –Љ–µ–љ–∞–і–Є–Њ–љ–Њ–Љ –љ–∞—В—А–Є—П –±–Є—Б—Г–ї—М—Д–Є—В–Њ–Љ –Є —Н—В–∞–Љ–Ј–Є–ї–∞—В–Њ–Љ –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є–є —Б–Є–љ–і—А–Њ–Љ —Б–Њ—Е—А–∞–љ—П–ї—Б—П. –Ф–ї—П –њ—А–Њ–≤–µ–і–µ–љ–Є—П —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–є –∞–љ—В–Є—Ж–Є—В–Њ–Љ–µ–≥–∞–ї–Њ–≤–Є—А—Г—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є —А–µ–±–µ–љ–Њ–Ї –±—Л–ї –њ–µ—А–µ–≤–µ–і–µ–љ –≤ –Ґ—Г—И–Є–љ—Б–Ї—Г—О –і–µ—В—Б–Ї—Г—О –±–Њ–ї—М–љ–Є—Ж—Г –љ–∞ 3-–µ —Б—Г—В –ґ–Є–Ј–љ–Є.
–°–Њ—Б—В–Њ—П–љ–Є–µ —А–µ–±–µ–љ–Ї–∞ –њ—А–Є –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–Є вАУ —Б—А–µ–і–љ–µ–є —В—П–ґ–µ—Б—В–Є. –Ь–∞—Б—Б–∞ —В–µ–ї–∞ вАУ 3390 –≥. –Ґ–µ–Љ–њ–µ—А–∞—В—Г—А–∞ —В–µ–ї–∞ вАУ 36,7¬∞–°. –І–∞—Б—В–Њ—В–∞ —Б–µ—А–і–µ—З–љ—Л—Е —Б–Њ–Ї—А–∞—Й–µ–љ–Є–є вАУ 138/–Љ–Є–љ, —З–∞—Б—В–Њ—В–∞ –і—Л—Е–∞–љ–Є–є вАУ 31/–Љ–Є–љ. –Я—А–Є–Ј–љ–∞–Ї–Њ–≤ –і—Л—Е–∞—В–µ–ї—М–љ–Њ–є –Є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –љ–µ—В. –Ъ–Њ—А–Љ–Є—В—Б—П —Б—Ж–µ–ґ–µ–љ–љ—Л–Љ –Љ–∞—В–µ—А–Є–љ—Б–Ї–Є–Љ –Љ–Њ–ї–Њ–Ї–Њ–Љ, —Б–Њ—Б–µ—В –∞–Ї—В–Є–≤–љ–Њ. –£—А–Њ–≤–µ–љ—М –±–Њ–і—А—Б—В–≤–Њ–≤–∞–љ–Є—П вАУ –∞–і–µ–Ї–≤–∞—В–љ—Л–є. –Ъ—А–Є–Ї –≥—А–Њ–Љ–Ї–Є–є, –љ–µ —А–∞–Ј–і—А–∞–ґ–µ–љ–љ—Л–є. –†–µ—Д–ї–µ–Ї—Б—Л –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ–Њ–≥–Њ –≤—Л–Ј—Л–≤–∞—О—В—Б—П. –Э–∞ –Ї–Њ–ґ–µ –ї–Є—Ж–∞, —В—Г–ї–Њ–≤–Є—Й–∞, –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є вАУ –њ–µ—В–µ—Е–Є–∞–ї—М–љ–∞—П —Б—Л–њ—М, –µ–і–Є–љ–Є—З–љ—Л–µ ¬Ђ—Б–Є–љ—П—З–Ї–Є¬ї. –Э–∞ –≤–Є–і–Є–Љ—Л—Е —Б–ї–Є–Ј–Є—Б—В—Л—Е вАУ –µ–і–Є–љ–Є—З–љ—Л–µ –њ–µ—В–µ—Е–Є–Є. –Ґ—Г—А–≥–Њ—А —В–Ї–∞–љ–µ–є –Є —Н–ї–∞—Б—В–Є—З–љ–Њ—Б—В—М –Ї–Њ–ґ–Є –љ–µ –љ–∞—А—Г—И–µ–љ—Л. –Я–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є–µ –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є–µ —Г–Ј–ї—Л –љ–µ —Г–≤–µ–ї–Є—З–µ–љ—Л. –Т –ї–µ–≥–Ї–Є—Е –њ—Г—Н—А–Є–ї—М–љ–Њ–µ –і—Л—Е–∞–љ–Є–µ. –Ґ–Њ–љ—Л —Б–µ—А–і—Ж–∞ —А–Є—В–Љ–Є—З–љ—Л–µ, –Ј–≤—Г—З–љ—Л–µ. –Ц–Є–≤–Њ—В –Љ—П–≥–Ї–Є–є, –і–Њ—Б—В—Г–њ–µ–љ –њ–∞–ї—М–њ–∞—Ж–Є–Є, –±–µ–Ј–±–Њ–ї–µ–Ј–љ–µ–љ–љ—Л–є. –Я–µ—З–µ–љ—М +1,5 —Б–Љ, —Б–µ–ї–µ–Ј–µ–љ–Ї–∞ –љ–µ –њ–∞–ї—М–њ–Є—А—Г–µ—В—Б—П. –Я—Г–њ–Њ—З–љ–∞—П —А–∞–љ–Ї–∞ вАУ —Б –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Њ–є –Ї–Њ—А–Њ—З–Ї–Њ–є, –Ї–Њ–ґ–љ—Л–є –≤–∞–ї–Є–Ї –љ–µ –≤–Њ—Б–њ–∞–ї–µ–љ. –Я—Г–њ–Њ—З–љ—Л–µ —Б–Њ—Б—Г–і—Л –љ–µ –њ–∞–ї—М–њ–Є—А—Г—О—В—Б—П. –°—В—Г–ї –Є –Љ–Њ—З–µ–Є—Б–њ—Г—Б–Ї–∞–љ–Є–µ –≤ –љ–Њ—А–Љ–µ.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≤–µ–і—Г—Й–Є–Љ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А—В–Є–љ–µ —П–≤–ї—П–ї—Б—П –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є–є —Б–Є–љ–і—А–Њ–Љ, –≥–µ–љ–µ–Ј –Ї–Њ—В–Њ—А–Њ–≥–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –±—Л–ї–Њ —Г—В–Њ—З–љ–Є—В—М. –Ф–ї—П —Н—В–Њ–≥–Њ —Б—А–∞–Ј—Г –њ—А–Є –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–Є —Бito! –±—Л–ї–Є –њ—А–Њ–≤–µ–і–µ–љ—Л –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–ї–Є–Ј –Ї—А–Њ–≤–Є, –Ї–Њ–∞–≥—Г–ї–Њ–≥—А–∞–Љ–Љ–∞, –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Н–ї–µ–Ї—В—А–Њ–ї–Є—В–Њ–≤, –≥–∞–Ј–Њ–≤ –Ї—А–Њ–≤–Є –Є –µ–µ –Ї–Є—Б–ї–Њ—В–љ–Њ-—Й–µ–ї–Њ—З–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П (–Ъ–©–°), —А–µ–љ—В–≥–µ–љ –Њ—А–≥–∞–љ–Њ–≤ –≥—А—Г–і–љ–Њ–є –Ї–ї–µ—В–Ї–Є, –∞ —В–∞–Ї–ґ–µ, —Г—З–Є—В—Л–≤–∞—П —А–Є—Б–Ї –≤–љ—Г—В—А–Є—З–µ—А–µ–њ–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ–Є–Ј–ї–Є—П–љ–Є—П, вАУ –љ–µ–є—А–Њ—Б–Њ–љ–Њ–≥—А–∞—Д–Є—П –Є –Њ—Б–Љ–Њ—В—А –≥–ї–∞–Ј–љ–Њ–≥–Њ –і–љ–∞. –Ю–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –±—Л–ї –Њ—Б—Г—Й–µ—Б—В–≤–ї–µ–љ –Ј–∞–±–Њ—А –Ї—А–Њ–≤–Є –і–ї—П –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞, –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П —Г—А–Њ–≤–љ—П –°-—А–µ–∞–Ї—В–Є–≤–љ–Њ–≥–Њ –±–µ–ї–Ї–∞ (–°–†–С) –Є –њ—А–Њ–Ї–∞–ї—М—Ж–Є—В–Њ–љ–Є–љ–∞, –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Љ–µ—В–Њ–і–∞–Љ–Є –њ–Њ–ї–Є–Љ–µ—А–∞–Ј–љ–Њ–є —Ж–µ–њ–љ–Њ–є —А–µ–∞–Ї—Ж–Є–Є (–Я–¶–†) –Є –Є–Љ–Љ—Г–љ–Њ—Д–µ—А–Љ–µ–љ—В–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ (–Ш–§–Р) –і–ї—П –≤–µ—А–Є—Д–Є–Ї–∞—Ж–Є–Є –Љ–∞—А–Ї–µ—А–Њ–≤ TORCH-–Є–љ—Д–µ–Ї—Ж–Є–Є (–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ—А–Њ–≤–Њ–і–Є–ї–Є –≤ –¶–Э–Ш–Ш —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є–Є –†–Њ—Б–њ–Њ—В—А–µ–±–љ–∞–і–Ј–Њ—А–∞). –Я—А–Є–љ–Є–Љ–∞—П –≤–Њ –≤–љ–Є–Љ–∞–љ–Є–µ —В–Њ—В —Д–∞–Ї—В, —З—В–Њ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Я–¶–† –Є –Ш–§–Р –љ–∞ –≤–љ—Г—В—А–Є—Г—В—А–Њ–±–љ—Л–µ –Є–љ—Д–µ–Ї—Ж–Є–Є –±—Г–і—Г—В –Є–Ј–≤–µ—Б—В–љ—Л —В–Њ–ї—М–Ї–Њ —З–µ—А–µ–Ј 24 —З, –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –±—Л–ї–Є –Њ—В–Њ–±—А–∞–љ—Л –Њ–±—А–∞–Ј—Ж—Л –Ї—А–Њ–≤–Є —А–µ–±–µ–љ–Ї–∞, –Љ–∞—В–µ—А–Є –Є –Њ—В—Ж–∞ –і–ї—П –Є—Б–Ї–ї—О—З–µ–љ–Є—П –Є–Љ–Љ—Г–љ–љ—Л—Е –≤–∞—А–Є–∞–љ—В–Њ–≤ —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–Є (–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ—А–Њ–≤–Њ–і–Є–ї–Є –≤ –ї–∞–±–Њ—А–∞—В–Њ—А–Є–Є –Є–Љ–Љ—Г–љ–Њ–≥–µ–Љ–∞—В–Њ–ї–Њ–≥–Є–Є –У–µ–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –љ–∞—Г—З–љ–Њ–≥–Њ —Ж–µ–љ—В—А–∞ –†–Р–Ь–Э).
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Бito!:
вАУ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–ї–Є–Ј –Ї—А–Њ–≤–Є (3-–Є —Б—Г—В –ґ–Є–Ј–љ–Є): –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ вАУ 179 –≥/–ї, —Н—А–Є—В—А–Њ—Ж–Є—В—Л вАУ 4,31—Е1012/–ї, MCH вАУ 29 –њ–≥, MCV вАУ 98 —Д–ї, –ї–µ–є–Ї–Њ—Ж–Є—В—Л вАУ 14,7—Е109/–ї, –љ–µ–є—В—А–Њ—Д–Є–ї—Л вАУ 56%, –ї–Є–Љ—Д–Њ—Ж–Є—В—Л вАУ 32%, –Љ–Њ–љ–Њ—Ж–Є—В—Л вАУ 8%, —Н–Њ–Ј–Є–љ–Њ—Д–Є–ї—Л вАУ 3%, –±–∞–Ј–Њ—Д–Є–ї—Л вАУ 1%, —В—А–Њ–Љ–±–Њ—Ж–Є—В—Л вАУ 37—Е109/–ї, M–†V вАУ 11 —Д–ї;
вАУ –Ї–Њ–∞–≥—Г–ї–Њ–≥—А–∞–Љ–Љ–∞ (3-–Є —Б—Г—В –ґ–Є–Ј–љ–Є: –Р–І–Ґ–Т вАУ 32 —Б, –Я–Ґ–Ш вАУ 113%, —В—А–Њ–Љ–±–Є–љ–Њ–≤–Њ–µ –≤—А–µ–Љ—П вАУ 15 —Б, —Д–Є–±—А–Є–љ–Њ–≥–µ–љ вАУ 3,2 –≥/–ї, –•–∞–≥–µ–Љ–∞–љ-–Ј–∞–≤–Є—Б–Є–Љ—Л–є —Д–Є–±—А–Є–љ–Њ–ї–Є–Ј вАУ 10 –Љ–Є–љ, D-–і–Є–Љ–µ—А—Л вАУ 450;
вАУ –љ–µ–є—А–Њ—Б–Њ–љ–Њ–≥—А–∞—Д–Є—П, —А–µ–љ—В–≥–µ–љ –Њ—А–≥–∞–љ–Њ–≤ –≥—А—Г–і–љ–Њ–є –Ї–ї–µ—В–Ї–Є, –≥–ї–∞–Ј–љ–Њ–µ –і–љ–Њ, —Н–ї–µ–Ї—В—А–Њ–ї–Є—В—Л, –≥–∞–Ј—Л –Ї—А–Њ–≤–Є –Є –µ–µ –Ъ–©–° вАУ –±–µ–Ј –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є;
вАУ –°–†–С, –њ—А–Њ–Ї–∞–ї—М—Ж–Є—В–Њ–љ–Є–љ вАУ –≤ –њ—А–µ–і–µ–ї–∞—Е –љ–Њ—А–Љ—Л.
–Я—А–Є –Ј–∞–±–Њ—А–µ –Ї–∞–њ–Є–ї–ї—П—А–љ–Њ–є –Ї—А–Њ–≤–Є –і–ї—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞, –≥–∞–Ј–Њ–≤ –Ї—А–Њ–≤–Є –Є –µ–µ –Ъ–©–° –Њ—В–Љ–µ—З–µ–љ–∞ –њ—А–Њ–ї–Њ–љ–≥–∞—Ж–Є—П –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Ї—А–Њ–≤–Њ—В–Њ—З–Є–≤–Њ—Б—В–Є.
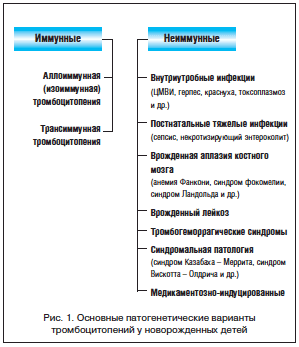
–Ю—В—Б—Г—В—Б—В–≤–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ –Ї–Њ–∞–≥—Г–ї–Њ–≥—А–∞–Љ–Љ–µ –≤ –і–Є–љ–∞–Љ–Є–Ї–µ (–≤ 1-–є –Є 3-–є –і–љ–Є –ґ–Є–Ј–љ–Є) –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ —Б–і–µ–ї–∞—В—М –Ј–∞–Ї–ї—О—З–µ–љ–Є–µ, —З—В–Њ –њ—А–Є—З–Є–љ–Њ–є –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ —Г —А–µ–±–µ–љ–Ї–∞ —П–≤–ї—П–µ—В—Б—П —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є—П –±–µ–Ј —Г—З–∞—Б—В–Є—П –љ–∞—А—Г—И–µ–љ–Є–є –њ–ї–∞–Ј–Љ–µ–љ–љ–Њ–≥–Њ –≥–µ–Љ–Њ—Б—В–∞–Ј–∞. –Ґ—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є—П –≤ –њ–µ—А–Є–Њ–і–µ –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ–Њ—Б—В–Є –≤—Б—В—А–µ—З–∞–µ—В—Б—П –њ—А–Є —Ж–µ–ї–Њ–Љ —А—П–і–µ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Б–Њ—Б—В–Њ—П–љ–Є–є, –њ–Њ—Н—В–Њ–Љ—Г –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ—Л–є –і–Є–∞–≥–љ–Њ–Ј –љ–µ—А–µ–і–Ї–Њ –≤—Л–Ј—Л–≤–∞–µ—В –Ј–∞—В—А—Г–і–љ–µ–љ–Є—П. –Ю–њ—А–µ–і–µ–ї–µ–љ–љ–∞—П –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–∞—П –њ–Њ–Љ–Њ—Й—М –њ—А–Є —Н—В–Њ–Љ –Љ–Њ–ґ–µ—В –±—Л—В—М –њ–Њ–ї—Г—З–µ–љ–∞, –µ—Б–ї–Є –≤—Б–µ –љ–µ–Њ–љ–∞—В–∞–ї—М–љ—Л–µ —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–Є —А–∞–Ј–і–µ–ї–Є—В—М –љ–∞ 2 –Њ—Б–љ–Њ–≤–љ—Л–µ –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –≥—А—Г–њ–њ—Л: –Є–Љ–Љ—Г–љ–љ—Л–µ –Є –љ–µ–Є–Љ–Љ—Г–љ–љ—Л–µ (—А–Є—Б. 1).
–Я—А–Є—З–Є–љ–∞–Љ–Є –љ–µ–Є–Љ–Љ—Г–љ–љ—Л—Е —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–є —П–≤–ї—П—О—В—Б—П –≤–љ—Г—В—А–Є—Г—В—А–Њ–±–љ—Л–µ –Є —В—П–ґ–µ–ї—Л–µ –њ–Њ—Б—В–љ–∞—В–∞–ї—М–љ—Л–µ –Є–љ—Д–µ–Ї—Ж–Є–Є, —В—А–Њ–Љ–±–Њ–≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є–µ —Б–Є–љ–і—А–Њ–Љ—Л, –≤—А–Њ–ґ–і–µ–љ–љ—Л–є –ї–µ–є–Ї–Њ–Ј, –≤—А–Њ–ґ–і–µ–љ–љ–∞—П –∞–њ–ї–∞–Ј–Є—П –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ (–∞–љ–µ–Љ–Є—П –§–∞–љ–Ї–Њ–љ–Є, —Б–Є–љ–і—А–Њ–Љ —Д–Њ–Ї–Њ–Љ–µ–ї–Є–Є, —Б–Є–љ–і—А–Њ–Љ –Ы–∞–љ–і–Њ–ї—М–і–∞ –Є –і—А.) –Є –і—А—Г–≥–∞—П —Б–Є–љ–і—А–Њ–Љ–∞–ї—М–љ–∞—П –њ–∞—В–Њ–ї–Њ–≥–Є—П —А–∞–Ј–ї–Є—З–љ–Њ–≥–Њ –≥–µ–љ–µ–Ј–∞ (—Б–Є–љ–і—А–Њ–Љ –Ъ–∞–Ј–∞–±–∞—Е–∞ вАУ –Ь–µ—А—А–Є—В–∞, —Б–Є–љ–і—А–Њ–Љ –Т–Є—Б–Ї–Њ—В—В–∞ вАУ –Ю–ї–і—А–Є—З–∞ –Є –і—А.).
–Т –Њ—Б–љ–Њ–≤–µ –љ–µ–Њ–љ–∞—В–∞–ї—М–љ—Л—Е –Є–Љ–Љ—Г–љ–љ—Л—Е —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–є –ї–µ–ґ–Є—В –њ–µ—А–µ–і–∞—З–∞ –њ–ї–Њ–і—Г —З–µ—А–µ–Ј –њ–ї–∞—Ж–µ–љ—В—Г –Њ—В –Љ–∞—В–µ—А–Є –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ—Л—Е –∞–љ—В–Є—В–µ–ї. –Я—А–Є —Н—В–Њ–Љ —Е–∞—А–∞–Ї—В–µ—А –∞–љ—В–Є—В–µ–ї –Ј–∞–≤–Є—Б–Є—В –Њ—В –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –Є–Љ–Љ—Г–љ–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –Љ–∞—В–µ—А–Є. –Х—Б–ї–Є —Г –Љ–∞—В–µ—А–Є –Є–Љ–µ–µ—В –Љ–µ—Б—В–Њ –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ–∞—П —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є—П –Є–ї–Є —Б–Є—Б—В–µ–Љ–љ–∞—П –Ї—А–∞—Б–љ–∞—П –≤–Њ–ї—З–∞–љ–Ї–∞, —В–Њ —Б—Г—Й–µ—Б—В–≤—Г–µ—В —А–Є—Б–Ї —В—А–∞–љ—Б–њ–ї–∞—Ж–µ–љ—В–∞—А–љ–Њ–≥–Њ –њ—А–Њ–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ –њ–ї–Њ–і–∞ –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л—Е —В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ—Л—Е –∞–љ—В–Є—В–µ–ї. –Я—А–Є —Н—В–Њ–Љ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ–∞—П —В—А–∞–љ—Б–Є–Љ–Љ—Г–љ–љ–∞—П —Д–Њ—А–Љ–∞ –љ–µ–Њ–љ–∞—В–∞–ї—М–љ–Њ–є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–Є. –Т —В–µ—Е –ґ–µ —Б–ї—Г—З–∞—П—Е, –Ї–Њ–≥–і–∞ –њ–ї–Њ–і –љ–∞—Б–ї–µ–і—Г–µ—В –Њ—В –Њ—В—Ж–∞ —В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ—Л–µ –∞–љ—В–Є–≥–µ–љ—Л —З–µ–ї–Њ–≤–µ–Ї–∞ (HPA вАУ –Эuman –†latelet –Рntigens), –Њ—В—Б—Г—В—Б—В–≤—Г—О—Й–Є–µ —Г –Љ–∞—В–µ—А–Є, –≤–Њ–Ј–Љ–Њ–ґ–љ—Л –µ–µ —Б–µ–љ—Б–Є–±–Є–ї–Є–Ј–∞—Ж–Є—П –Є –њ–Њ—Б–ї–µ–і—Г—О—Й–∞—П –њ–µ—А–µ–і–∞—З–∞ –∞–љ—В–Є—В–µ–ї –њ–ї–Њ–і—Г —З–µ—А–µ–Ј –њ–ї–∞—Ж–µ–љ—В—Г —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ –∞–ї–ї–Њ-(–Є–Ј–Њ)–Є–Љ–Љ—Г–љ–љ–Њ–є –љ–µ–Њ–љ–∞—В–∞–ї—М–љ–Њ–є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–Є (—А–Є—Б. 1). –Ч–љ–∞—З–Є—В–µ–ї—М–љ–Њ —А–µ–ґ–µ —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–Є —Г –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л—Е –≤—Л–Ј—Л–≤–∞—О—В—Б—П –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–∞–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ –њ—А–Є–љ–Є–Љ–∞–µ—В –Љ–∞—В—М (—В–Њ–ї–±—Г—В–∞–Љ–Є–і, –≥–Є–і—А–∞–ї–∞–Ј–Є–љ, –≥–Є–і–∞–љ—В–Є–Њ–љ, –∞–Ј–∞—В–Є–Њ–њ—А–Є–љ, –≥–µ–њ–∞—А–Є–љ –Є –і—А.) –Є–ї–Є –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л–є (–ґ–Є—А–Њ–≤—Л–µ —Н–Љ—Г–ї—М—Б–Є–Є –і–ї—П –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ–≥–Њ –њ–Є—В–∞–љ–Є—П, –≤–∞–ї—М–њ—А–Њ–∞—В—Л, –≥–µ–њ–∞—А–Є–љ), –∞ —В–∞–Ї–ґ–µ –і—А—Г–≥–Є–Љ–Є –њ—А–Є—З–Є–љ–∞–Љ–Є.
–° —Г—З–µ—В–Њ–Љ —Б–Њ—Е—А–∞–љ—П—О—Й–µ–≥–Њ—Б—П –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ —Г –Њ–±—Б—Г–ґ–і–∞–µ–Љ–Њ–≥–Њ —А–µ–±–µ–љ–Ї–∞, –∞ —В–∞–Ї–ґ–µ —Б–љ–Є–ґ–µ–љ–Є—П —Г—А–Њ–≤–љ—П —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ –≤ –і–Є–љ–∞–Љ–Є–Ї–µ –±—Л–ї–Њ –њ—А–Є–љ—П—В–Њ —А–µ—И–µ–љ–Є–µ –Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –њ—А–Њ–≤–µ–і–µ–љ–Є—П —В–µ—А–∞–њ–Є–Є Ig –і–ї—П –≤/–≤ –≤–≤–µ–і–µ–љ–Є—П (–Ш–У–Т–Т), –љ–µ –і–Њ–ґ–Є–і–∞—П—Б—М –њ–Њ–ї—Г—З–µ–љ–Є—П —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Є–Љ–Љ—Г–љ–Њ–≥–µ–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Љ–µ—В–Њ–і–∞–Љ–Є –Ш–§–Р –Є –Я–¶–†. –Ш–У–Т–Т —З–µ–ї–Њ–≤–µ–Ї–∞ –љ–Њ—А–Љ–∞–ї—М–љ—Л–є –±—Л–ї –љ–∞–Ј–љ–∞—З–µ–љ –Є–Ј —А–∞—Б—З–µ—В–∞ 400 –Љ–≥/–Ї–≥ –љ–∞ 1 –≤–≤–µ–і–µ–љ–Є–µ, –љ–∞ –Ї—Г—А—Б вАУ 5 –≤–≤–µ–і–µ–љ–Є–є —Б –Є–љ—В–µ—А–≤–∞–ї–Њ–Љ 24 —З; –Ї—Г—А—Б–Њ–≤–∞—П –і–Њ–Ј–∞ вАУ 2 –≥/–Ї–≥.
–Ю–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ —Б –Ш–У–Т–Т-—В–µ—А–∞–њ–Є–µ–є –њ—А–Њ–і–Њ–ї–ґ–∞–ї–Є –њ—А–Њ–≤–Њ–і–Є—В—М –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ—Г—О –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї—Г. –Р–љ–∞–ї–Є–Ј –і–∞–љ–љ—Л—Е –∞–љ–∞–Љ–љ–µ–Ј–∞, –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А—В–Є–љ—Л –Є —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–≥–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Г–ґ–µ –≤ 1-–µ —Б—Г—В –њ—А–µ–±—Л–≤–∞–љ–Є—П —А–µ–±–µ–љ–Ї–∞ –≤ –Ґ—Г—И–Є–љ—Б–Ї–Њ–є –і–µ—В—Б–Ї–Њ–є –±–Њ–ї—М–љ–Є—Ж–µ –њ–Њ–Ј–≤–Њ–ї–Є–ї –Є—Б–Ї–ї—О—З–Є—В—М —Б–µ–њ—Б–Є—Б –Є –љ–µ–Ї—А–Њ—В–Є–Ј–Є—А—Г—О—Й–Є–є —Н–љ—В–µ—А–Њ–Ї–Њ–ї–Є—В, —В—А–Њ–Љ–±–Њ–≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є–µ —Б–Є–љ–і—А–Њ–Љ—Л, –∞–љ–µ–Љ–Є—О –§–∞–љ–Ї–Њ–љ–Є, —Б–Є–љ–і—А–Њ–Љ —Д–Њ–Ї–Њ–Љ–µ–ї–Є–Є, —Б–Є–љ–і—А–Њ–Љ –Ъ–∞–Ј–∞–±–∞—Е–∞ вАУ –Ь–µ—А—А–Є—В–∞, –∞ —В–∞–Ї–ґ–µ –њ–Њ–±–Њ—З–љ—Л–µ –і–µ–є—Б—В–≤–Є—П –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–≤ (—В–∞–±–ї. 1).
–Я–Њ–ї—Г—З–µ–љ–љ—Л–µ –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –љ–∞ TORCH-–Є–љ—Д–µ–Ї—Ж–Є–Є —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤–Њ–≤–∞–ї–Є –Њ–± –Њ—В—Б—Г—В—Б—В–≤–Є–Є –Љ–∞—А–Ї–µ—А–Њ–≤ –≤–љ—Г—В—А–Є—Г—В—А–Њ–±–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є. –Ґ–∞–Ї, –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Я–¶–†-–∞–љ–∞–ї–Є–Ј–∞ (–Ї—А–Њ–≤—М, –Љ–Њ—З–∞) –љ–∞ –≤–Є—А—Г—Б—Л –≥–µ—А–њ–µ—Б–∞ —З–µ–ї–Њ–≤–µ–Ї–∞ 1, 2, 6-–≥–Њ —В–Є–њ–Њ–≤, —Ж–Є—В–Њ–Љ–µ–≥–∞–ї–Њ–≤–Є—А—Г—Б (–¶–Ь–Т), –≤–Є—А—Г—Б –Ї—А–∞—Б–љ—Г—Е–Є, —В–Њ–Ї—Б–Њ–њ–ї–∞–Ј–Љ—Г. –†–µ–Ј—Г–ї—М—В–∞—В—Л –Ш–§–Р-–∞–љ–∞–ї–Є–Ј–∞ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤–Њ–≤–∞–ї–Є –Њ–± –Њ—В—Б—Г—В—Б—В–≤–Є–Є –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є —А–µ–±–µ–љ–Ї–∞ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є—Е –∞–љ—В–Є—В–µ–ї –Ї –≥–µ—А–њ–µ—Б-–≤–Є—А—Г—Б–∞–Љ, –≤–Є—А—Г—Б—Г –Ї—А–∞—Б–љ—Г—Е–Є, —В–Њ–Ї—Б–Њ–њ–ї–∞–Ј–Љ–µ, –∞ —В–∞–Ї–ґ–µ anti-CMV-IgM. –Т—Л—П–≤–ї–µ–љ–љ—Л–µ anti-CMV-IgG –±—Л–ї–Є –≤—Л—Б–Њ–Ї–Њ–∞–≤–Є–і–љ—Л–Љ–Є (0,78) –Є —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л–Љ–Є —Б –Љ–∞—В–µ—А–Є–љ—Б–Ї–Є–Љ–Є –њ–Њ —В–Є—В—А—Г –Є –∞–≤–Є–і–љ–Њ—Б—В–Є, —З—В–Њ, –љ–∞—А—П–і—Г —Б –Њ—В—Б—Г—В—Б—В–≤–Є–µ–Љ –≥–µ–љ–Њ–Љ–∞ –¶–Ь–Т –≤ –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Б—А–µ–і–∞—Е —А–µ–±–µ–љ–Ї–∞, –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ –Є—Б–Ї–ї—О—З–Є—В—М —Г –љ–µ–≥–Њ –≤–љ—Г—В—А–Є—Г—В—А–Њ–±–љ—Г—О –¶–Ь–Т–Ш. –° —Г—З–µ—В–Њ–Љ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є –Њ–±–љ–∞—А—Г–ґ–µ–љ–љ—Л—Е –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є —А–µ–±–µ–љ–Ї–∞ –∞–љ—В–Є—В–µ–ї –Ї –¶–Ь–Т (Ig –Ї–ї–∞—Б—Б–∞ G, –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –Є –Є–љ–і–µ–Ї—Б –∞–≤–Є–і–љ–Њ—Б—В–Є вАУ –Ї–∞–Ї —Г –Љ–∞—В–µ—А–Є) –Њ–љ–Є –±—Л–ї–Є —А–∞—Б—Ж–µ–љ–µ–љ—Л –Ї–∞–Ї –Љ–∞—В–µ—А–Є–љ—Б–Ї–Є–µ, –њ–µ—А–µ–і–∞–љ–љ—Л–µ —А–µ–±–µ–љ–Ї—Г —В—А–∞–љ—Б–њ–ї–∞—Ж–µ–љ—В–∞—А–љ–Њ. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ—А–µ–і–њ–Њ–ї–Њ–ґ–µ–љ–Є–µ –Њ –≤–љ—Г—В—А–Є—Г—В—А–Њ–±–љ–Њ–є –¶–Ь–Т–Ш –Ї–∞–Ї –њ—А–Є—З–Є–љ–µ —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–Є –љ–µ –љ–∞—И–ї–Њ —Г–±–µ–і–Є—В–µ–ї—М–љ—Л—Е –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є–є.
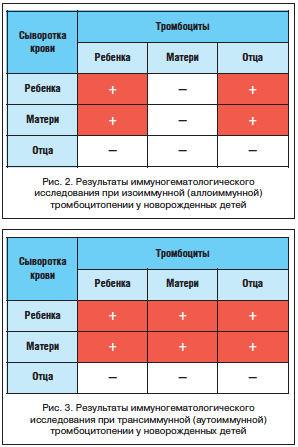
–Т —В–Њ –ґ–µ –≤—А–µ–Љ—П —А–µ–Ј—Г–ї—М—В–∞—В—Л –Є–Љ–Љ—Г–љ–Њ–≥–µ–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –љ–∞–≥–ї—П–і–љ–Њ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є –љ–∞–ї–Є—З–Є–µ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–∞—Е –Ї—А–Њ–≤–Є –Љ–∞—В–µ—А–Є –Є —А–µ–±–µ–љ–Ї–∞ –∞–љ—В–Є—В–µ–ї –Ї —В—А–Њ–Љ–±–Њ—Ж–Є—В–∞–Љ —А–µ–±–µ–љ–Ї–∞ –Є –µ–≥–Њ –Њ—В—Ж–∞ (—А–Є—Б. 2). –≠—В–Њ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ —Б–і–µ–ї–∞—В—М –≤—Л–≤–Њ–і –Њ —В–Њ–Љ, —З—В–Њ –њ—А–Є—З–Є–љ–Њ–є –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –≤ –і–∞–љ–љ–Њ–Љ —Б–ї—Г—З–∞–µ —П–≤–ї—П–µ—В—Б—П –∞–ї–ї–Њ–Є–Љ–Љ—Г–љ–љ–∞—П —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є—П, —А–∞–Ј–≤–Є–≤—И–∞—П—Б—П –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –Є–Ј–Њ–Є–Љ–Љ—Г–љ–Є–Ј–∞—Ж–Є–Є –Љ–∞—В–µ—А–Є HPA –њ–ї–Њ–і–∞, –Ї–Њ—В–Њ—А—Л–є —Г–љ–∞—Б–ї–µ–і–Њ–≤–∞–ї –Є—Е –Њ—В –Њ—В—Ж–∞. –Ш–У–Т–Т-—В–µ—А–∞–њ–Є—П –±—Л–ї–∞ –њ—А–Њ–і–Њ–ї–ґ–µ–љ–∞, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ –±—Л—Б—В—А–Њ –Ї—Г–њ–Є—А–Њ–≤–∞—В—М –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є–є —Б–Є–љ–і—А–Њ–Љ –Є –і–Њ–±–Є—В—М—Б—П —В–µ–љ–і–µ–љ—Ж–Є–Є –Ї –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—О —Г—А–Њ–≤–љ—П —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ (112—Е109/–ї вАУ –љ–∞ 7вАУ–µ —Б—Г—В –ґ–Є–Ј–љ–Є, –њ–Њ—Б–ї–µ 5-–≥–Њ –≤–≤–µ–і–µ–љ–Є—П –Ш–У–Т–Т; 141—Е109/–ї вАУ –Ї 10вАУ–Љ —Б—Г—В –ґ–Є–Ј–љ–Є; 148—Е109/–ї вАУ –Ї 14-–Љ —Б—Г—В –ґ–Є–Ј–љ–Є; 164—Е109/–ї вАУ –Ї 21-–Љ —Б—Г—В –ґ–Є–Ј–љ–Є). –Ъ–∞—В–∞–Љ–љ–µ—Б—В–Є—З–µ—Б–Ї–Њ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ –Ј–∞ —А–µ–±–µ–љ–Ї–Њ–Љ –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ–± –Њ—В—Б—Г—В—Б—В–≤–Є–Є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–Є –Є –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≤ —Б—В—А—Г–Ї—В—Г—А–µ –љ–µ–Њ–љ–∞—В–∞–ї—М–љ—Л—Е —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–є –Њ—Б–Њ–±–Њ–µ –Љ–µ—Б—В–Њ –Ј–∞–љ–Є–Љ–∞—О—В –Є–Љ–Љ—Г–љ–љ—Л–µ –≤–∞—А–Є–∞–љ—В—Л. –Я—А–Є —Н—В–Њ–Љ —В—А–∞–љ—Б–Є–Љ–Љ—Г–љ–љ—Л–µ –љ–µ–Њ–љ–∞—В–∞–ї—М–љ—Л–µ —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–Є –љ–∞–±–ї—О–і–∞—О—В—Б—П –≤ —В–µ—Е —Б–ї—Г—З–∞—П—Е, –Ї–Њ–≥–і–∞ —Г –Љ–∞—В–µ—А–µ–є –Є–Љ–µ–µ—В –Љ–µ—Б—В–Њ –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ–∞—П —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є—П –Є–ї–Є —Б–Є—Б—В–µ–Љ–љ–∞—П –Ї—А–∞—Б–љ–∞—П –≤–Њ–ї—З–∞–љ–Ї–∞. –Т –Њ—Б–љ–Њ–≤–µ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –і–∞–љ–љ–Њ–є —Д–Њ—А–Љ—Л –љ–µ–Њ–љ–∞—В–∞–ї—М–љ–Њ–є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–Є –ї–µ–ґ–Є—В —В—А–∞–љ—Б–њ–ї–∞—Ж–µ–љ—В–∞—А–љ—Л–є –њ–µ—А–µ–љ–Њ—Б –Ї –њ–ї–Њ–і—Г –Љ–∞—В–µ—А–Є–љ—Б–Ї–Є—Е –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л—Е –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ—Л—Е –∞–љ—В–Є—В–µ–ї –Ї–ї–∞—Б—Б–∞ IgG. –Я–Њ –і–∞–љ–љ—Л–Љ —А–∞–Ј–љ—Л—Е –∞–≤—В–Њ—А–Њ–≤, —Г –ґ–µ–љ—Й–Є–љ —Б –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ–Њ–є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–µ–є —А–Є—Б–Ї —А–Њ–ґ–і–µ–љ–Є—П —А–µ–±–µ–љ–Ї–∞ —Б —В—А–∞–љ—Б–Є–Љ–Љ—Г–љ–љ–Њ–є –љ–µ–Њ–љ–∞—В–∞–ї—М–љ–Њ–є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–µ–є –і–Њ—Б—В–Є–≥–∞–µ—В 30вАУ75%. –Я—А–Є —Н—В–Њ–Љ —В—П–ґ–µ–ї—Л–µ —Д–Њ—А–Љ—Л —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–Є –Њ—В–Љ–µ—З–∞—О—В—Б—П –≤ 8вАУ15% —Б–ї—Г—З–∞–µ–≤, –∞ —А–Є—Б–Ї –≤–љ—Г—В—А–Є—З–µ—А–µ–њ–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ–Є–Ј–ї–Є—П–љ–Є—П —Б–Њ—Б—В–∞–≤–ї—П–µ—В 1,5% [8]. –Ф–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —Б—В–µ–њ–µ–љ—М —Б–љ–Є–ґ–µ–љ–Є—П —Г—А–Њ–≤–љ—П —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ —Г –Љ–∞—В–µ—А–Є –≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –љ–µ –≤–ї–Є—П–µ—В –љ–∞ —В—П–ґ–µ—Б—В—М —В—А–∞–љ—Б–Є–Љ–Љ—Г–љ–љ–Њ–є –љ–µ–Њ–љ–∞—В–∞–ї—М–љ–Њ–є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–Є. –Ъ —Б–Њ–ґ–∞–ї–µ–љ–Є—О, –і–Њ –љ–∞—Б—В–Њ—П—Й–µ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –љ–µ—В –µ–і–Є–љ–Њ–є –Є –Њ–±—Й–µ–і–Њ—Б—В—Г–њ–љ–Њ–є —В–∞–Ї—В–Є–Ї–Є –≤–µ–і–µ–љ–Є—П –±–µ—А–µ–Љ–µ–љ–љ—Л—Е —Б –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ–Њ–є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–µ–є, –њ–Њ–Ј–≤–Њ–ї—П—О—Й–µ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—А–Њ–≤–∞—В—М —А–∞–Ј–≤–Є—В–Є–µ —В—А–∞–љ—Б–Є–Љ–Љ—Г–љ–љ–Њ–є –љ–µ–Њ–љ–∞—В–∞–ї—М–љ–Њ–є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–Є.
–Т–µ—А–Є—Д–Є–Ї–∞—Ж–Є—П –і–Є–∞–≥–љ–Њ–Ј–∞ —В—А–∞–љ—Б–Є–Љ–Љ—Г–љ–љ–Њ–є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–Є –њ—А–Њ–≤–Њ–і–Є—В—Б—П –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Є–Љ–Љ—Г–љ–Њ–≥–µ–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –≤ –Њ—Б–љ–Њ–≤–µ –Ї–Њ—В–Њ—А–Њ–≥–Њ –ї–µ–ґ–Є—В –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –њ—А–Њ–± —Б–Њ–≤–Љ–µ—Б—В–Є–Љ–Њ—Б—В–Є —Б—Л–≤–Њ—А–Њ—В–Ї–Є —А–µ–±–µ–љ–Ї–∞, –Љ–∞—В–µ—А–Є, –Њ—В—Ж–∞ —Б —В—А–Њ–Љ–±–Њ—Ж–Є—В–∞–Љ–Є, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, —А–µ–±–µ–љ–Ї–∞, –Љ–∞—В–µ—А–Є, –Њ—В—Ж–∞. –Х—Б–ї–Є –Њ—В–Љ–µ—З–∞–µ—В—Б—П –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–µ —Б—Л–≤–Њ—А–Њ—В–Ї–Є –Љ–∞—В–µ—А–Є —Б —Б–Њ–±—Б—В–≤–µ–љ–љ—Л–Љ–Є —В—А–Њ–Љ–±–Њ—Ж–Є—В–∞–Љ–Є, –∞ —В–∞–Ї–ґ–µ —Б —В—А–Њ–Љ–±–Њ—Ж–Є—В–∞–Љ–Є —А–µ–±–µ–љ–Ї–∞ –Є –Њ—В—Ж–∞ –Є –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ —Б—Л–≤–Њ—А–Њ—В–Ї–∞ —А–µ–±–µ–љ–Ї–∞ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤—Г–µ—В —Б–Њ —Б–≤–Њ–Є–Љ–Є —Б–Њ–±—Б—В–≤–µ–љ–љ—Л–Љ–Є —В—А–Њ–Љ–±–Њ—Ж–Є—В–∞–Љ–Є, –∞ —В–∞–Ї–ґ–µ —Б —В—А–Њ–Љ–±–Њ—Ж–Є—В–∞–Љ–Є –Љ–∞—В–µ—А–Є –Є —В—А–Њ–Љ–±–Њ—Ж–Є—В–∞–Љ–Є –Њ—В—Ж–∞, —В–Њ –њ–Њ–і—В–≤–µ—А–ґ–і–∞–µ—В—Б—П —В—А–∞–љ—Б–Є–Љ–Љ—Г–љ–љ—Л–є –≤–∞—А–Є–∞–љ—В (—А–Є—Б. 3). –Ю–±—К—П—Б–љ—П–µ—В—Б—П —Н—В–Њ —В–µ–Љ, —З—В–Њ –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л–µ –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ—Л–µ –∞–љ—В–Є—В–µ–ї–∞ –Љ–∞—В–µ—А–Є –њ–µ—А–µ–і–∞—О—В—Б—П —А–µ–±–µ–љ–Ї—Г —З–µ—А–µ–Ј –њ–ї–∞—Ж–µ–љ—В—Г –Є –µ—Й–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –љ–µ–і–µ–ї—М –Є –і–∞–ґ–µ –Љ–µ—Б—П—Ж–µ–≤ –њ–Њ—Б–ї–µ —А–Њ–ґ–і–µ–љ–Є—П –±—Г–і—Г—В —Ж–Є—А–Ї—Г–ї–Є—А–Њ–≤–∞—В—М –≤ –µ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–µ. –Р—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л–µ –∞–љ—В–Є—В–µ–ї–∞ –љ–∞–њ—А–∞–≤–ї–µ–љ—Л –њ—А–Њ—В–Є–≤ –Њ–±—Й–Є—Е HPA, –њ—А–Є—Б—Г—В—Б—В–≤—Г—О—Й–Є—Е –љ–∞ —В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—Е –≤—Б–µ—Е –ї—О–і–µ–є, –Є —Б—Л–≤–Њ—А–Њ—В–Ї–Є –Ї—А–Њ–≤–Є, –≤ –Ї–Њ—В–Њ—А—Л—Е –Њ–љ–Є –љ–∞—Е–Њ–і—П—В—Б—П (–≤ –і–∞–љ–љ–Њ–Љ —Б–ї—Г—З–∞–µ вАУ –≤ –Љ–∞—В–µ—А–Є–љ—Б–Ї–Њ–є –Є —Г –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ–Њ–≥–Њ), –±—Г–і—Г—В –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Њ–≤–∞—В—М —Б —В—А–Њ–Љ–±–Њ—Ж–Є—В–∞–Љ–Є –љ–µ —В–Њ–ї—М–Ї–Њ –Љ–∞—В–µ—А–Є, —А–µ–±–µ–љ–Ї–∞, –љ–Њ –Є –Њ—В—Ж–∞. –Т —Б–≤—П–Ј–Є —Б —В–µ–Љ, —З—В–Њ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –Њ—В—Ж–∞ –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л—Е –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ—Л—Е –∞–љ—В–Є—В–µ–ї –љ–µ—В, –Њ–љ–∞ –љ–µ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤—Г–µ—В –љ–Є —Б —Б–Њ–±—Б—В–≤–µ–љ–љ—Л–Љ–Є —В—А–Њ–Љ–±–Њ—Ж–Є—В–∞–Љ–Є, –љ–Є —Б —В—А–Њ–Љ–±–Њ—Ж–Є—В–∞–Љ–Є —А–µ–±–µ–љ–Ї–∞ –Є –Љ–∞—В–µ—А–Є (—А–Є—Б. 3).

–Ш–Ј–Њ–Є–Љ–Љ—Г–љ–љ–∞—П (–∞–ї–ї–Њ–Є–Љ–Љ—Г–љ–љ–∞—П) —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є—П –≤—Б—В—А–µ—З–∞–µ—В—Б—П —Б —З–∞—Б—В–Њ—В–Њ–є 1 —Б–ї—Г—З–∞–є –љ–∞ 1 —В—Л—Б. –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л—Е [8]. –Я–∞—В–Њ–≥–µ–љ–µ–Ј –њ–Њ—Б–ї–µ–і–љ–µ–є –≤–Њ –Љ–љ–Њ–≥–Њ–Љ —Б—Е–Њ–і–µ–љ —Б –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –≥–µ–Љ–Њ–ї–Є—В–Є—З–µ—Б–Ї–Њ–є –∞–љ–µ–Љ–Є–Є –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л—Е –њ—А–Є —А–µ–Ј—Г—Б-–Ї–Њ–љ—Д–ї–Є–Ї—В–µ –Є —П–≤–ї—П–µ—В—Б—П —А–µ–Ј—Г–ї—М—В–∞—В–Њ–Љ –њ—А–Њ–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П —З–µ—А–µ–Ј –њ–ї–∞—Ж–µ–љ—В—Г –Ї –Љ–∞—В–µ—А–Є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ –њ–ї–Њ–і–∞. –Я—А–Є –љ–µ—Б–Њ–≤–Љ–µ—Б—В–Є–Љ–Њ—Б—В–Є –Љ–∞—В–µ—А–Є –Є –њ–ї–Њ–і–∞ –њ–Њ HPA –ґ–µ–љ—Й–Є–љ–∞ –Є–Љ–Љ—Г–љ–Є–Ј–Є—А—Г–µ—В—Б—П –Є –≤—Л—А–∞–±–∞—В—Л–≤–∞–µ—В –∞–љ—В–Є—В–µ–ї–∞ –Ї –∞–љ—В–Є–≥–µ–љ–∞–Љ –њ–ї–Њ–і–∞, –Ї–Њ—В–Њ—А—Л—Е –љ–µ—В –љ–∞ –µ–µ —В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—Е, –љ–Њ –Њ–љ–Є —Г–љ–∞—Б–ї–µ–і–Њ–≤–∞–љ—Л —А–µ–±–µ–љ–Ї–Њ–Љ –Њ—В –Њ—В—Ж–∞. –Т –њ–Њ–і–∞–≤–ї—П—О—Й–µ–Љ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ –Є–Ј–Њ—Б–µ–љ—Б–Є–±–Є–ї–Є–Ј–∞—Ж–Є—П –Љ–∞—В–µ—А–Є –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –Ї –∞–љ—В–Є–≥–µ–љ—Г –ЭP–Р-1–∞. –Ю–±—А–∞–Ј–Њ–≤–∞–≤—И–Є–µ—Б—П –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –±–µ—А–µ–Љ–µ–љ–љ–Њ–є –∞–љ—В–Є—В–µ–ї–∞ –Ї–ї–∞—Б—Б–∞ IgG –Ї HPA –њ–ї–Њ–і–∞ –≤ –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–Љ –њ–µ—А–µ–і–∞—О—В—Б—П —З–µ—А–µ–Ј –њ–ї–∞—Ж–µ–љ—В—Г –Є —Б–≤—П–Ј—Л–≤–∞—О—В—Б—П —Б —В—А–Њ–Љ–±–Њ—Ж–Є—В–∞–Љ–Є –њ–ї–Њ–і–∞, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –Є—Е –њ–Њ–≤—Л—И–µ–љ–љ–Њ–Љ—Г —А–∞–Ј—А—Г—И–µ–љ–Є—О —Г–ґ–µ –≤–љ—Г—В—А–Є—Г—В—А–Њ–±–љ–Њ. –Я—А–Є —Н—В–Њ–Љ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –≤ –њ–Њ–ї–Њ–≤–Є–љ–µ –≤—Б–µ—Е —Б–ї—Г—З–∞–µ–≤ –≤–љ—Г—В—А–Є—З–µ—А–µ–њ–љ—Л—Е –≥–µ–Љ–Њ—А—А–∞–≥–Є–є, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ—Л—Е –Є–Ј–Њ–Є–Љ–Љ—Г–љ–љ–Њ–є (–∞–ї–ї–Њ–Є–Љ–Љ—Г–љ–љ–Њ–є) —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–µ–є, –Ї—А–Њ–≤–Њ–Є–Ј–ї–Є—П–љ–Є—П —А–∞–Ј–≤–Є–≤–∞—О—В—Б—П –µ—Й–µ –≤–љ—Г—В—А–Є—Г—В—А–Њ–±–љ–Њ. –Т —Ж–µ–ї–Њ–Љ —А–Є—Б–Ї –≤–љ—Г—В—А–Є—З–µ—А–µ–њ–љ—Л—Е –Ї—А–Њ–≤–Њ–Є–Ј–ї–Є—П–љ–Є–є –њ—А–Є –і–∞–љ–љ–Њ–є —Д–Њ—А–Љ–µ –Є–Љ–Љ—Г–љ–љ–Њ–є –љ–µ–Њ–љ–∞—В–∞–ї—М–љ–Њ–є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–Є, –њ–Њ –љ–µ–Ї–Њ—В–Њ—А—Л–Љ –і–∞–љ–љ—Л–Љ, –і–Њ—Б—В–Є–≥–∞–µ—В 20% [8].
–Я–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —А–∞–Ј–≤–Є—В–Є–µ –Є–Ј–Њ–Є–Љ–Љ—Г–љ–љ–Њ–є (–∞–ї–ї–Њ–Є–Љ–Љ—Г–љ–љ–Њ–є) —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –і–∞–ґ–µ –њ—А–Є –њ–µ—А–≤–Њ–є –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є, –љ–Њ –љ–∞–Є–±–Њ–ї–µ–µ —В—П–ґ–µ–ї–Њ–µ —В–µ—З–µ–љ–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Њ—В–Љ–µ—З–∞–µ—В—Б—П –њ—А–Є –њ–Њ—Б–ї–µ–і—Г—О—Й–Є—Е –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В—П—Е –Њ—В —Н—В–Њ–≥–Њ –ґ–µ –њ–∞—А—В–љ–µ—А–∞. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ –≤ —Б–ї—Г—З–∞–µ –≤—Л—П–≤–ї–µ–љ–Є—П —Г –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ–Њ–≥–Њ –Є–Ј–Њ–Є–Љ–Љ—Г–љ–љ–Њ–є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–Є —А–Њ–і–Є—В–µ–ї–Є –і–Њ–ї–ґ–љ—Л –±—Л—В—М –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ—Л –Њ –≤—Л—Б–Њ–Ї–Њ–Љ —А–Є—Б–Ї–µ —А–Њ–ґ–і–µ–љ–Є—П –і–µ—В–µ–є —Б —В—П–ґ–µ–ї—Л–Љ–Є —Д–Њ—А–Љ–∞–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Я—А–Є —Н—В–Њ–Љ –µ–і–Є–љ—Л—Е –њ–Њ–і—Е–Њ–і–Њ–≤ –Ї –≤–µ–і–µ–љ–Є—О –±–µ—А–µ–Љ–µ–љ–љ—Л—Е, –Є–Ј–Њ–Є–Љ–Љ—Г–љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Ї –ЭP–Р, –љ–µ—В, –љ–Њ –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–є –њ—А–Є–і–µ—А–ґ–Є–≤–∞—О—В—Б—П —В–∞–Ї—В–Є–Ї–Є –µ–ґ–µ–љ–µ–і–µ–ї—М–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П –Ш–У–Т–Т –≤ –і–Њ–Ј–µ 1 –≥/–Ї–≥, –≤ –љ–µ–Ї–Њ—В–Њ—А—Л—Е —Б–ї—Г—З–∞—П—Е –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–∞–Љ–Є (0,5 –Љ–≥/–Ї–≥ –њ–Њ –њ—А–µ–і–љ–Є–Ј–Њ–ї–Њ–љ—Г), –љ–∞—З–Є–љ–∞—П —Б 20-–є –љ–µ–і. –≥–µ—Б—В–∞—Ж–Є–Є. –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –≤ —А—П–і–µ –Ї–ї–Є–љ–Є–Ї –і–Њ—Б—В–Є–≥–љ—Г—В—Л —Е–Њ—А–Њ—И–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ—А–Є –Љ–Њ–љ–Є—В–Њ—А–Є—А–Њ–≤–∞–љ–Є–Є —Г—А–Њ–≤–љ—П —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ —Г –њ–ї–Њ–і–Њ–≤ –≤ –њ—Г–њ–Њ–≤–Є–љ–љ–Њ–є –Ї—А–Њ–≤–Є –і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П —В–µ—Е –Ї—А–Є—В–Є—З–µ—Б–Ї–Є—Е —Б–ї—Г—З–∞–µ–≤ —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–Є, –Ї–Њ–≥–і–∞ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –≤–љ—Г—В—А–Є–њ—Г–њ–Њ–≤–Є–љ–љ–Њ–µ (–њ–Њ–і –£–Ч–Ш-–Ї–Њ–љ—В—А–Њ–ї–µ–Љ) –≤–≤–µ–і–µ–љ–Є–µ –Ш–У–Т–Т –Є —В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ–Њ–≥–Њ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—В–∞.
–Ф–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –Є–Ј–Њ–Є–Љ–Љ—Г–љ–љ–Њ–є (–∞–ї–ї–Њ–Є–Љ–Љ—Г–љ–љ–Њ–є) —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–Є –Њ—Б–љ–Њ–≤–∞–љ–∞ –љ–∞ —Г—В–Њ—З–љ–µ–љ–Є–Є –∞–љ–∞–Љ–љ–µ–Ј–∞ (—Г–Ї–∞–Ј–∞–љ–Є–µ –љ–∞ –њ—А–µ–і—И–µ—Б—В–≤—Г—О—Й—Г—О –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –Є–Ј–Њ–Є–Љ–Љ—Г–љ–Є–Ј–∞—Ж–Є—О –Љ–∞—В–µ—А–Є –Є–Ј-–Ј–∞ –љ–µ–Њ–і–љ–Њ–Ї—А–∞—В–љ–Њ–≥–Њ –њ–µ—А–µ–ї–Є–≤–∞–љ–Є—П —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ –Є/–Є–ї–Є —А–Њ–ґ–і–µ–љ–Є–µ –і–µ—В–µ–є —Б –Є–Ј–Њ–Є–Љ–Љ—Г–љ–љ–Њ–є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–µ–є), –∞ —В–∞–Ї–ґ–µ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Є–Љ–Љ—Г–љ–Њ-–≥–µ–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П. –Я—А–Є —Н—В–Њ–Љ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–µ —Б—Л–≤–Њ—А–Њ—В–Ї–Є –Ї—А–Њ–≤–Є –Љ–∞—В–µ—А–Є –Є —А–µ–±–µ–љ–Ї–∞ —Б —В—А–Њ–Љ–±–Њ—Ж–Є—В–∞–Љ–Є —А–µ–±–µ–љ–Ї–∞ –Є –Њ—В—Ж–∞ –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П –Є—Е —Б —В—А–Њ–Љ–±–Њ—Ж–Є—В–∞–Љ–Є –Љ–∞—В–µ—А–Є —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ–± –Є–Ј–Њ–Є–Љ–Љ—Г–љ–Њ–є (–∞–ї–ї–Њ–Є–Љ–Љ—Г–љ–љ–Њ–є) —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–Є. –Ю–±—К—П—Б–љ–µ–љ–Є–µ–Љ —Н—В–Њ–Љ—Г —П–≤–ї—П–µ—В—Б—П —В–Њ—В —Д–∞–Ї—В, —З—В–Њ –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ—Л–µ –∞–љ—В–Є—В–µ–ї–∞ –Љ–∞—В–µ—А–Є, –≤—Л—А–∞–±–Њ—В–∞–љ–љ—Л–µ –љ–∞ –Њ—В—Б—Г—В—Б—В–≤—Г—О—Й–Є–є —Г –љ–µ–µ –∞–љ—В–Є–≥–µ–љ, –љ–Њ –Є–Љ–µ—О—Й–Є–є—Б—П —Г —А–µ–±–µ–љ–Ї–∞ (—Г–љ–∞—Б–ї–µ–і–Њ–≤–∞–љ –Њ—В –Њ—В—Ж–∞), —В—А–∞–љ—Б–њ–ї–∞—Ж–µ–љ—В–∞—А–љ–Њ –њ–µ—А–µ–і–∞—О—В—Б—П –њ–ї–Њ–і—Г. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Б—Л–≤–Њ—А–Њ—В–Ї–∞ –Ї—А–Њ–≤–Є –Љ–∞—В–µ—А–Є –Є —Б—Л–≤–Њ—А–Њ—В–Ї–∞ –Ї—А–Њ–≤–Є —А–µ–±–µ–љ–Ї–∞ —Б–Њ–і–µ—А–ґ–∞—В —Н—В–Є –∞–љ—В–Є—В–µ–ї–∞, –Љ–Є—И–µ–љ—М—О –і–ї—П –Ї–Њ—В–Њ—А—Л—Е —П–≤–ї—П—О—В—Б—П —В—А–Њ–Љ–±–Њ—Ж–Є—В—Л —А–µ–±–µ–љ–Ї–∞ –Є –Њ—В—Ж–∞ (—А–Є—Б. 2).
–Ґ–∞–Ї—В–Є–Ї–∞ –≤–µ–і–µ–љ–Є—П –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л—Е –і–µ—В–µ–є —Б –Є–Љ–Љ—Г–љ–љ—Л–Љ–Є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є—П–Љ–Є –њ—А–µ–і—Г—Б–Љ–∞—В—А–Є–≤–∞–µ—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ–≥–Њ –µ–ґ–µ–і–љ–µ–≤–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П –Ј–∞ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ–Љ —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ –≤ —В–µ—З–µ–љ–Є–µ —А–∞–љ–љ–µ–≥–Њ –љ–µ–Њ–љ–∞—В–∞–ї—М–љ–Њ–≥–Њ –њ–µ—А–Є–Њ–і–∞. –Я—А–Є —В—П–ґ–µ–ї–Њ–є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–Є –Њ–±—П–Ј–∞—В–µ–ї—М–љ—Л —В–∞–Ї–ґ–µ –Ї–Њ–љ—В—А–Њ–ї—М –Ј–∞ –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ —Б—В–∞—В—Г—Б–Њ–Љ –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ–Њ–≥–Њ, –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –љ–µ–є—А–Њ—Б–Њ–љ–Њ–≥—А–∞—Д–Є–Є –Є –Њ—Б–Љ–Њ—В—А –≥–ї–∞–Ј–љ–Њ–≥–Њ –і–љ–∞ –≤ –і–Є–љ–∞–Љ–Є–Ї–µ. –Т —В–µ—Е —Б–ї—Г—З–∞—П—Е, –Ї–Њ–≥–і–∞ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ —Б–љ–Є–ґ–∞–µ—В—Б—П –і–Њ 50—Е109/–ї –Є –љ–Є–ґ–µ, –∞ –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є–є —Б–Є–љ–і—А–Њ–Љ –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г–µ—В, –њ–Њ–Ї–∞–Ј–∞–љ–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Ш–У–Т–Т. –Ф–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В –Ш–У–Т–Т –і–Њ—Б—В–Є–≥–∞–µ—В—Б—П –њ—А–Є –Ї—Г—А—Б–Њ–≤–Њ–є –і–Њ–Ј–µ 2 –≥/–Ї–≥, –Ї–Њ—В–Њ—А—Г—О –≤–≤–Њ–і—П—В –Ј–∞ 5 –µ–ґ–µ–і–љ–µ–≤–љ—Л—Е –Є–љ—Д—Г–Ј–Є–є (400 –Љ–≥/–Ї–≥/–≤–≤–µ–і–µ–љ–Є–µ) –Є–ї–Є –Ј–∞ 2 –µ–ґ–µ–і–љ–µ–≤–љ—Л—Е –≤–≤–µ–і–µ–љ–Є—П (1 –≥/–Ї–≥/–≤–≤–µ–і–µ–љ–Є–µ). –Я—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є —Н—Д—Д–µ–Ї—В–∞ –Њ—В –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–є —В–µ—А–∞–њ–Є–Є –Є–ї–Є –њ—А–Є –Є—Б—Е–Њ–і–љ–Њ –Ї—А–Є—В–Є—З–µ—Б–Ї–Є –љ–Є–Ј–Ї–Њ–Љ —Г—А–Њ–≤–љ–µ —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ –њ–Њ–Ї–∞–Ј–∞–љ–Њ —Б—А–Њ—З–љ–Њ–µ –≤–≤–µ–і–µ–љ–Є–µ –Њ—В–Љ—Л—В—Л—Е –Љ–∞—В–µ—А–Є–љ—Б–Ї–Є—Е —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ [8].
–Я—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ–Њ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ —В–Њ–Љ, —З—В–Њ –њ—А–Є —А–∞–Ј–≤–Є—В–Є–Є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–Є —Г –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ–Њ–≥–Њ —А–µ–±–µ–љ–Ї–∞ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ—А–Њ–≤–Њ–і–Є—В—М –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ—Г—О –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї—Г —Б —Ж–µ–ї—Л–Љ —А—П–і–Њ–Љ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Б–Њ—Б—В–Њ—П–љ–Є–є. –Я—А–Є —Н—В–Њ–Љ –љ–µ–ї—М–Ј—П –Ј–∞–±—Л–≤–∞—В—М –Њ —В–Њ–Љ, —З—В–Њ –≤ –Њ—Б–љ–Њ–≤–µ –љ–µ–Њ–љ–∞—В–∞–ї—М–љ—Л—Е —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–є –Љ–Њ–≥—Г—В –ї–µ–ґ–∞—В—М –Є–Љ–Љ—Г–љ–љ—Л–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л, –∞ –Є—Е —Б–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ–∞—П –≤–µ—А–Є—Д–Є–Ї–∞—Ж–Є—П –њ–Њ–Ј–≤–Њ–ї–Є—В –Є–Ј–±–µ–ґ–∞—В—М –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є—Е –Њ—И–Є–±–Њ–Ї –Є –љ–µ–∞–і–µ–Ї–≤–∞—В–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П.











