
–Т–≤–µ–і–µ–љ–Є–µ
–Ъ–∞–ґ–і—Л–є —А–µ–±–µ–љ–Њ–Ї –њ–µ—А–µ–љ–Њ—Б–Є—В 3вАУ8 —Н–њ–Є–Ј–Њ–і–Њ–≤ –Є–љ—Д–µ–Ї—Ж–Є–Є –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є (–Ш–Ф–Я) –Ј–∞ –≥–Њ–і, –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –Є–Ј –љ–Є—Е –Є–Љ–µ—О—В –≤–Є—А—Г—Б–љ—Г—О —Н—В–Є–Њ–ї–Њ–≥–Є—О [1]. –Ґ–Њ–ї—М–Ї–Њ 6вАУ8% –≤—Б–µ—Е –Ш–Ф–Я —Г –і–µ—В–µ–є –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ—Л –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–Љ–Є –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П–Љ–Є –Є —В—А–µ–±—Г—О—В –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є (–Р–С–Ґ) [2]. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –љ–µ–ї—М–Ј—П –Њ—Б—В–∞–≤–Є—В—М –±–µ–Ј –≤–љ–Є–Љ–∞–љ–Є—П –Ј–љ–∞—З–Є–Љ–Њ—Б—В—М –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –Ш–Ф–Я. –Э–∞–њ—А–Є–Љ–µ—А, —Б–Њ–≥–ї–∞—Б–љ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П PAPIRUS (Prospective Assessment of Pneumococcal Infection in Russia), –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В—М –њ–љ–µ–≤–Љ–Њ–љ–Є–µ–є –≤ –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –§–µ–і–µ—А–∞—Ж–Є–Є —Б–Њ—Б—В–∞–≤–ї—П–µ—В —З—Г—В—М –±–Њ–ї–µ–µ 530 —Б–ї—Г—З–∞–µ–≤ –љ–∞ 100 000 –і–µ—В–µ–є –і–Њ 5 –ї–µ—В [3]. –Т –°–®–Р –µ–ґ–µ–≥–Њ–і–љ–∞—П —З–∞—Б—В–Њ—В–∞ –њ–љ–µ–≤–Љ–Њ–љ–Є–Є —Б–Њ—Б—В–∞–≤–ї—П–µ—В 157 —Б–ї—Г—З–∞–µ–≤ –љ–∞ 100 000 –і–µ—В–µ–є, –љ–∞–Є–±–Њ–ї—М—И–∞—П —З–∞—Б—В–Њ—В–∞ –љ–∞–±–ї—О–і–∞–µ—В—Б—П —Г –і–µ—В–µ–є –і–Њ 2 –ї–µ—В (622 —Б–ї—Г—З–∞—П –љ–∞ 100 000) [4]. –Ю–≥—А–Њ–Љ–љ–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –њ—Г–±–ї–Є–Ї–∞—Ж–Є–є (–Є —А–Њ—Б—Б–Є–є—Б–Ї–Є—Е, –Є –Ј–∞—А—Г–±–µ–ґ–љ—Л—Е) –µ–ґ–µ–≥–Њ–і–љ–Њ –њ–Њ—Б–≤—П—Й–∞–µ—В—Б—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –Є –ї–µ—З–µ–љ–Є—О –Ш–Ф–Я –≤ –њ–µ–і–Є–∞—В—А–Є–Є, –љ–Њ –Є–љ—В–µ—А–µ—Б –≤—А–∞—З–µ–є –Ї –і–∞–љ–љ–Њ–є –њ—А–Њ–±–ї–µ–Љ–µ —Б –Ї–∞–ґ–і—Л–Љ –≥–Њ–і–Њ–Љ –љ–µ —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П, –∞ –ї–Є—И—М —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П. –Я—А–∞–Ї—В–Є–Ї–∞ —Б—В–∞–≤–Є—В –њ–µ—А–µ–і –≤—А–∞—З–∞–Љ–Є –≤–Њ–њ—А–Њ—Б—Л, –љ–∞ –Ї–Њ—В–Њ—А—Л–µ –љ–µ –≤—Б–µ–≥–і–∞ –Љ–Њ–ґ–љ–Њ –љ–∞–є—В–Є –Њ–і–љ–Њ–Ј–љ–∞—З–љ—Л–µ –Њ—В–≤–µ—В—Л. –Э–µ–Ї–Њ—В–Њ—А—Л–Љ –Є–Ј —Н—В–Є—Е –≤–Њ–њ—А–Њ—Б–Њ–≤ –њ–Њ—Б–≤—П—Й–µ–љ–∞ –і–∞–љ–љ–∞—П –њ—Г–±–ї–Є–Ї–∞—Ж–Є—П.
–Ь–Њ–ґ–µ—В –ї–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ –њ—А–Є –Њ—Б—В—А—Л—Е —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е (–Ю–†–Ч) –њ—А–µ–і–Њ—В–≤—А–∞—В–Є—В—М —А–∞–Ј–≤–Є—В–Є–µ –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є?
–Ю—В–≤–µ—В –љ–∞ –і–∞–љ–љ—Л–є –≤–Њ–њ—А–Њ—Б –њ—А–Є—Б—Г—В—Б—В–≤—Г–µ—В –≤ —Ж–µ–ї–Њ–Љ —А—П–і–µ —Б–Є—Б—В–µ–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Њ–±–Ј–Њ—А–Њ–≤, –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј–Њ–≤, —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л—Е –Є –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –Ї–Њ—В–Њ—А—Л–µ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є, —З—В–Њ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ –њ—А–Є –Ю–†–Ч –љ–µ –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞–µ—В —А–∞–Ј–≤–Є—В–Є–µ –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є. –Ґ–∞–Ї, –≤ –Ъ–Њ—Е—А–µ–є–љ–Њ–≤—Б–Ї–Њ–Љ –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј–µ (2013) –±—Л–ї —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–є —Н—Д—Д–µ–Ї—В –Њ—В –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ (–Р–С–Я) –њ—А–Є —В–Њ–љ–Ј–Є–ї–ї–Є—В–µ –Є —Д–∞—А–Є–љ–≥–Є—В–µ, –∞ –Є–Љ–µ–љ–љ–Њ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –≤ —Б—А–µ–і–љ–µ–Љ –љ–∞ 16 —З, –љ–Њ —Н—В–Њ –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –±—Л–ї–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ –≤–Ї–ї—О—З–µ–љ–Є–µ–Љ –≤ –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –≤ –Ї–Њ—В–Њ—А—Л—Е –Р–С–Я –љ–∞–Ј–љ–∞—З–∞–ї–Є—Б—М –њ—А–Є —В–Њ–љ–Ј–Є–ї–ї–Њ—Д–∞—А–Є–љ–≥–Є—В–µ, –≤—Л–Ј–≤–∞–љ–љ–Њ–Љ Streptococcus pyogenes [5]. –Р–≤—В–Њ—А—Л –Њ—В–Љ–µ—З–∞—О—В, —З—В–Њ –њ–Њ–ї—М–Ј–∞ –Њ—В –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Р–С–Я –њ—А–Є —В–Њ–љ–Ј–Є–ї–ї–Є—В–µ –Є —Д–∞—А–Є–љ–≥–Є—В–µ –≤–µ—Б—М–Љ–∞ —Б–Ї—А–Њ–Љ–љ–∞—П [5].
–І—В–Њ –Ї–∞—Б–∞–µ—В—Б—П –Њ—Б—В—А–Њ–≥–Њ —Б—А–µ–і–љ–µ–≥–Њ –Њ—В–Є—В–∞ (–Ю–°–Ю), —В–Њ –Њ—З–µ–љ—М –љ–∞–≥–ї—П–і–љ—Л–Љ–Є —П–≤–ї—П—О—В—Б—П —А–µ–Ј—Г–ї—М—В–∞—В—Л —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –Ї–Њ–≥–Њ—А—В–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–≥–Њ –≤ –Т–µ–ї–Є–Ї–Њ–±—А–Є—В–∞–љ–Є–Є –≤ 1990вАУ2006 –≥–≥. [6]. –Т —Е–Њ–і–µ –і–∞–љ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –±—Л–ї–∞ –њ—А–Њ–∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–∞ –±–∞–Ј–∞ –і–∞–љ–љ—Л—Е General Practice Research Database —Б –Њ–±—Й–Є–Љ —З–Є—Б–ї–Њ–Љ –і–µ—В–µ–є 2 622 348 (854 —А–µ–±–µ–љ–Ї–∞ —Б –Љ–∞—Б—В–Њ–Є–і–Є—В–Њ–Љ, –Є–Ј –љ–Є—Е —В–Њ–ї—М–Ї–Њ —Г 1/3 –±—Л–ї–∞ –Ї–ї–Є–љ–Є–Ї–∞ –Ю–°–Ю). –Ъ–∞–Ї –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М, –њ—А–Є –Ю–°–Ю –Њ—В–Љ–µ—З–∞–µ—В—Б—П –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–є —Н—Д—Д–µ–Ї—В –Њ—В –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Р–С–Я, –Њ–і–љ–∞–Ї–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–°–Ю, –Ї–Њ—В–Њ—А—Л—Е –љ–∞–і–Њ –њ—А–Њ–ї–µ—З–Є—В—М –і–ї—П –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є—П 1 —Б–ї—Г—З–∞—П –Љ–∞—Б—В–Њ–Є–і–Є—В–∞ (number needed to treat, NNT), —Б–Њ—Б—В–∞–≤–ї—П–µ—В 4831 [6]. –Х—Б–ї–Є –±—Л –Р–С–Я –≤–Њ–Њ–±—Й–µ –љ–µ –љ–∞–Ј–љ–∞—З–∞–ї–Є—Б—М –њ—А–Є –Ю–°–Ю, —В–Њ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –≤–Њ–Ј–љ–Є–Ї–ї–Њ –±—Л 255 —Б–ї—Г—З–∞–µ–≤ –Љ–∞—Б—В–Њ–Є–і–Є—В–∞, –љ–Њ –њ—А–Є —Н—В–Њ–Љ –≤ –Т–µ–ї–Є–Ї–Њ–±—А–Є—В–∞–љ–Є–Є –≤ –≥–Њ–і —Б—В–∞–ї–Њ –±—Л –љ–∞ 738 775 –љ–∞–Ј–љ–∞—З–µ–љ–Є–є –Р–С–Я –Љ–µ–љ—М—И–µ [6].
–Т —Е–Њ–і–µ –µ—Й–µ –Њ–і–љ–Њ–≥–Њ —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –Ї–Њ–≥–Њ—А—В–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–≥–Њ –≤ –Т–µ–ї–Є–Ї–Њ–±—А–Є—В–∞–љ–Є–Є, –±—Л–ї–Є –њ—А–Њ¬≠–∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ—Л —Б–≤–µ–і–µ–љ–Є—П –Њ 3,36 –Љ–ї–љ —Н–њ–Є–Ј–Њ–і–Њ–≤ –Ш–Ф–Я —Г –і–µ—В–µ–є –Є –≤–Ј—А–Њ—Б–ї—Л—Е, —В–∞–Ї–ґ–µ –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ –Є–Ј –±–∞–Ј—Л –і–∞–љ–љ—Л—Е General Practice Research Database [7]. –Ъ–∞–Ї –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М, –њ–Њ—Б–ї–µ –Є–љ—Д–µ–Ї—Ж–Є–є –≤–µ—А—Е–љ–Є—Е –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є, —В–Њ–љ–Ј–Є–ї–ї–Є—В–∞, —Д–∞—А–Є–љ–≥–Є—В–∞ –Є –Ю–°–Ю —Б–µ—А—М–µ–Ј–љ—Л–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П –≤–Њ–Ј–љ–Є–Ї–∞—О—В —А–µ–і–Ї–Њ, –љ–Њ –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ–∞—П –њ–Њ–ї—М–Ј–∞ –Њ—В –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Р–С–Я –њ—А–Є—Б—Г—В—Б—В–≤—Г–µ—В, –њ—А–Є —Н—В–Њ–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М NNT —Б–Њ—Б—В–∞–≤–ї—П–µ—В >4000 [7]. –Э–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –±—Л–ї —Б–і–µ–ї–∞–љ –≤—Л–≤–Њ–і –Њ —В–Њ–Љ, —З—В–Њ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Р–С–Я –і–ї—П —Б–љ–Є–ґ–µ–љ–Є—П —А–Є—Б–Ї–∞ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П —Б–µ—А—М–µ–Ј–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Є–љ—Д–µ–Ї—Ж–Є–є –≤–µ—А—Е–љ–Є—Е –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є –љ–µ—Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ [7].
–Ъ–Њ—Е—А–µ–є–љ–Њ–≤—Б–Ї–Є–є –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ 11 —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –≤ –Ї–Њ—В–Њ—А–Њ–Љ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М —Б—А–∞–≤–љ–µ–љ–Є–µ –Р–С–Ґ —Б –њ–ї–∞—Ж–µ–±–Њ –њ—А–Є –ї–µ—З–µ–љ–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Б–Є–Љ–њ—В–Њ–Љ–∞–Љ–Є –Њ—Б—В—А–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є –≤–µ—А—Е–љ–Є—Е –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М—О –і–Њ 7 –і–љ–µ–є –Є–ї–Є –Њ—Б—В—А–Њ–≥–Њ –≥–љ–Њ–є–љ–Њ–≥–Њ —А–Є–љ–Є—В–∞ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М—О –і–Њ 10 –і–љ–µ–є, –љ–µ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї –њ–Њ–ї—М–Ј—Г –Њ—В –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Р–С–Я –њ—А–Є –њ—А–Њ—Б—В—Г–і–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –≤ –≥—А—Г–њ–њ–µ –Р–С–Ґ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≥—А—Г–њ–њ–Њ–є –њ–ї–∞—Ж–µ–±–Њ –±—Л–ї–∞ –≤—Л—И–µ —З–∞—Б—В–Њ—В–∞ –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є [8].
–Х—Й–µ –≤ –Њ–і–љ–Њ–Љ –Ъ–Њ—Е—А–µ–є–љ–Њ–≤—Б–Ї–Њ–Љ –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј–µ (2017 –≥., 17 –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, 5099 —Г—З–∞—Б—В–љ–Є–Ї–Њ–≤) –±—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –Є–Љ–µ—О—В—Б—П –Њ–≥—А–∞–љ–Є—З–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ –Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ–Њ–ї—М–Ј–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Р–С–Я –њ—А–Є –Њ—Б—В—А–Њ–Љ –±—А–Њ–љ—Е–Є—В–µ (—Б–Њ–Ї—А–∞—Й–µ–љ–Є–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –Є –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Ї–∞—И–ї—П, –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –љ–∞ 0,64 –і–љ—П –Є –њ–µ—А–Є–Њ–і–∞ –љ–∞—А—Г—И–µ–љ–љ–Њ–є –њ–Њ–≤—Б–µ–і–љ–µ–≤–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –љ–∞ 0,49 –і–љ—П), –Њ–і–љ–∞–Ї–Њ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ –Њ—В –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Р–С–Ґ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М –≤ –±–Њ–ї–µ–µ —И–Є—А–Њ–Ї–Њ–Љ –Ї–Њ–љ—В–µ–Ї—Б—В–µ –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ—Л—Е –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є, —З—А–µ–Ј–Љ–µ—А–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤ –і–ї—П –ї–µ—З–µ–љ–Є—П —Б–Њ—Б—В–Њ—П–љ–Є–є, –Ї–Њ—В–Њ—А—Л–µ –њ—А–Њ–є–і—Г—В –Є –±–µ–Ј –ї–µ—З–µ–љ–Є—П, –∞ —В–∞–Ї–ґ–µ —А–Њ—Б—В–∞ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є (–Р–С–†) —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л—Е –њ–∞—В–Њ–≥–µ–љ–Њ–≤ –Є —Г–і–Њ—А–Њ–ґ–∞–љ–Є—П —Б—В–Њ–Є–Љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П [9].
–С–Њ–ї–µ–µ —В–Њ–≥–Њ, —А–µ–Ј—Г–ї—М—В–∞—В—Л –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є, —З—В–Њ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Р–С–Я –њ—А–Є –Ю–†–Ч –њ–Њ–≤—Л—И–∞–µ—В —А–Є—Б–Ї –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є [10вАУ13]. –†–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л–є —В—А–∞–Ї—В –Ј–і–Њ—А–Њ–≤–Њ–≥–Њ —З–µ–ї–Њ–≤–µ–Ї–∞ —Б–Њ–і–µ—А–ґ–Є—В –±–Њ–ї–µ–µ 140 —А–∞–Ј–ї–Є—З–љ—Л—Е –≥–µ–љ–Њ–Љ–Њ–≤ –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤, –±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–µ –і–µ—А–µ–≤–Њ —Б–Њ–і–µ—А–ґ–Є—В –≤ —Б—А–µ–і–љ–µ–Љ 2000 –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –≥–µ–љ–Њ–Љ–Њ–≤ –љ–∞ 1 —Б–Љ2 –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є, –∞ –≤–Њ–Ј–љ–Є–Ї–∞—О—Й–Є–є –і–Є—Б–±–Є–Њ–Ј —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞, –ґ–µ–ї—Г–і–Њ—З–љ–Њ-–Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ (–Ц–Ъ–Ґ) –Є –Ї–Њ–ґ–Є –љ–∞ —Д–Њ–љ–µ –Р–С–Ґ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–Љ—Г —А–∞–Ј–≤–Є—В–Є—О –њ–∞—В–Њ–≥–µ–љ–љ–Њ–є –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є, –∞ —В–∞–Ї–ґ–µ –∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Њ–є –њ—А–µ–і—А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ–Њ—Б—В–Є [10, 13].
–Т–ї–Є—П–µ—В –ї–Є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л—Е –њ–∞—В–Њ–≥–µ–љ–Њ–≤ –љ–∞ –≤—Л–±–Њ—А –њ—А–µ–њ–∞—А–∞—В–∞ –і–ї—П –ї–µ—З–µ–љ–Є—П –Ш–Ф–Я –≤ –∞–Љ–±—Г–ї–∞—В–Њ—А–љ–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ?
–Э–µ—Б–Њ–Љ–љ–µ–љ–љ–Њ, –Ї–ї–Є–љ–Є—Ж–Є—Б—В—Г –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Є–Љ–µ—В—М —З–µ—В–Ї–Є–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є—П –Њ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В—Л—Е –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є –Ш–Ф–Я, –∞ –Є–Љ–µ–љ–љ–Њ Streptococcus pneumoniae, S. pyogenes –Є Haemophilus influenzae. –Э–∞–Є–±–Њ–ї–µ–µ –Є–љ—Д–Њ—А–Љ–∞—В–Є–≤–љ—Л–Љ –Є—Б—В–Њ—З–љ–Є–Ї–Њ–Љ –і–∞–љ–љ—Л—Е –њ–Њ –Р–С–† —А–∞–Ј–ї–Є—З–љ—Л—Е –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –њ–∞—В–Њ–≥–µ–љ–Њ–≤ –≤ –†–§ —П–≤–ї—П–µ—В—Б—П online ¬Ђ–Ъ–∞—А—В–∞ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –†–Њ—Б—Б–Є–Є¬ї вАФ AMRmap (–і–Њ—Б—В—Г–њ–љ–∞ –њ–Њ —Б—Б—Л–ї–Ї–µ www.map.antibiotic.ru), –Ї–Њ—В–Њ—А–∞—П —А–∞–Ј—А–∞–±–Њ—В–∞–љ–∞ —Б–Њ–≤–Љ–µ—Б—В–љ–Њ –Э–Ш–Ш –∞–љ—В–Є–Љ–Є–Ї—А–Њ–±–љ–Њ–є —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є –Є –Ь–µ–ґ—А–µ–≥–Є–Њ–љ–∞–ї—М–љ–Њ–є –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є–µ–є –њ–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Љ–Є–Ї—А–Њ–±–Є–Њ–ї–Њ–≥–Є–Є –Є –∞–љ—В–Є–Љ–Є–Ї—А–Њ–±–љ–Њ–є —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є [14]. –Ф–∞–ї–µ–µ –±—Г–і–µ—В –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—П –њ–Њ –Р–С–† —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л—Е –њ–∞—В–Њ–≥–µ–љ–Њ–≤ –≤ –†–§ –Ј–∞ –њ–µ—А–Є–Њ–і —Б 2013 –њ–Њ 2018 –≥. –њ–Њ –і–∞–љ–љ—Л–Љ –∞–љ–∞–ї–Є–Ј–∞ AMRmap, –∞ —В–∞–Ї–ґ–µ –њ–Њ –і—А—Г–≥–Є–Љ –њ—Г–±–ї–Є–Ї–∞—Ж–Є—П–Љ –њ–Њ –і–∞–љ–љ–Њ–є –њ—А–Њ–±–ї–µ–Љ–∞—В–Є–Ї–µ –Ј–∞ —Г–Ї–∞–Ј–∞–љ–љ—Л–є –њ–µ—А–Є–Њ–і –≤—А–µ–Љ–µ–љ–Є.
–° 2013 –њ–Њ 2018 –≥. –≤ –Э–Ш–Ш –∞–љ—В–Є–Љ–Є–Ї—А–Њ–±–љ–Њ–є —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є –±—Л–ї —Б–Њ–±—А–∞–љ –Є –њ—А–Њ—В–µ—Б—В–Є—А–Њ–≤–∞–љ 561 —И—В–∞–Љ–Љ S. pyogenes, –≤—Л–і–µ–ї–µ–љ–љ—Л–є –њ—А–Є –Ш–Ф–Я –Є –Є–љ—Д–µ–Ї—Ж–Є—П—Е –Ы–Ю–†-–Њ—А–≥–∞–љ–Њ–≤ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 0 –і–Њ 18 –ї–µ—В (—А–Є—Б. 1). –Т—Б–µ –Є–Ј–Њ–ї—П—В—Л ќ≤-–≥–µ–Љ–Њ–ї–Є—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Б—В—А–µ–њ—В–Њ–Ї–Њ–Ї–Ї–∞ —Б–µ—А–Њ–≥—А—Г–њ–њ—Л –Р (–С–У–°–Р) —Б–Њ—Е—А–∞–љ—П–ї–Є —Г–љ–Є–≤–µ—А—Б–∞–ї—М–љ—Г—О —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ї–Њ –≤—Б–µ–Љ ќ≤-–ї–∞–Ї—В–∞–Љ–љ—Л–Љ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ, –∞ —В–∞–Ї–ґ–µ –Ї –≤–∞–љ–Ї–Њ–Љ–Є—Ж–Є–љ—Г –Є –ї–Є–љ–µ–Ј–Њ–ї–Є–і—Г. –Э–∞–Є–±–Њ–ї—М—И–Є–є —Г—А–Њ–≤–µ–љ—М —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В–Є –Њ—В–Љ–µ—З–µ–љ –Ї –њ—А–µ–њ–∞—А–∞—В–∞–Љ —В–µ—В—А–∞—Ж–Є–Ї–ї–Є–љ–Њ–≤–Њ–≥–Њ —А—П–і–∞ (–Њ–Ї–Њ–ї–Њ 14% –љ–µ—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л—Е —И—В–∞–Љ–Љ–Њ–≤) –Є –Ї –Љ–∞–Ї—А–Њ–ї–Є–і–∞–Љ (–Њ–Ї–Њ–ї–Њ 12% —И—В–∞–Љ–Љ–Њ–≤, –љ–µ—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л—Е –Ї —Н—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ—Г).
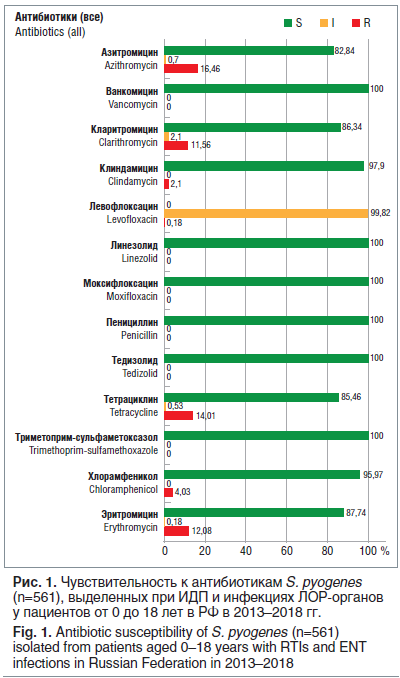
–Я–Њ –і–∞–љ–љ—Л–Љ AMRmap, –Ј–∞ —Г–Ї–∞–Ј–∞–љ–љ—Л–є –њ–µ—А–Є–Њ–і —Б—А–µ–і–Є –њ—А–Њ—В–µ—Б—В–Є—А–Њ–≤–∞–љ–љ—Л—Е 242 –Є–Ј–Њ–ї—П—В–Њ–≤ H. influenzae —А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л–Љ–Є –Ї –∞–Љ–њ–Є—Ж–Є–ї–ї–Є–љ—Г –±—Л–ї–Є 12,8% —И—В–∞–Љ–Љ–Њ–≤. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П, –њ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П SOAR (Survey of Antibiotic Resistance), –≤ –Ї–Њ—В–Њ—А–Њ–Љ –±—Л–ї–Є –Є–Ј—Г—З–µ–љ—Л 279 —И—В–∞–Љ–Љ–Њ–≤ –≥–µ–Љ–Њ—Д–Є–ї—М–љ–Њ–є –њ–∞–ї–Њ—З–Ї–Є, –≤—Л–і–µ–ї–µ–љ–љ—Л—Е –≤ –†–§ –≤ 2014вАУ2016 –≥–≥., –љ–µ—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л–Љ–Є –Ї –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ—Г –Њ–Ї–∞–Ј–∞–ї–Є—Б—М 19% –Є–Ј–Њ–ї—П—В–Њ–≤, –њ—А–Є —Н—В–Њ–Љ –њ—А–Њ–і—Г–Ї—Ж–Є—П ќ≤-–ї–∞–Ї—В–∞–Љ–∞–Ј –±—Л–ї–∞ –Њ–±–љ–∞—А—Г–ґ–µ–љ–∞ —Г 15,4% —И—В–∞–Љ–Љ–Њ–≤ [15]. –Р–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ/–Ї–ї–∞–≤—Г–ї–∞–љ–∞—В —Б–Њ—Е—А–∞–љ—П–ї –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–Њ—В–Є–≤ –±–Њ–ї–µ–µ —З–µ–Љ 97,5% –Є–Ј–Њ–ї—П—В–Њ–≤ H. influenzae.
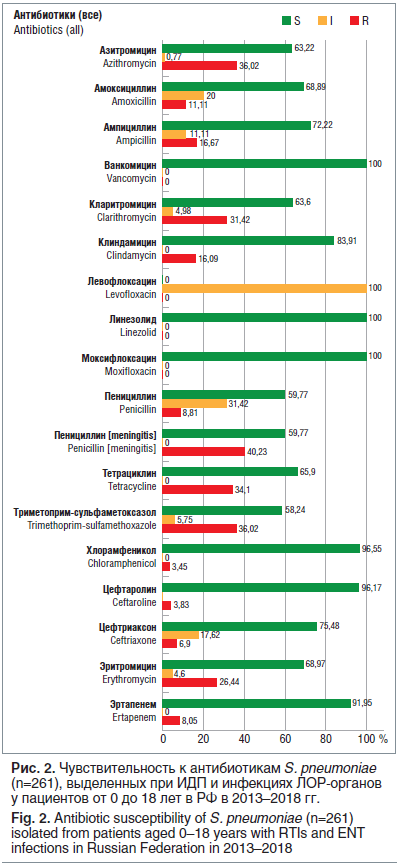
AMRmap —В–∞–Ї–ґ–µ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Є–Ј—Г—З–∞—В—М –і–Є–љ–∞–Љ–Є–Ї—Г –Р–С–† —А–∞–Ј–ї–Є—З–љ—Л—Е –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є. –Я—А–Є –∞–љ–∞–ї–Є–Ј–µ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Ї –Р–С–Я –њ–љ–µ–≤–Љ–Њ–Ї–Њ–Ї–Ї–Њ–≤, –≤—Л–і–µ–ї–µ–љ–љ—Л—Е –≤ –њ–µ–і–Є–∞—В—А–Є—З–µ—Б–Ї–Њ–є –њ–Њ–њ—Г–ї—П—Ж–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ 2013вАУ2018 –≥–≥., –Њ—В–Љ–µ—З–µ–љ—Л —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤ –Р–С–† –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –±–Њ–ї–µ–µ —А–∞–љ–љ–Є–Љ–Є –њ–µ—А–Є–Њ–і–∞–Љ–Є –≤—А–µ–Љ–µ–љ–Є.
–Ґ–∞–Ї, –Ј–∞–Љ–µ—В–љ–Њ –≤—Л—А–Њ—Б–ї–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В–Є S. pneumoniae –Ї –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ—Г: –≤ —Б—А–µ–і–љ–µ–Љ –њ–Њ –†–Њ—Б—Б–Є–Є —З–∞—Б—В–Њ—В–∞ —Г–Љ–µ—А–µ–љ–љ–Њ —А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л—Е —И—В–∞–Љ–Љ–Њ–≤ —Б–Њ—Б—В–∞–≤–ї—П–µ—В –±–Њ–ї–µ–µ 30%, –∞ —А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л—Е вАФ –њ–Њ—З—В–Є 9%. –†–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є–µ –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л—Е –њ–љ–µ–≤–Љ–Њ–Ї–Њ–Ї–Ї–Њ–≤ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ —З–Є—Б–ї–∞ –Є–Ј–Њ–ї—П—В–Њ–≤, –љ–µ—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л—Е –Ї –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ—Л–Љ —Ж–µ—Д–∞–ї–Њ—Б–њ–Њ—А–Є–љ–∞–Љ III –њ–Њ–Ї–Њ–ї–µ–љ–Є—П (—Ж–µ—Д—В—А–Є–∞–Ї—Б–Њ–љ—Г), вАФ 17,6% —Г–Љ–µ—А–µ–љ–љ–Њ —А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л—Е –Є 6,9% —А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л—Е –Є–Ј–Њ–ї—П—В–Њ–≤. –І–∞—Б—В–Њ—В–∞ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Ї –Љ–∞–Ї—А–Њ–ї–Є–і–∞–Љ –њ–Њ –†–§ –њ—А–µ–≤—Л—Б–Є–ї–∞ 30% (—А–Є—Б. 2).
–Э—Г–ґ–љ–Њ –ї–Є –Є—Б–Ї–ї—О—З–Є—В—М –Љ–∞–Ї—А–Њ–ї–Є–і—Л –Є–Ј –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –≤ –њ–µ–і–Є–∞—В—А–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –≤ —Б–≤—П–Ј–Є —Б —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є–µ–Љ –Љ–∞–Ї—А–Њ–ї–Є–і–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л—Е —И—В–∞–Љ–Љ–Њ–≤ –њ–љ–µ–≤–Љ–Њ–Ї–Њ–Ї–Ї–∞?
–Э–µ—Б–Њ–Љ–љ–µ–љ–љ–Њ, –љ–µ–ї—М–Ј—П –Є–≥–љ–Њ—А–Є—А–Њ–≤–∞—В—М –њ–Њ—П–≤–Є–≤—И–Є–µ—Б—П –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ 5 –ї–µ—В —В—А–µ–≤–Њ–ґ–љ—Л–µ —В–µ–љ–і–µ–љ—Ж–Є–Є, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є —А–Њ—Б—В —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –њ–љ–µ–≤–Љ–Њ–Ї–Њ–Ї–Ї–Њ–≤ –Ї –Љ–∞–Ї—А–Њ–ї–Є–і–∞–Љ (–Њ–Ї–Њ–ї–Њ 30% –≤ –њ–µ–і–Є–∞—В—А–Є—З–µ—Б–Ї–Њ–є –њ–Њ–њ—Г–ї—П—Ж–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤). –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ –Љ–∞–Ї—А–Њ–ї–Є–і—Л –њ–Њ—В–µ—А—П–ї–Є –њ–Њ–Ј–Є—Ж–Є–Є —Б—В–∞—А—В–Њ–≤—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ—А–Є —Н–Љ–њ–Є—А–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є –Ш–Ф–Я –Є –Є–љ—Д–µ–Ї—Ж–Є–є –Ы–Ю–†-–Њ—А–≥–∞–љ–Њ–≤ —Г –і–µ—В–µ–є.
–Ь–∞–Ї—А–Њ–ї–Є–і—Л –љ–µ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П –≤ –Х–≤—А–Њ–њ–µ–є—Б–Ї–Є—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е –њ–Њ —А–Є–љ–Њ—Б–Є–љ—Г—Б–Є—В—Г 2012 –≥. (European position paper on rhinosinusitis and nasal polyps, EPOS) –Є –†—Г–Ї–Њ–≤–Њ–і—Б—В–≤–µ –њ–Њ –≤–µ–і–µ–љ–Є—О –≤–Ј—А–Њ—Б–ї—Л—Е –Є –і–µ—В–µ–є —Б –Њ—Б—В—А—Л–Љ –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–Љ —А–Є–љ–Њ—Б–Є–љ—Г—Б–Є—В–Њ–Љ 2012 –≥., —А–∞–Ј—А–∞–±–Њ—В–∞–љ–љ—Л—Е –Р–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Є–Љ –Њ–±—Й–µ—Б—В–≤–Њ–Љ –њ–Њ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–Љ –±–Њ–ї–µ–Ј–љ—П–Љ (The Infectious Diseases Society of America, IDSA), –Ї–∞–Ї –њ—А–µ–њ–∞—А–∞—В—Л –і–ї—П —Н–Љ–њ–Є—А–Є—З–µ—Б–Ї–Њ–є –Р–С–Ґ —А–Є–љ–Њ—Б–Є–љ—Г—Б–Є—В–∞, —З—В–Њ —А–∞–љ–µ–µ —Г–ґ–µ –Њ–±—Б—Г–ґ–і–∞–ї–Њ—Б—М –≤ —А–Њ—Б—Б–Є–є—Б–Ї–Є—Е –њ—Г–±–ї–Є–Ї–∞—Ж–Є—П—Е [16, 17].
–Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –љ–µ–ї—М–Ј—П –њ–Њ–ї–љ–Њ—Б—В—М—О –Є—Б–Ї–ї—О—З–Є—В—М —Ж–µ–ї—Л–є –Ї–ї–∞—Б—Б –Р–С–Я –Є–Ј –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П. –Т –Ш—Б–њ–∞–љ–Є–Є —Г—А–Њ–≤–µ–љ—М –љ–µ—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є S. pneumoniae —Б–Њ—Б—В–∞–≤–ї—П–µ—В 25вАУ30%, –Њ–і–љ–∞–Ї–Њ –Љ–∞–Ї—А–Њ–ї–Є–і—Л (–∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ –Є–ї–Є –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ) –њ—А–Є—Б—Г—В—Б—В–≤—Г—О—В –≤ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е –њ–Њ —В–µ—А–∞–њ–Є–Є –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ —Б–Є–љ—Г—Б–Є—В–∞ –њ—А–Є –∞–ї–ї–µ—А–≥–Є–Є –љ–∞ ќ≤-–ї–∞–Ї—В–∞–Љ—Л [18]. –Т –Ъ–∞–љ–∞–і–µ –∞–љ–∞–ї–Њ–≥–Є—З–љ–∞—П —Б–Є—В—Г–∞—Ж–Є—П: –њ—А–Є —Г—А–Њ–≤–љ–µ –љ–µ—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Ї –Љ–∞–Ї—А–Њ–ї–Є–і–∞–Љ, —А–∞–≤–љ–Њ–Љ 19вАУ23%, –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ –Є –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ –Њ—Б—В–∞—О—В—Б—П –≤ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е –њ–Њ —В–µ—А–∞–њ–Є–Є —А–Є–љ–Њ—Б–Є–љ—Г—Б–Є—В–∞ –њ—А–Є –љ–µ–њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є ќ≤-–ї–∞–Ї—В–∞–Љ–љ—Л—Е –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ [19].
–Т –Ш—В–∞–ї–Є–Є —Г—А–Њ–≤–µ–љ—М —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є S. pyogenes –Ї –Љ–∞–Ї—А–Њ–ї–Є–і–∞–Љ —Б–Њ—Б—В–∞–≤–ї—П–ї –≤ 2000 –≥. 38,6%, –≤ 2012вАУ2013 –≥–≥. вАФ 7,4%, S. pneumoniae вАФ 25%, –њ—А–Є —Н—В–Њ–Љ –Љ–∞–Ї—А–Њ–ї–Є–і—Л –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –њ—А–Є –С–У–°–Р-—В–Њ–љ–Ј–Є–ї–ї–Њ—Д–∞—А–Є–љ–≥–Є—В–µ –Є –Ю–°–Ю –≤ –Ї–∞—З–µ—Б—В–≤–µ –∞–ї—М—В–µ—А–љ–∞—В–Є–≤–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ—А–Є –∞–ї–ї–µ—А–≥–Є–Є –љ–∞ ќ≤-–ї–∞–Ї—В–∞–Љ—Л (–Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ –Є–ї–Є –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ). –Р —З—В–Њ –Ї–∞—Б–∞–µ—В—Б—П –≤–љ–µ–±–Њ–ї—М–љ–Є—З–љ–Њ–є –њ–љ–µ–≤–Љ–Њ–љ–Є–Є, —В–Њ —Г –і–µ—В–µ–є 1вАУ3 –Љ–µ—Б. –Є 5вАУ18 –ї–µ—В –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ –Є –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П –Ї–∞–Ї –њ—А–µ–њ–∞—А–∞—В—Л –≤—Л–±–Њ—А–∞ –љ–∞—А—П–і—Г —Б –∞–Љ–Є–љ–Њ–њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–∞–Љ–Є [20].
–Я—А–Є–Љ–µ—А–Њ–Љ –∞–љ–∞–ї–Њ–≥–Є—З–љ–Њ–≥–Њ –њ–Њ–і—Е–Њ–і–∞ –Ї –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—О –Љ–∞–Ї—А–Њ–ї–Є–і–Њ–≤ —П–≤–ї—П—О—В—Б—П —А–Њ—Б—Б–Є–є—Б–Ї–Є–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –Э–∞—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є –Њ—В–Њ—А–Є–љ–Њ–ї–∞—А–Є–љ–≥–Њ–ї–Њ–≥–Њ–≤ ¬Ђ–Ю—Б—В—А—Л–є —Б–Є–љ—Г—Б–Є—В¬ї, –≥–і–µ —Г–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –Љ–∞–Ї—А–Њ–ї–Є–і—Л (–∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ, –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ, –і–ґ–Њ–Ј–∞–Љ–Є—Ж–Є–љ) —Б–ї–µ–і—Г–µ—В –њ—А–Є–Љ–µ–љ—П—В—М –њ—А–Є –Њ—Б—В—А–Њ–Љ —Б–Є–љ—Г—Б–Є—В–µ —Г –і–µ—В–µ–є –≤ —Б–ї—Г—З–∞–µ –∞–ї–ї–µ—А–≥–Є–Є –љ–∞ ќ≤-–ї–∞–Ї—В–∞–Љ—Л [21]. –Ъ–Њ–љ–µ—З–љ–Њ –ґ–µ, –Њ –Љ–∞–Ї—А–Њ–ї–Є–і–∞—Е —Б–ї–µ–і—Г–µ—В –њ–Њ–Љ–љ–Є—В—М –Є –≤ —Б–ї—Г—З–∞—П—Е, –Ї–Њ–≥–і–∞ –Ш–Ф–Я (–≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М –≤–љ–µ–±–Њ–ї—М–љ–Є—З–љ–∞—П –њ–љ–µ–≤–Љ–Њ–љ–Є—П) –≤—Л–Ј–≤–∞–љ—Л –∞—В–Є–њ–Є—З–љ—Л–Љ–Є –њ–∞—В–Њ–≥–µ–љ–∞–Љ–Є (Mycoplasma pneumoniae, Chlamydophila pneumoniae).
–І—В–Њ –ї—Г—З—И–µ –љ–∞–Ј–љ–∞—З–Є—В—М вАФ –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ –Є–ї–Є –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ/–Ї–ї–∞–≤—Г–ї–∞–љ–∞—В?
–Я—А–Є –Њ—В–≤–µ—В–µ –љ–∞ —Н—В–Њ—В –≤–Њ–њ—А–Њ—Б –љ—Г–ґ–љ–Њ –њ—А–Є–љ–Є–Љ–∞—В—М –≤–Њ –≤–љ–Є–Љ–∞–љ–Є–µ –Ї–∞–Ї —З–∞—Б—В–Њ—В—Г –љ–µ—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є H. influenzae –Ї –∞–Љ–њ–Є—Ж–Є–ї–ї–Є–љ—Г (12,8%, –∞ –њ–Њ –і–∞–љ–љ—Л–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П SOAR вАФ 19% –Є–Ј–Њ–ї—П—В–Њ–≤, –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –Є–Ј –љ–Є—Е –њ—А–Њ–і—Г—Ж–Є—А–Њ–≤–∞–ї–Є ќ≤-–ї–∞–Ї—В–∞–Љ–∞–Ј—Л), —В–∞–Ї –Є –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л–µ —Д–∞–Ї—В–Њ—А—Л —А–Є—Б–Ї–∞ –љ–∞–ї–Є—З–Є—П —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ–є —Д–ї–Њ—А—Л —Г –њ–µ–і–Є–∞—В—А–Є—З–µ—Б–Ї–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ [22]:
–њ—А–Є–µ–Љ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ –≤ —В–µ—З–µ–љ–Є–µ –њ—А–µ–і—И–µ—Б—В–≤—Г—О—Й–Є—Е 3 –Љ–µ—Б.;
–≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є—П –≤ —В–µ—З–µ–љ–Є–µ –њ—А–µ–і—И–µ—Б—В–≤—Г—О—Й–Є—Е 3 –Љ–µ—Б.;
–ї–µ—З–µ–љ–Є–µ –≤ –і–љ–µ–≤–љ—Л—Е —Б—В–∞—Ж–Є–Њ–љ–∞—А–∞—Е –њ–Њ–ї–Є–Ї–ї–Є–љ–Є–Ї;
–њ–Њ—Б–µ—Й–µ–љ–Є–µ –і–µ—В—Б–Ї–Є—Е –і–Њ—И–Ї–Њ–ї—М–љ—Л—Е —Г—З—А–µ–ґ–і–µ–љ–Є–є;
–Ї–Њ–љ—В–∞–Ї—В —Б –і–µ—В—М–Љ–Є, –њ–Њ—Б–µ—Й–∞—О—Й–Є–Љ–Є –і–µ—В—Б–Ї–Є–µ –і–Њ—И–Ї–Њ–ї—М–љ—Л–µ —Г—З—А–µ–ґ–і–µ–љ–Є—П;
–Є–Љ–Љ—Г–љ–Њ—Б—Г–њ—А–µ—Б—Б–Є–≤–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П/—Б–Њ—Б—В–Њ—П–љ–Є—П;
—Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Њ—А–≥–∞–љ–Њ–≤ –і—Л—Е–∞–љ–Є—П (–±—А–Њ–љ—Е–Є–∞–ї—М–љ–∞—П –∞—Б—В–Љ–∞);
—Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В;
–љ–µ–і–∞–≤–љ–Є–µ –њ—Г—В–µ—И–µ—Б—В–≤–Є—П.
–Я—А–Є –ї–µ—З–µ–љ–Є–Є —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л–Љ–Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є —А–Є—Б–Ї–∞ –љ–µ–Ј–∞—Й–Є—Й–µ–љ–љ—Л–µ –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ—Л –Љ–Њ–≥—Г—В –Њ–Ї–∞–Ј–∞—В—М—Б—П –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ–Є, –њ–Њ—Н—В–Њ–Љ—Г –≤—Л–±–Њ—А —Б—В–∞—А—В–Њ–≤–Њ–є —В–µ—А–∞–њ–Є–Є —А–µ—И–∞–µ—В—Б—П –≤ –њ–Њ–ї—М–Ј—Г –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ —Б –±–Њ–ї–µ–µ —И–Є—А–Њ–Ї–Є–Љ –Љ–Є–Ї—А–Њ–±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ —Б–њ–µ–Ї—В—А–Њ–Љ –Є —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–Љ–Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—П–Љ–Є вАФ –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞/–Ї–ї–∞–≤—Г–ї–∞–љ–∞—В–∞ [22].
–Т —Ж–µ–ї–Њ–Љ –≤ –†–§ –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ –≤ –Ї–∞—З–µ—Б—В–≤–µ —Б—В–∞—А—В–Њ–≤–Њ–є —В–µ—А–∞–њ–Є–Є –Њ—Б—В–∞–µ—В—Б—П –њ—А–Є–Њ—А–Є—В–µ—В–љ—Л–Љ –≤ —Б–ї—Г—З–∞—П—Е –љ–µ—В—П–ґ–µ–ї–Њ–≥–Њ —В–µ—З–µ–љ–Є—П –Є–љ—Д–µ–Ї—Ж–Є–Є, –Ї–Њ–≥–і–∞ –Њ—В—Б—Г—В—Б—В–≤—Г—О—В —Д–∞–Ї—В–Њ—А—Л —А–Є—Б–Ї–∞ –Є–љ—Д–µ–Ї—Ж–Є–Є, –≤—Л–Ј–≤–∞–љ–љ–Њ–є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л–Љ–Є –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П–Љ–Є. –Я—А–Є –љ–∞–ї–Є—З–Є–Є —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ –Є–љ—Д–µ–Ї—Ж–Є–Є, –≤—Л–Ј–≤–∞–љ–љ–Њ–є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л–Љ–Є –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П–Љ–Є, –∞ —В–∞–Ї–ґ–µ –њ—А–Є –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Б—В–∞—А—В–Њ–≤–Њ–є –Р–С–Ґ —Б–ї–µ–і—Г–µ—В —А–∞—Б—Б–Љ–Њ—В—А–µ—В—М –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞/–Ї–ї–∞–≤—Г–ї–∞–љ–∞—В–∞ [22].
–Э—Г–ґ–љ—Л –ї–Є –≤ –†–Њ—Б—Б–Є–Є –≤—Л—Б–Њ–Ї–Є–µ –і–Њ–Ј—Л –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞ –Є–ї–Є –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞/–Ї–ї–∞–≤—Г–ї–∞–љ–∞—В–∞?
–Э–∞ —Н—В–Њ—В –≤–Њ–њ—А–Њ—Б –≤ –љ–∞—Б—В–Њ—П—Й–Є–є –Љ–Њ–Љ–µ–љ—В –љ–µ—В –Њ–і–љ–Њ–Ј–љ–∞—З–љ–Њ–≥–Њ –Њ—В–≤–µ—В–∞. –° –Њ–і–љ–Њ–є —Б—В–Њ—А–Њ–љ—Л, —А–Њ—Б—В –Р–С–† –Є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є–µ —Г–Љ–µ—А–µ–љ–љ–Њ —А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л—Е (>30%) –Є —А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л—Е (9%) –Ї –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ—Г —И—В–∞–Љ–Љ–Њ–≤ S. pneumoniae –Ј–∞—Б—В–∞–≤–ї—П–µ—В –Ј–∞–і—Г–Љ–∞—В—М—Б—П –Њ —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ—Б—В–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞ –Є–ї–Є –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞/–Ї–ї–∞–≤—Г–ї–∞–љ–∞—В–∞ –≤ –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј–∞—Е (90 –Љ–≥/–Ї–≥/—Б—Г—В –њ–Њ –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ—Г). –° –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –≤ –Ї–Њ—В–Њ—А—Л—Е –±—Л –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –њ—А—П–Љ–Њ–µ —Б–Њ–њ–Њ—Б—В–∞–≤–ї–µ–љ–Є–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є —Б—В–∞–љ–і–∞—А—В–љ—Л—Е –Є –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞/–Ї–ї–∞–≤—Г–ї–∞–љ–∞—В–∞, –њ–Њ—З—В–Є –љ–µ—В.
–Т —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Б—А–∞–≤–љ–Є–≤–∞–ї–Є—Б—М —Б—В–∞–љ–і–∞—А—В–љ—Л–µ (45 –Љ–≥/–Ї–≥/—Б—Г—В) –Є –≤—Л—Б–Њ–Ї–Є–µ (90 –Љ–≥/–Ї–≥/—Б—Г—В) –і–Њ–Ј—Л –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞ –≤ —В–µ—З–µ–љ–Є–µ 3 –і–љ–µ–є —Г 876 –і–µ—В–µ–є –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 2 –Љ–µ—Б. –і–Њ 5 –ї–µ—В —Б –≤–љ–µ–±–Њ–ї—М–љ–Є—З–љ–Њ–є –њ–љ–µ–≤–Љ–Њ–љ–Є–µ–є: —З–∞—Б—В–Њ—В–∞ –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —В–µ—А–∞–њ–Є–Є —Б–Њ—Б—В–∞–≤–Є–ї–∞ 5,9% –Є 7,9% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ [23]. –Р–≤—В–Њ—А—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Ј–∞–Ї–ї—О—З–∞—О—В, —З—В–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –Є—Б—Е–Њ–і—Л —Г –і–µ—В–µ–є —Б –љ–µ—В—П–ґ–µ–ї–Њ–є –њ–љ–µ–≤–Љ–Њ–љ–Є–µ–є –љ–µ —А–∞–Ј–ї–Є—З–∞—О—В—Б—П –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —Б—В–∞–љ–і–∞—А—В–љ–Њ–є –Є –≤—Л—Б–Њ–Ї–Њ–є –і–Њ–Ј—Л –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞ [23].
–Т 2018 –≥. –±—Л–ї–Њ –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–Њ –і–≤–Њ–є–љ–Њ–µ —Б–ї–µ–њ–Њ–µ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–µ –≤ –°–®–Р –≤ –њ–µ—А–Є–Њ–і —Б –љ–Њ—П–±—А—П 2014 –≥. –њ–Њ —Д–µ–≤—А–∞–ї—М 2017 –≥. —Б —Г—З–∞—Б—В–Є–µ–Љ 315 –∞–Љ–±—Г–ї–∞—В–Њ—А–љ—Л—Е –≤–Ј—А–Њ—Б–ї—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ—Б—В—А—Л–Љ —Б–Є–љ—Г—Б–Є—В–Њ–Љ, –≤ –Ї–Њ—В–Њ—А–Њ–Љ —Б—А–∞–≤–љ–Є–≤–∞–ї–Є—Б—М —Б—В–∞–љ–і–∞—А—В–љ–∞—П –Є –≤—Л—Б–Њ–Ї–∞—П –і–Њ–Ј—Л –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞/–Ї–ї–∞–≤—Г–ї–∞–љ–∞—В–∞ [24]. –Т —Б–≤—П–Ј–Є —Б —В–µ–Љ, —З—В–Њ –љ–∞ –њ–Њ–ї–Њ–≤–Є–љ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б—В–∞–ї–∞ –љ–µ–і–Њ—Б—В—Г–њ–љ–Њ–є –Њ—А–Є–≥–Є–љ–∞–ї—М–љ–∞—П –≤—Л—Б–Њ–Ї–Њ–і–Њ–Ј–љ–∞—П —Д–Њ—А–Љ–∞ –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞/–Ї–ї–∞–≤—Г–ї–∞–љ–∞—В–∞ (2000/125 –Љ–≥), –≤–Њ 2-–Љ –њ–µ—А–Є–Њ–і–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б—В–∞–ї–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –Њ–±—Л—З–љ—Л–є –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ –≤ –і–Њ–Ј–µ 1750 –Љ–≥ –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б 250 –Љ–≥ –Ї–ї–∞–≤—Г–ї–∞–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л. –Ъ–∞–Ї –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М, —Г –≤–Ј—А–Њ—Б–ї—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ—Б—В—А—Л–Љ –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–Љ —Б–Є–љ—Г—Б–Є—В–Њ–Љ –љ–µ –Њ—В–Љ–µ—З–µ–љ–Њ —А–∞–Ј–ї–Є—З–Є–є –≤ —Г–ї—Г—З—И–µ–љ–Є–Є –Ї 3-–Љ—Г –і–љ—О –Є –Є–Ј–ї–µ—З–µ–љ–Є–Є –Ї 10-–Љ—Г –і–љ—О –Љ–µ–ґ–і—Г 1-–Љ –Є 2-–Љ –њ–µ—А–Є–Њ–і–∞–Љ–Є –ї–µ—З–µ–љ–Є—П (—В–∞–±–ї. 1). –Ю—В–Љ–µ—З–∞–ї–Њ—Б—М –ї–Є—И—М –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –±–Њ–ї–µ–µ –±—Л—Б—В—А–Њ–µ —Г–ї—Г—З—И–µ–љ–Є–µ –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞ –≤–Њ 2-–Љ –њ–µ—А–Є–Њ–і–µ –ї–µ—З–µ–љ–Є—П, –Њ–і–љ–∞–Ї–Њ —Н—В–Њ –љ–µ –њ–Њ–≤–ї–Є—П–ї–Њ –љ–∞ –Є—Б—Е–Њ–і—Л —В–µ—А–∞–њ–Є–Є. –Я—А–Є —Н—В–Њ–Љ —З–∞—Б—В–Њ—В–∞ –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є (–њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ, —Б–Њ —Б—В–Њ—А–Њ–љ—Л –Ц–Ъ–Ґ) –±—Л–ї–∞ –≤—Л—И–µ –≤ –≥—А—Г–њ–њ–µ –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј, —Е–Њ—В—П —А–∞–Ј–ї–Є—З–Є—П –љ–µ –і–Њ—Б—В–Є–≥–ї–Є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–є –Ј–љ–∞—З–Є–Љ–Њ—Б—В–Є. –І–∞—Б—В–Њ—В–∞ –ґ–µ —В—П–ґ–µ–ї–Њ–є –і–Є–∞—А–µ–Є —Б–Њ—Б—В–∞–≤–Є–ї–∞ 15,8% –≤–Њ 2-–Љ –њ–µ—А–Є–Њ–і–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤ –≥—А—Г–њ–њ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞/–Ї–ї–∞–≤—Г–ї–∞–љ–∞—В–∞ –Є 4,8% –≤ –≥—А—Г–њ–њ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П —Б—В–∞–љ–і–∞—А—В–љ–Њ–є –і–Њ–Ј—Л (—А=0,048).
![–Ґ–∞–±–ї–Є—Ж–∞ 1. –°—А–∞–≤–љ–µ–љ–Є–µ —Б—В–∞–љ–і–∞—А—В–љ—Л—Е –Є –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞/–Ї–ї–∞–≤—Г–ї–∞–љ–∞—В–∞ —Г –≤–Ј—А–Њ—Б–ї—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ—Б—В—А—Л–Љ —Б–Є–љ—Г—Б–Є- —В–Њ–Љ [24] Table 1. Comparison of standard and high doses of amoxicillin/clavulanate in adult patients with acute sinusitis [24] –Ґ–∞–±–ї–Є—Ж–∞ 1. –°—А–∞–≤–љ–µ–љ–Є–µ —Б—В–∞–љ–і–∞—А—В–љ—Л—Е –Є –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞/–Ї–ї–∞–≤—Г–ї–∞–љ–∞—В–∞ —Г –≤–Ј—А–Њ—Б–ї—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ—Б—В—А—Л–Љ —Б–Є–љ—Г—Б–Є- —В–Њ–Љ [24] Table 1. Comparison of standard and high doses of amoxicillin/clavulanate in adult patients with acute sinusitis [24]](/upload/medialibrary/0f6/105-3.png)
–Я—А–Є –∞–љ–∞–ї–Є–Ј–µ –њ—А–Њ–≥–љ–Њ–Ј–Є—А—Г–µ–Љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Р–С–Я –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –њ–љ–µ–≤–Љ–Њ–Ї–Њ–Ї–Ї–∞ –Є –≥–µ–Љ–Њ—Д–Є–ї—М–љ–Њ–є –њ–∞–ї–Њ—З–Ї–Є –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є—Е –Є —Д–∞—А–Љ–∞–Ї–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ –±—Л–ї–Є —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ—Л –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–µ —А–∞–Ј–ї–Є—З–Є—П –Љ–µ–ґ–і—Г —Б—В–∞–љ–і–∞—А—В–љ–Њ–є –Є –≤—Л—Б–Њ–Ї–Њ–і–Њ–Ј–љ–Њ–є —В–µ—А–∞–њ–Є–µ–є –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–Њ–Љ/–Ї–ї–∞–≤—Г–ї–∞–љ–∞—В–Њ–Љ, –љ–Њ –≤ —В–Њ –ґ–µ –≤—А–µ–Љ—П –≤—Л—П–≤–ї–µ–љ–Њ —П–≤–љ–Њ–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞/–Ї–ї–∞–≤—Г–ї–∞–љ–∞—В–∞ –њ–µ—А–µ–і –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–Њ–Љ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є H. influenzae (—В–∞–±–ї. 2) [15].
![–Ґ–∞–±–ї–Є—Ж–∞ 2. –Я—А–Њ–≥–љ–Њ–Ј–Є—А—Г–µ–Љ–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є S. pneumoniae –Є H. influenzae –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —Д–∞—А- –Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є—Е –Є —Д–∞—А–Љ–∞–Ї–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ [15] Table 2. Predictable efficacy of antibiotics against S. pneumoniae and H. influenz–∞–µ ba –Ґ–∞–±–ї–Є—Ж–∞ 2. –Я—А–Њ–≥–љ–Њ–Ј–Є—А—Г–µ–Љ–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є S. pneumoniae –Є H. influenzae –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —Д–∞—А- –Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є—Е –Є —Д–∞—А–Љ–∞–Ї–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ [15] Table 2. Predictable efficacy of antibiotics against S. pneumoniae and H. influenz–∞–µ ba](/upload/medialibrary/79d/105-4.png)
–≠—Д—Д–µ–Ї—В–Є–≤–љ—Л –ї–Є –њ–µ—А–Њ—А–∞–ї—М–љ—Л–µ —Ж–µ—Д–∞–ї–Њ—Б–њ–Њ—А–Є–љ—Л III –њ–Њ–Ї–Њ–ї–µ–љ–Є—П (–≤ —З–∞—Б—В–љ–Њ—Б—В–Є, —Ж–µ—Д–Є–Ї—Б–Є–Љ) –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –і–ї—П —Н–Љ–њ–Є—А–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є –Ш–Ф–Я —Г –і–µ—В–µ–є?
–Ъ–Њ–≥–і–∞ —А–µ—З—М –Є–і–µ—В –Њ –њ–µ—А–Њ—А–∞–ї—М–љ—Л—Е —Ж–µ—Д–∞–ї–Њ—Б–њ–Њ—А–Є–љ–∞—Е III –њ–Њ–Ї–Њ–ї–µ–љ–Є—П (—Ж–µ—Д–Є–Ї—Б–Є–Љ–µ, —Ж–µ—Д—В–Є–±—Г—В–µ–љ–µ), —В–Њ –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М –љ—Г–ґ–љ–Њ –њ–Њ–Љ–љ–Є—В—М, —З—В–Њ —Н—В–Є –њ—А–µ–њ–∞—А–∞—В—Л –љ–µ —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–љ—Л –њ–Њ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Њ—Б–љ–Њ–≤–љ–Њ–≥–Њ —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ–Њ–≥–Њ –њ–∞—В–Њ–≥–µ–љ–∞ S. pneumoniae –Є –њ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–Є –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –Ш–Ф–Я –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ—Л–Љ —Ж–µ—Д–∞–ї–Њ—Б–њ–Њ—А–Є–љ–∞–Љ III –њ–Њ–Ї–Њ–ї–µ–љ–Є—П (—Ж–µ—Д—В—А–Є–∞–Ї—Б–Њ–љ—Г –Є —Ж–µ—Д–Њ—В–∞–Ї—Б–Є–Љ—Г).
–Т –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є Alexander Project, –≤ –Ї–Њ—В–Њ—А–Њ–Љ –њ—А–Є–љ—П–ї–Є —Г—З–∞—Б—В–Є–µ 26 —Б—В—А–∞–љ –Є –±—Л–ї–Њ –њ—А–Њ—В–µ—Б—В–Є—А–Њ–≤–∞–љ–Њ 8882 —И—В–∞–Љ–Љ–∞ –њ–љ–µ–≤–Љ–Њ–Ї–Њ–Ї–Ї–∞, —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М –њ–љ–µ–≤–Љ–Њ–Ї–Њ–Ї–Ї–∞ –Ї —Ж–µ—Д–Є–Ї—Б–Є–Љ—Г —Б–Њ—Б—В–∞–≤–Є–ї–∞ 30,8% [25]. –Т —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –њ–Њ–Ј–Є—Ж–Є–µ–є –Т–Ю–Ч —Ж–µ—Д–Є–Ї—Б–Є–Љ –Њ—В–љ–Њ—Б–Є—В—Б—П –Ї –≥—А—Г–њ–њ–µ watch (–±–і–Є—В–µ–ї—М–љ–Њ—Б—В—М, –љ–∞–±–ї—О–і–µ–љ–Є–µ), —В. –µ. –Ї –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ, –Ї–Њ—В–Њ—А—Л–µ —А–µ–Ї–Њ–Љ–µ–љ–і—Г—О—В—Б—П –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –і–ї—П —В–µ—А–∞–њ–Є–Є —В–Њ–ї—М–Ї–Њ –љ–µ–±–Њ–ї—М—И–Њ–≥–Њ –њ–µ—А–µ—З–љ—П –Є–љ—Д–µ–Ї—Ж–Є–є. –¶–µ—Д–Є–Ї—Б–Є–Љ –љ–µ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ –Т–Ю–Ч –і–ї—П –ї–µ—З–µ–љ–Є—П —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є —Г –і–µ—В–µ–є, –∞ –µ–і–Є–љ—Б—В–≤–µ–љ–љ—Л–Љ –њ–Њ–Ї–∞–Ј–∞–љ–Є–µ–Љ –Ї –µ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –≤ ¬Ђ–Я—А–Є–Љ–µ—А–љ–Њ–Љ –њ–µ—А–µ—З–љ–µ –Њ—Б–љ–Њ–≤–љ—Л—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤¬ї —Г–Ї–∞–Ј–∞–љ—Л –Њ—Б—В—А–∞—П –Є–љ–≤–∞–Ј–Є–≤–љ–∞—П –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–∞—П –і–Є–∞—А–µ—П –Є –і–Є–Ј–µ–љ—В–µ—А–Є—П (–њ—А–µ–њ–∞—А–∞—В 2-–≥–Њ —А—П–і–∞) [26]. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –њ—А–Є —В–µ—Б—В–Є—А–Њ–≤–∞–љ–Є–Є –њ–µ–і–Є–∞—В—А–Њ–≤ [27] –љ–∞ –≤–Њ–њ—А–Њ—Б: ¬Ђ–Ъ–∞–Ї–Є–µ ќ≤-–ї–∞–Ї—В–∞–Љ—Л —Б–Њ—Е—А–∞–љ—П—О—В –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л—Е —И—В–∞–Љ–Љ–Њ–≤ S. pneumoniae?¬ї вАФ –±–Њ–ї–µ–µ 30% –≤—А–∞—З–µ–є —Г–Ї–∞–Ј–∞–ї–Є —Ж–µ—Д–Є–Ї—Б–Є–Љ –Є –Њ–Ї–Њ–ї–Њ 15% вАФ —Ж–µ—Д—В–Є–±—Г—В–µ–љ, —З—В–Њ —Б–Њ–≤–µ—А—И–µ–љ–љ–Њ –љ–µ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В –і–µ–є—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ —Ж–µ—Д–Є–Ї—Б–Є–Љ–∞ –Ї–∞–Ї –њ—А–µ–њ–∞—А–∞—В–∞ —Н—В–Є–Њ—В—А–Њ–њ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ —В–Њ–ї—М–Ї–Њ –≤ —Б–ї—Г—З–∞—П—Е —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ–Њ–є (–њ–Њ –і–∞–љ–љ—Л–Љ –±–∞–Ї—В–µ—А–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П) —А–Њ–ї–Є H. influenzae –≤ –Ї–∞—З–µ—Б—В–≤–µ –µ–і–Є–љ—Б—В–≤–µ–љ–љ–Њ–≥–Њ —Н—В–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–≥–µ–љ—В–∞ –Ш–Ф–Я –њ—А–Є –љ–µ–њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є –Є–ї–Є –њ—А–µ–і—И–µ—Б—В–≤—Г—О—Й–µ–є –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤—Л–±–Њ—А–∞ (1-–≥–Њ —А—П–і–∞). –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –ґ–µ –њ–µ—А–Њ—А–∞–ї—М–љ—Л—Е —Ж–µ—Д–∞–ї–Њ—Б–њ–Њ—А–Є–љ–Њ–≤ III –њ–Њ–Ї–Њ–ї–µ–љ–Є—П –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Б—В–∞—А—В–Њ–≤–Њ–є —Н–Љ–њ–Є—А–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є –∞–±—Б–Њ–ї—О—В–љ–Њ –љ–µ—Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ.
–Ъ–∞–Ї–Њ–≤–∞ –Њ–њ—В–Є–Љ–∞–ї—М–љ–∞—П –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Ш–Ф–Я —Г –і–µ—В–µ–є?
–°—Г—Й–µ—Б—В–≤—Г—О—В –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –њ—А–Є –Ї–Њ—В–Њ—А—Л—Е —З–µ—В–Ї–Њ –Њ–≥–Њ–≤–Њ—А–µ–љ–∞ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –Р–С–Ґ. –Ґ–∞–Ї, –њ—А–Є —Б—В—А–µ–њ—В–Њ–Ї–Њ–Ї–Ї–Њ–≤–Њ–Љ —В–Њ–љ–Ј–Є–ї–ї–Њ—Д–∞—А–Є–љ–≥–Є—В–µ –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–ї—П–µ—В 10 –і–љ–µ–є –і–ї—П –≤—Б–µ—Е –Р–С–Я, –Ї—А–Њ–Љ–µ –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞ –Є –±–µ–љ–Ј–∞—В–Є–љ–∞ –±–µ–љ–Ј–Є–ї–њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–∞ [1, 28, 29]. –Я—А–Є –і—А—Г–≥–Є—Е –Ш–Ф–Я –Є –Є–љ—Д–µ–Ї—Ж–Є—П—Е –Ы–Ю–†-–Њ—А–≥–∞–љ–Њ–≤ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –Р–С–Ґ —Г—Б—В–∞–љ–∞–≤–ї–Є–≤–∞–µ—В—Б—П –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Є –њ–∞—А–∞–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –і–Є–љ–∞–Љ–Є–Ї–Є. –£–ґ–µ –±–Њ–ї–µ–µ 10 –ї–µ—В –Њ—В–Љ–µ—З–∞–µ—В—Б—П –Њ–±—Й–∞—П —В–µ–љ–і–µ–љ—Ж–Є—П –Ї —Б–Њ–Ї—А–∞—Й–µ–љ–Є—О –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Р–С–Ґ –Њ—З–µ–љ—М –Љ–љ–Њ–≥–Є—Е –љ–Њ–Ј–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Д–Њ—А–Љ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –≤ —В. —З. –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –Ш–Ф–Я.
–Э–∞ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–є –Љ–Њ–Љ–µ–љ—В —Б—Г—Й–µ—Б—В–≤—Г—О—В –њ—Г–±–ї–Є–Ї–∞—Ж–Є–Є, –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г—О—Й–Є–µ —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–љ—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —Б—В–∞–љ–і–∞—А—В–љ—Л—Е –Є –Ї–Њ—А–Њ—В–Ї–Є—Е –Ї—Г—А—Б–Њ–≤ –Р–С–Ґ –і–∞–ґ–µ —В–∞–Ї–Њ–≥–Њ —Б–µ—А—М–µ–Ј–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Г –і–µ—В–µ–є, –Ї–∞–Ї –≤–љ–µ–±–Њ–ї—М–љ–Є—З–љ–∞—П –њ–љ–µ–≤–Љ–Њ–љ–Є—П.
–Ґ–∞–Ї, —Б–Њ–≥–ї–∞—Б–љ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б —Г—З–∞—Б—В–Є–µ–Љ 2188 –і–µ—В–µ–є –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 2 –Љ–µ—Б. –і–Њ 5 –ї–µ—В —Б –љ–µ—В—П–ґ–µ–ї—Л–Љ —В–µ—З–µ–љ–Є–µ–Љ –≤–љ–µ–±–Њ–ї—М–љ–Є—З–љ–Њ–є –њ–љ–µ–≤–Љ–Њ–љ–Є–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞ –≤ —В–µ—З–µ–љ–Є–µ 3 –і–љ–µ–є –±—Л–ї–Њ —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л–Љ –њ–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Б –µ–≥–Њ 5-–і–љ–µ–≤–љ—Л–Љ –Ї—Г—А—Б–Њ–Љ (89,5% –Є 89,9% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ), –∞ –њ—А–Є–≤–µ—А–ґ–µ–љ–љ–Њ—Б—В—М —А–Њ–і–Є—В–µ–ї–µ–є –љ–∞–Ј–љ–∞—З–µ–љ–љ–Њ–є –Р–С–Ґ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 94% –Є 85% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ [30].
–Т –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ–Њ–Љ –≤ 2011 –≥. –Њ–±–Ј–Њ—А–µ –њ—А–Є–≤–µ–і–µ–љ—Л —А–µ–Ј—Г–ї—М—В–∞—В—Л 4 –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –≤—Л–њ–Њ–ї–љ–µ–љ–љ—Л—Е –≤ —А–∞–Ј–≤–Є–≤–∞—О—Й–Є—Е—Б—П —Б—В—А–∞–љ–∞—Е —Б —Г—З–∞—Б—В–Є–µ–Љ –і–µ—В–µ–є –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 2 –Љ–µ—Б. –і–Њ 5 –ї–µ—В —Б –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –Ї—А–Є—В–µ—А–Є—П–Љ–Є –Т–Ю–Ч –љ–µ—В—П–ґ–µ–ї–Њ–є –≤–љ–µ–±–Њ–ї—М–љ–Є—З–љ–Њ–є –њ–љ–µ–≤–Љ–Њ–љ–Є–µ–є. –Ъ–∞–Ї –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М, –љ–µ –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є –Љ–µ–ґ–і—Г 3-–і–љ–µ–≤–љ—Л–Љ –Є 5-–і–љ–µ–≤–љ—Л–Љ –Ї—Г—А—Б–∞–Љ–Є –Р–С–Ґ –њ–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є–ї–Є —З–∞—Б—В–Њ—В–µ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П —А–µ—Ж–Є–і–Є–≤–Њ–≤ [31].
–Т –Ъ–Њ—Е—А–µ–є–љ–Њ–≤—Б–Ї–Њ–Љ —Б–Є—Б—В–µ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–Љ –Њ–±–Ј–Њ—А–µ –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —Г –і–µ—В–µ–є –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 2 –Љ–µ—Б. –і–Њ 5 –ї–µ—В —Б –љ–µ—В—П–ґ–µ–ї–Њ–є –њ–љ–µ–≤–Љ–Њ–љ–Є–µ–є 3-–і–љ–µ–≤–љ—Л–є –Ї—Г—А—Б –Р–С–Ґ –љ–µ —Г—Б—В—Г–њ–∞–µ—В –њ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –±–Њ–ї–µ–µ –і–ї–Є—В–µ–ї—М–љ–Њ–Љ—Г –Ї—Г—А—Б—Г –ї–µ—З–µ–љ–Є—П [32].
–≠–Ї—Б–њ–µ—А—В—Л –†–Њ—Б—Б–Є–є—Б–Ї–Њ–≥–Њ —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ–Њ–≥–Њ –Њ–±—Й–µ—Б—В–≤–∞, –Р–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Њ–≥–Њ –Њ–±—Й–µ—Б—В–≤–∞ –њ–Њ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–Љ –±–Њ–ї–µ–Ј–љ—П–Љ (Infectious Diseases Society of America, IDSA) –Є –Р–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Њ–≥–Њ —В–Њ—А–∞–Ї–∞–ї—М–љ–Њ–≥–Њ –Њ–±—Й–µ—Б—В–≤–∞ (American Thoracic Society, ATS) –њ–Њ–ї–∞–≥–∞—О—В, —З—В–Њ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –Р–С–Ґ –њ—А–Є –≤–љ–µ–±–Њ–ї—М–љ–Є—З–љ–Њ–є –њ–љ–µ–≤–Љ–Њ–љ–Є–Є –і–Њ–ї–ґ–љ–∞ —Б–Њ—Б—В–∞–≤–ї—П—В—М –љ–µ –Љ–µ–љ–µ–µ 5 –і–љ–µ–є [33].
–Т—А—П–і –ї–Є –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –њ–µ–і–Є–∞—В—А–Њ–≤ —А–µ—И–∞—В—Б—П –ї–µ—З–Є—В—М —А–µ–±–µ–љ–Ї–∞ —Б –љ–µ—В—П–ґ–µ–ї–Њ–є –≤–љ–µ–±–Њ–ї—М–љ–Є—З–љ–Њ–є –њ–љ–µ–≤–Љ–Њ–љ–Є–µ–є 5 –і–љ–µ–є. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ, —Г—З–Є—В—Л–≤–∞—П –≤–Њ–Ј—А–∞—Б—В–∞—О—Й—Г—О –њ—А–Њ–±–ї–µ–Љ—Г —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є—П –Р–С–†, –љ—Г–ґ–љ–Њ –њ–Њ–Љ–љ–Є—В—М –Њ —В–Њ–Љ, —З—В–Њ —З—А–µ–Ј–Љ–µ—А–љ–Њ –і–ї–Є—В–µ–ї—М–љ–Њ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ —В–∞–Ї–ґ–µ —П–≤–ї—П–µ—В—Б—П —Д–∞–Ї—В–Њ—А–Њ–Љ —А–Є—Б–Ї–∞ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –Р–С–† —Г –њ–∞—В–Њ–≥–µ–љ–Њ–≤. –Ъ–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –њ—А–Є –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–Є —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л —В–µ–ї–∞ –Є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Є –њ–∞—А–∞–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –і–Є–љ–∞–Љ–Є–Ї–µ (—А–µ–Ј—Г–ї—М—В–∞—В—Л –Є–љ—Б—В—А—Г–Љ–µ–љ—В–∞–ї—М–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є) –љ–∞ 2вАУ3 —Б—Г—В —В–µ—А–∞–њ–Є–Є –±—Г–і–µ—В –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –њ—А–Њ–і–Њ–ї–ґ–Є—В—М –Р–С–Ґ –µ—Й–µ –≤ —В–µ—З–µ–љ–Є–µ 3вАУ4 —Б—Г—В, –њ—А–Є —Н—В–Њ–Љ –Њ–±—Й–∞—П –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Р–С–Я —Б–Њ—Б—В–∞–≤–Є—В –≤ —Б—А–µ–і–љ–µ–Љ 6вАУ8 —Б—Г—В.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Т –і–∞–љ–љ–Њ–є –њ—Г–±–ї–Є–Ї–∞—Ж–Є–Є –Љ—Л –њ–Њ–њ—Л—В–∞–ї–Є—Б—М –∞—А–≥—Г–Љ–µ–љ—В–Є—А–Њ–≤–∞–љ–љ–Њ –Њ—В–≤–µ—В–Є—В—М –љ–∞ —З–∞—Б—В—Л–µ –Є –≤–µ—Б—М–Љ–∞ –љ–µ–њ—А–Њ—Б—В—Л–µ –≤–Њ–њ—А–Њ—Б—Л, –≤–Њ–Ј–љ–Є–Ї–∞—О—Й–Є–µ —Г –Ї–ї–Є–љ–Є—Ж–Є—Б—В–Њ–≤. –•–Њ—З–µ—В—Б—П –љ–∞–і–µ—П—В—М—Б—П, —З—В–Њ —Н—В–∞ —Б—В–∞—В—М—П –њ–Њ–Љ–Њ–ґ–µ—В –њ–µ–і–Є–∞—В—А–∞–Љ –≥—А–∞–Љ–Њ—В–љ–Њ –Є –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ–Њ –≤—Л–±–Є—А–∞—В—М —В–∞–Ї—В–Є–Ї—Г –Р–С–Ґ –њ—А–Є –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –Ш–Ф–Я.
–°–≤–µ–і–µ–љ–Є—П –Њ–± –∞–≤—В–Њ—А–∞—Е:
–Р–љ–і—А–µ–µ–≤–∞ –Ш—А–Є–љ–∞ –Т–µ–љ–Є–∞–Љ–Є–љ–Њ–≤–љ–∞ вАФ –Ї.–Љ.–љ., –і–Њ—Ж–µ–љ—В, —Б—В–∞—А—И–Є–є –љ–∞—Г—З–љ—Л–є —Б–Њ—В—А—Г–і–љ–Є–Ї –Э–Ш–Ш –∞–љ—В–Є–Љ–Є–Ї—А–Њ–±–љ–Њ–є —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є, ORCID iD 0000-0001-7916-1488;
–°—В–µ—Ж—О–Ї –Ю–ї—М–≥–∞ –£–ї—М—П–љ–Њ–≤–љ–∞ вАФ –Ї.–Љ.–љ., —Б—В–∞—А—И–Є–є –љ–∞—Г—З–љ—Л–є —Б–Њ—В—А—Г–і–љ–Є–Ї –Э–Ш–Ш –∞–љ—В–Є–Љ–Є–Ї—А–Њ–±–љ–Њ–є —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є, ORCID iD 0000-0002-7316-9187;
–Х–≥–Њ—А–Њ–≤–∞ –Ю–ї—М–≥–∞ –Р–љ–∞—В–Њ–ї—М–µ–≤–љ–∞ вАФ –Ї.–Љ.–љ., –і–Њ—Ж–µ–љ—В –Ї–∞—Д–µ–і—А—Л –Њ—В–Њ—А–Є–љ–Њ–ї–∞—А–Є–љ–≥–Њ–ї–Њ–≥–Є–Є, ORCID iD 0000-0002-6316-6046.
–§–У–С–Ю–£ –Т–Ю –°–У–Ь–£ –Ь–Є–љ–Ј–і—А–∞–≤–∞ –†–Њ—Б—Б–Є–Є. 214019, –≥. –°–Љ–Њ–ї–µ–љ—Б–Ї, —Г–ї. –Ъ—А—Г–њ—Б–Ї–Њ–є, –і. 28.
–Ъ–Њ–љ—В–∞–Ї—В–љ–∞—П –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—П: –Р–љ–і—А–µ–µ–≤–∞ –Ш—А–Є–љ–∞ –Т–µ–љ–Є–∞–Љ–Є–љ–Њ–≤–љ–∞, e-mail: irina.andreeva@antibiotic.ru. –Я—А–Њ–Ј—А–∞—З–љ–Њ—Б—В—М —Д–Є–љ–∞–љ—Б–Њ–≤–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є: –љ–Є–Ї—В–Њ –Є–Ј –∞–≤—В–Њ—А–Њ–≤ –љ–µ –Є–Љ–µ–µ—В —Д–Є–љ–∞–љ—Б–Њ–≤–Њ–є –Ј–∞–Є–љ—В–µ—А–µ—Б–Њ–≤–∞–љ–љ–Њ—Б—В–Є –≤ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л—Е –Љ–∞—В–µ—А–Є–∞–ї–∞—Е –Є–ї–Є –Љ–µ—В–Њ–і–∞—Е. –Ъ–Њ–љ—Д–ї–Є–Ї—В –Є–љ—В–µ—А–µ—Б–Њ–≤ –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В. –°—В–∞—В—М—П –њ–Њ—Б—В—Г–њ–Є–ї–∞ 19.04.2020.
About the authors:
Irina V. Andreeva вАФ MD, PhD, Associate Professor, Senior Research Fellow of the Institute of Antimicrobial Chemotherapy, ORCID iD 0000-0001-7916-1488;
Olga U. Stetsyuk вАФ MD, PhD, Senior Research Fellow of the Institute of Antimicrobial Chemotherapy, ORCID iD 0000-0002-7316-9187;
Olga A. Egorova вАФ MD, PhD, Associate Professor of the Department of ENT Diseases, ORCID iD 0000-0002-6316-6046.
Smolensk State Medical University. 28, Krupskaya str., Smolensk, 214019, Russian Federation.
Contact information: Irina V. Andreeva, e-mail: irina.andreeva@antibiotic.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 19.04.2020.











