В настоящее время преимущество перед стандартными лечебными диетами получили специализированные продукты питания, достоинства которых выражаются в полном сбалансированном соответствии с потребностями детей, наличием необходимых витаминов и микроэлементов, высококачественных белков, жирных кислот.
Поскольку при критических состояниях часто наблюдается недостаточность ферментативного гидролиза полимеров в тонкой кишке, для энтерального питания были разработаны так называемые элементные диеты, содержащие основные питательные вещества в виде гидролизатов и мономерных продуктов [5,12,13].
Наряду с успешным применением данных смесей у детей при лечении кишечных свищей, синдроме короткой кишки, воспалительных заболеваниях толстой кишки, накоплен клинический материал о применении их в практике интенсивной терапии [14,15].
Важно отметить, что у детей в критических состояниях отмечаются выраженная дисфункция ЖКТ, проявляющаяся рвотой, резким снижением переваривающей и всасывательной способностей желудка и кишечника, что объясняет использование данных смесей.
К тому же трудность проведения физиологического питания у детей в критических состояниях зачастую обусловлена состояниям больного, необходимостью проведения искусственной вентиляции легких, парезом желудочно–кишечного тракта, а также наличием стрессовых язв [16,17].
В практике хирургической реанимации ДГКБ №9 им. Г.Н. Сперанского проведена оценка клинической эффективности специализированных смесей для энтерального питания у детей в раннем посттравматическом периоде: до 1–года: «Альфаре» (Нестле, Швейцария), «Пепти–Нутрилон ТСЦ» (Нутриция, Голландия); от 1–года до 10 лет: «Пептамен Юниор» (Нестле, Швейцария); от 10 лет: «Пептамен» (Нестле, Швейцария), «Нутриен Элементаль» (Нутритек, Россия).
Следует добавить, что на отечественном рынке скоро появится новый продукт для энтерального питания – «Пептамен Юниор» («Нестле», Швейцария), который рекомендовано использовать у детей от 1 года до 10 лет.
Белковый компонент смеси «Пептамен Юниор» и «Пептамен» создан на основе пептидов (олигопептидов, полученных при гидролизе сывороточных белков).
Говоря о сывороточном белке, следует напомнить, что этот белок является высоко биологически ценным продуктом с широким набором аминокислот; у белка отмечается оптимальный коэффициент белковой эффективности по серосодержащим аминокислотам/аминокислотам с разветвленной цепью = 3,2; белок способствует восстановлению двигательной активности желудка и кишечника, что важно у критических больных при нарушениях двигательной функции ЖКТ, сывороточный белок содержит 20–25% альфа–лактоальбумина – содержащегося в женском молоке, что важно для детей до 1–го года, белок не переваривается в желудке, а усваивается в кишечнике.
Жировой состав представлен среднецепочечными триглицеридами, что улучшает усвоение смеси в желудочно–кишечном тракте, а также позволяет назначать в ранние сроки после операций, в том числе на желудочно–кишечном тракте, при ограниченном усвоении жиров у пациентов в критических состояниях с нарушениями функции пищеварительной системы. Всасывание среднецепочечных триглицеридов (МСТ) не требует дополнительных ферментативных усилий, что обеспечивает относительный функциональный покой печени и поджелудочной железе. В состав жирового компонента входят эссенциальные жирные кислоты (линолевая и a–линоленовая), что позволяет добиться максимального усвоения смеси при хорошей энергетической обеспеченности. В смесях содержатся L–карнитин, необходимый для полноценного усвоения жирных кислот, и таурин – эссенциальная аминокислота для больных, получающих интенсивную терапию.
Углеводный компонент сформирован смесью мальтодекстринов с различным декстрозным эквивалентом (степенью гидролиза). Соотношение углеводных компонентов обеспечивает низкую осмоляльность (315 мОсм/л) и хорошие органолептические свойства продукта. Смесь имеет сбалансированный витаминно–минеральный состав, что делает возможным ее применение в течение длительного времени. Наличие сывороточных протеинов и среднецепочечных триглицеридов повышает усвояемость смесей в ЖКТ детей в критических состояниях.
Цель работы: оценить эффективность раннего энтерального питания с использованием полуэлементных смесей для энтерального питания у детей в раннем посттравматическом периоде.
Пациенты и методы
Обследовано 46 детей, находившихся в отделении реанимации и интенсивной терапии (в возрасте от 1 года 6 месяцев до 15 лет) с сочетанной травмой (закрытая черепно–мозговая травма, сочетанная травма, переломы конечностей, открытые огнестрельные ранения).
Ежесуточные потребности в основных питательных ингредиентах определяли с помощью расчетной формулы (уравнение Шоффильда). Комплекс биохимических исследований проводили с помощью автоматического анализатора фирмы «Architect» (Германия).
Статистический анализ проводили с использованием компьютерной программы Statistica. 6 (Статсофт, Россия), достоверность различий между значениями и показателей, полученных на этапах исследования, оценивали по t–критерию Стьюдента <0,05.
Эффективность изучаемых смесей проводилась по данным клинико–лабораторных и функциональных методов исследований. Клиническими критериями усвоения смесей служили отсутствие застоя, признаков диспепсических расстройств (тошнота, рвота, метеоризм, диарея).
Все наблюдаемые дети поступали в шоке, с момента поступления проводилась интенсивная терапия, направленная не устранение гемодинамических расстройств, улучшение реологии и микроциркуляции крови, ликвидация расстройств кислотно–основного состояния. У 58% наблюдаемых детей энтеральный путь введения нутриентов в раннем постшоковом периоде (1–2 сутки после поступления) был блокирован в связи с анорексией и парезом мускулатуры ЖКТ. Поэтому в раннем постшоковом периоде возросшие энергетические и пластические потребности возмещались проведением полного парентерального питания.
После разрешения пареза желудочно–кишечного тракта назначали энтеральное питание с использованием пектина с регидроном (5,5 г Пекто + 100,0 Регидрона), начиная с 30,0–50,0 мл за 1 кормление, объемом до 150–500 мл/сутки через зонды внутреннего диаметра (5–14 мм), установленные назогастрально, что обеспечивало восстановление моторики кишки и нарушенного водно–электролитного баланса организма ребенка. При удержании данного раствора начинали использовать полуэлементные смеси в половинном разведении от рекомендованного по 30,0–50,0 мл за 1 кормление до 6–7 раз в сутки; в дальнейшем, при удержании смеси, отсутствии застойного содержимого, с 4–х суток – назначение смеси по 50,0–120,0 мл за 1 кормление до 6–7 раз в сутки, увеличивая объем и концентрацию смеси к 5–7–м суткам, доводя разведение смеси до стандартного по 120,0–180,0 мл за 1 кормление. После перевода в коечное отделение больные продолжали прием указанных смесей перорально в виде напитка объемом до 1000 –1200 мл. Отмечены хорошие вкусовые качества смеси (ванильный вкус).
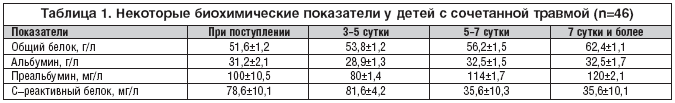
При биохимическом обследовании отмечено, что с момента поступления у наблюдаемых больных отмечались гипопротеинемия (51,6±1,2г/л), гипоальбуминемия (31,2±2,1 г/л). Отмечено снижение преальбумина до 100±10,5 мг/л, рост С–реактивного белка до 78,6±2,1 мг/л (табл. 1).
На фоне раннего энтерального питания к 5–7 суткам наблюдается прирост белковых фракций, достигающий к 7–м суткам 62,4±1,1 г/л показателя общего белка, 32,5±1,7 г/л альбумина, 120±2,1 мг/л преальбумина, со снижением С–реактивного белка до 35,6±10,1 мг/л (табл. 1).
Таким образом, результаты биохимического исследования показали эффективность назначения энтеральной терапии, позволяющей адекватно корригировать метаболические нарушения до уровня нормы в относительно короткий период времени (7 дней) и полноценно обеспечивать возросшие энергетические и пластические потребности детей с сочетанной травмой.
Все дети, получившие нутритивную поддержку в ранние сроки от поступления, своевременно были переведены в коечные отделения в среднем на 7±2,1 день, без развития послеоперационных осложнений.
Выписка из истории болезни № 6576
М–в Азамат., 1 год 8 мес., доставлен в клинику 4.09.2004 из зоны террористического акта (г. Беслан) с диагнозом: тяжелая минно–взрывная травма, баротравма, сотрясение головного мозга, осколочная проникающая (сквозная) рана брюшной полости с повреждением правой доли печени, восходящего отдела ободочной кишки, подвздошной кишки, гемоперитонеум, эвентрация кишечника, травматический шок.
Одновременно с противошоковой терапией проведено оперативное вмешательство: лапаротомия, резекция восходящей ободочной кишки (до 6 см), резекция подвздошной кишки до уровня 40 см от илеоцекального угла с формированием илеостомы по Микуличу.
В раннем послеоперационном периоде в отделении реанимации и интенсивной терапии ребенок находится на полном парентеральном питании, с 2–х суток (с 6.09.2004) назначена глюкозомономерная смесь (Регидрон) с использованием пектина, с 4–х суток постепенное введение энтерального питания. Для энтерального питания была использована полуэлементная смесь «Пептамен Юниор» в 50% разведении от рекомендованного по 30,0 мл за 1 кормление до 6–7 раз в сутки, которую вводили с помощью перфузионного насоса через инфузионный канал зонда со скоростью 5–10 мл/час в течение первой недели от оперативного вмешательства.
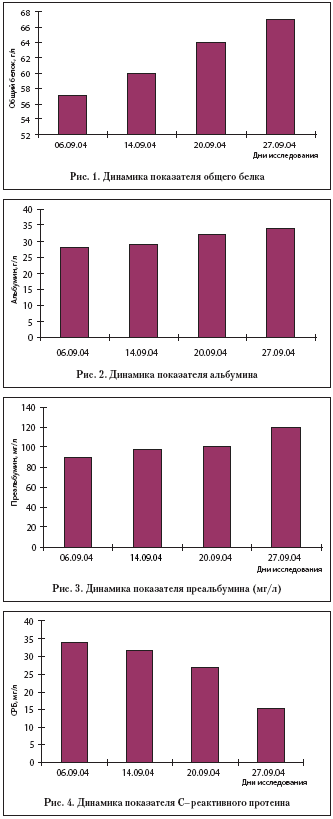
Начиная с 5–х суток, указанную смесь назначали по 60,0 за 1 кормление до 6–7 раз в сутки, увеличивая объем и концентрацию смеси к 6–м суткам – до 100% разведения по 90,0–180,0 мл за 1 кормление. На представленных рисунках 1–4 показана динамика некоторых биохимических показателей на протяжении всего периода от начала кормления.
Как видно из рисунков 1–4, отмечено увеличение висцеральных протеинов (общего белка, альбумина, преальбумина) и снижение С–реактивного протеина, начиная с 7–го дня от начала кормления, достигая результатов нормы к 3–й неделе. Швы с раны сняты на 11–е сутки, заживление первичным натяжением.
Ребенок переведен из отделения интенсивной терапии и реанимации в плановое отделение 13.09.2004 (через 9 дней от поступления) в стабильном тяжелом состоянии. Выписан 15.10.09, находясь на самостоятельном питании полуэлементной смесью «Пептамен Юниор», с постепенным расширением рациона (введением безмолочной гречневой каши, разведенной указанной смесью, овощного и мясного пюре).
Результаты исследования показали: энтеральное зондовое питание с использованием современных специализированных полуэлементных смесей расширяет возможности лечения и выхаживания больных детей в критических состояниях; обеспечивает естественный путь введения пищевых веществ, позволяет сократить объем и сроки парентерального питания, снизить частоту послеоперационных и посттравматических осложнений, сократить сроки лечения больных с острой травмой.
Травмы и оперативные вмешательства неизбежно приводят к развитию расстройств питания, связанных с генерацией острофазного ответа и катаболической реакции организма, что требует назначения в максимально ранние сроки энтерального питания легкоусвояемыми специализированными лечебными смесями, которое предупреждает уменьшение потерь мышечной массы, влияет на повышение концентраций сывороточных протеинов (транстиретина, альбумина), препятствует углублению катаболизма, при этом не оказывая заметного влияния на функциональную активность желудочно–кишечного тракта, и в конечном итоге улучшает качество лечения оперированных больных, сокращает сроки их пребывания в отделении интенсивной терапии и реанимации.
Достоинства специализированных продуктов питания перед стандартными лечебными диетами выражаются в полном сбалансированном соответствии с потребностями детей, наличием необходимо важных витаминов и микроэлементов, наличием высококачественных белков жирных кислот, а отсутствие глютена и лактозы позволяет использовать продукты при нарушенной функции желудочно–кишечного тракта. Жиры представлены полиненасыщенными кислотами и среднецепочечными триглицеридами. В качестве углеводов используются декстрин–мальтоза, моносахариды, также введен витаминно–минеральный комплекс. Продукты способны полностью всасываться в верхнем отделе тонкой кишки, вызывают минимальную стимуляцию соко–, желчеотделения и кишечной перистальтики, не содержат балластных веществ, обладают низкой осмолярностью, что является одним из условий успешного заживления послеоперационной раны, снижает риск инфицирования швов каловыми массами. Низкая осмолярность смесей необходима для обеспечения изотонического питания, позволяющего избежать осложнений, характерных для применения высокоосмолярных смесей (тошнота, рвота, диарея, судороги). Отсутствие глютена и лактозы позволяет использовать данные продукты при нарушенной функции желудочно–кишечного тракта.
Данная проблема осложняется тем, что в случае болезни при ограничении питания дети раннего возраста страдают значительно сильнее, чем более старшего возраста и взрослые. Это связано с рядом анатомо–физиологических особенностей их организма: небольшой массой тела по сравнению со взрослыми (меньшие запасы питательных веществ); более быстрыми темпами роста, приводящими к повышенной потребности в энергии и пищевых субстратах; изменяющейся потребностью в нутриентах в разные возрастные периоды. В то же время функция желудочно–кишечного тракта у детей нарушается сильнее, чем у взрослых, приводя к снижению переваривающей способности, абсорбции и метаболизма нутриентов. Данные анатомические особенности определяют необходимость использования специализированных продуктов для энтерального питания у пациентов в критических состояниях.
Таким образом, питание ребенка в критическом состоянии необходимо осуществлять в соответствии с патогенезом и тяжестью основного заболевания, учитывать глубину и характер метаболических нарушений, определяющих угрозу для жизни больного, степень токсического поражения органов и систем, ответственных за процессы пищеварения и выведения конечных продуктов обмена из организма
Проведение искусственного лечебного питания с использованием специализированных лечебных продуктов (полуэлементные смеси) в раннем посттравматическом периоде у детей раннего возраста является необходимым важным компонентом в общем комплексе интенсивной терапии. Создание оптимальных режимов назначения лечебного питания, основанных на учете энергопотребностей конкретного пациента при определенной клинической ситуации, позволит улучшить лечение больных детей с хирургической патологией и в тяжелых критических состояниях в раннем посттравматическом периоде.
Литература
1. А.Ю.Барановский, И.Я.Шапиро. Искусственное питание больных. //Санкт–Петербург, 2000 г. –154 с.
2. Боровик Т.Э., Лекманов А.У. Энтеральное питание при неотложных состояниях у детей. // Рос. Педиатp. журн.– 2000. – №5. –с.49–52.
3. Карли Ф. Метаболический ответ на острый стресс. // Освежающий курс лекций по анестезиологии и реаниматологии. Архангельск. – 1996. – с. 31–33.
4. Курек В.В., Кулагин А.Е., Васильцева А.П., Слинько С.К. Опыт применения зондового питания у детей в условиях интенсивной терапии. // Анест. и реаним.– 2000.– № 1. – с.24–27.
5. Смит Б., Хикмен Р., Моррей Дж. Питание ребенка в отделении интенсивной терапии. / Интенсивная терапия в педиатрии: Пер. с англ., –М. Медицина.–1995. –Т.1.– с.39–68.
6. Apelgren K.N., Rombeau J.L., Twomey P.L., Miller R.A. Comparison of nutritional indices and outcomes in critically ill patients. // J. Crit. Care Med. 1982. – V. 10. – P. 305–307.
7. Avery M.E.et al. Transiet tyrosinemia of newborn: dietary and clinical aspects. Pediatrics. 39: 378–84, 1967.
8. Carlson M., Nordenstrom J. et al.Сlinical implications of contionius measurement of energy expenditure in mechanically ventilated patients. // J.Clin.Nutr.–1984.–V.3. – № 11.– Р. 103–110.
9. Chwals W.J., Lally K.P., Woolley M.M. et all. Measured energy expenditure in critically ill infants and young children. // J.Surg.Res.–1988.–V.44. – Р. 467–472.
10. Kinney J.M., Metabolic responses of the critically ill patient. //. Crit.Care Clin.–1995. – V.11. –– P.569–586.
11. Mentec H., Duppont H., Bocchetti M. et al. Upper digestive intolerance during enteral nutrition in critically ill patients: Frequency, risk factors and complications. //Crit.Care Med. – 2001. – V.29. – P.1955–1961.
12. Meredith J.W., Ditesheim J.A., Zaloga G.P. Visceral protein levels in trauma patients are greater with peptide than with intact protein diet. // Journal of Trauma. – 1990. – V.30. –Р.825–829.
13. Moore Е.Е, Jones T.N. Benefits of immediate jejunostomy feeding after major abdominal trauma – a prospective randomized study. // Journal of Trauma. – 1986. – V.26. – Р.874–881.
14. Napolitano L. M., Grant Bochicchio. Enteral feeding of the critically ill. //Current opinion in critical care. –2000. – № 16. –P. 136–142.
15. Pingleton S.K. Hinthorn D.R. Liu C. Enteral nutrition in patients receiving mechanical ventilation. // American Journal of Medicine. – 1986. – V.80. – Р.827– 832.
16. Rees R.G., Attrill H., Quinn D. et al. Improved design of nasogastric feeding tubes. // Clinical Nutrition. – 1986. – V.5. –Р.203–207.
17. Tilden S.J., Watkins S., Tong T.K. et al. Measured energy expenditure in pediatric intensive care patients. //Am.J.Dis. Child – 1989. –V.143. – P.490–492.











