Предстоящий эпидсезон будет отличаться циркуляцией не только обычных сезонных штаммов вируса, но и распространением «свиного» гриппа A/H1N1/Калифорния/04/2009. Проведенные исследования перекрестной реактивности показали, что иммунизация против сезонных штаммов способна в ряде случаев повысить титр антител к пандемическому штамму [7]. Отдельно следует подчеркнуть, что вакцинация позволит снизить циркуляцию сезонных вирусов среди людей, ограничивая возможность реассортации и появление новых потенциально опасных форм вируса. В сложившейся ситуации специалисты особенно подчеркивают необходимость проведения массовой вакцинации против сезонного гриппа [8].
В практике здравоохранения применяются живые, инактивированные расщепленные и субъединичные вакцины. Последние наиболее безопасны по сравнению с цельновирионными инактивированными и живыми и именно поэтому предпочтительны для вакцинации детских контингентов. Однако иммуногенность субъединичных вакцин не всегда бывает высокой и в значительной степени зависит от качества сборки субъединиц после удаления детергента. Одним из способов увеличения иммуногенности является использование адъювантов с иммуномодулирующим действием или непосредственно иммуномодуляторов в качестве адъюванта. К таким препаратам относится полиоксидоний, стимулирующий антигенпрезентирующие клетки и лимфоциты [9]. В вакцинах семейства Гриппол (Гриппол, Гриппол плюс, Гриппол Нео) сочетается современная технология получения и сборки протективных антигенов гриппа с иммуноадъювантом – Полиоксидонием.
Вакцина Гриппол плюс содержит в своем составе по 5 мкг высокоочищенных антигенов вируса гриппа и 500 мкг Полиоксидония в качестве адъюванта. Вакцина производится на современном предприятии в соответствии с мировыми стандартами производства (GMP). Выпускается в современной упаковке – индивидуальная шприц–доза со специальной атравматичной иглой для безболезненной вакцинации. Важно, что впервые в составе инактивированной отечественной вакцины нет консерванта (тиомерсала).
Повышение современных требований к оценке безопасности вакцин и необходимость ежегодной иммунизации против гриппа в первую очередь детей с увеличением охвата вакцинируемых детских контингентов определили цель настоящего исследования – оценить реактогенность и переносимость вакцины гриппозной тривалентной инактивированной полимер–субъединичной Гриппол плюс у детей в возрасте от 3 до 17 лет.
Пациенты и методы
На базе отдела профилактики инфекционных заболеваний ФГУ НИИ детских инфекций в осенний период проведена вакцинация 153 детей: 37 в возрасте 3–6 лет (20 мальчиков и 17 девочек); 64 в возрасте 7–12 лет (29 мальчиков, 35 девочек); 52 в возрасте 13–17 лет (24 мальчика, 28 девочек).
Критерии включения в исследование:
1. Лица обоего пола в возрасте от 3 до 17 лет.
2. Предыдущая вакцинация против гриппа не менее, чем за 6 мес. до настоящего исследования.
3. Отсутствие противопоказаний, предусмотренных инструкцией по применению.
Критерии исключения:
1. Наличие в анамнезе аллергических реакций на белковые препараты (в том числе сенсибилизации к белку куриного яйца).
2. Текущие острые инфекционные и неинфекционные заболевания, включая период реконвалесценции, менее одного месяца с момента клинического выздоровления.
3. Перенесенный гепатит или менингококковая инфекция, менее чем через 6 мес после выздоровления.
4. Системные заболевания соединительной ткани.
5. Наличие декомпенсированных заболеваний, которые могут повлиять на проведение исследования (декомпенсированная патология сердечно–сосудистой системы, больные с острой почечной или печеночной недостаточностью, онкологические заболевания, ВИЧ и ВИЧ–ассоциированные заболевания).
Все родители (опекуны) детей подписали добровольное информированное согласие на вакцинацию и участие в исследовании. Вакцинация проводилась внутримышечно в дельтовидную мышцу в объеме 0,5 мл. Клиническое наблюдение перед прививкой, в течение первых 5 суток, на 21–е сутки после прививки включало врачебный осмотр, термометрию, измерение артериального давления (АД). Течение поствакцинального периода оценивали как гладкое (отсутствие интеркуррентных заболеваний) или осложненное (присоединение интеркуррентных заболеваний после иммунизации). Следует отметить, что в поствакцинальном периоде проводился мониторинг и регистрация любых событий (как общих, так и местных), которые могут быть связаны или не связаны с вакцинацией. При гладком течении общие вакцинальные реакции, развивающиеся в первые 3 дня после прививки, разделяли по общепринятым критериям на слабые (появление субфебрильной температуры до 37,5°С при отсутствии симптомов интоксикации), средней силы (подъем температуры от 37,6°С до 38,5°С, кратковременные симптомы интоксикации в виде недомогания, головной боли, нарушения сна, аппетита), сильные (лихорадка выше 38,6°С, выраженные проявления интоксикации). При отсутствии температуры и симптомов интоксикации нормальный вакцинальный процесс считали бессимптомным.
На каждого привитого заведена «Индивидуальная регистрационная карта» для регистрации общих и местных реакций, возникших после вакцинации. Местные вакцинальные реакции определяли в первые 4–5 сут. и расценивали как: нормальные слабые (отек и гиперемия в месте введения вакцины не превышали 25 мм в диаметре), средние (диаметр 25–50 мм) и сильные (диаметр более 50 мм). В качестве местной вакцинальной реакции регистрировали также болезненность по субъективным ощущениям как слабую, среднюю и выраженную. В течение 4 мес. после вакцинации проведен учет интеркуррентной заболеваемости на основании опроса и справок о перенесенных заболеваниях, выданных поликлиникой по месту жительства детей.
К нормальным местным реакциям, сопровождающим вакцинацию, относились покраснение, уплотнение, отек, болезненность, крапивница, увеличение близлежащих от места инъекции лимфоузлов. Эти симптомы развиваются сразу после введения препарата и проходят в течение нескольких дней (в первые 4 дня) [10].
Статистический анализ результатов исследования проводился с помощью программы STATISTICA 6.0 (StatSoft, США). Количественные показатели представлены в виде среднего арифметического значения ± стандартная ошибка среднего. Статистический анализ проведен с использованием t–критерия Стьюдента, а при отсутствии нормального распределения – с помощью критерия Манна–Уитни. Различия считали статистически значимыми при р<0,05.
Результаты исследования
и их обсуждение
Анализ клинических проявлений местного вакцинального процесса показал, что у 13,1% привитых небольшая болезненность в месте введения вакцины отмечалась непосредственно после инъекции и сохранялась у 11,1% на 2–й день, у 7,2% на 3–й день (табл. 1). Следует отметить возможный субъективный характер этой жалобы, так как на болезненность жаловались только дети старшего возраста (7–17 лет). Объективные же проявления местной реакции в первые двое суток в виде небольшой гиперемии и уплотнения при отсутствии жалоб на болезненность чаще диагностировали у детей 3–6 лет. Гиперемия и уплотнение, которые расцениваются, как отражение нормальной реакции организма на введение белка либо на инъекцию, отмечены у 9 человек в день вакцинации. К 4 сут. проявления гиперемии сохранились только у 1 ребенка, уплотнения сохранялись не более 2 дней. Размеры гиперемии и уплотнения в основном не превышали 3–6 мм, у 3 детей размер гиперемии составил соответственно 10, 20 и 30 мм, у одного ребенка зарегистрировано уплотнение, не превышающее 15 мм.
Таким образом, все наблюдаемые явления в месте инъекции относились к нормальным реакциям слабой степени выраженности, не вызывали дискомфорта у детей и исчезали самостоятельно в течение 2–4 дней.
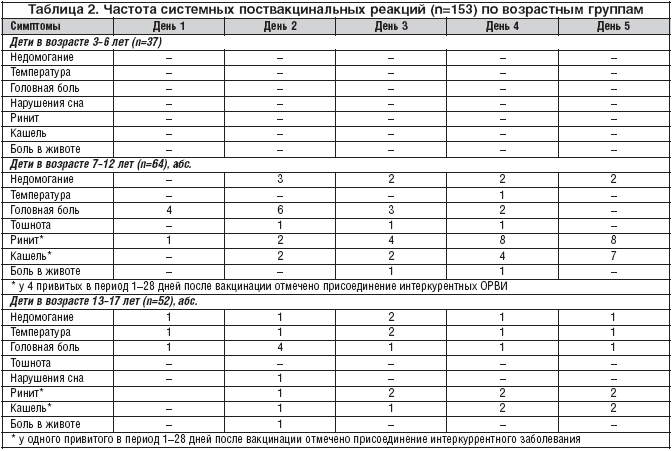
Оценка общего вакцинального процесса свидетельствует, что 99,3% детей переносили вакцинацию без температуры (табл. 2). У 1 ребенка из старшей группы в течение всех 5 дней наблюдения отмечалась температура 37,0°С без каких–либо жалоб и других клинических проявлений, что можно расценивать как фоновую температуру. У второго подростка на 3–й день отмечено однократное увеличение температуры до 37,2°С, также без жалоб, что расценено как обычная слабая вакцинальная реакция. У 1 ребенка в группе 7–12 лет однократный подъем температуры до 38,4°С на 4–й день сопровождался жалобами на боли в горле, что рассматривали как легкое респираторное заболевание, развившееся в поствакцинальном периоде и продолжавшееся 2–3 дня. Таким образом, только у 1 (0,65%) из 153 детей в поствакцинальном периоде была зарегистрирована слабой силы нормальная реакция с субфебрильной температурой.
Детальная оценка общего состояния детей после вакцинации свидетельствует о хорошей переносимости вакцины Гриппол плюс. У 93,5% привитых не выявлено проявлений вакцинального процесса, вакцинация протекала бессимптомно. Ни у одного ребенка не было поствакцинальных осложнений. Жалобы на головную боль и недомогание отмечались только у детей школьного возраста в 2,6–6,3% случаев, что не позволяет исключить их связь с другими факторами (учебной и физической нагрузкой, наслоившимися интеркуррентными заболеваниями) (табл. 2). У одной девочки 12 лет с вегето–сосудистой дистонией в анамнезе отмечались жалобы на головокружения, у нее же были жалобы и на болезненность в месте введения вакцины в течение трех дней при отсутствии объективных проявлений местного (гиперемия и уплотнение) и общего (температура) вакцинального процесса. Если учитывать любые жалобы, появившиеся в первые дни после вакцинации (недомогание, головная боль, нарушение сна, боли в животе, и т.д.), а также субфебрильную температуру, то они отмечались у 10 из 153 детей (6,5%), причем все это были дети старше 6 лет. Из 10 детей с какими–либо жалобами (у всех отмечалось несколько жалоб одновременно), у 5 постепенно развились катаральные явления в виде ринита, у троих – со второго дня присоединился кашель. С 4–го дня выявлено еще 5 детей с ринитом, из которых 4 – с кашлем, у 1 из них отмечены жалобы на тошноту и боли в животе, что заставило подозревать развитие энтеровирусной инфекции. Учитывая увеличение числа детей с клиническими признаками ОРВИ на поздних сроках (4–5 день после прививки), можно предполагать, что все 10 детей, имевших ринит, были инфицированы ОРВИ и, следовательно, симптоматика недомоганий и других указанных выше жалоб была связана с заболеванием, а не с прививкой. Все дети с катаральными симптомами были школьного возраста, что также говорит в пользу заболевания, а не вакцинальной реакции. С учетом сроков появления (катаральный синдром выявлен после 4 сут.) только у 5 детей указанные симптомы расценены, как интеркуррентные заболевания.
При анализе безопасности вакцины отмечалось, что Гриппол плюс хорошо переносится детьми, реакции зарегистрированы у небольшого числа детей и относятся к нормальным вакцинальным реакциям слабой степени выраженности. Полученные результаты позволяют утверждать, что вакцина Гриппол плюс – малореактогенный препарат, который имеет высокий профиль безопасности. Комплекс свойств препарата (сниженная антигенная нагрузка на организм, иммуноадъювантные свойства Полиоксидония, отсутствие консерванта, доказанная в ходе двойных слепых испытаний высокая иммуногенность) позволяет рекомендовать его для широкого применения в детской практике, в том числе в рамках Национального календаря прививок.

Литература
1. Таточенко В.К. и др. Иммунопрофилактика–2009 *(Справочник), М., 2009, с.66
2. Об итогах распространения гриппа и ОРВИ в России в эпидсезон 2007/2008гг. Письмо Роспотребнадзора РФ от 19.06.08 №01/6424–8–32
3. О санитарно–эпидемиологической обстановке в Российской Федерации в 2008 году: Государственный доклад.—М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2009.—467 с.
4. www.who.int/wer No. 33, 2005, 80, 277–288
5. CDC. Prevention and control of influenza: recommendations of the Advisory Committee on Immunization Practices [ACIP]. MMWR 2005; 54 [No. RR–8]:1–42.
6. Fiore A.E., Shay D.K., Broder K., et al. Prevention and Control of Influenza Recommendations of the Advisory Committee on Immunization Practices (ACIP), 2008. MMWR, August 8, 2008 . – 57.–RR07. – Р.1–60
7. Department of Health and Human Services Centers for Disease Control and Prevention. Serum Cross–Reactive Antibody Response to a Novel Influenza A (H1N1) Virus After Vaccination with Seasonal Influenza Vaccine. Morbidity and Mortality Weekly Report, 2009 58(19)
8. Centers for Disease Control and Prevention. 2009–10 Influenza Prevention & Control Reccomendations (http://www.cdc.gov/flu/professionals/acip/persons.htm)
9. Пинегин Б.В., Иванова А.С., Климова С.В. и др. Влияние тривалентной конъюгированной полимер–субъединичной вакцины Гриппол на иммунный статус привитых добровольцев // Иммунология. 2003. №3. С. 8–15.
10. Харит С.М., Лакоткина Е.А., Черняева Т.В., и др. Дифференциальный диагноз поствакцинальных осложнений // Т–пациент. Прил. Педиатрия. 2006, №2. С. 17–22











