Первые указания на необычные реакции на пищу принадлежат еще Гиппократу, который описал проявления повышенной чувствительности на молоко. Анафилактические реакции на яйцо и рыбу были описаны в XVI и XVII веках (Sampson H.A., 1999). На протяжении столетий реакциям на пищевые продукты уделяли внимание врачи и их пациенты. В XX веке произошел качественный перелом как в составе пищевого рациона, потребляемого «обычным» человеком, так и в попытках объяснить возможные механизмы «необычных» реакций на продукты. Многообразие клинических проявлений, отсутствие общепринятой классификации, возможности «безграничной интерпретации неизвестных» механизмов реакций на пищевые продукты сегодня зачастую приводят к сомнительному диагнозу и неоправданным ограничениям рациона питания.
Классификации побочных реакций на пищевые продукты основаны на выделении иммунных и неиммунных форм пищевой непереносимости. Пищевой аллергией называют вызванную приемом пищевого продукта побочную реакцию, в основе которой лежат иммунные механизмы. При этом выделяют IgE– и не–IgE–медиируемые реакции.
Кожные проявления пищевой аллергии наиболее часто представлены:
- IgE–медиируемыми реакциями, которые манифестируют крапивницей/отеком Квинке,
- не–IgE–медиируемыми реакциями – герпетиформный дерматит,
- сочетанием IgE– и не–IgE–медиируемых реакций – атопический дерматит.
Крапивница – заболевание, проявляющееся преходящими высыпаниями, морфологическим элементом которых является волдырь – четко ограниченный участок отека дермы. Цвет волдырей варьирует от светло–розового до ярко красного, размеры от 1–2 мм до нескольких сантиметров.
Отек Квинке – четко локализованный участок отека дермы и подкожной клетчатки. Высыпания обычно исчезают в течение 24 часов, и после них не остается следов.
Среди продуктов наиболее частая причина острой крапивницы – молоко, рыба, крабы, бобовые, орехи и яйцо. Различные фрукты и овощи могут также являться причиной IgE–опосредованной крапивницы. Необходимо подчеркнуть, что хроническая крапивница у детей редко связана с пищевой гиперчувствительностью (Sampson H.A., 1999).
Известен ряд продуктов, которые при контакте с неповрежденной кожей вызывают крапивницу. Типичным примером могут служить яйца, рыба. Достаточно часто встречается контактная гиперчувствительность к коровьему молоку, в частности, к белкам – лактоглобулину и казеину, проявляющаяся в виде рецидивирующей крапивницы. Дифференциальный диагноз кожных реакций, индуцированных локальным контактом или системной абсорбцией, особенно сложен у детей раннего возраста, которые контактируют с пищевыми продуктами различными участками тела.
Герпетиформный дерматит – заболевание, манифестирующее зудящей сыпью, обычно распространяемой на экстензорной поверхности и ягодицах. Высыпания могут быть представлены уртикариями, везикулами, папулами. В области ладоней и подошв возможно развитие геморрагических элементов. Герпетиформный дерматит связан с целиакией и гиперчувствительностью к глютену. В 75–90% случаев выявляют целиакию, в остальных глютензависимая гиперчувствительность является субклинической и проявляется при массивном воздействии глютена. Наиболее часто встречается у детей в возрасте 2–7 лет. Необходимо подчеркнуть, что при использовании диеты с элиминацией глютена положительная динамика со стороны кожных покровов возникает в более поздние сроки по сравнению с нормализацией функционирования кишечника.
Значение пищевой аллергии в формировании атопического дерматита у детей показано в ряде исследований (Балаболкин И.И., Гребенюк В.Н., 1999). Так, пищевая аллергия играет ключевую роль у 1/3–1/2 детей с атопическим дерматитом (Sampson H.A., McCaskill C.C., 1985). Повторяющееся воздействие пищевых аллергенов ведет к хроническому воспалению, зуду, вызывающему расчесы с последующим формированием лихенифицирующего повреждения кожи (Sampson H.A., 1995).
Характерным для значительной части детей с пищевой аллергией является ее транзиторность. В частности, к 3–х летнему возрасту полностью выздоравливают от 70 до 90% детей, ранее имевших проявления пищевой аллергии в виде атопического дерматита (Host A., 1997). Вместе с тем данная тенденция выявляется не для всех продуктов. Так, к 5–летнему возрасту у детей с выявленной в 1 год пищевой аллергией в 10% случаев сохранялась гиперчувствительность к коровьему молоку, в 20% – к яйцу и в 60% – к арахису. Необходимо подчеркнуть, что несмотря на наличие поливалентной сенсибилизации у большинства детей, клинически значимой обычно является сенсибилизация к 1 или 2 пищевым аллергенам (Bernhisel–Broadbent J., 1989).
В работе Guillet G., Guillet M.H. (1992) было продемонстрировано наличие прямой корреляции между тяжестью атопического дерматита и вероятностью пищевой аллергии. В проспективном исследовании доказан положительный эффект элиминации яйцесодержащих продуктов у детей раннего возраста, имеющих сенсибилизацию к релевантному аллергену (Lever R. и соавт., 1998).
Поражения желудочно–кишечного тракта занимают второе место среди патологии, вызываемой пищевыми аллергенами. Клинические проявления IgE–опосредованных заболеваний желудочно–кишечного тракта обычно встречаются в комплексе с поражением кожи и манифестируют в виде различных симптомов (рвота, тошнота, боль, диарея). К не–IgE–медиируемым реакциям на пищевые продукты относятся энтероколит, индуцированный пищевыми белками; проктит/проктоколит, индуцированный пищевыми белками у детей раннего возраста; энтеропатия, индуцированная пищевыми белками, и целиакия. В патогенезе эозинофильного эзофагита и эозинофильного гастроэнтерита предполагается роль IgE– и не–IgE–медиируемых реакций на пищевые продукты.
Оральным аллергическим синдромом могут страдать как дети, так и взрослые. Симптомы ограничены поражением орофарингеальной области и проявляются зудом, чувством дискомфорта, ангиоотеком губ, языка, неба. Симптомы, как правило, возникают в течение минут после контакта с соответствующими продуктами и обычно недлительны.
Существует мнение, что оральный аллергический синдром распространен в большей степени у взрослых. Вместе с тем, вероятно, варьирует не столько частота наличия орального аллергического синдрома, сколько спектр гиперчувствительности к пищевым аллергенам. Так, у детей заболевание преимущественно ассоциировано с аллергенами яйца, рыбы, орехов, бобовых. У взрослых наряду с перечисленными продуктами значение приобретают овощи и фрукты. Важным аспектом данной нозологии у детей старшего возраста является наличие перекрестной IgE–опосредованной гиперчувствительности к пыльце и пищевым продуктам (яблокам, лесным орехам, сельдерею, моркови с березой; вишне, абрикосам, сливе, персику с бразильским орехом) (Sicherer S., 2001; Fritsch R., 1998).
Реакции немедленной гиперчувствительности в желудочно–кишечном тракте могут проявляться в любом возрасте и развиваются в течение минут – двух часов после употребления продукта. Временные рамки являются ключевыми для диагностики IgE–опосредованной гиперчувствительности. К наиболее выраженным симптомам относятся рвота, тошнота, колики, абдоминальные боли, диарея. Изолированные IgE–опосредованные симптомы поражения желудочно–кишечного тракта редки. Характерным представляется сочетание дерматологических и желудочно–кишечных симптомов, связанных с атопической гиперчувствительностью.
Рвота – наиболее яркий симптом, но она может быть менее выражена при длительной экспозиции аллергена. В этом случае ведущими симптомами являются потеря аппетита, снижение веса, абдоминальные боли (Walker– Smith J.A.) Необходимо подчеркнуть, что значение количества перорально вводимого аллергена в развитии различных дискинетических нарушений желудочно–кишечного тракта доказано в эксперименте Frick O. (1995).
Среди проявлений IgE–опосредованной гиперчувствительности необходимо отметить синдром, заключающийся в сочетании запора и сенсибилизации к коровьему молоку (Iacono G., 1996). При тщательной оценке выявляется, что большинство больных с этим заболеванием имеют проктит. Кроме того, согласно нашим наблюдениям, причиной запора при пищевой аллергии может быть анальный зуд. В этом случае ребенок сдерживает дефекацию и запор приобретает привычный характер. Запоры уменьшаются после отмены молочных продуктов.
Симптомы энтероколита, индуцированного пищевыми белками, включают рвоту и профузную диарею с развитием тяжелого шокоподобного состояния (Dupont C., 2000). Большинство больных с энтероколитом, индуцированным пищевыми белками, – это дети первых дней – месяцев жизни. Так, Powell G. (1976) описал 9 детей с персистирующей рвотой и диареей в возрасте 4–27 дней, находящихся на вскармливании смесями на основе коровьего молока. Переход на диету на основе соевых смесей характеризовался транзиторным улучшением с возвратом симптомов приблизительно через 7 дней. Обычно заболевание исчезает к 2–м годам, но иногда может персистировать и в старшем возврате. Установлено, что у всех детей раннего возраста, страдавших энтероколитом, индуцированным пищевыми белками, кожные прик–тесты и специфические IgE (RAST) к релевантным аллергенам (коровье молоко или соя) негативны. В отличие от IgE–медиируемых реакций симптомы энтероколита, индуцированного пищевыми белками, начинаются спустя 1–10 часов после употребления соответствующего продукта. Симптомы обычно начинаются с рвоты, за которой следует диарея (Sicherer S., 2000). Рвота начинается через 2–4 часа. Симптомы исчезают в течение 72 часов после элиминации аллергена, однако могут продолжаться и более длительно в связи с развитием вторичной дисахаридазной недостаточности. Наиболее частыми продуктами, вызывающими энтероколит у детей первого года жизни, являются коровье молоко и соя (Sicherer S., 1998). У детей старшего возраста провоцирующими факторами обычно являются яйцо, пшеница, рис, кукуруза и горох.
Пищевая аллергия – наиболее частая причина ректальных кровотечений у детей раннего возраста. Проктит, индуцированный пищевыми белками, обнаруживается у детей первых месяцев жизни и проявляется появлением примеси крови в кале на фоне хорошего самочувствия. Средний возраст постановки диагноза приблизительно 60 дней, однако обычно кровотечение наблюдается в течение нескольких недель до установления правильного диагноза. Потери крови обычно небольшие. Наиболее частыми триггерами являются смеси на основе сои и коровьего молока. Синдром может развиться и у детей, находящихся исключительно на грудном вскармливании (Lake A.M., 1997). Элиминация из диеты сои и коровьего молока приводит к исчезновению явного кровотечения в течение 72 часов. Длительность продолжения скрытого кровотечения не известна. В случае развития заболевания на фоне гидролизованных смесей возможен эффект от использования аминокислотных смесей.
Энтеропатия, индуцированная пищевыми белками, проявляется у детей раннего возраста и заключается в диарее, рвоте и недостаточном наборе веса. При биопсии кишечника обнаруживается атрофия ворсинок, клеточная инфильтрация, что приводит к нарушению абсорбции и потерям белка, а в итоге – к отекам у некоторых больных (Walker–Smith J., 1994). Анемия не выражена. Гиперчувствительность к молоку наиболее распространена, но может сочетаться с сенсибилизацией к сое, яйцу, пшенице и другим продуктам. Кровопотеря быстро исчезает после элиминации белков коровьего молока. Большинство больных становятся толерантными к молоку при достижении 1–3 летнего возраста. Имеются отдельные сообщения о данном заболевании у детей старшего возраста.
Целиакия представляет собой энтеропатию, индуцированную пищевым белком, содержащим глиадин, который содержится в пшенице, овсе, рисе, ячмене (Collin P., 1999). Диагноз документируется типичными гистологическими находками (атрофия ворсинок и клеточные инфильтраты), которые нивелируются при элиминации глиадина из диеты. Гастроинтестинальные симптомы включают потерю веса, хроническую диарею, стеаторею. Возможно развитие оральных язв (Poon E., Nixon R., 2001).
Эозинофильный гастроэнтерит может поражать больных всех возрастов (Kelly K.) и проявляется во множестве симптомов: абдоминальные боли, диарея, потеря веса, мелена и т.д. В биоптате слизистой желудка и кишечника выявляется эозинофильная инфильтрация. Возможна эозинофилия в периферической крови. Необходимо помнить, что и при ряде других поражений эозинофилы могут быть обнаружены в ЖКТ (паразитарные инфекции, воспалительные заболевания кишечника). Диагноз эозинофильного гастроэнтерита устанавливается только после исключения других заболеваний.
Эозинофильный эзофагит проявляется у детей и взрослых (Moon A., 1995). Симптомы эозинофильного эзофагита аналогичны манифестации гастроэзофагального рефлюкса, но не отвечают на антирефлюксную терапию. Рвота и абдоминальные боли – наиболее частые симптомы. Кроме того, возможны анемия (вследствие скрытого кровотечения), потеря веса, ахалазия. Необходимо подчеркнуть, что не исключено и развитие других симптомов. Так, Vitellas K. et al. сообщили о 13 больных с эозинофильным эзофагитом, у которых отмечались дисфагия (12/13), аллергические симптомы (10/13), эозинофилия в периферической крови (12/13), стриктуры проксимального отдела пищевода (10/13) и положительный ответ на кортикостероидную терапию, что свидетельствует о наличии воспалительного процесса. В ряде исследований было установлено, что эозинофильный эзофагит может иметь место и в детском возрасте. Kelly K. et al. (1995) обследовали 23 ребенка с классическими симптомами гастроэзофагальной рефлюксной болезни, которые не исчезали при стандартной терапии. Количество эозинофилов в биоптате было увеличено по сравнению с детьми, имевшими обычный гастроэзофагальный рефлюкс. При открытых провокационных пробах молоко индуцировало симптомы у 7 детей, соя – 4, пшеница – 2, арахис – 2, яйцо – 1. Таким образом, пищевая аллергия, вероятно, играет определенную роль в патогенезе эозинофильного эзофагита у детей.
Легкие являются одним из шоковых органов, которые поражаются при пищевой аллергии. Вместе с тем, эти заболевания выявляются значительно реже по сравнению с болезнями кожи и желудочно–кишечного тракта. Наиболее часто встречаемой клинической манифестацией легочной патологии при пищевой аллергии являются бронхиальная астма и аллергический ринит, заболевания, ассоциированные с IgE–медиируемыми реакциями. Изолированные назальные и бронхиальные реакции на пищевые продукты встречаются достаточно редко. Более характерно их вовлечение в реакции, связанные с пищевой аллергией при наличии атопического поражения кожи и желудочно–кишечного тракта. Частота респираторных симптомов, подтвержденных провокационным тестированием, составляет от 6% до 25% и максимальна у детей с атопическим дерматитом и астмой (James J.M., Eigenmann; Sampson H. 1999; Bock S., 1992; Novembre F. et al.). Большинство астматических реакций к пищевым продуктам связано с присутствием специфических IgE (Bock S., 1992; James J.M.; Sampson H.A., 1993; Sampson H.A., Mendelson L.M., Rosen J.P., 1992) . Среди широкого спектра пищевых продуктов, способных индуцировать бронхоспазм, особое внимание необходимо уделить арахису, лесному ореху (Bock S.A., 1992).
Астматические реакции могут появляться при прямой ингаляции аэрозоля, содержащего пищевые аллергены. Эти реакции обычно происходят у больных с аллергией к рыбе, морепродуктам, яйцу при условиях их приготовления в ограниченном пространстве. Необходимо отметить, что заложенность носа у детей 1 года жизни, часто связываемая с употреблением коровьего молока, выявляется при проведении провокационного тестирования с данным продуктом менее чем у 0,2 % обследованных (Bock S.A., 1987; Host A., Halken S., 1990; Schrander J.J.P., 1993). Вместе с тем первичный путь экспозиции пищевых аллергенов, которые вызывают астму – пероральный, а не ингаляционный.
Синдром Гейнера возникает у детей первых месяцев жизни и характеризуется не–IgE–медиируемой иммунной реакцией к белкам коровьего молока. Клинически это проявляется свистящим дыханием, одышкой, кашлем, периодически возникающими инфильтратами в легких, легочным гемосидерозом, анемией, рецидивирующими пневмониями, задержкой роста (Heiner D.C., Sears J.W.). Возможны риниты, формирования легочного сердца, рецидивирующие отиты, а также различные симптомы поражения желудочно–кишечного тракта. Преципитирующие антитела класса G к коровьему молоку обнаружены у больных с данной патологией. Симптомы уменьшаются при исключении коровьего молока и рецидивируют при повторном его введении в диету.
К наиболее тяжелым и, к счастью, наиболее редким проявлениям пищевой аллергии относятся системные реакции – анафилаксия. В США пищевые продукты вызывают анафилаксию со смертельным исходом приблизительно у 100 человек в год (Yocum M.W., 1994). Необходимо подчеркнуть, пищевая аллергия – наиболее частая причина внегоспитальной анафилаксии (Sampson H.A., Mendelson L., Rosen J.P., 1992; Yocum M.W., 1999). По данным Rance F. (1999), из 544 детей с подтвержденной пищевой гиперчувствительностью анафилаксия являлась частью их клинических проявлений у 27 (4.9%). Наиболее частыми причинами анафилаксии, индуцированной пищевыми продуктами и подтвержденной двойной слепой, плацебо–контролируемой провокацией, являются яйца, коровье молоко, арахис, соя, рыба, морепродукты и различные орехи (Bock S.A., Atkins F.M., 1990, Burks A.W., James J.M., Hiegel A., 1998). Причем наиболее «опасными» продуктами, вызывающими летальную или тяжелую анафилаксию, являются арахис и орехи, растущие на деревьях: лесной орех, грецкий орех, кешью, фисташки, миндаль, а также морепродукты: моллюски, крабы, лобстеры, устрицы (Wuthrich B., 2000; Yunginger J.W., 1988). Патофизиология анафилаксии понятна не до конца, и ее связывают с массивным высвобождением медиаторов.
Клинические проявления анафилаксии, вызванной пищевыми продуктами, включают отек гортани, крапивницу, ангиоотек, стридор, бронхообструкцию, одышку, рвоту, абдоминальные боли, гипотензию, загрудинные боли, сердечную аритмию и т.д. Ряд факторов предрасполагает к развитию анафилаксии, вызванной пищевыми продуктами:
- наличие в анамнезе личной и наследственной отягощенности по атопическим заболеваниям (в особенности бронхиальной астмой);
- максимальный риск в первые 2 года жизни, а затем он снижается;
- диета, содержащая наиболее распространенные аллергены в течение первого года жизни, вероятно, способствует формированию сенсибилизации;
- особенности национальной кухни также определяют спектр пищевых продуктов, к которым развивается гиперчувствительность.
Анафилаксия к пищевым продуктам может являться одной из причин синдрома внезапной смерти. Аллергия к белкам коровьего молока, видимо, играет определенную роль в данном синдроме у детей первых месяцев жизни (Coombs R.R.A., Holgate S.T., 1990).
Приблизительно треть больных с анафилаксией к пищевым продуктам имеют двухфазную реакцию, у 1/4 больных отмечаются пролонгированные (до 3 недель) симптомы (Sampson H.A., Mendelson L.M., Rosen J.P., 1992).
У части пациентов анафилаксия появляется только в том в случае, если физической нагрузке предшествует употребление определенного продукта, к которому у больного определяются положительные скарификационные пробы. Эти продукты (сельдерей, крабы, пшеница) могут быть использованы в пище в течение последних 24 часов.
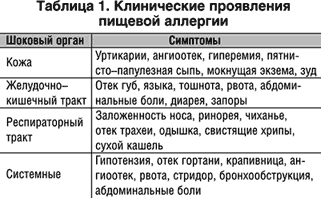
Заключение. Клинические проявления пищевой аллергии чрезвычайно вариабельны (табл. 1). Поэтому, учитывая многообразие клинических манифестаций пищевой аллергии у детей, перед проведением специальных методов обследования рекомендуется ответить на следующие вопросы:
- Какой продукт подозревается?
- Вызывает ли «подозреваемый» продукт определенные симптомы при каждом его употреблении и как это зависит от его количества?
- Какой период необходим для возникновения симптомов после еды?
- Какова продолжительность симптомов?
- Возможно ли развитие клинических проявлений без употребления «подозреваемого» продукта?
1. Балаболкин И.И., Гребенюк В.Н. Атопический дерматит у детей.– Москва.–1999.– 240с.
2. Bernhisel–Broadbent J., Taylor S., Sampson H.A.: Cross–allergenicity in the legume botanical family in children with food hypersensitivity. II. Laboratory correlates. J Allergy Clin Immunol 84:701–709, 1989
3. Bock S.A., Atkins F.M.: Patterns of food hypersensitivity during sixteen years of double–blind placebo–controlled oral food challenges. J Pediatr 117:561–567, 1990
4. Bock S.A.: Respiratory reactions induced by food challenges in children with pulmonary disease. Pediatr Allergy Immunol 3:188–194, 1992.
5. Bock S.A.. Prospective appraisal of complaints of adverse reactions to foods in children during the first 3 years of life. Pediatrics 1987;79:683–8.
Burks A.W., James J.M., Hiegel A.: Atopic dermatitis and food hypersensitivity reactions. J Pediatr 132:132–136, 1998
6. Collin P., Kaukinen K., Maki M.: Clinical features of celiac disease today. Dig Dis Sci 17:100–106, 1999
7. Coombs R.R.A., Holgate S.T.: Allergy and cot death: With special focus on allergic sensitivity to cows’ milk and anaphylaxis. Clin Exp Allergy 20:359–366, 1990
8. Guillet G., Guillet M.H. Natural history of sensitizations in atopic dermatitis. Arch Dermatol 1992;128:187–92.
9. Dupont C., Heyman M.: Food protein–induced enterocolitis syndrome: Laboratory perspectives. J Pediatr Gastroenterol Nutr 30(suppl):50–57, 2000
10. Frick O., Ermel R., Reinhart G. Late–phase reactions to foodsin atopic dogs. 15 International Congress of allergology and clinical immunology. Stockholm, p.104–1994.
11. Fritsch R., Bohle B., Vollmann U.: Bet v 1, the major birch pollen allergen, and Mal d 1, the major apple allergen, cross–react at the level of allergen–specific T helper cells. J Allergy Clin Immunol 102:679–686, 1998.
12. Heiner D.C., Sears J.W.: Chronic respiratory disease associated with multiple circulating precipitins to cow’s milk. Am J Dis Child 100:500–502, 1960
13. Host A. Development of atopy in childhood. Allergy 1997: 52: 695–7.
14. Host A., Halken S. A prospective study of cow milk allergy in Danish infants during the first 3 years of life. Allergy 1990;45:587–96.
15. James J.M., Bernhisel–Broadbent J., Sampson H.A.: Respiratory reactions provoked by double–blind food challenges in children. Am J Respir Crit Care Med 149:59–64, 1994.
16. Iacono G., Carroccio A., Cavataio F.: Gastroesophageal reflux and cow’s milk allergy in infants: A prospective study. J Allergy Clin Immunol 97:822–827, 1996
17. Kelly K.: Eosinophilic gastroenteritis. J Pediatr Gastroenterol Nutr 30(suppl):28–35, 2000
18. Kelly K., Lazenby A., Rowe P.: Eosinophilic esophagitis attributed to gastroesophageal reflux: Improvement with an amino acid–based formula. Gastroenterology 109:1503–1512, 1995
19. Lake A.M.: Beyond hydrolysates: Use of L–amino acid formula in resistant dietary protein–induced intestinal disease in infants. J Pediatr 131:658–660, 1997
20. Lever R., MacDonald C., Waugh P., Aitchison T. Randomized controlled trial of advice on an egg exclusion diet in young children with atopic eczema and sensitivity to eggs. Pediatr Allergy Immunol 1998;9:13–9.
21. Moon A., Kleinman R.: Allergic gastroenteropathy in children. Ann Allergy Asthma Immunol 74:5–9, 1995
22. Poon E., Nixon R. Cutaneous spectrum of coeliac disease. Aust J Dermatol 42:136–138, 2001
23. Powell G.K. Enterocolitis in low–birth–weight infants associated with milk and soy protein intolerance. J Pediatr 1976;88:840–4.
24. Sicherer S. Clinical implications of cross–reactive food allergens. J Allergy Clin Immunol 2001;108:881–90.
25. Sampson H.A.: Food allergy: I. Immunopathogenesis and clinical disorders. J Allergy Clin Immunol 103:717–728, 1999
26. Sampson H.: Food allergy: II. Diagnosis and management. J Allergy Clin Immunol 103:981–989, 1999
27. Sampson H.A., McCaskill C.C. Food hypersensitivity and atopic dermatitis: Evaluation of 113 patients. J Pediatr 1985;107:669.
28. Sampson H.A., Mendelson L., Rosen J.P.: Fatal and near–fatal food anaphylaxis reactions in children. N Engl J Med 327:380–384, 1992
29. Sampson H.: Diagnosing food allergy. In Spector S (ed): Provocation Testing in Clinical Practice.NewYork,MarcelDekker,1995,p.623.
30. Sampson H.A., Mendelson L.M., Rosen J.P.: Fatal and near–fatal anaphylactic reactions to food in children and adolescents. N Engl J Med 327:380–384, 1992
31. Sampson H.A.: Adverse reactions to foods. In Middleton EJ, Reed CE, Ellis EF, et al (eds): Allergy, Principles and Practice. St. Louis, Mosby, 1993, pp 1661–1686
32. Schrander J.J.P., van den Bogart J.P.H., Forget P.P., Schrander–Stumpel C.T.R.M., Kuijten R.H., Kester A.D.M. Cow’s milk protein intolerance in infants under 1 year of age: a prospective epidemiological study. Eur J Pediatr 1993;152:640–4.
33. Sicherer S.: Food protein–induced enterocolitis syndrome: Clinical perspectives. J Pediatr Gastroenterol Nutr 30(suppl):45–49, 2000
34. Sicherer S., Eigenmann P., Sampson H.: Clinical features of food protein–induced enterocolitis syndrome. J Pediatr 133:214–219, 1998
35. Novembre E., de Martino M., Vierucci A.: Foods and respiratory allergy. J Allergy Clin Immunol 81:1059–1065, 1988
36. Vitellas K., Bennett W., Bova J.: Radiographic manifestations of eosinophilic gastroenteritis. Abdom Imaging 20:406–413, 1995
37. Walker–Smith J.: Food sensitive enteropathy: Overview and update. Acta Paediatr Jpn 36:545–549, 1994
38. Walker–Smith J.A., Ford R.P., Phillips A.D.: The spectrum of gastrointestinal allergies to food. Ann Allergy 53:629–636, 1984
39. Wuthrich B.: Lethal or life–threatening allergic reactions to food. Invest Allergol Clin Immunol 10:59–65, 2000
40. Yocum M.W., Khan D.A.: Assessment of patients who have experienced anaphylaxis: A 3–year survey. Mayo Clin Proc 69:16–23, 1994
41. Yocum M.W., Butterfield J.H., Klein J.S.: Epidemiology of anaphylaxis in Olmsted County: A population–based study. J Allergy Clin Immunol 104:452–456, 1999
42. Yunginger J.W., Sweeney K.G., Sturner W.Q.: Fatal food–induced anaphylaxis. JAMA 260:1450–1452, 1988











