–Т–≤–µ–і–µ–љ–Є–µ
–С–Њ–ї–µ–Ј–љ—М –љ–∞–Ї–Њ–њ–ї–µ–љ–Є—П —Н—Д–Є—А–Њ–≤ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –Є –±–Њ–ї–µ–Ј–љ—М –Т–Њ–ї—М–Љ–∞–љ–∞ —П–≤–ї—П—О—В—Б—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ–Є —Д–µ–љ–Њ—В–Є–њ–∞–Љ–Є –µ–і–Є–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П вАФ –і–µ—Д–Є—Ж–Є—В–∞ –ї–Є–Ј–Њ—Б–Њ–Љ–љ–Њ–є –Ї–Є—Б–ї–Њ–є –ї–Є–њ–∞–Ј—Л (–Ф–Ы–Ъ–Ы), –љ–∞—Б–ї–µ–і—Б—В–≤–µ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є –љ–∞–Ї–Њ–њ–ї–µ–љ–Є—П [1].–Ы–Є–Ј–Њ—Б–Њ–Љ–љ–∞—П –Ї–Є—Б–ї–∞—П –ї–Є–њ–∞–Ј–∞ (–Ы–Ъ–Ы) —П–≤–ї—П–µ—В—Б—П –≤–∞–ґ–љ—Л–Љ —Д–µ—А–Љ–µ–љ—В–Њ–Љ –Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞, –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—Й–Є–Љ –≥–Є–і—А–Њ–ї–Є–Ј —Н—Д–Є—А–Њ–≤ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –Є —В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–Њ–≤. –≠—В–Њ—В –њ—А–Њ—Ж–µ—Б—Б –Є–Љ–µ–µ—В —Д—Г–љ–і–∞–Љ–µ–љ—В–∞–ї—М–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –≤ –Њ–±–µ—Б–њ–µ—З–µ–љ–Є–Є –Ї–ї–µ—В–Њ–Ї –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–Њ–Љ, –Ї–Њ—В–Њ—А—Л–є —Г—З–∞—Б—В–≤—Г–µ—В –≤ —А–Њ—Б—В–µ –Ї–ї–µ—В–Ї–Є, —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–Є –µ–µ –Љ–µ–Љ–±—А–∞–љ—Л –Є –њ—А–Њ—З–Є—Е –≤–∞–ґ–љ—Л—Е —Д—Г–љ–Ї—Ж–Є—П—Е [2]. –Я—А–Є –њ–Њ—П–≤–ї–µ–љ–Є–Є –≤—А–Њ–ґ–і–µ–љ–љ–Њ–є –Љ—Г—В–∞—Ж–Є–Є –≥–µ–љ–∞ LIPA, –Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Ј–∞ —Б–Є–љ—В–µ–Ј –Ы–Ъ–Ы, –њ—А–Њ–Є—Б—Е–Њ–і—П—В —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —Д–µ—А–Љ–µ–љ—В–∞, –љ–∞—А—Г—И–µ–љ–Є–µ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ —Н—Д–Є—А–Њ–≤ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –Є —В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–Њ–≤ –Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–µ –љ–∞–Ї–Њ–њ–ї–µ–љ–Є–µ –Є—Е –≤ –ї–Є–Ј–Њ—Б–Њ–Љ–∞—Е –Ї–ї–µ—В–Њ–Ї. –≠—В–Њ, –≤ —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М, –њ—А–Є–≤–Њ–і–Є—В –Ї –Ї–ї–µ—В–Њ—З–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є –Є –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—О —А–∞–Ј–ї–Є—З–љ—Л—Е –Њ—А–≥–∞–љ–Њ–≤ –Є —В–Ї–∞–љ–µ–є [3, 4]. –Ю—Б–љ–Њ–≤–љ—Л–Љ–Є –Њ—А–≥–∞–љ–∞–Љ–Є-–Љ–Є—И–µ–љ—П–Љ–Є –њ—А–Є –Ф–Ы–Ъ–Ы –≤—Л—Б—В—Г–њ–∞—О—В –њ–µ—З–µ–љ—М, —Б–µ–ї–µ–Ј–µ–љ–Ї–∞, –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–Є, –Ї–Є—И–µ—З–љ–Є–Ї, —Б—В–µ–љ–Ї–Є —Б–Њ—Б—Г–і–Њ–≤. –Ю–і–љ–∞–Ї–Њ –і—А—Г–≥–Є–µ –Њ—А–≥–∞–љ—Л —В–∞–Ї–ґ–µ –≤–Њ–≤–ї–µ—З–µ–љ—Л –≤ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –њ—А–Њ—Ж–µ—Б—Б –Ј–∞ —Б—З–µ—В –њ–Њ–≤—А–µ–ґ–і–µ–љ–љ—Л—Е –Љ–∞–Ї—А–Њ—Д–∞–≥–Њ–≤, –≤ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–µ –Ї–Њ—В–Њ—А—Л—Е –Ы–Ъ–Ы –Є–≥—А–∞–µ—В –≤–µ–і—Г—Й—Г—О —А–Њ–ї—М [1].
–Т —Б–≤—П–Ј–Є —Б —Б–Є—Б—В–µ–Љ–љ—Л–Љ —Е–∞—А–∞–Ї—В–µ—А–Њ–Љ –Ф–Ы–Ъ–Ы –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —А–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–љ—Л, —З—В–Њ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –≤–ї–Є—П–љ–Є–µ –љ–∞ —Б–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ–Њ—Б—В—М —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –≤–µ—А–љ–Њ–≥–Њ –і–Є–∞–≥–љ–Њ–Ј–∞.
–Ш–љ—Д–∞–љ—В–Є–ї—М–љ–∞—П —Д–Њ—А–Љ–∞ –Ф–Ы–Ъ–Ы, –Є–ї–Є –±–Њ–ї–µ–Ј–љ—М –Т–Њ–ї—М–Љ–∞–љ–∞, –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є —В—П–ґ–µ–ї–Њ–µ, –±—Л—Б—В—А–Њ–њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–µ, —А–∞–Ј–≤–Є–≤–∞—О—Й–µ–µ—Б—П –≤ –њ–µ—А–≤—Л–µ –љ–µ–і–µ–ї–Є –ґ–Є–Ј–љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ. –°–Њ—Б—В–Њ—П–љ–Є–µ –Љ–∞–љ–Є—Д–µ—Б—В–Є—А—Г–µ—В —Б –љ–∞—А—Г—И–µ–љ–Є—П –≤—Б–Ї–∞—А–Љ–ї–Є–≤–∞–љ–Є—П, —В–Њ—И–љ–Њ—В—Л, —А–≤–Њ—В—Л, —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Љ–∞–ї—М–∞–±—Б–Њ—А–±—Ж–Є–Є, –Ј–∞–і–µ—А–ґ–Ї–Є —А–Њ—Б—В–∞ –Є —А–∞–Ј–≤–Є—В–Є—П –Є —В—П–ґ–µ–ї–Њ–≥–Њ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –њ–µ—З–µ–љ–Є [1]. –Я—А–Є —А–∞–љ–љ–µ–є —Д–Њ—А–Љ–µ –Ф–Ы–Ъ–Ы –њ—А–Њ–≥–љ–Њ–Ј –Ї—А–∞–є–љ–µ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–є вАФ –Љ–µ–і–Є–∞–љ–∞ –≤–Њ–Ј—А–∞—Б—В–∞ —Б–Љ–µ—А—В–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 3,7 –Љ–µ—Б. [5].
–С–Њ–ї–µ–Ј–љ—М –љ–∞–Ї–Њ–њ–ї–µ–љ–Є—П —Н—Д–Є—А–Њ–≤ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞, –љ–∞–Њ–±–Њ—А–Њ—В, –њ—А–Њ—В–µ–Ї–∞–µ—В –Ј–∞—З–∞—Б—В—Г—О –ї–∞—В–µ–љ—В–љ–Њ, –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ–Њ –Є —П–≤–ї—П–µ—В—Б—П –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–є –љ–∞—Е–Њ–і–Ї–Њ–є –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є —А—Г—В–Є–љ–љ–Њ–≥–Њ –Њ—Б–Љ–Њ—В—А–∞ –Є –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ –Ї—А–Њ–≤–Є. –Я—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є –±–Њ–ї–µ–Ј–љ–Є –љ–∞–Ї–Њ–њ–ї–µ–љ–Є—П —Н—Д–Є—А–Њ–≤ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ —П–≤–ї—П—О—В—Б—П —Б–Є–Љ–њ—В–Њ–Љ—Л –њ–Њ—А–∞–ґ–µ–љ–Є—П –њ–µ—З–µ–љ–Є, —В–∞–Ї–Є–µ –Ї–∞–Ї –≥–µ–њ–∞—В–Њ–Љ–µ–≥–∞–ї–Є—П, –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –∞–ї–∞–љ–Є–љ–∞–Љ–Є–љ–Њ—В—А–∞–љ—Б—Д–µ—А–∞–Ј—Л (–Р–Ы–Ґ) –Є –∞—Б–њ–∞—А—В–∞—В–∞–Љ–Є–љ–Њ—В—А–∞–љ—Б—Д–µ—А–∞–Ј—Л (–Р–°–Ґ), —Б—В–µ–∞—В–Њ–Ј, —Д–Є–±—А–Њ–Ј –Є —Ж–Є—А—А–Њ–Ј –њ–µ—З–µ–љ–Є. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Љ–Њ–≥—Г—В –љ–∞–±–ї—О–і–∞—В—М—Б—П —Б–њ–ї–µ–љ–Њ–Љ–µ–≥–∞–ї–Є—П –Є —Б–Є–Љ–њ—В–Њ–Љ—Л –≥–Є–њ–µ—А—Б–њ–ї–µ–љ–Є–Ј–Љ–∞, –љ–∞–њ—А–Є–Љ–µ—А, –∞–љ–µ–Љ–Є—П –Є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є—П –Є —А–∞–љ–љ–µ–µ —А–∞–Ј–≤–Є—В–Є–µ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞ [6]. –Э–µ—Б–Љ–Њ—В—А—П –љ–∞ ¬Ђ—В–Є—Е–Њ–µ¬ї, –∞—Б–Є–Љ–њ—В–Њ–Љ–љ–Њ–µ —В–µ—З–µ–љ–Є–µ –±–Њ–ї–µ–Ј–љ–Є, –њ—А–Њ–≥–љ–Њ–Ј —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Н—В–Њ–є —Д–Њ—А–Љ–Њ–є –Ф–Ы–Ъ–Ы —В–∞–Ї–ґ–µ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–є. –£ 78% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ф–Ы–Ъ–Ы –±—Л–ї –Њ–±–љ–∞—А—Г–ґ–µ–љ —Д–Є–±—А–Њ–Ј –Є/–Є–ї–Є —Ж–Є—А—А–Њ–Ј (Ishak score вЙ•3) –њ–Њ –і–∞–љ–љ—Л–Љ –±–Є–Њ–њ—Б–Є–Є; –њ—А–Є–Љ–µ—З–∞—В–µ–ї–µ–љ —В–Њ—В —Д–∞–Ї—В, —З—В–Њ —Г –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Ж–Є—А—А–Њ–Ј–Њ–Љ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –њ—А–Њ—В–µ–Ї–∞–ї–Њ –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ–Њ [7]. –Ь–µ–і–Є–∞–љ–∞ –≤—А–µ–Љ–µ–љ–Є –і–Њ —А–∞–Ј–≤–Є—В–Є—П —Д–Є–±—А–Њ–Ј–∞, —Ж–Є—А—А–Њ–Ј–∞ –Є–ї–Є –њ–Њ—В—А–µ–±–љ–Њ—Б—В–Є –≤ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є –њ–µ—З–µ–љ–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ф–Ы–Ъ–Ы —Б–Њ—Б—В–∞–≤–ї—П–µ—В 3,7 –≥–Њ–і–∞ —Б –Љ–Њ–Љ–µ–љ—В–∞ –Љ–∞–љ–Є—Д–µ—Б—В–∞—Ж–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П [8].
–Ф–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –Ф–Ы–Ъ–Ы –Ј–∞—В—А—Г–і–љ–µ–љ–∞ –≤–≤–Є–і—Г —А–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–Є—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А—В–Є–љ—Л, –Њ–і–љ–∞–Ї–Њ —Б—Г—Й–µ—Б—В–≤—Г–µ—В –њ—А–Њ—Б—В–Њ–є –Є —В–Њ—З–љ—Л–є —В–µ—Б—В, –њ–Њ–Ј–≤–Њ–ї—П—О—Й–Є–є –њ–Њ–і—В–≤–µ—А–і–Є—В—М –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ. –Ф–ї—П –≤–µ—А–Є—Д–Є–Ї–∞—Ж–Є–Є –і–Є–∞–≥–љ–Њ–Ј–∞ –Ф–Ы–Ъ–Ы –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —Д–µ—А–Љ–µ–љ—В–∞ –Ы–Ъ–Ы –≤ –ї–µ–є–Ї–Њ—Ж–Є—В–∞—Е –Є/–Є–ї–Є –њ—П—В–љ–∞—Е –≤—Л—Б—Г—И–µ–љ–љ–Њ–є –Ї—А–Њ–≤–Є (–њ–Њ—Б–ї–µ–і–љ–Є–є –њ–Њ–і—Е–Њ–і –њ—А–µ–і–њ–Њ—З—В–Є—В–µ–ї–µ–љ) –Є –њ—А–Є —Б–љ–Є–ґ–µ–љ–Є–Є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —Д–µ—А–Љ–µ–љ—В–∞ –њ—А–Њ–≤–Њ–і—П—В –Ф–Э–Ъ-–і–Є–∞–≥–љ–Њ—Б—В–Є–Ї—Г –і–ї—П –њ–Њ–Є—Б–Ї–∞ –Љ—Г—В–∞—Ж–Є–є–≥–µ–љ–∞ LIPA.
–Ф–Њ –љ–µ–і–∞–≤–љ–µ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –і–ї—П —В–µ—А–∞–њ–Є–Є –Ф–Ы–Ъ–Ы –±—Л–ї–∞ –і–Њ—Б—В—Г–њ–љ–∞ —В–Њ–ї—М–Ї–Њ —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–∞—П —В–µ—А–∞–њ–Є—П: –≥–Є–њ–Њ–ї–Є–њ–Є–і–µ–Љ–Є—З–µ—Б–Ї–Є–µ –њ—А–µ–њ–∞—А–∞—В—Л, –і–Є–µ—В–∞ —Б –љ–Є–Ј–Ї–Є–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ –ґ–Є—А–∞, —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—П –њ–µ—З–µ–љ–Є, —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—П –≥–µ–Љ–Њ–њ–Њ—Н—В–Є—З–µ—Б–Ї–Є—Е —Б—В–≤–Њ–ї–Њ–≤—Л—Е –Ї–ї–µ—В–Њ–Ї (–Ґ–У–°–Ъ).
–≠–љ—В–µ—А–∞–ї—М–љ–Њ–µ –Є –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ–µ –њ–Є—В–∞–љ–Є–µ —Б –љ–Є–Ј–Ї–Є–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ –ґ–Є—А–Њ–≤ –њ—А–Є–Љ–µ–љ—П–ї–Њ—Б—М –≤ —В–µ—А–∞–њ–Є–Є –Љ–ї–∞–і–µ–љ—Ж–µ–≤ —Б –±—Л—Б—В—А–Њ–њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–є —А–∞–љ–љ–µ–є —Д–Њ—А–Љ–Њ–є –Ф–Ы–Ъ–Ы (–±–Њ–ї–µ–Ј–љ—М—О –Т–Њ–ї—М–Љ–∞–љ–∞), –Њ–і–љ–∞–Ї–Њ –Ї–∞–Ї–Њ–≥–Њ-–ї–Є–±–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ —Б–Љ–µ—А—В–љ–Њ—Б—В—М –і–∞–љ–љ–∞—П —В–µ—А–∞–њ–Є—П –љ–µ –Њ–Ї–∞–Ј–∞–ї–∞. –Э–Є–Ј–Ї–Њ–ґ–Є—А–Њ–≤–∞—П –і–Є–µ—В–∞ –і–Њ –љ–∞—Б—В–Њ—П—Й–µ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –њ—А–Є–Љ–µ–љ—П–µ—В—Б—П —Г –і–µ—В–µ–є –Є –≤–Ј—А–Њ—Б–ї—Л—Е —Б –Ф–Ы–Ъ–Ы, —Е–Њ—В—П —Н—В–Њ—В –њ–Њ–і—Е–Њ–і —В–∞–Ї–ґ–µ –љ–µ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї —Б–≤–Њ—О –і–Њ—Б—В–∞—В–Њ—З–љ—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М [9, 10].
–†–µ–Ј—Г–ї—М—В–∞—В—Л —В–µ—А–∞–њ–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ф–Ы–Ъ–Ы –≥–Є–њ–Њ–ї–Є–њ–Є–і–µ–Љ–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –≤ –ї–Є—В–µ—А–∞—В—Г—А–µ –љ–µ–Њ–і–љ–Њ–Ј–љ–∞—З–љ—Л [11]. –Ю—Б—В–∞–µ—В—Б—П –љ–µ—П—Б–љ—Л–Љ, –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –ї–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —Б—В–∞—В–Є–љ–Њ–≤ –Ї–∞–Ї–Њ–µ-
–ї–Є–±–Њ –≤–ї–Є—П–љ–Є–µ –љ–∞ —А–∞–Ј–≤–Є—В–Є–µ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞ –Є —А–Є—Б–Ї —Б–µ—А–і–µ—З–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л—Е —Б –Ф–Ы–Ъ–Ы. –Ш –Ї—А–∞–є–љ–µ –≤–∞–ґ–µ–љ —В–Њ—В —Д–∞–Ї—В, —З—В–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —Б—В–∞—В–Є–љ–Њ–≤ –љ–µ –Њ–Ї–∞–Ј–∞–ї–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –њ–Њ—А–∞–ґ–µ–љ–Є—П –њ–µ—З–µ–љ–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ф–Ы–Ъ–Ы [12].
–Ґ–У–°–Ъ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В—Б—П –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ –ї–µ—З–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ф–Ы–Ъ–Ы, —В. –Ї. –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ—В—Б—П, —З—В–Њ –Ы–Ъ–Ы –±—Г–і–µ—В —Б–Є–љ—В–µ–Ј–Є—А–Њ–≤–∞—В—М—Б—П –≤ –і–Њ–љ–Њ—А—Б–Ї–Є—Е –Ї–ї–µ—В–Ї–∞—Е. –Ю–і–љ–∞–Ї–Њ –љ–µ–±–Њ–ї—М—И–Њ–µ —З–Є—Б–ї–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —Б–ї—Г—З–∞–µ–≤, –і–Њ—Б—В—Г–њ–љ—Л—Е –і–ї—П –∞–љ–∞–ї–Є–Ј–∞, –љ–µ –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Б–і–µ–ї–∞—В—М –Њ–і–љ–Њ–Ј–љ–∞—З–љ–Њ–≥–Њ –≤—Л–≤–Њ–і–∞ –Њ–± —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –і–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –њ—А–Њ—Ж–µ–і—Г—А–∞ –Ґ–У–°–Ъ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–∞ —Б –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, —В–∞–Ї–Є—Е, –љ–∞–њ—А–Є–Љ–µ—А, –Ї–∞–Ї –Њ—В—В–Њ—А–ґ–µ–љ–Є–µ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—В–∞, —А–µ–∞–Ї—Ж–Є—П ¬Ђ—В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—В –њ—А–Њ—В–Є–≤ —Е–Њ–Ј—П–Є–љ–∞¬ї –Є –і—А—Г–≥–Є–µ –њ–Њ—Б—В–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ –Ґ–У–°–Ъ –љ–µ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–∞ –Ї–∞–Ї —А—Г—В–Є–љ–љ–∞—П —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–∞—П –Њ–њ—Ж–Є—П –і–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ф–Ы–Ъ–Ы [13].
–Ґ—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—П –њ–µ—З–µ–љ–Є —В–∞–Ї–ґ–µ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–∞ —Б –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Є –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –≤–ї–Є—П–љ–Є—П –љ–∞ —Б–Є—Б—В–µ–Љ–љ—Л–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Т –ї–Є—В–µ—А–∞—В—Г—А–µ —Б—Г—Й–µ—Б—В–≤—Г—О—В –Њ–њ–Є—Б–∞–љ–Є—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —Б–ї—Г—З–∞–µ–≤ –њ—А–Њ–≥—А–µ—Б—Б–Є–Є –Ф–Ы–Ъ–Ы –Є —А–∞–Ј–≤–Є—В–Є—П —В–µ—А–Љ–Є–љ–∞–ї—М–љ–Њ–≥–Њ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –њ–Њ—З–µ–Ї —Г –њ–∞—Ж–Є–µ–љ—В–Ї–Є —Б–њ—Г—Б—В—П 7 –ї–µ—В –њ–Њ—Б–ї–µ –њ—А–Њ—Ж–µ–і—Г—А—Л —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є –њ–µ—З–µ–љ–Є. –Я—А–Є –±–Є–Њ–њ—Б–Є–Є –њ–Њ—З–µ–Ї –≤ –і–∞–љ–љ–Њ–Љ —Б–ї—Г—З–∞–µ –±—Л–ї –≤—Л—П–≤–ї–µ–љ –≤—Л—А–∞–ґ–µ–љ–љ—Л–є –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј —Б –Њ–±—И–Є—А–љ—Л–Љ–Є –Њ—В–ї–Њ–ґ–µ–љ–Є—П–Љ–Є –ї–Є–њ–Є–і–Њ–≤ –≤ —Б—В–µ–љ–Ї–∞—Е —Б–Њ—Б—Г–і–Њ–≤ [14]. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—П –њ–µ—З–µ–љ–Є –љ–µ –Њ—Б—В–∞–љ–∞–≤–ї–Є–≤–∞–µ—В –њ—А–Њ–≥—А–µ—Б—Б–Є—О –Ф–Ы–Ъ–Ы –Є –њ–Њ—А–∞–ґ–µ–љ–Є–µ –і—А—Г–≥–Є—Е –Њ—А–≥–∞–љ–Њ–≤-–Љ–Є—И–µ–љ–µ–є. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –љ–µ–ї—М–Ј—П –Є—Б–Ї–ї—О—З–Є—В—М —А–Є—Б–Ї –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П —В—А–∞–љ—Б–њ–ї–∞–љ—В–Є—А–Њ–≤–∞–љ–љ–Њ–є –њ–µ—З–µ–љ–Є, —В. –Ї. —Г—А–Њ–≤–µ–љ—М –Ы–Ъ–Ы –њ–Њ-–њ—А–µ–ґ–љ–µ–Љ—Г –Њ—Б—В–∞–µ—В—Б—П –љ–Є–Ј–Ї–Є–Љ [15].
–°—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ –љ–µ–і–∞–≤–љ–Њ –њ–Њ—П–≤–Є–ї—Б—П –љ–Њ–≤—Л–є –њ–Њ–і—Е–Њ–і –Ї –ї–µ—З–µ–љ–Є—О –Ф–Ы–Ъ–Ы вАФ –Ј–∞–Љ–µ—Б—В–Є—В–µ–ї—М–љ–∞—П —Д–µ—А–Љ–µ–љ—В–љ–∞—П —В–µ—А–∞–њ–Є—П. –Т –†–Њ—Б—Б–Є–Є, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –љ–Њ–≤—Л–µ –Ј–љ–∞–љ–Є—П –Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–Є, –љ–∞–Ї–Њ–њ–ї–µ–љ –і–Њ—Б—В–∞—В–Њ—З–љ—Л–є –Њ–њ—Л—В –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Ф–Ы–Ъ–Ы. –Я–Њ –і–∞–љ–љ—Л–Љ –∞–љ–∞–ї–Є–Ј–∞ —Б–µ–Ї–≤–µ–љ–Є—А–Њ–≤–∞–љ–Є—П 523 —З–µ–ї–Њ–≤–µ–Ї –≤ —А–Њ—Б—Б–Є–є—Б–Ї–Њ–є –њ–Њ–њ—Г–ї—П—Ж–Є–Є –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ—В—Б—П, —З—В–Њ —З–∞—Б—В–Њ—В–∞ –Ф–Ы–Ъ–Ы –≤ –†–Њ—Б—Б–Є–Є –Љ–Њ–ґ–µ—В —Б–Њ—Б—В–∞–≤–ї—П—В—М 1 : 67 600 [16]. –С–ї–∞–≥–Њ–і–∞—А—П –Ј–љ–∞–љ–Є—П–Љ –≤—А–∞—З–µ–є, –≤–љ–Є–Љ–∞–љ–Є—О –Ї –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ –њ–µ—З–µ–љ–Є —Г –і–µ—В–µ–є, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—П–Љ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е –ї–∞–±–Њ—А–∞—В–Њ—А–Є–є –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ—Л –і–µ—Б—П—В–Ї–Є —Б–ї—Г—З–∞–µ–≤ –Ф–Ы–Ъ–Ы. –Ю–і–љ–∞–Ї–Њ –Њ—Б–≤–µ–і–Њ–Љ–ї–µ–љ–љ–Њ—Б—В—М –Њ–± –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А—В–Є–љ—Л –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –≤–∞–ґ–љ–∞ –і–ї—П –µ–≥–Њ —Б–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –±—Л—Б—В—А–Њ–µ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –Ф–Ы–Ъ–Ы –Є–љ–Њ–≥–і–∞ –љ–µ –і–∞–µ—В –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –њ—А–Њ–≤–Њ–і–Є—В—М –і–Њ–ї–≥–Є–є –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–є –њ–Њ–Є—Б–Ї. –Т –і–∞–љ–љ–Њ–є —Б—В–∞—В—М–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –љ–∞–±–ї—О–і–µ–љ–Є—П –Њ–±–µ–Є—Е —Д–Њ—А–Љ –Ф–Ы–Ъ–Ы.
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –љ–∞–±–ї—О–і–µ–љ–Є—П
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ вДЦ 1:
–±–Њ–ї–µ–Ј–љ—М –љ–∞–Ї–Њ–њ–ї–µ–љ–Є—П —Н—Д–Є—А–Њ–≤ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞
–Я–∞—Ж–Є–µ–љ—В–Ї–∞ 1998 –≥. —А. –≤–њ–µ—А–≤—Л–µ –њ–Њ–њ–∞–ї–∞ –њ–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є–µ –≤—А–∞—З–µ–є –≤ –≤–Њ–Ј—А–∞—Б—В–µ 10 –Љ–µ—Б. —Б –≥–µ–њ–∞—В–Њ–Љ–µ–≥–∞–ї–Є–µ–є. –Ш–Ј –∞–љ–∞–Љ–љ–µ–Ј–∞ –Є–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ —А–∞–љ–љ–µ–µ —А–∞–Ј–≤–Є—В–Є–µ –њ—А–Њ—Е–Њ–і–Є–ї–Њ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ –≤–Њ–Ј—А–∞—Б—В—Г, –±–µ–Ј –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є.–Т –≤–Њ–Ј—А–∞—Б—В–µ 13 –Љ–µ—Б. –њ–∞—Ж–Є–µ–љ—В–Ї–∞ –±—Л–ї–∞ –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–∞ –≤ –≥–µ–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Њ—В–і–µ–ї–µ–љ–Є–µ –≤ —Б–≤—П–Ј–Є —Б –≥–Є–њ–Њ—Е—А–Њ–Љ–љ–Њ–є –∞–љ–µ–Љ–Є–µ–є –Є –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–Ј–Њ–Љ. –Я—А–Є –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –њ–µ—З–µ–љ–Є (+6 —Б–Љ) –Є —Б–µ–ї–µ–Ј–µ–љ–Ї–Є (+5 —Б–Љ). –Я–Њ –і–∞–љ–љ—Л–Љ –£–Ч–Ш: —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –њ–µ—З–µ–љ–Є —Б —А–Њ–≤–љ—Л–Љ –Ї–Њ–љ—В—Г—А–Њ–Љ –Є –љ–µ–Њ–і–љ–Њ—А–Њ–і–љ–Њ–є –≥–Є–њ–µ—А—Н—Е–Њ–≥–µ–љ–љ–Њ–є –њ–∞—А–µ–љ—Е–Є–Љ–Њ–є, —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Б–µ–ї–µ–Ј–µ–љ–Ї–Є, —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —А–∞–Ј–Љ–µ—А–Њ–≤ –њ–Њ—З–µ–Ї. –Т –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–Љ –∞–љ–∞–ї–Є–Ј–µ –Ї—А–Њ–≤–Є –Њ–њ—А–µ–і–µ–ї—П–ї–Є—Б—М –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Р–Ы–Ґ –і–Њ 88вАУ146 –Х–і/–ї (–љ–Њ—А–Љ–∞ вАФ 4вАУ40 –Х–і/–ї), –Р–°–Ґ вАФ –і–Њ 59вАУ92 –Х–і/–ї (–љ–Њ—А–Љ–∞ вАФ 4вАУ40 –Х–і/–ї), –Њ–±—Й–µ–≥–Њ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ вАФ –і–Њ 9,7 –Љ–Љ–Њ–ї—М/–ї (–≤–Њ–Ј—А–∞—Б—В–љ–∞—П –љ–Њ—А–Љ–∞ вАФ вЙ§5,2 –Љ–Љ–Њ–ї—М/–ї), —В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–Њ–≤ вАФ –і–Њ 2,3 –Љ–Љ–Њ–ї—М/–ї (–≤–Њ–Ј—А–∞—Б—В–љ–∞—П –љ–Њ—А–Љ–∞ вАФ вЙ§0,8 –Љ–Љ–Њ–ї—М/–ї), —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Ы–Я–Т–Я вАФ –і–Њ 0,8 –Љ–Љ–Њ–ї—М/–ї (–≤–Њ–Ј—А–∞—Б—В–љ–∞—П –љ–Њ—А–Љ–∞ вАФ вЙ•1,2 –Љ–Љ–Њ–ї—М/–ї). –Т –Њ–±—Й–µ–Љ –∞–љ–∞–ї–Є–Ј–µ –Ї—А–Њ–≤–Є —Б–Њ—Е—А–∞–љ—П–ї—Б—П –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–Ј –і–Њ 13вАУ16√Ч109/–ї (–≤–Њ–Ј—А–∞—Б—В–љ–∞—П –љ–Њ—А–Љ–∞ вАФ 5вАУ12√Ч109/–ї). –Ґ–Њ—З–љ—Л–є –і–Є–∞–≥–љ–Њ–Ј —Г—Б—В–∞–љ–Њ–≤–Є—В—М –љ–µ —Г–і–∞–ї–Њ—Б—М.
–Т–њ–µ—А–≤—Л–µ –і–Є–∞–≥–љ–Њ–Ј –Ф–Ы–Ъ–Ы –±—Л–ї –Ј–∞–њ–Њ–і–Њ–Ј—А–µ–љ –≤ –≤–Њ–Ј—А–∞—Б—В–µ 2,7 –≥–Њ–і–∞, –Ї–Њ–≥–і–∞ –њ–∞—Ж–Є–µ–љ—В–Ї–∞ –±—Л–ї–∞ –љ–∞–њ—А–∞–≤–ї–µ–љ–∞ –љ–∞ –Ї–Њ–љ—Б—Г–ї—М—В–∞—Ж–Є—О –≥–µ–љ–µ—В–Є–Ї–∞. –Я–Њ–≤–Њ–і–Њ–Љ –і–ї—П –≤–Ї–ї—О—З–µ–љ–Є—П –Ф–Ы–Ъ–Ы –≤ –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–є –њ–Њ–Є—Б–Ї –±—Л–ї–Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–∞—П –≥–µ–њ–∞—В–Њ–Љ–µ–≥–∞–ї–Є—П, –њ–µ—А—Б–Є—Б—В–Є—А—Г—О—Й–µ–µ –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –Є —В—А–∞–љ—Б–∞–Љ–Є–љ–∞–Ј. –Я–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –Є–Ј–Љ–µ—А–µ–љ–Є—П –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ы–Ъ–Ы –≤ –ї–µ–є–Ї–Њ—Ж–Є—В–∞—Е —Ж–µ–ї—М–љ–Њ–є –Ї—А–Њ–≤–Є –≤—Л—П–≤–ї–µ–љ–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —Д–µ—А–Љ–µ–љ—В–∞ вАФ –і–Њ 5,8 –Љ–Љ–Њ–ї—М/–Љ–≥ –±–µ–ї–Ї–∞/—З –њ—А–Є –љ–Њ—А–Љ–µ >23,4 –Љ–Љ–Њ–ї—М/–Љ–≥ –±–µ–ї–Ї–∞/—З. –Э–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А—В–Є–љ—Л –Є –Њ–±–љ–∞—А—Г–ґ–µ–љ–Є—П —А–µ–Ј–Ї–Њ–≥–Њ —Б–љ–Є–ґ–µ–љ–Є—П –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ы–Ъ–Ы –±—Л–ї —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ –і–Є–∞–≥–љ–Њ–Ј: –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М –ї–Є–Ј–Њ—Б–Њ–Љ–љ–Њ–є –Ї–Є—Б–ї–Њ–є –ї–Є–њ–∞–Ј—Л, –±–Њ–ї–µ–Ј–љ—М –љ–∞–Ї–Њ–њ–ї–µ–љ–Є—П —Н—Д–Є—А–Њ–≤ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ (–С–Э–≠–•).
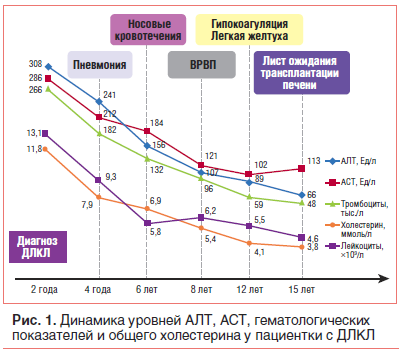
–Я—А–Є –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–Љ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Б–њ—Г—Б—В—П 3 –Љ–µ—Б. –Њ—В–Љ–µ—З–∞–ї–∞—Б—М –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–∞—П –і–Є–љ–∞–Љ–Є–Ї–∞: –≥–Є–њ–µ—А—Е–Њ–ї–Є—Б—В–µ—А–Є–љ–µ–Љ–Є—П –љ–∞—А–∞—Б—В–∞–ї–∞ –і–Њ 11,8 –Љ–Љ–Њ–ї—М/–ї (–≤–Њ–Ј—А–∞—Б—В–љ–∞—П –љ–Њ—А–Љ–∞ вАФ вЙ§5,2 –Љ–Љ–Њ–ї—М/–ї), –њ–Њ–≤—Л—Б–Є–ї—Б—П —Г—А–Њ–≤–µ–љ—М —В—А–∞–љ—Б–∞–Љ–Є–љ–∞–Ј (—А–Є—Б. 1), –≥–∞–Љ–Љ–∞-–≥–ї—Г—В–∞–Љ–Є–ї—В—А–∞–љ—Б–њ–µ–њ—В–Є–і–∞–Ј—Л (–У–У–Ґ) вАФ –і–Њ 174 –Х–і/–ї (–љ–Њ—А–Љ–∞ вАФ 8вАУ45 –Х–і/–ї), –Ј–љ–∞—З–µ–љ–Є–µ —Й–µ–ї–Њ—З–љ–Њ–є —Д–Њ—Б—Д–∞—В–∞–Ј—Л –Њ—Б—В–∞–≤–∞–ї–Њ—Б—М –љ–Њ—А–Љ–∞–ї—М–љ—Л–Љ. –Я–Њ –і–∞–љ–љ—Л–Љ –£–Ч–Ш вАФ –≥–µ–њ–∞—В–Њ–Љ–µ–≥–∞–ї–Є—П –±–µ–Ј –і–Є–љ–∞–Љ–Є–Ї–Є.
–Т –≤–Њ–Ј—А–∞—Б—В–µ 3 –ї–µ—В 5 –Љ–µ—Б. –њ—А–Є –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –≤–њ–µ—А–≤—Л–µ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –њ—А–Њ—В—А–Њ–Љ–±–Є–љ–Њ–≤–Њ–≥–Њ –Є–љ–і–µ–Ї—Б–∞ (–Я–Ґ–Ш) –і–Њ 53% (–љ–Њ—А–Љ–∞ вАФ 60вАУ90%).
–Т 2002 –≥. –њ–∞—Ж–Є–µ–љ—В–Ї–∞ –±—Л–ї–∞ –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–∞ –≤ —Б–Њ—Б—В–Њ—П–љ–Є–Є —Б—А–µ–і–љ–µ–є —В—П–ґ–µ—Б—В–Є —Б –ґ–∞–ї–Њ–±–∞–Љ–Є –љ–∞ –њ–µ—А–Є–Њ–і–Є—З–µ—Б–Ї–Є–µ –љ–Њ—Б–Њ–≤—Л–µ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П. –Я—А–Є –Њ—Б–Љ–Њ—В—А–µ: –≤–µ—Б вАФ –≤ –њ—А–µ–і–µ–ї–∞—Е –≤–Њ–Ј—А–∞—Б—В–љ–Њ–є –љ–Њ—А–Љ—Л, –≤—Л—А–∞–ґ–µ–љ–љ–∞—П –њ–∞–ї—М–Љ–∞—А–љ–∞—П —Н—А–Є—В–µ–Љ–∞, —Б–ї–Є–Ј–Є—Б—В—Л–µ –≥—Г–± вАФ —Б—Г—Е–Є–µ, —Б —В—А–µ—Й–Є–љ–∞–Љ–Є. –Я—А–Є –њ–∞–ї—М–њ–∞—Ж–Є–Є –Њ–њ—А–µ–і–µ–ї—П–ї–∞—Б—М –њ–ї–Њ—В–љ–Њ—Н–ї–∞—Б—В–Є—З–љ–∞—П –њ–µ—З–µ–љ—М, —Г–≤–µ–ї–Є—З–µ–љ–љ–∞—П –≤ —А–∞–Ј–Љ–µ—А–∞—Е (+6 —Б–Љ), —Б–µ–ї–µ–Ј–µ–љ–Ї–∞ –њ–ї–Њ—В–љ–∞—П, –±–µ–Ј–±–Њ–ї–µ–Ј–љ–µ–љ–љ–∞—П, —В–∞–Ї–ґ–µ —Г–≤–µ–ї–Є—З–µ–љ–љ–∞—П –≤ —А–∞–Ј–Љ–µ—А–∞—Е (+10 —Б–Љ). –Я–Њ –і–∞–љ–љ—Л–Љ –£–Ч–Ш –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л –і–Є—Б–Ї–Є–љ–µ–Ј–Є—П –ґ–µ–ї—З–µ–≤—Л–≤–Њ–і—П—Й–Є—Е –њ—Г—В–µ–є, –і–µ—Д–Њ—А–Љ–∞—Ж–Є—П –ґ–µ–ї—З–љ–Њ–≥–Њ –њ—Г–Ј—Л—А—П, —А–µ–∞–Ї—В–Є–≤–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л. –Я–Њ –і–∞–љ–љ—Л–Љ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –љ–∞—А–∞—Б—В–∞–љ–Є–µ —Г—А–Њ–≤–љ—П —В—А–∞–љ—Б-
–∞–Љ–Є–љ–∞–Ј, —Б–Њ—Е—А–∞–љ—П–ї–Є—Б—М –≥–Є–њ–µ—А—Е–Њ–ї–µ—Б—В–µ—А–Є–љ–µ–Љ–Є—П (—А–Є—Б. 1), –ґ–µ–ї–µ–Ј–Њ–і–µ—Д–Є—Ж–Є—В–љ–∞—П –∞–љ–µ–Љ–Є—П (–Ц–Ф–Р), —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Ы–Я–Э–Я –і–Њ 7,46 –Љ–Љ–Њ–ї—М/–ї (–≤–Њ–Ј—А–∞—Б—В–љ–∞—П –љ–Њ—А–Љ–∞ вАФ вЙ§ 2,8 –Љ–Љ–Њ–ї—М/–ї).
–†–µ–љ—В–≥–µ–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л –њ—А–Є–Ј–љ–∞–Ї–Є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞, –Є—Б—В–Њ–љ—З–µ–љ–Є–µ –Ї–Њ—А–Ї–Њ–≤–Њ–≥–Њ —Б–ї–Њ—П –Ї–Њ—Б—В–Є –і–Њ 0,05 –Љ–Љ (–љ–Њ—А–Љ–∞ вАФ >2 –Љ–Љ) (–Ї–Њ—Б—В–љ—Л–є –≤–Њ–Ј—А–∞—Б—В —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В –Ї–∞–ї–µ–љ–і–∞—А–љ–Њ–Љ—Г).
–Т 2004 –≥. (–≤ 5 –ї–µ—В 10 –Љ–µ—Б.) –њ–∞—Ж–Є–µ–љ—В–Ї–∞ –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–∞ –≤ –£–љ–Є–≤–µ—А—Б–Є—В–µ—В—Б–Ї—Г—О –Ї–ї–Є–љ–Є–Ї—Г –§—А–∞–є–±—Г—А–≥–∞ (–У–µ—А–Љ–∞–љ–Є—П), –≥–і–µ –њ—А–Є –њ–Њ–≤—В–Њ—А–љ–Њ–Љ –∞–љ–∞–ї–Є–Ј–µ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ы–Ъ–Ы –≤ –ї–µ–є–Ї–Њ—Ж–Є—В–∞—Е –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —Д–µ—А–Љ–µ–љ—В–∞ –Є –±—Л–ї –≤–љ–Њ–≤—М –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ –і–Є–∞–≥–љ–Њ–Ј –Ф–Ы–Ъ–Ы –≤ —Д–Њ—А–Љ–µ –С–Э–≠–•.
–Т 6,5 –≥–Њ–і–∞ –њ–∞—Ж–Є–µ–љ—В–Ї–∞ –≤–љ–Њ–≤—М –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–∞ –≤ —Б—В–∞—Ж–Є–Њ–љ–∞—А. –†–∞–Ј–Љ–µ—А—Л –њ–µ—З–µ–љ–Є –Є —Б–µ–ї–µ–Ј–µ–љ–Ї–Є вАФ –±–µ–Ј –і–Є–љ–∞–Љ–Є–Ї–Є: +6 —Б–Љ –Є +9 —Б–Љ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –њ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –±—Л–ї –≤—Л—Б—В–∞–≤–ї–µ–љ –і–Є–∞–≥–љ–Њ–Ј: –Њ—Б—В—А–∞—П –њ—А–∞–≤–Њ—Б—В–Њ—А–Њ–љ–љ—П—П –љ–Є–ґ–љ–µ–і–Њ–ї–µ–≤–∞—П —Б–µ–≥–Љ–µ–љ—В–∞—А–љ–∞—П –њ–љ–µ–≤–Љ–Њ–љ–Є—П, –њ–∞–љ—Б–Є–љ—Г—Б–Є—В, –і–≤—Г—Е—Б—В–Њ—А–Њ–љ–љ–Є–є –Ї–∞—В–∞—А–∞–ї—М–љ—Л–є —Б—А–µ–і–љ–Є–є –Њ—В–Є—В. –Т—Л–њ–Є—Б–∞–љ–∞ —Б –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–µ–є —Б–Њ—Б—В–Њ—П–љ–Є—П –њ–Њ –њ–љ–µ–≤–Љ–Њ–љ–Є–Є, –љ–Њ —Б —Б–Њ—Е—А–∞–љ–µ–љ–Є–µ–Љ —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Ф–Ы–Ъ–Ы.
–Т –≤–Њ–Ј—А–∞—Б—В–µ 6 –ї–µ—В 10 –Љ–µ—Б. –і–µ–≤–Њ—З–Ї–∞ –њ–Њ–≤—В–Њ—А–љ–Њ –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–∞ —Б –ґ–∞–ї–Њ–±–∞–Љ–Є –љ–∞ –љ–Њ—Б–Њ–≤—Л–µ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П, —Б–ї–∞–±–Њ—Б—В—М –Є —Г—В–Њ–Љ–ї—П–µ–Љ–Њ—Б—В—М. –Я—А–Є –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –±—Л–ї–Є –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л –Ї—А–∞–µ–≤–∞—П —Б—Г–±–Є–Ї—В–µ—А–Є—З–љ–Њ—Б—В—М —Б–Ї–ї–µ—А; –љ–∞ —Й–µ–Ї–∞—Е –Ї–∞–њ–Є–ї–ї—П—А–Є—В, –њ–∞–ї—М–Љ–∞—А–љ–∞—П —Н—А–Є—В–µ–Љ–∞ –Є –≥–Є–њ–µ—А—В—А–Є—Е–Њ–Ј, —А–∞—Б—И–Є—А–µ–љ–Є–µ –≤–µ–љ–Њ–Ј–љ–Њ–є —Б–µ—В–Є –љ–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –≥—А—Г–і–Є. –Я–Њ—П–≤–Є–ї–∞—Б—М –і–Є—Д—Д—Г–Ј–љ–∞—П –Љ—Л—И–µ—З–љ–∞—П –≥–Є–њ–Њ—В–Њ–љ–Є—П. –Ц–Є–≤–Њ—В –±—Л–ї —Г–≤–µ–ї–Є—З–µ–љ –≤ –Њ–±—К–µ–Љ–µ, –њ—А–Є –њ–∞–ї—М–њ–∞—Ж–Є–Є —З—Г–≤—Б—В–≤–Є—В–µ–ї–µ–љ –≤ —В–Њ—З–Ї–µ –ґ–µ–ї—З–љ–Њ–≥–Њ –њ—Г–Ј—Л—А—П, –Њ–±–љ–∞—А—Г–ґ–µ–љ —Б–Є–Љ–њ—В–Њ–Љ –Ю—А—В–љ–µ—А–∞ (–У—А–µ–Ї–Њ–≤–∞). –Я–µ—З–µ–љ—М –Є —Б–µ–ї–µ–Ј–µ–љ–Ї–∞ –±—Л–ї–Є —Г–≤–µ–ї–Є—З–µ–љ—Л –љ–∞ +5 —Б–Љ –Є +9 —Б–Љ —Б –њ–ї–Њ—В–љ–Њ–є –Ї–Њ–љ—Б–Є—Б—В–µ–љ—Ж–Є–µ–є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ. –°–Њ—Е—А–∞–љ—П–ї–Є—Б—М —Б–Є–љ–і—А–Њ–Љ —Ж–Є—В–Њ–ї–Є–Ј–∞, –≥–Є–њ–µ—А—Е–Њ–ї–µ—Б—В–µ—А–Є–љ–µ–Љ–Є—П (—А–Є—Б. 1), –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –Ы–Я–Э–Я –і–Њ 6,38 –Љ–Љ–Њ–ї—М/–ї (–≤–Њ–Ј—А–∞—Б—В–љ–∞—П –љ–Њ—А–Љ–∞ вАФ вЙ§2,8 –Љ–Љ–Њ–ї—М/–ї) –Є —В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–Њ–≤ –і–Њ 1,8 –Љ–Љ–Њ–ї—М/–ї (–≤–Њ–Ј—А–∞—Б—В–љ–∞—П –љ–Њ—А–Љ–∞ вАФ вЙ§0,8 –Љ–Љ–Њ–ї—М/–ї). –° –њ–Њ–Љ–Њ—Й—М—О –і–µ–љ—Б–Є—В–Њ–Љ–µ—В—А–Є–Є –±—Л–ї –≤—Л—П–≤–ї–µ–љ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј. –Ю–±—Й–Є–є –∞–љ–∞–ї–Є–Ј –Ї—А–Њ–≤–Є вАФ –±–µ–Ј –Њ—В–Ї–ї–Њ–љ–µ–љ–Є–є.
–°–њ—Г—Б—В—П 9 –ї–µ—В –њ–Њ—Б–ї–µ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –і–Є–∞–≥–љ–Њ–Ј–∞ –Ф–Ы–Ъ–Ы –≤ –≤–Њ–Ј—А–∞—Б—В–µ 12 –ї–µ—В –њ–∞—Ж–Є–µ–љ—В–Ї–µ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–Њ —А–∞—Б—Б–Љ–Њ—В—А–µ—В—М –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є –њ–µ—З–µ–љ–Є –≤ —Б–≤—П–Ј–Є —Б –µ–µ –љ–∞—А–∞—Б—В–∞—О—Й–Є–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ –Є —А–∞–Ј–≤–Є—В–Є–µ–Љ –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –њ–µ—З–µ–љ–Њ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –≤—Б–ї–µ–і—Б—В–≤–Є–µ —Ж–Є—А—А–Њ–Ј–∞.
–Т –≤–Њ–Ј—А–∞—Б—В–µ 13 –ї–µ—В –њ–∞—Ж–Є–µ–љ—В–Ї–∞ –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–∞ —Б —Г—Е—Г–і—И–µ–љ–Є–µ–Љ —Б–Њ—Б—В–Њ—П–љ–Є—П, —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–µ–є, –ї–µ–є–Ї–Њ–њ–µ–љ–Є–µ–є, –∞–љ–µ–Љ–Є–µ–є, –≥–µ–њ–∞—В–Њ—Б–њ–ї–µ–љ–Њ–Љ–µ–≥–∞–ї–Є–µ–є, –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є –њ–Њ—А—В–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–Є. –Я–µ—З–µ–љ–Њ—З–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М –њ–Њ —И–Ї–∞–ї–µ –І–∞–є–ї–і вАФ –Я—М—О –Њ—Ж–µ–љ–Є–≤–∞–ї–∞—Б—М –≤ 11 –±–∞–ї–ї–Њ–≤ –Є–Ј 15 –≤–Њ–Ј–Љ–Њ–ґ–љ—Л—Е, —З—В–Њ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В —Ж–Є—А—А–Њ–Ј—Г –њ–µ—З–µ–љ–Є –Ї–ї–∞—Б—Б–∞ –° (–і–µ–Ї–Њ–Љ–њ–µ–љ—Б–Є—А–Њ–≤–∞–љ–љ—Л–є). –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ —А–∞–Ј–≤–Є—В–Є—П —Ж–Є—А—А–Њ–Ј–∞ —Б–Њ—Б—В–Њ—П–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–Ї–Є –Њ—Б–ї–Њ–ґ–љ–Є–ї–Њ—Б—М –≤–∞—А–Є–Ї–Њ–Ј–љ—Л–Љ —А–∞—Б—И–Є—А–µ–љ–Є–µ–Љ –≤–µ–љ –њ–Є—Й–µ–≤–Њ–і–∞ 3 —Б—В. –Є –≤–µ–љ –ґ–µ–ї—Г–і–Ї–∞. –Т–љ–Њ–≤—М –±—Л–ї–∞ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–∞ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—П –њ–µ—З–µ–љ–Є. –Я–Њ –і–∞–љ–љ—Л–Љ –Ь–†–Ґ —Б–Њ—Б—В–Њ—П–љ–Є–µ –њ–µ—З–µ–љ–Є —Г—Е—Г–і—И–Є–ї–Њ—Б—М: –љ–∞–ї–Є—З–Є–µ —Ж–Є—А—А–Њ–Ј–∞ –Є –Љ–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ—Л—Е —А–µ–≥–µ–љ–µ—А–∞—В–Њ—А–љ—Л—Е —Г–Ј–ї–Њ–≤ –≤ –њ–∞—А–µ–љ—Е–Є–Љ–µ, —Г–Љ–µ—А–µ–љ–љ–Њ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ —А–∞—Б—И–Є—А–µ–љ–Є–µ –µ–і–Є–љ–Є—З–љ—Л—Е –≤–љ—Г—В—А–Є–њ–µ—З–µ–љ–Њ—З–љ—Л—Е –њ—А–Њ—В–Њ–Ї–Њ–≤ –Є –њ–Њ—А—В–∞–ї—М–љ–∞—П –≥–Є–њ–µ—А—В–µ–љ–Ј–Є—П. –°–Њ—Е—А–∞–љ–µ–љ–Є–µ —Б–њ–ї–µ–љ–Њ–Љ–µ–≥–∞–ї–Є–Є. –°–≤–Њ–±–Њ–і–љ–∞—П –ґ–Є–і–Ї–Њ—Б—В—М –≤ –њ–Њ–і–њ–µ—З–µ–љ–Њ—З–љ–Њ–Љ –Є –њ–Њ–і—Б–µ–ї–µ–Ј–µ–љ–Њ—З–љ–Њ–Љ –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–µ. –Т—В–Њ—А–Є—З–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –њ–∞—А–µ–љ—Е–Є–Љ—Л –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л.
–Т 2015 –≥. –≤ –≤–Њ–Ј—А–∞—Б—В–µ 16 –ї–µ—В –њ–∞—Ж–Є–µ–љ—В–Ї–∞ –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–∞ –≤ –Њ—В–і–µ–ї–µ–љ–Є–µ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –≥–µ–љ–µ—В–Є–Ї–Є —Б –ґ–∞–ї–Њ–±–∞–Љ–Є –љ–∞ –Є–Ј–±—Л—В–Њ—З–љ—Л–є –≤–µ—Б, —Г—В–Њ–Љ–ї—П–µ–Љ–Њ—Б—В—М –Є –Њ—В—Б—Г—В—Б—В–≤–Є–µ –Љ–µ–љ—Б—В—А—Г–∞—Ж–Є–є.
–Я—А–Є –Њ—Б–Љ–Њ—В—А–µ: –≥–Є–њ–µ—А—В—А–Є—Е–Њ–Ј, —Б–Њ—Б—Г–і–Є—Б—В—Л–µ –Ј–≤–µ–Ј–і–Њ—З–Ї–Є –љ–∞ —Й–µ–Ї–∞—Е, –≤ –Њ–±–ї–∞—Б—В–Є –љ–Њ—Б–Њ–≥—Г–±–љ–Њ–є —Б–Ї–ї–∞–і–Ї–Є —Б–ї–µ–≤–∞, –≤ –њ–Њ–і–Ї–ї—О—З–Є—З–љ–Њ–є –Њ–±–ї–∞—Б—В–Є –Є –љ–∞ —Б–њ–Є–љ–µ, –њ–Є–≥–Љ–µ–љ—В–љ—Л–µ –љ–µ–≤—Г—Б—Л –љ–∞ –Ї–Њ–љ–µ—З–љ–Њ—Б—В—П—Е, —Б–њ–Є–љ–µ –Є –ґ–Є–≤–Њ—В–µ, —Н–Ї—Е–Є–Љ–Њ–Ј –љ–∞ –њ—А–∞–≤–Њ–є –≥–Њ–ї–µ–љ–Є. –Ю—В–Љ–µ—З–µ–љ–Њ —Г—Б–Є–ї–µ–љ–Є–µ –≤–µ–љ–Њ–Ј–љ–Њ–є —Б–µ—В–Є –љ–∞ –±—А—О—И–љ–Њ–є —Б—В–µ–љ–Ї–µ –≤ –њ–Њ–і–≤–Ј–і–Њ—И–љ—Л—Е –Њ–±–ї–∞—Б—В—П—Е, –≤ —Н–њ–Є–≥–∞—Б—В—А–∞–ї—М–љ–Њ–є –Њ–±–ї–∞—Б—В–Є. –Я–∞–ї—М–њ–∞—В–Њ—А–љ–Њ –Њ—В–Љ–µ—З–∞–ї–Є—Б—М —Г–Љ–µ–љ—М—И–µ–љ–Є–µ —А–∞–Ј–Љ–µ—А–Њ–≤ –њ–µ—З–µ–љ–Є (—Г —А–µ–±–µ—А–љ–Њ–є –і—Г–≥–Є) –Є —Б–Њ—Е—А–∞–љ–µ–љ–Є–µ —Б–њ–ї–µ–љ–Њ–Љ–µ–≥–∞–ї–Є–Є (+12 —Б–Љ). –Ю—Ж–µ–љ–Ї–∞ —Ж–Є—А—А–Њ–Ј–∞ –њ–µ—З–µ–љ–Є –њ–Њ —И–Ї–∞–ї–µ –І–∞–є–ї–і вАФ –Я—М—О —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Њ–≤–∞–ї–∞ 5 –±–∞–ї–ї–∞–Љ. –Т —Б–≤—П–Ј–Є —Б —Б–Њ—Е—А–∞–љ—П—О—Й–µ–є—Б—П —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–µ–є, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ —В—А–∞–љ—Б—Д—Г–Ј–Є–Є –њ–ї–∞–Ј–Љ—Л –Є —В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ–Њ–є –Љ–∞—Б—Б—Л, –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –±–Є–Њ–њ—Б–Є–Є –њ–µ—З–µ–љ–Є –Њ—В–Љ–µ–љ–µ–љ–Њ –≤–≤–Є–і—Г –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є.
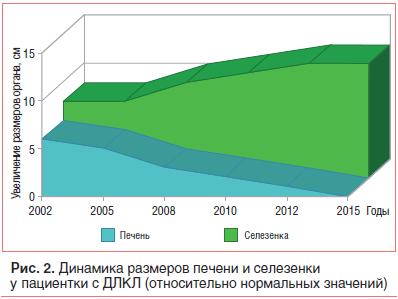
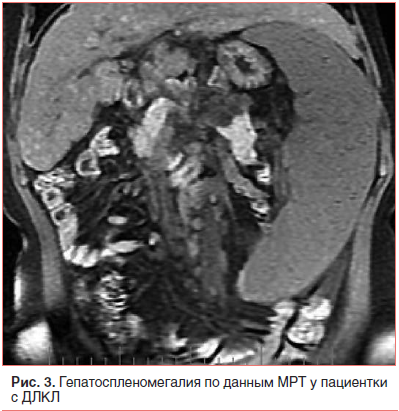
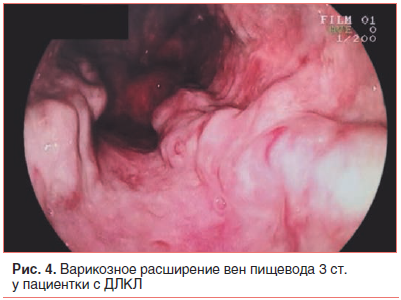
–Т –≤–Њ–Ј—А–∞—Б—В–µ 17 –ї–µ—В –њ–∞—Ж–Є–µ–љ—В–Ї–∞ –±—Л–ї–∞ –≤–љ–Њ–≤—М –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–∞ –≤ —Б—В–∞—Ж–Є–Њ–љ–∞—А, –≥–і–µ –њ–Њ –і–∞–љ–љ—Л–Љ –£–Ч–Ш –≤—Л—П–≤–ї–µ–љ–Њ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ —А–∞–Ј–Љ–µ—А–Њ–≤ –њ–µ—З–µ–љ–Є (93√Ч121 –Љ–Љ) –њ—А–Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–Љ –љ–∞—А–∞—Б—В–∞–љ–Є–Є —А–∞–Ј–Љ–µ—А–Њ–≤ —Б–µ–ї–µ–Ј–µ–љ–Ї–Є (260√Ч90 –Љ–Љ) (—А–Є—Б. 2). –Я–µ—З–µ–љ–Њ—З–љ–∞—П –њ–∞—А–µ–љ—Е–Є–Љ–∞ –±—Л–ї–∞ –љ–µ–Њ–і–љ–Њ—А–Њ–і–љ–Њ–є, —Б –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є —Н—Е–Њ–≥–µ–љ–љ–Њ—Б—В—М—О, –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ –њ–µ—А–Є–њ–Њ—А—В–∞–ї—М–љ—Л–Љ —Д–Є–±—А–Њ–Ј–Њ–Љ, –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є –њ–µ—А–Є–њ–Њ—А—В–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–Є –Є —Ж–Є—А—А–Њ–Ј–∞. –†–µ–Ј—Г–ї—М—В–∞—В—Л —Д–Є–±—А–Њ—Н–ї–∞—Б—В–Њ–≥—А–∞—Д–Є–Є –њ–Њ–і—В–≤–µ—А–і–Є–ї–Є —Ж–Є—А—А–Њ–Ј (—Б—В–∞–і–Є—П F4 –њ–Њ —И–Ї–∞–ї–µ METAVIR). –Э–∞ –Ь–†–Ґ –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ –њ—А–Є—Б—Г—В—Б—В–≤–Є–µ —Б–≤–Њ–±–Њ–і–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є –≤ –њ–Њ–і–њ–µ—З–µ–љ–Њ—З–љ–Њ–Љ –Є –њ–Њ–і—Б–µ–ї–µ–Ј–µ–љ–Њ—З–љ–Њ–Љ –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–∞—Е. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Б–µ–ї–µ–Ј–µ–љ–Ї–Є —В–∞–Ї–ґ–µ –њ–Њ–Ї–∞–Ј–∞–ї–Њ –љ–µ–Њ–і–љ–Њ—А–Њ–і–љ–Њ—Б—В—М –µ–µ –њ–∞—А–µ–љ—Е–Є–Љ—Л —Б –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є —Н—Е–Њ–≥–µ–љ–љ–Њ—Б—В—М—О, —А–∞—Б—И–Є—А–µ–љ–љ—Л–Љ–Є —Б–Њ—Б—Г–і–∞–Љ–Є –Є —Б–Њ–µ–і–Є–љ–Є—В–µ–ї—М–љ–Њ—В–Ї–∞–љ–љ—Л–Љ–Є –њ–µ—А–µ–Љ—Л—З–Ї–∞–Љ–Є (—А–Є—Б. 3). –Я—А–Є –≠–У–Ф–° –≤—Л—П–≤–ї–µ–љ–Њ –≤–∞—А–Є–Ї–Њ–Ј–љ–Њ–µ —А–∞—Б—И–Є—А–µ–љ–Є–µ –≤–µ–љ –њ–Є—Й–µ–≤–Њ–і–∞ 3 —Б—В. —Б –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ–є —Г–≥—А–Њ–Ј–Њ–є –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П (—А–Є—Б. 4). –Ф–∞–љ–љ–Њ–µ —Д–Њ—В–Њ –њ–Њ–ї—Г—З–µ–љ–Њ –≤ –Њ—В–і–µ–ї–µ–љ–Є–Є —Н–љ–і–Њ—Б–Ї–Њ–њ–Є–Є –Ї–ї–Є–љ–Є–Ї–Є –њ—А–Њ–њ–µ–і–µ–≤—В–Є–Ї–Є –≤–љ—Г—В—А–µ–љ–љ–Є—Е –±–Њ–ї–µ–Ј–љ–µ–є, –≥–∞—Б—В—А–Њ—Н–љ—В–µ—А–Њ–ї–Њ–≥–Є–Є –Є –≥–µ–њ–∞—В–Њ–ї–Њ–≥–Є–Є –Є–Љ. –Т. –•. –Т–∞—Б–Є–ї–µ–љ–Ї–Њ –Я–µ—А–≤–Њ–≥–Њ –Ь–У–Ь–£ –Є–Љ. –Ш. –Ь. –°–µ—З–µ–љ–Њ–≤–∞.
–Ґ–∞–Ї–ґ–µ –љ–∞–Љ–µ—В–Є–ї–∞—Б—М —В–µ–љ–і–µ–љ—Ж–Є—П –Ї —Б–љ–Є–ґ–µ–љ–Є—О —Г—А–Њ–≤–љ—П —В—А–∞–љ—Б–∞–Љ–Є–љ–∞–Ј –Є –Њ–±—Й–µ–≥–Њ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ (—А–Є—Б. 1) (–≤ —Б–≤—П–Ј–Є —Б –њ–µ—З–µ–љ–Њ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О), –њ–Њ–≤—Л—И–µ–љ–Є—О —Г—А–Њ–≤–љ—П –±–Є–ї–ї–Є—А—Г–±–Є–љ–∞ –і–Њ 43,8 –Љ–Ї–Љ–Њ–ї—М/–ї (–≤–Њ–Ј—А–∞—Б—В–љ–∞—П –љ–Њ—А–Љ–∞ вАФ –і–Њ 20,5 –Љ–Ї–Љ–Њ–ї—М/–ї).
–Т 2016 –≥. –њ—А–Є –њ–Њ–≤—В–Њ—А–љ–Њ–Љ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–Є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ы–Ъ–Ы –≤–љ–Њ–≤—М –Њ—В–Љ–µ—З–∞–ї–∞—Б—М —А–µ–Ј–Ї–Њ —Б–љ–Є–ґ–µ–љ–љ–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —Д–µ—А–Љ–µ–љ—В–∞ вАФ –і–Њ 0,01 –љ–Ь/—З/–њ—П—В–љ–Њ –њ—А–Є –љ–Њ—А–Љ–µ 0,30вАУ3,00 –љ–Ь/—З/–њ—П—В–љ–Њ. –Р–љ–∞–ї–Є–Ј –≥–µ–љ–∞ LIPA –Љ–µ—В–Њ–і–Њ–Љ –њ—А—П–Љ–Њ–≥–Њ —Б–µ–Ї–≤–µ–љ–Є—А–Њ–≤–∞–љ–Є—П –љ–µ –њ–Њ–Ї–∞–Ј–∞–ї –њ–∞—В–Њ–≥–µ–љ–љ—Л—Е –Љ—Г—В–∞—Ж–Є–є. –Ю—В—Б—Г—В—Б—В–≤–Є–µ –Љ—Г—В–∞—Ж–Є–є –љ–µ –њ–Њ–Ј–≤–Њ–ї—П–ї–Њ –Њ–і–љ–Њ–Ј–љ–∞—З–љ–Њ –Є—Б–Ї–ї—О—З–Є—В—М –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –Љ—Г—В–∞—Ж–Є–Є –Љ–Њ–≥—Г—В –њ—А–µ–і—Б—В–∞–≤–ї—П—В—М —А–µ–і–Ї–Є–µ –≤–∞—А–Є–∞–љ—В—Л –Є–Ј–Љ–µ–љ–µ–љ–Є—П –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ—Б—В–Є, –Ї–Њ—В–Њ—А—Л–µ –љ–µ –≤—Л—П–≤–ї—П—О—В—Б—П —А—Г—В–Є–љ–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ –∞–љ–∞–ї–Є–Ј–∞ –≥–µ–љ–∞.
–° —Г—З–µ—В–Њ–Љ –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–≥–Њ —Е–∞—А–∞–Ї—В–µ—А–∞ —В–µ—З–µ–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Ф–Ы–Ъ–Ы –Є –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є, –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –Ї–Њ—В–Њ—А–Њ–є —А–∞–Ј–≤–Є–ї—Б—П —Ж–Є—А—А–Њ–Ј –њ–µ—З–µ–љ–Є —Б –њ–µ—З–µ–љ–Њ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О, –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –њ–Њ—А—В–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–µ–є, –≤–∞—А–Є–Ї–Њ–Ј–љ—Л–Љ —А–∞—Б—И–Є—А–µ–љ–Є–µ–Љ –≤–µ–љ –њ–Є—Й–µ–≤–Њ–і–∞, —Б–Є–љ–і—А–Њ–Љ–Њ–Љ –≥–Є–њ–µ—А—Б–њ–ї–µ–љ–Є–Ј–Љ–∞ –Є –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, –њ–∞—Ж–Є–µ–љ—В–Ї–µ –њ–Њ –ґ–Є–Ј–љ–µ–љ–љ—Л–Љ –њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–∞ –Ј–∞–Љ–µ—Б—В–Є—В–µ–ї—М–љ–∞—П —Д–µ—А–Љ–µ–љ—В–љ–∞—П —В–µ—А–∞–њ–Є—П –Ф–Ы–Ъ–Ы.
–Т 2016 –≥. (–≤ –≤–Њ–Ј—А–∞—Б—В–µ 18 –ї–µ—В) –њ–Њ –ґ–Є–Ј–љ–µ–љ–љ—Л–Љ –њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ –њ–∞—Ж–Є–µ–љ—В–Ї–µ –±—Л–ї–∞ –љ–∞–Ј–љ–∞—З–µ–љ–∞ –Ј–∞–Љ–µ—Б—В–Є—В–µ–ї—М–љ–∞—П —Д–µ—А–Љ–µ–љ—В–љ–∞—П —В–µ—А–∞–њ–Є—П –љ–µ–Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–љ—Л–Љ –љ–∞ —В–Њ—В –Љ–Њ–Љ–µ–љ—В –≤ –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –§–µ–і–µ—А–∞—Ж–Є–Є –њ—А–µ–њ–∞—А–∞—В–Њ–Љ —Б–µ–±–µ–ї–Є–њ–∞–Ј–∞ –∞–ї—М—Д–∞ –≤ –і–Њ–Ј–µ 1 –Љ–≥/–Ї–≥ 1 —А–∞–Ј –≤ 2 –љ–µ–і. –≤ –≤–Є–і–µ –≤–љ—Г—В—А–Є–≤–µ–љ–љ—Л—Е –Є–љ—Д—Г–Ј–Є–є.
–Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Њ—В–Љ–µ—З–∞–ї–Є—Б—М —Г–ї—Г—З—И–µ–љ–Є–µ —Б–Њ—Б—В–Њ—П–љ–Є—П, –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є—П —Г—А–Њ–≤–љ—П —В—А–∞–љ—Б–∞–Љ–Є–љ–∞–Ј –Є –Њ–±—Й–µ–≥–Њ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞, –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –і–Њ 107 –≥/–ї, —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ вАФ –і–Њ 103 —В—Л—Б./–ї, —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –≤–∞—А–Є–Ї–Њ–Ј–љ–Њ–≥–Њ —А–∞—Б—И–Є—А–µ–љ–Є—П –≤–µ–љ –њ–Є—Й–µ–≤–Њ–і–∞ –і–Њ 2 —Б—В. –Ю –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–Є –њ–µ—З–µ–љ–Њ—З–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –Ї–Њ—Б–≤–µ–љ–љ–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –Є –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є—П –Љ–µ–љ—Б—В—А—Г–∞–ї—М–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є (—Г—Б—В—А–∞–љ–µ–љ–Є–µ –њ–µ—А–≤–Є—З–љ–Њ–є –∞–Љ–µ–љ–Њ—А–µ–Є).
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ вДЦ 2:
–Є–љ—Д–∞–љ—В–Є–ї—М–љ–∞—П —Д–Њ—А–Љ–∞ –Ф–Ы–Ъ–Ы (–±–Њ–ї–µ–Ј–љ—М –Т–Њ–ї—М–Љ–∞–љ–∞)
–Я–∞—Ж–Є–µ–љ—В 2015 –≥. —А. –≤–њ–µ—А–≤—Л–µ –њ–Њ–њ–∞–ї –њ–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є–µ —Г—З–∞—Б—В–Ї–Њ–≤–Њ–≥–Њ –њ–µ–і–Є–∞—В—А–∞ –≤ –≤–Њ–Ј—А–∞—Б—В–µ 2 –Љ–µ—Б. –Є 11 –і–љ–µ–є —Б —Б–Є–Љ–њ—В–Њ–Љ–∞–Љ–Є –ї–Є—Е–Њ—А–∞–і–Ї–Є –і–Њ 37,8 ¬∞–°. –Э–∞—Б–ї–µ–і—Б—В–≤–µ–љ–љ—Л–є –∞–љ–∞–Љ–љ–µ–Ј –љ–µ –Њ—В—П–≥–Њ—Й–µ–љ, —А–µ–±–µ–љ–Њ–Ї –Њ—В –≤—В–Њ—А–Њ–є –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є, –Њ—Б–ї–Њ–ґ–љ–µ–љ–љ–Њ–є —В–Њ–Ї—Б–Є–Ї–Њ–Ј–Њ–Љ –Є –Ї–Њ–ї—М–њ–Є—В–Њ–Љ, —А–Њ–і—Л –Љ–µ—В–Њ–і–Њ–Љ –Ї–µ—Б–∞—А–µ–≤–∞ —Б–µ—З–µ–љ–Є—П –≤ —Б—А–Њ–Ї 36 –љ–µ–і. –°–Њ—Б—В–Њ—П–љ–Є–µ –њ–Њ—Б–ї–µ —А–Њ–ґ–і–µ–љ–Є—П –±—Л–ї–Њ —Г–і–Њ–≤–ї–µ—В–≤–Њ—А–Є—В–µ–ї—М–љ—Л–Љ, 8/8 –њ–Њ —И–Ї–∞–ї–µ –Р–њ–≥–∞—А. –Я–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –Њ—Б–Љ–Њ—В—А–∞ –±—Л–ї —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ –і–Є–∞–≥–љ–Њ–Ј: –Њ—А–Њ—Д–∞—А–Є–љ–≥–µ–∞–ї—М–љ—Л–є –Ї–∞–љ–і–Є–і–Њ–Ј, –љ–∞–Ј–љ–∞—З–µ–љ–∞ –Љ–µ—Б—В–љ–∞—П —В–µ—А–∞–њ–Є—П. –°–њ—Г—Б—В—П 7 –і–љ–µ–є —Б–Њ—Б—В–Њ—П–љ–Є–µ –±–µ–Ј —Г–ї—Г—З—И–µ–љ–Є—П, –њ—А–Є –њ–Њ–≤—В–Њ—А–љ–Њ–Љ –Њ—Б–Љ–Њ—В—А–µ –њ–µ–і–Є–∞—В—А–Њ–Љ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ –і–Є–∞–≥–љ–Њ–Ј: –Њ—Б—В—А—Л–є —Д–∞—А–Є–љ–≥–Є—В, –Ц–Ф–Р, —Ж–µ—А–µ–±—А–∞–ї—М–љ–∞—П –Є—И–µ–Љ–Є—П. –Э–∞–њ—А–∞–≤–ї–µ–љ –љ–∞ –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є—О.–Я—А–Є –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–Є —А–µ–±–µ–љ–Њ–Ї –≤ —В—П–ґ–µ–ї–Њ–Љ —Б–Њ—Б—В–Њ—П–љ–Є–Є, —Б –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ–Є —Б–Є–Љ–њ—В–Њ–Љ–∞–Љ–Є –Є–љ—В–Њ–Ї—Б–Є–Ї–∞—Ж–Є–Є. –Я—А–Є –Њ—Б–Љ–Њ—В—А–µ –љ–∞ –Љ–Њ–Љ–µ–љ—В –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є —Б–Њ—Б—В–Њ—П–љ–Є–µ —В—П–ґ–µ–ї–Њ–µ, —А–µ–±–µ–љ–Њ–Ї –±–µ—Б–њ–Њ–Ї–Њ–є–љ—Л–є. –Ґ–µ–ї–Њ—Б–ї–Њ–ґ–µ–љ–Є–µ –њ—А–∞–≤–Є–ї—М–љ–Њ–µ, –Ї–Њ–ґ–љ—Л–µ –њ–Њ–Ї—А–Њ–≤—Л –±–ї–µ–і–љ—Л–µ, ¬Ђ–Љ—А–∞–Љ–Њ—А–љ–Њ—Б—В—М¬ї –Ї–Њ–ґ–љ—Л—Е –њ–Њ–Ї—А–Њ–≤–Њ–≤, –≤—Л—А–∞–ґ–µ–љ–љ–∞—П —Б–Њ—Б—Г–і–Є—Б—В–∞—П —Б–µ—В—М –≥–Њ–ї–Њ–≤—Л, –њ–µ—А–Є–Њ—А–∞–ї—М–љ—Л–є —Ж–Є–∞–љ–Њ–Ј. –Ч–µ–≤ –≥–Є–њ–µ—А–µ–Љ–Є—А–Њ–≤–∞–љ. –Ц–Є–≤–Њ—В —Г–≤–µ–ї–Є—З–µ–љ –≤ —А–∞–Ј–Љ–µ—А–∞—Е, –њ–∞–ї—М–њ–∞—В–Њ—А–љ–Њ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –њ–µ—З–µ–љ–Є –і–Њ 5 —Б–Љ, —Б–µ–ї–µ–Ј–µ–љ–Ї–Є вАФ –і–Њ 8 —Б–Љ. –Ь—Л—И–µ—З–љ—Л–є —В–Њ–љ—Г—Б —Б–љ–Є–ґ–µ–љ.
–Ф–ї—П —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –і–Є–∞–≥–љ–Њ–Ј–∞ –њ–∞—Ж–Є–µ–љ—В—Г –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ –≤—Б–µ—Б—В–Њ—А–Њ–љ–љ–µ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ: –љ–∞ –≤–Є—А—Г—Б–љ—Г—О –Є –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Г—О –Є–љ—Д–µ–Ї—Ж–Є—О, –Љ–∞—А–Ї–µ—А—Л –Њ–љ–Ї–Њ–≥–µ–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –∞ —В–∞–Ї–ґ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –±–Є–Њ–њ—В–∞—В–∞ –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, –Ї–Њ–Љ–њ—М—О—В–µ—А–љ–∞—П —В–Њ–Љ–Њ–≥—А–∞—Д–Є—П (–Ъ–Ґ), —А–µ–љ—В–≥–µ–љ–Њ–≥—А–∞—Д–Є—П –Њ—А–≥–∞–љ–Њ–≤ –≥—А—Г–і–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є, —Н—Е–Њ–Ї–∞—А–і–Є–Њ–≥—А–∞—Д–Є—П, —Д–Є–±—А–Њ–≥–∞—Б—В—А–Њ–і—Г–Њ–і–µ–љ–Њ—Б–Ї–Њ–њ–Є—П, –Љ–љ–Њ–≥–Њ–Ї—А–∞—В–љ–Њ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –£–Ч–Ш.
–Ф–∞–љ–љ—Л—Е –Ј–∞ –≤–Є—А—Г—Б–љ—Г—О —Н—В–Є–Њ–ї–Њ–≥–Є—О, –Њ–љ–Ї–Њ–≥–µ–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –љ–µ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ. –Я–Њ—Б–µ–≤ –Ї—А–Њ–≤–Є –љ–∞ —Б—В–µ—А–Є–ї—М–љ–Њ—Б—В—М –≤—Л—П–≤–Є–ї —А–Њ—Б—В Staphylococcus piscifermentans –Є Streptococcus spp.
–†–µ–љ—В–≥–µ–љ–Њ–≥—А–∞—Д–Є—П –Њ—А–≥–∞–љ–Њ–≤ –≥—А—Г–і–љ–Њ–є –Ї–ї–µ—В–Ї–Є вАФ –±–µ–Ј –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є.
–Т –±–Є–Њ–њ—Б–Є–Є –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –±—Л–ї–Є –Њ–њ—А–µ–і–µ–ї–µ–љ—Л —Б—Г–ґ–µ–љ–Є–µ —В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ–Њ–≥–Њ —А–Њ—Б—В–Ї–∞, —А–∞—Б—И–Є—А–µ–љ–Є–µ –ї–Є–Љ—Д–Њ—Ж–Є—В–∞—А–љ–Њ–≥–Њ —А–Њ—Б—В–Ї–∞, –Ј–∞–і–µ—А–ґ–Ї–∞ —Б–Њ–Ј—А–µ–≤–∞–љ–Є—П –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–≤ –љ–∞ —Г—А–Њ–≤–љ–µ –Љ–Є–µ–ї–Њ—Ж–Є—В–Њ–≤ –Є –Љ–µ—В–∞–Љ–Є–µ–ї–Њ—Ж–Є—В–Њ–≤. –Т –њ—А–µ–њ–∞—А–∞—В–µ —Б–Њ–і–µ—А–ґ–∞–ї–Є—Б—М –Љ–Є—В–Њ—В–Є—З–µ—Б–Ї–Є–µ –Ї–ї–µ—В–Ї–Є, —А–∞–Ј—А—Г—И–µ–љ–љ—Л–µ –Ї–ї–µ—В–Ї–Є, —Б–Ї–Њ–њ–ї–µ–љ–Є—П –Љ–∞–Ї—А–Њ—Д–∞–≥–Њ–≤.
–Я–∞—Ж–Є–µ–љ—В –њ—А–Њ–Ї–Њ–љ—Б—Г–ї—М—В–Є—А–Њ–≤–∞–љ –≥–µ–љ–µ—В–Є–Ї–Њ–Љ, —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–Њ –Є—Б–Ї–ї—О—З–Є—В—М –љ–∞—Б–ї–µ–і—Б—В–≤–µ–љ–љ—Л–µ –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П.
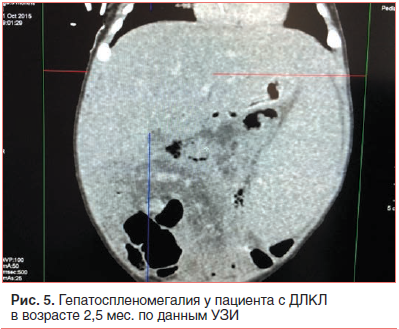
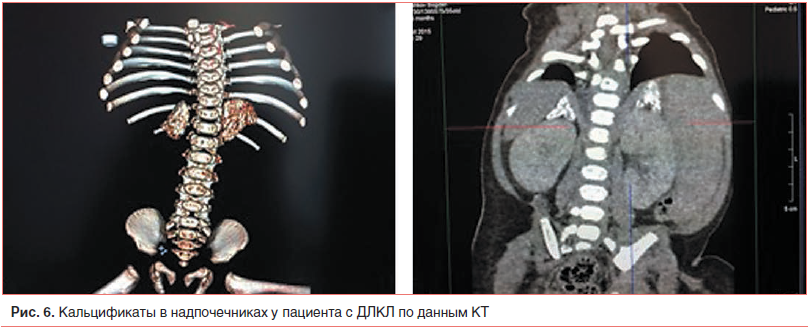
–Я–Њ –і–∞–љ–љ—Л–Љ –£–Ч–Ш –Њ—А–≥–∞–љ–Њ–≤ –±—А—О—И–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є –≤ —В–µ—З–µ–љ–Є–µ –≤—Б–µ–≥–Њ –њ–µ—А–Є–Њ–і–∞ –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є –Њ–њ—А–µ–і–µ–ї—П–ї–∞—Б—М –≥–µ–њ–∞—В–Њ—Б–њ–ї–µ–љ–Њ–Љ–µ–≥–∞–ї–Є—П (—А–Є—Б. 5). –Т –Њ–Ї—В—П–±—А–µ 2015 –≥. (—Б–њ—Г—Б—В—П 16 –і–љ–µ–є –њ–Њ—Б–ї–µ –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є) –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –£–Ч–Ш –Њ–±—А–∞—В–Є–ї–Є –љ–∞ —Б–µ–±—П –≤–љ–Є–Љ–∞–љ–Є–µ –Ї–∞–ї—М—Ж–Є–љ–∞—В—Л –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–Њ–≤: –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–Є —Г–≤–µ–ї–Є—З–µ–љ—Л, –Ї–Њ–љ—В—Г—А—Л –љ–µ—А–Њ–≤–љ—Л–µ, –љ–µ–Њ–і–љ–Њ—А–Њ–і–љ–Њ —Г–њ–ї–Њ—В–љ–µ–љ—Л (–Ї–∞–ї—М—Ж–Є—Д–Є–Ї–∞—Ж–Є—П), —Б–ї–Њ–Є –љ–µ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А—Г—О—В—Б—П. –Ф–∞–љ–љ—Л–µ –Ъ–Ґ –њ–Њ–і—В–≤–µ—А–і–Є–ї–Є –љ–∞–ї–Є—З–Є–µ –Ї–∞–ї—М—Ж–Є—Д–Є–Ї–∞—В–Њ–≤ –≤ –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–∞—Е. (—А–Є—Б. 6).
–Т —Б–≤—П–Ј–Є —Б –њ–Њ—П–≤–ї–µ–љ–Є–µ–Љ –і–∞–љ–љ–Њ–≥–Њ —Б–Є–Љ–њ—В–Њ–Љ–∞ –≤ —Б–Њ–≤–Њ–Ї—Г–њ–љ–Њ—Б—В–Є —Б –≥–µ–њ–∞—В–Њ—Б–њ–ї–µ–љ–Њ–Љ–µ–≥–∞–ї–Є–µ–є, –і—А–∞–Љ–∞—В–Є—З–µ—Б–Ї–Є–Љ —А–Њ—Б—В–Њ–Љ —Г—А–Њ–≤–љ—П —В—А–∞–љ—Б–∞–Љ–Є–љ–∞–Ј –≤–Њ–Ј–љ–Є–Ї–ї–Њ –њ–Њ–і–Њ–Ј—А–µ–љ–Є–µ –љ–∞ –±–Њ–ї–µ–Ј–љ—М –Т–Њ–ї—М–Љ–∞–љ–∞. –Ъ—А–Њ–≤—М –љ–∞–њ—А–∞–≤–ї–µ–љ–∞ –љ–∞ –∞–љ–∞–ї–Є–Ј –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ы–Ъ–Ы.
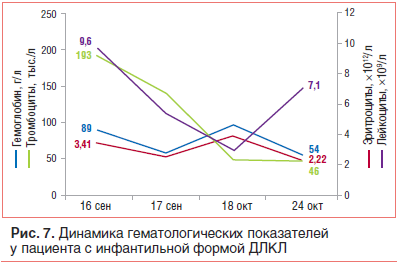
–Э–µ—Б–Љ–Њ—В—А—П –љ–∞ –њ—А–Њ–≤–Њ–і–Є–Љ—Г—О —В–µ—А–∞–њ–Є—О (–≥–µ–Љ–Њ—В—А–∞–љ—Б—Д—Г–Ј–Є–Є, –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–∞—П —В–µ—А–∞–њ–Є—П, –Є–љ—Д—Г–Ј–Є–Њ–љ–љ–∞—П —В–µ—А–∞–њ–Є—П, –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–∞—П —В–µ—А–∞–њ–Є—П, —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–∞—П —В–µ—А–∞–њ–Є—П), —Б–Њ—Б—В–Њ—П–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–∞ –Ї—А–Є—В–Є—З–µ—Б–Ї–Є —Г—Е—Г–і—И–∞–ї–Њ—Б—М: –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–ї–∞ –≥–Є–њ–Њ—Е—А–Њ–Љ–љ–∞—П –∞–љ–µ–Љ–Є—П –≤–њ–ї–Њ—В—М –і–Њ –њ–Њ—В—А–µ–±–љ–Њ—Б—В–Є –≤ —В—А–∞–љ—Б—Д—Г–Ј–Є—П—Е, —А–∞–Ј–≤–Є–ї–∞—Б—М —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є—П –і–Њ 46√Ч109/–ї, –љ–∞–±–ї—О–і–∞–ї–∞—Б—М —В–µ–љ–і–µ–љ—Ж–Є—П –Ї —Г–≥–ї—Г–±–ї–µ–љ–Є—О –ї–µ–є–Ї–Њ–њ–µ–љ–Є–Є (—А–Є—Б. 7).
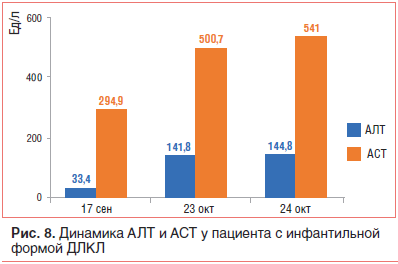
–Ґ–∞–Ї–ґ–µ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –љ–∞—А–∞—Б—В–∞–љ–Є–µ —Б–Є–љ–і—А–Њ–Љ–∞ —Ж–Є—В–Њ–ї–Є–Ј–∞, —З—В–Њ —Б–Є–≥–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–ї–Њ –Њ –њ—А–Њ–≥—А–µ—Б—Б–Є–Є –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –њ–µ—З–µ–љ–Є (—А–Є—Б. 8). –°–љ–Є–ґ–µ–љ–Є–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –±–µ–ї–Ї–∞ –і–Њ 38,9 –≥/–ї —В–∞–Ї–ґ–µ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤–Њ–≤–∞–ї–Њ –Њ –њ–Њ—А–∞–ґ–µ–љ–Є–Є –њ–µ—З–µ–љ–Є –Є —Б–љ–Є–ґ–µ–љ–Є–Є –µ–µ –±–µ–ї–Ї–Њ–≤–Њ-—Б–Є–љ—В–µ–Ј–Є—А—Г—О—Й–µ–є —Д—Г–љ–Ї—Ж–Є–Є.
–°–Њ—Б—В–Њ—П–љ–Є–µ —А–µ–±–µ–љ–Ї–∞ —Г—Е—Г–і—И–∞–ї–Њ—Б—М –Ј–∞ —Б—З–µ—В –љ–∞—А–∞—Б—В–∞–љ–Є—П –њ–Њ–ї–Є–Њ—А–≥–∞–љ–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є: –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–є –∞–љ–µ–Љ–Є–Є, –њ–µ—З–µ–љ–Њ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є, –Ф–Т–°-—Б–Є–љ–і—А–Њ–Љ–∞, –њ—А–Њ—П–≤–Є–≤—И–µ–≥–Њ—Б—П –≤ –≤–Є–і–µ –ґ–µ–ї—Г–і–Њ—З–љ–Њ-–Ї–Є—И–µ—З–љ—Л—Е –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є –Є –Ї—А–Њ–≤–Њ—В–Њ—З–Є–≤–Њ—Б—В–Є –Љ–µ—Б—В –Є–љ—К–µ–Ї—Ж–Є–є, —Б–Ї—А—Л—В–Њ–є –Ї—А–Њ–≤–Є –≤ –∞–љ–∞–ї–Є–Ј–µ –Ї–∞–ї–∞. –Ц–µ–ї—В—Г—И–љ–Њ—Б—В—М –Ї–Њ–ґ–љ—Л—Е –њ–Њ–Ї—А–Њ–≤–Њ–≤ –Є —Б–ї–Є–Ј–Є—Б—В—Л—Е —Г—Б–Є–ї–Є–≤–∞–ї–∞—Б—М.
–Т –≤–Њ–Ј—А–∞—Б—В–µ 3 –Љ–µ—Б. 24 –і–љ–µ–є —Г –њ–∞—Ж–Є–µ–љ—В–∞ –±—Л–ї–∞ –Ј–∞—Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–∞ –Њ—Б—В–∞–љ–Њ–≤–Ї–∞ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П. –Я–∞—Ж–Є–µ–љ—В —Б–Ї–Њ–љ—З–∞–ї—Б—П –њ–Њ—Б–ї–µ –њ—А–Њ–≤–µ–і–µ–љ–Є—П –±–µ–Ј—А–µ–Ј—Г–ї—М—В–∞—В–љ—Л—Е —А–µ–∞–љ–Є–Љ–∞—Ж–Є–Њ–љ–љ—Л—Е –Љ–µ—А–Њ–њ—А–Є—П—В–Є–є. –Я–Њ—Б–Љ–µ—А—В–љ—Л–є –Ј–∞–Ї–ї—О—З–Є—В–µ–ї—М–љ—Л–є –і–Є–∞–≥–љ–Њ–Ј: –љ–∞—Б–ї–µ–і—Б—В–≤–µ–љ–љ–Њ–µ –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ –Њ–±–Љ–µ–љ–∞ –≤–µ—Й–µ—Б—В–≤ (–±–Њ–ї–µ–Ј–љ—М –У–Њ—И–µ, –±–Њ–ї–µ–Ј–љ—М –Т–Њ–ї—М–Љ–∞–љ–∞?). –Я—А–Є—З–Є–љ–∞–Љ–Є –ї–µ—В–∞–ї—М–љ–Њ–≥–Њ –Є—Б—Е–Њ–і–∞ —Б—В–∞–ї–Є: –њ–Њ–ї–Є–Њ—А–≥–∞–љ–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М, –∞–љ–µ–Љ–Є—П, —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є—П, –њ–µ—З–µ–љ–Њ—З–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М, –њ–Њ—А—В–∞–ї—М–љ–∞—П –≥–Є–њ–µ—А—В–µ–љ–Ј–Є—П, –Ф–Т–°-—Б–Є–љ–і—А–Њ–Љ, –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П –ґ–µ–ї—Г–і–Њ—З–љ–Њ-–Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞, –і—Л—Е–∞—В–µ–ї—М–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М.
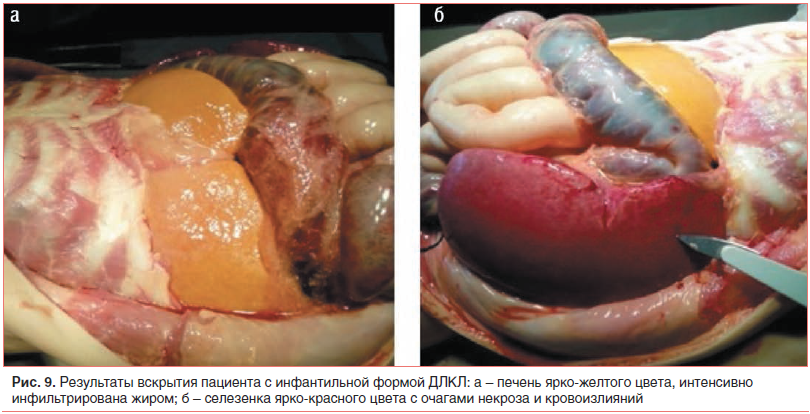
–Э–∞ —Б–µ–Ї—Ж–Є–Є –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –њ–µ—З–µ–љ–Є, —П—А–Ї–Њ-–ґ–µ–ї—В–Њ–≥–Њ —Ж–≤–µ—В–∞, —В–Ї–∞–љ—М –њ–µ—З–µ–љ–Є –Є–љ—Д–Є–ї—М—В—А–Є—А–Њ–≤–∞–љ–∞ –ґ–Є—А–Њ–Љ, –≥–µ–њ–∞—В–Њ—Ж–Є—В—Л –Ї—А—Г–њ–љ—Л–µ, –Ј–∞–њ–Њ–ї–љ–µ–љ–љ—Л–µ –ґ–Є—А–Њ–Љ. –°–µ–ї–µ–Ј–µ–љ–Ї–∞ —Г–≤–µ–ї–Є—З–µ–љ–∞, —В–µ–Љ–љ–Њ-–Ї—А–∞—Б–љ–Њ–≥–Њ —Ж–≤–µ—В–∞, —Б –Њ—З–∞–≥–∞–Љ–Є –љ–µ–Ї—А–Њ–Ј–∞ –Є –≥–µ–Љ–∞—В–Њ–Љ, —Д–Њ–ї–ї–Є–Ї—Г–ї—Л –љ–µ—А–∞–Ј–ї–Є—З–Є–Љ—Л, –Є–љ—Д–Є–ї—М—В—А–Є—А–Њ–≤–∞–љ–∞ –Љ–∞–Ї—А–Њ—Д–∞–≥–∞–Љ–Є, –Ј–∞–њ–Њ–ї–љ–µ–љ–љ—Л–Љ–Є –ґ–Є—А–Њ–Љ (—А–Є—Б. 9).
–Я—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤—Л—П–≤–ї–µ–љ—Л –Њ–њ–Є—Б–∞–љ–љ—Л–µ —А–∞–љ–µ–µ –Љ—Г—В–∞—Ж–Є–Є –≤ –≥–µ–љ–µ LIPA –≤ –Ї–Њ–Љ–њ–∞—Г–љ–і-–≥–µ—В–µ—А–Њ–Ј–Є–≥–Њ—В–љ–Њ–Љ —Б–Њ—Б—В–Њ—П–љ–Є–Є –°–Ь993350: —Б.348G>A (p.W116*); CM960945: c.796G>T (p.G266*). –Ю–±–µ –Љ—Г—В–∞—Ж–Є–Є –Њ—В–љ–Њ—Б—П—В—Б—П –Ї —В—П–ґ–µ–ї—Л–Љ –Є –њ—А–Є–≤–Њ–і—П—В –Ї —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—О —Б—В–Њ–њ-–Ї–Њ–і–Њ–љ–∞. –Я–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ –і–Є–∞–≥–љ–Њ–Ј: –Ф–Ы–Ъ–Ы, –Є–љ—Д–∞–љ—В–Є–ї—М–љ–∞—П —Д–Њ—А–Љ–∞.
–Ю–±—Б—Г–ґ–і–µ–љ–Є–µ
–Ф–Ы–Ъ–Ы вАФ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–µ –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–µ –љ–∞—Б–ї–µ–і—Б—В–≤–µ–љ–љ–Њ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ, –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ–Њ–µ —Б –≤—Л—Б–Њ–Ї–Њ–є –ї–µ—В–∞–ї—М–љ–Њ—Б—В—М—О –Є —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П —В–µ—А–Љ–Є–љ–∞–ї—М–љ–Њ–≥–Њ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –њ–µ—З–µ–љ–Є –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –љ–∞–Ї–Њ–њ–ї–µ–љ–Є—П —Б–ї–Њ–ґ–љ—Л—Е —Н—Д–Є—А–Њ–≤ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –Є —В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–Њ–≤ –≤ –њ–µ—З–µ–љ–Є, —Б–µ–ї–µ–Ј–µ–љ–Ї–µ, —Б—В–µ–љ–Ї–∞—Е –Ї—А–Њ–≤–µ–љ–Њ—Б–љ—Л—Е —Б–Њ—Б—Г–і–Њ–≤ –Є –і—А—Г–≥–Є—Е —В–Ї–∞–љ—П—Е [17, 18]. –Ф–Ы–Ъ–Ы –Љ–Њ–ґ–µ—В –Љ–∞–љ–Є—Д–µ—Б—В–Є—А–Њ–≤–∞—В—М –љ–∞ –њ–µ—А–≤–Њ–Љ –≥–Њ–і—Г –ґ–Є–Ј–љ–Є —А–µ–±–µ–љ–Ї–∞ (–Є–љ—Д–∞–љ—В–Є–ї—М–љ–∞—П —Д–Њ—А–Љ–∞ –Ф–Ы–Ъ–Ы –Є–ї–Є –±–Њ–ї–µ–Ј–љ—М –Т–Њ–ї—М–Љ–∞–љ–∞), –Є —И–∞–љ—Б –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є —В–∞–Ї–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±–Њ–ї–µ–µ 12 –Љ–µ—Б. —Б–Њ—Б—В–∞–≤–ї—П–µ—В 0,114.–Я—А–Є–Љ–µ–љ–µ–љ–Є–µ —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –≤–Ї–ї—О—З–∞—П —В—А–∞–љ—Б-
–њ–ї–∞–љ—В–∞—Ж–Є—О –њ–µ—З–µ–љ–Є –Є –Ґ–У–°–Ъ, —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В —Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В —Б–Љ–µ—А—В–Є —Б 3 –Љ–µ—Б. (–Љ–µ–і–Є–∞–љ–∞ –≤–Њ–Ј—А–∞—Б—В–∞ —Б–Љ–µ—А—В–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Є–љ—Д–∞–љ—В–Є–ї—М–љ–Њ–є —Д–Њ—А–Љ–Њ–є –Ф–Ы–Ъ–Ы —В–Њ–ї—М–Ї–Њ —Б —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–µ–є) –і–Њ 8,6 –Љ–µ—Б. —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ—Б–ї–µ –њ—А–Њ—Ж–µ–і—Г—А—Л –Ґ–У–°–Ъ –Є/–Є–ї–Є —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є –њ–µ—З–µ–љ–Є [5].
–Ф–Ы–Ъ–Ы, –Љ–∞–љ–Є—Д–µ—Б—В–Є—А—Г—О—Й–∞—П –≤ –±–Њ–ї–µ–µ –њ–Њ–Ј–і–љ–µ–Љ –≤–Њ–Ј—А–∞—Б—В–µ, —В–∞–Ї–ґ–µ –Є–Љ–µ–µ—В –Ї—А–∞–є–љ–µ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–є –њ—А–Њ–≥–љ–Њ–Ј –≤ —Б–≤—П–Ј–Є —Б –±—Л—Б—В—А—Л–Љ —А–∞–Ј–≤–Є—В–Є–µ–Љ —Ж–Є—А—А–Њ–Ј–∞, —В–µ—А–Љ–Є–љ–∞–ї—М–љ–Њ–є –њ–µ—З–µ–љ–Њ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –Є –њ–Њ—В—А–µ–±–љ–Њ—Б—В–Є –≤ —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є –њ–µ—З–µ–љ–Є: –Љ–µ–і–Є–∞–љ–∞ –≤—А–µ–Љ–µ–љ–Є –і–Њ —А–∞–Ј–≤–Є—В–Є—П —Г–Ї–∞–Ј–∞–љ–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ф–Ы–Ъ–Ы —Б–Њ—Б—В–∞–≤–ї—П–µ—В 3,7 –≥–Њ–і–∞ —Б –Љ–Њ–Љ–µ–љ—В–∞ –Љ–∞–љ–Є—Д–µ—Б—В–∞—Ж–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П [8].
–Ґ–µ—З–µ–љ–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –≤ –њ—А–Є–≤–µ–і–µ–љ–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –љ–∞–±–ї—О–і–µ–љ–Є—П—Е —Б–Њ–≥–ї–∞—Б—Г–µ—В—Б—П —Б –ї–Є—В–µ—А–∞—В—Г—А–љ—Л–Љ–Є –і–∞–љ–љ—Л–Љ–Є. –Т –њ–µ—А–≤–Њ–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–Љ –љ–∞–±–ї—О–і–µ–љ–Є–Є —Г—Е—Г–і—И–µ–љ–Є–µ —Б–Њ—Б—В–Њ—П–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Ї–Є, –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –њ–µ—З–µ–љ–Є –Є —А–∞–Ј–≤–Є—В–Є–µ —Ж–Є—А—А–Њ–Ј–∞ –њ—А–Є–≤–µ–ї–Є –Ї —А–µ—И–µ–љ–Є—О –Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –њ–ї–∞–љ–Є—А–Њ–≤–∞–љ–Є—П —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є –њ–µ—З–µ–љ–Є –≤ –≤–Њ–Ј—А–∞—Б—В–µ 14 –ї–µ—В. –¶–Є—А—А–Њ–Ј –Ї–∞–Ї —А–µ–Ј—Г–ї—М—В–∞—В –њ—А–Њ–≥—А–µ—Б—Б–Є–Є –Ф–Ы–Ъ–Ы –њ—А–Є–≤–µ–ї –Ї —А–∞–Ј–≤–Є—В–Є—О –Љ–љ–Њ–ґ–µ—Б—В–≤–∞ –і—А—Г–≥–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є: –≤–∞—А–Є–Ї–Њ–Ј–љ–Њ–≥–Њ —А–∞—Б—И–Є—А–µ–љ–Є—П –≤–µ–љ –њ–Є—Й–µ–≤–Њ–і–∞ –Є –ґ–µ–ї—Г–і–Ї–∞, –њ–Њ—А—В–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–Є, –љ–∞—А—Г—И–µ–љ–Є–є –≥–µ–Љ–Њ—Б—В–∞–Ј–∞ –Є —В. –і. –Я—А–Њ–≤–µ–і–µ–љ–Є–µ —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є –±—Л–ї–Њ –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ. –Э–∞–Ј–љ–∞—З–µ–љ–Є–µ —Б–µ–±–µ–ї–Є–њ–∞–Ј—Л –∞–ї—М—Д–∞ –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є –њ—А–Є–≤–µ–ї–Њ –Ї –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–Є–Є –Њ–±–Љ–µ–љ–∞ –ї–Є–њ–Є–і–Њ–≤, —Г—А–Њ–≤–љ—П –Њ–±—Й–µ–≥–Њ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞, —Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є–Є —Б–Њ—Б—В–Њ—П–љ–Є—П –њ–µ—З–µ–љ–Є, —Г–ї—Г—З—И–µ–љ–Є—О –Њ–±—Й–µ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П –Є –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є, –≤–Ї–ї—О—З–∞—П –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є—О –Љ–µ–љ—Б—В—А—Г–∞–ї—М–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є.
–Ъ —Б–Њ–ґ–∞–ї–µ–љ–Є—О, –≤—В–Њ—А–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є –њ—А–Є–Љ–µ—А –Є–љ—Д–∞–љ—В–Є–ї—М–љ–Њ–є —Д–Њ—А–Љ—Л –Ф–Ы–Ъ–Ы –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г–µ—В –≤—Л—Б–Њ–Ї—Г—О –Њ–њ–∞—Б–љ–Њ—Б—В—М –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Г –і–µ—В–µ–є –њ–µ—А–≤–Њ–≥–Њ –≥–Њ–і–∞ –ґ–Є–Ј–љ–Є: —Б–Љ–µ—А—В—М –њ–∞—Ж–Є–µ–љ—В–∞ –Њ—В –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Ф–Ы–Ъ–Ы –љ–∞—Б—В—Г–њ–Є–ї–∞ –≤ —В–µ—З–µ–љ–Є–µ 1 –Љ–µ—Б. –Є 13 –і–љ–µ–є —Б –Љ–Њ–Љ–µ–љ—В–∞ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –њ–µ—А–≤—Л—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –±–Њ–ї–µ–Ј–љ–Є. –Т–µ—А–љ—Л–є –і–Є–∞–≥–љ–Њ–Ј –±—Л–ї —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ –њ–Њ—Б–Љ–µ—А—В–љ–Њ, —Е–Њ—В—П –њ–Њ–і–Њ–Ј—А–µ–љ–Є–µ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –Ф–Ы–Ъ–Ы –Ї–∞–Ї –њ—А–Є—З–Є–љ—Л —В—П–ґ–µ–ї–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П —А–µ–±–µ–љ–Ї–∞ –≤–Њ–Ј–љ–Є–Ї–ї–Њ –µ—Й–µ –њ—А–Є –ґ–Є–Ј–љ–Є –њ–∞—Ж–Є–µ–љ—В–∞ –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –Њ–±–љ–∞—А—Г–ґ–µ–љ–Є—П –Ї–∞–ї—М—Ж–Є—Д–Є–Ї–∞—Ж–Є–Є –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–Њ–≤.
–Ю–±–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –љ–∞–±–ї—О–і–µ–љ–Є—П –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г—О—В –≤–∞–ґ–љ–Њ—Б—В—М —Б–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Ф–Ы–Ъ–Ы –і–ї—П –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є—П —В—П–ґ–µ–ї—Л—Е –њ–Њ—Б–ї–µ–і—Б—В–≤–Є–є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –†–Њ—Б—Б–Є–є—Б–Ї–Є–Љ–Є —Н–Ї—Б–њ–µ—А—В–∞–Љ–Є –±—Л–ї–Є —А–∞–Ј—А–∞–±–Њ—В–∞–љ—Л –Ї—А–Є—В–µ—А–Є–Є, –њ–Њ–Ј–≤–Њ–ї—П—О—Й–Є–µ —Б–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ–Њ –Ј–∞–њ–Њ–і–Њ–Ј—А–Є—В—М –Ф–Ы–Ъ–Ы –Є —Г—Б—В–∞–љ–Њ–≤–Є—В—М –≤–µ—А–љ—Л–є –і–Є–∞–≥–љ–Њ–Ј (—В–∞–±–ї. 1).
–Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ—А–Њ—Б—В–Њ–≥–Њ –Є –≤—Л—Б–Њ–Ї–Њ–Є–љ—Д–Њ—А–Љ–∞—В–Є–≤–љ–Њ–≥–Њ —В–µ—Б—В–∞ вАУ –Є–Ј–Љ–µ—А–µ–љ–Є–µ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ы–Ъ–Ы –≤ –њ—П—В–љ–∞—Е –≤—Л—Б—Г—И–µ–љ–љ–Њ–є –Ї—А–Њ–≤–Є –њ–Њ–Ї–∞–Ј–∞–љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ –≤—Б–µ—Е –≤–Њ–Ј—А–∞—Б—В–љ—Л—Е –≥—А—Г–њ–њ —Б –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ –њ–µ—З–µ–љ–Є –љ–µ—П—Б–љ–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–Є (—Ж–Є—А—А–Њ–Ј, —Д–Є–±—А–Њ–Ј), –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —В—А–∞–љ—Б–∞–Љ–Є–љ–∞–Ј –Є –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ—А–Њ–≤–Њ–і–Є—В—М —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–є —Б–Ї—А–Є–љ–Є–љ–≥ –≥—А—Г–њ–њ –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞ –і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П —Н—В–Њ–≥–Њ —А–µ–і–Ї–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П.








.gif)



