СРК представляет собой комплекс функциональных нарушений работы кишечника, наиболее частыми симптомами которого является нарушение самого акта дефекации, различные варианты абдоминального болевого синдрома и отсутствие при этом значимых воспалительных или иных органических изменений кишечной трубки [2,3].
До появления понятия «СРК» для определения его симптомов применялись самые разные названия, например дискинезия толстой кишки, нервная диарея, невроз кишечника, слизистая колика, спастический колит, функциональная колопатия и многие другие [2,4,5].
Проблемы терминологии отражались и в практической деятельности врачей–гастроэнтерологов разных стран и научных школ, не позволяя выработать единые подходы к пониманию патогенеза патологического процесса, и, как следствие, не создавали предпосылки к единому лечебному подходу. Период использования субъективных критериев в подходах к диагностике СРК завершился с моментом публикации широко известных критериев Маннинга [Manning et al.,1978], которые имели достаточно высокую специфичность, но низкую чувствительность.
Диагностические критерии Маннинга включали:
1) видимое на глаз вздутие живота;
2) уменьшение интенсивности боли после дефекации;
3) более частую дефекацию в начале болей;
4) частый жидкий стул в начале болей;
5) слизеотделение из прямой кишки;
6) чувство неполного опорожнения кишки.
Выделение данных критериев стало отправной точкой в систематизации диагностически значимых признаков функциональных заболеваний кишечника и, в частности, СРК и позволило в дальнейшем проводить более детальное описание каждой из функциональных патологий ЖКТ, выделяя круг диагностических критериев и патогномоничных симптомов. Вместе с тем сохранялась настоятельная необходимость продолжения стандартизации симптоматики и выработки еще более четких критериев диагностики функциональной патологии ЖКТ и в т.ч. СРК. Именно это и было сделано в 1988 г. во время работы IX Всемирного конгресса гастроэнтерологов, в рамках которого заседала международная группа по изучению функциональной патологии ЖКТ. Тогда впервые в официальных документах были зафиксированы определение СРК и критерии его диагностики. По месту принятия данного программного документа они были названы «Римскими критериями СРК». В тот момент Римские критерии включали:
– по крайней мере 12 нед. непрерывного абдоминального дискомфорта или болей за предшествующий 12–месячный период, имеющих два из трех следующих признаков:
1) облегчение при дефекации и/или
2) начало, связанное с изменением частоты стула, и/или
3) начало, связанное с изменением внешнего вида кала.
– следующие симптомы, кумулятивно подтверждающие диагноз СРК:
1) патологическая частота стула (более 3 раз/сут. или менее 3 раз/нед.);
2) патологическая форма кала;
3) патологический пассаж каловых масс (напряжение кишечника, безотлагательность, чувство неполного опорожнения);
4) слизеотделение;
5) вздутие живота и чувство распирания.
В 1999 г. критерии были дополнены и приняты «Римские критерии СРК II» [6], а в 2006 г. новые уточнения данных диагностических протоколов были опубликованы уже под традиционным названием «Римские критерии III пересмотра» [4].
Следует отметить, что педиатрическая общественность и ранее использовала основные положения «Римских критериев» в своей практике, а в России на их основе был создан и принят «Рабочий протокол диагностики и лечения функциональных заболеваний органов пищеварения у детей» (2004 г., с дополнениям от 2005 г.) [7]. Между тем только в «Римских критериях III пересмотра» официально появились ссылки и уточнения, касающиеся детского возраста. В пересмотренных рекомендациях основные симптомы СРК изменений не претерпели и в своей основе содержат все те же критерии Маннинга. Однако предшествующая длительность симптомов сокращена с 12 (Рим. II) до 6 мес., а регулярность характерной симптоматики должна быть не реже 3 дней в месяц в течение последних 3 мес. [8].
Итак, согласно «Римским критериям III», диагностическими критериями СРК являются:
– рецидивирующая боль в животе или дискомфорт по крайней мере 3 дня в месяц за последние 3 мес., связанные с двумя или более из нижеследующих признаков:
• улучшение после дефекации;
• начало, связанное с изменением частоты стула;
• начало, связанное с изменением формы стула.
Дополнительными симптомами являются:
• патологическая частота стула (менее 3 раз в неделю или более 3 раз в сутки);
• патологическая форма стула (комковатый/твердый стул или жидкий/водянистый стул);
• натуживание при дефекации;
• императивный позыв или чувство неполного опорожнения, выделение слизи и вздутие.
Примечание: а) критерии присутствуют в течение последних 3 мес. с началом симптомов не менее чем за 6 мес. до того; б) дискомфорт означает неприятное ощущение, не описанное как боль.
Таким образом, в настоящее время СРК имеет самостоятельный рубрикативный шифр в МКБ 10–го пересмотра, т.е. обладает всеми необходимыми признаками и критериями самостоятельной нозологической единицы.
Вместе с тем основная трудность формирования диагностических критериев состоит в отсутствии биологического маркера СРК, что, в свою очередь, отражает несколько основных патогенетических звеньев развития этого заболевания.
Согласно современным представлениям о СРК, сформулированным в «Римском консенсусе III», это заболевание является биопсихосоциальным расстройством, в основе развития которого лежат два основных патологических механизма – психосоциальное воздействие и сенсорно–моторная дисфункция кишечника, т.е. нарушения висцеральной чувствительности и двигательной активности кишечника [8,9]. Еще одним, не менее важным фактором, привлекающим в настоящее время внимание исследователей, являются стойкие нейроиммунные повреждения, которые развиваются после инфекционных заболеваний кишечника и рассматриваются как возможная причина формирования сенсорно–моторной дисфункции.
После того как диагноз СРК установлен, в дальнейшем необходимо правильно классифицировать пациента по преобладающему симптому для последующей выработки правильной лечебной программы. Возникающие при этом трудности практическим врачам предложено решать с применением Бристольской шкалы формы кала.
Предложено следующее разделение СРК (IBS) по преобладающей форме стула:
1) СРК с преобладанием запора (IBS–C);
2) СРК с преобладанием диареи (IBS–D);
3) смешанный СРК (IBS–М);
4) неклассифицируемый СРК.
При этом для каждого из вариантов в «Римских критериях III» предусмотрены минимальные и максимальные варианты встречаемости нетипичного характера каловых масс, учет которых проводится без применения противодиарейных или слабительных средств. Принимая во внимание, что эта классификация – путь к унифицированному описанию и пониманию больных, у которых дефекация часто изменяется в течение времени (запор сменяется поносом и наоборот), экспертами рабочей группы для таких случаев предложен термин «перемежающийся СРК» (IBS–A).
На современном этапе выделяют еще одну форму СРК. Это постинфекционный СРК (PI–IBS), развившийся после перенесенных острых кишечных инфекций. К этой форме заболевания, несмотря на ее отсутствие в «Римском консенсусе III», привлечено большое внимание специалистов и исследователей. Данное состояние описано более полувека назад [G.T. Stewart, 1950] и, по данным современных авторов, у 7–33% пациентов, перенесших кишечные инфекции в период от 3–4 мес. до 6 лет, развивается картина СРК [10].
Отечественные ученые [11] предложили диагностические критерии данной формы СРК (PI–IBS), которые включают:
– соответствие диагноза «Римским критериям»;
– упоминание в анамнезе о перенесенных кишечных инфекциях, предшествующих развитию СРК;
– обнаружение маркеров ОКИ в биосубстратах от больного;
– нарушение микрофлоры в бактериологических исследованиях кала;
– избыточный бактериальный рост в тонкой кишке;
– изменение мукозной микрофлоры слизистой оболочки тонкой кишки;
– положительный эффект от лечения антисептиками и пробиотиками.
При этом следует отметить, что не менее 10% пациентов с СРК связывают заболевание с перенесенной инфекцией [12]. Считаем, что данный факт крайне важен в педиатрической практике. Связано это с особенностями детского возраста и высокой удельной частотой кишечных инфекций у детей.
По данным зарубежных авторов, приблизительно 10–15% взрослого населения имеют симптомы СРК, и, по данным большинства исследований, женщины страдают приблизительно в 2 раза чаще мужчин [13].
Эпидемиологические исследования среди детского населения в США показали, что признаки СРК имеют 6% младших и 14% старших школьников [14], в Италии 13,9% детей в возрасте до 12 лет имели симптомы СРК, а в Китае – 13,3% [15]. По данным российских исследователей, в одном из западносибирских мегаполисов среди подростков 14–17 лет имели симптоматику СРК от 14 до 24% обследованных [16].
Учеными всего мира продолжаются массовые исследования в области функциональной гастроэнтерологии, в т.ч. СРК. Уточняются эпидемиологические показатели, симптоматика, патогенетические аспекты заболевания. Достаточно подробно описаны механизмы нарушений моторной функции кишечника, развитие и характеристики болевого абдоминального синдрома, а также связь этих изменений с эфферентной чувствительностью и рефлекторными механизмами. Изучены и продолжают изучаться другие клинические аспекты СРК, такие как, например, психоличностные особенности пациентов и их связь с социально–экономическими условиями жизни, микроэкологические нарушения в кишечнике и их связь с длительностью течения патологического процесса и с механизмами «первичного полома» [17]. Одним из изучаемых патогенетических звеньев СРК является выявление взаимосвязей с нарушениями иммунологической защиты. Так, по данным ряда авторов, нередко отмечается снижение уровня иммуноглобулинов, преимущественно класса IgG, у больных с СРК. [5]. Этому отводится немаловажная роль в патогенезе данного заболевания.
У пациентов с началом формирования СРК после перенесенных эпизодов кишечной инфекции нейроиммунным нарушениям в кишечнике придается ведущее значение. Установлено, что в биоптатах слизистой оболочки таких больных повышен уровень провоспалительного цитокина интерлейкина–1b в сравнении с пациентами, у которых после перенесенной кишечной инфекции СРК не формировался [18,19]. У этих же групп пациентов выявлено увеличение количества клеток хронического воспаления и CD3+–лимфоцитов в собственной пластинке слизистой оболочки толстой кишки [20,21].
Таким образом, являясь биопсихосоциальным расстройством [22], СРК не только наносит серьезный экономический ущерб обществу, но и значительно влияет на качество жизни [23]. Это заставляет врачей и исследователей совершенствовать программы терапии и реабилитации данной группы пациентов, уделяя внимание не только основным звеньям патогенетического процесса, но и т.н. последующим звеньям, являющимся производными уже развившихся патологических нарушений [24,25].
Ярким примером этого являются сочетания нарушений т.н. «реактивных» изменений моторики и абсорбционной функции ЖКТ, которые ведут к нарушению процессов внутриполостного пищеварения, дисбиотическим нарушениям, что в свою очередь усугубляет иммунологическую недостаточность. В связи с вышеизложенным приоритет получают фармакологические препараты, нормализующие функции биологических регуляторных систем, которые могут корректировать нарушения на еще функциональном этапе, не допуская развития органической патологии [26].
В этой связи наше внимание привлек отечественный иммунобиологический препарат Кипферон® – суппозитории для вагинального или ректального введения. Данный препарат представляет собой комбинацию комплексного иммуноглобулинового препарата (КИП) 60 мг, содержащего иммуноглобулины трех основных классов – G, А и М, – и рекомбинантного человеческого интерферона альфа–2b, не менее 500 000 МЕ.
Клинические исследования и практика медицинского применения Кипферона® показали, что в препарате сочетается антибактериальное, противовирусное, противовоспалительное и иммуномодулирующее действие. При этом противовирусное и антибактериальное действие препарата проявляется как во внутриклеточной, так и внеклеточной среде организма за счет прямого действия на возбудителей заболевания и стимуляции механизмов клеточного и гуморального иммунитета [27,28]. При этом важной характеристикой препарата является отсутствие риска активной специфической стимуляции иммунной системы ребенка [26].
Исследование эффективности включения препарата Кипферон® в схемы лечения пациентов с СРК проведено на базе педиатрических отделений Клинической больницы им. С.Р. Миротворцева ГОУ ВПО «Саратовский госмедуниверситет им. В.И. Разумовского Росздрава».
Группу наблюдения составили 48 детей с различными клиническими вариантами СРК. Из них 30 пациентам в комплекс терапии был включен препарат Кипферон® и 18 детей, получавших стандартный курс лечения, составили группу сравнения.
Для верификации диагноза СРК у пациентов с момента поступления в клинику применялись как традиционные методы непосредственного обследования (расспрос, выяснение особенностей анамнеза заболевания и анамнеза жизни), так и комплекс протоколируемых лабораторных и инструментальных исследований.
При выяснении анамнестических данных обязательный акцент делался на вопросах, позволяющих исключить т.н. симптомы тревоги при СРК.
Обязательными в плане обследования являлось проведение: общего анализа крови, общего анализа мочи, биохимического исследования сыворотки крови, копрологического исследования, исследование кала на дисбактериоз, исследование показателей клеточного и гуморального иммунитета, ультразвукового исследования органов брюшной полости, ФГДС (по показаниям), ректороманоскопии и ирригоскопии. Следует указать, что после установки диагноза, который соответствовал «Римским критериям», значимые для постановки диагноза СРК жалобы, такие как боль в животе, боль, облегчающаяся при дефекации, чередование диареи с запором, тяжесть и длительность запора, метеоризм, выделение слизи, чувство неполного опорожнения кишечника, а также жалобы, которые могли трактоваться как признаки внекишечных проявлений СРК (головная боль, сонливость, дизурия), не только протоколировались, но и оценивались по 5–балльной шкале для последующего динамического наблюдения.
В качестве дополнительных методов обследования проводились эхоэнцефалоскопия, реоэнцефаловазография и консультации невролога для уточнения неврологического статуса пациентов.
Основная группа пациентов (30 детей) была представлена 18 мальчиками и 12 девочками, средний возраст составил 9,2±2,5 года. Группу сравнения составили 11 девочек и 7 мальчиков, средний возраст 11,1±2,1 года.
В основной группе СРК с запором верифицирован у 46% (14 детей), СРК с преобладанием диареи – у 26,6% (8 детей), у 26,6% (8 детей) установлена смешанная форма СРК.
В группе сравнения: СРК с диареей отмечен у 4 (22,2%) пациентов, 10 (55,5%) больных представляли группу СРК с запорами и у 4 (22,2%) пациентов установлена смешанная форма заболевания.
У всех детей обследуемых групп были выявлены признаки синдрома вегетативной дисфункции.
Стандартная терапия СРК включала обязательное использование диетологических рекомендаций, назначение ноотропов и седативных препаратов. Детям с превалированием запора в качестве базисного средства назначали препараты лактулозы в индивидуально подобранных дозах, при диарее использовали курсы цитомукопротекторов и сорбентов. В случаях превалирования болевого синдрома лечение дополняли спазмолитиками (гиосцина бутилбромид, мебеверин, дротаверина гидрохлорид). При необходимости в лечение включали препараты группы эубиотиков. Комплексное лечение дополнялось включением курсов физио– и психотерапии.
Препарат Кипферон® назначали в стандартной дозировке по 1 свече 2 раза/сут. в течение 10 дней детям до 7 лет и 3 раза/сут. детям старше 7 лет дополнительно к базисной терапии. Контроль основных лабораторных показателей проводили через 2–4 дня после завершения иммуномодулирующего курса. Оценку качества лечения проводили через месяц после его начала.
В течение 10–14 дней у всех пациентов на фоне проведенной терапии состояние улучшилось до стабильно удовлетворительного. Вместе с тем при анализе жалоб в подгруппе детей с СРК с запором, получавших Кипферон®, устойчивый положительный эффект в виде получения регулярного непатологического стула был достигнут ранее, чем в группе сравнения (p<0,05). В этой связи, безусловно, нельзя исключить неспецифический эффект применения препарата в виде суппозиториев.
При анализе бактериологического спектра кишечного содержимого по результатам исследования кала на дисбактериоз у детей, получавших Кипферон®, была отмечена следующая динамика. До назначения лечения дисбиоз кишечника выявлен у 90% детей обследуемой группы, из них у 40% он соответствовал 3–й степени [Кузнецова Г.Г., 1972], у 46,6% – 2–й степени. При дисбиозе 3–й степени микробный пейзаж кишечника пациентов до получения препарата Кипферон® был представлен высокими титрами стафилококков и протея (выше, чем 106), в 75% случаев высоким содержанием гемолитических штаммов E. сoli, а также наличием в 50% случаев бактерий родов Klebsiella, Citrobacter.
После проведенного лечения у 83,3% пациентов основной группы, получавшей в том числе и иммуномодулирующую терапию, показатели дисбиоза достигли 1–й степени, когда отмечалось только умеренное снижение количества бифидо– или лактобактерий и кишечной палочки. В группе сравнения после стандартного курса лечения, подобной динамики достичь не удалось (p<0,05) (табл. 1).
Иммунологическое обследование, включавшее в себя исследование субпопуляций лимфоцитов, уровня сывороточных иммуноглобулинов, индексов фагоцитарной активности, продемонстрировало при первоначальном сравнении недостоверные различия показателей детей двух групп.
При анализе в подгруппах наибольший интерес представила подгруппа детей с СРК с запором. До начала лечения у 50% пациентов этой подгруппы выявлено снижение показателей IgA и у 35,7% – снижение показателей IgG сыворотки крови. В группе сравнения отмечены однонаправленные изменения. Однако после использования препарата Кипферон® показатели сывороточных иммуноглобулинов в достоверном числе случаев достигли рефренсного интервала, что не было достигнуто в группе сравнения (табл. 2). Данное изначальное снижение уровня IgA, вероятно, может быть связано с высокой степенью микробной нагрузки, в т. ч. со стороны микрофлоры кишечника, что иллюстрируют показатели микробного пейзажа, приведенные выше.
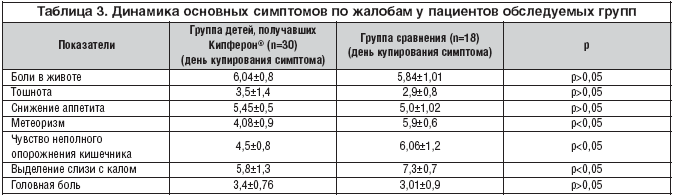
В сравниваемых группах больных с СРК на фоне приема препарата Кипферон® достоверно быстрее были купированы некоторые из патологических симптомов, определяемых по жалобам пациентов или их родителей, а также при активном обследовании ребенка, или динамика их угасания была выше. Получена достоверная разница по срокам купирования жалоб на метеоризм, чувство неполного опорожнения кишечника, выделение слизи с калом (p<0,05) по сравнению с группой больных, не получавших иммуномодулирующую терапию (табл. 3).
Через месяц после окончания лечения в группе детей, получавших Кипферон®, не отмечено рецидивирования патологической симптоматики, характерной для того или иного варианта СРК, в то время как в группе сравнения при сохранении общей благоприятной тенденции по основным симптомам болезни зафиксировано появление балльных оценок при регистрации слабых проявлений метеоризма, также выявлено нарастание вегетативной симптоматики, такой как цефалгии, утомляемости, дизурии.
После завершения исследования проведен дополнительный анализ в группе детей, получавших Кипферон®, с некоторыми анамнестическими данными. Была выявлена достоверная корреляция между эффектом на фоне применения препарата и указанием на перенесенную в течение последних 6 мес. до появления симптомов СРК кишечную инфекцию. Это позволяет говорить о наибольшей эффективности применения препарата у детей с постинфекционным СРК.
Таким образом, результаты работы позволяют считать целесообразным включение Кипферона® в комплексную терапию детей с СРК независимо от формы и характера течения заболевания.
Кроме того, считаем важным при рассмотрении поправок к «Рабочему протоколу диагностики и лечения функциональных заболеваний органов пищеварения у детей», обсуждение которых проходит в этом году, внести в группу СРК в качестве одного из вариантов постинфекционную форму как отдельный вариант течения и рекомендовать включение отечественного комбинированного иммунобиологического препарата Кипферон® в базисную терапию этого заболевания.


Литература
1. Бельмер С.В., Гасилина Т.В., Хавкин А.И., Эйберман А.С. Функциональные нарушения органов пищеварения у детей. Рекомендации и комментарии. М., 2005: 31.
2. Синдром раздраженного кишечника //Учебное пособие под ред. И.В.Маева, М., ГОУ ВУНЦ МЗ РФ; 2004:70 с.
3. Терещенко С.Ю. Синдром раздраженного кишечника у детей: диагностика и современные подходы к терапии // Пед. фармакология, 2006;3(2).
4. Щербаков, П.Л. Синдром раздраженного кишечника у детей и подростков // Вопросы современной педиатрии, 2006;5(3):52.
5. Гастроэнтерология детского возраста / Под ред. С.В. Бельмера, А.И.Хавкина // Практическое руководство по детским болезням под ред. В.Ф.Коколиной, А.Г.Румянцева. М., Медпрактика – М;2003:249–266.
6. Thompson W. G., Longstreth G. F., Drossman D. A., Heaton K. W., Irvine E. J., Muller–Lissner S.A. Functional bowel disorders and functional abdominal pain. Rome II: A Multinational Consensus Document on Functional Gastrointestinal Disorders. Gut, 1999; 45 (Suppl. II): 1143–8.
7. Рабочий протокол диагностики и лечения функциональных заболеваний органов пищеварения детей, (принятый на XI Конгрессе детских гастроэнтерологов России) (Москва, 2004 г.) с дополнениями 2005 г.(Координаторы проекта: А.И. Хавкин, А.С. Эйберман) – Гастро NEWS– лайн. Педиатрический выпуск. 2005.
8. Drossman D.A. The Functional Gastrointestinal Disorders and the Rome III Process. Gastroenterology 2006; 130 (5): 1377–90.
9. Симаненков В.И. Психосоматические расстройства в практике терапевта СПб., 2008;335.
10. Tornblom H., Holmvall P., Svenungsson B., et al.Gastrointestinal symptoms after infections diarrhea: a five–year follow–up in Swedish cohort of adults. Clin.Gastroenterol. Hepatol.2007;5(4);461–4.
11. Ручкина И.Н., Парфенов А.И.Осипов Г.А.Постинфекционный синдром раздраженного кишечника – новое направление в этиологии и патогенезе функциональных заболеваний. Сonsilium Medicum. 2006; (Экстравыпуск):8–12.
12. Neal K.R., Barker L.,Spiller R.C. Prognosis in post–infective irritable bowel syndrome; a six year follow up study. Gut.2002; 51(3):410–3.
13. Маев И.В., Черемушкин С.В. Синдром раздраженного кишечника. Римские критерии III. Consilium medicum. Гастроэнтерология 2007; 1; 29–34.
14. El–Baba MF, Nazer H, Konop R et al. Irritable Bowel Syndrome. URL: http://www.emedicine.com/ped/topic1210.htm.
15. Dong L, Dingguo L, Xiaoxing X, Hanming L. An epidemiologic study of irritable bowel syndrome in adolescents and children in China: a school–based study. Pediatrics 2005; 116 (3): p.3–6.
16. Reshetnikov O.V., Kurilovich S.A., Denisova D.V. et al. Prevalence of dyspepsia and irritable bowel syndrome among adolescents of Novosibirsk, western Siberia. Int. J. Circumpolar. Health 2001; 60 (2): 253–57.
17. Маев И.В., Черемушкин С.В. Психосоциальные факторы в развитии синдрома разраженного кишечника: возможности терапии. Cоnsilium medicum. Гастроэнтерология 2006;7:34–42.
18. Collins S.M. A case for an immunological basis for irritable bowel syndrome. Gastroenterology 2002; 122: 2078–80.
19. Gwee K.A., Collins S.M., Read N.W. et al. Increased rectal mucosal expression of interleukin 1beta in recently acquired post–infection irritable bowel syndrome.Gut 2003; 52:523–6.
20. Gwee K.A., Leong Y.L., Graham C. et al. The role of psychological and biological factors in postinfective gut dysfunction. Gut 1999; 44 (3): 400–6.
21. Spiller R.C., Jenkins D., Thornley J.P. et al. Increased rectal mucosal enteroendocrine cells, t lymphocytes and increased gut permeability following acute Campylobacter enteritis and in post–dysenteric irritable bowel syndrome. Gut 2000; 47: 804–11.
22. Козлова И.В., Цыбина М.И. Синдром раздраженного кишечника как психосоматическая проблема: клиника, диагностика, тактика ведения Методические рекомендации.Саратов.,2002:3–14.
23. Избранные лекции по гастроэнтерологии/ под ред. В.Т.Ивашкина, А.А. Шептулина. М., МЕДпресс; 2001:54–82.
24. Головенко О.В. Современные стандарты диагностики и лечения синдрома раздраженного кишечника. Пособие для врачей М., 2007:15.
25. Симаненков В.И., Суворов А.Н., Захаренко С.М., Бочкарева А.Н., Сундукова З.Р. Постинфекционный синдром раздраженного кишечника: есть ли место в терапии пробиотикам?//Инф. болезни,2009; 7(3):3–9.
26. Римарчук Г.В., Васечкина Л.И., Тюрина Т.К. и др. Иммунонапроавленная терапия детей с хроническими заболеваниями органов пищеварения. «Лечащий врач», 2009;6:74–76.
27. Кондрашин Ю.И. Новый противовирусный антибактериальный иммуномодулирующий препарат Кипферон. Русский медицинский журнал. 2006;14(4):318–319.
28. Опыт применения Кипферона в практике педиатра. М., Анита–пресс. 2008: 31.











