Болезни накопления гликогена (гликогеновые болезни, гликогенозы, ГБ, МКБ-10 Е74.0) — группа наследственных болезней углеводного обмена, в основе патогенетических механизмов которых лежит дефект генов, кодирующих ферменты — регуляторы основных процессов гликогеногенеза, гликогенолиза [1, 2]. Уровень общей заболеваемости гликогенозами в зависимости от типа заболевания составляет 1 случай на 20 000–43 000 живых новорожденных детей [3, 4].
Следствием нарушений процессов синтеза или распада гликогена является его избыточное накопление в органах и тканях, преимущественно в печени и мышцах. В настоящее время выделяют 15 типов ГБ согласно хронологической последовательности открытия фенотипа, которые относят к печеночным, мышечным или смешанным формам [3, 5, 6].
К гликогенозам, протекающим с преимущественным поражением печени, относятся I, III, IV, VI и IX типы. Течение заболевания имеет свои особенности, обусловленные патогенетическими реакциями и наличием компенсаторных механизмов при каждом типе. Тяжелое течение I типа характеризуется выраженными и частыми эпизодами гипогликемии, что обусловлено блокировкой процессов гликогенолиза и глюконеогенеза, в то время как при III и VI–IX типах процессы глюконеогенеза не затронуты и позволяют поддерживать уровень глюкозы в пределах референсных значений значительно дольше. Каждый тип заболевания имеет свои подтипы, что также определяет полиморфность клинической картины.
Характерными симптомами заболевания являются выраженная задержка физического развития и отставание в росте у данной группы пациентов, проявления остеопении с раннего возраста, жалобы на выраженную слабость и плохую переносимость физической нагрузки, повышенную заболеваемость, сухость кожных покровов, частые носовые кровотечения, выраженную потливость, изменения характера стула. Объективно отмечается увеличение окружности живота за счет гепатомегалии, расширение венозной сети передней брюшной стенки (преимущественно у пациентов с I типом заболевания), капиллярит ладоней и стоп [7, 8].
ГБ является тяжелым заболеванием, в большинстве случаев приводящим к инвалидизации больных и требующим комплексного пожизненного лечения [9]. Патогенетическое лечение для печеночных форм ГБ в настоящее время не разработано. Основой лечения является диетотерапия, требующая раннего вмешательства, длительного контроля и внесения необходимых корректировок в процессе роста и развития пациента, страдающего данным наследственным заболеванием [10–12]. Диетотерапия у пациентов с ГБ позволяет минимизировать метаболические нарушения, связанные с течением болезни, а также снизить риск развития отсроченных осложнений [13, 14]. Важным методом коррекции на протяжении многих лет является проведение заместительной терапии кукурузным крахмалом [15]. Из рациона пациентов с ГБ исключают сахарозу, строго ограничивают потребление фруктозы и галактозы [16].
Диетотерапия у пациентов с болезнями накопления должна основываться на детальном изучении пищевого статуса и включать комплекс диагностических мероприятий: антропометрию, оценку фактического питания, исследование состава тела, измерение основного обмена методом непрямой калориметрии, непрерывное мониторирование уровня глюкозы, определение уровня макро- и микронутриентного состава сыворотки крови [17]. У детей с печеночными формами ГБ вследствие генетически обусловленных ферментативных нарушений и изменений метаболизма отмечается дефицит различных макро- и микронутриентов, в т. ч. витаминов [18]. На сегодняшний день в отечественной и зарубежной литературе представлены немногочисленные исследования, посвященные оценке витаминного статуса у детей с ГБ [19–21]. Изучение данного вопроса позволяет определить принципы и сформулировать рекомендации для оптимизации рационов питания детей с ГБ с целью обогащения по витаминному, макро- и микронутриентному составу, что улучшит качество жизни и прогноз заболевания.
Целью исследования являлась оценка витаминного статуса детей с печеночными формами ГБ.
Материал и методы
Исследование витаминного статуса проведено у 81 пациента, из них 55 мальчиков и 26 девочек. Количество детей с I типом ГБ составило 20 человек (24,7%), с III типом — 15 человек (18,5%), с VI–IX типами — 46 человек (56,8%). В связи с идентичными клиническими проявлениями VI и IX типов ГБ данные дети были объединены в одну группу. В группе пациентов с I типом заболевания мальчиков — 6, девочек — 14; в группе пациентов с III типом мальчиков — 7, девочек — 8; в группе с VI–IX типами ГБ — 42 мальчика и 4 девочки. Медиана возраста детей составила 5,0 [2,3; 8,5] лет. Медиана возраста при I типе заболевания — 6,0 [1,4; 8,2], при III типе — 3,0 [2,0; 6,3], при VI–IX типах — 5,0 [2,6; 11,0].
Концентрацию витамина Е (сумма содержания α- и γ-токоферолов) определяли с помощью высокоэффективной жидкостной хроматографии, содержание витамина С (сумму аскорбиновой и дегидроаскорбиновой кислот) в сыворотке крови — фотометрическим методом с использованием набора «Vitamin C» (Immundiagnostik AG, Германия). Концентрацию витамина В2 (рибофлавина) оценивали спектрофлуориметрически с использованием рибофлавинсвязывающего апобелка, содержание фолата в сыворотке крови — микробиологическим методом с использованием набора «ID–Vit Folic acid» (Immundiagnostik AG, Германия). Для определения концентрации витамина В12 и 25-гидроксивитамина D в сыворотке крови использовали иммуноферментный метод с помощью наборов «ID–Vit Vitamin В12» (Immundiagnostik AG, Германия) и «25-Hydroxy Vitamin D EIA» (Immunodiagnostic systems, Великобритания). Содержание 4-пиридоксиловой кислоты и 1-метилникотинамида в утренней порции мочи оценивали флуоресцентными методами.
Проверка выборок на соответствие закону нормального распределения проводилась с использованием критерия Шапиро — Уилка. Во всех случаях распределение отличалось от нормального, поэтому при описании данных использованы медиана и интерквартильный размах. При сравнении более двух групп применяли непараметрический метод дисперсионного анализа — критерий Краскела — Уоллиса, для апостериорных сравнений использовали критерий Данна. Корреляционный анализ проводили с использованием критерия Спирмена. Для решения поставленных задач в качестве программного обеспечения использовали программы Statistica v10.0, GraphPad Prizm v7.0. Оценивали двусторонний уровень значимости. Значения p<0,05 считались статистически значимыми, во всех случаях приводились абсолютные значения достигнутых уровней значимости.
Результаты исследования и их обсуждение
Полученные результаты (табл. 1, рис. 1) свидетельствуют об адекватном уровне витаминов С, В12 и фолиевой кислоты в общей группе пациентов с ГБ. Медиана концентрации витамина Е в плазме крови достигала верхней границы референсных значений. Показатели уровня токоферолов были достоверно выше в группе девочек (p=0,0439), превышение отмечалось в 59% случаев, максимальный уровень повышения — 3,6 мг/дл. Превышение границы нормы витамина Е (максимально до 2,7 мг/дл) в группе мальчиков выявлено у 35% больных. Снижение концентрации транспортной формы витамина D зарегистрировано в 78% случаев общей группы пациентов с ГБ, нормальные показатели отмечались у 9 (17,3%) мальчиков и 8 девочек (33%). Достоверных различий уровня витамина D в зависимости от пола отмечено не было. Снижение концентрации рибофлавина в сыворотке крови наблюдалось у 25% мальчиков и у 61,5% девочек, отмечалась тенденция к более выраженному снижению концентрации ниже пороговых значений у девочек, но достоверных различий в ходе анализа не получено (p=0,0550). Результаты оценки уровня рибофлавина в пробах мочи свидетельствовали о достоверно более выраженном снижении данного показателя в группе девочек с ГБ (p=0,0023). Снижение экскреции с мочой рибофлавина зарегистрировано у 20% мальчиков и 80% девочек. Снижение экскреции 4-пиридоксиловой кислоты зарегистрировано у 3/4 детей, достоверно более значимое снижение отмечено в группе девочек (p=0,0065). Следует отметить, что сниженная экскреция данного показателя может быть обусловлена как недостаточным содержанием витамина В6 в рационе, так и дефицитом витамина В2, коферментные формы которого участвуют в метаболизме пиридоксина. Снижение экскреции 1-метилникотинамида с мочой отмечено у 90% пациентов с ГБ, достоверных различий уровня снижения в зависимости от пола не выявлено. Вероятной причиной недостаточности никотиновой кислоты могут служить особенности питания пациентов с ГБ, диета которых является преимущественно высокоуглеводной, богатой зерновыми культурами, при сравнительно низком количестве белков животного происхождения.

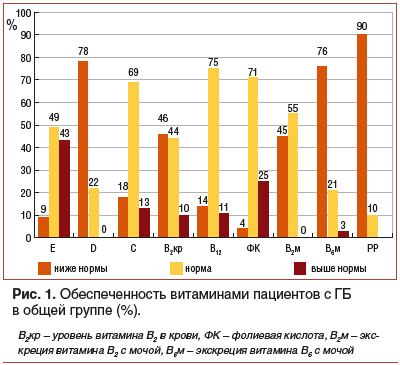
При оценке витаминного статуса пациентов с ГБ в зависимости от типа (рис. 2) наибольший процент случаев повышения уровня витамина Е (62%) и снижения концентрации витамина D (87%) зарегистрирован при III типе заболевания. У пациентов с I типом ГБ наиболее выражен дефицит витамина В2 (73%) в плазме крови и, как следствие, максимальный процент случаев недостаточности метаболитов В2 (75%) и В6 (87%) при экскреции с мочой. Снижение концентрации 1-метилникотинамида с мочой отмечалось в высоком проценте случаев при всех типах заболевания, что является возможным результатом высокого содержания углеводов и крахмала в рационе больных.
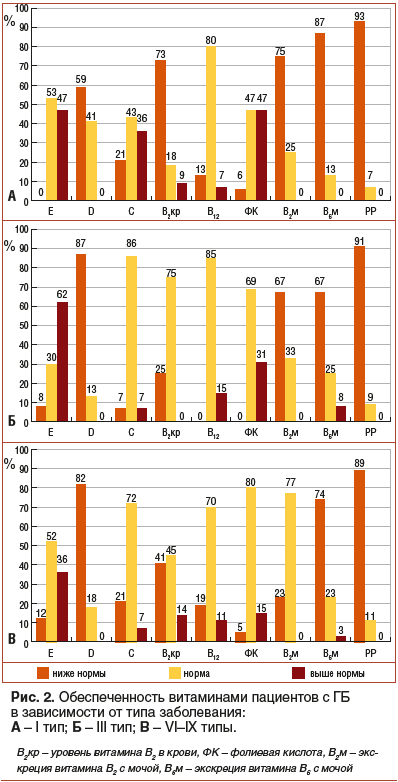
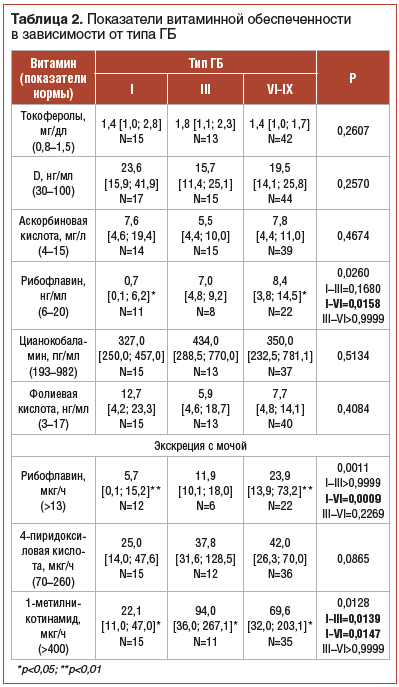
В процессе сравнительного анализа (табл. 2) концентрации витаминов в зависимости от типа ГБ выявлены достоверные различия уровня рибофлавина в плазме крови и моче, которые при попарном сравнении с учетом уровня значимости множественных сравнений отразили достоверно более низкие показатели витамина в группе с I типом ГБ по отношению к группе с VI–IX типами ГБ (p=0,0158, p=0,0009). Достоверно более низкий уровень 1-метилникотинамида отмечался при I типе ГБ в сравнении с III (p=0,0139) и VI–IX типами ГБ (p=0,0147). Данные показатели отражают наиболее слабую обеспеченность витаминами группы В у пациентов с I типом, который характеризуется наиболее тяжелыми клиническими проявлениями.
Анализ уровня витамина Е в зависимости от типа заболевания не выявил статистически значимых различий (p=0,2607). При всех типах было отмечено значительное повышение уровня витамина Е, которое коррелировало с высоким уровнем триглицеридов (ТГ) в плазме крови (r=0,2956, p=0,0207) (рис. 3). При выражении содержания токоферолов в расчете на ТГ недостаток витамина Е выявлялся в 2,1 раза чаще (в 18,9% случаев в общей группе пациентов), преимущественно у пациентов с ГБ I и III типов.

Анализ обеспеченности витамином D не выявил достоверных различий в группах сравнения, при всех типах отмечалось снижение концентрации показателя ниже пороговых значений, которое имело сезонный характер (рис. 4). Так, уровень витамина D достигал нормальных значений в летний период и имел выраженную тенденцию к снижению в осенне-зимний и весенний периоды.

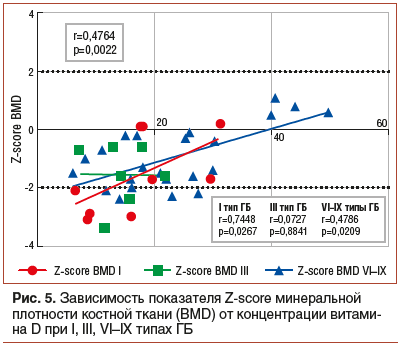
Крупномасштабные исследования, которые были проведены в популяционных выборках различных стран, указывают на статистически значимые корреляции между недостаточностью витамина D и снижением минеральной плотности костной ткани, что имеет большое значение для пациентов с печеночными формами ГБ. Мы провели анализ, направленный на выявление зависимости минеральной плотности костной ткани у пациентов с ГБ от уровня транспортной формы витамина D в плазме крови. Использовали критерий Z-score, отражающий величину стандартного отклонения показателей пациента от средневозрастной нормы. Отмечалось статистически значимое снижение минеральной плотности костной ткани при низких концентрациях витамина D в общей группе больных (r=0,4764, p=0,0022). Анализ в группах в зависимости от типа подтвердил наличие корреляции у пациентов с I (r=0,7448, p=0,0267) и VI–IX (r=0,4786, p=0,0209) типами ГБ (рис. 5).
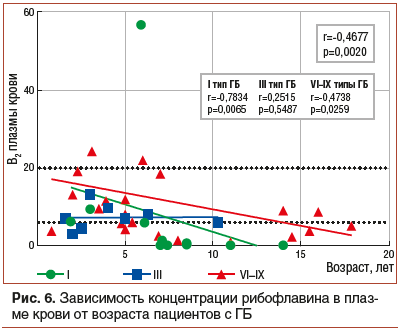
При анализе концентрации витаминов в зависимости от возрастного фактора наблюдается статистически значимая обратная связь уровня рибофлавина в плазме крови от возраста у детей с ГБ (r=-0,4677, p=0,0020). Отмечается достоверное снижение уровня рибофлавина с возрастом у пациентов с I (r=-0,7834, p=0,0065) и VI–IX (r=-0,4738, p=0,0259) типами заболевания (рис. 6). При анализе уровня рибофлавина в моче достоверное снижение концентрации витамина с возрастом было отмечено только при I типе ГБ (r=-0,7042, p=0,0135) (рис. 7).

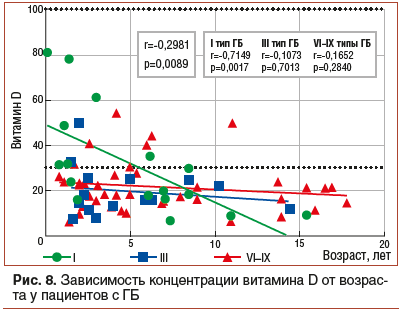
В ходе анализа уровня витамина D в зависимости от возраста отмечается достоверное снижение концентрации витамина с возрастом у пациентов с I (r=-0,7149, p=0,0017) типом заболевания (рис. 8).
Результаты анализа витаминного статуса у пациентов с печеночными формами ГБ свидетельствовали о наличии витаминной недостаточности у 94% пациентов. Сочетанный недостаток двух витаминов отмечался в 81% случаев, трех и более витаминов — в 56% случаев. Отмечался адекватный уровень обеспеченности витаминами С, В12 и фолиевой кислотой в общей группе пациентов и в зависимости от типа заболевания.
Повышение содержания витамина Е было отмечено в 43% случаев среди пациентов с ГБ, медиана концентрации достигала верхней границы референсных значений. Наибольший процент случаев повышения уровня витамина Е (62%) был зарегистрирован при III типе заболевания. Сравнительный анализ уровня повышения витамина не имел достоверных различий в зависимости от типа (p=0,2607). Данные изменения характерны при развитии гиперлипидемии, которая сопровождается повышением уровня липопротеидов, участвующих в транспорте токоферолов [22, 23]. Проведенный анализ отразил наличие прямой корреляции с высоким уровнем триглицеридов в плазме крови (r=0,2956, p=0,0207), в то время как при выражении содержания токоферолов в расчете на ТГ дефицит витамина Е выявлялся в 2,1 раза чаще, преимущественно у пациентов с ГБ I и III типов. Необходимо отметить значимую роль витамина Е в антиоксидантной системе. У пациентов с Ib типом ГБ в целом ряде исследований была продемонстрирована эффективность назначения витамина Е в терапевтических дозировках (600–900 мг/сут) с целью повышения уровня нейтрофилов, защиты нейтрофилов от апоптоза и улучшения их функции, снижения частоты рецидивирующих тяжелых инфекций и воспалительных изменений в кишечнике [19, 24]. Применение гранулоцитарного колониестимулирующего фактора у пациентов с ГБ Ib типа в случае выраженной нейтропении не препятствует индукции апоптоза в циркулирующих нейтрофилах и несет в себе риск возникновения целого ряда побочных эффектов. Введение витамина Е позволяет снизить частоту и дозировку гранулоцитарного колониестимулирующего фактора, улучшая качество жизни пациента. Важным моментом при назначении витамина Е является назначение природных форм. Синтетический витамин Е не является биохимическим эквивалентом натуральных форм, представляет собой смесь из 8 стереоизомеров, только один из которых приравнивается к D-альфа-токоферолу. Натуральный витамин Е эффективнее синтетического витамина Е, является основным безопасным антиоксидантом, который состоит из 8 различных компонентов. При этом прием только альфа-токоферола в дозировке 400 МЕ значительно снижает концентрацию в сыворотке крови γ- и δ-токоферола. Высокие показатели α-токоферола в крови могут говорить о недостатке других компонентов витамина, что, в свою очередь, может вызывать клинические проявления гиповитаминоза витамина Е. В связи с этим показано назначение натурального витамина Е, представленного в виде D-α-токоферола, а также смеси изомеров токоферола (D-β, D-δ, D-γ).
Снижение концентрации транспортной формы витамина D зарегистрировано в 78% случаев, наибольший процент случаев дефицита зафиксирован при III типе заболевания (87%). Уровень концентрации витамина D при сравнительном анализе в группах достоверно не отличался (p=0,2570). Снижение концентрации витамина отмечалось преимущественно в осенне-зимний и весенний периоды. Выявлена прямая корреляция, отражающая снижение минеральной плотности костной ткани при низких концентрациях витамина D в общей группе больных (r=0,4764, p=0,0022). В соответствии с рекомендациями Международного общества эндокринологов в качестве показателя обеспеченности витамином D был принят уровень циркулирующей формы витамина D (25(ОН)D) в сыворотке крови. Уровень <20 нг/мл (50 нмоль/л) соответствовал дефициту витамина, диапазон 21–29 нг/мл (50–75 нмоль/л) свидетельствовал о недостаточной обеспеченности организма этим витамином. При адекватной обеспеченности организма концентрация находилась в диапазоне 30–100 нг/мл (75–250 нмоль/л), при глубоком дефиците концентрация снижалась до уровня менее 10 нг/мл. Лишь у 2 пациентов младшего возраста концентрация витамина D достигла показателя 70 ммоль/л, в то время как снижение уровня менее 10 нг/мл было отмечено у 9 пациентов. Дефицит витамина D у пациентов с ГБ Ib типа преимущественно связан с ограничительным характером диеты, нарушением обмена веществ и синдромом мальабсорбции на фоне воспалительных изменений [21]. Недостаточность инсоляции, скудный рацион питания, недостаточность витаминов А, К2, нарушение процессов всасывания являются возможными причинами дефицита витамина D у пациентов с ГБ. Сам по себе витамин D не активен, реализация его биологических эффектов возможна лишь после метаболических преобразований в печени до 25-ОН-гидроксивитамина D (кальцидола) и в почках до 1,25-дигидроксивитамина D (кальцитриола), который является конечным и самым активным метаболитом витамина D, а по специфике своего действия приравнивается к гормонам, обладая паракринным, аутокринным и эндокринным действием. Таким образом, основные механизмы биотрансформации витамина D происходят в коже, печени и почках. Заболевания печени и почек могут служить эндогенными причинами дефицита витамина D.
Снижение концентрации рибофлавина в сыворотке крови (46%) и при экскреции с мочой (45%), метаболитов пиридоксина (у 76% пациентов) и ниацина (в 90% случаев) было характерно для всех исследуемых типов заболевания. Содержание рибофлавина в сыворотке крови (p=0,0158) и при экскреции с мочой (p=0,0009) было достоверно ниже при I типе ГБ в сравнении с VI–IX типами заболевания. Сравнительный анализ концентрации 4-пиридоксиловой кислоты при экскреции с мочой в зависимости от типа ГБ не выявил достоверных различий. Следует отметить, что сниженная экскреция данного показателя может быть обусловлена как недостаточным содержанием витамина В6 в рационе, так и функциональной недостаточностью, обусловленной дефицитом витамина В2, коферментные формы которого участвуют в метаболизме пиридоксина [25, 26]. Достоверно более низкие показатели 1-метилникотинамида регистрировались при I типе ГБ в сравнении с III (p=0,0139) и VI–IX типами ГБ (p=0,0147). Снижение уровня рибофлавина, пиридоксина, никотиновой кислоты в организме наблюдается при воспалительно-дистрофических заболеваниях тонкого кишечника (на относительно ранних стадиях развития энтерита, протекающего с синдромом мальабсорбции или при болезни Крона), что определяет необходимость своевременной диагностики содержания данных показателей у детей с ГБ, преимущественно I типа. Также гиповитаминоз никотиновой кислоты развивается в случаях диеты, включающей в себя преимущественно зерновые культуры, с высоким процентом углеводного компонента и относительно низким содержанием белков животного происхождения. При ГБ рекомендована высокоуглеводная диета с назначением кукурузного крахмала, на долю которого приходится до 30% суточной калорийности рациона больных. Витамин РР в кукурузе и кукурузном крахмале содержится в минимальном количестве и труднорастворимой форме, что повышает риск развития дефицита никотиновой кислоты у пациентов с ГБ. Применение никотиновой кислоты показано при заболеваниях печени, частых инфекционных заболеваниях и гиперлипидемии. Данные критерии отражают особую важность оценки количественного содержания витамина РР у пациентов с ГБ. Выявленные изменения показателей витаминного статуса являются основанием для оптимизации диетотерапии у больных с печеночными формами ГБ.
Заключение
Результаты исследования свидетельствуют о типовых и возрастных изменениях композиционного витаминного статуса у пациентов с печеночными формами ГБ. Дефицит витамина D (78%), снижение концентрации рибофлавина в сыворотке крови (46%) и при экскреции с мочой (45%), метаболитов пиридоксина (76%) и ниацина (90%) были характерны для всех исследуемых типов заболевания и являются основанием для проведения своевременной и адекватной коррекции. Повышение концентрации витамина Е (43%) является следствием гиперлипидемии. Истинную концентрацию токоферолов необходимо оценивать в расчете отношения содержания витамина Е к показателям уровня триглицеридов.
Диагностика витаминной обеспеченности в практике ведения пациентов с ГБ является обязательным компонентом комплексной оценки пищевого статуса и важным этапом лечебно-профилактических мероприятий, направленных на своевременную коррекцию выявленных изменений с целью предотвращения долгосрочных осложнений и улучшения качества жизни.











