–Я–Њ–≤—Л—И–µ–љ–Є–µ –њ—А–Є–≤–µ—А–ґ–µ–љ–љ–Њ—Б—В–Є –њ–∞—Ж–Є–µ–љ—В–∞ –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–є —В–µ—А–∞–њ–Є–Є —Б –њ—А–Є–≤–ї–µ—З–µ–љ–Є–µ–Љ –њ—Б–Є—Е–Њ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –Њ—З–µ–≤–Є–і–љ—Г—О –≤–∞–ґ–љ–Њ—Б—В—М, –љ–µ –Љ–Њ–ґ–µ—В –±—Л—В—М –Њ–њ—А–µ–і–µ–ї–µ–љ–Њ –Ї–∞–Ї –Ј–∞–≤–µ–і–Њ–Љ–Њ —Г—Б–њ–µ—И–љ–Њ–µ –Љ–µ—А–Њ–њ—А–Є—П—В–Є–µ. –Ю–њ—А–Њ—Б –≤—А–∞—З–µ–є –њ–Њ–Ї–∞–Ј—Л–≤–∞–µ—В, —З—В–Њ, –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —Б–Њ–±—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Њ–њ—Л—В–∞, –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –Є–Ј –љ–Є—Е —Б—З–Є—В–∞–µ—В –љ–∞–Є–±–Њ–ї–µ–µ –≤–∞–ґ–љ—Л–Љ –і–ї—П —Г—Б–њ–µ—И–љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П –Њ–њ—В–Є–Љ–Є–Ј–∞—Ж–Є—О —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Б—В—А–∞—В–µ–≥–Є–є —Б –њ—А–µ–і–њ–Њ—З—В–Є—В–µ–ї—М–љ—Л–Љ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є–љ—К–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е —Д–Њ—А–Љ. –Т —Н—В–Њ–Љ —Б–ї—Г—З–∞–µ —Б–Њ–±–ї—О–і–µ–љ–Є–µ –≤—А–∞—З–µ–±–љ—Л—Е –љ–∞–Ј–љ–∞—З–µ–љ–Є–є —Б—В–∞–љ–Њ–≤–Є—В—Б—П –ї–µ–≥–Ї–Њ–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л–Љ –Љ–µ—А–Њ–њ—А–Є—П—В–Є–µ–Љ. –Я–Њ–Љ–Є–Љ–Њ —Г–ї—Г—З—И–µ–љ–Є—П –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Ї–Њ–Љ–њ–ї–∞–є–µ–љ—Б–∞ —Н—В–Њ—В –њ—Г—В—М –Њ—В–ї–Є—З–∞–µ—В—Б—П —А—П–і–Њ–Љ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л—Е –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤, –≥–ї–∞–≤–љ—Л–Љ –Є–Ј –Ї–Њ—В–Њ—А—Л—Е —П–≤–ї—П–µ—В—Б—П —Б—В–∞–±–Є–ї—М–љ–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –Ї—А–Њ–≤–Є [24].
–Э–µ—Б–Љ–Њ—В—А—П –љ–∞ –љ–∞–ї–Є—З–Є–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –і–µ—Б—П—В–Ї–Њ–≤ –Р–Я-–њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Њ–±–Њ–Є—Е –≥—А—Г–њ–њ (—В–Є–њ–Є—З–љ—Л–µ –Є –∞—В–Є–њ–Є—З–љ—Л–µ), –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –Љ–µ–љ—М—И–µ. –Ґ–∞–Ї–Є–µ –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї–Є —Н—В–Њ–є –≥—А—Г–њ–њ—Л, –Ї–∞–Ї —Д–ї—Г—Д–µ–љ–∞–Ј–Є–љ (–≤ –≤–Є–і–µ —Д–ї—Г—Д–µ–љ–∞–Ј–Є–љ-—Н–љ–∞–љ—В–∞—В–∞ –Є —Д–ї—Г—Д–µ–љ–∞–Ј–Є–љ- –і–µ–Ї–∞–љ–Њ–∞—В–∞) –Є –≥–∞–ї–Њ–њ–µ—А–Є–і–Њ–ї (–≤ —Д–Њ—А–Љ–µ –≥–∞–ї–Њ–њ–µ—А–Є–і–Њ–ї-–і–µ–Ї–∞–љ–Њ–∞—В–∞1) —И–Є—А–Њ–Ї–Њ –њ—А–Є–Љ–µ–љ—П—О—В—Б—П –і–Њ –љ–∞—Б—В–Њ—П—Й–µ–≥–Њ –≤—А–µ–Љ–µ–љ–Є. –≠—В–Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ —Б—А–µ–і—Б—В–≤–∞ –љ–∞—Е–Њ–і—П—В—Б—П –≤ –∞—Б—Б–Њ—А—В–Є–Љ–µ–љ—В–µ –њ—Б–Є—Е–Є–∞—В—А–Њ–≤ –≤ —В–µ—З–µ–љ–Є–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –і–µ—Б—П—В–Ї–Њ–≤ –ї–µ—В.
–°–∞–Љ–∞ –Є—Б—В–Њ—А–Є—П –і–µ–њ–Њ–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е –Р–Я-–њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–∞—З–∞–ї–∞—Б—М –≤—Б–Ї–Њ—А–µ –њ–Њ—Б–ї–µ –њ–Њ—П–≤–ї–µ–љ–Є—П –њ–µ—А–≤—Л—Е –љ–µ–є—А–Њ–ї–µ–њ—В–Є–Ї–Њ–≤. –Т 1950-—Е –≥–≥. –њ—А–Њ–≤–Њ–і–Є–ї–Є—Б—М —А–∞–±–Њ—В—Л –њ–Њ —Б–Є–љ—В–µ–Ј—Г –і–ї–Є—В–µ–ї—М–љ–Њ –і–µ–є—Б—В–≤—Г—О—Й–Є—Е –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –Ј–∞–≤–µ—А—И–Є–ї–Є—Б—М –њ–Њ—П–≤–ї–µ–љ–Є–µ–Љ –њ—А–Њ–њ–Є–Њ–љ–∞—В–Њ–≤ – —Б–Њ–µ–і–Є–љ–µ–љ–Є–є, –њ—А–µ–і—Б—В–∞–≤–ї—П–≤—И–Є—Е —Б–Њ–±–Њ–є —Б–ї–Њ–ґ–љ—Л–є —Н—Д–Є—А –њ—А–Њ–њ–Є–Њ–љ–Њ–≤–Њ–є (–њ—А–Њ–њ–∞–љ–Њ–≤–Њ–є) –Ї–Є—Б–ї–Њ—В—Л. –Я—А–Є –≤–≤–µ–і–µ–љ–Є–Є –≤ –Љ—Л—И–µ—З–љ—Г—О —В–Ї–∞–љ—М —В–∞–Ї–Њ–µ —Б–Њ–µ–і–Є–љ–µ–љ–Є–µ –≤—Б–∞—Б—Л–≤–∞–ї–Њ—Б—М –≤ —В–µ—З–µ–љ–Є–µ –±–Њ–ї–µ–µ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–Є, —З–µ–Љ –љ–µ—Н—Б—В–µ—А–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ—Л–є –≥–Њ—А–Љ–Њ–љ, —З—В–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Б–љ–Є–ґ–∞–ї–Њ —З–∞—Б—В–Њ—В—Г —В—А–µ–±—Г–µ–Љ—Л—Е –Є–љ—К–µ–Ї—Ж–Є–є (–і–Њ 1–2 —А–∞–Ј –≤ –љ–µ–і–µ–ї—О).
–Ш–љ–Є—Ж–Є–∞—В–Њ—А–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –∞–љ–∞–ї–Њ–≥–Є—З–љ–Њ–≥–Њ –њ–Њ–і—Е–Њ–і–∞ –Ї –љ–Њ–≤–Њ–Љ—Г —В–Њ–≥–і–∞ –љ–µ–є—А–Њ–ї–µ–њ—В–Є–Ї—Г —Д–ї—Г—Д–µ–љ–∞–Ј–Є–љ—Г –±—Л–ї –∞–љ–≥–ї–Є–є—Б–Ї–Є–є —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥ –Ф–ґ–µ—А–∞–ї—М–і –Ф–∞–љ–Є–µ–ї. –Ш—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–Є —Н—В–µ—А–Є—Д–Є—Ж–Є—А–Њ–≤–∞–ї–Є –≥–Є–і—А–Њ–Ї—Б–Є–ї—М–љ—Г—О –≥—А—Г–њ–њ—Г (––Ю–Э) –њ—А–µ–њ–∞—А–∞—В–∞, –њ—А–Є—Б–Њ–µ–і–Є–љ–Є–≤ —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ –Ї —Н—Д–Є—А–љ–Њ–є —Б–≤—П–Ј–Є –Ї–∞—А–±–Њ–љ–Њ–≤—Г—О –≥–µ–њ—В–∞–љ–Њ–≤—Г—О (—Н–љ–∞–љ—В–∞–љ–Њ–≤—Г—О) –Ї–Є—Б–ї–Њ—В—Г, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –Ј–∞–Љ–µ–і–ї–Є—В—М –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–µ –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞ –Є–Ј —Б—Д–Њ—А–Љ–Є—А–Њ–≤–∞–≤—И–µ–≥–Њ—Б—П –≤ –Љ–µ—Б—В–µ –Є–љ—К–µ–Ї—Ж–Є–Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–≥–Њ –і–µ–њ–Њ –≤ –Ї—А–Њ–≤–Њ—В–Њ–Ї. –Т 1967 –≥. —Д–ї—Г—Д–µ–љ–∞–Ј–Є–љ-—Н–љ–∞–љ—В–∞—В —Б—В–∞–ї –і–Њ—Б—В—Г–њ–µ–љ –і–ї—П —И–Є—А–Њ–Ї–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П, —Б—В–∞–≤ –њ–µ—А–≤—Л–Љ –Р–Я –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–Љ —Б—А–µ–і—Б—В–≤–Њ–Љ –Ј–∞–Љ–µ–і–ї–µ–љ–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П. –Я—А–µ–њ–∞—А–∞—В –±—Л–ї –њ—А–µ–і–љ–∞–Ј–љ–∞—З–µ–љ –і–ї—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –≤ –≤–Є–і–µ –≤–љ—Г—В—А–Є–Љ—Л—И–µ—З–љ—Л—Е –Є–љ—К–µ–Ї—Ж–Є–є, –Ї–Њ—В–Њ—А—Л–µ —В—А–µ–±–Њ–≤–∞–ї–Њ—Б—М –њ—А–Њ–≤–Њ–і–Є—В—М 1 —А–∞–Ј –≤ 2–3 –љ–µ–і. –≠—В–Њ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ –Ј–∞–Љ–µ–љ–Є—В—М —А–µ–≥—Г–ї—П—А–љ—Л–є –њ—А–Є–µ–Љ —В–∞–±–ї–µ—В–Є—А–Њ–≤–∞–љ–љ—Л—Е —Д–Њ—А–Љ –љ–µ–є—А–Њ–ї–µ–њ—В–Є–Ї–Њ–≤.
–Ъ–∞–Ї –њ–Є—И–µ—В D. Johnson (2009), –љ–Њ–≤–∞—П –Ї–Њ–љ—Ж–µ–њ—Ж–Є—П –Є–љ—К–µ–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П –њ–µ—А–≤–Њ–љ–∞—З–∞–ї—М–љ–Њ –љ–µ –±—Л–ї–∞ –њ—А–Є–љ—П—В–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ–Є –њ—Б–Є—Е–Є–∞—В—А–∞–Љ–Є, –∞–≤—В–Њ—А–Є—В–µ—В–љ—Л–Љ–Є —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В–∞–Љ–Є. –У–ї–∞–≤–љ—Л–Љ –≤ —Н—В–Є—Е –Њ–њ–∞—Б–µ–љ–Є—П—Е –±—Л–ї–Њ –љ–µ–і–Њ–≤–µ—А–Є–µ –Ї –љ–Њ–≤–Њ–є –Њ—А–≥–∞–љ–Є–Ј–∞—Ж–Є–Є –ї–µ—З–µ–±–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞. –Т –њ–µ—З–∞—В–љ—Л—Е —А–∞–±–Њ—В–∞—Е —В–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –≤—Л—Б–Ї–∞–Ј—Л–≤–∞–ї–Є—Б—М —Б–Њ–Љ–љ–µ–љ–Є—П –≤ —В–Њ–Љ, —З—В–Њ –Њ–і–љ–∞ –Є–љ—К–µ–Ї—Ж–Є—П –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –љ–µ–і–µ–ї—М –і–µ–є—Б—В–≤–Є—В–µ–ї—М–љ–Њ —Б–њ–Њ—Б–Њ–±–љ–∞ –Њ–±–µ—Б–њ–µ—З–Є—В—М —Б—В–∞–±–Є–ї—М–љ–Њ–µ –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–µ –і–µ–є—Б—В–≤—Г—О—Й–µ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞. –Т –њ–µ—А–≤–Њ–љ–∞—З–∞–ї—М–љ—Л—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е –њ—А–µ–і–ї–∞–≥–∞–ї–Њ—Б—М —Б –љ–∞—З–∞–ї–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –Р–Я –љ–µ –њ—А–µ–Ї—А–∞—Й–∞—В—М –њ—А–Є–µ–Љ —В–∞–±–ї–µ—В–Є—А–Њ–≤–∞–љ–љ–Њ–є —Д–Њ—А–Љ—Л, –Њ—Б—В–∞–≤–Є–≤ –µ–µ «–і–ї—П –њ–Њ–і—Б—В—А–∞—Е–Њ–≤–Ї–Є». –Ф—А—Г–≥–Є–Љ –∞—А–≥—Г–Љ–µ–љ—В–Њ–Љ –±—Л–ї–Є –Њ–њ–∞—Б–µ–љ–Є—П –њ–Њ –њ–Њ–≤–Њ–і—Г –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ–Љ–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞–љ–Є—П —З–∞—Б—В–Њ—В—Л –Є –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤. –≠—В–Є –љ–∞—Б—В—А–Њ–µ–љ–Є—П —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В–Њ–≤ –±—Л–ї–Є –њ–Њ–і–і–µ—А–ґ–∞–љ—Л –њ–Њ—В—А–µ–±–Є—В–µ–ї—П–Љ–Є –њ—Б–Є—Е–Є–∞—В—А–Є—З–µ—Б–Ї–Є—Е —Б–ї—Г–ґ–±, –Ї –Ї–Њ—В–Њ—А—Л–Љ –±—Л–ї–∞ –Њ–±—А–∞—Й–µ–љ–∞ –∞–љ—В–Є–њ—Б–Є—Е–Є–∞—В—А–Є—З–µ—Б–Ї–∞—П —А–Є—В–Њ—А–Є–Ї–∞ —В–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–Є, –Њ–њ–µ—А–Є—А–Њ–≤–∞–≤—И–∞—П –≤–њ–µ—З–∞—В–ї—П—О—Й–Є–Љ–Є —Н–њ–Є—В–µ—В–∞–Љ–Є («–ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ –Ї–∞–љ–і–∞–ї—Л», «—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–µ –Њ–≥–ї—Г—И–µ–љ–Є–µ»). –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ, –≤–љ–Є–Љ–∞–љ–Є–µ –Ї–ї–Є–љ–Є—Ж–Є—Б—В–Њ–≤ –Ї –њ—А–Њ–±–ї–µ–Љ–µ –љ–µ—Б–Њ–±–ї—О–і–µ–љ–Є—П —А–µ–≥—Г–ї—П—А–љ—Л—Е –≤—А–∞—З–µ–±–љ—Л—Е –њ—А–µ–і–њ–Є—Б–∞–љ–Є–є, –Њ—Б–Њ–±–µ–љ–љ–Њ –њ—А–Є –і–ї–Є—В–µ–ї—М–љ—Л—Е –Ї—Г—А—Б–∞—Е, –∞ —В–∞–Ї–ґ–µ –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Њ–±—К–µ–Љ–∞ –љ–∞—Г—З–љ–Њ–є –Є–љ—Д–Њ—А–Љ–∞—Ж–Є–Є –Њ –љ–Њ–≤—Л—Е –њ—А–µ–њ–∞—А–∞—В–∞—Е –њ—А–Є–≤–µ–ї–Є –Ї —В–Њ–Љ—Г, —З—В–Њ —Г–і–µ–ї—М–љ—Л–є –≤–µ—Б –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є–љ—К–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –Р–Я —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤–Њ–Ј—А–Њ—Б. –Т —Б–µ—А–Є–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –±—Л–ї–∞ –њ–Њ–Ї–∞–Ј–∞–љ–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є–љ—К–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –Р–Я –њ—А–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Є –њ—А–Є—Б—В—Г–њ–Њ–Њ–±—А–∞–Ј–љ–Њ–є —И–Є–Ј–Њ—Д—А–µ–љ–Є–Є [10, 14, 27–29]. –Ф–µ–њ–Њ–љ–Є—А–Њ–≤–∞–љ–љ—Л–µ —Д–Њ—А–Љ—Л –Њ–Ї–∞–Ј–∞–ї–Є—Б—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–µ–µ —В–∞–±–ї–µ—В–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ—А–Є –і–ї–Є—В–µ–ї—М–љ—Л—Е –Ї—Г—А—Б–∞—Е —В–µ—А–∞–њ–Є–Є (–±–Њ–ї–µ–µ 1 –≥–Њ–і–∞) [11]. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ, –Ї 1990-–Љ –≥–≥. —З–∞—Б—В–Њ—В–∞ –Є—Е –љ–∞–Ј–љ–∞—З–µ–љ–Є–є –і–ї—П –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–µ–є —В–µ—А–∞–њ–Є–Є —Г –≤–љ–µ–±–Њ–ї—М–љ–Є—З–љ–Њ–≥–Њ –Ї–Њ–љ—В–Є–љ–≥–µ–љ—В–∞ —Б–Њ—Б—В–∞–≤–ї—П–ї–∞ –Њ—В 20% –≤ –°–®–Р –і–Њ 80% – –≤ –Т–µ–ї–Є–Ї–Њ–±—А–Є—В–∞–љ–Є–Є [15, 17]. –Я—А–∞–Ї—В–Є—З–µ—Б–Ї–Є–µ –≤—А–∞—З–Є —В–∞–Ї–ґ–µ –Њ—Ж–µ–љ–Є–ї–Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М —Г–ї—Г—З—И–µ–љ–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П –Ј–∞ –≤–≤–µ–і–µ–љ–Є–µ–Љ –њ—А–µ–њ–∞—А–∞—В–∞, —З—В–Њ —П–≤–ї—П–µ—В—Б—П –Њ—Б–Њ–±–µ–љ–љ–Њ –∞–Ї—В—Г–∞–ї—М–љ—Л–Љ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —В–µ–љ–і–µ–љ—Ж–Є–µ–є –Ї –љ–µ—Б–Њ–±–ї—О–і–µ–љ–Є—О –љ–∞–Ј–љ–∞—З–µ–љ–љ–Њ–є –Р–Я-—В–µ—А–∞–њ–Є–Є.
–Т–њ–Њ—Б–ї–µ–і—Б—В–≤–Є–Є –±—Л–ї–Њ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ, —З—В–Њ —Г–і–ї–Є–љ–µ–љ–Є–µ –Ї–∞—А–±–Њ–љ–Њ–≤–Њ–є —Ж–µ–њ–Є (—Б 7 –і–Њ 10 –Є –±–Њ–ї–µ–µ –∞—В–Њ–Љ–Њ–≤ —Г–≥–ї–µ—А–Њ–і–∞) –µ—Й–µ –±–Њ–ї–µ–µ –Ј–∞–Љ–µ–і–ї—П–µ—В –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –Ї—А–Њ–≤—М. –Т—В–Њ—А–Њ–є –њ—А–µ–њ–∞—А–∞—В –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П – –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ—Л–є —Н—Д–Є—А —Д–ї—Г—Д–µ–љ–∞–Ј–Є–љ–∞ –Є –і–µ–Ї–∞–љ–Њ–≤–Њ–є (–Ї–∞–њ—А–Є–љ–Њ–≤–Њ–є) –Ї–Є—Б–ї–Њ—В—Л (—Д–ї—Г—Д–µ–љ–∞–Ј–Є–љ-–і–µ–Ї–∞–љ–Њ–∞—В) – –±—Л–ї –≤—Л–≤–µ–і–µ–љ –љ–∞ —А—Л–љ–Њ–Ї —З–µ—А–µ–Ј –њ–Њ–ї—В–Њ—А–∞ –≥–Њ–і–∞ –њ–Њ—Б–ї–µ –њ–µ—А–≤–Њ–≥–Њ. –†–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–љ—Л–є –і–ї—П –љ–µ–≥–Њ –Є–љ—В–µ—А–≤–∞–ї –Љ–µ–ґ–і—Г –Є–љ—К–µ–Ї—Ж–Є—П–Љ–Є –±—Л–ї –і–Њ–≤–µ–і–µ–љ –і–Њ 3–4 –љ–µ–і. –Ш—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—П–Љ–Є –њ–Њ–і —А—Г–Ї–Њ–≤–Њ–і—Б—В–≤–Њ–Љ P. Janssena –±—Л–ї–∞ —А–∞–Ј—А–∞–±–Њ—В–∞–љ–∞ –Є –љ–∞—И–ї–∞ —И–Є—А–Њ–Ї–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –і–µ–њ–Њ–љ–Є—А–Њ–≤–∞–љ–љ–∞—П —Д–Њ—А–Љ–∞ —Н—В–∞–ї–Њ–љ–љ–Њ–≥–Њ –љ–µ–є—А–Њ–ї–µ–њ—В–Є–Ї–∞ – –≥–∞–ї–Њ–њ–µ—А–Є–і–Њ–ї–∞ (–≥–∞–ї–Њ–њ–µ—А–Є–і–Њ–ї-–і–µ–Ї–∞–љ–Њ–∞—В). –Ґ–∞–Ї–ґ–µ –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л –Є –і–µ–њ–Њ–љ–Є—А–Њ–≤–∞–љ–љ—Л–µ —Д–Њ—А–Љ—Л —А–∞–Ј–ї–Є—З–љ—Л—Е –≥—А—Г–њ–њ –Р–Я-–њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ–µ—А–≤–Њ–≥–Њ –њ–Њ–Ї–Њ–ї–µ–љ–Є—П (—Д–ї—Г–њ–µ–љ—В–Є–Ї—Б–Њ–ї-–і–µ–Ї–∞–љ–Њ–∞—В, –Ј—Г–Ї–ї–Њ–њ–µ–љ—В–Є–Ї—Б–Њ–ї-–і–µ–Ї–∞–љ–Њ–∞—В, –±—А–Њ–Љ–њ–µ—А–Є–і–Њ–ї-–і–µ–Ї–∞–љ–Њ–∞—В, –њ–Є–њ–Њ—В–Є–∞–Ј–Є–љ-–њ–∞–ї—М–Љ–Є—В–∞—В –Є –і—А.).
–Ґ–∞–Ї–Є–µ —Н—В–µ—А–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ—Л–µ –Р–Я-—Б—А–µ–і—Б—В–≤–∞ (–љ–∞–њ—А., –≤ –≤–Є–і–µ –і–µ–Ї–∞–љ–Њ–∞—В–Њ–≤) —А–∞—Б—В–≤–Њ—А—П—О—В—Б—П –≤ –Љ–∞—Б–ї—П–љ–Њ–Љ –љ–∞–њ–Њ–ї–љ–Є—В–µ–ї–µ. –Т—Л–±–Њ—А –њ–Њ—Б–ї–µ–і–љ–µ–≥–Њ –Њ–њ—А–µ–і–µ–ї—П–µ—В –Ї–Њ—Н—Д—Д–Є—Ж–Є–µ–љ—В —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є—П –≤–Њ–і–љ–Њ–є –Є –Љ–∞—Б–ї—П–љ–Њ–є —Б–Њ—Б—В–∞–≤–ї—П—О—Й–Є—Е, —З—В–Њ –≤–ї–Є—П–µ—В –љ–∞ —Б–Ї–Њ—А–Њ—Б—В—М –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –Є–Ј –ґ–Є—А–Њ–≤–Њ–є —В–Ї–∞–љ–Є –≤ –Њ–±—Й–Є–є –Ї—А–Њ–≤–Њ—В–Њ–Ї. –І–∞—Й–µ –њ—А–Њ–Є–Ј–≤–Њ–і–Є—В–µ–ї—П–Љ–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Њ—Б—М —А–∞—Б—В–Є—В–µ–ї—М–љ–Њ–µ (–Ї—Г–љ–ґ—Г—В–љ–Њ–µ) –Љ–∞—Б–ї–Њ, —А–µ–ґ–µ – —Б–Њ–Ј–і–∞–≤–∞–ї—Б—П –Њ—Б–Њ–±—Л–є, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –њ–∞—В–µ–љ—В–Њ–≤–∞–љ–љ—Л–є, –љ–∞–њ–Њ–ї–љ–Є—В–µ–ї—М (—Б–Љ–µ—Б—М —В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–Њ–≤ –і–ї—П –Ј—Г–Ї–ї–Њ–њ–µ–љ—В–Є–Ї—Б–Њ–ї–∞ –Є —Д–ї—Г–њ–µ–љ—В–Є–Ї—Б–Њ–ї–∞) —Б –њ–Њ–і—Е–Њ–і—П—Й–Є–Љ–Є –Ї –Ї–Њ–љ–Ї—А–µ—В–љ–Њ–Љ—Г –њ—А–µ–њ–∞—А–∞—В—Г –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ–Є —Б–Ї–Њ—А–Њ—Б—В–Є —А–∞—Б—В–≤–Њ—А–µ–љ–Є—П –Є —А–∞—Б–њ–∞–і–∞.
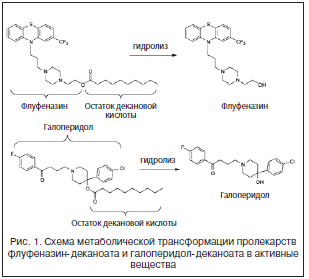
–Я–Њ—Б–ї–µ –Є–љ—К–µ–Ї—Ж–Є–Є –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ—Л–є —Н—Д–Є—А –і–Є—Д—Д—Г–љ–і–Є—А—Г–µ—В –Є–Ј –Љ–∞—Б–ї—П–љ–Њ–≥–Њ —А–∞—Б—В–≤–Њ—А–∞ –Є –≥–Є–і—А–Њ–ї–Є–Ј—Г–µ—В—Б—П –Љ—Л—И–µ—З–љ—Л–Љ–Є —Н—Б—В–µ—А–∞–Ј–∞–Љ–Є, –≤—Л—Б–≤–Њ–±–Њ–ґ–і–∞—П –і–µ–є—Б—В–≤—Г—О—Й–µ–µ –≤–µ—Й–µ—Б—В–≤–Њ (—А–Є—Б. 1). –°–Ї–Њ—А–Њ—Б—В—М —Н—В–Њ–є –і–Є—Д—Д—Г–Ј–Є–Є —П–≤–ї—П–µ—В—Б—П –Њ—Б–љ–Њ–≤–љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ, –Њ–њ—А–µ–і–µ–ї—П—О—Й–Є–Љ –Є–љ—В–µ—А–≤–∞–ї –Љ–µ–ґ–і—Г –Є–љ—К–µ–Ї—Ж–Є—П–Љ–Є –Є –і–Њ–Ј—Г –њ—А–µ–њ–∞—А–∞—В–∞.
–Э–∞–Ј–љ–∞—З–µ–љ–Є–µ –і–µ–њ–Њ–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е —Д–Њ—А–Љ –Р–Я-–њ—А–µ–њ–∞—А–∞—В–Њ–≤ –і–Њ–ї–ґ–љ–Њ —Г—З–Є—В—Л–≤–∞—В—М —А–∞—Б—Б–Љ–Њ—В—А–µ–љ–љ—Л–µ —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є. –Ш–љ—К–µ–Ї—Ж–Є–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ—А–Њ–≤–Њ–і–Є—В—М –≥–ї—Г–±–Њ–Ї–Њ –≤–љ—Г—В—А—М —П–≥–Њ–і–Є—З–љ–Њ–є –Љ—Л—И—Ж—Л, –Є–Ј–±–µ–≥–∞—П –њ–Њ–њ–∞–і–∞–љ–Є—П –≤ —Б–µ–і–∞–ї–Є—Й–љ—Л–є –љ–µ—А–≤. –Т –Ї–∞—З–µ—Б—В–≤–µ –∞–ї—М—В–µ—А–љ–∞—В–Є–≤—Л m. gluteus —З–∞—Б—В–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–∞ –Є–љ—К–µ–Ї—Ж–Є—П –њ—А–µ–њ–∞—А–∞—В–Њ–≤-–і–µ–њ–Њ –≤–љ—Г—В—А—М m. deltoideus. –Я–µ—А–≤–∞—П –Є–љ—К–µ–Ї—Ж–Є—П –њ—А–µ–њ–∞—А–∞—В–∞, –≤ —Б–ї—Г—З–∞–µ, –µ—Б–ї–Є –њ–∞—Ж–Є–µ–љ—В –µ–≥–Њ —А–∞–љ–µ–µ –љ–µ –њ–Њ–ї—Г—З–∞–ї, –і–Њ–ї–ґ–љ–∞ –њ—А–Њ–≤–Њ–і–Є—В—М—Б—П –≤ –Љ–Є–љ–Є–Љ–∞–ї—М–љ–Њ–є –і–Њ–Ј–µ —Б –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М—О –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–≥–Њ –µ–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П.
–Ф–ї—П –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —А–∞–≤–љ–Њ–≤–µ—Б–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ—А–Є–Љ–µ—А–љ–Њ 2–3 –Љ–µ—Б. –° —Н—В–Њ–є —Ж–µ–ї—М—О —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –≤ –љ–∞—З–∞–ї—М–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ —В–µ—А–∞–њ–Є–Є –њ—А–Њ–ї–Њ–љ–≥–Њ–Љ (–Њ—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –љ–µ–і–µ–ї—М –і–Њ 1–2 –Љ–µ—Б.) –і–µ–ї–Є—В—М –і–Њ–Ј—Г –Љ–µ–ґ–і—Г –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–є –Є –і–µ–њ–Њ–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є –Є–љ—К–µ–Ї—Ж–Є–Њ–љ–љ–Њ–є —Д–Њ—А–Љ–∞–Љ–Є.
–У–ї–∞–≤–љ—Л–Љ–Є –њ—А–Њ–±–ї–µ–Љ–∞–Љ–Є, —Б–≤—П–Ј–∞–љ–љ—Л–Љ–Є —Б –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ—Л–Љ–Є –Р–Я-–њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –њ–µ—А–≤–Њ–≥–Њ –њ–Њ–Ї–Њ–ї–µ–љ–Є—П, –±—Л–ї–Є —Н–Ї—Б—В—А–∞–њ–Є—А–∞–Љ–Є–і–љ—Л–µ —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞, –∞ —В–∞–Ї–ґ–µ –±–Њ–ї–µ–Ј–љ–µ–љ–љ–Њ—Б—В—М –Є –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –≤ –Љ–µ—Б—В–µ –Є–љ—К–µ–Ї—Ж–Є–Є. –°—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–µ —В—А—Г–і–љ–Њ—Б—В–Є –≤–Њ–Ј–љ–Є–Ї–∞–ї–Є –Є –Є–Ј-–Ј–∞ —В–Њ–≥–Њ, —З—В–Њ –њ–Њ –і–Њ—Б—В–Є–ґ–µ–љ–Є–Є —Б—В–∞–±–Є–ї—М–љ–Њ–≥–Њ —А–∞–≤–љ–Њ–≤–µ—Б–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ —В–∞–Ї–ґ–µ –љ–∞ –і–Њ–ї–≥–Њ–µ –≤—А–µ–Љ—П —Б—В–∞–±–Є–ї–Є–Ј–Є—А–Њ–≤–∞–ї–Є—Б—М –≤—Л–Ј–≤–∞–љ–љ—Л–µ –Є–Љ –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л; –Є—Е —А–∞–Ј—А–µ—И–µ–љ–Є–µ –њ–Њ—Б–ї–µ —Г–Љ–µ–љ—М—И–µ–љ–Є—П –і–Њ–Ј—Л –Є–ї–Є –Њ—В–Љ–µ–љ—Л –њ—А–µ–њ–∞—А–∞—В–∞ —В—А–µ–±–Њ–≤–∞–ї–Њ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –Є–Ј-–Ј–∞ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ–µ—А–Є–Њ–і–∞ –µ–≥–Њ —Н–ї–Є–Љ–Є–љ–∞—Ж–Є–Є.
–Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —Г–Ї–∞–Ј–∞–љ–љ—Л–µ –љ–µ–і–Њ—Б—В–∞—В–Ї–Є, –і–µ–њ–Њ–љ–Є—А–Њ–≤–∞–љ–љ—Л–µ –Р–Я –љ–∞–Ј–љ–∞—З–∞–ї–Є—Б—М –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —И–Є—А–Њ–Ї–Њ. –Я—А–Є–Љ–µ—А–љ–Њ 30–45% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–∞ –њ–Њ—Б—В—Б—В–∞—Ж–Є–Њ–љ–∞—А–љ–Њ–Љ —Н—В–∞–њ–µ –ї–µ—З–µ–љ–Є—П –њ–Њ–ї—Г—З–∞–ї–Є —В–µ—А–∞–њ–Є—О –Є–љ—К–µ–Ї—Ж–Є—П–Љ–Є –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–∞-–њ—А–Њ–ї–Њ–љ–≥–∞. –Я–Њ –Љ–µ—А–µ –Ј–∞–Љ–µ—Й–µ–љ–Є—П –Њ—А–∞–ї—М–љ—Л—Е –Р–Я-–љ–µ–є—А–Њ–ї–µ–њ—В–Є–Ї–Њ–≤ –∞—В–Є–њ–Є—З–љ—Л–Љ–Є –Р–Я-–њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є, –Њ–±–ї–∞–і–∞–≤—И–Є–Љ–Є —А—П–і–Њ–Љ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤, –і–∞–љ–љ—Л–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М —Б–љ–Є–Ј–Є–ї—Б—П –і–Њ 20–25% –Є –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ —Б–Њ—Е—А–∞–љ—П–ї—Б—П –љ–∞ —Н—В–Њ–Љ —Г—А–Њ–≤–љ–µ [24].
–Я—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –і–∞–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —В–∞–Ї–ґ–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Г—З–Є—В—Л–≤–∞—В—М, —З—В–Њ –љ–µ–Ї–Њ—В–Њ—А—Л–µ –њ–∞—Ж–Є–µ–љ—В—Л –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ –Њ—В–љ–Њ—Б—П—В—Б—П –Ї –Є–љ—К–µ–Ї—Ж–Є—П–Љ –њ—А–Њ–ї–Њ–љ–≥–Њ–≤ –Є –љ–µ —Б—А–∞–Ј—Г –і–∞—О—В —Б–Њ–≥–ї–∞—Б–Є–µ –љ–∞ —В–∞–Ї–Њ–є –Љ–µ—В–Њ–і –ї–µ—З–µ–љ–Є—П [1]. –Т —А–∞—Б–њ–Њ—А—П–ґ–µ–љ–Є–Є –≤—А–∞—З–∞ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –љ–µ–Љ–љ–Њ–≥–Њ –Є–љ—Д–Њ—А–Љ–∞—Ж–Є–Є –Њ —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ—Л—Е —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞—Е –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ—Л—Е —Д–Њ—А–Љ —А–∞–Ј–ї–Є—З–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Б —Г—З–µ—В–Њ–Љ –Є—Е —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є.
–Э–Є–ґ–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –Ї—А–∞—В–Ї–Є–µ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –љ–µ–Ї–Њ—В–Њ—А—Л—Е –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ—Л—Е –Р–Я-–њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ–µ—А–≤–Њ–≥–Њ –њ–Њ–Ї–Њ–ї–µ–љ–Є—П (—В–∞–±–ї. 1).
–У–∞–ї–Њ–њ–µ—А–Є–і–Њ–ї-–і–µ–Ї–∞–љ–Њ–∞—В. –Я–Њ–Љ–Є–Љ–Њ –њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Є—Е —Б–Њ—Б—В–Њ—П–љ–Є–є, –≤ —В.—З. —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–Є—Е—Б—П –∞–≥—А–µ—Б—Б–Є–µ–є, –Њ–і–љ–Є–Љ –Є–Ј –≤–∞–ґ–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞–љ–Є–є –Ї –љ–∞–Ј–љ–∞—З–µ–љ–Є—О –њ—А–µ–њ–∞—А–∞—В–∞ —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ —П–≤–ї—П–µ—В—Б—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –Љ–∞–љ–Є–∞–Ї–∞–ї—М–љ—Л—Е —Б–Њ—Б—В–Њ—П–љ–Є–є. –Х–≥–Њ –њ–µ—А–Є–Њ–і –њ–Њ–ї—Г–≤—Л–≤–µ–і–µ–љ–Є—П —П–≤–ї—П–µ—В—Б—П –љ–∞–Є–±–Њ–ї–µ–µ –і–ї–Є—В–µ–ї—М–љ—Л–Љ —Б—А–µ–і–Є –≤—Б–µ—Е –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ—Л—Е –љ–µ–є—А–Њ–ї–µ–њ—В–Є–Ї–Њ–≤ (3 –љ–µ–і.), —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Є–љ—В–µ—А–≤–∞–ї –Љ–µ–ґ–і—Г –Є–љ—К–µ–Ї—Ж–Є—П–Љ–Є –≤ –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л—Е —Б–ї—Г—З–∞—П—Е –Љ–Њ–ґ–µ—В –±—Л—В—М –і–Њ–≤–µ–і–µ–љ –і–Њ 6–8 –љ–µ–і. –Т—Б–ї–µ–і—Б—В–≤–Є–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–≥–Њ –і–Њ—Д–∞–Љ–Є–љ–±–ї–Њ–Ї–Є—А—Г—О—Й–µ–≥–Њ –і–µ–є—Б—В–≤–Є—П –≥–∞–ї–Њ–њ–µ—А–Є–і–Њ–ї–∞ –Њ—Б–Њ–±–Њ–µ –≤–љ–Є–Љ–∞–љ–Є–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Г–і–µ–ї—П—В—М –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –Є –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є—О —Н–Ї—Б—В—А–∞–њ–Є—А–∞–Љ–Є–і–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є.
–§–ї—Г—Д–µ–љ–∞–Ј–Є–љ-–і–µ–Ї–∞–љ–Њ–∞—В. –Ю—В–ї–Є—З–∞–µ—В—Б—П –±—Л—Б—В—А—Л–Љ –њ–Є–Ї–Њ–Њ–±—А–∞–Ј–љ—Л–Љ –љ–∞—А–∞—Б—В–∞–љ–Є–µ–Љ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –Ї—А–Њ–≤–Є –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –њ–Њ—Б–ї–µ –Є–љ—К–µ–Ї—Ж–Є–Є –љ–∞ –њ–µ—А–Є–Њ–і –і–Њ 24 —З. –Т —Н—В–Њ–Љ –њ–µ—А–Є–Њ–і–µ –Љ–Њ–≥—Г—В –њ—А–Њ—П–≤–ї—П—В—М—Б—П —В—А–∞–љ–Ј–Є—В–Њ—А–љ—Л–µ –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –њ—А–µ–њ–∞—А–∞—В–∞, —В–∞–Ї–Є–µ –Ї–∞–Ї –Њ—Б—В—А–∞—П –і–Є—Б—В–Њ–љ–Є—П. –Т –і–∞–ї—М–љ–µ–є—И–µ–Љ —Н—В–Њ—В –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П –њ—А–Є–Љ–µ—А–љ–Њ –љ–∞ 2/3 —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ –µ—Й–µ –±–Њ–ї–µ–µ –њ–ї–∞–≤–љ—Л–Љ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ.
–§–ї—Г–њ–µ–љ—В–Є–Ї—Б–Њ–ї-–і–µ–Ї–∞–љ–Њ–∞—В. –Я–Њ—Б–Ї–Њ–ї—М–Ї—Г –і–Њ –њ–Њ—П–≤–ї–µ–љ–Є—П –∞—В–Є–њ–Є—З–љ—Л—Е –Р–Я-–њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Њ–±—Л—З–љ–∞—П –њ—А–∞–Ї—В–Є–Ї–∞ —Б–Њ—Б—В–Њ—П–ї–∞ –≤ –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –љ–µ–є—А–Њ–ї–µ–њ—В–Є–Ї–Њ–≤ –≤ –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј–∞—Е –і–ї—П –њ—А–µ–Њ–і–Њ–ї–µ–љ–Є—П —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є, —Д–ї—Г–њ–µ–љ—В–Є–Ї—Б–Њ–ї-–і–µ–Ї–∞–љ–Њ–∞—В —Б —И–Є—А–Њ–Ї–Є–Љ –і–Є–∞–њ–∞–Ј–Њ–љ–Њ–Љ –њ—А–Є–Љ–µ–љ—П–µ–Љ—Л—Е –і–Њ–Ј (–≤–њ–ї–Њ—В—М –і–Њ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–≥–Њ –Ј–љ–∞—З–µ–љ–Є—П 400 –Љ–≥ 1 —А–∞–Ј/–љ–µ–і.) –њ–Њ–ї—Г—З–Є–ї —И–Є—А–Њ–Ї–Њ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є–µ. –†–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –љ–∞—З–Є–љ–∞—В—М —В–µ—А–∞–њ–Є—О –њ—А–µ–њ–∞—А–∞—В–Њ–Љ —Б —В–µ—Б—В–Њ–≤–Њ–є –і–Њ–Ј—Л 20–50 –Љ–≥ —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л–Љ –њ–Њ–і–±–Њ—А–Њ–Љ –і–Њ –∞–і–µ–Ї–≤–∞—В–љ–Њ–≥–Њ –Ј–љ–∞—З–µ–љ–Є—П.
–Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Г—З–Є—В—Л–≤–∞—В—М, —З—В–Њ –Љ–µ–і–ї–µ–љ–љ–Њ–µ –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є–µ –і–µ–є—Б—В–≤—Г—О—Й–µ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞ –Є–Ј –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–≥–Њ –і–µ–њ–Њ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –≤–Є–і–Њ–Є–Ј–Љ–µ–љ—П–µ—В —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –њ–∞—А–∞–Љ–µ—В—А—Л –њ—А–µ–њ–∞—А–∞—В–∞, –Ї–Њ—В–Њ—А—Л–є –≤ —В–∞–Ї–Њ–Љ –≤–Є–і–µ –Ј–∞–Љ–µ—В–љ–Њ –Њ—В–ї–Є—З–∞–µ—В—Б—П –Њ—В –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–є —Д–Њ—А–Љ—Л:
1. –Я–Њ—Б–Ї–Њ–ї—М–Ї—Г –њ—А–µ–њ–∞—А–∞—В –љ–∞–Ј–љ–∞—З–∞–µ—В—Б—П –≤–љ—Г—В—А–Є–Љ—Л—И–µ—З–љ–Њ, —Н—Д—Д–µ–Ї—В –њ–µ—А–≤–Њ–≥–Њ –њ—А–Њ—Е–Њ–ґ–і–µ–љ–Є—П —З–µ—А–µ–Ј –њ–µ—З–µ–љ—М –Љ–Є–љ–Є–Љ–Є–Ј–Є—А–Њ–≤–∞–љ, —З—В–Њ –њ—А–Є–±–ї–Є–ґ–∞–µ—В –µ–≥–Њ –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М –Ї 100%. –Т—Б–ї–µ–і—Б—В–≤–Є–µ —Н—В–Њ–≥–Њ –њ—А—П–Љ–Њ–є –њ–µ—А–µ—А–∞—Б—З–µ—В –і–Њ–Ј—Л —В–∞–±–ї–µ—В–Є—А–Њ–≤–∞–љ–љ–Њ–є —Д–Њ—А–Љ—Л –≤ –Є–љ—К–µ–Ї—Ж–Є–Њ–љ–љ—Г—О –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ—Г—О –±—Г–і–µ—В –љ–µ–≤–µ—А–љ—Л–Љ, —В.–Ї. –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –Ї—А–Њ–≤–Є –њ—А–Є –њ–µ—А–µ–≤–Њ–і–µ –љ–∞ –Є–љ—К–µ–Ї—Ж–Є–Є –њ—А–Њ–ї–Њ–љ–≥–∞ —Б—В–∞–љ–µ—В –≤—Л—И–µ.
2. –Ф–ї—П –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–є —Д–Њ—А–Љ—Л –Њ–њ—А–µ–і–µ–ї—П—О—Й–µ–є —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Њ–є —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Њ–є —П–≤–ї—П–µ—В—Б—П —Б–Ї–Њ—А–Њ—Б—В—М –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –і–ї—П –Є–љ—К–µ–Ї—Ж–Є–Њ–љ–љ–Њ–є –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ–Њ–є – —Б–Ї–Њ—А–Њ—Б—В—М –∞–±—Б–Њ—А–±—Ж–Є–Є. –Т —Б–ї—Г—З–∞–µ, –µ—Б–ї–Є –њ–Њ—Б–ї–µ–і–љ–Є–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –Њ–Ї–∞–Ј—Л–≤–∞–µ—В—Б—П –Љ–µ–љ—М—И–µ, —З–µ–Љ —Б–Ї–Њ—А–Њ—Б—В—М –≤—Л–≤–µ–і–µ–љ–Є—П, —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є–є –њ—А–Њ—Д–Є–ї—М –љ–Њ—Б–Є—В —Б–Ї–∞—З–Ї–Њ–Њ–±—А–∞–Ј–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А.
3. –Ф–µ–њ–Њ–љ–Є—А–Њ–≤–∞–љ–љ—Л–Љ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–Љ —Б—А–µ–і—Б—В–≤–∞–Љ —В—А–µ–±—Г–µ—В—Б—П —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –±–Њ–ї—М—И–µ–µ –≤—А–µ–Љ—П –Њ—В –љ–∞—З–∞–ї–∞ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Є –і–Њ –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —А–∞–≤–љ–Њ–≤–µ—Б–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П. –≠—В–Є –њ—А–µ–њ–∞—А–∞—В—Л –љ–µ –і–Њ–ї–ґ–љ—Л –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ–µ—А–≤–Њ–Њ—З–µ—А–µ–і–љ—Л—Е —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –љ–µ –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Р–Я-—В–µ—А–∞–њ–Є—О –і–Њ —Н—В–Њ–≥–Њ.
4. –Ш–Ј-–Ј–∞ –Ј–∞–Љ–µ–і–ї–µ–љ–љ–Њ–є –∞–±—Б–Њ—А–±—Ж–Є–Є –Є, –Ї–∞–Ї —Б–ї–µ–і—Б—В–≤–Є–µ, —Н–ї–Є–Љ–Є–љ–∞—Ж–Є–Є –і–µ–є—Б—В–≤–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ –њ—А–Њ–і–Њ–ї–ґ–∞–µ—В—Б—П –≤ —В–µ—З–µ–љ–Є–µ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–Є (–і–Њ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –Љ–µ—Б—П—Ж–µ–≤) –њ–Њ—Б–ї–µ –њ–Њ—Б–ї–µ–і–љ–µ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Г—Е—Г–і—И–µ–љ–Є–µ —Б–Њ—Б—В–Њ—П–љ–Є—П –Љ–Њ–ґ–µ—В –±—Л—В—М –Њ—В—Б—А–Њ—З–µ–љ–Њ –њ–Њ—Б–ї–µ –њ—А–µ–Ї—А–∞—Й–µ–љ–Є—П —В–µ—А–∞–њ–Є–Є –љ–∞ 3–6 –Є –±–Њ–ї–µ–µ –Љ–µ—Б—П—Ж–µ–≤.
–Т–љ–µ–і—А–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П —П–≤–Є–ї–Њ—Б—М –±–Њ–ї—М—И–Є–Љ —И–∞–≥–Њ–Љ –≤ –њ—Б–Є—Е–Њ—Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є–Є, –≤–Њ –Љ–љ–Њ–≥–Њ–Љ –Є–Ј–Љ–µ–љ–Є–≤—И–Є–Љ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–µ –∞–ї–≥–Њ—А–Є—В–Љ—Л –њ–Њ –њ—А–Њ–≤–µ–і–µ–љ–Є—О –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–µ–є —В–µ—А–∞–њ–Є–Є –Є –ї–µ—З–µ–љ–Є—О —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е —Д–Њ—А–Љ —И–Є–Ј–Њ—Д—А–µ–љ–Є–Є. –Ю–і–љ–∞–Ї–Њ, —Е–Њ—В—П –њ–Њ—П–≤–Є–≤—И–Є–µ—Б—П –љ–µ –Љ–µ–љ–µ–µ 20 –ї–µ—В –љ–∞–Ј–∞–і –∞—В–Є–њ–Є—З–љ—Л–µ –Р–Я-–њ—А–µ–њ–∞—А–∞—В—Л –Њ—В–ї–Є—З–∞—О—В—Б—П —Г–ї—Г—З—И–µ–љ–љ—Л–Љ –њ—А–Њ—Д–Є–ї–µ–Љ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є-–љ–µ–є—А–Њ–ї–µ–њ—В–Є–Ї–∞–Љ–Є, –∞—Б—Б–Њ—А—В–Є–Љ–µ–љ—В –і–µ–њ–Њ–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е –Р–Я-—Б—А–µ–і—Б—В–≤ –µ—Й–µ –і–Њ –љ–µ–і–∞–≤–љ–µ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –±—Л–ї –Њ–≥—А–∞–љ–Є—З–µ–љ —В–Њ–ї—М–Ї–Њ –њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л–Љ–Є –≤—Л—И–µ –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є. –Я—А–Њ–±–ї–µ–Љ—Г —Г—Б—Г–≥—Г–±–ї—П–µ—В —В–Њ—В —Д–∞–Ї—В, —З—В–Њ —В–∞–±–ї–µ—В–Є—А–Њ–≤–∞–љ–љ—Л–µ —Д–Њ—А–Љ—Л –∞—В–Є–њ–Є—З–љ—Л—Е –Р–Я –њ—А–Њ—В–Є–≤ –Њ–ґ–Є–і–∞–љ–Є—П –Ї–ї–Є–љ–Є—Ж–Є—Б—В–Њ–≤ –љ–µ –њ—А–Є–≤–µ–ї–Є –Ї —Г–ї—Г—З—И–µ–љ–Є—О –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Ї–Њ–Љ–њ–ї–∞–є–µ–љ—Б–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ [16]. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —А–∞–Ј—А–∞–±–Њ—В–Ї–∞ –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ—Л—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Д–Њ—А–Љ –і–ї—П –љ–Њ–≤—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —П–≤–Є–ї–∞—Б—М –љ–∞—Б—Г—Й–љ–Њ–є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М—О. –Э–∞—З–∞–ї—М–љ–Њ–є –њ—А–Њ–±–ї–µ–Љ–Њ–є, –Ї–Њ—В–Њ—А—Г—О –њ—А–Є—И–ї–Њ—Б—М —А–µ—И–∞—В—М —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–∞–Љ –њ—А–Є —А–∞–Ј—А–∞–±–Њ—В–Ї–µ –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ—Л—Е —Д–Њ—А–Љ —В–∞–Ї–Є—Е –∞—В–Є–њ–Є—З–љ—Л—Е –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–Њ–≤, –Ї–∞–Ї —А–Є—Б–њ–µ—А–Є–і–Њ–љ –Є –Њ–ї–∞–љ–Ј–∞–њ–Є–љ, –±—Л–ї–Њ –Њ—В—Б—Г—В—Б—В–≤–Є–µ —Г –љ–Є—Е –Ї–Њ–љ—Ж–µ–≤–Њ–є –≥–Є–і—А–Њ–Ї—Б–Є–ї—М–љ–Њ–є (-OH) –≥—А—Г–њ–њ—Л, –Ї –Ї–Њ—В–Њ—А–Њ–є –њ—А–Є —Н—В–µ—А–Є—Д–Є–Ї–∞—Ж–Є–Є –Љ–Њ–≥–ї–∞ –±—Л –±—Л—В—М –њ—А–Є—Б–Њ–µ–і–Є–љ–µ–љ–∞ —Ж–µ–њ—М –Ї–∞—А–±–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л. –Т –Ї–∞–ґ–і–Њ–Љ –Є–Ј —Н—В–Є—Е —Б–ї—Г—З–∞–µ–≤ –±—Л–ї–Њ –љ–∞–є–і–µ–љ–Њ –Њ—А–Є–≥–Є–љ–∞–ї—М–љ–Њ–µ —А–µ—И–µ–љ–Є–µ.
–Я–µ—А–≤—Л–Љ –∞—В–Є–њ–Є—З–љ—Л–Љ –Р–Я –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П –±—Л–ї–∞ –і–µ–њ–Њ–љ–Є—А–Њ–≤–∞–љ–љ–∞—П –Є–љ—К–µ–Ї—Ж–Є–Њ–љ–љ–∞—П —Д–Њ—А–Љ–∞ —А–Є—Б–њ–µ—А–Є–і–Њ–љ–∞ (–Ъ–Њ–љ—Б—В–∞)2, –њ—А–µ–і—Б—В–∞–≤–ї—П–≤—И–∞—П —Б–Њ–±–Њ–є –љ–µ–Љ–Њ–і–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–µ –∞–Ї—В–Є–≤–љ–Њ–µ –≤–µ—Й–µ—Б—В–≤–Њ, —Д–Є–Ј–Є—З–µ—Б–Ї–Є –≤–љ–µ–і—А–µ–љ–љ–Њ–µ –≤ —Б–Њ—Б—В–∞–≤ –±–Є–Њ–і–µ–≥—А–∞–і–Є—А—Г–µ–Љ—Л—Е –Љ–Є–Ї—А–Њ—Б—Д–µ—А –ї–∞–Ї—В–Є–і–љ–Њ-–≥–ї–Є–Ї–Њ–ї–Є–і–љ–Њ–є –њ–Њ–ї–Є–Љ–µ—А–љ–Њ–є —Б—В—А—Г–Ї—В—Г—А—Л (—Б–Є—Б—В–µ–Љ–∞ Medisorb). –Я–Њ–і–Њ–±–љ—Л–µ –±–Є–Њ—Б–Њ—Б—В–∞–≤—Л –Є–Ј–љ–∞—З–∞–ї—М–љ–Њ —А–∞–Ј—А–∞–±–∞—В—Л–≤–∞–ї–Є—Б—М –і–ї—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –≤ –Ї–∞—З–µ—Б—В–≤–µ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–≥–Њ —И–Њ–≤–љ–Њ–≥–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞. –°–Ї–Њ—А–Њ—Б—В—М –Є—Е –≤–Њ–і–љ–Њ–≥–Њ —А–∞—Б—В–≤–Њ—А–µ–љ–Є—П –Њ–њ—А–µ–і–µ–ї—П–µ—В –≤—А–µ–Љ—П –і–µ–є—Б—В–≤–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –Є–љ—В–µ—А–≤–∞–ї–µ –і–Њ 6 –љ–µ–і. –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є —А–Є—Б–Ї–∞ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –≤ –Љ–µ—Б—В–µ –Є–љ—К–µ–Ї—Ж–Є–Є. –Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –≤ –∞—В–Є–њ–Є—З–љ–Њ–Љ –Р–Я-–њ—А–µ–њ–∞—А–∞—В–µ-–њ—А–Њ–ї–Њ–љ–≥–µ –±—Л–ї–∞ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –≤–µ–ї–Є–Ї–∞, –≤—Б–ї–µ–і—Б—В–≤–Є–µ —З–µ–≥–Њ –≤—Б–Ї–Њ—А–µ –њ–Њ—Б–ї–µ —Б–≤–Њ–µ–≥–Њ –њ–Њ—П–≤–ї–µ–љ–Є—П —А–Є—Б–њ–µ—А–Є–і–Њ–љ (–Ъ–Њ–љ—Б—В–∞) –Ј–∞–љ—П–ї –≤–µ–і—Г—Й–µ–µ –Љ–µ—Б—В–Њ —Б—А–µ–і–Є –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –і–ї—П –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –≤ —А—П–і–µ —Б—В—А–∞–љ, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї —З–∞—Б—В–Њ—В–∞ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П —А–∞–љ–µ–µ –љ–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ–≥–Њ –Є–Ј –µ–≥–Њ –њ—А–µ–і—И–µ—Б—В–≤–µ–љ–љ–Є–Ї–Њ–≤ —Д–ї—Г–њ–µ–љ—В–Є–Ї—Б–Њ–ї-–і–µ–Ї–∞–љ–Њ–∞—В–∞ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–Љ–µ–љ—М—И–Є–ї–∞—Б—М. –Я—А–µ–њ–∞—А–∞—В –њ–Њ—Б—В–∞–≤–ї—П–µ—В—Б—П –≤ –њ–Њ—А–Њ—И–Ї–Њ–Њ–±—А–∞–Ј–љ–Њ–Љ –≤–Є–і–µ –Є –і–Њ–ї–ґ–µ–љ —Е—А–∞–љ–Є—В—М—Б—П –њ—А–Є –њ–Њ–љ–Є–ґ–µ–љ–љ–Њ–є —В–µ–Љ–њ–µ—А–∞—В—Г—А–µ. –Т–≤–µ–і–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞, –љ–∞–њ—А–Њ—В–Є–≤, —В—А–µ–±—Г–µ—В –Ї–Њ–Љ–љ–∞—В–љ–Њ–є —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л; —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Њ–љ –і–Њ–ї–ґ–µ–љ –±—Л—В—М –њ–Њ–і–≥–Њ—В–Њ–≤–ї–µ–љ –Ї –Є–љ—К–µ–Ї—Ж–Є–Є –Ј–∞—А–∞–љ–µ–µ. –Э–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –њ–µ—А–µ–і –Є–љ—К–µ–Ї—Ж–Є–µ–є –њ—А–µ–њ–∞—А–∞—В —А–∞–Ј–≤–Њ–і–Є—В—Б—П –≤–Њ–і–Њ—Б–Њ–і–µ—А–ґ–∞—Й–Є–Љ —А–∞—Б—В–≤–Њ—А–Є—В–µ–ї–µ–Љ. –Я–Њ—Б–ї–µ –≤–≤–µ–і–µ–љ–Є—П –≤–љ—Г—В—А—М –Љ—Л—И—Ж—Л –њ–Њ–ї–Є–Љ–µ—А –≥–Є–і—А–∞—В–Є—А—Г–µ—В—Б—П –Є –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ —А–∞—Б—В–≤–Њ—А—П–µ—В—Б—П, –њ—А–Є —Н—В–Њ–Љ –∞–Ї—В–Є–≤–љ–Њ–µ –≤–µ—Й–µ—Б—В–≤–Њ –њ–Њ–њ–∞–і–∞–µ—В –≤ –Ї—А–Њ–≤–Њ—В–Њ–Ї. –Я–Њ—Б–ї–µ –µ–і–Є–љ–Є—З–љ–Њ–є –Є–љ—К–µ–Ї—Ж–Є–Є –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –њ–ї–∞–Ј–Љ–µ –і–Њ—Б—В–Є–≥–∞–µ—В—Б—П —З–µ—А–µ–Ј 4–5 –љ–µ–і. –†–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ 2-–љ–µ–і–µ–ї—М–љ—Л–є –Є–љ—В–µ—А–≤–∞–ї –≤–≤–µ–і–µ–љ–Є—П, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–Љ —Б—В–∞–±–Є–ї—М–љ–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –і–Њ—Б—В–Є–≥–∞–µ—В—Б—П –≤ —В–µ—З–µ–љ–Є–µ 8 –љ–µ–і. –Э–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є —Н—В–Њ–≥–Њ –њ–µ—А–Є–Њ–і–∞ –љ–µ–Њ–±—Е–Њ–і–Є–Љ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–є –њ–µ—А–Њ—А–∞–ї—М–љ—Л–є –њ—А–Є–µ–Љ –њ—А–µ–њ–∞—А–∞—В–∞. –Ф–Њ–Ј–∞ –њ—А–µ–њ–∞—А–∞—В–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 25 –Љ–≥ –Ї–∞–ґ–і—Л–µ 2 –љ–µ–і. —Б –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–Љ –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ –і–Њ 37,5–50 –Љ–≥. –Э–µ–Ї–Њ—В–Њ—А—Л–µ –±–Њ–ї—М–љ—Л–µ –Љ–Њ–≥—Г—В –ґ–∞–ї–Њ–≤–∞—В—М—Б—П –љ–∞ –±–Њ–ї–µ–Ј–љ–µ–љ–љ–Њ—Б—В—М –≤ –Љ–µ—Б—В–µ –Є–љ—К–µ–Ї—Ж–Є–Є, —Е–Њ—В—П —В–∞–Ї–Є–µ —П–≤–ї–µ–љ–Є—П –Њ—В–Љ–µ—З–∞—О—В—Б—П —А–µ–ґ–µ, —З–µ–Љ –њ—А–Є –Є–љ—К–µ–Ї—Ж–Є—П—Е –Љ–∞—Б–ї—П–љ—Л—Е —А–∞—Б—В–≤–Њ—А–Њ–≤ –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ—Л—Е –Р–Я.
–°—А–∞–≤–љ–Є—В–µ–ї—М–љ–∞—П –Њ—Ж–µ–љ–Ї–∞ –њ–Њ–Ї–∞–Ј–∞–ї–∞ –Њ—В—Б—Г—В—Б—В–≤–Є–µ –Ј–љ–∞—З–Є–Љ—Л—Е –Њ—В–ї–Є—З–Є–є –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –њ–µ—А–Њ—А–∞–ї—М–љ—Г—О –Є –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ—Г—О –Є–љ—К–µ–Ї—Ж–Є–Њ–љ–љ—Г—О —Д–Њ—А–Љ—Л —А–Є—Б–њ–µ—А–Є–і–Њ–љ–∞ –і–ї–Є—В–µ–ї—М–љ—Л–Љ–Є (–і–Њ 1 –≥–Њ–і–∞) –Ї—Г—А—Б–∞–Љ–Є, –Ї–∞–Ї –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞, —В–∞–Ї –Є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є [5]. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ, —Б—Г—Й–µ—Б—В–≤—Г—О—В –Њ—В–і–µ–ї—М–љ—Л–µ —Г–Ї–∞–Ј–∞–љ–Є—П, —З—В–Њ —В–∞–Ї–Є–µ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є, –Ї–∞–Ї —Б—Г–±—К–µ–Ї—В–Є–≤–љ–∞—П –Њ—Ж–µ–љ–Ї–∞ –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є –Є –і–Є–љ–∞–Љ–Є–Ї–∞ –љ–µ–≥–∞—В–Є–≤–љ—Л—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤, –Љ–Њ–≥—Г—В –±—Л—В—М –ї—Г—З—И–Є–Љ–Є —Г –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞—О—Й–Є—Е –њ–µ—А–Њ—А–∞–ї—М–љ—Г—О —В–µ—А–∞–њ–Є—О, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –і–ї—П –і–µ–њ–Њ–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —Д–Њ—А–Љ—Л —Е–∞—А–∞–Ї—В–µ—А–љ—Л –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Є–љ—Б–∞–є—В–∞, –ї—Г—З—И–∞—П –і–Є–љ–∞–Љ–Є–Ї–∞ –њ—А–Њ–і—Г–Ї—В–Є–≤–љ—Л—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Є –±–Њ–ї–µ–µ –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–є –њ—А–Њ—Д–Є–ї—М –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Ї–Њ–Љ–њ–ї–∞–є–µ–љ—Б–∞ –њ—А–Є, –≤ —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М, –±–Њ–ї—М—И–µ–є —З–∞—Б—В–Њ—В–µ —Н–Ї—Б—В—А–∞–њ–Є—А–∞–Љ–Є–і–љ—Л—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤ [4, 31].
–®–Є—А–Њ–Ї–Њ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –і—А—Г–≥–Њ–≥–Њ –Р–Я-–њ—А–Њ–ї–Њ–љ–≥–∞ – –Љ–Њ–љ–Њ–≥–Є–і—А–∞—В–љ–Њ–≥–Њ –Њ–ї–∞–љ–Ј–∞–њ–Є–љ–∞ –њ–∞–Љ–Њ–∞—В–∞ (RELPREVV)3 – –Ї —Б–Њ–ґ–∞–ї–µ–љ–Є—О, –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М –Њ–≥—А–∞–љ–Є—З–µ–љ–љ—Л–Љ –Є–Ј-–Ј–∞ —А–µ–∞–ї–Є–Ј–∞—Ж–Є–Є —В—А–µ–±–Њ–≤–∞–љ–Є—П –∞–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Њ–є –Р–і–Љ–Є–љ–Є—Б—В—А–∞—Ж–Є–Є –њ–Њ –њ–Є—Й–µ–≤—Л–Љ –Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–Љ –њ—А–Њ–і—Г–Ї—В–∞–Љ (FDA) –Њ–± –Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ–Љ –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞ —В–Њ–ї—М–Ї–Њ –≤ —Б—В–∞—Ж–Є–Њ–љ–∞—А–љ—Л—Е —Г—Б–ї–Њ–≤–Є—П—Е —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ –љ–∞–±–ї—О–і–µ–љ–Є–µ–Љ –Є –Ї–Њ–љ—В—А–Њ–ї–µ–Љ –Р–Ф –≤ —В–µ—З–µ–љ–Є–µ –Ї–∞–Ї –Љ–Є–љ–Є–Љ—Г–Љ 3 —З –і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П —Б–µ—А—М–µ–Ј–љ–Њ–≥–Њ –Є –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ —Д–∞—В–∞–ї—М–љ–Њ–≥–Њ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П – —З—А–µ–Ј–Љ–µ—А–љ–Њ–є —Б–µ–і–∞—Ж–Є–Є —Б –і–µ–ї–Є—А–Є–Њ–Ј–љ—Л–Љ –њ–Њ–Љ—А–∞—З–µ–љ–Є–µ–Љ —Б–Њ–Ј–љ–∞–љ–Є—П –≤ —А–∞–Љ–Ї–∞—Е —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ–Њ–≥–Њ –њ–Њ—Б—В–Є–љ—К–µ–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –і–µ–ї–Є—А–Є–Њ–Ј–љ–Њ–є —Б–µ–і–∞—Ж–Є–Є (PDSS). –≠—В–Њ—В —Д–µ–љ–Њ–Љ–µ–љ –±—Л–ї –≤–њ–µ—А–≤—Л–µ –Њ—В–Љ–µ—З–µ–љ —Г –љ–µ–Ї–Њ—В–Њ—А—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ —Е–Њ–і–µ —А–µ–≥–Є—Б—В—А–∞—Ж–Є–Њ–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є4. –Ґ–∞–Ї–ґ–µ –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Њ–ї–∞–љ–Ј–∞–њ–Є–љ–∞ –њ–∞–Љ–Њ–∞—В–∞ –њ–∞—Ж–Є–µ–љ—В–∞–Љ –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ —Б –і–µ–Љ–µ–љ—Ж–Є–µ–є.
–Т –Њ—В–ї–Є—З–Є–µ –Њ—В –і—А—Г–≥–Є—Е –і–µ–њ–Њ–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е –Р–Я-–њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ–∞–Љ–Њ–∞—В –Њ–ї–∞–љ–Ј–∞–њ–Є–љ–∞ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –љ–µ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ—Л–є —Н—Д–Є—А, –∞ —Б–Њ–ї—М –њ–∞–Љ–Њ–µ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л. –Я—А–Њ—Ж–µ—Б—Б –µ–µ –і–Є—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є –≤ –Љ—Л—И–µ—З–љ–Њ–є —В–Ї–∞–љ–Є –њ—А–Њ—В–µ–Ї–∞–µ—В –Љ–µ–і–ї–µ–љ–љ–Њ, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ–Љ—Г –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є—О –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–љ–Њ–≥–Њ –Њ–ї–∞–љ–Ј–∞–њ–Є–љ–∞ –≤ –Ї—А–Њ–≤—М –≤ —В–µ—З–µ–љ–Є–µ 2–4 –љ–µ–і. [9]. –Ф–ї—П –Љ–Є–љ–Є–Љ–Є–Ј–∞—Ж–Є–Є –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є –≤–≤–µ–і–µ–љ–Є–µ –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –Њ–ї–∞–љ–Ј–∞–њ–Є–љ–∞ —В—А–µ–±—Г–µ—В —З–µ—В–Ї–Њ–≥–Њ —Б–Њ–±–ї—О–і–µ–љ–Є—П –Є–љ—Б—В—А—Г–Ї—Ж–Є–Є –њ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є –Є —В–µ—Е–љ–Є–Ї–Є –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Є–љ—К–µ–Ї—Ж–Є–Є. –Т –і–Њ–њ–Њ–ї–љ–µ–љ–Є–µ –Ї —Н—В–Є–Љ –Њ–≥—А–∞–љ–Є—З–µ–љ–Є—П–Љ –≤ –°–®–Р –њ—А–µ–њ–∞—А–∞—В –і–Њ—Б—В—Г–њ–µ–љ —В–Њ–ї—М–Ї–Њ –≤ —А–∞–Љ–Ї–∞—Е —Б–њ–µ—Ж–Є–∞–ї—М–љ–Њ–є –њ—А–Њ–≥—А–∞–Љ–Љ—Л —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є—П RELPREVV Patient Care Program, –њ—А–µ–і—Г—Б–Љ–∞—В—А–Є–≤–∞—О—Й–µ–є –љ–∞–ї–Є—З–Є–µ –њ–Њ–і–≥–Њ—В–Њ–≤–ї–µ–љ–љ–Њ–≥–Њ –ї–µ—З–∞—Й–µ–≥–Њ –≤—А–∞—З–∞, —Б—В–∞—Ж–Є–Њ–љ–∞—А–∞ (–Є–ї–Є –і–љ–µ–≤–љ–Њ–≥–Њ —Б—В–∞—Ж–Є–Њ–љ–∞—А–∞) –Є –њ—А–Њ—И–µ–і—И–µ–≥–Њ —В—А–µ–љ–Є–љ–≥ —Б–µ—Б—В—А–Є–љ—Б–Ї–Њ–≥–Њ –њ–µ—А—Б–Њ–љ–∞–ї–∞. –Т –ї–Є—В–µ—А–∞—В—Г—А–µ –њ—А–Є–≤–Њ–і—П—В—Б—П –і–∞–љ–љ—Л–µ –Њ —В–Њ–Љ, —З—В–Њ –њ–∞—Ж–Є–µ–љ—В—Л, –њ–Њ–ї—Г—З–∞—О—Й–Є–µ –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ—Л–є –Њ–ї–∞–љ–Ј–∞–њ–Є–љ, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—В—Б—П –љ–∞–Є–ї—Г—З—И–Є–Љ–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ–Є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є –Є —Б–Њ–±–ї—О–і–µ–љ–Є—П –≤—А–∞—З–µ–±–љ—Л—Е –њ—А–µ–і–њ–Є—Б–∞–љ–Є–є: –≤ —В–µ—З–µ–љ–Є–µ –≥–Њ–і–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –≤—Л–±—Л–≤–∞–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–µ –њ—А–µ–≤—Л—И–∞—О—В —Г—А–Њ–≤–љ—П 27%. –°—В–Њ–Є—В, –Њ–і–љ–∞–Ї–Њ, –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ —Н—В–Є –і–∞–љ–љ—Л–µ –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л –≤ —Е–Њ–і–µ —Б—В—А–Њ–≥–Њ —Д–Њ—А–Љ–∞–ї–Є–Ј–Њ–≤–∞–љ–љ—Л—Е –Є —А–µ–≥–ї–∞–Љ–µ–љ—В–Є—А–Њ–≤–∞–љ–љ—Л—Е —А–µ–≥–Є—Б—В—А–∞—Ж–Є–Њ–љ–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Є –љ–µ –Љ–Њ–≥—Г—В –±—Л—В—М –Њ–і–љ–Њ–Ј–љ–∞—З–љ–Њ –∞–њ–њ—А–Њ–Ї—Б–Є–Љ–Є—А–Њ–≤–∞–љ—Л –≤ –њ–Њ–≤—Б–µ–і–љ–µ–≤–љ—Г—О –Ї–ї–Є–љ–Є—З–µ—Б–Ї—Г—О –њ—А–∞–Ї—В–Є–Ї—Г [3, 21].
–Ю–±—Й–µ–є –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—М—О –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –і–≤—Г—Е —А–∞—Б—Б–Љ–Њ—В—А–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —П–≤–ї—П–µ—В—Б—П —В—А–µ–±—Г—О—Й–∞—П –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ–≥–Њ –Њ–±—Г—З–µ–љ–Є—П –њ—А–Њ—Ж–µ–і—Г—А–∞ –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–Є—П –Є–љ—К–µ–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ —А–∞—Б—В–≤–Њ—А–∞ –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –њ–µ—А–µ–і –≤–≤–µ–і–µ–љ–Є–µ–Љ.
–Ъ–∞–Ї –≤–Є–і–љ–Њ –Є–Ј –Є–Ј–ї–Њ–ґ–µ–љ–љ—Л—Е –≤—Л—И–µ –і–∞–љ–љ—Л—Е, –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ—Л–µ —Д–Њ—А–Љ—Л –і–≤—Г—Е –∞—В–Є–њ–Є—З–љ—Л—Е –Р–Я-—Б—А–µ–і—Б—В–≤ (—А–Є—Б–њ–µ—А–Є–і–Њ–љ–∞ –≤ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–є —Д–Њ—А–Љ–µ –Ъ–Њ–љ—Б—В–∞ –Є –Њ–ї–∞–љ–Ј–∞–њ–Є–љ–∞ –њ–∞–Љ–Њ–∞—В–∞) –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –Њ—В–ї–Є—З–∞—О—В—Б—П –Њ—В –њ—А–µ–њ–∞—А–∞—В–Њ–≤-–њ—А–µ–і—И–µ—Б—В–≤–µ–љ–љ–Є–Ї–Њ–≤ –Ї–∞–Ї —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є–µ–є –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞, —В–∞–Ї –Є —А–µ–∞–ї–Є–Ј–∞—Ж–Є–µ–є –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞ –µ–≥–Њ –Ј–∞–Љ–µ–і–ї–µ–љ–љ–Њ–≥–Њ –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є—П. –Т–Њ –Љ–љ–Њ–≥–Њ–Љ –Є–Љ–µ–љ–љ–Њ –≤—Б–ї–µ–і—Б—В–≤–Є–µ —Н—В–Є—Е –њ—А–Є—З–Є–љ —А–∞—Б—Б–Љ–Њ—В—А–µ–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –Є –Њ–±–ї–∞–і–∞—О—В —А—П–і–Њ–Љ —Б–≤–Њ–є—Б—В–≤, —Г—Б–ї–Њ–ґ–љ—П—О—Й–Є—Е –Є –Њ–≥—А–∞–љ–Є—З–Є–≤–∞—О—Й–Є—Е –Є—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ, –Ї–Њ—В–Њ—А–Њ–µ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В—Б—П –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –Љ–µ–љ—М—И–Є–Љ –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є-–њ—А–Њ–ї–Њ–љ–≥–∞–Љ–Є –њ–µ—А–≤–Њ–≥–Њ –њ–Њ–Ї–Њ–ї–µ–љ–Є—П.
–Х—Й–µ –Њ–і–Є–љ –њ—А–µ–њ–∞—А–∞—В –≤ —А—П–і—Г –∞—В–Є–њ–Є—З–љ—Л—Е –Р–Я –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П – –њ–∞–ї–Є–њ–µ—А–Є–і–Њ–љ-–њ–∞–ї—М–Љ–Є—В–∞—В, –і–Њ—Б—В—Г–њ–љ—Л–є –≤ –†–§ –њ–Њ–і —В–Њ—А–≥–Њ–≤—Л–Љ –љ–∞–Є–Љ–µ–љ–Њ–≤–∞–љ–Є–µ–Љ –Ъ—Б–µ–њ–ї–Є–Њ–љ (—Д–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–µ—Б–Ї–∞—П –Ї–Њ–Љ–њ–∞–љ–Є—П «–ѓ–љ—Б—Б–µ–љ»), – –њ—А–Є–Ј–≤–∞–љ –њ—А–µ–Њ–і–Њ–ї–µ—В—М –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л—Е –≤—Л—И–µ –љ–µ–і–Њ—Б—В–∞—В–Ї–Њ–≤.
–Ю–±—А–∞–Ј—Г–µ–Љ–Њ–µ —Н—В–Є–Љ –њ—А–Њ–ї–µ–Ї–∞—А—Б—В–≤–Њ–Љ –∞–Ї—В–Є–≤–љ–Њ–µ –≤–µ—Й–µ—Б—В–≤–Њ – –њ–∞–ї–Є–њ–µ—А–Є–і–Њ–љ (—Б–Є–љ. 9-–≥–Є–і—А–Њ–Ї—Б–Є—А–Є—Б–њ–µ—А–Є–і–Њ–љ) – —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В –Њ—Б–љ–Њ–≤–љ–Њ–Љ—Г –∞–Ї—В–Є–≤–љ–Њ–Љ—Г –Љ–µ—В–∞–±–Њ–ї–Є—В—Г —А–Є—Б–њ–µ—А–Є–і–Њ–љ–∞, —П–≤–ї—П—О—Й–µ–Љ—Г—Б—П –њ—А–Њ–і—Г–Ї—В–Њ–Љ –µ–≥–Њ –±–Є–Њ—В—А–∞–љ—Б—Д–Њ—А–Љ–∞—Ж–Є–Є –≤ –њ–µ—З–µ–љ–Є –Є –≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –Њ—В–≤–µ—З–∞—О—Й–µ–Љ—Г –Ј–∞ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В, —А–µ–≥–Є—Б—В—А–Є—А—Г–µ–Љ—Л–є –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є —А–Є—Б–њ–µ—А–Є–і–Њ–љ–∞.
–§–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –і–µ–є—Б—В–≤–Є–µ –њ–∞–ї–Є–њ–µ—А–Є–і–Њ–љ–∞ –Є —А–Є—Б–њ–µ—А–Є–і–Њ–љ–∞ —Б—Е–Њ–і–љ–Њ. –Я–∞–ї–Є–њ–µ—А–Є–і–Њ–љ —Б–≤—П–Ј—Л–≤–∞–µ—В—Б—П —Б —Ж–µ–љ—В—А–∞–ї—М–љ—Л–Љ–Є D2-–і–Њ–њ–∞–Љ–Є–љ–Њ–≤—Л–Љ–Є –Є 5-HT2A-—Б–µ—А–Њ—В–Њ–љ–Є–љ–Њ–≤—Л–Љ–Є —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є, –Њ–Ї–∞–Ј—Л–≤–∞—П –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–Є—З–µ—Б–Ї–Њ–µ –і–µ–є—Б—В–≤–Є–µ. –≠—В–∞ –њ–µ—А–≤–Є—З–љ–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–µ–њ–∞—А–∞—В–∞, –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ, –ї–µ–ґ–Є—В –≤ –Њ—Б–љ–Њ–≤–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞.
–Ґ–∞–Ї–ґ–µ –њ—А–µ–њ–∞—А–∞—В —П–≤–ї—П–µ—В—Б—П –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–Њ–Љ α1 –Є α2-–∞–і—А–µ–љ–µ—А–≥–Є—З–µ—Б–Ї–Є—Е –Є, –≤ –Љ–µ–љ—М—И–µ–є —Б—В–µ–њ–µ–љ–Є, H1-–≥–Є—Б—В–∞–Љ–Є–љ–µ—А–≥–Є—З–µ—Б–Ї–Є—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤. –Ю–љ –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –і–µ–є—Б—В–≤–Є—П –љ–∞ —Е–Њ–ї–Є–љ–µ—А–≥–Є—З–µ—Б–Ї–Є–µ –Љ—Г—Б–Ї–∞—А–Є–љ–Њ–≤—Л–µ —А–µ—Ж–µ–њ—В–Њ—А—Л, –∞ —В–∞–Ї–ґ–µ –љ–∞ β1- –Є β2-–∞–і—А–µ–љ–µ—А–≥–Є—З–µ—Б–Ї–Є–µ. –Т –њ—А–Њ—В–Є–≤–Њ–њ–Њ–ї–Њ–ґ–љ–Њ—Б—В—М —А–Є—Б–њ–µ—А–Є–і–Њ–љ—Г, –ї–Є—И–µ–љ–љ–Њ–Љ—Г —Б—В–µ—А–µ–Њ–Є–Ј–Њ–Љ–µ—А–Є–Є, —Г –Љ–Њ–ї–µ–Ї—Г–ї—Л –њ–∞–ї–Є–њ–µ—А–Є–і–Њ–љ–∞ –≤ –Љ–µ—Б—В–µ –њ—А–Є—Б–Њ–µ–і–Є–љ–µ–љ–Є—П –≥–Є–і—А–Њ–Ї—Б–Є–ї—М–љ–Њ–є –≥—А—Г–њ–њ—Л (–OH) –њ–Њ—П–≤–ї—П–µ—В—Б—П —Е–Є—А–∞–ї—М–љ—Л–є —Ж–µ–љ—В—А, —З—В–Њ –Њ–њ—А–µ–і–µ–ї—П–µ—В –і–ї—П –љ–µ–≥–Њ —Б—Г—Й–µ—Б—В–≤–Њ–≤–∞–љ–Є–µ –і–≤—Г—Е —Б—В–µ—А–µ–Њ–Є–Ј–Њ–Љ–µ—А–Њ–≤. –Т –Њ—В–ї–Є—З–Є–µ –Њ—В –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –±–Є–Њ–≥–µ–љ–љ–Њ–≥–Њ –њ–∞–ї–Є–њ–µ—А–Є–і–Њ–љ–∞ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–є —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є–є –њ–∞–ї–Є–њ–µ—А–Є–і–Њ–љ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є —А–∞—Ж–µ–Љ–Є—З–µ—Б–Ї—Г—О —Б–Љ–µ—Б—М –њ—А–∞–≤–Њ- –Є –ї–µ–≤–Њ–≤—А–∞—Й–∞—О—Й–µ–≥–Њ –Є–Ј–Њ–Љ–µ—А–Њ–≤. –Ш—Е —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М, –Њ–і–љ–∞–Ї–Њ, –Њ–њ—А–µ–і–µ–ї–µ–љ–∞ –Ї–∞–Ї —Б—Е–Њ–і–љ–∞—П –≤ –Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ–Љ –Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ–Њ–Љ –Њ—В–љ–Њ—И–µ–љ–Є—П—Е [13].
–Ь–µ—В–∞–±–Њ–ї–Є–Ј–Љ –њ–∞–ї–Є–њ–µ—А–Є–і–Њ–љ–∞ –њ—А–Њ—В–µ–Ї–∞–µ—В –і–≤–Њ—П–Ї–Њ. –Ю—Б–љ–Њ–≤–љ–∞—П —З–∞—Б—В—М –њ—А–µ–њ–∞—А–∞—В–∞ (–і–Њ 80%) –≤—Л–≤–Њ–і–Є—В—Б—П –≤ –љ–µ–Є–Ј–Љ–µ–љ–µ–љ–љ–Њ–Љ –≤–Є–і–µ –њ–Њ—З–Ї–∞–Љ–Є. –Р–љ–∞–ї–Є–Ј –њ–µ—З–µ–љ–Њ—З–љ–Њ–≥–Њ –њ—Г—В–Є –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –њ–∞–ї–Є–њ–µ—А–Є–і–Њ–љ–∞ –њ–Њ–Ї–∞–Ј—Л–≤–∞–µ—В –љ–∞–ї–Є—З–Є–µ 4 –Љ–µ—В–∞–±–Њ–ї–Є—В–Њ–≤; –і–Њ–ї—П –Ї–∞–ґ–і–Њ–≥–Њ –Є–Ј –љ–Є—Е –љ–µ –њ—А–µ–≤—Л—И–∞–µ—В 10% –Њ—В –љ–∞—З–∞–ї—М–љ–Њ–є –і–Њ–Ј—Л –њ–∞–ї–Є–њ–µ—А–Є–і–Њ–љ–∞. –Э–µ –Њ—В–Љ–µ—З–µ–љ–Њ –≤–ї–Є—П–љ–Є—П –њ–µ—З–µ–љ–Њ—З–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—Г—В–Є –љ–∞ –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Є–Ј–Њ—Н–љ–Ј–Є–Љ–Њ–≤ —Б–Є—Б—В–µ–Љ—Л —Ж–Є—В–Њ—Е—А–Њ–Љ–∞ P450. –Ґ–∞–Ї–Є–µ —Д–∞–Ї—В–Њ—А—Л, –Ї–∞–Ї –Ї—Г—А–µ–љ–Є–µ, –≤–Њ–Ј—А–∞—Б—В, –њ–Њ–ї –Є —А–∞—Б–Њ–≤–∞—П –њ—А–Є–љ–∞–і–ї–µ–ґ–љ–Њ—Б—В—М –љ–µ —П–≤–ї—П—О—В—Б—П —Д–∞–Ї—В–Њ—А–∞–Љ–Є, –Ј–љ–∞—З–Є–Љ–Њ –≤–ї–Є—П—О—Й–Є–Љ–Є –љ–∞ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ –њ–∞–ї–Є–њ–µ—А–Є–і–Њ–љ–∞ [6].
–Э–∞—А—Г—И–µ–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–Є –њ–Њ—З–µ–Ї –≤–ї–Є—П–µ—В –љ–∞ –Ї–ї–Є—А–µ–љ—Б –њ–∞–ї–Є–њ–µ—А–Є–і–Њ–љ–∞. –Я–Њ —Н—В–Њ–є –њ—А–Є—З–Є–љ–µ –і–Њ–Ј–∞ –њ–∞–ї–Є–њ–µ—А–Є–і–Њ–љ–∞ –і–Њ–ї–ґ–љ–∞ –±—Л—В—М —Г–Љ–µ–љ—М—И–µ–љ–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–Њ—З–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О; —В–∞–Ї–ґ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ –љ–µ —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –њ—А–Є –њ–Њ—З–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є —Б—В–µ–њ–µ–љ–Є [13].
–Я—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Г—З–Є—В—Л–≤–∞—В—М, —З—В–Њ –њ–∞–ї–Є–њ–µ—А–Є–і–Њ–љ –њ—А–Њ–љ–Є–Ї–∞–µ—В –≤ –≥—А—Г–і–љ–Њ–µ –Љ–Њ–ї–Њ–Ї–Њ; —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ–∞—Ж–Є–µ–љ—В–Ї–Є, –њ—А–Є–љ–Є–Љ–∞—О—Й–Є–µ –µ–≥–Њ, –і–Њ–ї–ґ–љ—Л –≤–Њ–Ј–і–µ—А–ґ–∞—В—М—Б—П –Њ—В –Ї–Њ—А–Љ–ї–µ–љ–Є—П –≥—А—Г–і—М—О [Gilday, 2012].
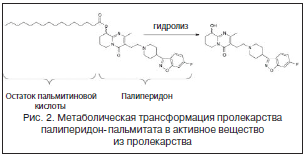
–Я–∞–ї–Є–њ–µ—А–Є–і–Њ–љ-–њ–∞–ї—М–Љ–Є—В–∞—В — —Н—В–Њ —Б–ї–Њ–ґ–љ—Л–є —Н—Д–Є—А, –љ–∞—Е–Њ–і—П—Й–Є–є—Б—П –≤ —Б–Њ—Б—В–Њ—П–љ–Є–Є —Б—В–∞–±–Є–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–љ–Њ–є —Б—Г—Б–њ–µ–љ–Ј–Є–Є. –Х–≥–Њ –≤–Њ–і–Њ—А–∞—Б—В–≤–Њ—А–Є–Љ–Њ—Б—В—М –Њ—З–µ–љ—М –љ–µ–≤–µ–ї–Є–Ї–∞. –Я–Њ—Б–ї–µ –Є–љ—К–µ–Ї—Ж–Є–Є –њ—А–µ–њ–∞—А–∞—В –Ї—А–∞–є–љ–µ –Љ–µ–і–ї–µ–љ–љ–Њ —А–∞—Б—В–≤–Њ—А—П–µ—В—Б—П –Є –≥–Є–і—А–Њ–ї–Є–Ј—Г–µ—В—Б—П –і–Њ –њ–∞–ї–Є–њ–µ—А–Є–і–Њ–љ–∞ —Д–µ—А–Љ–µ–љ—В–∞–Љ–Є –Љ—Л—И–µ—З–љ–Њ–є —В–Ї–∞–љ–Є (—А–Є—Б. 2). –°—А–µ–і–љ–µ–µ –Ј–љ–∞—З–µ–љ–Є–µ –≤—А–µ–Љ–µ–љ–Є –њ–Њ–ї—Г–≤—Л–≤–µ–і–µ–љ–Є—П –њ–∞–ї–Є–њ–µ—А–Є–і–Њ–љ-–њ–∞–ї—М–Љ–Є—В–∞—В–∞ –њ–Њ—Б–ї–µ –µ–і–Є–љ–Є—З–љ–Њ–є –Є–љ—К–µ–Ї—Ж–Є–Є –≤ –і–Њ–Ј–µ 50–150 –Љ–≥⋅—Н–Ї–≤ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 25–49 –і–љ–µ–є. –Ш–љ—К–µ–Ї—Ж–Є–Є –і–Њ–ї–ґ–љ—Л –њ—А–Њ–≤–Њ–і–Є—В—М—Б—П 1 —А–∞–Ј –≤ –Љ–µ—Б—П—Ж. –Я–Њ—Б—В—Г–њ–ї–µ–љ–Є–µ –њ–∞–ї–Є–њ–µ—А–Є–і–Њ–љ–∞ –≤ –Ї—А–Њ–≤—М –љ–∞—З–Є–љ–∞–µ—В—Б—П –≤ –і–µ–љ—М –Є–љ—К–µ–Ї—Ж–Є–Є –Є –њ—А–Њ–і–Њ–ї–ґ–∞–µ—В—Б—П –і–Њ 126 –і–љ—П [13]. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –њ–∞–ї–Є–њ–µ—А–Є–і–Њ–љ-–њ–∞–ї—М–Љ–Є—В–∞—В–∞ –љ–µ —В—А–µ–±—Г–µ—В –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–µ–≥–Њ –љ–∞—З–∞–ї—М–љ–Њ–≥–Њ –њ–µ—А–Є–Њ–і–∞ –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–≥–Њ –њ—А–Є–µ–Љ–∞ –Р–Я –і–Њ –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —Б—В–∞–±–Є–ї—М–љ–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є. –Ю–і–љ–∞–Ї–Њ –і–ї—П –Њ—Ж–µ–љ–Ї–Є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ —В–µ—Б—В–Њ–≤–Њ–є –і–Њ–Ј—Л –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–≥–Њ –њ–∞–ї–Є–њ–µ—А–Є–і–Њ–љ–∞ (–Є–ї–Є —А–Є—Б–њ–µ—А–Є–і–Њ–љ–∞) –њ–∞—Ж–Є–µ–љ—В–∞–Љ, –љ–µ –њ—А–Є–љ–Є–Љ–∞–≤—И–Є–Љ —А–∞–љ–µ–µ —Н—В–Њ—В –њ—А–µ–њ–∞—А–∞—В.
–Ш–љ—К–µ–Ї—Ж–Є–Є –њ–∞–ї–Є–њ–µ—А–Є–і–Њ–љ-–њ–∞–ї—М–Љ–Є—В–∞—В–∞ –Љ–Њ–≥—Г—В –±—Л—В—М –љ–∞–Ј–љ–∞—З–µ–љ—Л –≤ –і–Њ–Ј–∞—Е 50, 75, 100 –Є 150 –Љ–≥⋅—Н–Ї–≤, –Ї–Њ—В–Њ—А—Л–µ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—В —Б—Г—В–Њ—З–љ—Л–Љ –і–Њ–Ј–∞–Љ 3, 6, 9 –Є 12 –Љ–≥ –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–≥–Њ –њ–∞–ї–Є–њ–µ—А–Є–і–Њ–љ–∞. –Т —Б–ї—Г—З–∞–µ, –µ—Б–ї–Є –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –њ–µ—А–µ–≤–Њ–і —Б –і—А—Г–≥–Њ–≥–Њ –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –Р–Я-–њ—А–µ–њ–∞—А–∞—В–∞, –Є–љ—К–µ–Ї—Ж–Є—П –њ–∞–ї–Є–њ–µ—А–Є–і–Њ–љ-–њ–∞–ї—М–Љ–Є—В–∞—В–∞ –і–Њ–ї–ґ–љ–∞ –±—Л—В—М –њ—А–Њ–≤–µ–і–µ–љ–∞ –≤ —Б—А–Њ–Ї –Є –≤–Љ–µ—Б—В–Њ –њ—А–µ–і—Б—В–Њ—П—Й–µ–є –Є–љ—К–µ–Ї—Ж–Є–Є –њ—А–Њ–ї–Њ–љ–≥–∞. –Ф–Њ–Ј—Л –њ–∞–ї–Є–њ–µ—А–Є–і–Њ–љ-–њ–∞–ї—М–Љ–Є—В–∞—В–∞ 50, 75 –Є 100 –Љ–≥⋅—Н–Ї–≤ 1 —А–∞–Ј –≤ 4 –љ–µ–і. —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—В –і–Њ–Ј–∞–Љ 25, 37,5 –Є 50 –Љ–≥ 1 —А–∞–Ј –≤ 2 –љ–µ–і. –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ–Њ–є –Є–љ—К–µ–Ї—Ж–Є–Њ–љ–љ–Њ–є —Д–Њ—А–Љ—Л —А–Є—Б–њ–µ—А–Є–і–Њ–љ–∞ [6].
–Я—А–µ–њ–∞—А–∞—В –њ–Њ—Б—В–∞–≤–ї—П–µ—В—Б—П –≤ –≥–Њ—В–Њ–≤—Л—Е –Ї –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—О –Ј–∞–њ–Њ–ї–љ–µ–љ–љ—Л—Е —И–њ—А–Є—Ж–∞—Е –Є –љ–µ —В—А–µ–±—Г–µ—В —А–∞–Ј–≤–µ–і–µ–љ–Є—П. –•—А–∞–љ–µ–љ–Є–µ –Љ–Њ–ґ–µ—В –Њ—Б—Г—Й–µ—Б—В–≤–ї—П—В—М—Б—П –њ—А–Є –Ї–Њ–Љ–љ–∞—В–љ–Њ–є —В–µ–Љ–њ–µ—А–∞—В—Г—А–µ. –Ъ–∞–Ї —Г–ґ–µ —Г–њ–Њ–Љ–Є–љ–∞–ї–Њ—Б—М, –њ—А–µ–њ–∞—А–∞—В –і–Њ—Б—В—Г–њ–µ–љ –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –і–Њ–Ј–∞—Е: 78, 117, 156 –Є 234 –Љ–≥, —З—В–Њ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В 50, 75, 100 –Є 150 –Љ–≥ –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞ (–Љ–≥⋅—Н–Ї–≤). –Я–µ—А–≤—Л–µ –і–≤–µ –Є–љ—К–µ–Ї—Ж–Є–Є (–≤ 1-–є –Є –љ–∞ 8-–є –і–љ–Є) –і–Њ–ї–ґ–љ—Л –њ—А–Њ–≤–Њ–і–Є—В—М—Б—П –≤ –Њ–±–ї–∞—Б—В–Є –і–µ–ї—М—В–Њ–≤–Є–і–љ–Њ–є –Љ—Л—И—Ж—Л, –Њ–і–љ–∞–Ї–Њ –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–µ –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–Є–µ –Є–љ—К–µ–Ї—Ж–Є–Є –Љ–Њ–≥—Г—В –±—Л—В—М –ї–Њ–Ї–∞–ї–Є–Ј–Њ–≤–∞–љ—Л –Ї–∞–Ї –≤ –і–µ–ї—М—В–Њ–≤–Є–і–љ–Њ–є, —В–∞–Ї –Є –≤ —П–≥–Њ–і–Є—З–љ–Њ–є –Љ—Л—И—Ж–∞—Е –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –ґ–µ–ї–∞–љ–Є–µ–Љ –њ–∞—Ж–Є–µ–љ—В–∞. –Я—А–Є —Н—В–Њ–Љ —Б—З–Є—В–∞–µ—В—Б—П, —З—В–Њ –њ–Њ–ї–Њ–ґ–µ–љ–Є–µ —В–Њ—З–Ї–Є –Є–љ—К–µ–Ї—Ж–Є–Є –≤–ї–Є—П–µ—В –љ–∞ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ—Г—О –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –Ї—А–Њ–≤–Є: –њ—А–Є –Є–љ—К–µ–Ї—Ж–Є–Є –≤ m. gluteus —Н—В–Њ—В –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –Њ–Ї–∞–Ј—Л–≤–∞–µ—В—Б—П –љ–∞ 1/3 –љ–Є–ґ–µ, —З–µ–Љ –њ—А–Є –Є–љ—К–µ–Ї—Ж–Є–Є –≤ m. deltoideus [13].
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ
–Ф–µ–є—Б—В–≤–Є–µ –њ–∞–ї–Є–њ–µ—А–Є–і–Њ–љ-–њ–∞–ї—М–Љ–Є—В–∞—В–∞ –Њ—Ж–µ–љ–Є–≤–∞–ї–Њ—Б—М —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ–±–Њ—Б—В—А–µ–љ–Є–µ–Љ —И–Є–Ј–Њ—Д—А–µ–љ–Є–Є –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є 9- –Є 13-–љ–µ–і–µ–ї—М–љ—Л—Е –Ї—Г—А—Б–Њ–≤ —В–µ—А–∞–њ–Є–Є. –Ґ–∞–Ї–ґ–µ –±—Л–ї–∞ –њ—А–Њ–≤–µ–і–µ–љ–∞ –Њ—Ж–µ–љ–Ї–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –Ї–∞—З–µ—Б—В–≤–µ —Б—А–µ–і—Б—В–≤–∞ –і–ї–Є—В–µ–ї—М–љ–Њ–є –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–µ–є –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є, –љ–∞—З–Є–љ–∞—О—Й–µ–є—Б—П –њ–Њ—Б–ї–µ —Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–є —А–µ–Љ–Є—Б—Б–Є–Є. –Ш—Е —А–µ–Ј—Г–ї—М—В–∞—В—Л —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ–± —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ–∞–ї–Є–њ–µ—А–Є–і–Њ–љ-–њ–∞–ї—М–Љ–Є—В–∞—В–∞ –≤ –Ї–∞–ґ–і–Њ–Љ –Є–Ј —Н—В–Є—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є–є.
–Р–Ї—В–Є–≤–љ–∞—П —В–µ—А–∞–њ–Є—П
–Т —Б–µ—А–Є–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –±—Л–ї–∞ –њ–Њ–Ї–∞–Ј–∞–љ–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ–∞–ї–Є–њ–µ—А–Є–і–Њ–љ-–њ–∞–ї—М–Љ–Є—В–∞—В–∞ –≤ –і–Њ–Ј–µ 50–150 –Љ–≥⋅—Н–Ї–≤ —Б—Г–Љ–Љ–∞—А–љ–Њ —Г 1805 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ–±–Њ—Б—В—А–µ–љ–Є–µ–Љ —И–Є–Ј–Њ—Д—А–µ–љ–Є–Є. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В –≤ —Ж–µ–ї–Њ–Љ –Љ–Њ–ґ–µ—В –±—Л—В—М –Њ—Е–∞—А–∞–Ї—В–µ—А–Є–Ј–Њ–≤–∞–љ –Ї–∞–Ї –і–Њ–Ј–Њ–Ј–∞–≤–Є—Б–Є–Љ—Л–є. –Ю–њ—А–µ–і–µ–ї–µ–љ–љ—Л–є –і–Є–∞–њ–∞–Ј–Њ–љ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л—Е –і–Њ–Ј —Б–Њ–≤–њ–∞–ї —Б –і–Є–∞–њ–∞–Ј–Њ–љ–Њ–Љ –і–Њ—Б—В—Г–њ–љ—Л—Е –і–Њ–Ј–Є—А–Њ–≤–Њ–Ї –њ—А–µ–њ–∞—А–∞—В–∞, —Е–Њ—В—П –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—П–Љ–Є –њ–Њ–і—З–µ—А–Ї–Є–≤–∞–µ—В—Б—П, —З—В–Њ –і–∞–љ–љ—Л–µ –њ–Њ –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –њ—А–µ–њ–∞—А–∞—В –≤ –і–Њ–Ј–µ 150 –Љ–≥⋅—Н–Ї–≤, –љ—Г–ґ–і–∞—О—В—Б—П –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ —Г—В–Њ—З–љ–µ–љ–Є–Є. –°—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –Љ–Њ–ґ–µ—В –±—Л—В—М –Њ—В–љ–µ—Б–µ–љ–Њ —Г–ґ–µ –Ї 8-–Љ—Г –і–љ—О —В–µ—А–∞–њ–Є–Є. –Я–∞—Ж–Є–µ–љ—В–∞–Љ —Б –±–Њ–ї—М—И–µ–є –Њ—Б—В—А–Њ—В–Њ–є —Б–Њ—Б—В–Њ—П–љ–Є—П, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, —В—А–µ–±—Г–µ—В—Б—П –±—Л—Б—В—А–Њ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –і–Њ–Ј—Л –і–Њ —Г—А–Њ–≤–љ—П 150 –Љ–≥⋅—Н–Ї–≤ (—А–Є—Б. 3).
–Я–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–∞—П —В–µ—А–∞–њ–Є—П
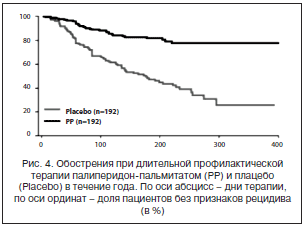
–Ю—Ж–µ–љ–Ї–∞ –і–ї–Є—В–µ–ї—М–љ–Њ–є –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–µ–є —В–µ—А–∞–њ–Є–Є –њ–∞–ї–Є–њ–µ—А–Є–і–Њ–љ-–њ–∞–ї—М–Љ–Є—В–∞—В–Њ–Љ –≤ —В–µ—З–µ–љ–Є–µ –њ–Њ–ї—Г—В–Њ—А–∞ –ї–µ—В –њ–Њ–Ї–∞–Ј–∞–ї–∞, —З—В–Њ –Љ–µ–і–Є–∞–љ–љ–Њ–µ –≤—А–µ–Љ—П –љ–∞—Б—В—Г–њ–ї–µ–љ–Є—П —А–µ—Ж–Є–і–Є–≤–∞ –≤ –≥—А—Г–њ–њ–µ –њ–ї–∞—Ж–µ–±–Њ —Б–Њ—Б—В–∞–≤–Є–ї–Њ 163 –і–љ—П, –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –і–ї—П —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–є –≥—А—Г–њ–њ—Л –љ–µ –Љ–Њ–ґ–µ—В –±—Л—В—М –Њ–њ—А–µ–і–µ–ї–µ–љ –Є–Ј-–Ј–∞ –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ —А–µ—Ж–Є–і–Є–≤–Њ–≤ (–Љ–µ–љ–µ–µ 25%). –Ю–±—Й–Є–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М —А–Є—Б–Ї–∞ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П —А–µ—Ж–Є–і–Є–≤–∞ —Б–Њ—Б—В–∞–≤–Є–ї –Љ–µ–љ–µ–µ 10% –≤ –≥—А—Г–њ–њ–µ –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–µ–є —В–µ—А–∞–њ–Є–Є –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б 35% –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ [12]. –†–µ–Ј—Г–ї—М—В–∞—В—Л –і–ї–Є—В–µ–ї—М–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є –і–Њ–Ј–∞–Љ–Є 75–100 –Љ–≥⋅—Н–Ї–≤ –њ–∞–ї–Є–њ–µ—А–Є–і–Њ–љ-–њ–∞–ї—М–Љ–Є—В–∞—В–∞ –≤ —В–µ—З–µ–љ–Є–µ –≥–Њ–і–∞ —В–∞–Ї–ґ–µ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ –µ–≥–Њ –≤—Л—Б–Њ–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є: 83% –±–µ–Ј—А–µ—Ж–Є–і–Є–≤–љ—Л—Е –љ–∞–±–ї—О–і–µ–љ–Є–є –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б 76% –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ (—А–Є—Б. 4).
–С–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –Є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М
–Т –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –±—Л–ї–Є –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ—Л —Б–ї–µ–і—Г—О—Й–Є–µ –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л–µ —П–≤–ї–µ–љ–Є—П, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ–Љ –њ–∞–ї–Є–њ–µ—А–Є–і–Њ–љ-–њ–∞–ї—М–Љ–Є—В–∞—В–∞: –±–Њ–ї–µ–Ј–љ–µ–љ–љ–Њ—Б—В—М –≤ –Љ–µ—Б—В–µ –Є–љ—К–µ–Ї—Ж–Є–Є, –≥–Њ–ї–Њ–≤–Њ–Ї—А—Г–ґ–µ–љ–Є–µ, —Н–Ї—Б—В—А–∞–њ–Є—А–∞–Љ–Є–і–љ—Л–µ —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞, –≤–Ї–ї—О—З–∞—П –∞–Ї–∞—В–Є–Ј–Є—О, –∞ —В–∞–Ї–ґ–µ —Б–µ–і–∞—Ж–Є—П. –І–∞—Б—В–Њ—В–∞ –Ї–∞–ґ–і–Њ–≥–Њ –Є–Ј –љ–Є—Е –љ–∞—Е–Њ–і–Є–ї–∞—Б—М –љ–∞ —Г—А–Њ–≤–љ–µ 5%. –С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ —Г—З–∞—Б—В–љ–Є–Ї–Њ–≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –і–Њ–Ј–µ 50–150 –Љ–≥⋅—Н–Ї–≤ –≤ —В–µ—З–µ–љ–Є–µ 25 –Є –±–Њ–ї–µ–µ –љ–µ–і–µ–ї—М —Е–Њ—А–Њ—И–Њ –њ–µ—А–µ–љ–Њ—Б–Є–ї–Є —В–µ—А–∞–њ–Є—О [25].
–Ф–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞—О—Й–Є—Е –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й—Г—О –Є–ї–Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї—Г—О —В–µ—А–∞–њ–Є—О –і–ї–Є—В–µ–ї—М–љ—Л–Љ–Є –Ї—Г—А—Б–∞–Љ–Є, –љ–µ–Њ–±—Е–Њ–і–Є–Љ –≤—Л–±–Њ—А –њ—А–µ–њ–∞—А–∞—В–∞ —Б –Љ–Є–љ–Є–Љ–∞–ї—М–љ—Л–Љ –њ–Њ—В–µ–љ—Ж–Є–∞–ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П —Н–љ–і–Њ–Ї—А–Є–љ–љ—Л—Е –Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є.
–≠—Д—Д–µ–Ї—В –≥–Є–њ–µ—А–њ—А–Њ–ї–∞–Ї—В–Є–љ–µ–Љ–Є–Є –њ—А–Є –ї–µ—З–µ–љ–Є–Є –њ–∞–ї–Є–њ–µ—А–Є–і–Њ–љ-–њ–∞–ї—М–Љ–Є—В–∞—В–Њ–Љ –≤ –±–Њ–ї—М—И–µ–є —Б—В–µ–њ–µ–љ–Є –≤—Л—А–∞–ґ–µ–љ —Г –ґ–µ–љ—Й–Є–љ –Є –Є–Љ–µ–µ—В —В–µ–љ–і–µ–љ—Ж–Є—О –Ї —Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є–Є –≤ —В–µ—З–µ–љ–Є–µ 1–2 –Љ–µ—Б. —В–µ—А–∞–њ–Є–Є. –Ю–љ –Љ–Њ–ґ–µ—В –±—Л—В—М –Њ—Е–∞—А–∞–Ї—В–µ—А–Є–Ј–Њ–≤–∞–љ –Ї–∞–Ї –і–Њ–Ј–Њ–Ј–∞–≤–Є—Б–Є–Љ—Л–є – –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л–µ —Б–ї—Г—З–∞–Є –±—Л–ї–Є —Б–≤—П–Ј–∞–љ—Л —Б –і–Њ–Ј–Њ–є –њ—А–µ–њ–∞—А–∞—В–∞ 150 –Љ–≥⋅—Н–Ї–≤ [7]. –Ґ–Њ –ґ–µ –Љ–Њ–ґ–љ–Њ —Б–Ї–∞–Ј–∞—В—М –Є –Њ–± —Н—Д—Д–µ–Ї—В–µ —Г–≤–µ–ї–Є—З–µ–љ–Є—П –Љ–∞—Б—Б—Л —В–µ–ї–∞ –љ–∞ 7% –Є –±–Њ–ї–µ–µ: 5% –±–Њ–ї—М–љ—Л—Е –њ—А–Є –Љ–Є–љ–Є–Љ–∞–ї—М–љ–Њ–є –і–Њ–Ј–µ, 8% – –њ—А–Є 100 –Љ–≥ 13% – –њ—А–Є 150 –Љ–≥⋅—Н–Ї–≤ –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б 5% –≤ –≥—А—Г–њ–њ–µ –њ–ї–∞—Ж–µ–±–Њ-–Ї–Њ–љ—В—А–Њ–ї—П. –Ґ–∞–Ї–ґ–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –љ–µ –Њ—В–Љ–µ—З–µ–љ–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є —Г—А–Њ–≤–љ—П –≥–ї—О–Ї–Њ–Ј—Л, –Є–љ—Б—Г–ї–Є–љ–∞ –Є –ї–Є–њ–Є–і–Њ–≤ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є – —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤, —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—Й–Є—Е –Њ —А–Є—Б–Ї–µ —А–∞–Ј–≤–Є—В–Є—П —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ – –њ—А–µ–і–±–Њ–ї–µ–Ј–љ–µ–љ–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П, –њ—А–µ–і—А–∞—Б–њ–Њ–ї–∞–≥–∞—О—Й–µ–≥–Њ –Ї —А–∞–Ј–≤–Є—В–Є—О —Б–∞—Е–∞—А–љ–Њ–≥–Њ –і–Є–∞–±–µ—В–∞, –≥–Є–њ–µ—А—В–Њ–љ–Є—З–µ—Б–Ї–Њ–Є̆ –±–Њ–ї–µ–Ј–љ–Є –Є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–Є̆ –±–Њ–ї–µ–Ј–љ–Є —Б–µ—А–і—Ж–∞ –Є –њ—А–Њ—П–≤–ї—П—О—Й–µ–≥–Њ—Б—П –∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ—Л–Љ –Њ–ґ–Є—А–µ–љ–Є–µ–Љ, –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–Є̆ –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–µ–Є̆ –Є —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —В–Њ–ї–µ—А–∞–љ—В–љ–Њ—Б—В–Є –Ї –≥–ї—О–Ї–Њ–Ј–µ.
–Я—А–µ–і—Б—В–∞–≤–ї—П—О—В –Є–љ—В–µ—А–µ—Б –і–∞–љ–љ—Л–µ L. Alphs –Є —Б–Њ–∞–≤—В. [2], –њ—А–Њ–∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–≤—И–Є—Е –і–∞–љ–љ—Л–µ –Њ 33 906 –Є–љ—К–µ–Ї—Ж–Є—П—Е –њ–∞–ї–Є–њ–µ—А–Є–і–Њ–љ-–њ–∞–ї—М–Љ–Є—В–∞—В–∞ 3817 –њ–∞—Ж–Є–µ–љ—В–∞–Љ –Є –Њ–±–љ–∞—А—Г–ґ–Є–≤—И–Є—Е, —З—В–Њ –љ–Є –≤ –Њ–і–љ–Њ–Љ –Є–Ј —Н—В–Є—Е —Б–ї—Г—З–∞–µ–≤ –љ–µ –±—Л–ї–Њ –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–Њ —А–∞–Ј–≤–Є—В–Є—П PDSS, –Є —В–Њ–ї—М–Ї–Њ 2 (0,006%) –Є–љ—К–µ–Ї—Ж–Є–Є —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–Є—Б—М —А–∞–Ј–≤–Є—В–Є–µ–Љ —Б–µ–і–∞—Ж–Є–Є —Б—А–µ–і–љ–µ–є —Б—В–µ–њ–µ–љ–Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є. –Я—А–µ–і–њ–Њ–ї–∞–≥–∞–µ—В—Б—П, —З—В–Њ, —Б –Њ–і–љ–Њ–є —Б—В–Њ—А–Њ–љ—Л, –Љ–µ–љ–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ (–њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Њ–ї–∞–љ–Ј–∞–њ–Є–љ–Њ–Љ) —Б–µ–і–∞—В–Є–≤–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ, —Б –і—А—Г–≥–Њ–є, – –Ј–∞–Љ–µ–і–ї–µ–љ–љ–∞—П —А–∞—Б—В–≤–Њ—А–Є–Љ–Њ—Б—В—М –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–є —Д–Њ—А–Љ—Л, –Ї–Њ—В–Њ—А–∞—П –љ–µ –Є–Ј–Љ–µ–љ—П–µ—В—Б—П –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –Њ–Ї—А—Г–ґ–∞—О—Й–Є—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–µ –і–µ–њ–Њ —Б—А–µ–і –Є —В–Ї–∞–љ–µ–є, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—В —В–∞–Ї–Њ–Љ—Г —Г–ї—Г—З—И–µ–љ–Є—О –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –Є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В–∞.
–° —Г—З–µ—В–Њ–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ–њ—Л—В–∞ –Є –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –≤—Л—И–µ–њ—А–Є–≤–µ–і–µ–љ–љ—Л—Е –≤—Л–≤–Њ–і–Њ–≤ –Љ–Њ–≥—Г—В –±—Л—В—М —Б—Д–Њ—А–Љ—Г–ї–Є—А–Њ–≤–∞–љ—Л –Њ–±—Й–Є–µ —Д–Њ—А–Љ–∞–ї–Є–Ј–Њ–≤–∞–љ–љ—Л–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ –њ—А–Њ–≤–µ–і–µ–љ–Є—О —В–µ—А–∞–њ–Є–Є –Є–љ—К–µ–Ї—Ж–Є–Њ–љ–љ—Л–Љ–Є –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є–Ї–∞–Љ–Є –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П (—А–Є—Б. 5). –Ъ–Њ–љ–Ї—А–µ—В–љ—Л–є –≤—Л–±–Њ—А –њ—А–µ–њ–∞—А–∞—В–∞ –њ—А–µ–і–ї–∞–≥–∞–µ—В—Б—П –Њ—Б–љ–Њ–≤—Л–≤–∞—В—М –љ–∞ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ–Љ –њ—А–Њ—Д–Є–ї–µ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П (—Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Ї—Г–њ–Є—А–Њ–≤–∞—В—М –њ—Б–Є—Е–Њ–Љ–Њ—В–Њ—А–љ–Њ–µ –≤–Њ–Ј–±—Г–ґ–і–µ–љ–Є–µ, –њ–Њ—В–µ–љ—Ж–Є–∞–ї –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –љ–∞ –њ—А–Њ–і—Г–Ї—В–Є–≤–љ—Г—О/–љ–µ–≥–∞—В–Є–≤–љ—Г—О —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї—Г –Є –і—А.), –∞ —В–∞–Ї–ґ–µ —Б —Г—З–µ—В–Њ–Љ –≤–Њ–њ—А–Њ—Б–Њ–≤ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –Є —Д–∞—А–Љ–∞–Ї–Њ—Н–Ї–Њ–љ–Њ–Љ–Є—З–µ—Б–Ї–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Я–Њ—А—П–і–Ї–∞ 80% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–µ—А–≤—Л–Љ —Н–њ–Є–Ј–Њ–і–Њ–Љ —И–Є–Ј–Њ—Д—А–µ–љ–Є–Є –і–Њ—Б—В–Є–≥–∞—О—В –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–є —А–µ–Љ–Є—Б—Б–Є–Є. –Ъ —Б–Њ–ґ–∞–ї–µ–љ–Є—О, –±–Њ–ї—М—И–∞—П –Є—Е —З–∞—Б—В—М —Б—В–∞–ї–Ї–Є–≤–∞–µ—В—Б—П —Б —А–µ—Ж–Є–і–Є–≤–∞–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –љ–∞—Б—В—Г–њ–∞—О—Й–Є–Љ–Є –њ—А–Є–Љ–µ—А–љ–Њ —Г 50% –Є–Ј –љ–Є—Е –≤ —В–µ—З–µ–љ–Є–µ 1–2 –ї–µ—В [19]. –Ю–і–љ–Њ–є –Є–Ј –њ—А–Є—З–Є–љ —Н—В–Њ–≥–Њ —П–≤–ї—П–µ—В—Б—П –≤—Л—Б–Њ–Ї–Є–є —Г–і–µ–ї—М–љ—Л–є –≤–µ—Б –Њ—В–Ї–∞–Ј–Њ–≤ –Њ—В –њ—А–Њ–≤–µ–і–µ–љ–Є—П –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–µ–є —В–µ—А–∞–њ–Є–Є. –Ш–Љ–µ–љ–љ–Њ –і–∞–љ–љ—Л–є —Д–∞–Ї—В –і–µ–ї–∞–µ—В —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ—Л–Љ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Є–љ—К–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ—Л—Е —Д–Њ—А–Љ –Р–Я-–њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Њ–њ—А–∞–≤–і–∞–љ–љ—Л–Љ –њ—А–Є–Љ–µ–љ–Є—В–µ–ї—М–љ–Њ –Ї–Њ –≤—Б–µ–Љ —Н—В–∞–њ–∞–Љ —В–µ—А–∞–њ–Є–Є. –Я—А–Њ–≥—А–µ—Б—Б —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є–Є, –Ї–Њ—В–Њ—А—Л–є –њ—А–Є–≤–µ–ї –Ї –њ–Њ—П–≤–ї–µ–љ–Є—О –≤—Л—Б–Њ–Ї–Њ—В–µ—Е–љ–Њ–ї–Њ–≥–Є—З–љ—Л—Е –Є –≤—Л—Б–Њ–Ї–Њ—Н—Д—Д–µ–Ї—В–Є–≤–љ—Л—Е –Р–Я-–њ—А–Њ–ї–Њ–љ–≥–Њ–≤ –љ–Њ–≤–Њ–≥–Њ –њ–Њ–Ї–Њ–ї–µ–љ–Є—П, –њ–Њ–Ј–≤–Њ–ї–Є—В —Г–ї—Г—З—И–Є—В—М –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є –Њ–њ—В–Є–Љ–Є–Ј–Є—А–Њ–≤–∞—В—М —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–µ –њ–Њ–і—Е–Њ–і—Л –Ї–∞–Ї –љ–∞ –∞–Ї—В–Є–≤–љ–Њ–Љ, —В–∞–Ї –Є –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–µ–Љ/–њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–Љ —Н—В–∞–њ–∞—Е –ї–µ—З–µ–љ–Є—П.
1 –Т —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є –љ–Њ–Љ–µ–љ–Ї–ї–∞—В—Г—А–Њ–є –љ–∞–Ј–≤–∞–љ–Є—П –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ—Л—Е —Н—Д–Є—А–Њ–≤ –і–Њ–ї–ґ–љ—Л –њ–Є—Б–∞—В—М—Б—П —Б–ї–Є—В–љ–Њ, –њ—А–Є —Н—В–Њ–Љ –љ–∞–Ј–≤–∞–љ–Є–µ —А–∞–і–Є–Ї–∞–ї–∞ –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П –≤ –Є–Љ–µ–љ–Є—В–µ–ї—М–љ–Њ–Љ –њ–∞–і–µ–ґ–µ, –∞ –Ї–Є—Б–ї–Њ—В–љ–Њ–≥–Њ –Њ—Б—В–∞—В–Ї–∞ — —Б —Б—Г—Д—Д–Є–Ї—Б–Њ–Љ «-–∞—В» (–љ–∞–њ—А., –≥–∞–ї–Њ–њ–µ—А–Є–і–Њ–ї–і–µ–Ї–∞–љ–Њ–∞—В). –Я–Њ—Б–Ї–Њ–ї—М–Ї—Г —В–∞–Ї–Њ–µ –љ–∞–њ–Є—Б–∞–љ–Є–µ –љ–µ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В —Б–ї–Њ–ґ–Є–≤—И–µ–є—Б—П –≤ —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є–Є —В—А–∞–і–Є—Ж–Є–Є, –Љ—Л –≤ –љ–∞—Б—В–Њ—П—Й–µ–є —А–∞–±–Њ—В–µ –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ «–њ—А–Њ–Љ–µ–ґ—Г—В–Њ—З–љ—Л–є» –≤–∞—А–Є–∞–љ—В —Б –љ–∞–њ–Є—Б–∞–љ–Є–µ–Љ —З–µ—А–µ–Ј –і–µ—Д–Є—Б (–≥–∞–ї–Њ–њ–µ—А–Є–і–Њ–ї-–і–µ–Ї–∞–љ–Њ–∞—В). –Т –њ—А–Њ—В–Є–≤–Њ–њ–Њ–ї–Њ–ґ–љ–Њ—Б—В—М —Н—В–Њ–Љ—Г, –љ–∞–Ј–≤–∞–љ–Є—П —Б–Њ–ї–µ–є –њ–Є—И—Г—В—Б—П –љ–∞–Љ–Є —Б–Њ–≥–ї–∞—Б–љ–Њ –љ–Њ–Љ–µ–љ–Ї–ї–∞—В—Г—А–µ – —А–∞–Ј–і–µ–ї—М–љ–Њ —Б –љ–∞–Ј–≤–∞–љ–Є–µ–Љ –Ї–∞—В–Є–Њ–љ–∞ –≤ —А–Њ–і–Є—В–µ–ї—М–љ–Њ–Љ –њ–∞–і–µ–ґ–µ, –∞–љ–Є–Њ–љ–∞ — –≤ –Є–Љ–µ–љ–Є—В–µ–ї—М–љ–Њ–Љ (–љ–∞–њ—А., –Њ–ї–∞–љ–Ј–∞–њ–Є–љ–∞ –њ–∞–Љ–Є–∞—В).
2 –Я—А–µ–њ–∞—А–∞—В –њ—А–Њ–Є–Ј–≤–Њ–і–Є—В—Б—П –Ї–Њ–Љ–њ–∞–љ–Є–µ–є –ѓ–љ—Б—Б–µ–љ –Є –њ–Њ—Б—В–∞–≤–ї—П–µ—В—Б—П –≤ –†–§ –њ–Њ–і —В–Њ—А–≥–Њ–≤–Њ–є –Љ–∞—А–Ї–Њ–є –†–Є—Б–њ–Њ–ї–µ–њ—В –Ъ–Њ–љ—Б—В–∞.
3 –Я—А–µ–њ–∞—А–∞—В Zyprexa RELPREVV –Ї–Њ–Љ–њ–∞–љ–Є–Є «–≠–ї–Є-–Ы–Є–ї–ї–Є» –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –і–ї—П –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –≤ –†–§ –љ–µ –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ.
4 –Ґ–Њ—З–љ—Л–є –Љ–µ—Е–∞–љ–Є–Ј–Љ —Н—В–Њ–≥–Њ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –і–Њ –Ї–Њ–љ—Ж–∞ –љ–µ –≤—Л—П—Б–љ–µ–љ. –Ю–і–љ–Њ –Є–Ј –≤–Њ–Ј–Љ–Њ–ґ–љ—Л—Е –Њ–±—К—П—Б–љ–µ–љ–Є–є —Б–Њ—Б—В–Њ–Є—В –≤ —В–Њ–Љ, —З—В–Њ —Б–ї—Г—З–∞–є–љ–Њ–µ –њ–Њ–њ–∞–і–∞–љ–Є–µ –Є–љ—К–µ–Ї—Ж–Є–Њ–љ–љ–Њ–є –Є–≥–ї—Л –≤ —Б–Њ—Б—Г–і –Љ–µ–ї–Ї–Њ–≥–Њ –Ї–∞–ї–Є–±—А–∞ –Є–ї–Є –≤ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –≥—Г—Б—В—Г—О –Ї–∞–њ–Є–ї–ї—П—А–љ—Г—О —Б–µ—В—М –≤ —В–Њ–ї—Й–µ –Љ—Л—И–µ—З–љ–Њ–є —В–Ї–∞–љ–Є –њ—А–Є–≤–Њ–і–Є—В –Ї –њ—А–Њ–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—О –љ–µ—А–∞—Б—З–µ—В–љ–Њ–є –і–Њ–Ј—Л –Њ–ї–∞–љ–Ј–∞–њ–Є–љ–∞ — –≤—Л—Б–Њ–Ї–Њ–њ–Њ—В–µ–љ—В–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ —Б –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ —Б–µ–і–∞—В–Є–≤–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ — –≤ —Б–Њ—Б—Г–і–Є—Б—В–Њ–µ —А—Г—Б–ї–Њ. –Т —Г—Б–ї–Њ–≤–Є—П—Е –љ–µ–њ—А–µ—А—Л–≤–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –і–Є—Б—Б–Њ—Ж–Є–∞—Ж–Є—П –њ–∞–Љ–Њ–∞—В–∞ –Њ–ї–∞–љ–Ј–∞–њ–Є–љ–∞ –Љ–љ–Њ–≥–Њ–Ї—А–∞—В–љ–Њ —Г—Б–Ї–Њ—А—П–µ—В—Б—П, –Є –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ –њ–Њ–≤—Л—И–µ–љ–Є–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –Њ–ї–∞–љ–Ј–∞–њ–Є–љ–∞ –≤ –Ї—А–Њ–≤–Є, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–µ–µ—Б—П —Б–Є–Љ–њ—В–Њ–Љ–∞–Љ–Є PDSS. –°–њ–Њ–љ—В–∞–љ–љ–Њ–µ —А–∞–Ј—А–µ—И–µ–љ–Є–µ –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –≤ –і–Є–∞–њ–∞–Ј–Њ–љ–µ 3–72 —З. –Ь–µ–і–Є—Ж–Є–љ—Б–Ї–∞—П –њ–Њ–Љ–Њ—Й—М –Њ–±—Л—З–љ–Њ –Њ–≥—А–∞–љ–Є—З–Є–≤–∞–µ—В—Б—П –љ–∞–±–ї—О–і–µ–љ–Є–µ–Љ —Б –Ї–Њ–љ—В—А–Њ–ї–µ–Љ –≤–Є—В–∞–ї—М–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є. –Ъ—Г–Љ—Г–ї—П—В–Є–≤–љ—Л–є —А–Є—Б–Ї –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П PDSS —Г –њ–∞—Ж–Є–µ–љ—В–∞ –≤ —В–µ—З–µ–љ–Є–µ –≥–Њ–і–∞ –њ—А–Є –њ–Њ—Б—В–Њ—П–љ–љ–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞ –Њ—Ж–µ–љ–Є–≤–∞–µ—В—Б—П –≤ 0,7–1,2% [26].
![–†–Є—Б. 3. –≠—Д—Д–µ–Ї—В —А–∞–Ј–љ—Л—Е –і–Њ–Ј –њ–∞–ї–Є–њ–µ—А–Є–і–Њ–љ-–њ–∞–ї—М–Љ–Є—В–∞—В–∞ (–†–†) –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –њ–ї–∞—Ж–µ–±–Њ (Placebo) –њ—А–Є –ї–µ—З–µ–љ–Є–Є –Њ–±–Њ—Б—В—А–µ–љ–Є—П —Г –±–Њ–ї—М–љ—Л—Е —И–Є–Ј–Њ—Д—А–µ–љ–Є–µ–є; —А–∞–Ј–Љ–µ—А —Н—Д—Д–µ–Ї—В–∞ —А–∞—Б—Б—З–Є—В–∞–љ –њ–Њ –Є–Ј–Љ–µ–љ–µ–љ–Є—О —Б—Г–Љ–Љ–∞—А–љ–Њ–≥–Њ –±–∞–ї–ї–∞ PANSS [–і–∞–љ–љ—Л–µ Gopal S., 2011; Kramer M., 2010; Nasrallah H.A., 2010; Pandina, 2010]](/data/articles/Image/t21/n30/1610-4.gif)
![–†–Є—Б. 5. –Р–ї–≥–Њ—А–Є—В–Љ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Р–Я-—В–µ—А–∞–њ–Є–Є —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –њ–µ—А–Њ—А–∞–ї—М–љ—Л—Е –Є –і–µ–њ–Њ–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е (–Ф–Р–Я) –Є–љ—К–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ [–њ–Њ E. Stip [30], —Б –Є–Ј–Љ.]](/data/articles/Image/t21/n30/1610-6.gif)
–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. –Р–≤–µ–і–Є—Б–Њ–≤–∞ –Р.–°., –ѓ—Б—В—А–µ–±–Њ–≤ –Ф.–Т. –Є –і—А. –Ь–Њ—В–Є–≤—Л –Њ—В–Ї–∞–Ј–Њ–≤ –±–Њ–ї—М–љ—Л—Е —И–Є–Ј–Њ—Д—А–µ–љ–Є–µ–Є̆ –Њ—В –і–ї–Є—В–µ–ї—М–љ–Њ–Є̆ –∞–љ—В–Є–њ—Б–Є—Е–Њ—В–Є—З–µ—Б–Ї–Њ–Є̆ —В–µ—А–∞–њ–Є–Є // –Я—Б–Є—Е–Є–∞—В—А–Є—П –Є –њ—Б–Є—Е–Њ—Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є—П. 2009.
2. Alps L., Gopal S. et al.. Are the Long-Acting Intramuscular Formulations of Risperidone or Paliperidone Palmitate Associated with Post-Injection Delirium/Sedation Syndrome? An Assessment of Safety Databases // Current Drug Safety. 2011. Vol. 6. P. 43–45.
3. Ascher-Svanum H., Montgmery W. et al. Treatment completion rates of olanzapine and risperidone in long acting injectable formulations for the treatment of schizophrenia: a comparison of single arm open-label studies // Schizophr. Res. 2008 (Suppl. 2). P. 278.
4. Basu A., Pereira J. et al. The pharmacological management of schizophrenia // Sem. General Adult Psychiatry. 2007. P. 238–294.
5. Chue P., Eerdekens M. et al. Efficacy and safety of long-acting risperidone microspheres and risperidone oral tablets // Schizophr. Res. 2002. Vol. 53 (Suppl. 3). P. 174–175.
6. Citrome L. Paliperidone palmitate: review of the efficacy, safety, and cost of a new second-generation depot antipsychotic medication // Int. J. Clin. Pract. 2010. Vol. 64. P. 216–239.
7. Coppola D., Liu Y. A one-year prospective study of the safety, tolerability and pharmacokinetics of the highest available dose of paliperidone palmitate in patients with schizophrenia. BMC Psychiatry 2012, 12:26
8. Gopal S., Vijapurkar U. et al. A 52-week open-label study of the safety and tolerability of paliperidone palmitate in patients with schizophrenia // J. Psychopharmacol. 2011. Vol. 25(5). P. 685–697.
9. Gulliver A., Detke H., McDonnell D.P. Olanzapine long acting injection: pharamcokinetics and dose correspondence data relative to oral olanzapine // Int. J. Neuropsychopharamcol. 2008. Vol. 11(Suppl. 1). P. 152–153.
10. Hirsch S.R., Gaind R. et al. Outpatient maintenance of chronic schizophrenic patients with long acting phenothiazines // BMJ. 1973; i: 633–637.
11. Hogarty G.E., Schooler N.R. et al. Fluphenazine and social therapy in the aftercare of schizophrenic patients. Relapse analyses of a two-year controlled study of fluphenazine decanoate and fluphenazine hydrochloride // Arch. Gen. Psychiatry. 1979. Vol. 36. P. 1283–1294.
12. Hough D., Gopal S. et al. Paliperidone palmitate maintenance treatment in delaying the time-to- relapse in patients with schizophrenia: a randomized, double-blind, placebo-controlled study // Schizophr. Res. 2010. Vol. 116(2–3). P. 107–117.
13. Hoy S.M., Scott L.J., Keating G.M. Intramuscular paliperidone palmitate // CNS Drugs. 2010. Vol. 24. P. 227–244.
14. Johnson D.A.W. Observations on the use of long-acting depot neuroleptic injections in the maintenance treatment of schizophrenia // J. Clin. Psychiatry. 1984. Vol. 45. P. 13–21.
15. Johnson D.A.W. United Kingdom: neuroleptic relapse prevention // Guidelines for Neuroleptic Relapse Prevention in Schizophrenia (–њ–Њ–і —А–µ–і. W. Kissling). Springer, 1991. P. 45.
16. Johnson D.A.W. Historical perspective on antipsychotic long-acting injections // Brit. J. Psychiatry. 2009. Vol. 195. S. 7–12.
17. Kissling W. (—А–µ–і). Neuroleptic relapse prevention // Guidelines for Neuroleptic Relapse Prevention in Schizophrenia. Springer, 1991. P. 50–52.
18. Kramer M., Litman R. et al. Paliperidone palmitate, a potential long-acting treatment for patients with schizophrenia. Results of a randomized, double-blind, placebo-controlled efficacy and safety study // Int. J. Neuropsychopharmacol. 2010. Vol. 13(5). P. 635–647.
19. Leucht C., Heres S. et al. Oral versus depot antipsychotic drugs for schizophrenia — a critical systematic review and meta-analysis of randomised long-term trials // Schizophr. Res. 2011. Vol. 127, вДЦ 1–3. P. 83–92.
20. Lieberman J.A., Stroup T.S. et al. Effectiveness of antipsychotic drugs in patients with chronic schizophrenia // N. Engl. J. Med. 2005. Vol. 353. P. 1209–1223.
21. Lindenmayer J.P. Long-acting injectable antipsychotics: focus on olanzapine pamoate // Neuropsychiatr. Dis. Treat. 2010. Vol. 24 (6). P. 261–267.
22. Marcus S.C., Olfson M. Outpatient antipsychotic treatment and inpatient costs of schizophrenia // Schizophr. Bull. 2008. Vol. 34 (1). P. 173–180.
23. Markowitz M., Fu D.-J. –Є –і—А. Long-acting injectable paliperidone palmitate versus oral paliperidone extended release: a comparative analysis from two placebo-controlled relapse prevention studies. Annals of General Psychiatry. 2013, 12: 22.
24. Nasrallah H. A. The case for long-acting antipsychotic agents in the post-CATIE era // Acta Psychiatr. Scand. 2007. Vol. 115. P. 260–267.
25. Nasrallah H.A., Gopal S. et al. A controlled, evidence-based trial of paliperidone palmitate, a long-acting injectable antipsychotic, in schizophrenia // Neuropsychopharmacol. 2010. Vol. 35(10). P. 2072–2082.
26. Novakovic V., Adel T. et al. Long-acting injectable antipsychotics and the development of postinjection delirium/sedation syndrome (PDSS) // Clin. Neuropharmacol. 2013. Vol. 36(2). P. 59–62.
27. Pietzcker A., Gaebel W. et al. A German multicenter study on the neuroleptic long-term therapy of schizophrenic patients // Pharmacopsychiatry. 1986. Vol. 19. P. 161–166.
28. Rifkin A., Quitkin F., Rabiner C.J. Fluphenazine decanoate, fluphenazine hydrochloride given orally and placebo in remitted schizophrenia: relapse rate over one year // Arch. Gen. Psychiatry. 1977. Vol. 34. P. 43–47.
29. Schooler N.R., Levine J. et al. Prevention of relapse in schizophrenia: an evaluation of fluphenazine decanoate // Arch. Gen. Psychiatry. 1980. Vol. 37. P. 16–24.
30. Stip E., Abdel-Baki A. et al. An expert opinion from the Association des médecins psychiatres du Québec // Can. J. Psychiatry. 2011. Vol. 56, вДЦ 6. P. 367–376.
31. Zhornitsky S., Stip E. Oral versus long-Acting injectable antipsychotics in the treatment of schizophrenia and special populations at risk for treatment nonadherence: a systematic review // Schizophr. Res. Treatment. 2012. 12 p.












