Respiratory infections play an important role in the pathogenesis of bronchial asthma by deteriorating the mucociliary neurogenic regulation of bronchial smooth muscle tone, resulting in respiratory epithelial damage and increasing vascular permeability, enhancing IgE production, etc. Associated bronchial hyperreactivity leads to the development and exacerbation of bronchial asthma.
Е.О. Балкарова — НИИ Пульмонологии МЗ РФ, Москва
А.Г. Чучалин — академик, директор НИИ Пульмонологии МЗ РФ, Москва
Ye.O. Balkarova — Research Institute of Pulmonology, Ministry of Health of the Russian Federation, Moscow
A.G. Chuchalin — Academician, Director, Research Institute of Pulmonology, Ministry of Health of the Russian Federation, Moscow
Современное определение бронхиальной астмы (БА), предложенное в Международном соглашении по БА (GINA, 1995), трактует астму как хронический воспалительный процесс нижних дыхательных путей (ДП). Эта концепция отражает важное патогенетическое значение инфекционного звена в формировании БА [1, 2]. Показано, что одним из факторов, способствующих развитию БА и вызывающих ее обострение, является респираторная вирусная инфекция [1, 3 – 8].
В основу современной классификации вирусов заложены тип нуклеиновой кислоты, наличие или отсутствие суперкапсида (внешней оболочки), позитивность или негативность генома, механизм репликации. Вирусы человека и животных включают 17 семейств, причем 8 из них составляют патогенные респираторные вирусы, способные вызывать патологию ДП (табл. 1).
Наиболее значимыми в отношении патологии ДП у пациентов с БА являются вирусы гриппа, парагриппа типов 1, 2, 3, РС-вирус, риновирусы и аденовирусы.
Заболевания, вызываемые вирусами, известны с древнейших времен. Так, грипп был описан как “итальянская лихорадка” еще в VI – X веках до н.э. Впервые достоверное описание гриппа (от фр. “la grippe” – охватывать) сделал французский исследователь Паскье в 1403 г.
В 1957 г. Chanock и Finberg (США) выделили РС-вирус у детей с поражениями нижних ДП. РС-вирусная патология широко распространена в мире и считается ведущей в патологии нижних ДП человека.
Риновирусная инфекция (заразный насморк-common cold) была известна еще 60 лет назад. Более полно эта инфекция была изучена в начале 60-х годов, когда Tyrell и соавт. выделили цитопатогенные вирусы, вызывающие болезнь. Риновирус имеет глобальное распространение.
Изучение группы аденовирусных болезней началось с 1953 г. Rowe и соавт. впервые выделили штаммы нового вируса из удаленных у детей аденоматозных полипов и миндалин и культивировали их по методу Enders на тканях, в которых они вызывали дегенерацию, в связи с чем эти вирусы получили название “adenoid degeneration”. Термин “аденовирусы” был предложен Enders и соавт. в 1956 г. Распространены они повсеместно и циркулируют круглогодично.
Таблица 1. Респираторные вирусы, способные вызывать патологию ДП
|
Семейство |
Род |
Вид |
Уровень поражения ДП |
| РНК-вирусы: | |||
| Orthomyxoviridae | Influenzavirus | Грипп А,В,С | Трахеит |
| Paramyxoviridae | Paramyxovirus | Парагрипп типов 1 – 4 | Ларингит |
| Pneumovirus | РС-вирус | Бронхит, бронхиолит | |
| Morbillivirus | Вирус кори | Ринофарингит | |
| Picornaviridae | Rhinovirus C | Риновирус типов 1 – 113 | Ринит |
| Enterovirus | Вирусы Коксаки, ЕСНО | Ринофарингит | |
| Coronaviridae | Coronavirus | Коронавирус человека, млекопитающих, птиц | Ринит |
| Reoviridae | Reovirus | Реовирусы человека | Ринофарингит |
| Rotavirus | Ротавирусы человека | Ларингит | |
| ДНК-вирусы: | |||
| Adenoviridae | Mastadenovirus | Аденовирусы человека и млекопитающих | Фаринготонзиллит |
| Herpetoviridae | |||
| a-herpesviridae b-herpesviridae Gammaherpesviridae |
Simplexvirus Cytomegalovirus Lymphocruptovirus |
Вирусы герпеса HSV1,2, цитомегаловирус человека Вирус Эпштейна-Барр | Вторичная пневмония |
Таблица 2. Респираторные вирусы, приводящие к обострению БА в различных возрастных группах
|
Возраст |
Респираторный вирус |
| До 4 лет | РС-вирус, вирус парагриппа типов 1 – 3, вирусы гриппа, коронавирус |
| 5 – 16 лет | Риновирус, вирусы гриппа, вирусы парагриппа типов 1 – 3, РС-вирус |
| Взрослые | Вирусы гриппа, риновирус, РС-вирус |
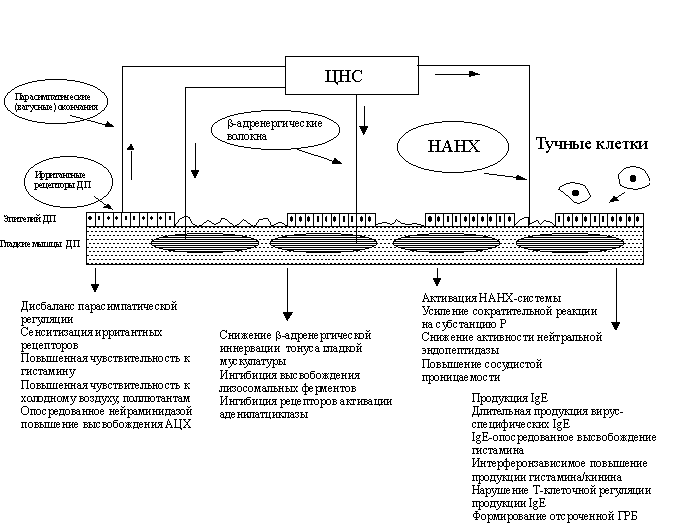
Рис. 1. Факторы, способствующие изменению реактивности ДП после РВИ [9].
В 1956 г. Chanock описал вирус СА (croup associated), который затем был назван вирусом парагриппа, поскольку имеет много общего с вирусом гриппа. Он также широко распространен.
Биологические свойства вирусов, так же как и особенности макроорганизма, определяют поражение того или иного отдела респираторного тракта и, следовательно, клинические проявления заболевания. Возраст пациентов до некоторой степени обусловливает восприимчивость к различным группам вирусов [8], способствующих обострению и развитию БА (табл. 2).
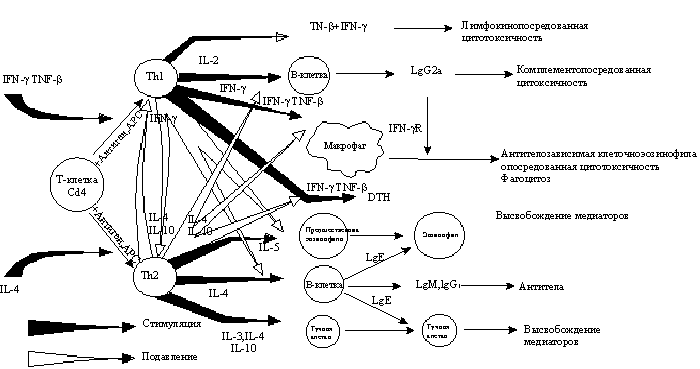
Рис. 2. Регуляция взаимодействия клеток и развитие аллергической реакции [24].
В современной литературе важное значение в формировании БА придается хроническим респираторно-вирусным инфекциям (РВИ) [9]. Известно,что продуктивный тип взаимодействия вируса с клеткой может приводить к длительной персистенции вируса, в то время как интегративный тип обусловливает латентное течение заболевания и вирусоносительство. Особенностью данного типа взаимодействия является и то, что под действием ряда физических и химических факторов репродукция вируса может повторяться и этот процесс может иметь длительное, иногда пожизненное течение [10].
Таблица 3. Сезонность распространения респираторных вирусов, ассоциированных с обострением БА
|
Вирусы |
Время года |
| РС-вирус | Зима, начало весны |
| Вирус парагриппа | Осень, весна |
| Вирус гриппа | Зима |
| Риновирус | Осень, весна – лето |
| Коронавирус | Зима |
| Аденовирус | Круглогодично |
Острые РВИ возникают в виде эпидемических вспышек, при этом патогенные свойства вирусов изменяются в зависимости от времени года (табл. 3), что необходимо учитывать при профилактике обострений у пациентов с БА .
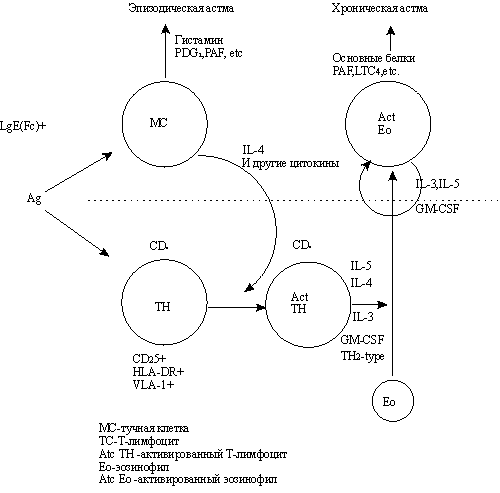
Рис. 3. Механизмы развития эпизодической и хронической астмы на фоне аллергического воспаления.
Один из важных компонентов патогенного воздействия РВИ – ухудшение мукоцилиарного клиренса и облегчение продвижения бактерий в нижние отделы ДП, а также подавление фагоцитарной активности альвеолярных макрофагов с блокадой внутриклеточных бактерицидных процессов [6, 11, 12]. В результате этого создаются условия для присоединения бактериальной инфекции и формирования вирусно-бактериальных ассоциаций [13, 14]. Микст-инфекция приводит к более тяжелому течению обострений и изменению клинической картины заболевания [6, 7]. Чаще всего при РВИ выявляется инфицирование Mycoplasma pneumonia, что приводит к более тяжелому течению обострения БА. Смешанная гриппозно-аденовирусная инфекция регистрируется в 10 – 15% случаев во время эпидемии гриппа. В межэпидемическое время сочетание парагриппа и аденовирусной инфекции отмечается в 2,5 – 4% случаев. Особенностями клинической картины обострения БА на фоне этой инфекции являются выраженный интоксикационный синдром, увеличение лихорадочного периода, преобладание признаков воспаления верхних ДП. Сочетание РС-вирусной инфекции с какой-либо другой вирусной или бактериальной инфекцией чаще приводит к обострению хронических заболеваний респираторного тракта.
Таблица 4. Противовирусные препараты
|
Препарат |
Активность в отношении РВН |
Механизм действия |
Дозировки |
Основные побочные реакции |
| Ремантадин | Грипп (профилактика) |
Блокирует включение вируса в клетки хозяина | 0,1 г 2 раза в сутки, курс – 10 – 15 сут | Диспепсические явления, депрес сия, кожный зуд |
| Ацикловир | Herpes simplex 1 и 2 | Блокирует репликацию ДНК, селективно воздействует на ДНК-полимеразу | 200 – 400 мг каждые 6 ч | Диспепсические явления, аллергические кожные реакции |
| Ганцикловир | H. simplex 1 и 2 | Подавляет ДНК-полимеразу вируса | 10 – 20 мг каждые 6 ч | Рвота, диарея, тромбо- и лейкопения |
| Рибавирин | РС-вирус, повторное инфицирование гриппом А и В | Множественный механизм действия на белковый синтез вируса | Начально – 2 мг, затем по 1 мг через 6 ч(4 дня), по 0,5 мг через6 ч (4 дня) | Снижение вентиляционных показателей легких |
| Азидотимидин | РС-вирус, грипп А и В | Изменяет уровень транскриптазы(вирусной ДНК-полимеразы) | То же | Диспепсические явления |
| Фоскарнет | H.simplex 1 и 2, ретровирусы | Изменяет уровень транскриптазы(вирусной ДНК-полимеразы) | 10 – 20 мг каждые 6 ч | Диарея, тошнота |
| Интерферон | ДНК- и РНК-вирусы | Селективно блокирует транскрипцию вирусной ДНК (РНК) | 5 капель раствора 2 раза в сутки |
Аллергические кожные реакции |
| Оксолин (мазь, капли) |
Грипп А и В, аденовирусы, H.simplex 1 и 2(профилактика) | Блокирует включение вируса в клетки хозяина | Мазь для носа, глазные капли |
РВИ провоцирует обострения БА, очевидно также участие РВИ в формировании гиперреактивности бронхов (ГРБ) у здоровых. Механизмы этого воздействия изучены не полностью, однако известно, что при РВИ выявляются функциональные и патоморфологические изменения ДП: изменение нейрогенной регуляции тонуса гладкой мускулатуры бронхов, повреждение эпителия ДП, повышение сосудистой проницаемости, продукции IgE, развитие поздних аллергических реакций. Все эти механизмы участвуют в формировании ГРБ, обусловливающей развитие и обострение БА [12, 13]. Подробнее каждый из перечисленных механизмов будет рассмотрен ниже.
Нейрогенная регуляция
Нейрогенные механизмы — одно из важных звеньев в патогенезе ГРБ. РВИ является одним из факторов, приводящих к нарушениям нейрогенной регуляции тонуса гладкой мускулатуры бронхов [15]. Исследования последних лет продемонстрировали роль дисбаланса между возбуждающими и тормозящими путями адренергической, холинергической иннерваций, а также, так называемой неадренергической нехолинергической системы (НАНХ). Факторы развития синдрома ГРБ при вирусной инфекции представлены на рис. 1.
Воздействие вирусного агента, приводя к десквамации эпителиальных клеток ДП, активизирует ирритантные рецепторы, что проявляется гипервосприимчивостью к ингаляционным патогенам, холодному воздуху, поллютантам окружающей среды. В совокупности с повышенной чувствительностью вагусных окончаний этот процесс может вызывать бронхиальную обструкцию.
Определенное значение в нарушении регуляции тонуса гладкой мускулатуры ДП придается степени адренергического дисбаланса (снижению b- и возрастанию a-адренергической активности), возникающего при РВИ [8, 15].
Особый интерес представляет автономная НАНХ-система. Медиаторы этой системы – нейропептиды, образующиеся в эндокринно-активных клетках слизистой оболочки ДП, – включают регуляторные пептиды с бронходилатирующим (гистидин-метионин, вазоактивный интестинальный пептид) и бронхоконстрикторным (субстанция Р, тахикинин, галанин, нейропептид U, кальциеподобный пептид) действием. Ряд исследователей подтверждает важное значение субстанции Р как активного медиатора воспаления. Вирусная инфекция, вызывая снижение активности нейтральной пептидазы, усиливает действие субстанции Р [16]. Регуляторные пептиды имеют важное значение в развитии ГРБ при вирусной инфекции.
Повреждение эпителия
Острое катаральное воспаление, развивающееся под действием респираторных вирусов, приводит к десквамации эпителия ДП [1]. В зависимости от рода вируса повреждающее действие затрагивает разные уровни респираторного тракта (см. табл. 1).
Патогенное действие РВИ определяется несколькими механизмами. Во-первых, это непосредственное повреждающее действие вирусной частицы на цилиндрический мерцательный эпителий, вследствие чего облегчается доступ патологических агентов (антигенов) и макромолекул к подслизистому слою. Это подтверждено экспериментально: механическое удаление эпителия усиливает констрикторный эффект спазмогенов [17]. Во-вторых, поврежденные клетки эпителия высвобождают медиаторы воспаления, воздействующие на субэпителиальные чувствительные рецепторы и нервные окончания, приводя к активации нервно-рефлекторных механизмов. Кроме того, РВИ приводит к снижению функциональной активности мерцательного эпителия с последующей атрофией ресничек и “параличом” цилиарного аппарата. В результате этого повышается вязкость бронхиального секрета и создаются условия для продвижения инфекционного агента в нижние отделы респираторного тракта. Определенное значение придается также назовагусному рефлексу, посредством которого респираторный вирус может способствовать формированию ГРБ и бронхообструкции.
Формирование ГРБ в ответ на альтерацию эпителия подтверждено в ряде экспериментов. Так, при изучении свойств трахеи человека, инкубировавшейся с вирусом гриппа, были отмечены выраженная десквамация эпителиальных клеток, усиление ответа на воздействие субстанции Р и снижение активности нейтральной эндопептидазы – энзима, ингибирующего субстанцию Р [18].
Следующим этапом в патогенезе ГРБ является изменение клеточного аппарата эпителия ДП и вовлечение в процесс эффекторных клеток воспаления. После контакта с вирусным агентом (чаще РС-вирусом, риновирусом и вирусом парагриппа типа 3) развивается ранняя астматическая реакция [19 – 21], результатом которой являются IgE-опосредованная дегрануляция тучных клеток [9], выброс хемотаксического фактора эозинофилов и нейтрофилов, гистамина, лейкотриенов (ЛТС4, ЛТД4, ЛТЕ4) и фактора активации тромбоцитов (ФАТ), обладающих бронхосуживающим свойством [19,21]. Кроме того, высвобождается простагландин ПГД2, вызывающий констрикцию ДП человека. ПГД2 потенцирует также бронхоконстрикторную реакцию на гистамин и холинергические агонисты у больных БА.
Показано, что эозинофильная инфильтрация ДП – характерный дифференциально-диагностический критерий астмы [1, 11]. Активация эозинофилов респираторным вирусом приводит к значительному выбросу медиаторов – ЛТС4, ЛТВ4, тромбоксана А2, ФАТ, кислородных радикалов, основных белков [1, 22], что в свою очередь вызывает альтерацию эпителия. Важную роль играет ФАТ, селективно притягивающий эозинофилы. что влечет за собой эозинофильную инфильтрацию ДП, а также высвобождение эозинофильной пероксидазы. Эти процессы приводят к длительному повышению бронхиальной реактивности.
РВИ посредством выработки IgE повышает активность альвеолярных макрофагов, результатом чего является выработка таких медиаторов воспаления, как тромбоксан, ПГ, ФАТ, отвечающих за развитие поздней фазы аллергических реакций [9, 23]. Так, на фоне экспериментальной риновирусной инфекции было отмечено значимое повышение уровня гистамина как в острой фазе, так и в течение 4 нед после заражения. Отмечались признаки бронхообструкции, снижение эффективности бронходилататоров, развитие отсроченных аллергических реакций, изменения дыхательного паттерна [12]. Это подтверждает значение РВИ в формировании поздней фазы аллергических реакций [19, 21].
Следовательно, РВИ, потенцируя выработку эффекторными клетками множества сильнодействующих хемотаксических факторов, обусловливает повышение бронхиальной реактивности у здоровых людей и клинические проявления обострений у пациентов с БА. Воздействие гистамина, ПГ, ЛТ прямо приводит к сокращению гладкой мускулатуры бронхов, увеличению секреции слизи в ДП, повышению проницаемости сосудов и активации вторичных эффекторных клеток.
Повышение сосудистой проницаемости
РВИ, вызывая и поддерживая воспалительные изменения слизистой оболочки ДП, приводит к повышению сосудистой проницаемости [13, 24]. Это влечет за собой пропотевание альбумина и повышение вязкости бронхиального секрета с образованием слизистых пробок и развитием обтурации периферических ДП, что приводит к угнетению мукоцилиарного клириенса и задержке выведения воспалительного секрета [11].
Под действием респираторных вирусов, преимущественно РС-вируса, аденовируса, вируса парагриппа типа 3, происходит выработка медиаторов воспаления (гистамина, брадикинина, ЛТ, ФАТ). Вследствие этого стимулируются капсаицинчувствительные первичные афферентные нервные окончания, что приводит к высвобождению нейропептидов, в частности субстанции Р [22]. В результате повышается сосудистая проницаемость, развивается отек слизистой оболочки, сужается просвет бронхов. Все это вкупе с мышечным компонентом приводит к повышению реактивности ДП. Усиление отека слизистой оболочки усугубляет предсуществующую альтерацию эпителиальных клеток, замыкая порочный круг.
РВИ и изменения иммунной реактивности
Исследования последних лет подтверждают роль РВИ в развитии атопии [12, 24]. Одним из возможных механизмов формирования аллергических реакций является выработка IgE-антител на антигены вирусов [25]. Известно, что выработка IgЕ стимулируется интерлейкином-4 (ИЛ-4) и g-интерфероном [20, 21]. Основными эффекторными клетками в продукции IgE являются Т-хелперы (рис. 2).
Вирусная инфекция способствует активации Т-клеток и запуску процесса выработки IgE, что показано в эксперименте. При исследовании бронхоальвеолярного лаважа и участков бронхов, подвергавшихся воздействию риновируса, были отмечены клеточная инфильтрация и значительный приток эозинофилов в ДП. В эксперименте инкубация препарированных лимфоцитов и моноцитов с риновирусом 16 (RV 16) через 22 ч привела к увеличению концентрации СД3 и СД69. Поскольку СД69 является индикатором активации Т-клеток, можно заключить, что риновирусная инфекция в данном случае привела к развитию аллергического воспаления ДП [19].
Welliver и соавт. описали атопический процесс и развитие атопической предрасположенности у пациентов, ранее не страдавших заболеваниями органов дыхания, после РС-вирусной инфекции. Было показано, что выработка IgE, опосредованная повышенной продукцией ИЛ-4, приводила к снижению образования неоптерина (ингибирующего фактора аллергической реакции).
Были выявлены и другие механизмы повышения выработки IgE при РВИ [25]. Sakamoto и соавт. исследовали аллергическую сенситизацию к аэрозольному овальбумину у мышей с привнесенным вирусом гриппа. Отмечены усиление продукции IgE, значительная десквамация эпителия с повышением уровня пероксидазы. Возможно, это один из альтернативных вариантов Т-клеточной стимуляции продукции IgE при вирусной инфекции.
РВИ способствует вовлечению и других клеток в воспалительный и иммунный ответ (рис. 3). Ida и соавт. предположили, что выработка интерферона во время РВИ лейкоцитами больных с аллергией на амброзию может индуцироваться высвобождением гистамина. Повышение секреции многих других медиаторов воспаления, включая ЛТС4, кинины, гистамин выявлено при изучении ГРБ во время РВИ (J. Barnett и соавт.) При инкубации препарированных лейкоцитов человека с вирусами гриппа А, парагриппа, РС-вирусом, парамиксовирусом выявлено значительное усиление высвобождения гистамина базофилами [18].
Выработка вирусспецифических IgE и их взаимодействие с эффекторными клетками ведут к мощному выбросу медиаторов воспаления, определяя формирование сенсибилизации и развитие аллергической реакции.
Основные принципы терапии вирусиндуцированной БА
Принципы лечения астмы, ассоциированной с РВИ, определяются особенностями воздействия вирусной инфекции на организм. С одной стороны, это супрессивное действие на иммунную систему, способствующее присоединению бактериальной флоры, с другой – снижение резистентности организма в целом, а также проявление аллергических реакций и симптомов бронхоконстрикции. В связи с этим в комплексную терапию необходимо включать противовирусные препараты, иммуномодуляторы, антибактериальные средства, одновременно проводя терапию БА в соответствии со степенью ее тяжести (адекватные дозы глюкокортикостероидов, препараты кромогликата натрия, бронхолитические, отхаркивающие, антигистаминные средства). Подробнее будут рассмотрены группы противовирусных и иммуномодулирующих препаратов.
Противовирусная терапия
В настоящее время противовирусная терапия остается все еще недостаточно успешной. Это связано с тем, что жизнедеятельность вирусов происходит внутри клетки, что затрудняет воздействие. Сложность состоит также в том, что клинические проявления РВИ развиваются уже после того, как произошла репликация с образованием вирусного потомства. Следовательно, более эффективны профилактика РВИ во время эпидемических вспышек и лечение контактеров в инкубационном периоде болезни. Механизмы действия, дозировки основных современных противовирусных препаратов представлены в табл. 4.
Иммунотерапия
Целью ее проведения является как восстановление факторов естественной защиты ДП, так и выработка специфического иммунитета к наиболее распространенным респираторным вирусным агентам. Использование поликомпонентных вакцин – мощное средство профилактики РВИ. Существуют противовирусные и противобактериальные вакцины. Их использование у пациентов с БА позволяет снизить вероятность формирования вирусно-бактериальных ассоциаций и уменьшить тяжесть обострений БА.
Поликомпонентные вакцины
Биомунил Гранулт состоит из рибосом клебсиеллы, пневмококка, пиогенного стрептококка группы А, гемофильной палочки, протеогликана из клебсиеллы. Применяют по 3 таблетки или 1 дозу гранулята в течение 3 нед по 4 дня в неделю. Препарат можно комбинировать с антибиотиками, что особенно важно в случаях присоединения бактериальной флоры.
Бронховаксон содержит высушенные экстракты гемофильной палочки, пневмококка, K. pneumoniae и ozaenae, золотистого стафилококка, моракселлы, пиогенного и зеленящего стрептококка. Применяют по 1 капсуле. Более продолжительный курс лечения составляет 3 мес: в течение 1 мес по 1 капсуле в день, последующие 2 мес – 10 дней по 1 капсуле 2 раза в день. Препарат высокоэффективен у пациентов с вирусной инфекцией верхних и нижних ДП, особенно на фоне обструктивных заболеваний ДП.
Рибомунил – рибосомальная фракция из наиболее часто встречающихся рибосомальных патогенов (клебсиелла, пневмококк, пиогенный стрептококк группы А, гемофильная палочка и протеогликан из клебсиеллы). Показанием к применению служат повторяющиеся и острые инфекции респираторного тракта, в том числе при БА. Назначают по 3 таблетки утром 4 дня в неделю на протяжении 3 нед, затем 4 дня в месяц еще 5 мес. Подкожно препарат вводят по схеме.
ИРС 19 – раствор для ингаляций в виде спрея. Содержит лизаты пневмококка, гемофильной палочки, S. pyogenes и faecalis, золотистый стафилококк, M. catarrhalis, N.flava и perflava, Gatnya tetragena. Применяют ежедневно в каждый носовой ход при острых респираторных заболеваниях в течение 8-10 дней, при хронических респираторных инфекциях в течение 4 нед.
Луивак – таблетки, содержащие 3 мг лизата S. auerus и S.mitis, пиогенный стрептококк, пневмококк, клебсиеллу, моракселлу, гемофильную палочку. Показан при инфекциях верхних и нижних ДП по 1 таблетке каждые 28 дней.
Иммуноглобулины делятся на две группы: широкого спектра и направленного действия. Целью данной терапии является создание пассивного иммунитета.
Иммуномодуляторы
Левамизол восстанавливает функцию Т-лимфоцитов и фагоцитов, усиливает реакцию клеточного иммунитета. Применяется при хронических и рецидивирующих инфекциях, хронических обструктивных болезнях легких. Суточная доза 150 мг.
Тималин регулирует количество Т- и b-лимфоцитов, стимулирует реакцию клеточного иммунитета, усиливает активность фагоцитов. Широко применяется при РВИ. Вводят внутримышечно по схеме.
Натрия нуклеинат – стимулирует миграцию и кооперацию Т- и b-лимфоцитов, повышает фагоцитарную активность макрофагов. Применяется при заболеваниях вирусной этиологии. Назначается внутрь по 0,25 – 0,5 – 1,0 г на прием.
Продигиозан активирует Т-систему иммунитета и функцию коры надпочечников. Применяется при хронических инфекциях ДП. Вводят внутримышечно по схеме.
Литература:
1.Barnes PJ. New concepts in the pathogenesis of bronchial responsiveness and asthma. J Allergy Clin Immunol 1989;83:1013–26.
2. Hogg JC. Persistent and latent viral infections in the pathology of asthma. Am Rev Respir Dis 1992;145:S7.
3. Бронхиальная астма. Глобальная стратегия. Пульмонология. – 1996. – Прил.: С. 2 – 6.
4. Федосеев Г.Б. Механизмы обструкции бронхов. Спб.: Мед.информ. – 1995. – С. 333.
5. Чучалин А.Г. Бронхиальная астма. М.: “Агар”. – Том 2. – С. 90–102.
6. Busse WW, Godard P, Howarth P, et al. Role and contribution of viral respiratory infections to asthma. Eur J Allergy Clin Immunol 1993;48(Suppl. 17):57–61.
7. Сapcar D, Busse WW. Role of viral infections in ashtma. Immunol. Allergy Clin North Am 1993;13(4):745–67.
8. Empey DW, et al. Mechanisms of bronchial hyperreactivity in normal subjects after upper respiratory tract infection. Am Rev Respir Dis 1976;113:131.
9. Hall WJ, Hall CB. Bacteria and viruses in etiology and treatment. 564–73.
10. Покровский В.И., Лобан К.М. Руководство по инфекционным болезням. М.: Медицина. – 1986. – С. 306–27.
11. Чучалин А.Г. Бронхиальная астма. М.: “Агар”. – Том 1. – С. 343–56.
12. Busse WW. The role of respiratory infections in airway hyperresponsiveness and asthma. Am J Respir Crit Care Med 1994;150:S77–S79.
13. Busse WW. Mechanisms of persistent airway inflammation in asthma. Am J Respir Crit Care Med 1995;152:388–93.
14. Djukanovic R, et al. Mucosal inflammation in asthma. Am Rev Respir Dis 1990;142:434.
15. Springer TA. Adhesion receptors of the immune system. Nature 1990;346:425–34.
16. Jacoby DB, et al. Influenza infection causes airway hyperresponsiveness by decreasing enkephalinase. J Appl Physiol 1988;64:2653–8.
17. Saban R, et al. Enhancement by parainfluenza 3 infection of contractile responses to substance P and capsaicin in airway smooth muscle from the guinea pig. Am Rev Respir Dis 1987;136:586–91.
18. Clementsen P, et al. Influenza A virus enhances basophilic histamine release and the enhancement is abolished by carbohydrates. Allergy 1990;45(6):471–6.
19. Calhoun WJ, et al. Experimental rhinovirus-16 infection potentiates histamine release after antigen bronchoprovocation in allergic subjects. Am Rev Respir Dis 1991;144:1267–73.
20. Einarsson O, et al. Asthma- associated viruses specifically induce lung stromal cells to produce interleukin-11, a mediator of airway hyperreactivity. Chest 1995;107( Suppl.3): S132–S133.
21. Einarsson O, et al. Interleukin-11: stimulation in vivo and in vitro by respiratory viruses and induction of airways hyperresponsiveness. J Clin Invest 1996;97(4): 915–24.
22. Barnes PJ. Neuropeptides and asthma. Am Rev Respir Dis 1991;143(Suppl.):S28.
23. Holgate ST, et al. The pathogenesis and significance of bronchial hyperresponsiveness in airways disease. Clin Sei 1987;73:561–72.
24. Busse WW. Viral infections in humans. Am J Respir Crit Care Med 1995;151:1675–77.
25. Robinson DS, et al. Predominant TH2-like bronchoalveolar T-lymphocyte population in atopic asthma. N Engl J Med 1992;326:298–304.
Благодарность
Автор статьи и редакция “Русского медицинского журнала” выражают признательность московскому представительству фирмы “Glaxo Wellcome” за обеспечение всесторонней информационной поддержки, оказанной автору при подготовке данной публикации.












