В статье суммированы современные знания о эпидемиологии, этиологии и патогенезе идиопатического фиброзирующего альвеолита, подробно представлены методы диагностики данного заболевания и даны рекомендации по его лечению.
The paper summarizes current knowledge of the epidemioligy, etiology, and pathogenesis of idiopathic fibrosing alveolitis, details diagnostic methods for the disease, and gives recommendations on its treatment.
О.Е. Авдеева, С.Н. Авдеев, А.Г. Чучалин
НИИ пульмонологии Минздрава РФ, Москва
O.Ye. Avdeeva, S.N. Avdeev, A.G. Chuchalin, Research Institute of Pulmonology, Ministry of Health of the Russian Federation, Moscow
Интерстициальные заболевания легких (ИЗЛ) занимают до 10 – 15 % в структуре всех болезней легких [21]. К ним относятся более 130 заболеваний известной и неизвестной этиологии [9]. Одним из наиболее распространенных и прогностически неблагоприятных заболеваний из группы ИЗЛ является идиопатический фиброзирующий альвеолит (ИФА). ИФА характеризуется воспалением и фиброзом легочного интерстиция и воздухоносных пространств, дезорганизацией структурно-функциональных единиц паренхимы, приводящим к развитию рестриктивных изменений легких, нарушению газообмена, прогрессирующей дыхательной недостаточности и в конечном итоге к смерти больного [22].
Считается, что первые упоминания о заболевании относятся к 1935 г., когда L. Hamman и A. Rich [34] описали 4 больных с быстропрогрессирующей дыхательной недостаточностью, умерших в течение 6 мес от начала возникновения болезни. При аутопсии был обнаружен выраженный распространенный фиброз легких, и авторы назвали заболевание "острый диффузный интерстициальный фиброз легких". Длительное время синдромом Хаммена – Рича называли и заболевания с хроническим течением, однако в последнее десятилетие данный синдром относят лишь к одной из форм ИФА – быстропрогрессирующей или острой интерстициальной пневмонии [16]. Возможно, первым автором, описавшим заболевание, был немецкий врач G. Rindfleisch (1897), предложивший для него термин "кистозный цирроз легких".
Термин "фиброзирующий альвеолит", предложенный J. Scadding в 1964 г., отражает основные ключевые признаки заболевания: воспаление и фиброз. В нашей стране наиболее употребителен термин "идиопатический фиброзирующий альвеолит" [1], также отражающий первичность и неясную природу заболевания. Синонимами ИФА являются "идиопатический легочный фиброз" – термин, чаще всего используемый в американской литературе [8], и "криптогенный фиброзирующий альвеолит" (cryptogenic fibrosing alveolitis), получивший большее распространение в Европе, особенно в Великобритании [22].
В качестве еще одного синонима ИФА в последнее время все чаще используют понятие "обычная интерстициальная пневмония", что отражает наиболее частый морфологический субстрат заболевания [18].
Эпидемиология
За последнее десятилетие в мире проведено несколько эпидемиологических исследований, посвященных ИФА [13, 12]. Показатели распространенности заболевания значительно варьируют. По данным D. Coultas и соавт. (1994), распространненость заболевания в США составляет для мужчин 31,5 и для женщин 26,1 на 100 тыс. населения в год. В Великобритании заболеваемость ИФА значительно ниже – 6 случаев на 100 тыс. населения в год [12]. В Моравии и Силезии заболеваемость ИФА составляет от 4,1 до 27,6 случаев на 100 тыс. населения (V. Kolek.,1994). За период с 1979 по 1988 г. в Англии и Уэльсе летальность от криптогенного фиброзирующего альвеолита выросла в 2 раза (336 и 702 случая в год соответственно) . Подобные тенденции прослеживаются в Австралии, Шотландии и Канаде, в то же время летальность от ИФА практически не изменилась в Новой Зеландии, США и Германии [13]. В Японии летальность от ИФА в период с 1974 по 1985 г. составила 3 случая на 100 тыс. населения в год (К. Iwai и соавт.,1994). Данные различия в показателях распространенности и летальности ИФА очень трудно трактовать, так как в основе лежат различные подходы кодирования заболевания в национальных регистрах, различия в экологических условиях, уровне диагностики заболевания и других факторах. Кроме того, основные исследования ИФА, как правило, проводят в специализированных пульмонологических центрах, где наблюдают более молодых и более тяжелых больных, что значительно искажает тенденции распространения и развития заболевания в общей популяции [12].
Этиология и патогенез
Несмотря на наличие в названии заболевания термина "идиопатический" или "криптогенный", в настоящее время исследователи предпринимают активные попытки поиска причины возникновения ИФА. Заболевание рассматривают как процесс, протекающий в несколько этапов: 1) первичное повреждение эпителиальных и/или эндотелиальных клеток легочной паренхимы с развитием воспалительной реакции; 2) восстановление структуры поврежденной ткани с накоплением мезенхимальных клеток и избыточным развитием экстрацеллюлярного матрикса/фиброза (М. Sheppard, W. Harrison, 1992).
Многие авторы рассматривают ИФА как аутоиммунное заболевание с развитием персистирующих иммунных реакций в легочном интерстиции. Гистологические паттерны при фиброзирующих альвеолитах на фоне диффузных заболеваний соединительной ткани (ДЗСТ) и при ИФА практически идентичны [7]. В пользу аутоиммунной теории свидетельствуют частое присутствие гипергаммаглобулинемии, циркулирующих иммунных комплексов, ревматоидного и антинуклеарного факторов [8]. Доказана местная продукция иммуноглобулина и образование иммунных комплексов в легких (А. Hance,1988).
В одном из исследований W. Wallace и соавт. обнаружили при ИФА более чем в 80 % случаев наличие в плазме циркулирующих аутоантител к протеину легочной ткани массой 70 – 90 kDa (W. Wallace и соавт.,1994). Иммуногистохимическое исследование показало, что этот протеин локализован на эпителиальных клетках альвеол, которые, возможно, и являются основной мишенью при аутоиммунной атаке. В последующей работе эти же авторы продемонстрировали идентичность данного аутоантигена белковым молекулам, экспрессируемым на альвеолоцитах 2-го типа. В исследовании G. Nacos и соавт. было выявлено, что в качестве аутоантигена может выступать и нативный коллаген: в 81% у пациентов с ИФА обнаруживали антитела к коллагенам I, II, III, IV типов и к составляющим их цепям, кроме того было показано, что существует обратная связь между длительностью развития заболевания и уровнем аутоантител к коллагенам I и III типов.
Развитие реакций к аутоантигенам может быть результатом повышения их экспрессии на клеточных мембранах вследствие действия неизвестных повреждающих агентов: органической и неорганической пыли, лекарств, вирусной инфекции. На роль вирусов, принимающих участие в патогенезе ИФА, претендуют латентные, "медленные" вирусы. Обсуждается роль вирусов гепатита С (Т. Ueda и соавт., 1992), аденовирусов (К. Kuwado и соавт., 1997), вируса Эпштейна – Барра (J. Egan и соавт., 1995). Вирусные протеины способны усиливать реакции хронического воспаления и репарации, активировать продукцию коллагена I типа и выступать в роли трансактивирующих факторов, т.е. взаимодействовать с генами, регулирующими клеточный рост. Вирусы могут не только выступать в качестве первичного триггера развития повреждения при ИФА, репликация вируса в уже поврежденной ткани может потенциировать прогрессирование заболевания на поздних стадиях.
Другая теория рассматривает в качестве причины заболевания экспозицию к экологическим и профессиональным факторам. В нескольких эпидемиологических исследованиях была показана связь ИФА с профессиональным контактом с металлической и древесной пылью. В исследовании R. Hubbard и соавт. заболевание наиболее часто развивалось у лиц, имевших профессиональный анамнез работы с латунью, свинцом, сталью, древесной пылью [13]. В работе японских авторов (К. Iwai и соавт., 1994) кроме лиц, участвующих в производстве металло- и деревообработки, достоверный риск развития ИФА имели маляры, работники прачечных и косметических салонов, парикмахеры. При сравнении частоты развития ИФА среди девяти районов Англии и Уэльса, наибольшее число случаев заболевания наблюдали в Ноттингеме – области с наиболее развитой промышленностью (I. Johnston и соавт.,1990). Не исключена роль и других видов неорганической пыли: асбеста (Е. Gaensler и соавт., 1991), силикатной пыли (Е. Monso, 1990). В наиболее крупном на сегодняшний день исследовании, посвященном криптогенному фиброзирующему альвеолиту, проведенном Британским торакальным обществом (British Toracic Society – BTS), около половины всех пациентов имели в анамнезе контакт с пылью, при этом у 87 больных отмечался контакт с асбестом [12].
Существует также точка зрения, что имеется генетическая предрасположенность к развитию избыточного фиброзообразования в легких в ответ на неспецифическое повреждение эпителия (Р. Lympany du R. Bois, 1997). В пользу данной гипотезы говорит наличие семейных форм заболевания (Р. Bitterman и соавт.,1986). Изучается генетическая предрасположенность к развитию диффузных заболеваний легких, в основе которой лежит наследственый полиморфизм генов, кодирующих протеины, участвующие в процессинге и презентации антигенов к T-лимфоцитам. Исследования сосредоточены на изучении полиморфизма молекул, кодируемых генами MHС (major histocompatibility complex), так, D. Briggs и соавт. обнаружили при системной склеродермии ассоциацию фиброзирующего альвеолита с присутствием аллелей HLA-DR3/DR52a в 45 % случаев, в то время как в контрольной группе данный фактор присутствовал в 6 % (D. Briggs и соавт., 1991).
Механизмы развития воспаления/ фиброза. В процесах воспаления и репарации принимают участие многие клетки: альвеолярные макрофаги, нейтрофилы, эозинофилы, тучные клетки и др. Считается, что центральной клеткой воспаления при альвеолитах является альвеолярный макрофаг. Макрофаги способны высвобождать хемоатрактанты для нейтрофилов, включая лейкотриен В4 и интерлейкин-8 (R. Сherniack, 1991), факторы роста (тромбоцитарный фактор роста, инсулиноподобный фактор роста-1, трансформирующий фактор роста-b, фибронектин (P. Vaillant и соавт., 1996), стимулировать секреторную активность фибробластов и нейтрофилов (R. Shaw и соавт., 1991), высвобождать кислородные радикалы, играющие важнейшую роль в повреждении паренхимы (Р. Southorn и соавт., 1988). Нейтрофилы также являются основными эффекторными клетками при ИФА, они способны высвобождать такие повреждающие факторы, как протеазы (коллагеназа, эластаза), кислородные радикалы (М. Sheppard, N. Harrison, 1992). Эозинофилы, кроме протеаз и активных продуктов кислорода, секретируют специфичные цитотоксические вещества: эозинофильный катионный протеин, большой основной белок и др. (K. Fujimoto и соавт., 1995). Изучается роль тучных клеток в процессах фиброзообразования, их количество в легочной ткани резко повышено в областях фиброза (А. Pesci и соавт., 1993), в лаважной жидкости больных ИФА обнаруживают значительное повышение продуктов тучных клеток: гистамина и триптазы (А. Walls и соавт., 1991). Определенное значение имеют и Т-лимфоциты. У больных ИФА обнаруживают маркеры активации Т-клеток в крови, в сыворотке крови повышение IL-2 (М. Shepard, N. Harrison, 1992), а в жидкости БАЛ – интерферон-g (В. Robinson и соавт., 1990). Интерферон-g активирует макрофаги и лимфоциты, стимулирует экспрессию эндотелиальных клеток молекулы адгезии ICAM-1 и экспрессию продуктов HLA-DR, оказывает влияние на депозицию коллагена в интерстиции (М. Shepard, N. Harrison, 1992). Повреждение эпителиальных клеток оказывает модулирующий эффект на развитие подлежащей соединительной ткани и может также вести к развитию фиброза (I. Adamson и соавт., 1991). Регенерирующие эпителиальные клетки способны продуцировать фиброгенные факторы: трансформирующий фактор-b, фактор некроза опухоли-a [7]. Реэпителизация происходит, в основном, за счет альвеолоцитов 2-го типа, что является одной из характерных морфологических особенностей фиброзирующего альвеолита (М. Sheppard, N. Harrison, 1992). Обсуждается вклад внеклеточных процессов в воспалении при ИФА, в частности, значение повышенной проницаемости эпителия и "пропотевания" компонентов плазмы в интерстиций (R. Cherniack, 1991), изменение состава компонентов сурфактанта (H. Hamm и соавт., 1996).
Морфологическая картина
Гистологическая картина при ИФА неоднородна. В одной из ранних классификаций А. Liebow выделял пять морфологических типов фиброзирующего альвеолита: обычная интерстициальная пневмония (usual interstitial pneumonia – UIP), десквамативная интерстициальная пневмония (desquamative interstitial pneumonia – DIP), интерстициальная пневмония, ассоциированная с бронхиолитом (bronchiolitis interstitial pneumonia – BIP), гигантоклеточная интерстициальная пневмония (giant cell interstitial pneumonia – GIP), лимфоидная интерстициальная пневмония (limphoid interstitial pneumonia – LIP) [14]. В настоящее время свое значение сохранили только два первых типа, в то время как BIP соответствует самостоятельному, недавно описанному заболеванию легких – облитерирующему бронхиолиту с организующейся пневмонией (G. Epler и соавт., 1985), LIP – ассоциирован с лимфопролиферативными заболеваниями (D. Braggs и соавт., 1994), а паттерн GIP чаще всего выявляется при пневмокониозах и болезнях легких, вызванных тяжелыми металлами (D. Сugell, 1992). В то же время, в последнее десятилетие морфологическая классификация дополнилась двумя типами интерcтициальных пневмоний: неспецифической интерстициальной пневмонией/фиброзом (nonspecific interstitial pneumonia/ fibrosis – NIP) [15] и острой интерстициальной пневмонией (acute interstitial pneumonia – AIP) [16].
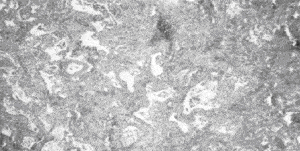
Наиболее частым гистологическим паттерном является обычная интерстициальная пневмония – UIP (синонимы: муральная форма или смешанный фиброзно-воспалительный вариант ИФА), которая составляет около 90 % всех форм ИФА [4]. На ранних этапах развития заболевания морфологическая картина характеризуется отеком и интенсивной инфильтрацией стенок альвеол лимфоцитами, моноцитами, плазматическими клетками и эозинофилами. Наряду с воспалением присутствуют признаки фиброза: фокусы фибробластов, активно синтезирующих коллаген (С. Kuhn и соавт., 1991), миофибробласты, чья сократительная способность может играет определенную роль в ремоделировании паренхимы легких (К. Adler и соавт., 1989). Часто, особенно на фоне ДЗСТ, присутствуют признаки фокальной гиперплазии лимфоидной ткани [7]. На более поздних стадиях заболевания происходит замещение нормальной структуры паренхимы грубой соединительной тканью, в которую замурованы кистозно-расширенные воздухоносные пространства, выстланные изнутри гиперплазированным бронхиолярным или кубовидным альвеолярным эпителием, альвеолоциты 1-го типа замещаются альвеолоцитами 2-го типа, иногда присутствуют признаки метаплазии. В полях фиброза могут присутствовать клетки воспаления, однако их количество не такое выраженное, как на ранних стадиях. Также в полях фиброза часто находят реактивную мышечную гиперплазию, происхождение гиперплазированных миоцитов вероятнее всего имеет связь с бронхиолами или мелкими кровеносными сосудами, а не с миофибробластами из молодой соединительной ткани [7]. Внутри измененных альвеол могут обнаруживаться муцин, белковый детрит, кристаллы холестерина, макрофаги и другие клетки. Стенки сосудов значительно утолщены в области фиброзных полей и могут быть нормальными в непораженной ткани легких. Макроскопические изменения легких на поздних стадиях характеризуются уплотнением и сморщиванием ткани легких и формированием "сотового легкого" (на этом основании одним из первых названий болезни – было "кистозный цирроз легких";
G. Rindfleisch, 1897). Фиброз особенно выражен в субплевральной области и напоминает ленту шириной несколько сантиметров. Наибольшие изменения выражены в заднебазальных сегментах [7]. Поражение плевры, в отличие от асбестоза, встречается редко. Данный тип ИФА характеризуется плохим прогнозом, летальность в течение пяти лет превышает 60 % [3].
На долю десквамативной интерстициальной пневмонии – DIP (синоним – клеточный паттерн) приходится около 5 % ИФА. Кардинальным признаком данной формы является содержание значительного количества клеток в просвете альвеол. Раньше предполагали, что основными типами клеток являются десквамированные альвеолоциты, что и легло в основу названия данного паттерна. На самом деле основной клеточной популяцией внутри альвеол являются макрофаги [7]. Альвеолы выстланы гиперплазированными альвеолоцитами 2-го типа. Альвеолярные септы инфильтрированы лимфоцитами, иногда эозинофилами, может наблюдаться небольшое повышение содержания мезенхимальных клеток, однако фиброз, как правило, выражен незначительно. В настоящее время так до конца и не решен вопрос, является ли десквамативная пневмония самостоятельным заболеванием или ранним проявлением ИФА (Т. Hartman и соавт., 1996). Настоящая форма ИФА отличается чувствительностью к кортикостероидам и хорошим прогнозом, однако, иногда возможно прогрессирование болезни до стадии "сотового легкого" (В. Lipworth, 1987) [17]. Летальность при десквамативной пневмонии не превышает 25% [3].
Острая интерстициальная пневмония (AIP) была впервые описана L. Hamman и A. Rich в 1935 г., однако в самостоятельную форму была выделена в лишь в 1986 г. (A. Katzenstein 1986). В настоящее время только данная форма ИФА может обозначаться как синдром Хаммена – Рича [7]. Характер морфологических изменений при АIP укладывается в картину диффузного альвеолярного повреждения (diffuse alveolar damage), которую наблюдают при респираторном дисстресс-синдроме взрослых. В раннюю фазу наблюдается интерстициальный отек паренхимы и формирование гиалиновых мембран, на поздних этапах (обычно после второй недели от начала заболевания) – признаки интраальвеолярной и/или интерстициальной организации, обычно ассоциированные с пролиферацией альвеолоцитов 2-го типа (J. Olson, 1990). Частой находкой являются тромбы в мелких артериях. Заболевание характеризуется фулминантным течением, прогноз плохой, летальность достигает 70%, хотя в некоторых наблюдениях отмечена репарация паренхимы легких без остаточных явлений и летальность не превышала 60% [18].
В 1994 г. А. Katzenstein и R. Fiorell описали новый подтип ИФА – неспецифическую интерстициальную пневмонию/фиброз (NIP) (синоним – неклассифицируемая пневмония). Морфологическая картина отлична от всех известных вариантов фиброзирующего альвеолита. Данная форма занимает в структуре ИФА до 5%. Основной особенностью NIP является гомогенность или униформность морфологической картины. Спектр морфологических изменений варьирует от изолированного воспаления до выраженного фиброза, однако по сравнению, например с UIP, при которой одновременно в разных регионах паренхимы сосуществуют воспаление и фиброз различной выраженности и области сохранной паренхимы, при NIP на данный момент присутствует воспаление/фиброз примерно на одном этапе развития, т.е. гистологическая картина гомогенна. В некоторых случаях наблюдается аккумуляция макрофагов в просвете альвеол, однако, по сравнению с DIP, при неспецифической пневмонии данный феномен имеет "пятнистый" (patchy), негомогенный тип распределения, преобладает интерстициальное воспаление. Данная форма ИФА характеризуется подострым течением, более чем в 80% при NIP наблюдается регрессия или стабилизация воспалительного процесса, летальность не превышает 11 – 17% ([15], V. Cottin и соавт., 1997).
Диагностика ИФА
Клиническая картина ИФА не имеет патогномоничных признаков. Заболевание чаще всего встречается у пациентов в возрасте от 40 до 70 лет. Отмечается преобладание заболевания у мужчин, соотношение полов в наиболее крупных исследованиях составляло 1,9 : 1 [3]; 1,7 : 1 [12] в пользу мужчин. Основными жалобами больных являются одышка и непродуктивный кашель. По мере развития заболевания отмечается нарастание одышки, вплоть до полной инвалидизации больного: из-за одышки больной не способен произнести фразу, предложение, не может ходить, обслуживать себя. Начало болезни, как правило, незаметное, хотя в ряде случаев (до 20%) ИФА может начинаться острыми симптомами, что предполагает роль вирусной инфекции в генезе заболевания (J. Egan и соавт., 1997). Так как болезнь прогрессирует довольно медленно, пациенты успевают адаптироваться к своей одышке, постепенно снижая свою активность и переходя к более пассивному образу жизни. Большинство пациентов на момент обследования имеют анамнез заболевания длительностью до 1 – 3 лет. Иногда отмечается продуктивный кашель (в исследовании BTS – до 20,4%), даже признаки гиперсекреции мокроты, причем данный признак ассоциирован с более неблагоприятным прогнозом заболевания (N. Hiwatari и соавт., 1991). Лихорадка не характерна для ИФА. Другими симптомами может быть общая слабость, артралгии, миалгии, снижение массы тела, изменение ногтевых фаланг (в виде “барабанных палочек”). Артриты и артралгии, по данным исследования BTS, чаще встречаются у женщин, чем у мужчин (в 23,7 и 16,6% случаев соответственно). Симптом "барабанных палочек", наоборот, преобладает у мужчин и встречается в 40 – 72% (M. Johnson., 1997; R. Crystal, 1976). Данный признак в некоторых исследованиях сочетался с более плохим прогнозом (C. Smith, 1990), а по данным T. Kanematsu и соавт. (1994), наличие у больного "барабанных палочек" соответствует определенной гистологической картине заболевания: в полях фиброза часто отмечается выраженная гладкомышечная пролиферация.
Характерным аускультативным феноменом при ИФА является крепитация, которую сравнивают с "треском целлофана" или обозначают как хрипы "velcro". Наиболее часто хрипы выслушивают в заднебазальных отделах, хотя в 1/5 всех случаев крепитацию можно прослушать и в верхних отделах (Р. Bettencourt и соавт., 1994). По сравнению с крепитацией при других заболеваниях (пневмония, бронхоэктазы, застойные процессы в легких), крепитация при ИФА более нежная (fine crackles) – менее громкая и более высокая по частоте, выслушивается на высоте вдоха, т.е. в конечноинспираторную фазу (Р. Piirila, 1995). Иногда можно выслушать и экспираторную крепитацию (чаще во вторую треть выдоха), что может быть признаком прогрессирования заболевания (М. Walshaw и соавт., 1990). Сухие хрипы могут быть слышны у 5 – 10% больных и обычно появляются при сопутствующем бронхите. До 50% всех пациентов имеют тахипное [20]. По мере прогрессирования заболевания появляются признаки дыхательной недостаточности и легочного сердца: диффузный серо-пепельный цианоз, усиление 2-го тона над легочной артерией, тахикардия, S3 галоп, набухание шейных вен, периферические отеки.
Выживаемость пациентов с момента постановки диагноза в среднем 3 – 5 лет [8, 21]. В исследовании BTS в течение 5 лет умерло 50 % всех больных ИФА [12]. Прогноз значительно лучше у пациентов с фиброзирующим альвеолитом на фоне ДЗСТ (С. Agusti и соавт., 1992; А. Wells и соавт., 1994). Прогноз также несколько лучше у женщин, у более молодых пациентов, при анамнезе заболевания менее 1 года ([27]; D. Schwartz и соавт., 1994). Наиболее частой причиной смерти больных является дыхательная недостаточность, как естественное следствие прогрессирования заболевания. В исследовании R. Panos, посвященном анализу 550 случаев ИФА, дыхательная недостаточность в структуре смертности занимала 38,7%; другими причинами летальности были сердечная недостаточность (14,4%), бронхогенная карцинома (10,4%), ишемическая болезнь сердца (9,5%), тромбоэмболия легочной артерии (3,4%), легочные инфекции (2,8%) [21]. В исследовании BTS летальность была непосредственно связана с течением ИФА в 53% всех случаев, имела возможную связь с ИФА в 28 % и не была связана с ИФА в 14% случаев, рак легких был обнаружен у 12,6% всех умерших больных [12]. На фоне ИФА возможно развитие любой формы рака легкого: наиболее частыми гистологическими вариантами являются плоскоклеточный рак и аденокарцинома [7], описаны развитие бронхоальвеолярного рака, гигантоклеточного рака [22]. В целом риск заболевания раком легких у больных ИФА выше в 14,1 раз, чем в общей популяции того же возраста, пола и длительности курения [21].
Лабораторные тесты при ИФА обычно не несут какой-либо ценной информации. До 70% больных имеют повышенoе СОЭ (в среднем 38 мм/ч) (I. Johnston и соавт., 1995), у большинства обнаруживают циркулирующие иммунные комплексы (R. Dreisin и соавт., 1978), у 30% пациентов – повышение общего уровня иммуноглобулинов, довольно часто до 41 % обнаруживают криоглобулины [8]. Примерно 20 – 40% больных ИФА без сопутствующих ДЗСТ имеют повышенные титры ревматоидного и антинуклеарного факторов. В исследовании BTS положительный ревматоидный фактор был выявлен у 19% пациентов и антинуклеарный фактор – у 26% [12]. У больных ИФА, как правило, повышен сывороточный уровень лактатдегидрогеназы (ЛДГ) (R. de Remee и соавт.,1968), возможным источником которой являются альвеолярные макрофаги и альвеолоциты 2-го типа (К. Driscoll и соавт., 1990). В одном из исследований сывороточный уровень ЛДГ был тесно связан с другими маркерами активности ИФА: числом нейтрофилов и эозинофилов бронхоальвеолярного лаважа, и снижение ЛДГ наблюдалось при успешной терапии заболевания (S. Matusiewicz и соавт., 1993).
Перспективным маркером активности заболевания является сывороточный уровень протеинов сурфактанта А и D (surfactant proteins A and D – SP-A and SP-D) – основных гликопротеинов сурфактанта. В условиях повышенной проницаемости альвеолярно-капиллярной мембраны при активном альвеолите происходит значительное повышение SP-A и SP-D в сыворотке (Y. Kuroki и соавт., 1993; Y. Honda и соавт., 1995). Уровни протеинов сурфактанта достаточно хорошо отражают активность воспалительного процесса в легких при ИФА (Y. Honda и соавт., 1995). Еще одним направлением оценки активности альвеолита является определение в сыворотке муцин-антигенов, отражающих гиперплазию и гипертрофию альвеолоцитов 2-го типа и их повышенную секреторную функцию при интерстициальном воспалении. При ИФА доказана ценность таких муцин-антигенов, как SSEA-1 (Н. Satoh и соавт., 1991), KL-6 (N. Kohno и соавт., 1989), 3EG5 (O. Avdeeva, Yu. Lebedin, 1997).
Рентгенография грудной клетки является важнейшим диагностическим методом при ИФА. Наиболее частым признаком заболевания являются двусторонние диссеминированные изменения ретикулярного или ретикулонодулярного характера, более выраженные в нижних отделах легких. На ранних этапах развития заболевания может наблюдаться лишь некоторое уменьшение объема легочных полей и понижение прозрачности легких по типу "матового стекла", данные изменения особенно заметны при сравнении серии рентгенограмм больного. При прогрессировании заболевания ретикулярный паттерн становится более грубым, тяжистым, появляются округлые кистозные просветления размерами 0,5 – 2 см, отражающие формирование "сотового легкого", могут быть видны линейные тени дисковидных ателектазов. Рентгенологическая картина при ИФА может коррелировать с гистопатологическими изменениями, однако такая связь существует лишь при наличии признаков "сотового легкого" [4]. В исследовании BTS наиболее характерными рентгенографическими признаками ИФА являлись: очерченные узелково-линейные затемнения (51,0%); изменения по типу "сотового легкого"(15,1%); изменения по типу "матового стекла"(5,1%) [12]. Также на поздних стадиях ИФА рентгенологическая картина часто выявляет девиацию трахеи вправо, трахеомегалию [23]. Необходимо обратить внимание на то, что до 16% пациентов с гистологически доказанным диагнозом ИФА могут иметь неизмененную рентгенологическую картину (J. Orens и соавт.,1995). Вовлечение плевры, внутригрудная аденопатия, локализованные паренхиматозные уплотнения не характерны для ИФА и могут отражать либо другое интерстициальное заболевание легких, либо осложнения заболевания, такие, как инфекции или опухоли.
Более ценную информацию можно получить при помощи рентгенологической компьютерной томографии (КТ), особенно КТ высокого разрешения (high-resolution computed tomography). Характерными находками при КТ являются нерегулярные линейные тени, снижение прозрачности легочных полей по типу "матового стекла" и кистозные просветления размерами от 2 до 20 мм в диаметре. Признаки "сотового легкого" выявляют в 70% при КТ, по сравнению с 15 – 30% при обзорной рентгенографии (N. Muller, R. Muller,1990). Наибольшие изменения выявляют в базальных и субплевральных отделах легких. КТ паттерн и распределение изменений в большинстве случаев являются патогномоничными для ИФА (S. Padley и соавт., 1991). Кроме того, КТ-признаки отражают морфологические признаки фиброзирующего альвеолита: ретикулярный паттерн соответствует фиброзу, а паттерн "матового стекла" – клеточной инфильтрации (А. Wells, 1992). Картина "матового стекла" проявляется только при минимальном утолщении альвеолярных стенок, интерстиция или частичном заполнении альвеол клетками, жидкостью, аморфным материалом (С. Engeler и соавт., 1993). Поэтому КТ-картина имеет прогностическое значение, в исследовании А. Wells (1993) лучший прогноз имели пациенты с паттерном "матового стекла", худший – с ретикулярным паттерном, и промежуточный – со смешанным паттерном. Больные с паттерном "матового стекла" хорошо отвечали на терапию стероидами, улучшение клинического статуса этих больных сопровождалось улучшением КТ-картины, в то время, как ни в одном случае не наблюдалось уменьшение ретикулярного паттерна (А. Wells и соавт., 1993). В настоящее время по предсказательной ценности КТ выходит на первый план, опережая функциональные легочные тесты, бронхоальвеолярный лаваж и даже биoпсию легких, так как позволяет дать оценку поражения практически всей паренхимы легких по сравнению с отдельным биопсийным образцом (А. Wells, 1997). При сочетании ИФА с эмфиземой КТ является единственным методом, позволяющим оценить выраженность эмфиземы, которая преимущественно локализуется в верхних отделах, и разграничить ее с кистозными изменениями, характеризующими "сотовое легкое" (J. Wiggins и соавт., 1990).
Функциональные легочные тесты являются ключевым методом, позволяющим установить наличие принадлежности заболевания к группе ИЗЛ (В. Keogh, R. Crystal, 1980). На ранних этапах заболевания показатели спирографии часто в пределах нормальных значений, однако уже может наблюдаться снижение статических объемов – общей емкости легких (TLC), функциональной остаточной емкости (FRC), остаточного объема (RV), что выявляют при помощи бодиплетизмографии или метода разведения газов. В дальнейшем происходит снижение показателей объема форсированного выдоха за 1 с (FEV1) и форсированной жизненной емкости (FVC). Соотношение FEV1/FVC (коэффициент Тиффно) в пределах нормы или даже повышено из-за увеличения объемной скорости воздушного потока вследствие повышения эластической отдачи легких. Снижение ТLC хорошо коррелирует с выраженностью клеточной воспалительной реакции в биоптатах легочной ткани [6] и неблагоприятным прогнозом (R. Erbes и соавт., 1997).
Ценным показателем является диффузионная способность легких (DLCO), снижение которой является одним из ранних признаков заболевания (L. Watters, 1986). Выраженность изменений DLCO может являться предиктором морфологической картины: в исследовании R. Cherniack (1995) была выявлена достоверная корреляция между диффузионной способностью и выраженностью десквамации и суммарной выраженностью гистологических изменений, однако исходная DLCO не предсказывает дальнейшее течение ИФА и ответа на противовоспалительную терапию. Кроме того, DLCO наиболее тесно связана с кардинальным клиническим симптомом ИФА - диспное (D. Schwartz и соавт., 1994). Выраженное снижение DLCO (< 50%), как правило, ассоциировано с развитием легочной гипертензии и расширением альвеолоартериального градиента Р(А-а)О2 при физической нагрузке [23].
Реже при оценке ИЗЛ используют анализ кривой давление – объем, при заболеваниях данной группы она смещена вправо и вниз, что отражает снижение растяжимости легких и уменьшение объема легких. Данный тест имеет очень высокую чувствительность на ранних этапах развития заболевания, в то время, когда другие тесты еще не изменены (Т. King, 1990; Р. de Lucas и соавт., 1996).
 |
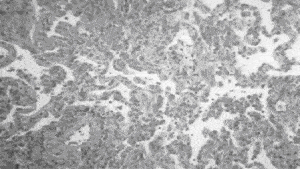 |
| Рис. 1. Морфологическая картина при UIP:утолщение альвеолярных перегородок, поля фиброза, нарушение легочной архитектоники. | Рис. 2. Морфологическая картина при DIP: утолщение альвеолярных перегородок: аккумуляция макрофагов в просвете альвеол. |
На ранних этапах заболевания газовый анализ артериальной крови, выполненный в покое, практически не изменен, хотя при физической нагрузке может наблюдаться десатурация, что проявляется снижением парциального напряжения кислорода РаО2 и расширением Р(А-а)О2. По мере прогрессирования заболевания гипоксемия появляется и в покое, и сопровождается гипокапнией, отражающей особенности дыхательного паттерна больных – частого поверхностного дыхания (rapid shallow breathing), гиперкапния появляется только на терминальных этапах ИФА. Традиционно причиной гипоксемии считалось нарушение DLCO, однако в настоящее время доказано, что основным механизмом гипоксемии является вентиляционно- перфузионный дисбаланс (J. West, 1988; N. Strickland, 1993). DLCO является лимитирующим фактором газообмена только при интенсивной физической нагрузке (А. Agusti и соавт., 1991). Наиболее чувствительными тестами при ИФА, как и при других ИЗЛ, является исследование газообмена во время физической нагрузки (J. Fulmer и соавт.,1979; L. Watters и соавт., 1986; А. Wells и соавт.,1997). Кроме изменений РаО2 и Р(А-а)О2, во время нагрузки при ИФА наблюдают повышение функционального мертвого пространства Vd/Vt и работы дыхания, снижение максимальной частоты сердечных сокращений, анаэробного порога и продукции кислорода VO2 (D. Gillespie, В. Staat, 1994).
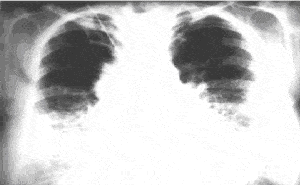
Рис. 3. Обзорная рентгенограмма легких больного ИФА. Снижение прозрачности легочных полей по интерстициальному типу в базальных отделах, округлые кистозные просветления, уменьшение размеров легочных полей.
Функциональные легочные тесты теряют свое значение и предсказательную ценность при сочетании ИФА c эмфиземой, такая ситуация возникает примерно в 17 % (М. Turner-Warwick и соавт., 1980), как правило, у курильщиков. У таких больных, по сравнению с "чистым" ИФА, статические объемы легких (TLC, FRC, RV) сохранены или даже повышены, наблюдается более выраженное снижение DLCO ([19]; D. Schwartz и соавт., 1991) и показателей газообмена (А. Wells и соавт., 1997).
Для оценки активности воспалительного процесса при ИФА используется сканирование легких с галлием-67. Галлий является аналогом железа и связывается в организме с рецепторами трансферрина, которые экспрессируются только на мембранах активных альвеолярных макрофагов, но отсутствуют на нейтрофилах, лимфоцитах и эпителиоцитах 2-го типа (Y. Tsuchiya и соавт.,1992). Поэтому более интенсивное накопление галлия наблюдается при активном альвеолите. Достоинством метода является возможность визуальной оценки протяженности, интенсивности и рисунка активного воспалительного процесса, однако ввиду отсутствия стандартизации метода и четкой количественной оценки галлиевых сканов, а также появлением других более удобных и точных методов, этот метод редко используется в настоящее время [23].
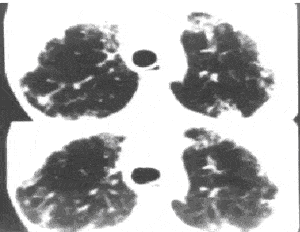
Рис. 4. Компьютерная томограмма легких больного ИФА. “Сотовое легкое”.
Более ценным изотопным методом является позитронное томографическое сканирование легких после ингаляции диэтилен-триаминпентаацетата, меченного технецием-99 (99mTc-DTPA). Данный метод позволяет оценить проницаемость альвеолярно-капиллярной мембраны и диффузного альвеолярного повреждения (Y. Anazawa и соавт., 1991). Повышение клиренса 99mTc-DTPA помогает разграничить больных ИФА со стабильным и прогрессирующим течением (t1/2 снижена у больных с более активным воспалительным процессом), а также имеет определенное прогностическое значение (А. Wells,1993).
Диагностический подход к пациентам с интерстициальными заболеваниями легких
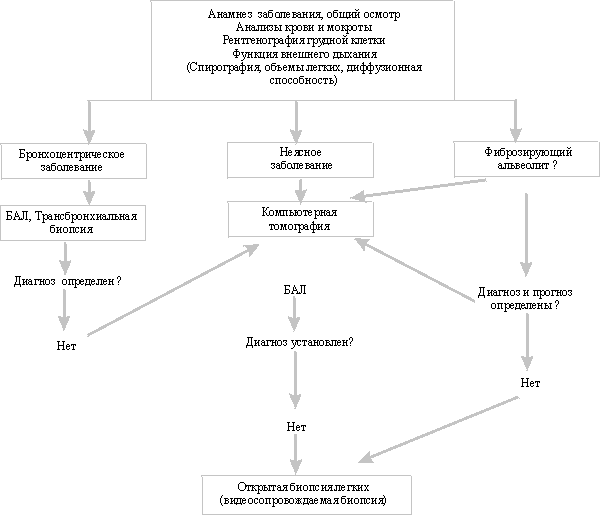
Получены первые данные о значении оценки активности воспаления при ИФА по уровню окиси азота в выдыхаемом воздухе(eNO). Выдыхаемый NO признан адекватным маркером для неинвазивной оценки воспаления дыхательных путей при бронхиальной астме, муковисцидозе, бронхоэктатической болезни (S. Singhn и соавт., 1997). Однако в исследовании S. Loc и соавт. не было обнаружено различий по eNO между больными ИФА и контрольной группой (S. Lok и соавт.,1997).
Бронхоскопия не имеет самостоятельного значения при ИФА. Наиболее частой находкой при бронхоскопии является картина умеренного катарального бронхита, реже – небольшое количество слизистого секрета.
Бронхоальвеолярный лаваж (БАЛ) является важнейшим диагностическим методом при ИЗЛ и позволяет получить для исследования клетки и жидкость из нижних отделов дыхательных путей [24]. Достоинством метода является возможность получения материала из большего количества альвеол, чем при биопсии [9], относительная неинвазивность, возможность многократного повторения, а также безопасность процедуры БАЛ. Общее число осложнений при БАЛ не превышает 0 – 3%, по сравнению с 7% при трансбронхиальной биопсии и с 13% при открытой биопсии легких (W. Petro и соавт., 1989). БАЛ имеет диагностическую значимость, позволяет оценить течение и прогноз ИФА, мониторировать активность воспалительного процесса при терапии заболевания.
Общее число клеток в жидкости БАЛ при ИФА значительно повышено (М. Drent соавт.,1996). Характерной чертой БАЛ является значительный нейтрофилез (в среднем, 12 – 35%) (L. Watters и соавт.,1987). Однако число нейтрофилов повышено при многих других ИЗЛ, включая асбестоз, ДЗСТ, силикозы. Следует помнить, что очень выраженное увеличение числа нейтрофилов в БАЛ можно наблюдать также при сопутствующих бактериальных инфекциях [25]. У больных ИФА также обнаруживают повышение продукта секреции нейтрофилов – коллагеназы (J. Gadek и соавт.,1979), которая играет важное значении в патогенезе заболевания. На поздних стадиях ИФА содержание протеолитических ферментов заметно снижается (М. Schmidt и соавт.,1987).
Для ИФА также характерно повышение эозинофилов, однако степень их повышения не так выражена, как при бронхиальной астме или при синдроме Churg-Strauss, и обычно не превышает 20% (J. Allen, W. Davis,1994), в среднем 5 – 8% от общего числа клеток. Нейтрофильно-эозинофильную ассоциацию обнаруживают у двух третей пациентов с ИФА (P. Haslam и соавт.,1980). Число нейтрофилов и эозинофилов хорошо коррелирует с активностью и течением заболевания [24]. В исследовании L. Watters и соавт. (1987) было показано, что число эозинофилов в БАЛ, превышающее 5%, ассоциировано с более выраженными морфологическими изменениями – картиной "сотового легкого", также наблюдается связь эозинофилии БАЛ со степенью эозинофильной инфильтрации ткани легких (К. Fujimoto и соавт.,1995). Эозинофилия БАЛ (как абсолютное число, так и процент эозинофилов) может быть связана с неблагоприятным прогнозом ИФА (К. Boomars и соавт.,1995). Пациенты с повышенным числом эозинофилов в лаваже имеют, как правило, плохой ответ на терапию стероидами (Р. Haslam и соавт., 1980), причем стероидотерапия способна приводить к снижению числа нейтрофилов в БАЛ, но число эозинофилов не меняется (R. Rudd и соавт.,1981). Однако некоторые больные ИФА с эозинофилией лаважа могут отвечать на терапию комбинацией циклофосфамида и преднизолона [26].
Иногда пациенты с ИФА могут иметь лимфоцитарный профиль БАЛ. Лимфоцитоз лаважа коррелирует с выраженностью альвеолярного и септального воспаления при относительном отсутствии "сотового легкого" по данным открытой биопсии легких, и также связан с хорошим ответом на терапию стероидами (L. Watters и соавт., 1987). Лимфоцитарный характер БАЛ относится к положительным прогностическим факторам заболевания (D. Schwartz и соавт., 1994). Соотношение СD4/CD8 при ИФА обычно повышено, в отличие от фиброзирующих альвеолитов, ассоциированных с ДЗСТ, при которых оно снижено (S. Nagai и соавт., 1985), но при быстром прогрессировании заболевания (снижение VC > 15% и DLCO > 20% в течение 3 мес) наблюдается резкое снижение СD4/CD8 (К. Fujimoto и соавт., 1995).
При оценке цитологического состава БАЛ необходимо учитывать фактор курения. В исследовании D. Schwartz и соавт. у курящих больных ИФА число альвеолярных макрофагов, нейтрофилов и эозинофилов в БАЛ было значительно выше, чем у некурящих пациентов, и повышение числа клеток имело достоверную корреляцию с показателем пачко-лет (D. Schwartz и соавт., 1991).
Диагностическое и прогностическое значение также имеют и неклеточные компоненты БАЛ. При ИФА наблюдается значительное повышение в БАЛ циркулирующих иммунных комплексов, причем в некоторых исследованиях при их высоком уровне отмечались хорошие результаты стероидотерапии [24]. Также значительно повышен уровень иммуноглобулина G, причем отношение IgG к альбумину выше в БАЛ, чем в сыворотке, что, вероятно, связано с местной продукцией иммуноглобулинов (P. Haslam, 1979). Следует отметить, что и альбумин может иметь определенное значение. В исследовании С. Roberts и соавт. содержание альбумина в БАЛ было значительно у больных с альвеолитом, причем уровень альбумина был тесно связан с лимфоцитозом БАЛ, индексом сканирования с галлием-67 и с DLCO (С. Roberts и соавт.,1993).
Липидный состав БАЛ, отражающий систему сурфактанта, при ИФА претерпевает существенные изменения: снижается общий уровень фосфолипидов (PL), меняется соотношение их фракций: уменьшается отношение фосфатидилгликоля к фосфатидилинозитолу (F. McCormack и соавт., 1991). Чем выше уровень PL в БАЛ, тем лучше прогноз заболевания (P. Robinson и соавт., 1988). Одним из наиболее популярных маркеров активности при ИЗЛ является другой компонент сурфактанта – протеин сурфактанта А(SP-A). Его содержание в БАЛ значительно снижено при ИФА (по сравнению с нормой в 2 – 3 раза) (F. McCormack и соавт.,1991), а соотношение SP-A/PL коррелирует с течением заболевания и имеет прогностическое значение: в исследовании F. McCormack и соавт. пятилетняя выживаемость пациентов с ИФА, имевших уровень SP-A/PL выше и ниже 29,7 g/mol, различалась более чем вдвое – соответственно 68 и 30% (F. McCormack и соавт.,1995).
К другим неклеточным компонентам БАЛ, позволяющим оценить активность воспалительного процесса при ИФА относятся продукты секреции альвеолоцитов 2-го типа: муцин- антигены KL-6 (N. Kohno и соавт., 1993), фибробластов – проколлаген-3-пептид и гиалуронан (N. Milman и соавт.,1995); нейтрофилов – эластаза (Y. Sibille и соавт.,1990); тучных клеток – гистамин и триптаза (А. Walls и соавт.,1991); эндотелиальных клеток – ангиотензинпревращающий фермент (U. Specks и соавт.,1990); компонентов внеклеточного матрикса – фибронектин (S. Rennard и соавт.,1982) и витронектин (W. Pohl и соавт.,1991).
Открытая биопсия легких (ОБЛ) является "золотым" диагностическим стандартом при ИФА и позволяет не только установить диагноз, но и предсказать прогноз заболевания и возможный ответ на терапию. Диагностическая информативность ОБЛ превышает 94%, общее число осложнений – около 5 – 19%, летальность достигает 3% (S. Shah и соавт., 1992). Биопсию производят из нескольких участков: из участков с наибольшими изменениями, по данным рентгенографии или КТ, и из участков с относительно сохранной паренхимой. Обычно берется 2 – 4 образца из верхней и нижней долей легкого. Язычковые сегменты и средняя доля являются наименее подходящими для биопсии, так как в этих областях чаще всего развивается фиброз, не связанный с диффузным заболеванием легких, или застойные явления (J. Ray и соавт.,1976). Кроме обычных морфологических и бактериологических/вирусологических исследований, биопсийные материалы могут использоваться для иммунофлюоресцентного, иммуногистохимического и электронно-микроскопического исследований, что необходимо учитывать уже при заборе материала, так как каждое исследование требует специального приготовления и фиксации образцов (G. Raghu, 1995). Кроме качественной оценки биопсии, предложены специальные балльные системы для количественной оценки биопсий (J. Fulmer и соавт., 1979; L. Watters и соавт.,1986; R. Cherniack и соавт.,1995), которые, как правило, учитывают выраженность клеточных воспалительных реакций, фиброза, десквамации, "сотовых" изменений. Такая оценка позволяет стандартизировать оценку биопсийных образцов и более точно установить стадию развития заболевания.
Менее инвазивным методом биопсии, получающим все большую популярность в последнее время, является видеосопровождаемая биопсия легких (ВСБЛ). ВСБЛ позволяет выполнить забор такого же числа и размера образцов, что и при ОБЛ, получить информацию в 95%, однако при ВСБЛ сокращаются продолжительность дренажа плевральной полости, длительность пребывания больных в стационаре и число осложнений процедуры (около 9%) ([27]; D. Bensard и соавт.,1993). Во многих клинических и исследовательских центрах отмечается тенденция к повышению доли числа ВСТБ за счет уменьшения процедур ОБЛ и медиастиноскопии (М. Ravini и соавт., 1997).
Трансбронхиальная биопсия (ТББ) при ИФА имеет небольшое значение в отличие от так называемых бронхоцентрических заболеваний (саркоидоз, экзогенный аллергический альвеолит, облитерирующий бронхиолит с организующейся пневмонией и без нее), опухолей, инфекционных заболеваний (Т. Kotsimbos, Е. Walters, 1995). Однако в результате ТББ можно исключить перечисленные заболевания; достоинствами ТББ является большая безопасность по сравнению с ОБЛ, недостатком – малый размер получаемого образца и, следовательно, меньшая информативность. Осложнения при ТББ не превышают 7%, летальность практически равна 0 (S. Herf и соавт., 1977).
Еще одним инвазивным методом диагностики является чрескожная пункционная биопсия (ЧКПБ). Процедура выполняется специальной режущей иглой типа Silverman под местной анестезией. Информативность ЧПБ при ИЗЛ – около 70%, число осложнений – до 30% (в основном, пневмотораксы, не требующие дренирования), летальности нет (А. Niden, F. Salem, 1997).
Несмотря на неоспоримую ценность исследования, биопсия выполняется лишь у небольшой части больных ИФА. В исследовании BTS трансбронхиальная биопсия проводилась у 28% больных ИФА, чрескожная пункционная биопсия – у 1,0% , открытая бипсия легких – у 12,4%, бронхоальвеолярный лаваж – у 11,3% больных. Перечисленные диагностические процедуры чаще выполнялись у более молодых больных и у больных с более легкими функциональными нарушениями. В одной из работ было показано, что назначать инвазивные процедуры более склонны пульмонологи, чем специалисты общей практики (С. Smith и соавт.,1990).
Лечение
Целью терапии ИФА является улучшение или стабилизация функциональных нарушений, предотвращение дальнейшего прогрессирования заболевания. Успех терапии зависит от стадии заболевания, соотношения процессов воспаления и фиброза, так как пока возможно воздействовать только на воспалительные и иммунологические звенья развития заболевания, и, практически, не существует эффективных препаратов, способных вызвать обратное развитие фиброза.
Основой медикаментозной терапии ИФА по-прежнему остаются пероральные глюкокортикостероиды(ГКС). Доза и длительность терапии значительно варьируют. Обычно начальная суточная доза преднизолона составляет от 1,0 – 1,5 мг/кг (идельной массы тела) до 100 мг. Чаще всего всю суточную дозу назначают в один прием, после завтрака. Через 2 – 3 нед проводится оценка переносимости такой терапии. Начальная доза обычно назначается на период до 12 нед. Если, несмотря на терапию высокими дозами ГКС, произошло ухудшение функциональных показателей (принято считать значимыми изменениями снижение DLCO на 20% (American Thoracic Society,1987), FVC на 15% (American Thoracic Society,1991), увеличение Р(А-а)О2 на 5 мм рт.ст.), рассматривается вопрос о назначении цитостатических препаратов. Если же произошло улучшение или стабилизация функциональных показателей, то в течение последующих 3 мес суточную дозу преднизолона уменьшают до 0,5 мг/ кг. В течение последующих 6 мес дозу преднизолона постепенно уменьшают до 0,25 мг/кг в сутки. Терапия ГКС приводит к объективному эффекту лишь у 15 – 20% больных ИФА [11].
Сравнительная морфологическая характеристика форм ИФА (по Katzenstein A.-L.A., 1994).
| Морфологические особенности пневмония | Обычная интерстициальная пневмония | Десквамативная интерстициальная пневмония | Острая интерстициальная пневмония | Неспецифическая интерстициальная |
| Гистологический паттерн на данный момент времени | Гетерогенный | Гомогенный | Гомогенный | Гомогенный |
| Интерстициальное воспаление | Скудное | Скудное | Скудное | Выраженное |
| Интерстициальный фиброз (коллаген) | Да, "пятнистый" | Варьирует, диффузный | Нет | Варьирует, диффузный |
| Интерстициальный фиброз (фибробласты) | Нет | Нет диффузный | Да, диффузный | Встречается, |
| Организующаяся пневмония | Встречается, фокальная | Нет | Встречается, фокальная | Встречается, фокальная |
| Фокусы фибробластов | Да, выраженные | Нет | Нет | Встречаются, фокальные |
| Участки "сотового легкого" | Да | Нет | Нет | Редко |
| Внутриальвеолярная аккумуляция макрофагов | Встречается, фокальная | Да, диффузная | Нет | Встречается, "пятнистая" |
| Гиалиновые мембраны | Нет | Нет | Нет | Да, фокальные |
Основными механизмами противовоспалительного действия ГКС являются ингибирование миграции нейтрофилов и моноцитов в ткань легких, нарушение высвобождения цитокинов, супрессия иммунного ответа [27]. Проблемой назначения высоких доз ГКС является большое число побочных проявлений. Чаще всего развиваются метаболические и эндокринные осложнения: сахарный диабет, остеопороз, подавление функции надпочечников, нарушение водного и электролитного обмена, развитие желудочных язв, задняя субкапсулярная катаракта, психологические нарушения, миопатия. Стероидная миопатия часто нарушает функцию диафрагмы и межреберных мышц, приводя к снижению силы и выносливости дыхательной мускулатуры, что также вносит свой вклад в развитие диспное (Wang, 1991). Иногда стероидная миопатия может даже маскировать положительные изменения разрешения воспалительного процесса в паренхиме легких.
Цитостатические препараты относятся к терапии второй линии [4]. Наиболее часто используют два препарата: циклофосфамид и азатиоприн.
Циклофосфамид относится к цитотоксическим алкилирующим препаратам, иммуносупрессивное действие опосредуется через уменьшение числа лейкоцитов, особенно лимфоцитов. Обычно препарат назначается per os в дозе 2 мг/кг в сутки, максимальная доза не должна превышать 200 мг в сутки. Оптимальной считается доза, при которой происходит снижение общего числа лейкоцитов до 3 тыс/мл, или числа лимфоцитов в 2 раза [20]. Кроме лейкопении, на фоне терапии циклофосфамидом могут развиваться такие побочные явления, как геморрагический цистит, стоматит, диаррея, повышенная чувствительность организма к инфекциям. Эффективность терапии обычно оценивается через 3 мес от начала лечения.
В нескольких неконтролируемых исследованиях была показана высокая эффективность циклофосфамида при ИФА (С. Agusti и соавт.,1994; К. van Oortegem и соавт., 1994; М. Turner-Warwick и соавт.,1987), однако в рандомизированных контролируемых исследованиях результаты применения препарата оказались более скромными [28].
При быстром прогрессировании заболевания могут оказаться эффективными короткие внутривенные курсы пульс-терапии преднизолоном 250 мг через каждые 6 ч или циклофосфамидом 2 мг/сут однократно в течение 3 – 5 дней [21]. В открытом нерандомизированном исследовании R. Baughman, E. Lower показана высокая эффективность внутривенного циклофосфамида, назначаемого каждые 2 нед в дозе 500 – 1800 мг (R. Baughman, E. Lower, 1992).
Более выраженный положительный эффект циклофосфамида наблюдается у пациентов с фиброзирующими альвеолитами на фоне ДЗСТ (R. Winterbauer, 1991; J. Lynch, W. McCun, 1997).
Азатиоприн относится к пуриновым аналогам, основным механизмом действия является блокада синтеза ДНК. Азатиоприн индуцирует лимфопению, снижает число Т- и В-лимфоцитов, подавляет синтез антител, снижает число натуральных киллеров (J. Lynch, W. McCune, 1997). По сравнению с циклофосфамидом, азатиоприн имеет менее выраженный иммуносупрессивный эффект, однако обладает более мощным противовоспалительным действием: блокада синтеза простагландинов, снижение проникновения нейтрофилов в очаг воспаления (D. Fox, W. McCune, 1994). Препарат назначается per os в дозе 1 – 3 мг/кг в сутки. Начальная доза 50 – 100 мг/сут, с последующим повышением на 25 – 50 мг через каждые 2 – 4 нед до оптимальной (максимальная доза не должна превышать 250 мг/сут). Основными побочными проявлениями являются панцитопения (при снижении числа лейкоцитов ниже 3 тыс/мл или тромбоцитов ниже 100 тыс/мл, доза препарата должна быть снижена), желудочно-кишечные нарушения, гонадо- и тератотоксичность.
Эффективность азатиоприна при ИФА показана в двух контролируемых рандомизированных исследованиях (R. Winterbauer и соавт., 1978; G. Raghu и соавт., 1991). Данные исследования продемонстрировали, что терапия преднизолоном/азатиоприном не более токсична, чем монотерапия преднизолоном.
В исследовании BTS комбинацию преднизолона и циклофосфамида получали 9,5% пациентов, комбинацию преднизолона и азатиоприна – 3,8% пациентов, в общей сложности около 17% всех больных получали терапию циклофосфамидом или азатиоприном [12].
К другим иммуносупрессивным препаратам, которые могут применяться при лечении ИФА, относятся D-пеницилламин, циклоспорин А, колхицин.
D-пеницилламин блокирует образование поперечных связей коллагена и дальнейшее фиброзообразование. Препарат, как правило, более эффективен при обострении или быстром прогрессировании заболевания [1], при развитии фиброзирующих альвеолитов на фоне ДЗСТ [20]. Начальная доза препарата 300 – 450 мг/сут, затем дозу повышают на 300 мг каждую неделю, максимальная доза обычно около 1800 мг/ сут. В настоящее время D-пеницилламин применяют довольно редко, так как препарат обладает серьезными побочными эффектами (J. Meyer-Sydow и соавт., 1990).
Циклоспорин А является эффективным супрессором Т-лимфоцитов, уменьшает гуморальный и клеточный иммунный ответ. Так как Т-лимфоциты имеют значение в процессе воспаления при ИФА, применение циклоспорина А может иметь свою точку приложения при заболевании. В настоящее время проведено несколько открытых исследований, посвященных применению циклоспорина А при ИФА. Комбинация препарата с преднизолоном оказалась эффективной у пациентов с UIP и у NIP, однако часто требуется отмена препарата ввиду побочных реакций: развитие тяжелой артериальной гипертензии, почечная недостаточность (J. Moolman и соавт.,1991).
Перспективным препаратом для терапии ИФА может оказаться колхицин. Колхицин способен уменьшать продукцию макрофагами фибронектина, инсулиноподобного фактора роста, снижать конверсию проколлагена в коллаген, ингибировать миграцию и пролиферацию фибробластов [10]. В ретроспективном исследовании S. Peters и соавт. колхицин в дозе 0,6 – 1,2 мг/сут в комбинации с преднизолоном приводил к клиническому улучшению в 22% случаев и стабилизации функциональных показателей в 39%, и у 39% больных ИФА наблюдали прогрессирование заболевания. Побочными проявлениями при терапии колхицина могут быть диаррея, миопатия, однако при терапии колхицином они возникают более редко, чем при терапии стероидами [10].
Кроме медикаментозной терапии, как и при других заболеваниях легких, при развитии гипоксемии используют терапию кислородом. Показания к длительной оксигенотерапии обычно не отличаются от принятых при хроническом обструктивном заболевании легких: 1) РаО2 в покое менее 55 мм рт.ст.; 2) РаО2 в покое в пределах 55 – 60 мм рт. ст. при наличии признаков легочного сердца или полицитэмии; 3) снижение PaO2 менее 55 мм рт. ст. при физических нагрузках, во время сна. Пациенты с ИФА нуждаются в более высоком назначении потока О2, чем при других заболеваниях легких, ввиду более выраженных вентиляционно-перфузионного дисбаланса и ограничения диффузионной способности легких (А. Braghioli и соавт.,1993).
Кислородотерапия способна уменьшить диспное, повысить интенсивность и длительность физических нагрузок у больных ИФА (А. Harris-Eze и соавт., 1994). Однако выживаемость пациентов ИФА, находящихся на длительной оксигенотерапии, очень низка (К. Strom и соавт., 1993). В исследовании А. Сrockett и соавт. к концу первого года терапии кислородом умерло 50% больных, а через 33 мес – 70% , в то время как выживаемость пациентов с ХОЗЛ к концу первого года оксигенотерапии – около 88%, а через два года – 78% (NOTT, 1980). Вентиляционная поддержка, как правило, не приносит эффекта даже при развитии гиперкапнии на поздних стадиях заболевания (J. Muir, 1993).
Трансплантация легких является на сегодняшний день самым наиболее значимым достижением в области терапии ИФА. Около 15% всех трансплантаций легких в мире выполняются у пациентов с ИФА (J. Edelman, R. Kotloff, 1997). Показаниями к трансплантации легких являются: диспное – III класс по NYHA; снижение VC или FVC ниже 65% ; гипоксемия при физической нагрузке; снижение DLCO менее 30% (S. Smith, 1997). Среди пациентов с ИФА, находящихся на листе ожидания трансплантации, отмечается наибольшая летальность по сравнению с пациентами из других групп (6-месячная выживаемость при ИФА – 38%; при первичной легочной гипертензии – 60%; при муковисцидозе – 74%; при ХОЗЛ – 81%) (А. Hayden, 1993). Патофизиологические особенности заболевания создают идеальные условия для выполнения при ИФА трансплантации одного легкого. Более низкий комплаенс и высокое сопротивление в легочных сосудах обеспечивают преимущественное перераспределение вентиляции и перфузии в сторону аллографта (R. Grossman и соавт., 1990). В некоторых случаях при хронической инфекции Aspergillus на фоне "сотового легкого" предпочтительней является пересадка двух легких; при сопутствующей тяжелой легочной гипертензии выполняют пересадку комплекса сердце–легкие (G. Patterson, 1997).
В посттрансплантационный период у пациентов с ИФА годичная выживаемость составляет около 64%, что несколько ниже, чем при ХОЗЛ – 77% (J. Edelman, R. Kotloff, 1997). Однако успешная трансплантация легкого приводит к значительному улучшению показателей ФВД, газообмена, толерантности к физическим нагрузкам (R. Grossman и соавт.,1990) и улучшению качества жизни (G. Mannes и соавт.,1997).
Перспективными направлениями терапии ИФА являются ингибиторы факторов роста, ингибиторы цитокинов, антифиброзные препараты (ниацин, таурин, pirfenidone), антипротеазы, препараты сурфактанта, генная терапия [29, 30].











