–•–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞ –≤–Є—В–∞–Љ–Є–љ–∞ D, DвАУ–≥–Њ—А–Љ–Њ–љ–∞ –Є DвАУ—Н–љ–і–Њ–Ї—А–Є–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л
–Ґ–µ—А–Љ–Є–љ–Њ–Љ ¬Ђ–≤–Є—В–∞–Љ–Є–љ D¬ї –Њ–±—К–µ–і–Є–љ—П—О—В –≥—А—Г–њ–њ—Г —Б—Е–Њ–і–љ—Л—Е –њ–Њ —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–Љ—Г —Б—В—А–Њ–µ–љ–Є—О (—Б–µ–Ї–Њ—Б—В–µ—А–Њ–Є–і—Л) –Є —Б—Г—Й–µ—Б—В–≤—Г—О—Й–Є—Е –≤ –њ—А–Є—А–Њ–і–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е —Д–Њ—А–Љ –≤–Є—В–∞–Љ–Є–љ–∞ D:
вАУ –Т–Є—В–∞–Љ–Є–љ D1 (—В–∞–Ї –±—Л–ї–Њ –љ–∞–Ј–≤–∞–љ–Њ –Њ—В–Ї—А—Л—В–Њ–µ –≤ 1913 –≥. E.V. McCollum –≤ –ґ–Є—А–µ –Є–Ј –њ–µ—З–µ–љ–Є —В—А–µ—Б–Ї–Є –≤–µ—Й–µ—Б—В–≤–Њ, –њ—А–µ–і—Б—В–∞–≤–ї—П—О—Й–µ–µ —Б–Њ–±–Њ–є —Б–Њ–µ–і–Є–љ–µ–љ–Є–µ —Н—А–≥–Њ–Ї–∞–ї—М—Ж–Є—Д–µ—А–Њ–ї–∞ –Є –ї—О–Љ–Є—Б—В–µ—А–Њ–ї–∞ –≤ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–Є 1:1);
вАУ –Т–Є—В–∞–Љ–Є–љ D2 вАУ —Н—А–≥–Њ–Ї–∞–ї—М—Ж–Є—Д–µ—А–Њ–ї, –Њ–±—А–∞–Ј—Г—О—Й–Є–є—Б—П –Є–Ј —Н—А–≥–Њ—Б—В–µ—А–Њ–ї–∞ –њ–Њ–і –і–µ–є—Б—В–≤–Є–µ–Љ —Б–Њ–ї–љ–µ—З–љ–Њ–≥–Њ —Б–≤–µ—В–∞ –≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –≤ —А–∞—Б—В–µ–љ–Є—П—Е; –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –љ–∞—А—П–і—Г —Б –≤–Є—В–∞–Љ–Є–љ–Њ–Љ D3, –Њ–і–љ—Г –Є–Ј –і–≤—Г—Е –љ–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л—Е –њ—А–Є—А–Њ–і–љ—Л—Е —Д–Њ—А–Љ –≤–Є—В–∞–Љ–Є–љ–∞ D;
вАУ –Т–Є—В–∞–Љ–Є–љ D3 вАУ —Е–Њ–ї–µ–Ї–∞–ї—М—Ж–Є—Д–µ—А–Њ–ї, –Њ–±—А–∞–Ј—Г—О—Й–Є–є—Б—П –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –ґ–Є–≤–Њ—В–љ—Л—Е –Є —З–µ–ї–Њ–≤–µ–Ї–∞ –њ–Њ–і –і–µ–є—Б—В–≤–Є–µ–Љ —Б–Њ–ї–љ–µ—З–љ–Њ–≥–Њ —Б–≤–µ—В–∞ –Є–Ј 7вАУ–і–µ–≥–Є–і—А–Њ—Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞; –Є–Љ–µ–љ–љ–Њ –µ–≥–Њ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В, –Ї–∞–Ї ¬Ђ–Є—Б—В–Є–љ–љ—Л–є¬ї –≤–Є—В–∞–Љ–Є–љ D, —В–Њ–≥–і–∞ –Ї–∞–Ї –і—А—Г–≥–Є–µ –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї–Є —Н—В–Њ–є –≥—А—Г–њ–њ—Л —Б—З–Є—В–∞—О—В –Љ–Њ–і–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ—Л–Љ–Є –њ—А–Њ–Є–Ј–≤–Њ–і–љ—Л–Љ–Є –≤–Є—В–∞–Љ–Є–љ–∞ D;
вАУ –Т–Є—В–∞–Љ–Є–љ D4 вАУ –і–Є–≥–Є–і—А–Њ—В–∞—Е–Є—Б—В–µ—А–Њ–ї –Є–ї–Є 22,23вАУ–і–Є¬≠–≥–Є–і¬≠—А–Њ—Н—А–≥–Њ–Ї–∞–ї—М—Ж–Є—Д–µ—А–Њ–ї;
вАУ –Т–Є—В–∞–Љ–Є–љ D5 вАУ —Б–Є—В–Њ–Ї–∞–ї—М—Ж–Є—Д–µ—А–Њ–ї (–Њ–±—А–∞–Ј—Г–µ—В—Б—П –Є–Ј 7вАУ–і–µ–≥–Є–і—А–Њ—Б–Є—В–Њ—Б—В–µ—А–Њ–ї–∞).
–Т–Є—В–∞–Љ–Є–љ D —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ –Њ—В–љ–Њ—Б—П—В –Ї –≥—А—Г–њ–њ–µ –ґ–Є—А–Њ—А–∞—Б—В–≤–Њ—А–Є–Љ—Л—Е –≤–Є—В–∞–Љ–Є–љ–Њ–≤. –Ю–і–љ–∞–Ї–Њ –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –≤—Б–µ—Е –і—А—Г–≥–Є—Е –≤–Є—В–∞–Љ–Є–љ–Њ–≤ –≤–Є—В–∞–Љ–Є–љ D –љ–µ —П–≤–ї—П–µ—В—Б—П —Б–Њ–±—Б—В–≤–µ–љ–љ–Њ –≤–Є—В–∞–Љ–Є–љ–Њ–Љ –≤ –Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Њ–Љ —Б–Љ—Л—Б–ї–µ —Н—В–Њ–≥–Њ —В–µ—А–Љ–Є–љ–∞, —В–∞–Ї –Ї–∞–Ї –Њ–љ: –∞) –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –љ–µ –∞–Ї—В–Є–≤–µ–љ; –±) –Ј–∞ —Б—З–µ—В –і–≤—Г—Е—Б—В—Г–њ–µ–љ—З–∞—В–Њ–є –Љ–µ—В–∞–±–Њ–ї–Є–Ј–∞—Ж–Є–Є –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –њ—А–µ–≤—А–∞—Й–∞–µ—В—Б—П –≤ –∞–Ї—В–Є–≤–љ—Г—О вАУ –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Г—О —Д–Њ—А–Љ—Г –Є –≤) –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –Љ–љ–Њ–≥–Њ–Њ–±—А–∞–Ј–љ—Л–µ –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Н—Д—Д–µ–Ї—В—Л –Ј–∞ —Б—З–µ—В –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П —Б–Њ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–Љ–Є —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є, –ї–Њ–Ї–∞–ї–Є–Ј–Њ–≤–∞–љ–љ—Л–Љ–Є –≤ —П–і—А–∞—Е –Ї–ї–µ—В–Њ–Ї –Љ–љ–Њ–≥–Є—Е —В–Ї–∞–љ–µ–є –Є –Њ—А–≥–∞–љ–Њ–≤. –Т —Н—В–Њ–Љ –Њ—В–љ–Њ—И–µ–љ–Є–Є –∞–Ї—В–Є–≤–љ—Л–є –Љ–µ—В–∞–±–Њ–ї–Є—В –≤–Є—В–∞–Љ–Є–љ–∞ D –≤–µ–і–µ—В —Б–µ–±—П, –Ї–∞–Ї –Є—Б—В–Є–љ–љ—Л–є –≥–Њ—А–Љ–Њ–љ, –≤ —Б–≤—П–Ј–Є —Б —З–µ–Љ –Є –њ–Њ–ї—Г—З–Є–ї –љ–∞–Ј–≤–∞–љ–Є–µ DвАУ–≥–Њ—А–Љ–Њ–љ. –Я—А–Є —Н—В–Њ–Љ, —Б–ї–µ–і—Г—П –Є—Б—В–Њ—А–Є—З–µ—Б–Ї–Њ–є —В—А–∞–і–Є—Ж–Є–Є, –≤ –љ–∞—Г—З–љ–Њ–є –ї–Є—В–µ—А–∞—В—Г—А–µ –µ–≥–Њ –љ–∞–Ј—Л–≤–∞—О—В –≤–Є—В–∞–Љ–Є–љ–Њ–Љ D.
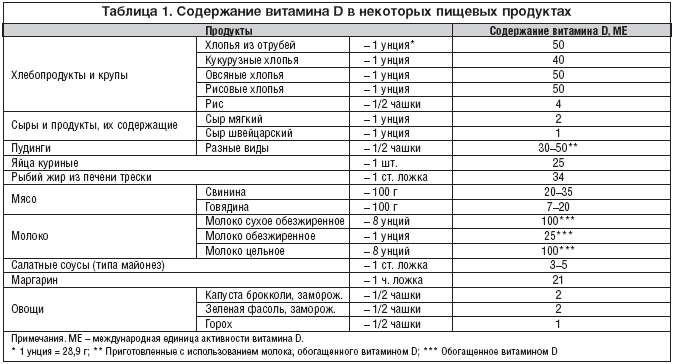
–Т –Њ—А–≥–∞–љ–Є–Ј–Љ —З–µ–ї–Њ–≤–µ–Ї–∞ –≤–Є—В–∞–Љ–Є–љ D2 –њ–Њ—Б—В—Г–њ–∞–µ—В –≤ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –љ–µ–±–Њ–ї—М—И–Є—Е –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞—Е вАУ –љ–µ –±–Њ–ї–µ–µ 20вАУ30% –Њ—В –њ–Њ—В—А–µ–±–љ–Њ—Б—В–Є. –Ю—Б–љ–Њ–≤–љ—Л–Љ–Є –µ–≥–Њ –њ–Њ—Б—В–∞–≤—Й–Є–Ї–∞–Љ–Є —П–≤–ї—П—О—В—Б—П –њ—А–Њ–і—Г–Ї—В—Л –Є–Ј –Ј–ї–∞–Ї–Њ–≤—Л—Е —А–∞—Б—В–µ–љ–Є–є, —А—Л–±–Є–є –ґ–Є—А, —Б–ї–Є–≤–Њ—З–љ–Њ–µ –Љ–∞—Б–ї–Њ, –Љ–∞—А–≥–∞—А–Є–љ, –Љ–Њ–ї–Њ–Ї–Њ, —П–Є—З–љ—Л–є –ґ–µ–ї—В–Њ–Ї –Є –і—А. (—В–∞–±–ї. 1). –Т–Є—В–∞–Љ–Є–љ D2 –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Є—А—Г–µ—В—Б—П —Б –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ–Љ –њ—А–Њ–Є–Ј–≤–Њ–і–љ—Л—Е, –Њ–±–ї–∞–і–∞—О—Й–Є—Е —Б—Е–Њ–і–љ—Л–Љ —Б –Љ–µ—В–∞–±–Њ–ї–Є—В–∞–Љ–Є –≤–Є—В–∞–Љ–Є–љ–∞ D3 –і–µ–є—Б—В–≤–Є–µ–Љ.
–Т—В–Њ—А–∞—П –њ—А–Є—А–Њ–і–љ–∞—П —Д–Њ—А–Љ–∞ –≤–Є—В–∞–Љ–Є–љ–∞ D вАУ –≤–Є—В–∞–Љ–Є–љ D3, –Є–ї–Є —Е–Њ–ї–µ–Ї–∞–ї—М—Ж–Є—Д–µ—А–Њ–ї, —П–≤–ї—П–µ—В—Б—П –Љ–∞–ї–Њ–Ј–∞–≤–Є—Б—П—Й–Є–Љ –Њ—В –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є—П –Є–Ј–≤–љ–µ –±–ї–Є–ґ–∞–є—И–Є–Љ –∞–љ–∞–ї–Њ–≥–Њ–Љ –≤–Є—В–∞–Љ–Є–љ–∞ D2. –•–Њ–ї–µ–Ї–∞–ї—М—Ж–Є—Д–µ—А–Њ–ї –Њ–±—А–∞–Ј—Г–µ—В—Б—П –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –∞–Љ—Д–Є–±–Є–є, —А–µ–њ—В–Є–ї–Є–є, –њ—В–Є—Ж –Є –Љ–ї–µ–Ї–Њ–њ–Є—В–∞—О—Й–Є—Е, –≤ —Б–≤—П–Ј–Є —Б —З–µ–Љ –Є–≥—А–∞–µ—В –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –±–Њ–ї—М—И—Г—О —А–Њ–ї—М –≤ –њ—А–Њ—Ж–µ—Б—Б–∞—Е –ґ–Є–Ј–љ–µ–і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є —З–µ–ї–Њ–≤–µ–Ї–∞, —З–µ–Љ –њ–Њ—Б—В—Г–њ–∞—О—Й–Є–є –≤ –љ–µ–±–Њ–ї—М—И–Є—Е –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞—Е —Б –њ–Є—Й–µ–є –≤–Є—В–∞–Љ–Є–љ D2. –Т –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –≤–Є—В–∞–Љ–Є–љ D3 –Њ–±—А–∞–Ј—Г–µ—В—Б—П –Є–Ј –љ–∞—Е–Њ–і—П—Й–µ–≥–Њ—Б—П –≤ –і–µ—А–Љ–∞–ї—М–љ–Њ–Љ —Б–ї–Њ–µ –Ї–Њ–ґ–Є –њ—А–µ–і—И–µ—Б—В–≤–µ–љ–љ–Є–Ї–∞ вАУ –њ—А–Њ–≤–Є—В–∞–Љ–Є–љ–∞ D3 (7вАУ–і–µ–≥–Є–і—А–Њ—Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞) –њ–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ –Ї–Њ—А–Њ—В–Ї–Њ–≤–Њ–ї–љ–Њ–≤–Њ–≥–Њ —Г–ї—М—В—А–∞—Д–Є–Њ–ї–µ—В–Њ–≤–Њ–≥–Њ –Њ–±–ї—Г—З–µ–љ–Є—П —Б–њ–µ–Ї—В—А–∞ –Т (–£–§вАУ–Т/—Б–Њ–ї–љ–µ—З–љ–Њ–≥–Њ —Б–≤–µ—В–∞, –і–ї–Є–љ–∞ –≤–Њ–ї–љ—Л 290вАУ315 –љ–Љ) –њ—А–Є —В–µ–Љ–њ–µ—А–∞—В—Г—А–µ —В–µ–ї–∞ –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ —Д–Њ—В–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є —А–µ–∞–Ї—Ж–Є–Є —А–∞—Б–Ї—А—Л—В–Є—П –Т –Ї–Њ–ї—М—Ж–∞ —Б—В–µ—А–Њ–Є–і–љ–Њ–≥–Њ —П–і—А–∞ –Є —В–µ—А–Љ–Њ–Є–Ј–Њ–Љ–µ—А–Є–Ј–∞—Ж–Є–Є, —Е–∞—А–∞–Ї—В–µ—А–љ–Њ–є –і–ї—П —Б–µ–Ї–Њ—Б—В–µ—А–Њ–Є–і–Њ–≤.
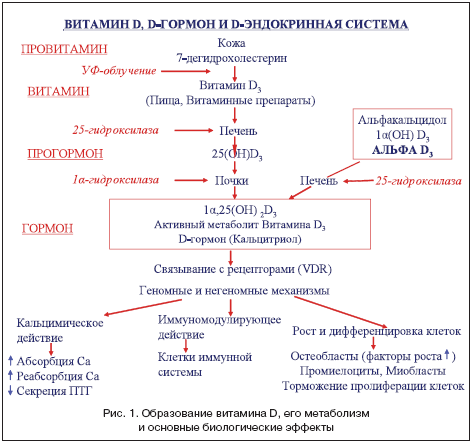
–Т–Є—В–∞–Љ–Є–љ D (–њ–Њ—Б—В—Г–њ–∞—О—Й–Є–є —Б –њ–Є—Й–µ–є –Є–ї–Є –Њ–±—А–∞–Ј—Г—О—Й–Є–є—Б—П –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –≤ –њ—А–Њ—Ж–µ—Б—Б–µ —Н–љ–і–Њ–≥–µ–љ–љ–Њ–≥–Њ —Б–Є–љ—В–µ–Ј–∞) –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –і–≤—Г—Е –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є –≥–Є–і—А–Њ–Ї—Б–Є–ї–Є—А–Њ–≤–∞–љ–Є—П –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –Љ–∞–ї–Њ–∞–Ї—В–Є–≤–љ—Л—Е –њ—А–µ–≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Л—Е —Д–Њ—А–Љ –њ–Њ–і–≤–µ—А–≥–∞–µ—В—Б—П –њ—А–µ–≤—А–∞—Й–µ–љ–Є—О –≤ –∞–Ї—В–Є–≤–љ—Л–µ –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Л–µ —Д–Њ—А–Љ—Л: –љ–∞–Є–±–Њ–ї–µ–µ –≤–∞–ґ–љ—Г—О, –Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ –Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ–Њ –Ј–љ–∞—З–Є–Љ—Г—О вАУ 1a,25вАУ–і–Є–≥–Є–і—А–Њ–Ї—Б–Є–≤–Є—В–∞–Љ–Є–љ D3 (1a,25(–Ю–Э)2D3; –љ–∞–Ј—Л–≤–∞–µ–Љ—Л–є —В–∞–Ї–ґ–µ DвАУ–≥–Њ—А–Љ–Њ–љ–Њ–Љ, –Ї–∞–ї—М—Ж–Є—В—А–Є–Њ–ї–Њ–Љ) –Є –Љ–Є–љ–Њ—А–љ—Г—О вАУ 24,25(–Ю–Э)2D3 (—А–Є—Б. 1).
–£—А–Њ–≤–µ–љ—М –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П DвАУ–≥–Њ—А–Љ–Њ–љ–∞ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –≤–Ј—А–Њ—Б–ї–Њ–≥–Њ –Ј–і–Њ—А–Њ–≤–Њ–≥–Њ —З–µ–ї–Њ–≤–µ–Ї–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В –Њ–Ї–Њ–ї–Њ 0,3вАУ1,0 –Љ–Ї–≥/—Б—Г—В. –Я–µ—А–≤–∞—П —А–µ–∞–Ї—Ж–Є—П –≥–Є–і—А–Њ–Ї—Б–Є–ї–Є—А–Њ–≤–∞–љ–Є—П –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В—Б—П –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤ –њ–µ—З–µ–љ–Є (–і–Њ 90%) –Є –Њ–Ї–Њ–ї–Њ 10% вАУ –≤–љ–µ–њ–µ—З–µ–љ–Њ—З–љ–Њ –њ—А–Є —Г—З–∞—Б—В–Є–Є –Љ–Є–Ї—А–Њ—Б–Њ–Љ–∞–ї—М–љ–Њ–≥–Њ —Д–µ—А–Љ–µ–љ—В–∞ 25вАУ–≥–Є–і—А–Њ–Ї—Б–Є–ї–∞–Ј—Л —Б –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ–Љ –њ—А–Њ–Љ–µ–ґ—Г—В–Њ—З–љ–Њ–є –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –Љ–∞–ї–Њ–∞–Ї—В–Є–≤–љ–Њ–є —В—А–∞–љ—Б–њ–Њ—А—В–љ–Њ–є —Д–Њ—А–Љ—Л вАУ 25(–Ю–Э)D (–Ї–∞–ї—М—Ж–Є–і–Њ–ї).
–У–Є–і—А–Њ–Ї—Б–Є–ї–Є—А–Њ–≤–∞–љ–Є–µ –≤–Є—В–∞–Љ–Є–љ–∞ D3 –≤ –њ–µ—З–µ–љ–Є –љ–µ —П–≤–ї—П–µ—В—Б—П –Њ–±—К–µ–Ї—В–Њ–Љ –Ї–∞–Ї–Є—ЕвАУ–ї–Є–±–Њ –≤–љ–µ–њ–µ—З–µ–љ–Њ—З–љ—Л—Е —А–µ–≥—Г–ї–Є—А—Г—О—Й–Є—Е –≤–ї–Є—П–љ–Є–є –Є –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –њ–Њ–ї–љ–Њ—Б—В—М—О —Б—Г–±—Б—В—А–∞—В–Ј–∞–≤–Є—Б–Є–Љ—Л–є –њ—А–Њ—Ж–µ—Б—Б. –†–µ–∞–Ї—Ж–Є—П 25вАУ–≥–Є–і—А–Њ–Ї—Б–Є–ї–Є—А–Њ–≤–∞–љ–Є—П –њ—А–Њ—В–µ–Ї–∞–µ—В –≤–µ—Б—М–Љ–∞ –±—Л—Б—В—А–Њ –Є –≤–µ–і–µ—В –Ї –њ–Њ–≤—Л—И–µ–љ–Є—О —Г—А–Њ–≤–љ—П 25(–Ю–Э)D –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є. –£—А–Њ–≤–µ–љ—М —Н—В–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞ –Њ—В—А–∞–ґ–∞–µ—В –Ї–∞–Ї –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –≤–Є—В–∞–Љ–Є–љ–∞ D –≤ –Ї–Њ–ґ–µ, —В–∞–Ї –Є –µ–≥–Њ –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–µ —Б –њ–Є—Й–µ–є, –≤ —Б–≤—П–Ј–Є —Б —З–µ–Љ –Љ–Њ–ґ–µ—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П –Ї–∞–Ї –Љ–∞—А–Ї–µ—А —Б—В–∞—В—Г—Б–∞ –≤–Є—В–∞–Љ–Є–љ–∞ D. –І–∞—Б—В–Є—З–љ–Њ —В—А–∞–љ—Б–њ–Њ—А—В–љ–∞—П —Д–Њ—А–Љ–∞ 25(–Ю–Э)D –њ–Њ—Б—В—Г–њ–∞–µ—В –≤ –ґ–Є—А–Њ–≤—Г—О –Є –Љ—Л—И–µ—З–љ—Г—О —В–Ї–∞–љ–Є, –≥–і–µ –Љ–Њ–ґ–µ—В —Б–Њ–Ј–і–∞–≤–∞—В—М —В–Ї–∞–љ–µ–≤—Л–µ –і–µ–њ–Њ —Б –љ–µ–Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–Љ —Б—А–Њ–Ї–Њ–Љ —Б—Г—Й–µ—Б—В–≤–Њ–≤–∞–љ–Є—П. –Я–Њ—Б–ї–µ–і—Г—О—Й–∞—П —А–µ–∞–Ї—Ж–Є—П 1aвАУ–≥–Є–і—А–Њ–Ї—Б–Є–ї–Є—А–Њ–≤–∞–љ–Є—П 25(–Ю–Э)D –њ—А–Њ—В–µ–Ї–∞–µ—В –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –≤ –Ї–ї–µ—В–Ї–∞—Е –њ—А–Њ–Ї—Б–Є–Љ–∞–ї—М–љ—Л—Е –Њ—В–і–µ–ї–Њ–≤ –Ї–∞–љ–∞–ї—М—Ж–µ–≤ –Ї–Њ—А—Л –њ–Њ—З–µ–Ї –њ—А–Є —Г—З–∞—Б—В–Є–Є —Д–µ—А–Љ–µ–љ—В–∞ 1aвАУ–≥–Є–і—А–Њ–Ї—Б–Є–ї–∞–Ј—Л (25вАУ–≥–Є–і—А–Њ–Ї—Б–Є–≤–Є—В–∞–Љ–Є–љ DвАУ1вАУaвАУ–≥–Є–і—А–Њ–Ї—Б–Є–ї–∞–Ј–∞, CYP27–Т1). –Т –Љ–µ–љ—М—И–µ–Љ, —З–µ–Љ –≤ –њ–Њ—З–Ї–∞—Е, –Њ–±—К–µ–Љ–µ 1aвАУ–≥–Є–і—А–Њ¬≠–Ї—Б–Є–ї–Є¬≠—А–Њ¬≠–≤–∞–љ–Є–µ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В—Б—П –Є –Ї–ї–µ—В–Ї–∞–Љ–Є –ї–Є–Љ—Д–Њ–≥–µ–Љ–Њ–њ–Њ—Н—В–Є—З–µ—Б–Ї–Њ–є —Б–Є—Б—В–µ–Љ—Л, –≤ –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є –Є, –Ї–∞–Ї —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ –≤ –њ–Њ—Б–ї–µ–і–љ–µ–µ –≤—А–µ–Љ—П, –Ї–ї–µ—В–Ї–∞–Љ–Є –љ–µ–Ї–Њ—В–Њ—А—Л—Е –і—А—Г–≥–Є—Е —В–Ї–∞–љ–µ–є, —Б–Њ–і–µ—А–ґ–∞—Й–Є–Љ–Є –Ї–∞–Ї 25(–Ю–Э)D, —В–∞–Ї –Є 1aвАУ–≥–Є–і—А–Њ–Ї—Б–Є–ї–∞–Ј—Г. –Ъ–∞–Ї 25вАУ–≥–Є–і—А–Њ–Ї—Б–Є–ї–∞–Ј–∞ (–°YP27–Т1 –Є –µ–µ –і—А—Г–≥–Є–µ –Є–Ј–Њ—Д–Њ—А–Љ—Л), —В–∞–Ї –Є 1aвАУ–≥–Є–і—А–Њ–Ї—Б–Є–ї–∞–Ј–∞ –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В —Б–Њ–±–Њ–є –Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Є–µ –Љ–Є—В–Њ—Е–Њ–љ–і—А–Є–∞–ї—М–љ—Л–µ –Є –Љ–Є–Ї—А–Њ—Б–Њ–Љ–∞–ї—М–љ—Л–µ –Њ–Ї—Б–Є–і–∞–Ј—Л —Б–Њ —Б–Љ–µ—И–∞–љ–љ—Л–Љ–Є —Д—Г–љ–Ї—Ж–Є—П–Љ–Є –Є —Г—З–∞—Б—В–≤—Г—О—В –≤ –њ–µ—А–µ–љ–Њ—Б–µ —Н–ї–µ–Ї—В—А–Њ–љ–Њ–≤ –Њ—В –Э–Р–Ф–§ —З–µ—А–µ–Ј —Д–ї–∞–≤–Њ–њ—А–Њ—В–µ–Є–љ—Л –Є —Д–µ—А—А–Њ–і–Њ–Ї—Б–Є–љ –≤ —Ж–Є—В–Њ—Е—А–Њ–Љ –†450 [Gupta et al., 2004]. –Ю–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –≤ –њ–Њ—З–Ї–∞—Е 1,25вАУ–і–Є–≥–Є–і—А–Њ–Ї—Б–Є–≤–Є—В–∞–Љ–Є–љ–∞ D3 —Б—В—А–Њ–≥–Њ —А–µ–≥—Г–ї–Є—А—Г–µ—В—Б—П —А—П–і–Њ–Љ —Н–љ–і–Њ–≥–µ–љ–љ—Л—Е –Є —Н–Ї–Ј–Њ–≥–µ–љ–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤.
–Т —З–∞—Б—В–љ–Њ—Б—В–Є, —А–µ–≥—Г–ї—П—Ж–Є—П —Б–Є–љ—В–µ–Ј–∞ 1a,25(–Ю–Э)2D3 –≤ –њ–Њ—З–Ї–∞—Е —П–≤–ї—П–µ—В—Б—П –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–µ–є –њ–∞—А–∞—В–Є—А–µ–Њ–Є–і–љ–Њ–≥–Њ –≥–Њ—А–Љ–Њ–љ–∞ (–Я–Ґ–У), –љ–∞ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О –Ї–Њ—В–Њ—А–Њ–≥–Њ –≤ –Ї—А–Њ–≤–Є, –≤ —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М, –њ–Њ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Г –Њ–±—А–∞—В–љ–Њ–є —Б–≤—П–Ј–Є –Њ–Ї–∞–Ј—Л–≤–∞—О—В –≤–ї–Є—П–љ–Є–µ –Ї–∞–Ї —Г—А–Њ–≤–µ–љ—М —Б–∞–Љ–Њ–≥–Њ –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є—В–∞ –≤–Є—В–∞–Љ–Є–љ–∞ D3, —В–∞–Ї –Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –Ї–∞–ї—М—Ж–Є—П –Є —Д–Њ—Б—Д–Њ—А–∞ –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –∞–Ї—В–Є–≤–Є—А—Г—О—Й–µ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ 1aвАУ–≥–Є–і—А–Њ¬≠–Ї—Б–Є–ї–∞–Ј—Г –Є –њ—А–Њ—Ж–µ—Б—Б 1aвАУ–≥–Є–і—А–Њ–Ї—Б–Є¬≠–ї–Є¬≠—А–Њ¬≠–≤–∞–љ–Є—П –Њ–Ї–∞–Ј—Л–≤–∞—О—В –Є –і—А—Г–≥–Є–µ —Д–∞–Ї—В–Њ—А—Л, –Ї —З–Є—Б–ї—Г –Ї–Њ—В–Њ—А—Л—Е –Њ—В–љ–Њ—Б—П—В—Б—П –њ–Њ–ї–Њ–≤—Л–µ –≥–Њ—А–Љ–Њ–љ—Л (—Н—Б—В—А–Њ–≥–µ–љ—Л –Є –∞–љ–і—А–Њ–≥–µ–љ—Л), –Ї–∞–ї—М—Ж–Є—В–Њ–љ–Є–љ, –њ—А–Њ–ї–∞–Ї—В–Є–љ, –≥–Њ—А–Љ–Њ–љ —А–Њ—Б—В–∞ (—З–µ—А–µ–Ј –Ш–Я–§–†вАУ1) –Є –і—А.; –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є 1aвАУ–≥–Є–і—А–Њ–Ї—Б–Є–ї–∞–Ј—Л —П–≤–ї—П—О—В—Б—П 1a,25(–Ю–Э)2D3 –Є —А—П–і –µ–≥–Њ —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є—Е –∞–љ–∞–ї–Њ–≥–Њ–≤, –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і–љ—Л–µ (–У–Ъ–°) –≥–Њ—А–Љ–Њ–љ—Л –Є –і—А. –§–∞–Ї—В–Њ—А —А–Њ—Б—В–∞ –Є–Ј —Д–Є–±—А–Њ–±–ї–∞—Б—В–Њ–≤ (FGF23), —Б–µ–Ї—А–µ—В–Є—А—Г–µ–Љ—Л–є –≤ –Ї–ї–µ—В–Ї–∞—Е –Ї–Њ—Б—В–Є, –≤—Л–Ј—Л–≤–∞–µ—В –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –љ–∞—В—А–Є–євАУ—Д–Њ—Б¬≠—Д–∞—ВвАУ–Ї–Њ¬≠—В—А–∞–љ¬≠—Б–њ–Њ—А—В–µ—А–∞, –Ї–Њ—В–Њ—А—Л–є –і–µ–є—Б—В–≤—Г–µ—В –≤ –Ї–ї–µ—В–Ї–∞—Е –њ–Њ—З–µ–Ї –Є —В–Њ–љ–Ї–Њ–≥–Њ –Ї–Є—И–µ—З–љ–Є–Ї–∞, –Њ–Ї–∞–Ј—Л–≤–∞–µ—В —В–Њ—А–Љ–Њ–Ј—П—Й–µ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ —Б–Є–љ—В–µ–Ј 1,25вАУ–і–Є–≥–Є–і—А–Њ–Ї—Б–Є–≤–Є—В–∞–Љ–Є–љ–∞ D3. –Э–∞ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ –≤–Є¬≠—В–∞–Љ–Є–љ–∞ D –Њ–Ї–∞–Ј—Л–≤–∞—О—В –≤–ї–Є—П–љ–Є–µ –Є –љ–µ–Ї–Њ—В–Њ—А—Л–µ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ —Б—А–µ–і—Б—В–≤–∞ (–Ы–°, –љ–∞–њ—А–Є–Љ–µ—А, –њ—А–Њ—В–Є–≤–Њ—Н–њ–Є–ї–µ–њ—В–Є—З–µ—Б–Ї–Є–µ —Б—А–µ–і—Б—В–≤–∞).
1ќ±,25вАУ–і–Є–≥–Є–і—А–Њ–Ї—Б–Є–≤–Є—В–∞–Љ–Є–љ D3 –њ–Њ–≤—Л—И–∞–µ—В —Н–Ї—Б–њ—А–µ—Б—Б–Є—О 25вАУ–≥–Є–і—А–Њ–Ї—Б–Є–≤–Є—В–∞–Љ–Є–љ DвАУ24вАУ–≥–Є–і—А–Њ–Ї—Б–Є–ї–∞–Ј—Л (24вАУ–Ю–Э–∞–Ј—Л) вАУ —Д–µ—А–Љ–µ–љ—В–∞, –Ї–∞—В–∞–ї–Є–Ј–Є—А—Г—О—Й–µ–≥–Њ –µ–≥–Њ –і–∞–ї—М–љ–µ–є—И–Є–є –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—О –≤–Њ–і–Њ—А–∞—Б—В–≤–Њ—А–Є–Љ–Њ–є –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –љ–µ–∞–Ї—В–Є–≤–љ–Њ–є –Ї–∞–ї—М—Ж–Є—В—А–Њ–µ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л, –Ї–Њ—В–Њ—А–∞—П –≤—Л–і–µ–ї—П–µ—В—Б—П —Б –ґ–µ–ї—З—М—О.
–Т—Б–µ –њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л–µ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В—Л –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –≤–Є—В–∞–Љ–Є–љ–∞ D, –∞ —В–∞–Ї–ґ–µ —В–Ї–∞–љ–µ–≤—Л–µ —П–і–µ—А–љ—Л–µ —А–µ—Ж–µ–њ—В–Њ—А—Л –Ї 1ќ±,25вАУ–і–Є–≥–Є–і—А–Њ–Ї—Б–Є–≤–Є—В–∞–Љ–Є–љ D3 (DвАУ–≥–Њ—А–Љ–Њ–љ—Г), –њ–Њ–ї—Г—З–Є–≤—И–Є–µ –љ–∞–Ј–≤–∞–љ–Є–µ —А–µ—Ж–µ–њ—В–Њ—А—Л –Ї –≤–Є—В–∞–Љ–Є–љ—Г D (–†–ТD), –Њ–±—К–µ–і–Є–љ—П—О—В –≤ —Н–љ–і–Њ–Ї—А–Є–љ–љ—Г—О —Б–Є—Б—В–µ–Љ—Г –≤–Є—В–∞–Љ–Є–љ–∞ D, —Д—Г–љ–Ї—Ж–Є–Є –Ї–Њ—В–Њ—А–Њ–є —Б–Њ—Б—В–Њ—П—В –≤ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –≥–µ–љ–µ—А–Є—А–Њ–≤–∞—В—М –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —А–µ–∞–Ї—Ж–Є–Є –±–Њ–ї–µ–µ —З–µ–Љ –≤ 40 —В–Ї–∞–љ—П—ЕвАУ–Љ–Є—И–µ–љ—П—Е –Ј–∞ —Б—З–µ—В —А–µ–≥—Г–ї—П—Ж–Є–Є –†–ТDвАЩ–Љ–Є —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Є –≥–µ–љ–Њ–≤ (–≥–µ–љ–Њ–Љ–љ—Л–є –Љ–µ—Е–∞–љ–Є–Ј–Љ) –Є –±—Л—Б—В—А—Л—Е –≤–љ–µ–≥–µ–љ–Њ–Љ–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є, –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ–Љ—Л—Е –њ—А–Є –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–Є —Б –†–ТD, –ї–Њ–Ї–∞–ї–Є–Ј–Њ–≤–∞–љ–љ—Л–Љ–Є –љ–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є —А—П–і–∞ –Ї–ї–µ—В–Њ–Ї. –Ч–∞ —Б—З–µ—В –≥–µ–љ–Њ–Љ–љ—Л—Е –Є –≤–љ–µ–≥–µ–љ–Њ–Љ–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ DвАУ—Н–љ–і–Њ–Ї—А–Є–љ–љ–∞—П —Б–Є—Б—В–µ–Љ–∞ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В —А–µ–∞–Ї—Ж–Є–Є –њ–Њ–і–і–µ—А–ґ–∞–љ–Є—П –Љ–Є–љ–µ—А–∞–ї—М–љ–Њ–≥–Њ –≥–Њ–Љ–µ–Њ—Б—В–∞–Ј–∞ (–њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –≤ —А–∞–Љ–Ї–∞—Е –Ї–∞–ї—М—Ж–Є–євАУ—Д–Њ—Б—Д–Њ—А–љ–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞), –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є —Н–ї–µ–Ї—В—А–Њ–ї–Є—В–Њ–≤ –Є –Њ–±–Љ–µ–љ–∞ —Н–љ–µ—А–≥–Є–Є. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Њ–љ–∞ –њ—А–Є–љ–Є–Љ–∞–µ—В —Г—З–∞—Б—В–Є–µ –≤ –њ–Њ–і–і–µ—А–ґ–∞–љ–Є–Є –∞–і–µ–Ї–≤–∞—В–љ–Њ–є –Љ–Є–љ–µ—А–∞–ї—М–љ–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є –Ї–Њ—Б—В–µ–є, –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–µ –ї–Є–њ–Є–і–Њ–≤, —А–µ–≥—Г–ї—П—Ж–Є–Є —Г—А–Њ–≤–љ—П –Р–Ф, —А–Њ—Б—В–∞ –≤–Њ–ї–Њ—Б, —Б—В–Є–Љ—Г–ї—П—Ж–Є–Є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–Є –Ї–ї–µ—В–Њ–Ї, –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є–Є –Ї–ї–µ—В–Њ—З–љ–Њ–є –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є–Є, —А–µ–∞–ї–Є–Ј–∞—Ж–Є–Є –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —А–µ–∞–Ї—Ж–Є–є (–Є–Љ–Љ—Г–љ–Њ–і–µ–њ—А–µ—Б—Б–Є–≤–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ).
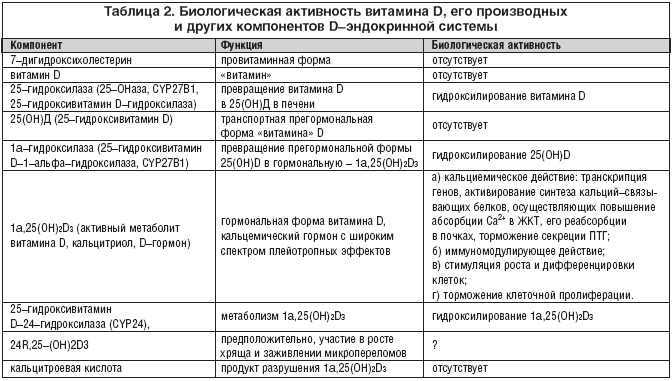
–Я—А–Є —Н—В–Њ–Љ –ї–Є—И—М —Б–∞–Љ DвАУ–≥–Њ—А–Љ–Њ–љ –Є –≥–Є–і—А–Њ–Ї—Б–Є–ї–Є—А—Г—О—Й–Є–µ —Д–µ—А–Љ–µ–љ—В—Л —П–≤–ї—П—О—В—Б—П –∞–Ї—В–Є–≤–љ—Л–Љ–Є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞–Љ–Є DвАУ—Н–љ–і–Њ¬≠–Ї—А–Є–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л (—В–∞–±–ї. 2).
–Т–∞–ґ–љ–µ–є—И–Є–Љ–Є —А–µ–∞–Ї—Ж–Є—П–Љ–Є, –≤ –Ї–Њ—В–Њ—А—Л—Е 1ќ±,25(–Ю–Э)2D3 —Г—З–∞—Б—В–≤—Г–µ—В –Ї–∞–Ї –Ї–∞–ї—М—Ж–µ–Љ–Є—З–µ—Б–Ї–Є–є –≥–Њ—А–Љ–Њ–љ, —П–≤–ї—П—О—В—Б—П –∞–±—Б–Њ—А–±—Ж–Є—П –Ї–∞–ї—М—Ж–Є—П –≤ –Ц–Ъ–Ґ –Є –µ–≥–Њ —А–µ–∞–±—Б–Њ—А–±—Ж–Є—П –≤ –њ–Њ—З–Ї–∞—Е. DвАУ–≥–Њ—А–Љ–Њ–љ —Г—Б–Є–ї–Є–≤–∞–µ—В –Ї–Є—И–µ—З–љ—Г—О –∞–±—Б–Њ—А–±—Ж–Є—О –Ї–∞–ї—М—Ж–Є—П –≤ —В–Њ–љ–Ї–Њ–Љ –Ї–Є—И–µ—З–љ–Є–Ї–µ –Ј–∞ —Б—З–µ—В –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П —Б–Њ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–Љ–Є –†–ТD вАУ –њ—А–µ–і—Б—В–∞–≤–ї—П—О—Й–Є–Љ–Є —Б–Њ–±–Њ–є –•вАУ—А–µ—Ж–µ–њ¬≠—В–Њ—А–љ—Л–є –Ї–Њ–Љ–њ–ї–µ–Ї—Б —А–µ—В–Є–љ–Њ–µ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л (–†–ТDвАУ–•–†–Ъ), –≤–µ–і—Г—Й–µ–≥–Њ –Ї —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –≤ –Ї–Є—И–µ—З–љ–Њ–Љ —Н–њ–Є—В–µ–ї–Є–Є –Ї–∞–ї—М—Ж–Є–µ–≤—Л—Е –Ї–∞–љ–∞–ї–Њ–≤ [1,6,8]. –≠—В–Є –≤—А–µ–Љ–µ–љ–љ—Л–µ (—В.–µ. —Б—Г—Й–µ—Б—В–≤—Г—О—Й–Є–µ –љ–µ–њ–Њ—Б—В–Њ—П–љ–љ–Њ) –њ–Њ—В–µ–љ—Ж–Є–∞–ївАУ–Ј–∞–≤–Є—Б–Є–Љ—Л–µ –Ї–∞—В–Є–Њ–љ–љ—Л–µ –Ї–∞–љ–∞–ї—Л –Њ—В–љ–Њ—Б—П—В—Б—П –Ї 6вАУ–Љ—Г —З–ї–µ–љ—Г –њ–Њ–і—Б–µ–Љ–µ–є—Б—В–≤–∞ V (TRPV6). –Т –Ї–Є—И–µ—З–љ—Л—Е —Н–љ—В–µ—А–Њ—Ж–Є—В–∞—Е –∞–Ї—В–Є–≤–∞—Ж–Є—П –†–Т–Ф —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –∞–љ–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ вАУ –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —Б–Є–љ—В–µ–Ј–∞ –Ї–∞–ї—М–±–Є–і–Є–љ–∞ 9–Ъ вАУ –Ї–∞–ї—М—Ж–Є–євАУ—Б–≤—П–Ј—Л–≤–∞—О—Й–µ–≥–Њ –±–µ–ї–Ї–∞ (–°–∞–°–С), –Ї–Њ—В–Њ—А—Л–є –≤—Л—Е–Њ–і–Є—В –≤ –њ—А–Њ—Б–≤–µ—В –Ї–Є—И–µ—З–љ–Є–Ї–∞, —Б–≤—П–Ј—Л–≤–∞–µ—В –°–∞2+ –Є —В—А–∞–љ—Б–њ–Њ—А—В–Є—А—Г–µ—В –Є—Е —З–µ—А–µ–Ј –Ї–Є—И–µ—З–љ—Г—О —Б—В–µ–љ–Ї—Г –≤ –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є–µ —Б–Њ—Б—Г–і—Л –Є –Ј–∞—В–µ–Љ –≤ —Б–Њ—Б—Г–і–Є—Б—В—Г—О —Б–Є—Б—В–µ–Љ—Г. –Ю–± —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –і–∞–љ–љ–Њ–≥–Њ –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В —В–Њ—В —Д–∞–Ї—В, —З—В–Њ –±–µ–Ј —Г—З–∞—Б—В–Є—П –≤–Є—В–∞–Љ–Є–љ–∞ D –ї–Є—И—М 10вАУ15% –њ–Є—Й–µ–≤–Њ–≥–Њ –Ї–∞–ї—М—Ж–Є—П –Є 60% —Д–Њ—Б—Д–Њ—А–∞ –∞–±—Б–Њ—А–±–Є—А—Г—О—В—Б—П –≤ –Ї–Є—И–µ—З–љ–Є–Ї–µ. –Т–Ј–∞–Є–Љ–Њ¬≠–і–µ–є—Б—В–≤–Є–µ –Љ–µ–ґ–і—Г 1ќ±,25вАУ–і–Є–≥–Є–і—А–Њ–Ї—Б–Є–≤–Є—В–∞–Љ–Є–љ–Њ–Љ D3 –Є –†–ТD –њ–Њ–≤—Л—И–∞–µ—В —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Ї–Є—И–µ—З–љ–Њ–є –∞–±—Б–Њ—А–±—Ж–Є–Є –°–∞2+ –і–Њ 30вАУ40%, —В.–µ. –≤ 2вАУ4 —А–∞–Ј–∞, –∞ —Д–Њ—Б—Д–Њ—А–∞ вАУ –і–Њ 80%. –°—Е–Њ–і–љ—Л–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –і–µ–є—Б—В–≤–Є—П DвАУ–≥–Њ—А–Љ–Њ–љ–∞ –ї–µ–ґ–∞—В –≤ –Њ—Б–љ–Њ–≤–µ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ–Љ–Њ–є –њ–Њ–і –µ–≥–Њ –≤–ї–Є—П–љ–Є–µ–Љ —А–µ–∞–±—Б–Њ—А–±—Ж–Є–Є –°–∞2+ –≤ –њ–Њ—З–Ї–∞—Е.
–Т –Ї–Њ—Б—В—П—Е 1ќ±,25(–Ю–Э)2D3 —Б–≤—П–Ј—Л–≤–∞–µ—В—Б—П —Б —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є –љ–∞ –Ї–Њ—Б—В—МвАУ—Д–Њ—А–Љ–Є—А—Г—О—Й–Є—Е –Ї–ї–µ—В–Ї–∞—Е вАУ –Њ—Б—В–µ–Њ–±–ї–∞—Б—В–∞—Е (–Ю–С), –≤—Л–Ј—Л–≤–∞—П –њ–Њ–≤—Л—И–µ–љ–Є–µ —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –Є–Љ–Є –ї–Є–≥–∞–љ–і–∞ —А–µ—Ж–µ–њ—В–Њ—А–∞ –∞–Ї—В–Є–≤–∞—В–Њ—А–∞ —П–і–µ—А–љ–Њ–≥–Њ —Д–∞–Ї—В–Њ—А–∞ –Ї–Т (RANKL) [6,8]. –†–µ—Ж–µ–њ¬≠—В–Њ—А –∞–Ї—В–Є–≤–∞—В–Њ—А —П–і–µ—А–љ–Њ–≥–Њ —Д–∞–Ї—В–Њ—А–∞ –Ї–Т (RANK), —П–≤–ї—П—О—Й–Є–є—Б—П —А–µ—Ж–µ–њ—В–Њ—А–Њ–Љ –і–ї—П RANKL, –ї–Њ–Ї–∞–ї–Є–Ј–Њ–≤–∞–љ–љ—Л–Љ –љ–∞ –њ—А–µ–Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–∞—Е (–њ—А–µ–Ю–Ъ), —Б–≤—П–Ј—Л–≤–∞–µ—В RANKL, —З—В–Њ –≤—Л–Ј—Л–≤–∞–µ—В –±—Л—Б—В—А–Њ–µ —Б–Њ–Ј—А–µ–≤–∞–љ–Є–µ –њ—А–µ–Ю–Ъ –Є –Є—Е –њ—А–µ–≤—А–∞—Й–µ–љ–Є–µ –≤ –Ј—А–µ–ї—Л–µ –Ю–Ъ. –Т –њ—А–Њ—Ж–µ—Б—Б–∞—Е –Ї–Њ—Б—В–љ–Њ–≥–Њ —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—П –Ј—А–µ–ї—Л–µ –Ю–Ъ —А–µ–Ј–Њ—А–±–Є—А—Г—О—В –Ї–Њ—Б—В—М, —З—В–Њ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –≤—Л–і–µ–ї–µ–љ–Є–µ–Љ –Ї–∞–ї—М—Ж–Є—П –Є —Д–Њ—Б—Д–Њ—А–∞ –Є–Ј –Љ–Є–љ–µ—А–∞–ї—М–љ–Њ–≥–Њ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞ (–≥–Є–і—А–Њ–Ї—Б–Є–∞–њ–∞—В–Є—В–∞) –Є –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –њ–Њ–і–і–µ—А–ґ–∞–љ–Є–µ —Г—А–Њ–≤–љ—П –Ї–∞–ї—М—Ж–Є—П –Є —Д–Њ—Б—Д–Њ—А–∞ –≤ –Ї—А–Њ–≤–Є. –Т —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М, –∞–і–µ–Ї–≤–∞—В–љ—Л–є —Г—А–Њ–≤–µ–љ—М –Ї–∞–ї—М—Ж–Є—П (–°–∞2+) –Є —Д–Њ—Б—Д–Њ—А–∞ (–≤ –≤–Є–і–µ —Д–Њ—Б—Д–∞—В–∞ (–Э–†–Ю42вАУ) –љ–µ–Њ–±—Е–Њ–і–Є–Љ –і–ї—П –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є –Љ–Є–љ–µ—А–∞–ї–Є–Ј–∞—Ж–Є–Є —Б–Ї–µ–ї–µ—В–∞.
DвАУ–і–µ—Д–Є—Ж–Є—В
–Т —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Г—Б–ї–Њ–≤–Є—П—Е –њ–Њ—В—А–µ–±–љ–Њ—Б—В—М –≤ –≤–Є—В–∞–Љ–Є–љ–µ D –≤–∞—А—М–Є—А—Г–µ—В –Њ—В 200 –Ь–Х (—Г –≤–Ј—А–Њ—Б–ї—Л—Е) –і–Њ 400 –Ь–Х (—Г –і–µ—В–µ–є) –≤ —Б—Г—В–Ї–Є. –°—З–Є—В–∞–µ—В—Б—П, —З—В–Њ –Ї—А–∞—В–Ї–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–µ (–≤ —В–µ—З–µ–љ–Є–µ 10вАУ30 –Љ–Є–љ.) —Б–Њ–ї–љ–µ—З–љ–Њ–µ –Њ–±–ї—Г—З–µ–љ–Є–µ –ї–Є—Ж–∞ –Є –Њ—В–Ї—А—Л—В—Л—Е —А—Г–Ї —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–љ–Њ –њ—А–Є–µ–Љ—Г –њ—А–Є–Љ–µ—А–љ–Њ 200 –Ь–Х –≤–Є—В–∞–Љ–Є–љ–∞ D, —В–Њ–≥–і–∞ –Ї–∞–Ї –њ–Њ–≤—В–Њ—А–љ–Њ–µ –њ—А–µ–±—Л–≤–∞–љ–Є–µ –љ–∞ —Б–Њ–ї–љ—Ж–µ –≤ –Њ–±–љ–∞–ґ–µ–љ–љ–Њ–Љ –≤–Є–і–µ —Б –њ–Њ—П–≤–ї–µ–љ–Є–µ–Љ —Г–Љ–µ—А–µ–љ–љ–Њ–є –Ї–Њ–ґ–љ–Њ–є —Н—А–Є—В–µ–Љ—Л –≤—Л–Ј—Л–≤–∞–µ—В –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П 25(–Ю–Э)D, –≤—Л—И–µ –љ–∞–±–ї—О–і–∞–µ–Љ–Њ–≥–Њ –њ—А–Є –Љ–љ–Њ–≥–Њ–Ї—А–∞—В–љ–Њ–Љ –µ–≥–Њ –≤–≤–µ–і–µ–љ–Є–Є –≤ –і–Њ–Ј–µ 10 000 –Ь–Х (250 –Љ–Ї–≥) –≤ –і–µ–љ—М [8,11,12].
–•–Њ—В—П –Ї–Њ–љ—Б–µ–љ—Б—Г—Б –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–≥–Њ —Г—А–Њ–≤–љ—П 25(–Ю–Э)D, –Є–Ј–Љ–µ—А—П–µ–Љ–Њ–≥–Њ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є, –Є –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В, –і–µ—Д–Є—Ж–Є—В –≤–Є—В–∞–Љ–Є–љ–∞ D (–Ф–ТD), –њ–Њ –Љ–љ–µ–љ–Є—О –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ —Н–Ї—Б–њ–µ—А—В–Њ–≤, –Є–Љ–µ–µ—В –Љ–µ—Б—В–Њ —В–Њ–≥–і–∞, –Ї–Њ–≥–і–∞ 25(–Ю–Э)D –љ–Є–ґ–µ 20 –љ–≥/–Љ–ї (—В.–µ. –љ–Є–ґ–µ 50 –љ–Љ–Њ–ї/–ї). –£—А–Њ–≤–µ–љ—М 25(–Ю–Э)D –Њ–±—А–∞—В–љ–Њ –њ—А–Њ–њ–Њ—А—Ж–Є–Њ–љ–∞–ї–µ–љ —Г—А–Њ–≤–љ—О –Я–Ґ–У –≤ –њ—А–µ–і–µ–ї–∞—Е, –Ї–Њ–≥–і–∞ —Г—А–Њ–≤–µ–љ—М –њ–Њ—Б–ї–µ–і–љ–µ–≥–Њ (–Я–Ґ–У) –і–Њ—Б—В–Є–≥–∞–µ—В –Є–љ—В–µ—А–≤–∞–ї–∞ –Љ–µ–ґ–і—Г 30 –Є 40 –љ–≥/–Љ–ї (—В.–µ. –Њ—В 75 –і–Њ 100 –љ–Љ–Њ–ї/–ї), –њ—А–Є —Г–Ї–∞–Ј–∞–љ–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є—П—Е –Ї–Њ—В–Њ—А–Њ–≥–Њ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –Я–Ґ–У –љ–∞—З–Є–љ–∞–µ—В —Б–љ–Є–ґ–∞—В—М—Б—П (–Њ—В –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–є). –С–Њ–ї–µ–µ —В–Њ–≥–Њ, –Ї–Є—И–µ—З–љ—Л–є —В—А–∞–љ—Б–њ–Њ—А—В –°–∞2+ –њ–Њ–≤—Л—И–∞–ї—Б—П –і–Њ 45вАУ65% —Г –ґ–µ–љ—Й–Є–љ, –Ї–Њ–≥–і–∞ —Г—А–Њ–≤–µ–љ—М 25(–Ю–Э)D —Г–≤–µ–ї–Є—З–Є–≤–∞–ї—Б—П –≤ —Б—А–µ–і–љ–µ–Љ –Њ—В 20 –і–Њ 32 –љ–≥/–Љ–ї (–Њ—В 50 –і–Њ 80 –љ–Љ–Њ–ї/–ї). –Э–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —Н—В–Є—Е –і–∞–љ–љ—Л—Е —Г—А–Њ–≤–µ–љ—М 25(–Ю–Э)D –Њ—В 21 –і–Њ 29 –љ–≥/–Љ–ї (—В.–µ. 52 –і–Њ 72 –љ–Љ–Њ–ї/–ї) –Љ–Њ–ґ–µ—В —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М—Б—П, –Ї–∞–Ї –Є–љ–і–Є–Ї–∞—В–Њ—А –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –≤–Є—В–∞–Љ–Є–љ–∞ D, –∞ —Г—А–Њ–≤–µ–љ—М 30 –љ–≥/–Љ–ї –Є –≤—Л—И–µ вАУ –Ї–∞–Ї –і–Њ—Б—В–∞—В–Њ—З–љ—Л–є (—В.–µ. –±–ї–Є–Ј–Ї–Є–є –Ї –љ–Њ—А–Љ–∞–ї—М–љ–Њ–Љ—Г). –Ш–љ—В–Њ¬≠–Ї—Б–Є¬≠–Ї–∞—Ж–Є—П –≤–Є—В–∞–Љ–Є–љ–Њ–Љ D –љ–∞–±–ї—О–і–∞–µ—В—Б—П, –Ї–Њ–≥–і–∞ —Г—А–Њ–≤–µ–љ—М 25(–Ю–Э)D –≤—Л—И–µ, —З–µ–Љ 150 –љ–≥/–Љ–ї (374 –љ–Љ–Њ–ї/–ї).
–° –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –≤ –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П 25(–Ю–Э)D –Є –Є—Е —Н–Ї—Б—В—А–∞–њ–Њ–ї—П—Ж–Є–µ–є –Љ–Њ–ґ–љ–Њ –≥–Њ–≤–Њ—А–Є—В—М –Њ —В–Њ–Љ, —З—В–Њ —Б–Њ–≥–ї–∞—Б–љ–Њ –Є–Љ–µ—О—Й–Є–Љ—Б—П —А–∞—Б—Б—З–µ—В–∞–Љ –Њ–Ї–Њ–ї–Њ 1 –Љ–ї—А–і. –ґ–Є—В–µ–ї–µ–є –Ч–µ–Љ–ї–Є –Є–Љ–µ—О—В –Ф–ТD –Є–ї–Є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М –≤–Є—В–∞–Љ–Є–љ–∞ D, —З—В–Њ –Њ—В—А–∞–ґ–∞–µ—В –Ї–∞–Ї –і–µ–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є–µ (–њ–Њ—Б—В–∞—А–µ–љ–Є–µ –љ–∞—Б–µ–ї–µ–љ–Є—П), —В–∞–Ї –Є —Н–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ (–Є–Ј–Љ–µ–љ–µ–љ–Є—П –Ї–ї–Є–Љ–∞—В–∞, —Б–љ–Є–ґ–µ–љ–Є–µ –Є–љ—Б–Њ–ї—П—Ж–Є–Є) –Є–Ј–Љ–µ–љ–µ–љ–Є—П, –њ—А–Њ–Є—Б—Е–Њ–і—П—Й–Є–µ –љ–∞ –њ–ї–∞–љ–µ—В–µ –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л. –Я–Њ –і–∞–љ–љ—Л–Љ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –Њ—В 40 –і–Њ 100% –њ–Њ–ґ–Є–ї—Л—Е –ї—О–і–µ–є –≤ –°–®–Р –Є –Х–≤—А–Њ–њ–µ, –ґ–Є–≤—Г—Й–Є—Е –≤ –Њ–±—Л—З–љ—Л—Е —Г—Б–ї–Њ–≤–Є—П—Е (–љ–µ –≤ –і–Њ–Љ–∞—Е –њ—А–µ—Б—В–∞—А–µ–ї—Л—Е), –Є–Љ–µ—О—В –Ф–ТD. –С–Њ–ї–µ–µ 50% –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–∞–ї—М–љ—Л—Е –ґ–µ–љ—Й–Є–љ, –њ—А–Є–љ–Є–Љ–∞—О—Й–Є—Е –њ—А–µ–њ–∞—А–∞—В—Л –і–ї—П –ї–µ—З–µ–љ–Є—П –Ю–Я, –Є–Љ–µ—О—В —Б—Г–±–Њ–њ—В–Є–Љ–∞–ї—М–љ—Л–є (–љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ—Л–є) —Г—А–Њ–≤–µ–љ—М 25(–Ю–Э)D, —В.–µ. –љ–Є–ґ–µ 30 –љ–≥/–Љ–ї (75 –љ–Љ–Њ–ї/–ї).
–£ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–≥–Њ —З–Є—Б–ї–∞ –і–µ—В–µ–є –Є –Љ–Њ–ї–Њ–і—Л—Е –≤–Ј—А–Њ—Б–ї—Л—Е —В–∞–Ї–ґ–µ –Є–Љ–µ–µ—В—Б—П –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ—Л–є —А–Є—Б–Ї –Ф–ТD. –Э–∞–њ—А–Є–Љ–µ—А, 52% –ї–∞—В–Є–љ–Њ–∞–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Є—Е –Є –љ–µ–≥—А–Є—В—П–љ—Б–Ї–Є—Е (–∞—Д—А–ЊвАУ–∞–Љ–µ—А–Є¬≠–Ї–∞–љ—Б–Ї–Є—Е) –њ–Њ–і—А–Њ—Б—В–Ї–Њ–≤ –≤ –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–Љ –≤ –С–Њ—Б—В–Њ–љ–µ (–°–®–Р) –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Є 48% –±–µ–ї—Л—Е –і–µ–≤–Њ—З–µ–Ї –Љ–ї–∞–і—И–µ–≥–Њ –њ–Њ–і—А–Њ—Б—В–Ї–Њ–≤–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є, –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–Љ –≤ –Ь–∞–є–љ–µ (–°–®–Р), –Є–Љ–µ–ї–Є —Г—А–Њ–≤–µ–љ—М 25(–Ю–Э)D –љ–Є–ґ–µ 20 –љ–≥/–Љ–ї. –Т –і—А—Г–≥–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е, –≤—Л–њ–Њ–ї–љ–µ–љ–љ—Л—Е –≤ –Ї–Њ–љ—Ж–µ –Ј–Є–Љ—Л, 42% –ґ–Є–≤—Г—Й–Є—Е –љ–∞ —В–µ—А—А–Є—В–Њ—А–Є–Є –°–®–Р –љ–µ–≥—А–Є—В—П–љ—Б–Ї–Є—Е –і–µ–≤–Њ—З–µ–Ї –Є –ґ–µ–љ—Й–Є–љ –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 15 –і–Њ 49 –ї–µ—В –Є–Љ–µ–ї–Є —Г—А–Њ–≤–µ–љ—М 25(–Ю–Э)D –љ–Є–ґ–µ 20 –љ–≥/–Љ–ї, –∞ —Г 32% –Ј–і–Њ—А–Њ–≤—Л—Е —Б—В—Г–і–µ–љ—В–Њ–≤ –Є –≤—А–∞—З–µ–є –≤ –С–Њ—Б—В–Њ–љ—Б–Ї–Њ–Љ –≥–Њ—Б–њ–Є—В–∞–ї–µ –±—Л–ї –≤—Л—П–≤–ї–µ–љ –Ф–ТD, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –µ–ґ–µ–і–љ–µ–≤–љ–Њ–µ –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –Є–Љ–Є 1 —Б—В–∞–Ї–∞–љ–∞ –Љ–Њ–ї–Њ–Ї–∞ –Є –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Љ—Г–ї—М—В–Є–≤–Є—В–∞–Љ–Є–љ–Њ–≤, –∞ —В–∞–Ї–ґ–µ –≤–Ї–ї—О—З–µ–љ–Є–µ –≤ –њ–Є—Й—Г –ї–Њ—Б–Њ—Б—П –љ–µ –Љ–µ–љ–µ–µ 1 —А–∞–Ј–∞ –≤ –љ–µ–і–µ–ї—О.
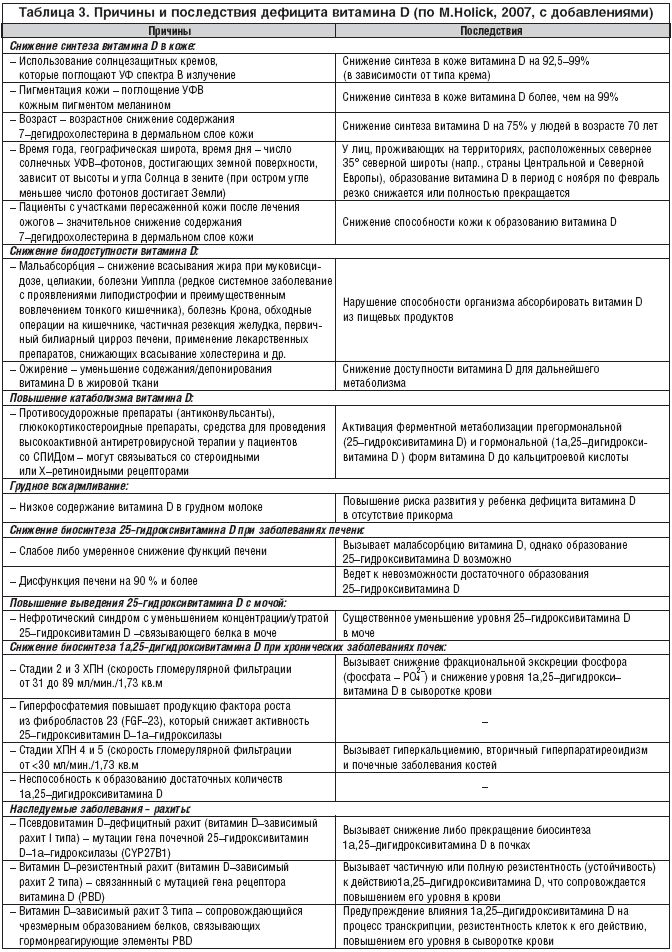
–Т –Х–≤—А–Њ–њ–µ, –≥–і–µ –Њ—З–µ–љ—М —А–µ–і–Ї–Є–µ –≤–Є–і—Л –њ–Є—Й–µ–≤—Л—Е –њ—А–Њ–і—Г–Ї—В–Њ–≤ –Є—Б–Ї—Г—Б—Б—В–≤–µ–љ–љ–Њ –Њ–±–Њ–≥–∞—Й–∞—О—В—Б—П –≤–Є—В–∞–Љ–Є–љ–Њ–Љ D, –і–µ—В–Є –Є –≤–Ј—А–Њ—Б–ї—Л–µ –њ–Њ–і–≤–µ—А–ґ–µ–љ—Л –Њ—Б–Њ–±–µ–љ–љ–Њ –≤—Л—Б–Њ–Ї–Њ–Љ—Г —А–Є—Б–Ї—Г –Ф–ТD. –Ы—О–і–Є, –ґ–Є–≤—Г—Й–Є–µ –≤ —Н–Ї–≤–∞—В–Њ—А–Є–∞–ї—М–љ–Њ–є –Њ–±–ї–∞—Б—В–Є —Б –≤—Л—Б–Њ–Ї–Є–Љ —Г—А–Њ–≤–љ–µ–Љ –њ—А–Є—А–Њ–і–љ–Њ–є –Є–љ—Б–Њ–ї—П—Ж–Є–Є, –Є–Љ–µ—О—В –±–ї–Є–Ј–Ї–Є–є –Ї –љ–Њ—А–Љ–∞–ї—М–љ–Њ–Љ—Г —Г—А–Њ–≤–µ–љ—М 25(–Ю–Э)D вАУ –≤—Л—И–µ 30 –љ–≥/–Љ–ї. –Ю–і–љ–∞–Ї–Њ –≤ –љ–∞–Є–±–Њ–ї–µ–µ —Б–Њ–ї–љ–µ—З–љ—Л—Е —А–µ–≥–Є–Њ–љ–∞—Е –Ч–µ–Љ–ї–Є –Ф–ТD –љ–µ—А–µ–і–Њ–Ї –Є–ЈвАУ–Ј–∞ –љ–Њ—И–µ–љ–Є—П –њ–Њ–ї–љ–Њ—Б—В—М—О –Ј–∞–Ї—А—Л–≤–∞—О—Й–µ–є —В–µ–ї–Њ –Њ–і–µ–ґ–і—Л. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е, –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е –≤ –°–∞—Г–і–Њ–≤—Б–Ї–Њ–є –Р—А–∞–≤–Є–Є, –Ю–Р–≠, –Р–≤—Б—В—А–∞–ї–Є–Є, –Ґ—Г—А—Ж–Є–Є, –Ш–љ–і–Є–Є –Є –Ы–Є–≤–∞–љ–µ –Њ—В 30 –і–Њ 50% –і–µ—В–µ–є –Є –≤–Ј—А–Њ—Б–ї—Л—Е –Є–Љ–µ—О—В —Г—А–Њ–≤–µ–љ—М 25(–Ю–Э)D –љ–Є–ґ–µ 20 –љ–≥/–Љ–ї. –Т —В–∞–±–ї–Є—Ж–µ 3 —Б—Г–Љ–Љ–Є—А–Њ–≤–∞–љ—Л –Њ—Б–љ–Њ–≤–љ—Л–µ –њ—А–Є—З–Є–љ—Л –Є –њ–Њ—Б–ї–µ–і—Б—В–≤–Є—П –Ф–ТD.
–Ф–µ—Д–Є—Ж–Є—В DвАУ–≥–Њ—А–Љ–Њ–љ–∞ (—З–∞—Й–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л–є DвАУ–≥–Є¬≠–њ–Њ¬≠–≤–Є—В–∞–Љ–Є–љ–Њ–Ј–Њ–Љ –ї–Є–±–Њ DвАУ–≤–Є—В–∞–Љ–Є–љ–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О, —В.–Ї. –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –і—А–∞–Љ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–љ–Є–ґ–µ–љ–Є—П —Г—А–Њ–≤–љ—П —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤ –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ —Н—В–Є–Љ —В–µ—А–Љ–Є–љ–Њ–Љ –Њ–±–Њ–Ј–љ–∞—З–∞—О—В –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ 25(–Ю–Э)D –Є 1a,25(–Ю–Э)2D3), –∞ —В–∞–Ї–ґ–µ –љ–∞—А—Г—И–µ–љ–Є—П –µ–≥–Њ —А–µ—Ж–µ–њ—Ж–Є–Є –Є–≥—А–∞—О—В —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Г—О —А–Њ–ї—М –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –љ–µ —В–Њ–ї—М–Ї–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —Б–Ї–µ–ї–µ—В–∞ (—А–∞—Е–Є—В, –Њ—Б—В–µ–Њ–Љ–∞–ї—П—Ж–Є—П, –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј), –љ–Њ –Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–≥–Њ —З–Є—Б–ї–∞ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л—Е –≤–љ–µ—Б–Ї–µ–ї–µ—В–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є (—Б–µ—А–і–µ—З–љ–ЊвАУ—Б–Њ—Б—Г–і–Є—Б—В–∞—П –њ–∞—В–Њ–ї–Њ–≥–Є—П, –Њ–њ—Г—Е–Њ–ї–Є, –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є –і—А.).
–†–∞–Ј–ї–Є—З–∞—О—В –і–≤–∞ –Њ—Б–љ–Њ–≤–љ—Л—Е —В–Є–њ–∞ –і–µ—Д–Є—Ж–Є—В–∞ DвАУ–≥–Њ—А–Љ–Њ–љ–∞ [8,12], –Є–љ–Њ–≥–і–∞ –љ–∞–Ј—Л–≤–∞–µ–Љ–Њ–≥–Њ —В–∞–Ї–ґ–µ ¬Ђ—Б–Є–љ–і—А–Њ–Љ–Њ–Љ DвАУ–љ–µ¬≠–і–Њ¬≠—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є¬ї. –Я–µ—А–≤—Л–є –Є–Ј –љ–Є—Е –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ –і–µ—Д–Є—Ж–Є—В–Њ–Љ/–љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О –≤–Є—В–∞–Љ–Є–љ–∞ D3 вАУ –њ—А–Є—А–Њ–і–љ–Њ–є –њ—А–Њ–≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є —Д–Њ—А–Љ—Л, –Є–Ј –Ї–Њ—В–Њ—А–Њ–є –Њ–±—А–∞–Ј—Г–µ—В—Б—П –∞–Ї—В–Є–≤–љ—Л–є(–µ) –Љ–µ—В–∞–±–Њ–ї–Є—В(—Л) [1a,25(–Ю–Э)2D3]. –≠—В–Њ—В —В–Є–њ –і–µ—Д–Є—Ж–Є—В–∞ –≤–Є—В–∞–Љ–Є–љ–∞ D —Б–≤—П–Ј—Л–≤–∞—О—В —Б –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ—Л–Љ –њ—А–µ–±—Л–≤–∞–љ–Є–µ–Љ –љ–∞ —Б–Њ–ї–љ—Ж–µ, –∞ —В–∞–Ї–ґ–µ —Б –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ—Л–Љ –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–µ–Љ —Н—В–Њ–≥–Њ –≤–Є—В–∞–Љ–Є–љ–∞ —Б –њ–Є—Й–µ–є, –њ–Њ—Б—В–Њ—П–љ–љ—Л–Љ –љ–Њ—И–µ–љ–Є–µ–Љ –Ј–∞–Ї—А—Л–≤–∞—О—Й–µ–є —В–µ–ї–Њ –Њ–і–µ–ґ–і—Л, —З—В–Њ —Б–љ–Є–ґ–∞–µ—В –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –њ—А–Є—А–Њ–і–љ–Њ–≥–Њ –≤–Є—В–∞–Љ–Є–љ–∞ –≤ –Ї–Њ–ґ–µ –Є –≤–µ–і–µ—В –Ї —Б–љ–Є–ґ–µ–љ–Є—О —Г—А–Њ–≤–љ—П 25(–Ю–Э)D –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є. –Я–Њ–і–Њ–±–љ–∞—П —Б–Є—В—Г–∞—Ж–Є—П –љ–∞–±–ї—О–і–∞–ї–∞—Б—М —А–∞–љ–µ–µ, –≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ —Г –і–µ—В–µ–є, –Є —П–≤–ї—П–ї–∞—Б—М, –њ–Њ —Б—Г—В–Є, —Б–Є–љ–Њ–љ–Є–Љ–Њ–Љ —А–∞—Е–Є—В–∞. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ –Є–љ–і—Г—Б—В—А–Є–∞–ї—М–љ—Л—Е —Б—В—А–∞–љ –Љ–Є—А–∞ –±–ї–∞–≥–Њ–і–∞—А—П –Є—Б–Ї—Г—Б—Б—В–≤–µ–љ–љ–Њ–Љ—Г –Њ–±–Њ–≥–∞—Й–µ–љ–Є—О –њ—А–Њ–і—Г–Ї—В–Њ–≤ –і–µ—В—Б–Ї–Њ–≥–Њ –њ–Є—В–∞–љ–Є—П –≤–Є—В–∞–Љ–Є–љ–Њ–Љ D –µ–≥–Њ –і–µ—Д–Є—Ж–Є—В/–љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М —Г –і–µ—В–µ–є –љ–∞–±–ї—О–і–∞–µ—В—Б—П –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ —А–µ–і–Ї–Њ. –Ю–і–љ–∞–Ї–Њ –Є–ЈвАУ–Ј–∞ –Є–Ј–Љ–µ–љ–Є–≤—И–µ–є—Б—П –≤–Њ –≤—В–Њ—А–Њ–є –њ–Њ–ї–Њ–≤–Є–љ–µ –•–• –≤–µ–Ї–∞ –і–µ–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Њ–є —Б–Є—В—Г–∞—Ж–Є–Є –і–µ—Д–Є—Ж–Є—В –≤–Є—В–∞–Љ–Є–љ–∞ D –љ–µ—А–µ–і–Ї–Њ –Є–Љ–µ–µ—В –Љ–µ—Б—В–Њ —Г –ї–Є—Ж –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞, –Њ—Б–Њ–±–µ–љ–љ–Њ –њ—А–Њ–ґ–Є–≤–∞—О—Й–Є—Е –≤ —Б—В—А–∞–љ–∞—Е –Є –љ–∞ —В–µ—А—А–Є—В–Њ—А–Є—П—Е —Б –љ–Є–Ј–Ї–Њ–є –µ—Б—В–µ—Б—В–≤–µ–љ–љ–Њ–є –Є–љ—Б–Њ–ї—П—Ж–Є–µ–є (—Б–µ–≤–µ—А–љ–µ–µ –Є–ї–Є —О–ґ–љ–µ–µ 40¬∞ –і–Њ–ї–≥–Њ—В—Л –≤ –°–µ–≤–µ—А–љ–Њ–Љ –Є –Ѓ–ґ–љ–Њ–Љ –њ–Њ–ї—Г—И–∞—А–Є—П—Е —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ), –Є–Љ–µ—О—Й–Є—Е –љ–µ–њ–Њ–ї–љ–Њ—Ж–µ–љ–љ—Л–є –Є–ї–Є –љ–µ—Б–±–∞–ї–∞–љ—Б–Є—А–Њ–≤–∞–љ–љ—Л–є –њ–Є—Й–µ–≤–Њ–є —А–∞—Ж–Є–Њ–љ –Є —Б –љ–Є–Ј–Ї–Њ–є —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О. –Я–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —Г –ї—О–і–µ–є –≤ –≤–Њ–Ј—А–∞—Б—В–µ 65 –ї–µ—В –Є —Б—В–∞—А—И–µ –љ–∞–±–ї—О–і–∞–µ—В—Б—П 4вАУ–Ї—А–∞—В–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –Њ–±—А–∞–Ј–Њ–≤—Л–≤–∞—В—М –≤–Є—В–∞–Љ–Є–љ D –≤ –Ї–Њ–ґ–µ. –Т —Б–≤—П–Ј–Є —Б —В–µ–Љ, —З—В–Њ 25(–Ю–Э)D —П–≤–ї—П–µ—В—Б—П —Б—Г–±—Б—В—А–∞—В–Њ–Љ –і–ї—П —Д–µ—А–Љ–µ–љ—В–∞ 1aвАУ–≥–Є–і—А–Њ–Ї—Б–Є–ї–∞–Ј—Л, –∞ —Б–Ї–Њ—А–Њ—Б—В—М –µ–≥–Њ –њ—А–µ–≤—А–∞—Й–µ–љ–Є—П –≤ –∞–Ї—В–Є–≤–љ—Л–є –Љ–µ—В–∞–±–Њ–ї–Є—В –њ—А–Њ–њ–Њ—А—Ж–Є–Њ–љ–∞–ї—М–љ–∞ —Г—А–Њ–≤–љ—О —Б—Г–±—Б—В—А–∞—В–∞ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є, —Б–љ–Є–ґ–µ–љ–Є–µ —Н—В–Њ–≥–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П <30 –љ–≥/–Љ–ї –љ–∞—А—Г—И–∞–µ—В –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –∞–і–µ–Ї–≤–∞—В–љ—Л—Е –Ї–Њ–ї–Є—З–µ—Б—В–≤ 1a,25(–Ю–Э)2D3. –Ш–Љ–µ–љ–љ–Њ —В–∞–Ї–Њ–є —Г—А–Њ–≤–µ–љ—М —Б–љ–Є–ґ–µ–љ–Є—П 25(–Ю–Э)D –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –±—Л–ї –≤—Л—П–≤–ї–µ–љ —Г 36% –Љ—Г–ґ—З–Є–љ –Є 47% –ґ–µ–љ—Й–Є–љ –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –≤ —Е–Њ–і–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П (Euronut Seneca Program), –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–≥–Њ –≤ 11 —Б—В—А–∞–љ–∞—Е –Ч–∞–њ–∞–і–љ–Њ–є –Х–≤—А–Њ–њ—Л. –Ш —Е–Њ—В—П –љ–Є–ґ–љ–Є–є –њ—А–µ–і–µ–ї –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є 25(–Ю–Э)D –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є, –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–є –і–ї—П –њ–Њ–і–і–µ—А–ґ–∞–љ–Є—П –љ–Њ—А–Љ–∞–ї—М–љ–Њ–≥–Њ —Г—А–Њ–≤–љ—П –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П 1a,25(–Ю–Э)2D3, –љ–µ–Є–Ј–≤–µ—Б—В–µ–љ, –µ–≥–Њ –њ–Њ—А–Њ–≥–Њ–≤—Л–µ –Ј–љ–∞—З–µ–љ–Є—П, –њ–ЊвАУ–≤–Є–і–Є–Љ–Њ–Љ—Г, —Б–Њ—Б—В–∞–≤–ї—П—О—В –Њ—В 12 –і–Њ 15 –љ–≥/–Љ–ї (30вАУ35 –љ–Љ–Њ–ї/–ї).
–Э–∞—А—П–і—Г —Б –њ—А–Є–≤–µ–і–µ–љ–љ—Л–Љ–Є –≤—Л—И–µ –і–∞–љ–љ—Л–Љ–Є, –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –њ–Њ—П–≤–Є–ї–Є—Б—М –Є –±–Њ–ї–µ–µ —З–µ—В–Ї–Є–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ—Л–µ –Ї—А–Є—В–µ—А–Є–Є DвАУ–і–µ—Д–Є—Ж–Є—В–∞. –°–Њ¬≠–≥–ї–∞—Б¬≠–љ–Њ –∞–≤—В–Њ—А–∞–Љ –≥–Є–њ–Њ–≤–Є—В–∞–Љ–Є–љ–Њ–Ј D –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –њ—А–Є —Г—А–Њ–≤–љ–µ 25(–Ю–Э)D –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є 100 –љ–Љ–Њ–ї/–ї (40 –љ–≥/–Љ–ї), DвАУ–≤–Є—В–∞–Љ–Є–љ–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М вАУ –њ—А–Є 50 –љ–Љ–Њ–ї/–ї, –∞ DвАУ–і–µ—Д–Є—Ж–Є—В вАУ –њ—А–Є <25 –љ–Љ–Њ–ї/–ї (10 –љ–≥/–Љ–ї). –Я–Њ—Б–ї–µ–і¬≠—Б—В–≤–Є¬≠–µ–Љ —Н—В–Њ–≥–Њ —В–Є–њ–∞ –і–µ—Д–Є—Ж–Є—В–∞ –≤–Є—В–∞–Љ–Є–љ–∞ D —П–≤–ї—П—О—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ –∞–±—Б–Њ—А–±—Ж–Є–Є –Є —Г—А–Њ–≤–љ—П –°–∞2+, –∞ —В–∞–Ї–ґ–µ –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Я–Ґ–У –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є (–≤—В–Њ—А–Є—З–љ—Л–є –≥–Є–њ–µ—А–њ–∞—А–∞—В–Є—А–µ–Њ–Є–і–Є–Ј–Љ), –љ–∞—А—Г—И–µ–љ–Є–µ –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—П –Є –Љ–Є–љ–µ—А–∞–ї–Є–Ј–∞—Ж–Є–Є –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є. –Ф–µ—Д–Є—Ж–Є—В 25(–Ю–Э)D —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В –≤ —В–µ—Б–љ–Њ–є —Б–≤—П–Ј–Є —Б –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є —Д—Г–љ–Ї—Ж–Є–є –њ–Њ—З–µ–Ї –Є –≤–Њ–Ј—А–∞—Б—В–Њ–Љ, –≤ —В–Њ–Љ —З–Є—Б–ї–µ —Б –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ–Љ –ї–µ—В, –њ—А–Њ–ґ–Є—В—Л—Е –њ–Њ—Б–ї–µ –љ–∞—Б—В—Г–њ–ї–µ–љ–Є—П –Љ–µ–љ–Њ–њ–∞—Г–Ј—Л. –Я—А–Є —Н—В–Њ–Љ –Њ—В–Љ–µ—З–µ–љ—Л –Ї–∞–Ї –≥–µ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є–µ –Є –≤–Њ–Ј—А–∞—Б—В–љ—Л–µ —А–∞–Ј–ї–Є—З–Є—П –≤ —Г—А–Њ–≤–љ–µ —Н—В–Њ–≥–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П, —В–∞–Ї –Є –µ–≥–Њ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М –Њ—В –≤—А–µ–Љ–µ–љ–Є –≥–Њ–і–∞, —В.–µ. –Њ—В —Г—А–Њ–≤–љ—П —Б–Њ–ї–љ–µ—З–љ–Њ–є –Є–љ—Б–Њ–ї—П—Ж–Є–Є/–Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ —Б–Њ–ї–љ–µ—З–љ—Л—Е –і–љ–µ–є (–£–§), —З—В–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ—А–Є–љ–Є–Љ–∞—В—М –≤–Њ –≤–љ–Є–Љ–∞–љ–Є–µ –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Є –∞–љ–∞–ї–Є–Ј–µ –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –і–∞–љ–љ—Л—Е.
–Ф–µ—Д–Є—Ж–Є—В 25(–Ю–Э)D –≤—Л—П–≤–ї–µ–љ —В–∞–Ї–ґ–µ –Є –њ—А–Є —Б–Є–љ–і—А–Њ–Љ–µ –Љ–∞–ї—М–∞–±—Б–Њ—А–±—Ж–Є–Є, –±–Њ–ї–µ–Ј–љ–Є –Ъ—А–Њ–љ–∞, —Б–Њ—Б—В–Њ—П–љ–Є—П—Е –њ–Њ—Б–ї–µ —Б—Г–±—В–Њ—В–∞–ї—М–љ–Њ–є –≥–∞—Б—В—А—Н–Ї—В–Њ–Љ–Є–Є –Є–ї–Є –њ—А–Є –Њ–±—Е–Њ–і–љ—Л—Е –Њ–њ–µ—А–∞—Ж–Є—П—Е –љ–∞ –Ї–Є—И–µ—З–љ–Є–Ї–µ, –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є —Б–µ–Ї—А–µ—Ж–Є–Є –њ–∞–љ–Ї—А–µ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Њ–Ї–∞, —Ж–Є—А—А–Њ–Ј–µ –њ–µ—З–µ–љ–Є, –≤—А–Њ–ґ–і–µ–љ–љ–Њ–є –∞—В—А–µ–Ј–Є–Є –ґ–µ–ї—З–љ–Њ–≥–Њ –њ—А–Њ—В–Њ–Ї–∞, –і–ї–Є—В–µ–ї—М–љ–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –њ—А–Њ—В–Є–≤–Њ—Б—Г–і–Њ—А–Њ–ґ–љ—Л—Е (–∞–љ—В–Є—Н–њ–Є–ї–µ–њ—В–Є—З–µ—Б–Ї–Є—Е) –Ы–°, –љ–µ—Д—А–Њ–Ј–∞—Е.
–Ф—А—Г–≥–Њ–є —В–Є–њ –і–µ—Д–Є—Ж–Є—В–∞ –≤–Є—В–∞–Љ–Є–љ–∞ D –љ–µ –≤—Б–µ–≥–і–∞ –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –њ—А–Њ–і—Г–Ї—Ж–Є–Є DвАУ–≥–Њ—А–Љ–Њ–љ–∞ –≤ –њ–Њ—З–Ї–∞—Е (–њ—А–Є —Н—В–Њ–Љ —В–Є–њ–µ –і–µ—Д–Є—Ж–Є—В–∞ –Љ–Њ–ґ–µ—В –љ–∞–±–ї—О–і–∞—В—М—Б—П –ї–Є–±–Њ –љ–Њ—А–Љ–∞–ї—М–љ—Л–є, –ї–Є–±–Њ —Б–ї–µ–≥–Ї–∞ –њ–Њ–≤—Л—И–µ–љ–љ—Л–є –µ–≥–Њ —Г—А–Њ–≤–µ–љ—М –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є), –љ–Њ —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –µ–≥–Њ —А–µ—Ж–µ–њ—Ж–Є–Є –≤ —В–Ї–∞–љ—П—Е (—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М –Ї –≥–Њ—А–Љ–Њ–љ—Г), —З—В–Њ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ—В—Б—П –Ї–∞–Ї —Д—Г–љ–Ї—Ж–Є—П –≤–Њ–Ј—А–∞—Б—В–∞. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П 1a,25(–Ю–Э)2D3 –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є –њ—А–Є —Б—В–∞—А–µ–љ–Є–Є, –Њ—Б–Њ–±–µ–љ–љ–Њ –≤ –≤–Њ–Ј—А–∞—Б—В–љ–Њ–є –≥—А—Г–њ–њ–µ —Б—В–∞—А—И–µ 65 –ї–µ—В, –Њ—В–Љ–µ—З–∞–µ—В—Б—П –Љ–љ–Њ–≥–Є–Љ–Є –∞–≤—В–Њ—А–∞–Љ–Є. –°–љ–Є–ґ–µ–љ–Є–µ –њ–Њ—З–µ—З–љ–Њ–є –њ—А–Њ–і—Г–Ї—Ж–Є–Є 1a,25(–Ю–Э)2D3 –љ–µ—А–µ–і–Ї–Њ –љ–∞–±–ї—О–і–∞–µ—В—Б—П –њ—А–Є –Ю–Я, –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е –њ–Њ—З–µ–Ї (–•–Я–Э –Є –і—А.), —Г –ї–Є—Ж –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ (>65 –ї–µ—В), –њ—А–Є –і–µ—Д–Є—Ж–Є—В–µ –њ–Њ–ї–Њ–≤—Л—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤, –≥–Є–њ–Њ—Д–Њ—Б—Д–∞—В–µ–Љ–Є—З–µ—Б–Ї–Њ–є –Њ—Б—В–µ–Њ–Љ–∞–ї—П—Ж–Є–Є –Њ–њ—Г—Е–Њ–ї–µ–≤–Њ–≥–Њ –≥–µ–љ–µ–Ј–∞, –њ—А–Є –Я–Ґ–УвАУ–і–µ—Д–Є—Ж–Є—В–љ–Њ–Љ –Є –Я–Ґ–УвАУ—А–µ¬≠–Ј–Є—Б—В–µ–љ—В–љ–Њ–Љ –≥–Є–њ–Њ–њ–∞—А–∞—В–Є—А–µ–Њ–Ј–µ, —Б–∞—Е–∞—А–љ–Њ–Љ –і–Є–∞–±–µ—В–µ, –њ–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –У–Ъ–° –Є –і—А. –†–∞–Ј–≤–Є—В–Є–µ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Ї 1a,25(–Ю–Э)2D3 –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ, –Ї–∞–Ї –њ–Њ–ї–∞–≥–∞—О—В, —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —З–Є—Б–ї–∞ –†–ТD –≤ —В–Ї–∞–љ—П—ЕвАУ–Љ–Є—И–µ–љ—П—Е, –Є –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –≤ –Ї–Є—И–µ—З–љ–Є–Ї–µ, –њ–Њ—З–Ї–∞—Е –Є —Б–Ї–µ–ї–µ—В–љ—Л—Е –Љ—Л—И—Ж–∞—Е. –Ю–±–∞ –≤–∞—А–Є–∞–љ—В–∞ –і–µ—Д–Є—Ж–Є—В–∞ –≤–Є—В–∞–Љ–Є–љ–∞ D —П–≤–ї—П—О—В—Б—П —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–Љ–Є –Ј–≤–µ–љ—М—П–Љ–Є –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –Ю–Я, –њ–∞–і–µ–љ–Є–є –Є –њ–µ—А–µ–ї–Њ–Љ–Њ–≤.
–Я—А–Њ–≤–µ–і–µ–љ–љ—Л–µ –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –Љ–∞—Б—И—В–∞–±–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ј–≤–Њ–ї–Є–ї–Є –≤—Л—П–≤–Є—В—М —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Г—О –Ї–Њ—А—А–µ–ї—П—Ж–Є—О –Љ–µ–ґ–і—Г –Ф–ТD –Є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М—О —А—П–і–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є. –Я—А–Є —Н—В–Њ–Љ –≤–∞–ґ–љ–∞—П –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—П, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, –±—Л–ї–∞ –њ–Њ–ї—Г—З–µ–љ–∞ –њ—А–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Б–≤—П–Ј–µ–є –Љ–µ–ґ–і—Г –Ф–ТD –Є —Б–µ—А–і–µ—З–љ–ЊвАУ—Б–Њ—Б—Г–і–Є—Б—В—Л–Љ–Є –Є –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є.
–Ф–≤–∞ –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л—Е –Ї–Њ–≥–Њ—А—В–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤–Ї–ї—О¬≠—З–∞–ї–Є 613 –Љ—Г–ґ—З–Є–љ –Є–Ј Health Professionals FollowвАУUp Study –Є 1198 –ґ–µ–љ—Й–Є–љ –Є–Ј Nurses Health Study —Б –Є–Ј–Љ–µ—А–µ–љ–љ—Л–Љ —Г—А–Њ–≤–љ–µ–Љ 25(–Ю–Э)D –Є –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ –љ–∞–±–ї—О–і–µ–љ–Є–µ–Љ –≤ —В–µ—З–µ–љ–Є–µ –Њ—В 4 –і–Њ 8 –ї–µ—В. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, 2 –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л—Е –Ї–Њ–≥–Њ—А—В–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤–Ї–ї—О—З–∞–ї–Є 38 338 –Љ—Г–ґ—З–Є–љ –Є 77 531 –ґ–µ–љ—Й–Є–љ—Г —Б –њ—А–µ–і—Б–Ї–∞–Ј–∞–љ–љ—Л–Љ —Г—А–Њ–≤–љ–µ–Љ 25(–Ю–Э)D –≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–Є–Њ–і–∞ –Њ—В 16 –і–Њ 18 –ї–µ—В. –Т–Њ –≤—А–µ–Љ—П 4 –ї–µ—В –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–≥–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П –Љ—Г–ї—М—В–Є–≤–∞—А–Є–∞–љ—В–љ—Л–є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ—Л–є —А–Є—Б–Ї —Б–ї—Г—З–∞–µ–≤ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–Є —Б—А–µ–і–Є –Љ—Г–ґ—З–Є–љ, —Г –Ї–Њ—В–Њ—А—Л—Е –Є–Ј–Љ–µ—А—П–µ–Љ—Л–є —Г—А–Њ–≤–µ–љ—М 25(–Ю–Э)D —Б–Њ—Б—В–∞–≤–ї—П–ї <15 –љ–≥/–Љ–ї (—В.–µ. —Б–Њ—Б—В–Њ—П–љ–Є–µ DвАУ–і–µ—Д–Є—Ж–Є—В–∞), –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б —В–µ–Љ–Є, —Г –Ї–Њ–≥–Њ —Н—В–Њ—В —Г—А–Њ–≤–µ–љ—М —Б–Њ—Б—В–∞–≤–ї—П–ї ¬≥30 –љ–≥/–Љ–ї –±—Л–ї –Њ–њ—А–µ–і–µ–ї–µ–љ –≤ 6,13 (!) (95% –Ф–Ш 1,00 –і–Њ 37,8). –°—А–µ–і–Є –ґ–µ–љ—Й–Є–љ —В–∞–Ї–Њ–µ –ґ–µ —Б—А–∞–≤–љ–µ–љ–Є–µ –≤—Л—П–≤–Є–ї–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–≥–Њ —А–Є—Б–Ї–∞, —А–∞–≤–љ—Л–є 2,67 (95% –Ф–Ш –Њ—В 1,05 –і–Њ 6,79). –У—А—Г–њ–њ–Є—А–Њ–≤–Ї–∞ –і–∞–љ–љ—Л—Е, –Ї–∞—Б–∞—О—Й–Є—Е—Б—П –Њ–±—Й–µ–≥–Њ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–≥–Њ —А–Є—Б–Ї–∞ —Г –Љ—Г–ґ—З–Є–љ –Є —Г –ґ–µ–љ—Й–Є–љ, —Г –Ї–Њ—В–Њ—А—Л—Е –±—Л–ї –Є–Ј–Љ–µ—А–µ–љ —Г—А–Њ–≤–µ–љ—М 25(–Ю–Э)D, –њ—А–Њ–≤–µ–і–µ–љ–љ–∞—П —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Љ–Њ–і–µ–ї–Є –і–Є—Б–њ–µ—А—Б–Є–Є —Б–ї—Г—З–∞–є–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤, –њ–Њ–Ј–≤–Њ–ї–Є–ї–∞ –њ–Њ–ї—Г—З–Є—В—М –Ј–љ–∞—З–µ–љ–Є–µ —Н—В–Њ–≥–Њ —А–Є—Б–Ї–∞, –±–ї–Є–Ј–Ї–Њ–µ –Ї 3,18 (95% –Ф–Ш –Њ—В 1,39 –і–Њ 7,29). –Ш—Б–њ–Њ–ї—М–Ј—Г—П –і–∞–љ–љ—Л–µ –Њ–± —Г—А–Њ–≤–љ–µ 25(–Ю–Э)D –≤ –±–Њ–ї—М—И–Є—Е –Ї–Њ–≥–Њ—А—В–∞—Е, –Љ–љ–Њ–≥–Њ–≤–∞—А–Є–∞–љ—В–љ—Л–є –Є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ—Л–µ —А–Є—Б–Ї–Є —Б—А–∞–≤–љ–Є–≤–∞–ї–Є –њ–Њ –љ–∞–Є–±–Њ–ї–µ–µ –љ–Є–Ј–Ї–Є–Љ –Є –љ–∞–Є–±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–Љ –і–µ—Ж–Є–ї—П–Љ —Б—А–µ–і–Є –Љ—Г–ґ—З–Є–љ, –≥–і–µ –Њ–љ —Б–Њ—Б—В–∞–≤–Є–ї 2,31 (95% –Ф–Ш –Њ—В 2,03 –і–Њ 2,63) –Є —Б—А–µ–і–Є –ґ–µ–љ—Й–Є–љ вАУ 1,57 (95% –Ф–Ш 1,44 –і–Њ 1,72). –Ґ–∞–Ї–Є–Љ –Њ–Њ–±—А–∞–Ј–Њ–Љ, —Г—А–Њ–≤–µ–љ—М 25(–Ю–Э)D –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є –Њ–±—А–∞—В–љ–Њ –њ—А–Њ–њ–Њ—А—Ж–Є–Њ–љ–∞–ї–µ–љ —А–Є—Б–Ї—Г —А–∞–Ј–≤–Є—В–Є—П –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–Є.
–Ю–њ–Є—Б–∞–љ–Њ 16 —А–∞–Ј–ї–Є—З–љ—Л—Е –≤–Є–і–Њ–≤ –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л—Е –Њ–њ—Г—Е–Њ–ї–µ–є, —А–∞–Ј–≤–Є—В–Є–µ –Ї–Њ—В–Њ—А—Л—Е –Ї–Њ—А—А–µ–ї–Є—А—Г–µ—В —Б –љ–Є–Ј–Ї–Њ–є –Є–љ—Б–Њ–ї—П—Ж–Є–µ–є/–£–§вАУ–Њ–±–ї—Г—З–µ–љ–Є–µ–Љ, –∞ –Є—Е —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –њ–Њ–≤—Л—И–∞–µ—В—Б—П –њ—А–Є DвАУ–і–µ—Д–Є—Ж–Є—В–µ/–љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є [11]. –°—А–µ–і–Є –љ–Є—Е: —А–∞–Ї –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л, —В–Њ–ї—Б—В–Њ–є –Є –њ—А—П–Љ–Њ–є –Ї–Є—И–Ї–Є, –Љ–∞—В–Ї–Є, –њ–Є—Й–µ–≤–Њ–і–∞, —П–Є—З–љ–Є–Ї–Њ–≤, —Е–Њ–і–ґ–Ї–Є–љ—Б–Ї–∞—П –Є –љ–µ—Е–Њ–і–ґ–Ї–Є–љ—Б–Ї–∞—П –ї–Є–Љ—Д–Њ–Љ–∞, —А–∞–Ї –Љ–Њ—З–µ–≤–Њ–≥–Њ –њ—Г–Ј—Л—А—П, –ґ–µ–ї—З–љ–Њ–≥–Њ –њ—Г–Ј—Л—А—П, –ґ–µ–ї—Г–і–Ї–∞, –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –Є –њ—А–µ–і—Б—В–∞—В–µ–ї—М–љ–Њ–є –ґ–µ–ї–µ–Ј, –њ–Њ—З–µ–Ї, —П–Є—З–µ–Ї –Є –≤–ї–∞–≥–∞–ї–Є—Й–∞. –Ф–∞–љ–љ—Л–µ, –Ї–∞—Б–∞—О—Й–Є–µ—Б—П —Б–≤—П–Ј–Є –Љ–µ–ґ–і—Г DвАУ–і–µ—Д–Є—Ж–Є¬≠—В–Њ–Љ/–љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О –Є –Њ—В–і–µ–ї—М–љ—Л–Љ–Є –≤–Є–і–∞–Љ–Є –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є, –њ–Њ–ї—Г—З–µ–љ—Л –≤ —А—П–і–µ –Ї–Њ–≥–Њ—А—В–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Є–ї–Є —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Љ–µ—В–Њ–і–Њ–ї–Њ–≥–Є–Є —Б–ї—Г—З–∞–євАУ–Ї–Њ–љ—В—А–Њ–ї—М.
–≠—В–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–і—В–≤–µ—А–і–Є–ї–Є –љ–∞–ї–Є—З–Є–µ –Ї–Њ—А—А–µ–ї—П—Ж–Є–Є –Љ–µ–ґ–і—Г —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М—О –Є —Б–Љ–µ—А—В–љ–Њ—Б—В—М—О –Њ—В –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л—Е –Њ–њ—Г—Е–Њ–ї–µ–є –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л, —В–Њ–ї—Б—В–Њ–є –Ї–Є—И–Ї–Є, —П–Є—З–љ–Є–Ї–Њ–≤ –Є –њ—А–µ–і—Б—В–∞—В–µ–ї—М–љ–Њ–є –ґ–µ–ї–µ–Ј—Л –Є –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В—М—О —Б–Њ–ї–љ–µ—З–љ–Њ–є —А–∞–і–Є–∞—Ж–Є–Є –≤ –Љ–µ—Б—В–µ –њ–Њ—Б—В–Њ—П–љ–љ–Њ–≥–Њ –њ—А–Њ–ґ–Є–≤–∞–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М—О –Є—Е –њ—А–µ–±—Л–≤–∞–љ–Є—П –љ–∞ —Б–Њ–ї–љ—Ж–µ –Є —Г—А–Њ–≤–љ–µ–Љ –≤–Є—В–∞–Љ–Є–љ–∞ D –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є [11].
–Т –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–Љ –≤ –°–®–Р –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Њ–њ—А–µ–і–µ–ї—П–ї–Є —Г—А–Њ–≤–µ–љ—М 25(–Ю–Э)D –≤ –њ–ї–∞–Ј–Љ–µ —Г 1095 –Љ—Г–ґ—З–Є–љ –≤ —А–∞–Љ–Ї–∞—Е —Г—З–∞—Б—В–Є—П –≤ ¬ЂHealth Professionals FollowвАУUp Study¬ї –Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –Љ–Њ–і–µ–ї—М –ї–Є–љ–µ–є–љ–Њ–є —А–µ–≥—А–µ—Б—Б–Є–Є –і–ї—П –Њ—Ж–µ–љ–Ї–Є 6 –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л—Е —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї (–њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–µ –≤–Є—В–∞–Љ–Є–љ–∞ D —Б –њ–Є—Й–µ–є –Є —Б–Њ–і–µ—А–ґ–∞—Й–Є–Љ–Є –µ–≥–Њ –і–Њ–±–∞–≤–Ї–∞–Љ–Є, —А–∞—Б–∞, –Є–љ–і–µ–Ї—Б –Љ–∞—Б—Б—Л —В–µ–ї–∞, –Љ–µ—Б—В–Њ –≥–µ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ–ґ–Є–≤–∞–љ–Є—П, —Д–Є–Ј–Є—З–µ—Б–Ї–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М) –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ—А–µ–і–Є–Ї—В–Њ—А–Њ–≤ —Г—А–Њ–≤–љ—П 25(–Ю–Э)D –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є. –Я—А–Є –∞–љ–∞–ї–Є–Ј–µ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –Ї–Њ–Љ–њ—М—О—В–µ—А–љ—Г—О —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї—Г—О –Љ–Њ–і–µ–ї—М, —Б —А–∞—Б—З–µ—В–Њ–Љ —Г—А–Њ–≤–љ—П 25(–Ю–Э)D —Г 47 800 –Љ—Г–ґ—З–Є–љ –≤ –Ї–Њ–≥–Њ—А—В–µ –Є –µ–≥–Њ —Б–≤—П–Ј—М —Б —А–Є—Б–Ї–Њ–Љ —А–∞–Ї–∞ –ї—О–±–Њ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є. –°–Њ–≥–ї–∞—Б–љ–Њ –њ–Њ–ї—Г—З–µ–љ–љ—Л–Љ –і–∞–љ–љ—Л–Љ –њ–Њ–≤—Л—И–µ–љ–Є–µ –Є–ї–Є —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –љ–∞ 25 –љ–Љ–Њ–ї/–ї (10 –љ–≥/–Љ–ї) –≤ —А–∞—Б—Б—З–Є—В–∞–љ–љ–Њ–Љ —Г—А–Њ–≤–љ–µ 25(–Ю–Э)D —Б–≤—П–Ј–∞–љ–Њ —Б 17% —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –Њ–±—Й–µ–≥–Њ —З–Є—Б–ї–∞ —Б–ї—Г—З–∞–µ–≤ —А–∞–Ї–∞ (–Ю–†=0,83, 95% –Ф–Ш =0,73 –і–Њ 0,94) –Є –љ–∞ 29% —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –Њ–±—Й–µ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ–Њ–є –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–Љ–Є –Њ–њ—Г—Е–Њ–ї—П–Љ–Є (–Ю–†=0,71, 95%–Ф–Ш 0,60 –і–Њ 0,83) —Б –њ—А–µ–Њ–±–ї–∞–і–∞—О—Й–Є–Љ –≤–ї–Є—П–љ–Є–µ–Љ –љ–∞ —Б–ї—Г—З–∞–Є —А–∞–Ї–∞ –Њ—А–≥–∞–љ–Њ–≤ –Ц–Ъ–Ґ. –°—Е–Њ–і–љ—Л–µ –і–∞–љ–љ—Л–µ –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л –Є –≤ —А—П–і–µ –і—А—Г–≥–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, —Г—Б—В–∞–љ–Њ–≤–Є–≤—И–Є—Е –љ–∞–ї–Є—З–Є–µ –Ї–Њ—А—А–µ–ї—П—Ж–Є–Є –Љ–µ–ґ–і—Г –Ф–ТD –Є —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П —Б–∞—Е–∞—А–љ–Њ–≥–Њ –і–Є–∞–±–µ—В–∞ I —В–Є–њ–∞, –і—А—Г–≥–Є–Љ–Є –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є (—А–∞—Б—Б–µ—П–љ–љ—Л–є —Б–Ї–ї–µ—А–Њ–Ј, —А–µ–≤–Љ–∞—В–Њ–Є–і–љ—Л–є –∞—А—В—А–Є—В), —Б–Љ–µ—А—В–љ–Њ—Б—В—М—О –њ—А–Є –•–Я–Э –Є –і—А., –±–Њ–ї–µ–Ј–љ—П–Љ–Є –¶–Э–° (—Н–њ–Є–ї–µ–њ—Б–Є—П, –±–Њ–ї–µ–Ј–љ—М –Я–∞—А–Ї–Є–љ—Б–Њ–љ–∞, –±–Њ–ї–µ–Ј–љ—М –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞ –Є –і—А.), —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–µ.
–Т—Б–µ —Н—В–Є –і–∞–љ–љ—Л–µ –Ї–∞–Ї —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В—Л, —В–∞–Ї –Є –Њ—А–≥–∞–љ—Л –Ј–і—А–∞–≤–Њ–Њ—Е—А–∞–љ–µ–љ–Є—П –°–®–Р –Є —Б—В—А–∞–љ –Ч–∞–њ–∞–і–љ–Њ–є –Х–≤—А–Њ–њ—Л —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В, –Ї–∞–Ї ¬Ђ—Н–њ–Є–і–µ–Љ–Є—О –Ф–ТD¬ї, –Є–Љ–µ—О—Й—Г—О —Б–µ—А—М–µ–Ј–љ—Л–µ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Є–µ –Є –Љ–µ–і–Є–Ї–ЊвАУ—Б–Њ—Ж–Є–∞–ї—М–љ—Л–µ –њ–Њ—Б–ї–µ–і—Б—В–≤–Є—П.
–§–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –Ї–Њ—А—А–µ–Ї—Ж–Є—П DвАУ–і–µ—Д–Є—Ж–Є—В–∞
–Ъ–∞–Ї –њ–Њ–Ї–∞–Ј–∞–љ–Њ –≤—Л—И–µ, –Ф–ТD —П–≤–ї—П–µ—В—Б—П –Њ–і–љ–Є–Љ –Є–Ј —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ —А—П–і–∞ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —З–µ–ї–Њ–≤–µ–Ї–∞. –Т–Њ—Б–њ–Њ–ї–љ–µ–љ–Є–µ —Н—В–Њ–≥–Њ –і–µ—Д–Є—Ж–Є—В–∞ –Ј–∞ —Б—З–µ—В –∞–і–µ–Ї–≤–∞—В–љ–Њ–≥–Њ –њ—А–µ–±—Л–≤–∞–љ–Є—П –љ–∞ —Б–Њ–ї–љ—Ж–µ –ї–Є–±–Њ –њ—А–Є –Є—Б–Ї—Г—Б—Б—В–≤–µ–љ–љ–Њ–Љ –£–§вАУ–Њ–±–ї—Г—З–µ–љ–Є–Є —П–≤–ї—П–µ—В—Б—П –≤–∞–ґ–љ—Л–Љ —Н–ї–µ–Љ–µ–љ—В–Њ–Љ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —Н—В–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤–Є—В–∞–Љ–Є–љ–∞ D, –Њ—Б–Њ–±–µ–љ–љ–Њ –µ–≥–Њ –∞–Ї—В–Є–≤–љ—Л—Е –Љ–µ—В–∞–±–Њ–ї–Є¬≠—В–Њ–≤ вАУ –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ–Њ–µ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–µ –≤ –ї–µ—З–µ–љ–Є–Є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л—Е –≤–Є–і–Њ–≤ –њ–∞—В–Њ–ї–Њ–≥–Є–Є: –љ–∞—А—П–і—Г —Б —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л–Љ–Є –Љ–µ—В–Њ–і–∞–Љ–Є —В–µ—А–∞–њ–Є–Є –Њ–љ–Є –Њ—В–Ї—А—Л–≤–∞—О—В –љ–Њ–≤—Л–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –і–ї—П –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Л [6,8,12].
–Я–Њ —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В—Л –≤–Є—В–∞–Љ–Є–љ–∞ D —А–∞–Ј–і–µ–ї—П—О—В –љ–∞ –і–≤–µ –≥—А—Г–њ–њ—Л. –Т –њ–µ—А–≤—Г—О –Є–Ј –љ–Є—Е –Њ–±—К–µ¬≠–і–Є–љ–µ–љ—Л –Њ–±–ї–∞–і–∞—О—Й–Є–µ —Г–Љ–µ—А–µ–љ–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О –љ–∞—В–Є–≤–љ—Л–µ –≤–Є—В–∞–Љ–Є–љ—Л D2 (—Н—А–≥–Њ–Ї–∞–ї—М—Ж–Є—Д–µ—А–Њ–ї) –Є D3 (—Е–Њ–ї–µ–Ї–∞–ї—М—Ж–Є—Д–µ—А–Њ–ї), –∞ —В–∞–Ї–ґ–µ —Б—В—А—Г–Ї—В—Г—А–љ—Л–є –∞–љ–∞–ї–Њ–≥ –≤–Є—В–∞–Љ–Є–љ–∞ D3 вАУ –і–Є¬≠–≥–Є–і—А–Њ—В–∞—Е–Є—Б—В–µ—А–Њ–ї. –Т–Є—В–∞–Љ–Є–љ D2 –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П –≤ —Б–Њ—Б—В–∞–≤–µ –њ–Њ–ї–Є–≤–Є—В–∞–Љ–Є–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –і–ї—П –і–µ—В–µ–є –Є –≤–Ј—А–Њ—Б–ї—Л—Е. –Я–Њ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є 1 –Љ–≥ –≤–Є—В–∞–Љ–Є–љ–∞ D2 —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–µ–љ 40 000 –Ь–Х –≤–Є—В–∞–Љ–Є–љ–∞ D. –Ю–±—Л—З–љ–Њ –≤–Є—В–∞–Љ–Є–љ D2 –≤—Л–њ—Г—Б–Ї–∞—О—В –≤ –Ї–∞–њ—Б—Г–ї–∞—Е –Є–ї–Є —В–∞–±–ї–µ—В–Ї–∞—Е –њ–Њ 50 000 –Ь–Х (1,25 –Љ–≥) –Є–ї–Є –≤ –Љ–∞—Б–ї—П–љ–Њ–Љ —А–∞—Б—В–≤–Њ—А–µ –і–ї—П –Є–љ—К–µ–Ї—Ж–Є–є –њ–Њ 500 000 –Ь–Х/–Љ–ї (12,5 –Љ–≥) –≤ –∞–Љ–њ—Г–ї–∞—Е. –С–µ–Ј—А–µ¬≠—Ж–µ–њ—В—Г—А–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –і–ї—П –њ—А–Є–µ–Љ–∞ –≤–љ—Г—В—А—М (—А–∞—Б—В–≤–Њ—А—Л) —Б–Њ–і–µ—А–ґ–∞—В 8000 –Ь–Х/–Љ–ї (0,2 –Љ–≥) –≤–Є—В–∞–Љ–Є–љ–∞ D2. –Т —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ –і–µ–є—Б—В–≤—Г—О—Й–Є—Е –≤–µ—Й–µ—Б—В–≤ –њ—А–µ–њ–∞—А–∞—В—Л —Н—В–Њ–є –≥—А—Г–њ–њ—Л –Њ—В–љ–Њ—Б—П—В –Ї –Љ–Є–Ї—А–Њ–љ—Г—В—А–Є–µ–љ—В–∞–Љ (–њ–Є—Й–µ–≤—Л–Љ –і–Њ–±–∞–≤–Ї–∞–Љ).
–Т–Њ –≤—В–Њ—А—Г—О –≥—А—Г–њ–њ—Г –≤—Е–Њ–і—П—В –∞–Ї—В–Є–≤–љ—Л–є –Љ–µ—В–∞–±–Њ–ї–Є—В –≤–Є—В–∞–Љ–Є–љ–∞ D3 –Є –µ–≥–Њ –∞–љ–∞–ї–Њ–≥–Є: –Ї–∞–ї—М—Ж–Є—В—А–Є–Њ–ї, –∞–ї—М—Д–∞–Ї–∞–ї—М—Ж–Є–і–Њ–ї –Є –і—А. [1,2,6вАУ8].
–Ь–µ—Е–∞–љ–Є–Ј–Љ –і–µ–є—Б—В–≤–Є—П –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ –∞–љ–∞–ї–Њ–≥–Є—З–µ–љ —В–∞–Ї–Њ–≤–Њ–Љ—Г –њ—А–Є—А–Њ–і–љ–Њ–≥–Њ –≤–Є—В–∞–Љ–Є–љ–∞ D –Є –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –≤ —Б–≤—П–Ј—Л–≤–∞–љ–Є–Є —Б –†–ТD –≤ –Њ—А–≥–∞–љ–∞—ЕвАУ–Љ–Є—И–µ–љ—П—Е –Є –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ—Л–Љ–Є –Є—Е –∞–Ї—В–Є–≤–∞—Ж–Є–µ–є —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є —Н—Д—Д–µ–Ї—В–∞–Љ–Є (—Г—Б–Є–ї–µ–љ–Є–µ –≤—Б–∞—Б—Л–≤–∞–љ–Є—П –Ї–∞–ї—М—Ж–Є—П –≤ –Ї–Є—И–µ—З–љ–Є–Ї–µ –Є –і—А.). –†–∞–Ј–ї–Є—З–Є—П –≤ –і–µ–є—Б—В–≤–Є–Є –Њ—В–і–µ–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–Њ—Б—П—В –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А –Є –Њ–њ—А–µ–і–µ–ї—П—О—В—Б—П –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П–Љ–Є –Є—Е —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є–Ї–Є –Є –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞. –Ґ–∞–Ї, –њ—А–µ–њ–∞—А–∞—В—Л –љ–∞—В–Є–≤–љ—Л—Е –≤–Є—В–∞–Љ–Є–љ–Њ–≤ D2 –Є D3 –њ–Њ–і–≤–µ—А–≥–∞—О—В—Б—П –≤ –њ–µ—З–µ–љ–Є 25вАУ–≥–Є–і—А–Њ–Ї—Б–Є–ї–Є—А–Њ–≤–∞–љ–Є—О —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ –њ—А–µ–≤—А–∞—Й–µ–љ–Є–µ–Љ –≤ –њ–Њ—З–Ї–∞—Е –≤ –∞–Ї—В–Є–≤–љ—Л–µ –Љ–µ—В–∞–±–Њ–ї–Є—В—Л, –Њ–Ї–∞–Ј—Л–≤–∞—О—Й–Є–µ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є–µ —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Н—Д—Д–µ–Ї—В—Л. –Т —Н—В–Њ–є —Б–≤—П–Ј–Є –Є –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б —Г–Ї–∞–Ј–∞–љ–љ—Л–Љ–Є –≤—Л—И–µ –њ—А–Є—З–Є–љ–∞–Љ–Є –њ—А–Њ—Ж–µ—Б—Б—Л –Љ–µ—В–∞–±–Њ–ї–Є–Ј–∞—Ж–Є–Є —Н—В–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, —Б–љ–Є–ґ–∞—О—В—Б—П —Г –ї–Є—Ж –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞, –њ—А–Є —А–∞–Ј–љ—Л—Е —В–Є–њ–∞—Е –Є —Д–Њ—А–Љ–∞—Е –њ–µ—А–≤–Є—З–љ–Њ–≥–Њ –Є –≤—В–Њ—А–Є—З–љ–Њ–≥–Њ –Ю–Я, —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —Б—В—А–∞–і–∞—О—Й–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є –Ц–Ъ–Ґ, –њ–µ—З–µ–љ–Є, –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л –Є –њ–Њ—З–µ–Ї (–•–Я–Э), –∞ —В–∞–Ї–ґ–µ –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞, –љ–∞–њ—А–Є–Љ–µ—А, –њ—А–Њ—В–Є–≤–Њ—Б—Г–і–Њ—А–Њ–ґ–љ—Л—Е –Є –і—А—Г–≥–Є—Е –Ы–°, —Г—Б–Є–ї–Є–≤–∞—О—Й–Є—Е –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ 25(–Ю–Э)D –і–Њ –љ–µ–∞–Ї—В–Є–≤–љ—Л—Е –њ—А–Њ–Є–Ј–≤–Њ–і–љ—Л—Е. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –і–Њ–Ј—Л –≤–Є—В–∞–Љ–Є–љ–Њ–≤ D2 –Є D3 –Є –Є—Е –∞–љ–∞–ї–Њ–≥–Њ–≤ –≤ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Д–Њ—А–Љ–∞—Е (–Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –±–ї–Є–Ј–Ї–Є–µ –Ї —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –њ–Њ—В—А–µ–±–љ–Њ—Б—В—П–Љ –≤ –≤–Є—В–∞–Љ–Є–љ–µ D вАУ 200вАУ800 –Ь–Х/—Б—Г—В.) —Б–њ–Њ—Б–Њ–±–љ—Л –≤ —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Г—Б–ї–Њ–≤–Є—П—Е —Г—Б–Є–ї–Є–≤–∞—В—М –∞–±—Б–Њ—А–±—Ж–Є—О –Ї–∞–ї—М—Ж–Є—П –≤ –Ї–Є—И–µ—З–љ–Є–Ї–µ, –љ–Њ –љ–µ –њ–Њ–Ј–≤–Њ–ї—П—О—В –њ—А–µ–Њ–і–Њ–ї–µ—В—М –µ–≥–Њ –Љ–∞–ї—М–∞–±—Б–Њ—А–±—Ж–Є—О –њ—А–Є —А–∞–Ј–љ—Л—Е —Д–Њ—А–Љ–∞—Е –Ю–Я, –≤—Л–Ј—Л–≤–∞—О—Й–Є—Е –њ–Њ–і–∞–≤–ї–µ–љ–Є–µ —Б–µ–Ї—А–µ—Ж–Є–Є –Я–Ґ–У, –Є –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞—О—В –Њ—В—З–µ—В–ї–Є–≤–Њ–≥–Њ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ –Ї–Њ—Б—В–љ—Г—О —В–Ї–∞–љ—М [1,2,4,6,8].
–≠—В–Є—Е –љ–µ–і–Њ—Б—В–∞—В–Ї–Њ–≤ –ї–Є—И–µ–љ—Л –њ—А–µ–њ–∞—А–∞—В—Л, —Б–Њ–і–µ—А–ґ–∞—Й–Є–µ –∞–Ї—В–Є–≤–љ—Л–µ –Љ–µ—В–∞–±–Њ–ї–Є—В—Л –≤–Є—В–∞–Љ–Є–љ–∞ D3 (–≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –Є—Е –њ—А–Є–Љ–µ–љ—П—О—В —Б –ї–µ—З–µ–±–љ—Л–Љ–Є —Ж–µ–ї—П–Љ–Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —И–Є—А–µ, —З–µ–Љ –њ—А–µ–њ–∞—А–∞—В—Л –љ–∞—В–Є–≤–љ–Њ–≥–Њ –≤–Є—В–∞–Љ–Є–љ–∞): 1a,25(–Ю–Э)2D3 (–Ь–Э–Э вАУ –Ї–∞–ї—М—Ж–Є—В—А–Є–Њ–ї; —Е–Є–Љ–Є—З–µ—Б–Ї–Є –Є–і–µ–љ—В–Є—З–µ–љ —Б–Њ–±—Б—В–≤–µ–љ–љ–Њ DвАУ–≥–Њ—А–Љ–Њ–љ—Г) –Є –µ–≥–Њ —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Њ–µ 1aвАУ–њ—А–Њ–Є–Ј–≤–Њ–і–љ–Њ–µ вАУ 1a(–Ю–Э)D3 (–Ь–Э–Э вАУ –∞–ї—М—Д–∞–Ї–∞–ї—М—Ж–Є–і–Њ–ї). –Ю–±–∞ –њ—А–µ–њ–∞—А–∞—В–∞ —Б—Е–Њ–і–љ—Л –њ–Њ —Б–њ–µ–Ї—В—А—Г —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Б–≤–Њ–є—Б—В–≤ –Є –Љ–µ—Е–∞–љ–Є–Ј–Љ—Г –і–µ–є—Б—В–≤–Є—П, –љ–Њ —А–∞–Ј–ї–Є—З–∞—О—В—Б—П –њ–Њ —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є–Љ –њ–∞—А–∞–Љ–µ—В—А–∞–Љ, –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є –Є –љ–µ–Ї–Њ—В–Њ—А—Л–Љ –і—А—Г–≥–Є–Љ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞–Љ [1вАУ3,6,8].
–Т —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є–Ї–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–∞ –Њ—Б–љ–Њ–≤–µ –љ–∞—В–Є–≤–љ—Л—Е —Д–Њ—А–Љ –≤–Є—В–∞–Љ–Є–љ–∞ D, –Є—Е –∞–Ї—В–Є–≤–љ—Л—Е –Љ–µ—В–∞–±–Њ–ї–Є—В–Њ–≤ –Є –њ—А–Њ–Є–Ј–≤–Њ–і–љ—Л—Е –Є–Љ–µ—О—В—Б—П —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–µ —А–∞–Ј–ї–Є—З–Є—П, –≤–Њ –Љ–љ–Њ–≥–Њ–Љ –Њ–њ—А–µ–і–µ–ї—П—О—Й–Є–µ –Є—Е –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ. –Э–∞—В–Є–≤–љ—Л–µ –≤–Є—В–∞–Љ–Є–љ—Л D2 –Є D3 –≤—Б–∞—Б—Л–≤–∞—О—В—Б—П –≤ –≤–µ—А—Е–љ–µ–Љ –Њ—В–і–µ–ї–µ —В–Њ–љ–Ї–Њ–≥–Њ –Ї–Є—И–µ—З–љ–Є–Ї–∞, –њ–Њ—Б—В—Г–њ–∞—П –≤ —Б–Њ—Б—В–∞–≤–µ —Е–Є–ї–Њ–Љ–Є–Ї—А–Њ–љ–Њ–≤ –≤ –µ–≥–Њ –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї—Г—О —Б–Є—Б—В–µ–Љ—Г, –њ–µ—З–µ–љ—М –Є –і–∞–ї–µ–µ –≤ –Ї—А–Њ–≤–µ–љ–Њ—Б–љ–Њ–µ —А—Г—Б–ї–Њ. –Ш—Е –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –љ–∞–±–ї—О–і–∞–µ—В—Б—П –≤ —Б—А–µ–і–љ–µ–Љ —З–µ—А–µ–Ј 12 —З –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –Њ–і–љ–Њ–Ї—А–∞—В–љ–Њ–є –і–Њ–Ј—Л –Є –≤–Њ–Ј–≤—А–∞—Й–∞–µ—В—Б—П –Ї –Є—Б—Е–Њ–і–љ–Њ–Љ—Г —Г—А–Њ–≤–љ—О —З–µ—А–µ–Ј 72 —З. –Э–∞ —Д–Њ–љ–µ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Н—В–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ (–Њ—Б–Њ–±–µ–љ–љ–Њ –≤ –±–Њ–ї—М—И–Є—Е –і–Њ–Ј–∞—Е) –Є—Е –≤—Л–≤–µ–і–µ–љ–Є–µ –Є–Ј —Ж–Є—А–Ї—Г–ї—П—Ж–Є–Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –Ј–∞–Љ–µ–і–ї—П–µ—В—Б—П –Є –Љ–Њ–ґ–µ—В –і–Њ—Б—В–Є–≥–∞—В—М –Љ–µ—Б—П—Ж–µ–≤, —З—В–Њ —Б–≤—П–Ј—Л–≤–∞—О—В —Б –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М—О –і–µ–њ–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –≤–Є—В–∞–Љ–Є–љ–Њ–≤ D2 –Є D3 –≤ –ґ–Є—А–Њ–≤–Њ–є –Є –Љ—Л—И–µ—З–љ–Њ–є —В–Ї–∞–љ—П—Е [8].
–Т–Є—В–∞–Љ–Є–љ D —Н–Ї—Б–Ї—А–µ—В–Є—А—Г–µ—В—Б—П —Б –ґ–µ–ї—З—М—О –≤ –≤–Є–і–µ –±–Њ–ї–µ–µ –њ–Њ–ї—П—А–љ—Л—Е –Љ–µ—В–∞–±–Њ–ї–Є—В–Њ–≤. –Я–Њ–і—А–Њ–±–љ–Њ –Є–Ј—Г—З–µ–љ–∞ —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є–Ї–∞ –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є—В–∞ –≤–Є—В–∞–Љ–Є–љ–∞ D вАУ –Ї–∞–ї—М—Ж–Є—В—А–Є–Њ–ї–∞ [1a,25(–Ю–Э)2D3]. –Я–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –≤–љ—Г—В—А—М –Њ–љ –±—Л—Б—В—А–Њ –≤—Б–∞—Б—Л–≤–∞–µ—В—Б—П –≤ —В–Њ–љ–Ї–Њ–Љ –Ї–Є—И–µ—З–љ–Є–Ї–µ. –Ь–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –Ї–∞–ї—М—Ж–Є—В—А–Є–Њ–ї–∞ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –і–Њ—Б—В–Є–≥–∞–µ—В—Б—П —З–µ—А–µ–Ј 2вАУ6 —З –Є —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Б–љ–Є–ґ–∞–µ—В—Б—П —З–µ—А–µ–Ј 4вАУ8 —З. –Я–µ—А–Є–Њ–і –њ–Њ–ї—Г–≤—Л–≤–µ–і–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–ї—П–µ—В 3вАУ6 —З. –Я—А–Є –њ–Њ–≤—В–Њ—А–љ–Њ–Љ –њ—А–Є–µ–Љ–µ —А–∞–≤–љ–Њ–≤–µ—Б–љ—Л–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –і–Њ—Б—В–Є–≥–∞—О—В—Б—П –≤ –њ—А–µ–і–µ–ї–∞—Е 7 —Б—Г—В. –Т –Њ—В–ї–Є—З–Є–µ –Њ—В –њ—А–Є—А–Њ–і–љ–Њ–≥–Њ –≤–Є—В–∞–Љ–Є–љ–∞ D3, –Ї–∞–ї—М—Ж–Є—В—А–Є–Њ–ї, –љ–µ —В—А–µ–±—Г—О—Й–Є–є –і–∞–ї—М–љ–µ–є—И–µ–є –Љ–µ—В–∞–±–Њ–ї–Є–Ј–∞—Ж–Є–Є –і–ї—П –њ—А–µ–≤—А–∞—Й–µ–љ–Є—П –≤ –∞–Ї—В–Є–≤–љ—Г—О —Д–Њ—А–Љ—Г, –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –≤–љ—Г—В—А—М –≤ –і–Њ–Ј–∞—Е 0,25вАУ0,5 –Љ–Ї–≥ –±–ї–∞–≥–Њ–і–∞—А—П –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—О —Б –≤–љ–µ—П–і–µ—А–љ—Л–Љ–Є —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є —Н–љ—В–µ—А–Њ—Ж–Є—В–Њ–≤ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –Ї–Є—И–µ—З–љ–Є–Ї–∞ –≤—Л–Ј—Л–≤–∞–µ—В —Г–ґ–µ —З–µ—А–µ–Ј 2вАУ6 —З –њ–Њ–≤—Л—И–µ–љ–Є–µ –Ї–Є—И–µ—З–љ–Њ–є –∞–±—Б–Њ—А–±—Ж–Є–Є –Ї–∞–ї—М—Ж–Є—П. –Я—А–µ–і–њ–Њ–ї–∞–≥–∞—О—В, —З—В–Њ —Н–Ї–Ј–Њ–≥–µ–љ–љ—Л–є –Ї–∞–ї—М—Ж–Є—В—А–Є–Њ–ї –њ—А–Њ–љ–Є–Ї–∞–µ—В –Є–Ј –Ї—А–Њ–≤–Є –Љ–∞—В–µ—А–Є –≤ –Ї—А–Њ–≤–Њ—В–Њ–Ї –њ–ї–Њ–і–∞, –≤—Л–і–µ–ї—П–µ—В—Б—П —Б –≥—А—Г–і–љ—Л–Љ –Љ–Њ–ї–Њ–Ї–Њ–Љ. –Т—Л–≤–Њ–і–Є—В—Б—П —Б –ґ–µ–ї—З—М—О –Є –њ–Њ–і–≤–µ—А–≥–∞–µ—В—Б—П —Н–љ—В–µ—А–Њ–≥–µ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є —Ж–Є—А–Ї—Г–ї—П—Ж–Є–Є. –Ш–і–µ–љ—В–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ–Њ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Љ–µ—В–∞–±–Њ–ї–Є—В–Њ–≤ –Ї–∞–ї—М—Ж–Є—В—А–Є–Њ–ї–∞, –Ї–Њ—В–Њ—А—Л–µ –Њ–±–ї–∞–і–∞—О—В –≤ —А–∞–Ј–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ–Є —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є –≤–Є—В–∞–Љ–Є–љ–∞ D; –Ї –Є—Е —З–Є—Б–ї—Г –Њ—В–љ–Њ—Б—П—В—Б—П 1a,25вАУ–і–Є–≥–Є–і—А–Њ–Ї—Б–ЄвАУ24вАУ–Њ–Ї¬≠—Б–Њ¬≠—Е–Њ–ї–µ¬≠–Ї–∞–ї—М—Ж–Є¬≠—Д–µ¬≠—А–Њ–ї, 1a,23,25вАУ—В—А–Є–≥–Є–і—А–Њ–Ї—Б–ЄвАУ24вАУ–Њ–Ї—Б–Њ¬≠—Е–Њ¬≠–ї–µ¬≠–Ї–∞–ї—М¬≠—Ж–Є—Д–µ¬≠—А–Њ–ї –Є –і—А.
–Я—А–Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–Љ —Б—Е–Њ–і—Б—В–≤–µ –≤ —Б–≤–Њ–є—Б—В–≤–∞—Е –Є –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞—Е –і–µ–є—Б—В–≤–Є—П –Љ–µ–ґ–і—Г –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –∞–Ї—В–Є–≤–љ—Л—Е –Љ–µ—В–∞–±–Њ–ї–Є—В–Њ–≤ –≤–Є—В–∞–Љ–Є–љ–∞ D —Б—Г—Й–µ—Б—В–≤—Г—О—В –Є –Ј–∞–Љ–µ—В–љ—Л–µ —А–∞–Ј–ї–Є—З–Є—П. –Ю—Б–Њ–±–µ–љ–љ–Њ—Б—В—М—О –∞–ї—М—Д–∞–Ї–∞–ї—М—Ж–Є–і–Њ–ї–∞ –Ї–∞–Ї –њ—А–Њ–ї–µ–Ї–∞—А—Б—В–≤–∞ —П–≤–ї—П–µ—В—Б—П —В–Њ, —З—В–Њ –Њ–љ, –Ї–∞–Ї —Г–ґ–µ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М, –њ—А–µ–≤—А–∞—Й–∞–µ—В—Б—П –≤ –∞–Ї—В–Є–≤–љ—Г—О —Д–Њ—А–Љ—Г, –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Є—А—Г—П—Б—М –≤ –њ–µ—З–µ–љ–Є –і–Њ 1a,25(–Ю–Э)2D3, –Є –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–∞—В–Є–≤–љ–Њ–≥–Њ –≤–Є—В–∞–Љ–Є–љ–∞ D –љ–µ –љ—Г–ґ–і–∞–µ—В—Б—П –≤ –њ–Њ—З–µ—З–љ–Њ–Љ –≥–Є–і—А–Њ–Ї—Б–Є–ї–Є—А–Њ–≤–∞–љ–Є–Є, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –µ–≥–Њ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є –њ–Њ—З–µ–Ї, –∞ —В–∞–Ї–ґ–µ —Г –ї–Є—Ж –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ —Б–Њ —Б–љ–Є–ґ–µ–љ–љ–Њ–є –њ–Њ—З–µ—З–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–µ–є. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –і–µ–є—Б—В–≤–Є–µ –Ї–∞–ї—М—Ж–Є—В—А–Є–Њ–ї–∞ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –±—Л—Б—В—А–µ–µ –Є —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ –≥–Є–њ–µ—А–Ї–∞–ї—М—Ж–Є–µ–Љ–Є—З–µ—Б–Ї–Є–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ, —З–µ–Љ —Г –∞–ї—М—Д–∞–Ї–∞–ї—М—Ж–Є–і–Њ–ї–∞ (–љ–∞–Є–±–Њ–ї–µ–µ —И–Є—А–Њ–Ї–Њ –њ—А–Є–Љ–µ–љ—П–µ–Љ—Л–Љ –≤ –†–Њ—Б—Б–Є–Є –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –∞–ї—М—Д–∞–Ї–∞–ї—М—Ж–Є–і–Њ–ї–∞ —П–≤–ї—П–µ—В—Б—П ¬Ђ–Р–ї—М—Д–∞ –Ф3вАУ–Ґ–µ–≤–∞¬ї), —В–Њ–≥–і–∞ –Ї–∞–Ї –њ–Њ—Б–ї–µ–і–љ–Є–є –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –ї—Г—З—И–Є–є —Н—Д—Д–µ–Ї—В –љ–∞ –Ї–Њ—Б—В–љ—Г—О —В–Ї–∞–љ—М. –Ю—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є–Ї–Є –Є —Д–∞—А–Љ–∞–Ї–Њ–і–Є–љ–∞–Љ–Є–Ї–Є —Н—В–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Њ–њ—А–µ–і–µ–ї—П—О—В —А–µ–ґ–Є–Љ –Є—Е –і–Њ–Ј–Є—А–Њ–≤–∞–љ–Є—П –Є –Ї—А–∞—В–љ–Њ—Б—В—М –љ–∞–Ј–љ–∞—З–µ–љ–Є—П. –Ґ–∞–Ї, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –њ–µ—А–Є–Њ–і –њ–Њ–ї—Г–≤—Л–≤–µ–і–µ–љ–Є—П –Ї–∞–ї—М—Ж–Є—В—А–Є–Њ–ї–∞ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –Ї–Њ—А–Њ—В–Њ–Ї, —В–Њ –і–ї—П –њ–Њ–і–і–µ—А–ґ–∞–љ–Є—П —Б—В–∞–±–Є–ї—М–љ–Њ–є —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –µ–≥–Њ —Б–ї–µ–і—Г–µ—В –љ–∞–Ј–љ–∞—З–∞—В—М –љ–µ –Љ–µ–љ–µ–µ 2вАУ3 —А–∞–Ј –≤ —Б—Г—В–Ї–Є. –Ф–µ–є—Б—В–≤–Є–µ –∞–ї—М—Д–∞–Ї–∞–ї—М—Ж–Є–і–Њ–ї–∞ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –Љ–µ–і–ї–µ–љ–љ–µ–µ, –Њ–і–љ–∞–Ї–Њ –њ–Њ—Б–ї–µ –Њ–і–љ–Њ–Ї—А–∞—В–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П –Њ–љ–Њ –±–Њ–ї–µ–µ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ, —З—В–Њ –Њ–њ—А–µ–і–µ–ї—П–µ—В –µ–≥–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –≤ –і–Њ–Ј–∞—Е 0,25вАУ1 –Љ–Ї–≥ 1вАУ2 —А–∞–Ј–∞ –≤ —Б—Г—В–Ї–Є [1,2,8].
–Я—А–µ–њ–∞—А–∞—В—Л –љ–∞—В–Є–≤–љ—Л—Е –≤–Є—В–∞–Љ–Є–љ–Њ–≤ D2 –Є D3, –∞ —В–∞–Ї–ґ–µ –Є—Е –∞–Ї—В–Є–≤–љ—Л—Е –Љ–µ—В–∞–±–Њ–ї–Є—В–Њ–≤ –Њ—В–љ–Њ—Б—П—В—Б—П –Ї —З–Є—Б–ї—Г –љ–∞–Є–±–Њ–ї–µ–µ —Е–Њ—А–Њ—И–Њ –њ–µ—А–µ–љ–Њ—Б–Є–Љ—Л—Е –Є –±–µ–Ј–Њ–њ–∞—Б–љ—Л—Е –Ы–°, –њ—А–Є–Љ–µ–љ—П–µ–Љ—Л—Е –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П –Ю–Я. –Ф–∞–љ–љ–Њ–µ –њ–Њ–ї–Њ–ґ–µ–љ–Є–µ –Є–Љ–µ–µ—В –±–Њ–ї—М—И–Њ–µ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –≤ —Б–≤—П–Ј–Є —Б —В–µ–Љ, —З—В–Њ –Є—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Њ–±—Л—З–љ–Њ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ (–≤ —В–µ—З–µ–љ–Є–µ –Љ–љ–Њ–≥–Є—Е –Љ–µ—Б—П—Ж–µ–≤ –Є –і–∞–ґ–µ –ї–µ—В). –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –љ–∞–±–ї—О–і–µ–љ–Є—П —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ —В–Њ–Љ, —З—В–Њ –њ—А–Є –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ–Љ –њ–Њ–і–±–Њ—А–µ –і–Њ–Ј –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤–Є—В–∞–Љ–Є–љ–∞ D –љ–∞ –Њ—Б–љ–Њ–≤–µ –Њ—Ж–µ–љ–Ї–Є —Г—А–Њ–≤–љ—П –Ї–∞–ї—М—Ж–Є—П –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –Љ–Є–љ–Є–Љ–∞–ї–µ–љ [1вАУ6,8]. –°–≤—П–Ј–∞–љ–Њ —Н—В–Њ —Б –њ—А–Є—Б—Г—Й–µ–є —Н—В–Є–Љ –њ—А–µ–њ–∞—А–∞—В–∞–Љ –±–Њ–ї—М—И–Њ–є —И–Є—А–Њ—В–Њ–є —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –∞–Ї—В–Є–≤–љ—Л—Е –Љ–µ—В–∞–±–Њ–ї–Є—В–Њ–≤ –≤–Є—В–∞–Љ–Є–љ–∞ D –њ—А–Є–Љ–µ—А–љ–Њ —Г 2вАУ4% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ —А–∞–Ј–≤–Є—В–Є–µ —А—П–і–∞ –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤, –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В—Л–Љ–Є –Є–Ј –Ї–Њ—В–Њ—А—Л—Е —П–≤–ї—П—О—В—Б—П –≥–Є–њ–µ—А–Ї–∞–ї—М—Ж–Є–µ–Љ–Є—П –Є –≥–Є–њ–µ—А—Д–Њ—Б—Д–∞—В–µ–Љ–Є—П, —З—В–Њ —Б–≤—П–Ј–∞–љ–Њ —Б –Њ–і–љ–Є–Љ –Є–Ј –Њ—Б–љ–Њ–≤–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –Є—Е –і–µ–є—Б—В–≤–Є—П вАУ —Г—Б–Є–ї–µ–љ–Є–µ–Љ –Ї–Є—И–µ—З–љ–Њ–є –∞–±—Б–Њ—А–±—Ж–Є–Є –Ї–∞–ї—М—Ж–Є—П –Є —Д–Њ—Б—Д–Њ—А–∞. –Ю–±–∞ —Н—В–Є —Н—Д—Д–µ–Ї—В–∞ –Љ–Њ–≥—Г—В –њ—А–Њ—П–≤–ї—П—В—М—Б—П –љ–µ–і–Њ–Љ–Њ–≥–∞–љ–Є–µ–Љ, —Б–ї–∞–±–Њ—Б—В—М—О, —Б–Њ–љ–ї–Є–≤–Њ—Б—В—М—О, –≥–Њ–ї–Њ–≤–љ—Л–Љ–Є –±–Њ–ї—П–Љ–Є, —В–Њ—И–љ–Њ—В–Њ–є, —Б—Г—Е–Њ—Б—В—М—О –≤–Њ —А—В—Г, –Ј–∞–њ–Њ—А–Њ–Љ –Є–ї–Є –њ–Њ–љ–Њ—Б–Њ–Љ, –і–Є—Б–Ї–Њ–Љ—Д–Њ—А—В–Њ–Љ –≤ —Н–њ–Є–≥–∞—Б—В—А–∞–ї—М–љ–Њ–є –Њ–±–ї–∞—Б—В–Є, –±–Њ–ї—П–Љ–Є –≤ –Љ—Л—И—Ж–∞—Е –Є —Б—Г—Б—В–∞–≤–∞—Е, –Ї–Њ–ґ–љ—Л–Љ –Ј—Г–і–Њ–Љ, —Б–µ—А–і—Ж–µ–±–Є–µ–љ–Є—П–Љ–Є. –Я—А–Є –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ –њ–Њ–і–Њ–±—А–∞–љ–љ–Њ–є –і–Њ–Ј–µ —Г–Ї–∞–Ј–∞–љ–љ—Л–µ –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –љ–∞–±–ї—О–і–∞—О—В—Б—П –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —А–µ–і–Ї–Њ.
–Ь–µ–ґ–і—Г–љ–∞—А–Њ–і–љ—Л–є –Є –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ—Л–є –Њ–њ—Л—В –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є—В–∞ –≤–Є—В–∞–Љ–Є–љ–∞ D вАУ –Ї–∞–ї—М—Ж–Є—В—А–Є–Њ–ї–∞ –Є –∞–ї—М—Д–∞–Ї–∞–ї—М—Ж–Є–і–Њ–ї–∞ –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П —А–∞–Ј–љ—Л—Е —В–Є–њ–Њ–≤ –Є —Д–Њ—А–Љ –Ю–Я, –∞ —В–∞–Ї–ґ–µ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –њ–∞–і–µ–љ–Є–є –Є –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ —Б—Г–Љ–Љ–Є—А–Њ–≤–∞–љ –≤ –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е ¬Ђ–Ю—Б—В–µ–Њ–њ–Њ—А–Њ–Ј. –Ф–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞, –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –Є –ї–µ—З–µ–љ–Є–µ¬ї 2008 –≥., –њ–Њ–і–≥–Њ—В–Њ–≤–ї–µ–љ–љ—Л—Е –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є–µ–є –њ–Њ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј—Г [5]. –Ч–∞–Ї–ї—О—З–µ–љ–Є–µ –Є —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є, –Ї–∞—Б–∞—О—Й–Є–µ—Б—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–∞ –Њ—Б–љ–Њ–≤–µ –∞–Ї—В–Є–≤–љ—Л—Е –Љ–µ—В–∞–±–Њ–ї–Є—В–Њ–≤ –≤–Є—В–∞–Љ–Є–љ–∞ D –њ—А–Є –ї–µ—З–µ–љ–Є–Є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞, —Б–Њ–і–µ—А–ґ–∞—Й–Є–µ—Б—П –≤ —Г–Ї–∞–Ј–∞–љ–љ–Њ–Љ –і–Њ–Ї—Г–Љ–µ–љ—В–µ, –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–∞—Е 4 –Є 5.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ—А–µ–њ–∞—А–∞—В—Л –≤–Є—В–∞–Љ–Є–љ–∞ D –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В —Б–Њ–±–Њ–є –≥—А—Г–њ–њ—Г —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л—Е –Є –±–µ–Ј–Њ–њ–∞—Б–љ—Л—Е –Ы–°, –њ—А–Є–Љ–µ–љ—П–µ–Љ—Л—Е –≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –њ—А–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е, –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –Ї–Њ—В–Њ—А—Л—Е –≤–µ–і—Г—Й—Г—О —А–Њ–ї—М –Є–≥—А–∞–µ—В DвАУ–і–µ—Д–Є¬≠—Ж–Є—В/–љ–µ¬≠–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М –Є —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –љ–Є–Љ –љ–∞—А—Г—И–µ–љ–Є—П –Љ–Є–љ–µ—А–∞–ї—М–љ–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞. –Я—А–µ–њ–∞—А–∞—В—Л –љ–∞—В–Є–≤–љ–Њ–≥–Њ –≤–Є—В–∞–Љ–Є–љ–∞ D, –Њ—Б–Њ–±–µ–љ–љ–Њ –≤ —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –і–Њ–Ј–∞—Е, –Ј–∞ —Б—З–µ—В –Ї–Њ—А—А–µ–Ї—Ж–Є–Є —Н–љ–і–Њ–≥–µ–љ–љ–Њ–≥–Њ DвАУ–і–µ—Д–Є—Ж–Є—В–∞/–љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –Њ–Ї–∞–Ј—Л–≤–∞—О—В –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–µ –і–µ–є—Б—В–≤–Є–µ –њ—А–Є —А–∞—Е–Є—В–µ, –∞ —В–∞–Ї–ґ–µ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Њ—Б—В–µ–Њ–њ–Њ—А–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞, –Љ–Њ–≥—Г—В —Б–љ–Є–ґ–∞—В—М –µ–≥–Њ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В—М –Є –њ—А–µ–і—Г–њ—А–µ–ґ–і–∞—В—М —А–∞–Ј–≤–Є—В–Є–µ –њ–µ—А–µ–ї–Њ–Љ–Њ–≤. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–∞—В–Є–≤–љ–Њ–≥–Њ –≤–Є—В–∞–Љ–Є–љ–∞ D —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ –≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –њ—А–Є 1вАУ–Љ —В–Є–њ–µ DвАУ–і–µ—Д–Є—Ж–Є—В–∞, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ–Њ–Љ –љ–µ–і–Њ—Б—В–∞—В–Ї–Њ–Љ –Є–љ—Б–Њ–ї—П—Ж–Є–Є –Є –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є—П –≤–Є—В–∞–Љ–Є–љ–∞ D —Б –њ–Є—Й–µ–є. –Я—А–µ–њ–∞—А–∞—В—Л –∞–Ї—В–Є–≤–љ—Л—Е –Љ–µ—В–∞–±–Њ–ї–Є—В–Њ–≤ –≤–Є—В–∞–Љ–Є–љ–∞ D (–∞–ї—М—Д–∞–Ї–∞–ї—М—Ж–Є–і–Њ–ї –Є –Ї–∞–ї—М—Ж–Є—В—А–Є–Њ–ї) –њ–Њ–Ї–∞–Ј–∞–љ—Л –Ї–∞–Ї –њ—А–Є 1вАУ–Љ, —В–∞–Ї –Є 2вАУ–Љ —В–Є–њ–µ DвАУ–і–µ—Д–Є—Ж–Є—В–∞. –Ч–∞ —Б—З–µ—В –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Њ–є, —З–µ–Љ —Г –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–∞—В–Є–≤–љ–Њ–≥–Њ –≤–Є—В–∞–Љ–Є–љ–∞ D, —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є, –Њ–љ–Є —Б–њ–Њ—Б–Њ–±–љ—Л –њ—А–µ–Њ–і–Њ–ї–µ–≤–∞—В—М —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М —В–Ї–∞–љ–µ–≤—Л—Е –†–ТD –Ї –∞–≥–Њ–љ–Є—Б—В—Г, –љ–µ –љ—Г–ґ–і–∞—О—В—Б—П –і–ї—П –њ—А–µ–≤—А–∞—Й–µ–љ–Є—П –≤ –∞–Ї—В–Є–≤–љ—Г—О —Д–Њ—А–Љ—Г –≤ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–∞—Ж–Є–Є –≤ –њ–Њ—З–Ї–∞—Е. –Я—А–µ–њ–∞—А–∞—В—Л –∞–Ї—В–Є–≤–љ—Л—Е –Љ–µ—В–∞–±–Њ–ї–Є—В–Њ–≤ –≤–Є—В–∞–Љ–Є–љ–∞ D –Њ–Ї–∞–Ј—Л–≤–∞—О—В –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Є–є –Є –ї–µ—З–µ–±–љ—Л–є —Н—Д—Д–µ–Ї—В—Л –њ—А–Є —А–∞–Ј–љ—Л—Е —В–Є–њ–∞—Е –Є —Д–Њ—А–Љ–∞—Е –Ю–Я, —Б–љ–Є–ґ–∞—О—В —А–Є—Б–Ї –њ–∞–і–µ–љ–Є–є; –Њ–љ–Є –Љ–Њ–≥—Г—В –њ—А–Є–Љ–µ–љ—П—В—М—Б—П –Ї–∞–Ї –≤ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є, —В–∞–Ї –Є –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б –і—А—Г–≥–Є–Љ–Є –∞–љ—В–Є–Њ—Б—В–µ–Њ–њ–Њ—А–µ—В–Є—З–µ—Б–Ї–Є–Љ–Є —Б—А–µ–і—Б—В–≤–∞–Љ–Є (–љ–∞–њ—А–Є–Љ–µ—А, —Б –±–Є—Б—Д–Њ—Б—Д–Њ–љ–∞—В–∞–Љ–Є, —Б—А–µ–і—Б—В–≤–∞–Љ–Є –Ч–У–Ґ) –Є —Б–Њ–ї—П–Љ–Є –Ї–∞–ї—М—Ж–Є—П. –Ш–љ–і–Є–≤–Є¬≠–і—Г¬≠–∞–ї—М–љ—Л–є –њ–Њ–і–±–Њ—А –і–Њ–Ј–Є—А–Њ–≤–Њ–Ї –Ї–∞–ї—М—Ж–Є—В—А–Є–Њ–ї–∞ –Є –∞–ї—М—Д–∞–Ї–∞–ї—М—Ж–Є–і–Њ–ї–∞ –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Б–≤–µ—Б—В–Є –Ї –Љ–Є–љ–Є–Љ—Г–Љ—Г —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤, —З—В–Њ –≤–Љ–µ—Б—В–µ —Б –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є–µ–Љ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –љ–Њ–≤—Л—Е –њ–µ—А–µ–ї–Њ–Љ–Њ–≤, —Г—Б—В—А–∞–љ–µ–љ–Є–µ–Љ –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –Є —Г–ї—Г—З—И–µ–љ–Є–µ–Љ –і–≤–Є–≥–∞—В–µ–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –њ–Њ–≤—Л—И–µ–љ–Є—О –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –њ–Њ–ґ–Є–ї–Њ–≥–Њ –Є —Б—В–∞—А—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞.
–Т—Л—Б–Њ–Ї–Є–є —Г—А–Њ–≤–µ–љ—М DвАУ–і–µ—Д–Є—Ж–Є—В–∞ –≤ –њ–Њ–њ—Г–ї—П—Ж–Є–Є –Є —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ –µ–≥–Њ –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є —Б —А—П–і–Њ–Љ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л—Е –≤–љ–µ—Б–Ї–µ–ї–µ—В–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є (—Б–µ—А–і–µ—З–љ–ЊвАУ—Б–Њ—Б—Г–і–Є—Б—В—Л—Е, –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е, –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є –і—А.) –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞–µ—В —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ—Б—В—М –і–∞–ї—М–љ–µ–є—И–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—О –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–µ–є –Є—Е –ї–µ—З–µ–љ–Є—П —Б –њ–Њ–Љ–Њ—Й—М—О –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤ –Є–Ј –≥—А—Г–њ–њ—Л –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є—В–∞ –≤–Є—В–∞–Љ–Є–љ–∞ D.