Таким образом, проблема «старения» общества диктует необходимость продления активной и качественной жизни человека, что позволит, с одной стороны, обеспечить необходимый социальный уровень и, с другой – снизить все возрастающие затраты на содержание и лечение нетрудоспособных пожилых людей.
Одной из частых клинических ситуаций у людей в возрасте старше 40 лет является болевой синдром в суставах. По мнению экспертов International Association on the Study of Pain, каждый седьмой пациент, обращающийся за плановой амбулаторной помощью, предъявляет жалобы на боли в суставах.
Особое значение данная проблема приобретает у лиц пожилого и старческого возраста. Более 50% пожилых людей испытывают затруднения при ходьбе и подъеме по лестнице, более 15% страдают явным ограничением подвижности, а после 75 лет эта цифра увеличивается до 30% (Powered by RiSearch 2000–2001 г.). Ведущей причиной столь неутешительной ситуации является наличие у них дегенеративно–дистрофических поражений суставов, т.н. деформирующий остеоартроз (ДО).
Известно, что в России 10–12% населения страдает ДО (около 15 млн. человек), манифестация которого у больных в возрасте старше 60 лет проявляется у подавляющего большинства – в 97% случаев. ДО является второй по частоте причиной инвалидизации после ССЗ.
Многие годы ДО рассматривался, как изолированное поражение суставов, связанное с дегенерацией хряща вследствие его старения. В настоящее время полагают, что в основе поражения хрящевой ткани лежит многокомпонентный процесс, а также комплекс причин и механизмов, только частично связанных со старением. Появились убедительные доказательства генетической предрасположенности к заболеванию, биомеханических и метаболических изменений, локальной воспалительной реакции и т.д. [Felson D.T., Lowrens R.C. et al., Ann. Intern. Med.2000; 133: 635–646].
В исследованиях Monson (1976), показано, что практически все пациенты с ДО имеют более одной соматической патологии, что и обусловливает у них меньшую продолжительность жизни: по данным Carman (1989) и Cerhan (1995), в среднем на 8–10 лет.
В качестве иллюстрации приводим пример пациентки А., 83 лет, инвалида 1 группы, находившейся в течение 3 лет под наблюдением в нашей клинике с сочетанием болезней: ИБС. Постинфарктный кардиосклероз с тяжелой бивентрикулярной сердечной недостаточностью и ХОБЛ с хроническим обструктивным бронхитом. У пациентки, помимо основной патологии, было длительное (более 30 лет) тяжелое поражение коленных и тазобедренных суставов, сопровождавшееся постоянным и выраженным болевым синдромом, практически без эффекта от проводимой терапии НПВП. Последняя госпитализации пациентки была обусловлена повторным инфарктом миокарда, приведшим к летальному исходу, что было подтверждено на аутопсии.
Таким образом, речь идет о достаточно типичном исходе заболевания у пожилого человека. При морфологическом исследовании суставных поверхностей коленного сустава у данной пациентки было выявлено практически полное отсутствие хрящевой ткани, микротрещины и кровоизлияния в структуре кости, прилежащей к суставам (рис. 1).
Хорошо известно, что в реальной практике, как правило, подобным пациентам достаточно часто назначаются НПВП, которые лишь в некоторой степени облегчают болевой синдром. Но поскольку речь идет о пожилых людях с сочетанной соматической патологией, данные препараты потенциально могут увеличивать риск эрозивно–язвенных поражений гастродуоденальной слизистой оболочки и смертельных желудочно–кишечных кровотечений (ЖКК), что является дополнительным фактором снижения продолжительности жизни таких пациентов [Monson, 1976].
Следует упомянуть, что наиболее часто назначаемые НПВП сами по себе ингибируют синтез протеогликанов суставного хряща, приводя тем самым к прогрессированию заболевания [Rashad S., Revell P., Hemingway A. et al., Lancet, 1989, i: 519–522].
За последние десять лет во врачебной практике утвердились так называемые медленнодействующие противовоспалительные или структурно–модифицирующие препараты («хондропротекторы»), эффективность которых при ДО показана в ряде плацебо–контролируемых исследований [Houpt JB, McMillan R, Paget–Dellio D, Russel A, Gahunia HK, 1998].
По мнению экспертов WHO/ILAR, OARS, замедление темпов прогрессирования остеоартроза, нормализация или стабилизация структурных изменений в гиалиновом хряще, профилактика дегенеративных изменений в непораженных суставах являются сутью лечения данной болезни, и достижение этих целей пока возможно лишь с помощью назначения болезнь–модифицирующих препаратов – хондропротекторов.
Однако в практической деятельности такие препараты при ДО назначаются достаточно редко, поскольку большинство врачей считают, что обезболивающая стратегия терапии у этих пациентов является единственной.
Каждый врач, планируя тактику ведения больных с ДО, должен представлять, что только обезболивающая терапия недостаточна для достижения стабилизации состояния и улучшения течения заболевания. Только длительное лечение, направленное на улучшение функции основных тканей сустава, способно привести к стойкому обезболивающему эффекту и улучшению структур хрящевой ткани [Н.В. Чичасова, Е.Л. Насонов, 2004].
На сегодня одним из наиболее перспективных препаратов группы хондропротекторов является комбинированный препарат АРТРА. В состав АРТРА входят два хондропротективных вещества – хондроитин сульфат (ХС) и глюкозамин (Г), эффективность которых при ОА доказана во многих клинических и экспериментальных исследованиях (уровень доказательности А). Совместное применение ХС и Г обеспечивает более высокую лечебную эффективность комбинированного препарата. Это обусловлено тем, что ХС и Г оказывают разнообразное, но не совсем идентичное фармакологическое действие на различные структуры сустава, в том числе на метаболизм хряща, и при совместном применении ХС и Г дополняют и усиливают действие друг друга. Более высокая эффективность комбинированных препаратов ХС и Г по сравнению с монопрепаратами доказана в ряде экспериментальных и клинических исследований [Amal M Das, Hendsonville NC, Jennifer Eitel, Tarek Hammad]. Для практического врача важно также учитывать тот факт, что для достижения лечебного эффекта необходима адекватная дозировка этих веществ: препарат АРТРА содержит 500 мг ХС и 500 мг глюкозамина гидрохлорида (ГГ).
Другим важным практическим вопросом является определение специальности врача, который должен заниматься ведением пациентов с ДО. Поскольку в ряде работ, приведенных выше, было показано, что в основном у всех пациентов с остеоартрозом имеется та или иная соматическая патология, то, вероятно, именно врач общей практики (а не только специалист–ревматолог) должен иметь навыки ведения данных пациентов.
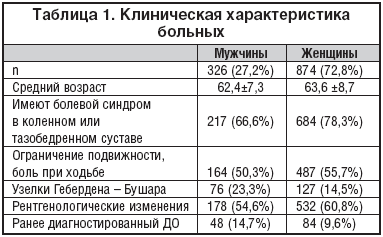
В терапевтической клинике нами был проведен скрининг с целью выявления ДО у 1200 пациентов с различными соматическими заболеваниями (326 мужчин, средний возраст которых составил 62,4±7,3 года, и 874 женщины, средний возраст которых – 63,6±8,7 года). У всех пациентов активно выявлялись клинические симптомы заболевания, проводился анализ клинической картины по шкале WOMAC и рентгенологическое исследование суставов (коленного или тазобедренного). Помимо этого, анализировались лечебные и профилактические мероприятия, направленные на лечение болевых синдромов, связанных с данной патологией у этих пациентов.
В результате было установлено, что до проведения скрининга лишь у 14,7% мужчин и 9,6% женщин ранее был диагностирован деформирующий остеоартроз (коксоарторз или гоноартроз). Из обследованных нами пациентов 901 (75,1%) предъявляли жалобы на боли в одном из крупных суставов (тазобедренном или коленном) (табл. 1). Из них 63,1% пациентов отмечали утреннюю скованность в суставе, длящуюся не более 1 часа. Ограничение подвижности и боль при ходьбе отмечалась у 54,3% пациентов.
Узелки Гебердена–Бушара были обнаружены у 16,9% пациентов.
Средний балл болевого синдрома по шкале WOMAC составил 356,4±46,4. Средний балл функциональной недостаточности по шкале WOMAC – 948,8±39,7.
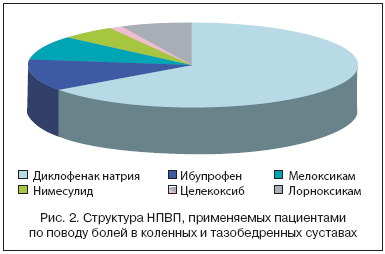
В связи с болевым синдромом 71,3% пациентов перманентно принимали НПВП. Структура НПВП, применяемых пациентами по поводу болей в коленных и тазобедренных суставах, представлена на рисунке 2.
Препараты со структурно модифицирующим действием (хондроитин сульфат и глюкозамин) принимали лишь 54 (4,5%) пациента.
При рентгенологическом исследовании диагноз ДО указанных суставов был выявлен у 710 (59,2%) пациентов, причем у женщин несколько чаще, чем у мужчин. Диагноз ДО устанавливался на основании выявления таких рентгенологических симптомов, как сужение суставной щели и остеофиты и/или субхондральный склероз и/или субхондральные кисты. Т.о., более 2/3 больных с хроническими соматическими заболеваниями имеют болевой синдром в коленных или тазобедренных суставах, при этом практически у 60% пациентов выявляются рентгенологические признаки ДО. Оценка по шкале WOMAC демонстрировала наличие выраженного болевого синдрома и значительную степень функциональных ограничений у данных пациентов. При этом более 71% пациентов получали НПВП и более 82% из них оценивали свою обезболивающую терапию, как неудовлетворительную.
Учитывая полученные нами неутешительные данные, приведенные выше, решение вопроса о ведении пациентов с деформирующим остеоартрозом и соматической патологией врачом общей практики является приоритетной задачей практического здравоохранения.
Несмотря на большое число публикаций, посвященных оценке эффективности хондропротективной терапии при ДО (как слепых рандомизированных, плацебо–контролируемых, так и клинических наблюдений), мы не обнаружили работ с препаратом АРТРА, критерием оценки эффективности терапии в которых служило бы МРТ исследование, являющееся на сегодняшний день самым объективным методом оценки состояния хрящевой ткани. Этот факт и определил цель настоящего исследования.
Цель исследования: изучить эффективность препарата АРТРА у пациентов с соматическими заболеваниями и деформирующим остеоартрозом коленных суставов.
Материалы и методы
В исследование было включено 60 больных, средний возраст которых составил 62,3±4,7 лет.
Критериями включения были: письменное информированное согласие на участие в исследовании, пациенты с подтвержденной соматической патологией, возраст пациентов 40–75 лет, ранее не диагностированный остеоартроз, боль при ходьбе по VAS>40, остеоартроз в соответствии с критериями Американской коллегии ревматологов (ACR), рентгенологически II–III стадия по Kellgron–Lawrence, прием НПВП в течение 30 дней за предшествующие исследованию 3 месяца.
Критерии исключения: хирургическое лечение в течение 6 предшествующих месяцев, необходимость внутрисуставного введения гормонов, хондрокальциноз, лечение другими хондропротекторами, лечение кортикостероидами, гиалуроновой кислотой в течение последнего месяца, тяжелые заболевания печени, почек (креатинин более 150 ммоль/л), тяжелая сердечно–сосудистая недостаточность, гематологические нарушения: снижение гемоглобина ниже 10 г/л, снижение лейкоцитов ниже 3 тысяч, тромбоцитов ниже 100 тыс, сахарный диабет I типа (инсулинозависимый), язвенная болезнь желудка и двенадцатиперстной кишки в течение последних 12 месяцев, аллергическая реакция на нестероидные противовоспалительные средства, участие в других клинических исследованиях.
Пациенты были рандомизированы на две, одинаковые по численности группы, в зависимости от назначения препарата АРТРА:
1 группа (n=30) – включала пациентов, которым назначена АРТРА
2 группа (n=30) – пациенты, которым не назначали препарат АРТРА
Как видно из таблицы 2, пациенты 1 и 2 группы были сопоставимы по возрасту, полу, распространенности отдельных терапевтических нозологий, интенсивности болевого синдрома и степени функциональных ограничений. В исследование специально были включены пациенты, у которых ДО был диагностирован впервые.
На момент исследования ряд пациентов принимали НПВП, причем число данных пациентов в группах было сопоставимо. В 1 группе 17 человек – диклофенак натрия, 6 – нимесулид, 3 – мелоксикам. Во 2 группе 14 – диклофенак натрия, 10 – нимесулид, 1 – ибупрофен, 2 – мелоксикам.
Дизайн исследования
В 1–й группе – всем пациентам назначен препарат АРТРА; пациенты продолжали получать ранее применяемые НПВП, в ходе исследования НПВП отменялись пациентам при отсутствии болевого синдрома и нерецидивировании последнего без терапии НПВП.
Режим дозирования АРТРА: по 1 таблетке 2 раза в сутки в течение трех первых недель; по 1 таблетке 1 раз в сутки в течение 6 месяцев.
Во 2–й группе – пациенты продолжали получать ранее назначенные НПВП, в ходе исследования НПВП отменялись пациентам при отсутствии болевого синдрома и нерецидивировании последнего без терапии НПВП.
Через 1, 3 и 6 месяцев наблюдения у всех пациентов проводился анализ по шкале WOMAC, оценивалась скорость ходьбы 15 метров. После окончания лечения больным предлагалось оценить эффективность терапии по критериям: плохо, удовлетворительно, хорошо, отлично.
Методами оценки безопасности терапии явились: анализ частоты развития НПВП–гастропатии по клиническим и инструментальным (ЭГДС) данным исходно и через 6 месяцев наблюдения.
С целью оценки структурно–модифицирующего действия препарата АРТРА и объективизации полученных данных всем пациентам была выполнена МРТ коленного сустава на старте исследования и через 9 месяцев.
Исследование проводилось на магнитно–резонансном томографе «Sonata» фирмы «Siemens» с напряженностью магнитного поля 1,5 Тл. 2002 г. выпуска. Плоскости сканирования – фронтальная, сагиттальная. Толщина срезов 3–5 мм. Расстояние между срезами 1 мм.
В качестве оценки изменений хрящевой структуры сустава проводилась оценка высоты суставного хряща в латеральных и медиальных срезах сустава в трех локализациях: I локализация – передняя поверхность головки бедренной кости (хрящ бедренной кости); II локализация – задняя поверхность головки бедренной кости (хрящ бедренной кости); III локализация – точка наибольшего соприкосновения бедренной и большеберцовой костей (сумма толщины бедренной и большеберцовой кости)
Оценивалась также площадь суставной поверхности.
Полученные результаты
Оценка динамики болевого синдрома продемонстрировала, что пациенты, которым была назначена АРТРА – уже через 3 месяца терапии имели больший регресс болевого синдрома по сравнению с группой контроля (рис. 3).
Через 6 месяцев терапии у пациентов 1 группы уровень интенсивности болевого синдрома был достоверно ниже, чем у пациентов 2 группы: 178,3±37,2 против 287,4±42,8 (р=0,02).
Скорость ходьбы 15 метров в 1 группе после терапии составила 29,7 сек. против 39,6 сек. во второй группе (рис. 4).
Оценка функциональной недостаточности (по шкале WOMAC) на старте исследования не выявила значимых различий между группами наблюдения. В обеих группах через 6 месяцев терапии мы наблюдали достоверное снижение балла функциональной недостаточности, однако в первой группе средний балл составил 427,3, во 2–й – 658,9 (р=0,002) (рис. 5).
Т.о., у пациентов, получающих АРТРА после окончания запланированного срока наблюдения, отмечалась достоверно большая динамика нивелирования болевого синдрома и функциональной недостаточности.
Визуальная оценка исследований до лечения и через 9 месяцев терапии врачом, проводившим МРТ коленного сустава, выявила в 1 группе 60% пациентов с положительной динамикой, 30% – с отсутствием динамики и 10% с отрицательной динамикой, во 2 группе 63,3% пациентов с отрицательной динамикой и 36,7% с отсутствием динамики.
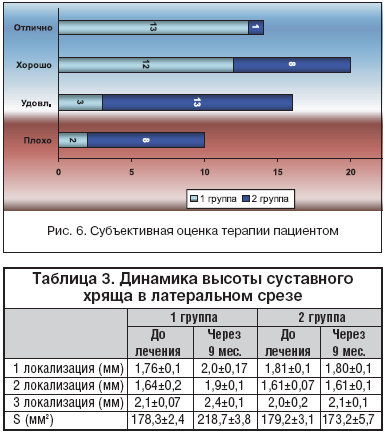
Анализ высоты суставного хряща (табл. 3) в латеральном срезе у пациентов І группы продемонстрировал положительную динамику во всех точках подсчета, площадь суставной поверхности за период наблюдения увеличилась в среднем на 40 мм2. Однако во второй группе (пациенты принимали только НПВП) в 1 и 2 локализации отмечена отрицательная динамика, площадь суставной поверхности уменьшилась в среднем на 6 мм2.
Анализ высоты суставного хряща в медиальном срезе показал аналогичные результаты (табл. 4).
Таким образом, больший положительный эффект с позиций клинической картины в группе пациентов, получающих АРТРА, был подтвержден и данными МРТ исследования, которое выявило увеличение площади суставной поверхности и прирост высоты хряща в исследуемых точках по окончании курса лечения препаратом.
При оценке эффективности терапии ДО у пациентов с соматической патологией также важными представлялись оценка динамики потребности пациента в обезболивающих препаратах и число случаев развития НПВП–гастропатии и диспепсии (табл. 5). Методами оценки безопасности терапии явились: оценка частоты развития НПВП–гастропатии по клиническим признакам (диспепсия) на протяжении всего курса терапии и данным ЭГДС через 6 месяцев лечения.
Как видно из таблицы 5, в группе больных, принимавших АРТРА, к концу лечения только 23,3% пациентов нуждались в дополнительном приеме НПВП против 73,3% в группе контроля, что, по–видимому, и повлияло на частоту случаев развития НПВП–гастропатии (как на случаи диспепсии, так и эрозивных поражений). Так, в группе больных, получавших АРТРА, данные поражения были выявлены лишь у 20% пациентов против 43,3% во второй группе, получавшей только НПВП.
Анализ субъективной оценки терапии пациентом в 1 группе продемонстрировал значительно большее количество пациентов, оценивших терапию как отличную и хорошую, в отличие от 2 группы, где в большинстве случаев пациенты оценили терапию как удовлетворительную и плохую (рис. 6).
Выводы
1. У пациентов с соматическими заболеваниями в 75,1% случаев выявляются болевые синдромы в крупных суставах, при этом в 59,2% случаев отмечаются рентгенологические признаки деформирующего остеоартроза коленных и тазобедренных суставов.
2. Пациенты с соматическими заболеваниями в 71,3% случаев принимают НПВП в связи с болевым синдромом в суставах, из них 56,9% – диклофенак натрия.
3. Прием хондропротекторов (препарат АРТРА) – уже через 3 месяца приводит к большему снижению балла функциональной недостаточности и регрессу болевого синдрома по сравнению с группой контроля, при этом скорость ходьбы 15 метров в группе пациентов, принимавших данный препарат, после терапии составила 29,7 сек. против 39,6 сек. у пациентов лишь с НПВП.
4. Через 9 месяцев по данным МРТ–исследования отмечен некоторый прирост высоты суставного хряща у пациентов, принимавших препарат АРТРА. У пациентов, принимавших НПВП, в ряде точек подсчета отмечена отрицательная динамика высоты суставного хряща.
5. В группе больных, получавших АРТРА и НПВП, НПВП–гастропатия выявлена у 20% пациентов против 43,3% во второй группе, леченных только НПВП.
6. Субъективная оценка терапии пациентами в 1 группе продемонстрировала значительно большее количество пациентов, оценивших терапию как отличную и хорошую.
Таким образом, включение хондропротективного препарата (АРТРА) в терапию пациентов с хроническими терапевтическими заболеваниями и деформирующим остеоартрозом позволяет быстрее добиться симптоматического (обезболивающего) эффекта и в некоторой степени улучшить состояние хрящевой ткани пораженного сустава (положительная динамика по данным МРТ). Кроме того, что немаловажно: терапия хондропротективными препаратами значительно повышает безопасность лечения – снижает риск развития эрозивно–язвенных поражений слизистой оболочки желудочно–кишечного тракта (это подтверждают данные ЭГДС), поскольку снижает потребность больных в применении НПВП.