Псориатический артрит (ПсА) – хроническое воспалительное заболевание суставов, ассоциированное с псориазом и обычно серонегативное по ревматоидному фактору [1]. Распространенность ПсА, по разным данным, составляет от 6 до 42% среди пациентов с псориазом [2,3]. Известно, что псориаз поражает 1–3% населения земного шара; следовательно, число пациентов, страдающих ПсА, сопоставимо с ревматоидным артритом (РА). Заболевание относят к группе серонегативных спондилоартропатий из–за ассоциации с HLA B27 антигеном, частого поражения осевого скелета и наличия энтезитов. Клиническая картина и течение ПсА могут варьировать от относительно доброкачественных моно–олигоартикулярных форм до генерализованного полиартрита, протекающего с внесуставными проявлениями и высокой воспалительной активностью и быстро приводящего к инвалидизации больных [29]. Известны несколько основных клинических вариантов ПсА, которые диагностируются в зависимости от преобладания того или иного симптомокомплекса у данного пациента [1]:
• С поражением дистальных межфаланговых суставов
• Моно–олигоартрит, характеризующийся асимметричным поражением не более 4 суставов
• Спондилоартритический
• Остеолитический, характеризуется различными типами костной резорбции, приводит к тяжелым деформациям суставов, в т.ч. к развитию мутилирующего артрита
• Полиартикулярный, протекающий с вовлечением большого числа суставов, асимметричный или симметричный (часто неотличимый от ревматоидного артрита (РА))
Нередко у одного больного имеется сочетание различных клинических форм ПсА. С течением болезни может происходить трансформация одного варианта заболевания в другой, например, моно–олигоартикулярного в полиартритический [4]. Другая особенность ПсА – характерное для заболеваний круга серонегативных спондилоартропатий вовлечение в патологический процесс периартикулярных тканей в виде энтезитов, теносиновитов и дактилита. При ПсА чаще, чем при неосложненном псориазе, наблюдается поражение ногтевых пластинок, причем тяжесть их поражения коррелирует с выраженностью псориаза и ПсА [5]. Рентгенологические черты, отличающие ПсА от РА и анкилозирующего спондилита (АС), следующие: формирование крупных эксцентрических костных эрозий, нередкое сочетание у одного пациента анкилоза сустава и периостита с резорбцией костной ткани, внутрисуставный остеолиз, ведущий к типичной для ПсА картине pencil–in–cup, акроостеолиз дистальных фаланг, асимметричный сакроилеит, парамаргинальные «перескакивающие» синдесмофиты, асимметричные паравертебральные оссификаты [6]. Долгое время не было общепринятых диагностических критериев для ПсА, что затрудняло проведение фундаментальных и клинических исследований при этом заболевании. В 2006 г. результатом деятельности международной группы исследователей CASPAR (СlASsification criteria for Psoriatic Arthritis) стала разработка новых диагностических критериев [7], в соответствии с которыми диагноз ПсА может быть установлен при наличии воспалительного заболевания суставов (периферических, осевого скелета или энтезисов) и не менее 3 признаков из следующих 5:
• наличие псориаза, псориаз в анамнезе или семейный анамнез псориаза
– наличие псориаза определяется как псориатическое поражение гладкой кожи или кожи волосистой части головы, подтвержденное дерматологом или ревматологом
– сведения о псориазе в анамнезе могут быть получены от пациента, семейного врача, дерматолога или ревматолога
– семейный анамнез псориаза определяется как наличие псориаза у родственников первой или второй степени родства (со слов пациента)
• типичное для псориаза поражение ногтевых пластинок, включающее онихолизис, «симптом наперстка» или гиперкератоз, зарегистрированное при физикальном обследовании
• отрицательный результат на наличие ревматоидного фактора с использованием любого метода, кроме латекс–теста (предпочтительнее ELISA или нефелометрия)
• дактилит в настоящее время, определяемый как припухание всего пальца, либо указания на дактилит в анамнезе, зарегистрированный ревматологом
• рентгенологическое подтверждение юкстаартикулярного образования костной ткани (оссификация около краев сустава), исключая формирование остеофитов, на рентгенограммах кистей и стоп
Специфичность критериев составляет 98,7%, чувствительность – 91,4%. Наличие псориаза при осмотре оценивается в 2 балла, все остальные признаки – в 1 балл.
Ранее ПсА рассматривался как заболевание с относительно благоприятным прогнозом, возможно, из–за меньшей болезненности суставов при ПсА по сравнению с РА [8], однако в последние годы эта точка зрения изменилась. По крайней мере у части пациентов наблюдается прогрессирующее течение заболевания, ведущее к появлению выраженных структурных изменений суставов и нарастанию функциональной недостаточности. Было показано, что ПсА сравним с РА по темпам прогрессирования, инвалидизации и ухудшения качества жизни пациентов [9,10]. В когорте из 180 пациентов с ПсА, изучавшейся Torre–Alonso и соавт. [11], 57% больных имели эрозивный артрит и 19% из них соответствовали III–IV классу функциональной недостаточности. В исследовании, посвященном раннему ПсА, было продемонстрировано, что в течение 2 лет от начала заболевания у 47% пациентов формируется по крайней мере одна эрозия [12]. В процессе 5–летнего проспективного наблюдения за 126 больными ПсА пропорция пациентов, имеющих как минимум 5 поврежденных суставов, удваивалась с 19% до 41%, несмотря на активное лечение и уменьшение количества воспаленных суставов [13]. Независимым клиническим предиктором прогрессирования заболевания считают полиартикулярное поражение в дебюте болезни [14,15]. Имеются данные о нарастании смертности у больных ПсА по сравнению с популяционной у лиц мужского пола на 66%, а у женщин на 59%. Риск преждевременной смерти выше у больных с высокой клинической и лабораторной активностью, наличием эрозий, большим количеством применявшихся лекарственных препаратов [16]. Таким образом, представляется обоснованным более раннее и агрессивное лечение пациентов, имеющих факторы риска прогрессирования болезни, с использованием болезнь–модифицирующих препаратов, целью которого является сохранение трудоспособности, увеличение продолжительности и качества жизни больных. Общность отдельных звеньев патогенеза ПсА и РА послужила обоснованием для применения традиционных базисных препаратов в лечении ПсА. Однако данные, подтверждающие их эффективность, ограничены. Контролируемые двойные слепые исследования низких доз перорального метотрексата, препаратов золота, азатиоприна, гидроксихлорохина показали их минимальную эффективность [17–22]; только сульфасалазин и высокие парентеральные дозы метотрексата продемонстрировали существенно большую эффективность, чем плацебо [23–25]. Исследования, в которых отслеживались отдаленные эффекты традиционных базисных препаратов на прогрессирование заболевания, не выявили существенной разницы между лечеными больными и контролем [26]. Лечение ПсА осложняется возможным неблагоприятным влиянием используемых препаратов на течение псориаза.
В последние годы достигнуты определенные успехи в изучении патогенеза ПсА, послужившие толчком к разработке новых терапевтических подходов. Они связаны с идентификацией уникального взаимодействия различных типов клеток иммунной системы, поверхностных клеточных маркеров и растворимых клеточных продуктов, вызывающих и поддерживающих процесс воспаления при ПсА. Одним из ключевых медиаторов в этом патогенетическом каскаде считается фактор некроза опухоли–a (ФНО–a), реализующий свои провоспалительные эффекты посредством разнообразных механизмов. Высвобождаясь преимущественно клетками моноцитарно–макрофагального ряда, ФНО–a индуцирует миграцию лимфоцитов в синовиальную оболочку, повышает экспрессию матриксных металлопротеиназ и секрецию других провоспалительных цитокинов (IL–1, IL–6, IL–8), потенцирует резорбцию кости остеокластами. Наиболее перспективным классом препаратов в терапии ПсА считаются биологические агенты, которые можно рассматривать как альтернативу традиционным базисным препаратам, лечение которыми зачастую бывает неэффективным и сопряжено с многочисленными побочными эффектами [34]. К первой группе биологических агентов относятся ингибиторы ФНО–a: этанерцепт, адалимумаб, инфликсимаб, лечебное действие которых обусловлено блокадой биологических эффектов ФНО–a. Другая группа препаратов, использование которых при ПсА представляется обоснованным и перспективным – это так называемые блокаторы костимуляции, или «второго сигнала», необходимого для активации Т–клеток: алефасепт, абатацепт, эфализумаб. Исследования по оценке их эффективности при псориазе и ПсА продолжаются. Широкое применение биологических агентов ограничено необходимостью парентерального введения и высокой стоимостью препаратов. Недостаточно данных относительно отдаленной безопасности биологических агентов, в частности, риска развития новообразований и инфекционных осложнений. Несмотря на достигнутые успехи в лечении ПсА, связанные с внедрением в практику биологических агентов, разработка простых в применении, эффективных и безопасных препаратов для лечения псориатического артрита сохраняет актуальность [56]. Псориаз и ПсА – воспалительные заболевания, обусловленные хронической Тh–1 активацией в результате презентации чужеродного антигена антигенпрезентирующими клетками. Стимулированные Т–лимфоциты активируют моноциты/макрофаги, которые, в свою очередь, продуцируют провоспалительные медиаторы, ответственные за развитие и прогрессирование заболевания. Понимание ключевой роли Т–лимфоцитов в патогенетическом каскаде при ПсА обусловило появление новых терапевтических мишеней, в частности, торможение Т–клеточной активации и пролиферации.
Лефлуномид (ЛФ) – селективный ингибитор de novo синтеза пиримидина, необходимого для активации и пролиферации Т–лимфоцитов, первоначально был создан для лечения РА, в патогенезе которого дисрегуляция Т–клеточного звена иммунитета играет важную роль. Быстроделящиеся Т–клетки нуждаются в восьмикратном увеличении пула пиримидиновых нуклеотидов [27,28], образующихся как внутриклеточно (синтез de novo), так и из поступающих из пищеварительного тракта предшественников. Лефлуномид и его активный метаболит А77 1726 в низких, терапевтически приемлемых дозах обратимо ингибируют фермент дигидрооротатдегидрогеназу, необходимую для синтеза пиримидинов de novo из уридинмонофосфата, тормозя пролиферацию аутореактивных Т–лимфоцитов. Биологические эффекты лефлуномида связаны с его уникальной способностью регулировать пролиферацию Т–клеток посредством торможения их синтеза в клеточном цикле [30]. В результате этого замедляется пролиферация аутореактивных Т–лимфоцитов и модифицируется Т–клеточный иммунный ответ. Противовоспалительный эффект А77 1726 связан с его способностью подавлять продукцию фактора некроза опухоли a и интерлейкина 1b посредством торможения межклеточных контактов между Т–лимфоцитами и моноцитами и снижать экспрессию COX–2 макрофагами [31,32]. А77 1726 нарушает процесс гликозилирования молекул адгезии, тормозя межклеточные контакты и замедляя миграцию клеток в очаг воспаления. А77 1726 подавляет ФНО–зависимую активацию нуклеолярного фактора kВ (NF–kB)–индуцибельного фактора транскрипции, играющего важную роль в регуляции иммунного и воспалительного ответа [33]. В течение последних 10 лет противовоспалительные и базисные свойства ЛФ, а также его удовлетворительная переносимость были доказаны в многочисленных клинических исследованиях у пациентов с РА как за рубежом, так и в России [35–42]. В 1998 г. он был одобрен FDA для лечения больных активным РА, причем с указанием, что препарат тормозит структурные повреждения, ассоциированные с РА. Сходство патогенеза РА и ПсА послужило обоснованием для его использования в качестве базисного препарата в лечении ПсА. Обнадеживающие результаты, полученные в небольших открытых исследованиях [43–45], стали предпосылкой для проведения двойного слепого многоцентрового исследования TOPAS (Treatment Оf Psoriatic Arthritis Study), доказавшего эффективность ЛФ по сравнению с плацебо как в отношении суставного синдрома, так и выраженности псориаза, и продемонстрировавшего приемлемый профиль безопасности препарата [46].
В марте 2005 г. ЛФ был одобрен в России для лечения ПсА. В настоящем сообщении мы представляем предварительные результаты применения ЛФ у больных активным ПсА.
Цели настоящего исследования:
– оценить эффективность лефлуномида, назначаемого в дозе 100 мг/сут. в течение 3 дней и 20 мг/сут. в течение 6 мес., у больных с активным псориатическим артритом, его переносимость, а также влияние ЛФ на выраженность псориаза
Параметры эффективности терапии: Psoriatic Arthritis Response Criteria (PsARC) , критерии улучшения ACR 20 (модифицированные для ПсА), HAQ, PASI, СОЭ, СР–Б
Критериями включения в исследование были:
1. Диагноз ПсА в соответствии с модифицированными критериями Bennet et al (см. приложение)
2. Мужчины и женщины от 18 до 70 лет включительно
3. Не менее 5 болезненных и 5 припухших суставов
4. Стабильная доза НПВП и ГК (<10 мг/сут. преднизолона или эквивалентная доза другого глюкокортикоидного препарата) на протяжении всего исследования и за 28 дней до начала лечения
5. Отсутствие базисной терапии в течение 28 дней до начала лечения.
Критериями исключения были:
1. Атипичные формы или прогрессирующее течение вульгарного Пс
2. Предшествующее применение ЛФ
3. Клинически значимые (по мнению исследователя) сопутствующие заболевания сердечно–сосудистой системы, почек, печени, желудочно–кишечного тракта, иммунологических и эндокринных расстройств, неврологических и психических заболеваний; злокачественные опухоли или лимфопролиферативные заболевания в анамнезе
4. Инфекционные заболевания (локальные или системные) в течение 3 мес. до начала лечения ЛФ; позитивность по ВИЧ, аНСV или HBsA
5. Нарушение функции печени или почек (АСТ, АЛТ, ГГТП, ЩФ, Сr>1,5 от ВГН, повышение уровня общего билирубина более 30 мкмоль/л ), нарушение функции кроветворения (Нв<100 г/л, Тр<100x109, Л<3,0x109) на скрининговом визите
Ограничениями, касавшимися сопутствующей терапии, были:
1. Системная терапия псориаза во время исследования или фототерапия псориаза в течение 3 мес. до включения в исследование
2. Внутрисуставное, периартикулярное или парентеральное введение ГК за 28 дней до начала лечения лефлуномидом и на протяжении всего исследования.
Материалы и методы
Настоящее исследование является открытым неконтролируемым 6–месячным исследованием IV фазы. Его проведение было одобрено независимым Комитетом по этике при ГУ ИР РАМН. Все пациенты, включенные в исследование, до начала проведения каких–либо процедур, связанных с участием в нем, подписали информированное согласие. Период набора длился с июня 2005 по октябрь 2006 г.
Пациенты
В предварительный анализ было включено 63 пациента, из них женщин – 39 (62%), мужчин – 24 (38%). 60 пациентов имели 2 (n=36, или 57%) и 3 (n=24, или 38%) степень активности болезни. Подавляющее большинство больных соответствовали I и II классу функциональной недостаточности по ACR. Краткая характеристика больных представлена в таблице 1.
У 10 (16%) больных длительность ПсА к моменту назначения ЛФ составила менее 3 лет, у 29 (46%) – от 3 до 10 лет, у 24 (38%) – 10 лет и более.
Большая часть пациентов (n=54, или 86%) до включения в исследование получала 1 или более болезнь–модифицирующих препаратов: метотрексат, сульфасалазин, тауредон, азатиоприн, циклоспорин А, аминохинолиновые производные; 43 больным проводилась терапия глюкокортикоидами (преимущественно в виде внутрисуставных инъекций), 3 пациента ранее лечились экстракорпоральными методами. 9 больных (14%) до включения в исследование принимали только НПВП. Большинство больных (n=42, или 67%) имели одно или более сопутствующих заболеваний, спектр которых в целом не отличался от пациентов общетерапевтической практики с преобладанием гипертонической болезни (n=23, или 36%), заболеваний желудочно–кишечного тракта (n=9, или 14%), мочекаменной болезни (n=6, или 10%).
Оценка активности ПсА
Оценка суставного синдрома включала:
– подсчет числа болезненных суставов (ЧБС) из 78 суставов – височно–нижнечелюстных, грудино–ключичных, ключично–акромиальных, плечевых, локтевых, лучезапястных, пястно–фаланговых, проксимальных межфаланговых рук и ног, дистальных межфаланговых рук и ног, тазобедренных, коленных, голеностопных, суставов предплюсны, таранно–пяточных, плюснефаланговых.
– оценка числа воспаленных суставов (ЧВС) из 76 суставов (исключены тазобедренные).
Боль в суставах и оценка активности ПсА больным и врачом проводились с помощью 100–мм визуальной аналоговой шкалы (ВАШ); кроме того, оценка активности ПсА пациентом и врачом осуществлялась с помощью 5–бальной шкалы Likert. Все показатели, отражающие активность ПсА, оценивались на каждом визите.
Влияние терапии лефлуномидом на функциональный статус пациентов проводилось с помощью опросника НАQ до лечения, через 3 и 6 мес. терапии [52,53].
Оценка эффективности терапии ПсА включает динамику показателей суставного и кожного синдрома.
Основной критерий эффективности суставного синдрома в данном исследовании– ответ по PsARC (Psoriatic Arthritis Response Criteria) [47])
Оцениваются следующие показатели:
1. Число болезненных суставов (из 78)
2. Число припухших суставов (из 76)
3. Общая оценка пациентом активности болезни по Likert
4. Общая оценка врачом активности болезни по Likert
Для того, чтобы пациент соответствовал понятию «ответчика» по PsARC, улучшение должно быть достигнуто по крайней мере по 2 из 4 показателей, причем один из них– ЧБС или ЧВС, при этом число болезненных и припухших суставов должно уменьшиться по крайней мере на 30%, оценка активности болезни врачом и больным должна уменьшиться не менее чем на 1 единицу по 5–бальной шкале Likert; не должно быть ухудшения ни по одному из 4 показателей.
Критерий эффективности по ACR 20, модифицированный для псориатического артрита [48] – это комплексный показатель, отражающий 20% улучшение как по количеству болезненных (из 78 ) и припухших (из 76) суставов, так и по трем из пяти следующих параметров: оценке активности болезни по ВАШ врачом, пациентом, оценке пациентом болевого синдрома (по ВАШ), показателю функциональной способности по опроснику HAQ и острофазовым показателям (СОЭ по Westergren или СР–Б).
Уровень СР–Б сыворотки определялся в лаборатории клинических исследований ИР РАМН высокочувствительным методом.
Оценка кожного синдрома производилась в начале лечения, после 3 и 6 мес. терапии с помощью цифровой оценочной шкалы, пронумерованной от 0 до 10 (шкала зуда), общей оценки врачом активности псориаза по 5–бальной шкале Likert и PASI (Psoriasis Area and Severity Index). PASI оценивался у больных с площадью поражения тела не менее 3%; при оценке площади поражения тела (BSA, Body Surfaсe Area) предполагается, что площадь ладони больного приблизительно соответствует 1% площади его тела. PASI – комплексный индекс, оценивающий тяжесть и распространенность псориаза [49]. Метод традиционно используется в клинических исследованиях с целью оценки эффективности терапии псориаза. Клинически значимыми конечными точками считаются 75% и 50% улучшение PASI [50]. Выраженность симптомов (эритема, инфильтрация, шелушение) оценивается в баллах от 0 (симптом отсутствует) до 4 (очень выражено) и суммируется; площадь поражения каждой части тела (голова, туловище, верхние и нижние конечности) перемножается на соответствующий индекс; сумма значений в каждой из 4 колонок и определяет значение PASI. Минимальное значение индекса составляет 0 баллов, максимальное – 72 балла.
Влияние поражения кожи на повседневную деятельность пациентов оценивалось с помощью опросника DLQI (Dermatology Life Quality Index), включающего10 вопросов, которые отражают наиболее общие аспекты изменения качества жизни при кожных заболеваниях [51]. Каждый вопрос анкеты предполагает один из четырех вариантов ответов: «нет», «немного», «умеренно», «очень сильно», оцениваемых в баллах: 0, 1, 2, 3 соответственно. Ответ «неактуально»также оценивается в 0 баллов. Сумма всех баллов определяет значение DQLI. Наибольший возможный балл [30] соответствует максимальному ухудшению качества жизни.
Оценка безопасности терапии
Безопасность лечения оценивалась с помощью физикального обследования, показателей жизнедеятельности, клинического и биохимического анализов крови. общего анализа мочи и мониторинга нежелательных явлений (НЯ), проводившихся на каждом визите.
Анализ эффективности лечения проводился в соответствии с наихудшим сценарием: у пациентов, не закончивших исследование, использовалась процедура переноса вперед последнего значения признаков, полученных при преждевременном выбывании (last observation carried forward); таким образом, у выбывших преждевременно больных значения показателей, полученные на визите досрочного выбывания, регистрировались для всех несостоявшихся визитов.
Статистическая обработка результатов проводилась с использованием пакета прикладных программ STATISTICA 6.0 фирмы StatSoft. Применялись методы описательной статистики; для сравнения параметров эффективности с исходным уровнем использовался критерий Вилкоксона для парных сравнений. Различия показателей считались статистически значимыми при р<0,05.
Результаты и обсуждение
Все 63 пациента, включенных в анализ, принимали ЛФ как минимум 1 месяц. 40 (63%) больных полностью завершили 6–месячный курс лечения в соответствии с протоколом исследования. 22 больных (35%) досрочно прекратили участие в исследовании по следующим причинам: из–за развития нежелательных явлений – 13 человек (20%), в связи с неэффективностью лечения – 3 человека (5%), по административным причинам – 1 (2%), из–за нарушения протокола – 1 (2%), отказались от дальнейшего участия в исследовании 4 человека (6%). Из анализируемой группы продолжает лечение лефлуномидом 1 человек (2%).
На рисунке 1 представлена ежемесячная динамика числа болезненных (ЧБС) и воспаленных (ЧВС) суставов.
Изменения ЧБС, ЧВС, уровня боли и активности ПсА по ВАШ, оценивавшейся больным и врачом, представлены в таблице 2.
Следует отметить быстроту наступления эффекта ЛФ: статистически значимым было уменьшение уровней всех параметров уже после первого месяца лечения (р<0,001). Начиная с второго и третьего месяцев приема ЛФ боль и оценка активности болезни больным не претерпевали существенной динамики до конца исследования (р=0,41 и р=0,104 соответственно). К концу наблюдения отмечено снижение боли в суставах на 31%, оценки активности болезни больным – на 33%, оценки активности болезни врачом – на 38% по сравнению с исходными значениями.
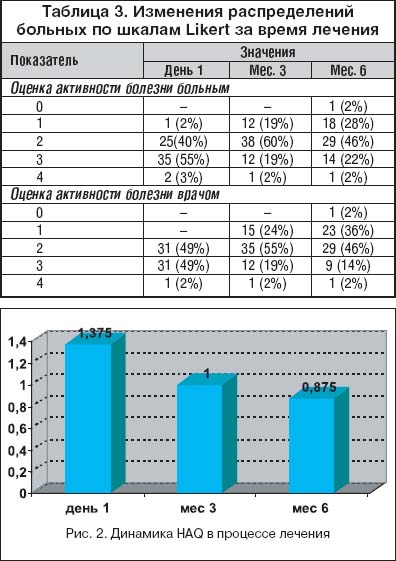
В таблице 3 представлено изменение соотношений числа пациентов в соответствии со степенью активности по шкале Likert в начале лечения, через 3 и 6 месяцев.
При анализе динамики активности болезни по 5–бальной шкале Likert в начале лечения и после 6 мес. терапии лефлуномидом также отмечено статистически значимое улучшение (p<0,001).
Оценка функциональной недостаточности проводилась в начале лечения, через 3 и 6 мес. терапии. На рисунке 2 представлена динамика HAQ. Выявлено статистически значимое уменьшение индекса HAQ к 3 месяцу лечения, которое сохранялось до конца исследования (p<0,001). К 6 месяцу лечения среднее значение индекса снизилось на 36% от исходного.
Клинически значимым для ПсА считается уменьшение значения индекса на 0,3 [54]. У 30 (48%) пациентов к 6 месяцу лечения достигнуто клинически значимое уменьшение HAQ.
Основным параметром эффективности лечения в настоящем исследовании был PsARC (Psoriatic Arthritis Response Criteria). К концу лечения «ответчиками» в соответствии с PsARC стали 36 из 62 больных (58%). Другим критерием эффективности терапии была пропорция пациентов, достигших к 6 месяцу лечения улучшения в соответствии с ACR 20; она составила 55% (34 пациента из 62). 1 пациент к моменту анализа данных не закончил 6–месячный курс лечения, однако при оценке эффективности терапии на 5 месяце лечения он достиг улучшения и по критериям ACR 20, и по PsARC.
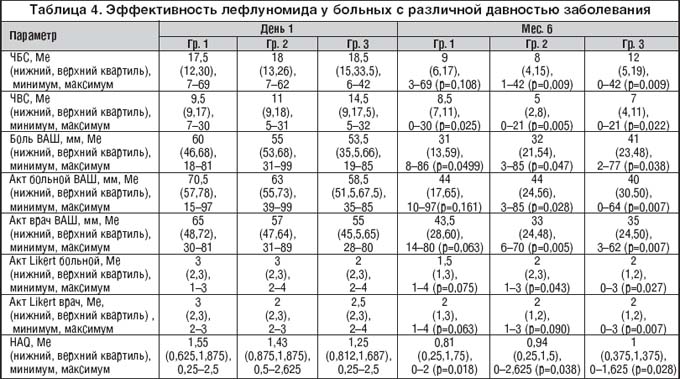
Представляется важным с практической точки зрения оценить эффективность ЛФ у больных с различной давностью заболевания (табл. 4). Исходя из этого, нами были проанализированы группы пациентов с длительностью ПсА менее 3 лет (группа 1, n=10), от 3 до 10 лет (группа 2, n=29) и 10 лет и более (группа 3, n=24). Сравнивались параметры суставного синдрома в начале и через 6 месяцев лечения, а также число и процент больных каждой группы, достигших улучшения по PsARC и ACR20.
Как видно из представленных данных, в группах больных с большой длительностью заболевания (более 3 лет) изменения практически всех показателей активности ПсА в начале и в конце лечения были статистически значимыми, тогда как для пациентов с длительностью ПсА менее 3 лет положительная динамика наблюдалась только для числа воспаленных суставов и индекса HAQ. Пропорция «ответчиков» по PsARC и ACR 20 между группами существенно не отличалась: в первой группе 5 (50%) больных достигли улучшения по обоим критериям, во второй группе – 18 (62%) «ответчиков» по PsARC и 15 (52%) – по ACR 20, в третьей группе –13 (56%) и 14 больных (60%) соответственно. Анализ влияния длительности ревматоидного артрита на эффективность терапии ЛФ показал, что его эффективность при «раннем» (длительность менее 2 лет) и «позднем» РА (длительность более 2 лет) существенно не отличалась [55], тогда как по другим данным [34] лучший эффект препарата отмечен при небольшой длительности РА.
Параллельно оценивалось влияние терапии ЛФ на кожный синдром. Показатели активности псориаза на протяжении исследования представлены в таблице 5.
У больных с площадью поражения кожи не менее 3% проводился подсчет PASI (Psoriasis Area and Severity Index). У 6 больных (10%) отмечено нарастание PASI к моменту окончания лечения, 5 пациентов (8%) достигли 50% улучшения индекса, трое (5%) – 75% улучшения (PASI 50 и PASI 75 считаются клинически значимыми конечными точками при оценке индекса). Несмотря на улучшение показателей шкалы зуда и DLQI, снижения PASI к концу лечения не отмечено. Уменьшение числа больных с BSA>3% к 6 месяцу терапии наблюдалось, но было статистически незначимо (р=0,108)
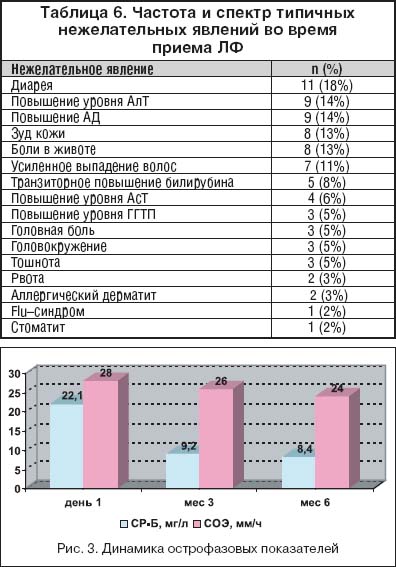
Не отмечено влияния ЛФ на СОЭ (р=0,371). Уровень СР–Б определялся до начала лечения, через 3 и 6 месяцев терапии (оценивались больные, получавшие ЛФ не менее 3 месяцев). Медиана исходного значения показателя составила 22,1 мг/л, через 3 месяца лечения – 9,2 мг/л, к окончанию исследования – 8,9 мг/л. Статистически значимое уменьшение уровня СР–Б отмечено к 3–му месяцу лечения (р<0,001) и к окончанию исследования существенно не менялось.
Изменения уровня СР–Б сыворотки и СОЭ во время лечения ЛФ отражены на рисунке 3.
Переносимость лечения лефлуномидом в целом можно расценить как удовлетворительную. Частота и спектр нежелательных явлений (НЯ), зарегистрированных во время лечения, существенно не отличались от побочных эффектов ЛФ, описанных ранее. НЯ во время лечения ЛФ были зарегистрированы у 46 больных. В таблице 6 представлены НЯ, обозначенные в инструкции по применению препарата как типичные (встречающиеся у 1–10% больных).
У трех больных (5%) отмечено снижение уровня гемоглобина к концу исследования до 94–96 г/л. У 8 больных (13%) зарегистрированы ОРВИ, тяжесть и характер течения которых не отличались от респираторных инфекций в анамнезе. НЯ как причина преждевременного прекращения приема ЛФ были зафиксированы у 13 больных (21%). В 2 случаях у пациентов развился аллергический дерматит, у 2 больных – диспепсия: рвота (n=1) и диарея (n=1). У одной больной развился фурункулез, у одного пациента – тяжелое обострение псориаза, сопровождавшееся изъязвлением бляшек и присоединением вторичной инфекции. Повышение более чем в 2 раза уровня печеночных ферментов сыворотки было причиной отмены ЛФ у 2 больных. Еще в 3 случаях причиной отмены ЛФ послужило обострение псориаза (n=1), усиленное выпадение волос (n=1) и выраженные оссалгии (n=1). В 2 случаях НЯ, послужившие причиной для прекращения приема ЛФ, не были связаны, по мнению исследователей, с приемом препарата. Во всех случаях повышения АД (n=9) тяжесть симптомов была расценена как легкая или средней тяжести, отмены или перерыва в приеме ЛФ не потребовалось. В 12 случаях НЯ требовался перерыв в приеме ЛФ, в трех–временное уменьшение дозы препарата. Тяжесть НЯ преимущественно расценивалась как легкая; НЯ средней степени тяжести отмечены в 28 случаях; тяжелые НЯ – в 4 случаях; серьезных нежелательных явлений зарегистрировано не было. Не отмечено случаев тяжелых гематологических нарушений, нефротоксичности ЛФ.
При сравнении результатов, полученных в нашем исследовании, с данными TOPAS, можно отметить совпадение пропорции больных, достигших улучшения по PsARC к окончанию лечения (58% и 58,9% соответственно). Пациентов, соответствующих критериям улучшения по ACR 20, оказалось больше среди наших пациентов (55% и 36%). Анализ динамики PASI не выявил положительного влияния ЛФ на тяжесть и распространенность псориаза, тогда как по результатам исследования TOPAS отмечен положительный эффект ЛФ на поражение кожи (PASI 50 достигнуто у 30,4% больных в группе, получавшей ЛФ). В нашем исследовании обострение псориаза во время лечения ЛФ зафиксировано у 14 больных (22%).
Заключение
В результате проведенного исследования было показано, что лефлуномид обладает отчетливым симптом–модифицирующим действием в отношении суставного синдрома у больных с полиартикулярной формой ПсА. К концу 6 месяца лечения наблюдалось существенное уменьшение числа болезненных и воспаленных суставов, а также показателей боли и активности болезни по ВАШ и шкалам Likert. Следует отметить положительное влияние препарата на степень функциональной недостаточности: уменьшение HAQ к 6 месяцу лечения было статистически значимым, а клинически значимое уменьшение индекса отмечено у 48% больных. Терапия лефлуномидом не оказала существенного эффекта на кожный синдром по PASI , тогда как положительная динамика по DLQI и шкале зуда была достоверной. Возможно, недостаточный лечебный эффект ЛФ в отношении псориаза связан с выраженной сезонностью обострений дерматоза и влиянием экзогенных факторов на его течение. На фоне лечения ЛФ выявлено снижение уровня СР–Б сыворотки, оказавшееся статистически значимым уже к третьему месяцу лечения. Интересным представляется то, что эффективность ЛФ у пациентов с большой продолжительностью заболевания оказалась выше, чем в группе больных с давностью ПсА менее 3 лет.
Переносимость лефлуномида можно расценить как удовлетворительную. Спектр нежелательных явлений, отмеченных в анализируемой группе пациентов, в целом не отличался от описанных ранее. Не было зарегистрировано случаев тяжелой гепато–, нефро– и миелотоксичности, нарастания частоты инфекционных осложнений, ухудшения течения сопутствующих заболеваний.
Результаты настоящего исследования позволяют рассматривать лефлуномид как высокоэффективный препарат для лечения активного ПсА, обладающий удовлетворительной переносимостью. Перспективы дальнейшего применения ЛФ в комплексной терапии ПсА связаны с его потенциальными возможностями замедлять прогрессирование заболевания и уточнением его влияния на течение псориаза.




Литература
1. J.M.H. Moll, V.Wright Psoriatic arthritis. Semin Arthritis Rheum V3;1:55–78
2. Shbeeb M, Uramoto KM,Gibson LE,O?Fallon WM,Gabriel SE.The epidemiology of psoriatic arthritis in Olmsted County,Minnesota,USA,1982–1991. J.Rheumatol 2000;27:1247–50
3. Alenius GM, Stenberg B, Stenlund H et al. Inflammatory joint manifestations are prevalent in psoriasis. J Rheumatol 2002;29:2577–82.
4. Gladman DD, Antoni C,Mease P, Clegg DO,Nash P Psoriatic arthritis: clinical features,course, and outcome Ann Rheum Dis 2005;64(suppl II),ii14–ii17
5. Williamson L, Dalbeth N, Dockerty JL, Gee BC, Weatherall R, Wordsworth BP. Extended report: nail disease in psoriatic arthritis––clinically important, potentially treatable and often overlooked. Rheumatology (Oxford). 2004 Jun;43(6):690–1.
6. Ory P A, Gladman DD, Mease P J Psoriatic arthritis and imaging Ann Rheum Dis 2005;64(suppl II),ii55–ii57
7. Taylor W,Gladman D,Helliwell P,Marchesoni A, Mease P, Mielants H, and the CASPAR Study Group Development of New Criteria From a Large International Study. Arthr Rheum 2006;54(8):2665–2673
8. Buskila D,Langevitz P,Gladman DD,Urovitz S,Smythe HA Patients with rheumatoid arthritis are more tender than those with psoriatic arthritis. J Rheumatol 1992;19:1115–1119
9. Rahman P,Nguyen E,Cheung C, Schentag CT, Gladman DD Comparison of radiological severity in psoriatic arthritis and rheumatoid arthritis J. Rheumatol. 2001; 28: 1041–4
10. Sokoll KB, Helliwell PS Comparison of disability and quality of life in rheumatoid arthritis and psoriatic arthritis J. Rheumatol. 2001; 28:1842–6
11. Torre–Alonso JC, Rodriguez Perez A,Aribass Castrillo JM,Ballina Garcia J, Rictra Noriega JL,Lopez Larrea C Psoriatic arthritis: a clinical, immunological and radiological study of 180 patients. Br.J.Rheumatol 1991;30:245–50
12. Kane D, Stafford L, Bresnihan B, FitzGerald O. A prospective, clinical and radiological study of early psoriatic arthritis: an early synovitis clinic experience.Rheumatology (Oxford) 2003;42:1460–8
13. Gladman DD, Stafford–Brady F,Chang CH, Lewandowski K,Russel ML Longitudinal study of clinical and radiological progression in psoriatic arthritis. J.Rheumatol 1990;17:809–12
14. Gladman DD,Farevell VT Progression in psoriatic arthritis:role of time varying clinical indicators. J. Rheumatol 1999;26:2409–13
15. Queiro–Silva R, Torre–Alonso JC, Tinture–Eguren T, Lopez–Lagunas I A poliarticular oncet predicts erosive and deforming disease in psoriatic arthritis. Ann Rheum Dis 2003;62:68–70
16. Gladman DD,Farevell VT, Wong K, Husted J Mortality studies in psoriatic arthritis.results from a single outpatient center.II. Prognostic indicators for death. Arthritis Rheum 1998;41(6):1103–1110
17. Gladman DD, Blake R, Brubacher B, Farewell VT Chloroquine therapy in psoriatic arthritis. J. Rheumatol. 1992; 19:1724–6
18. Mader R, Gladman DD, Long J, Gough J, Farewell VT Does injectable gold retard radiologic evidence of joint damage in psoriatic arthritis? Clin. Invest. Med. 1995; 18:139–43
19. Abu–Shakra M, Gladman DD, Thorne JC, Long J, Gough J, Farewell VT Longterm methotrexate therapy in in psoriatic arthritis: clinical and radiological outcome. J. Rheumatol. 1995; 22:241–5
20. Willkens RF, Williams HJ, Ward JR et al. Randomized, double–blind, placebo controlled trial of low–dose pulse methotrexate in psoriatic arthritis. Arthritis Rheum 1984;27:376–81.
21. Palit J, Hill J, Capell HA et al. A multicentre double–blind comparison of auranofin, intramuscular gold thiomalate and placebo in patients with psoriatic arthritis. Br J Rheumatol 1990;29:280–3.
22. Salvarani C, Macchioni P, Boiardi L et al. Low dose cyclosporine A in psoriatic arthritis: Relation between soluble interleukin 2 receptors and response to therapy. J Rheumatol 1992;19:74–9
23. Jones G, Crotty M, Brooks P, Interventions for treating psoriatic arthritis (Cochran Review). In: The Cochran Library, issue 3, Oxford, Update Software 2001; 1–18
24. Gupta AK, Grober JS, Hamilton TA, Ellis CN et al. Sulfasalasine therapy for psoriatic arthritis: a double blind,placebo controlled trial. J Rheumatol 1995; 22:894–8
25. Farr M, Kitas GD, Waterhouse L, Jubb R et al. Sulfasalasine in psoriatic arthritis: a double– blind,placebo –controlled study.Br J Rheumatol 1990;29:1427–34
26. Abu–Shakra M, Gladman DD, Thorne JC, Long J, Gough J, Farewell VT Longterm methotrexate therapy in in psoriatic arthritis: clinical and radiological outcome. J. Rheumatol. 1995; 22:241
27. Fairbanks LD,Bofil M, Ruckemann K,Simmonds HA Importance of ribonucleotide availability to proliferating T–lymphocytes from healthy humans. J Biol Chem 1995;270:29682–91
28. Breedveld FC,Dayer J–M Leflunomide–mode of action in the treatment of rheumatoid arthritis Ann rheum Dis 2000;59:841–849
29. В.В. Бадокин Современная терапия псориатического артрита, Consilium Medicum, 2005, Т.7, №3.
30. Herrmann M,Frangou CG, Kirschbaum B Cell cycle control of the de novo pyrimidine synthesis Inhibitor leflunomide through the p53 and p21 WAF–1 pathways.(Association of Rheumatology Health Professionals 32nd National Scientific Meeting; 8–12 Nov 1997)
31. M C Kraan, R J Reece, E C Barg, T J M Smeets, J Farnell, R Rosenburg, D J Veale, F C Breedveld, P Emery, P P Tak Modulation of inflammation and metalloproteinase expression in synovial tissue by leflunomide and methotrexate in patients with active rheumatoid arthritis Arthritis Rheum 2000; 43:1820–183
32. M Cutolo, A Sulli, P Ghiorzo et al Anti–inflammatory effects of leflunomide on cultured synovial macrophages from patients with rheumatoid arthritis. Ann Rheum Dis 2003;62:297–302
33. Chen F, Castranova V, Shi X, Demers LM. New insights into the role of nucleolar factor–?B,a ubiquitous transcription factor in the initiation of diseases. Clin Chem 1999;45:7–17
34. Е.Л.Насонов Инфликсимаб при спондилоартропатиях и псориатическом артрите: новые показания. РМЖ том 13, № 8(232),2005
35. Чичасова Н.В., Чижова К.А., Иголкина Е.В., Имаметдинова Г.Р., Насонов Е.Л. Новый базисный препарат для лечения ревматоидного артрита–Арава (лефлуномид): опыт многомесячного применения. РМЖ том 12, №2,2004
36. Чичасова Н.В., Иголкина Е.В., Бродецкая К.А., Имаметдинова Г.Р. Опыт длительного лечения активного ревматоидного артрита лефлуномидом. Терапевтический архив, 2005, № 5,с.33–38
37. Балабанова Р.М., Маколкин В.И., Шостак Н.А. и соавт. Динамика показателей воспалительной активности у больных ревматоидным артритом на ранних этапах базисной терапии лефлуномидом. Терапевт архив 2004; 5; 28–32
38. Mladenovic V,Domljan Z,Rozman B,et al Safety and effectiveness of leflunomide in the treatment of patients with active rheumatoid arthritis.Arthritis Rheum 1995;38:1595–603
39. Strand V,Cohen S, Schiff M,et al. Treatment of active rheumatoid arthritis with leflunomide compared with placebo and methotrexate.Arch Intern Med 1999;159;2542–50
40. Smolen JS,Kalden JR,Scott DL,et al. Efficacy and safety of leflunomide compared with placebo and sulfasalazine in active rheumatoid arthritis: a double–blind, randomized,multicentre trial. Lancet 1999;353:259–66
41. Emery P, Breedveld FC, Lemmel EM,et al. A comparison of the efficacy and safety of leflunomide and methotrexate for the treatment of rheumatoid arthritis.Rheumatology 2000;39:655–65
42. Scott DL,Smolen JS,Kalden JR,et al Treatment of active rheumatoid arthritis with leflunomide:two year follow–up of a double–blind,placebo controlled trial versus sulfasalazine. Ann Rheum Dis 2001;60:913–23
43. Liang GC, Barr WG Long term follow–up of the use of leflunomide in recalcitrant psoriatic arthritis and psoriasis [Abstract].Arthritis Rheum 2001;44(9Suppl):S121
44. Scarpa R,Manguso F,Orient A,Peluso R,Oriente P Leflunomide in psoriatic polyarthritis.An Italian pilot study [Abstract].Arthritis Rheum 2001;44(9Suppl):S92
45. Liang GC, Barr WG Open trial of Leflunomide for Refractory Psoriasis and Psoriatic Arthritis J Clin Rheum 2001; 6:366–370
46. Kaltwasser JP, Nash P, Gladman D, et al. Efficacy and safety of leflunomide in the treatment of psoriatic arthritis and psoriasis. Arthritis Rheum 2004; 50(6):1939–50
47. Clegg DO,Reda DJ,Mejias E,Cannon GW,Weisman MH,Taylor T,et al. Comparison of sulfasalasine and placebo in the treatment of psoriatic arthritis: a Department of Veterans Affairs cooperative study.Arthritis Rheum 1996;39:2013–20
48. Mease PJ, Goffe BS, Metz J, VanderStoep A, Finck B, Burge DJ. Etanercept in the treatment of psoriatic arthritis and psoriasis: a randomized trial. Lancet 2000; 356:385–90
49. Fredriksson T,Pettersson U.Severe psoriasis–oral therapy with a new retinoid/Dermatologica 1978;157:238–44
50. Сarlin CS,Feldman SR,Krueger JG,Menter A, Krueger GG.A 50% reduction in the Psoriasis Area and Severity Score (PASI 50) is a clinically significant endpoint in the assessment of psoriasis. J Am Acad Dermatol 2004;50:859–6
51. Finlay AY,Rhan GK. Dermatology Life Quality Index (DLQI)–a simple practical measure for routine clinical use. Clin Exp Dermatol 1994;19:210–16
52. Fries JF, Spitz P, Kraines RG et al. Measurment of patient outcome in arthritis. Arthritis Rheum 1980;23:137–45
53. Bruce B, Fries JF. The Health Assessment Questionnaire (HAQ). Clin Exp Rheumatol 2005; 23(Suppl 39):S14–S18
54. Mease PJ,Ganguly R, Wanke L,Yu E, Singh A How much improvement in functional status is considered important by patients with active psoriatic arthritis:applying the outcome measures in rheumatoid arthritis clinical trials [OMERACT] group guidelines [abstract] Ann Rheum Dis 2004;63 (suppl 1):39
55. Scott DL, Schattenkichner M, Smolen JS, et al. Efficacy of leflunomide in patients placebo, versus SSA in RA. Effect of disease duration. Arthritis Rheum 1998; 41: Suppl: S1551
56. Е.Л.Насонов, Н.В.Чичасова, К.А.Чижова Перспективы применения лефлуномида в ревматологии.РМЖ том 12, №20(220),2004, стр 1147–1151












