–°–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ —Ж–µ–ї–Є –ї–µ—З–µ–љ–Є—П –Љ–љ–Њ–≥–Њ–≥—А–∞–љ–љ—Л –Є –Ј–∞–Ї–ї—О—З–∞—О—В—Б—П –≤ –і–Њ—Б—В–Є–ґ–µ–љ–Є–Є –Ї–ї–Є–љ–Є–Ї–Њ––ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–є —А–µ–Љ–Є—Б—Б–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є–Є –њ–Њ—А–∞–ґ–µ–љ–Є—П –ґ–Є–Ј–љ–µ–љ–љ–Њ –≤–∞–ґ–љ—Л—Е –Њ—А–≥–∞–љ–Њ–≤ (–≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М –њ–Њ—З–µ–Ї –Є —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л), —Б–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ–Њ–Љ –≤—Л—П–≤–ї–µ–љ–Є–Є –Є –Ї–Њ–љ—В—А–Њ–ї–µ —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є, –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Є —Г–ї—Г—З—И–µ–љ–Є–Є –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є [4].
–° –Љ–Њ–Љ–µ–љ—В–∞ –≤—Л–і–µ–ї–µ–љ–Є—П –°–Ъ–Т –Ї–∞–Ї —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ–є –љ–Њ–Ј–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –µ–і–Є–љ–Є—Ж—Л –Є –і–Њ –љ–∞—Б—В–Њ—П—Й–µ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –Њ—Б–љ–Њ–≤—Г –ї–µ—З–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е —Б–Њ—Б—В–∞–≤–ї—П—О—В –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і—Л (–У–Ъ), —Н—Д—Д–µ–Ї—В –Ї–Њ—В–Њ—А—Л—Е –љ–∞—Б—В—Г–њ–∞–µ—В –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є —Б—А–∞–Ј—Г –њ–Њ—Б–ї–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П. –Ь–љ–Њ–≥–Њ–ї–µ—В–љ–Є–µ –љ–∞–±–ї—О–і–µ–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –У–Ъ —П–≤–ї—П—О—В—Б—П –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –≤—Л–±–Њ—А–∞ –њ—А–Є –≤—Б–µ—Е –≤–∞—А–Є–∞–љ—В–∞—Е –°–Ъ–Т, –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В –і–∞–≤–љ–Њ—Б—В–Є –Є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –±–Њ–ї–µ–Ј–љ–Є. –Ґ–µ—А–∞–њ–Є—П –У–Ъ —Б–Њ–≤–µ—А—И–µ–љ—Б—В–≤–Њ–≤–∞–ї–∞—Б—М –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є —А—П–і–∞ –ї–µ—В: –Љ–Њ–і–Є—Д–Є—Ж–Є—А–Њ–≤–∞–ї–Є—Б—М –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ —Д–Њ—А–Љ—Л, —А–∞–Ј—А–∞–±–Њ—В–∞–љ—Л —Б—В–∞–љ–і–∞—А—В—Л –љ–∞–Ј–љ–∞—З–µ–љ–Є—П —А–∞–Ј–ї–Є—З–љ—Л—Е –і–Њ–Ј –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б —В–Њ–њ–Є–Ї–Њ–є –Є —В—П–ґ–µ—Б—В—М—О –≤–Є—Б—Ж–µ—А–∞–ї—М–љ–Њ–≥–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П. –Ф–ї–Є—В–µ–ї—М–љ—Л–є —Н–Љ–њ–Є—А–Є—З–µ—Б–Ї–Є–є –Њ–њ—Л—В —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Њ–≤ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В, —З—В–Њ –У–Ъ —Б–ї–µ–і—Г–µ—В –і–∞–≤–∞—В—М –±–Њ–ї—М–љ—Л–Љ –°–Ъ–Т –≤ —В–µ—З–µ–љ–Є–µ –Љ–љ–Њ–≥–Є—Е –ї–µ—В, –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –њ–Њ–ґ–Є–Ј–љ–µ–љ–љ–Њ, –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ –њ–µ—А–µ—Е–Њ–і—П —Б –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј –≤ —Д–∞–Ј—Г –≤—Л—Б–Њ–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –і–Њ –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–Є—Е –њ—А–Є —Б—В–∞–±–Є–ї—М–љ–Њ–Љ —Б–Њ—Б—В–Њ—П–љ–Є–Є, —Б–Њ—Е—А–∞–љ—П—П –Љ–Є–љ–Є–Љ–∞–ї—М–љ—Л–µ –і–Њ–Ј—Л –і–∞–ґ–µ –≤ –њ–µ—А–Є–Њ–і —Б—В–Њ–є–Ї–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —А–µ–Љ–Є—Б—Б–Є–Є [67].
–С–Њ–ї—М–љ—Л–Љ –°–Ъ–Т —Б –љ–Є–Ј–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –љ–∞–Ј–љ–∞—З–∞—О—В –љ–µ–±–Њ–ї—М—И–Є–µ –і–Њ–Ј—Л –У–Ъ (–њ—А–µ–і–љ–Є–Ј–Њ–ї–Њ–љ < 10 –Љ–≥/—Б—Г—В.), —Б —Г–Љ–µ—А–µ–љ–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О – —Б—А–µ–і–љ–Є–µ –і–Њ–Ј—Л (20–40 –Љ–≥/—Б—Г—В.). –Я—А–Є –љ–∞–ї–Є—З–Є–Є —В—П–ґ–µ–ї–Њ–є –Њ—А–≥–∞–љ–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є – –і–Є—Д—Д—Г–Ј–љ–Њ–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–Є —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л (–¶–Э–°), –≤–Њ–ї—З–∞–љ–Њ—З–љ–Њ–Љ –љ–µ—Д—А–Є—В–µ, –≥–µ–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є (—В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–Є, –≥–µ–Љ–Њ–ї–Є—В–Є—З–µ—Б–Ї–Њ–є –∞–љ–µ–Љ–Є–Є), –≥–µ–љ–µ—А–∞–ї–Є–Ј–Њ–≤–∞–љ–љ–Њ–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–Є –Ї–Њ–ґ–Є – –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–µ –і–Њ–Ј—Л –У–Ъ – > 40 –Љ–≥/—Б—Г—В. –Ф–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –Є–љ–Є—Ж–Є–Є—А—Г—О—Й–µ–є –У–Ъ–—В–µ—А–∞–њ–Є–Є –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –і–Њ—Б—В–Є–ґ–µ–љ–Є—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –Ї–Њ–ї–µ–±–ї–µ—В—Б—П –Њ—В 4 –і–Њ 12 –љ–µ–і. –°–љ–Є–ґ–µ–љ–Є–µ –і–Њ–Ј—Л —Б–ї–µ–і—Г–µ—В –њ—А–Њ–≤–Њ–і–Є—В—М –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ, –њ–Њ–і —В—Й–∞—В–µ–ї—М–љ—Л–Љ –Ї–ї–Є–љ–Є–Ї–Њ––ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–Љ –Ї–Њ–љ—В—А–Њ–ї–µ–Љ, –∞ –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–Є–µ –і–Њ–Ј—Л (5–10 –Љ–≥/—Б—Г—В.) —Б–ї–µ–і—Г–µ—В –њ—А–Є–љ–Є–Љ–∞—В—М –і–ї–Є—В–µ–ї—М–љ–Њ [4,68].
–Т 2007 –≥. —А–∞–±–Њ—З–µ–є –≥—А—Г–њ–њ–Њ–є EULAR —Б—Д–Њ—А–Љ—Г–ї–Є—А–Њ–≤–∞–љ—Л –Њ—Б–љ–Њ–≤–љ—Л–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ –ї—Г—З—И–µ–Љ—Г –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—О –У–Ъ –њ—А–Є —А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е: —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–µ –і–Њ–Ј –Є –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є —В–µ—А–∞–њ–Є–Є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, —А–µ–≥—Г–ї—П—А–љ–∞—П –Њ—Ж–µ–љ–Ї–∞ –∞–і–µ–Ї–≤–∞—В–љ–Њ—Б—В–Є –і–Њ–Ј–Є—А–Њ–≤–Њ–Ї, –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –У–Ъ –Ї–Њ—А–Њ—В–Ї–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П (–њ—А–µ–і–љ–Є–Ј–Њ–ї–Њ–љ –Є –Љ–µ—В–Є–њ–ї–њ—А–µ–і–љ–Є–Ј–Њ–ї–Њ–љ) —Б —Г—З–µ—В–Њ–Љ —Ж–Є—А–Ї–∞–і–љ—Л—Е —А–Є—В–Љ–Њ–≤ –≤—Л—А–∞–±–Њ—В–Ї–Є —Н–љ–і–Њ–≥–µ–љ–љ—Л—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤ (—В.–µ. –≤ –њ–µ—А–≤—Г—О –њ–Њ–ї–Њ–≤–Є–љ—Г –і–љ—П), –Ї–Њ–љ—В—А–Њ–ї—М –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є), –Є–љ—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–љ–Њ—Б—В—М –њ–∞—Ж–Є–µ–љ—В–∞ –Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є —А–∞–Ј–≤–Є—В–Є—П –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є. –Ґ–∞–Ї–ґ–µ —Г–Ї–∞–Ј—Л–≤–∞–ї–Њ—Б—М –љ–∞ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –≥–∞—Б—В—А–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А–Њ–≤, –Њ–Њ—Б–±–µ–љ–љ–Њ –њ—А–Є —Б–Њ—З–µ—В–∞–љ–љ–Њ–Љ –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –У–Ъ –Є –љ–µ—Б—В–µ—А–Њ–Є–і–љ—Л—Е –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Є –Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ—Б—В—М –Ј–∞–Љ–µ—Б—В–Є—В–µ–ї—М–љ–Њ–є –њ–µ—А–Є–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–є –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є. –Я—А–Є–≤–µ–і–µ–љ—Л —Г–±–µ–і–Є—В–µ–ї—М–љ—Л–µ –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤–∞, —З—В–Њ –У–Ъ–—В–µ—А–∞–њ–Є—П –≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ –Љ–∞—В—М –Є –њ–ї–Њ–і [69].
–Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —Б–≤–µ—А—Е–≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј –У–Ъ –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ – «–њ—Г–ї—М—Б–—В–µ—А–∞–њ–Є—П» – –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М –≤–µ—Б—М–Љ–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ –њ—А–Є —А–∞–Ј–≤–Є—В–Є–Є —Г–≥—А–Њ–ґ–∞—О—Й–Є—Е –і–ї—П –ґ–Є–Ј–љ–Є –њ—А–Њ—П–≤–ї–µ–љ–Є–є –°–Ъ–Т. –Т—Л–і–µ–ї–µ–љ–∞ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–∞—П –Ї–∞—В–µ–≥–Њ—А–Є—П –±–Њ–ї—М–љ—Л—Е —Б –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–Љ–Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є (–Љ–Њ–ї–Њ–і–Њ–є –≤–Њ–Ј—А–∞—Б—В, –±—Л—Б—В—А–Њ –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–Є–є –≤–Њ–ї—З–∞–љ–Њ—З–љ—Л–є –љ–µ—Д—А–Є—В (–Т–Э), –≤—Л—Б–Њ–Ї–∞—П –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М), —Г –Ї–Њ—В–Њ—А—Л—Е –і–∞–љ–љ—Л–є –Љ–µ—В–Њ–і –ї–µ—З–µ–љ–Є—П –і–Њ–ї–ґ–µ–љ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П –≤ –і–µ–±—О—В–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є–ї–Є –љ–µ–Ј–∞–Љ–µ–і–ї–Є—В–µ–ї—М–љ–Њ –њ—А–Є –Њ–±–Њ—Б—В—А–µ–љ–Є–Є. –Э–∞—А—П–і—Г —Б –±—Л—Б—В—А—Л–Љ –і–Њ—Б—В–Є–ґ–µ–љ–Є–µ–Љ —Н—Д—Д–µ–Ї—В–∞ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є —Б–≤–µ—А—Е–≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј –У–Ъ –Њ—В–Љ–µ—З–µ–љ–Њ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–µ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–µ —Б–≤–Њ–є—Б—В–≤–Њ «–њ—Г–ї—М—Б–—В–µ—А–∞–њ–Є–Є», –∞ –Є–Љ–µ–љ–љ–Њ —Б—В–µ—А–Њ–Є–і–—Б–±–µ—А–µ–≥–∞—О—Й–µ–µ –і–µ–є—Б—В–≤–Є–µ, –њ–Њ–Ј–≤–Њ–ї—П—О—Й–µ–µ –≤–њ–Њ—Б–ї–µ–і—Б—В–≤–Є–Є –і–ї—П –њ–Њ–і–∞–≤–ї–µ–љ–Є—П –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –љ–∞–Ј–љ–∞—З–∞—В—М –Љ–µ–љ—М—И–Є–µ –і–Њ–Ј—Л –њ–µ—А–Њ—А–∞–ї—М–љ—Л—Е –У–Ъ [5,6,68].
–Ю–і–љ–∞–Ї–Њ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є—П –У–Ъ –љ–µ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –і–Њ—Б—В–Є–≥–љ—Г—В—М —А–µ–Љ–Є—Б—Б–Є–Є –њ—А–Є –љ–µ–Ї–Њ—В–Њ—А—Л—Е —Д–Њ—А–Љ–∞—Е –°–Ъ–Т –Є –љ–µ —Г–ї—Г—З—И–∞–µ—В –Њ—В–і–∞–ї–µ–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ —Г–ґ–µ –≤ –Ї–Њ–љ—Ж–µ 1960–—Е –≥–Њ–і–Њ–≤ –≤—Л—А–∞–±–Њ—В–∞–љ–∞ —Б—В—А–∞—В–µ–≥–Є—П –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ—Л–Љ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ–Љ —Ж–Є—В–Њ—Б—В–∞—В–Є—З–µ—Б–Ї–Є—Е –Є–Љ–Љ—Г–љ–Њ–і–µ–њ—А–µ—Б—Б–∞–љ—В–Њ–≤, –∞–Љ–Є–љ–Њ—Е–Є–љ–Њ–ї–Є–љ–Њ–≤—Л—Е –њ—А–Њ–Є–Ј–≤–Њ–і–љ—Л—Е –Є –і—А—Г–≥–Є—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ [71].
–І–∞—Й–µ –≤—Б–µ–≥–Њ –њ—А–Є –°–Ъ–Т –њ—А–Є–Љ–µ–љ—П—О—В —Ж–Є–Ї–ї–Њ—Д–Њ—Б—Д–∞–Љ–Є–і (–¶–§) –Є –∞–Ј–∞—В–Є–Њ–њ—А–Є–љ (–Р–Ч–Р); –≤ —А—П–і–µ —Б–ї—Г—З–∞–µ–≤ –њ—А–Є –љ–∞–ї–Є—З–Є–Є –њ–Њ–Ї–∞–Ј–∞–љ–Є–є –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П —Е–ї–Њ—А–±—Г—В–Є–љ, –Љ–µ—В–Њ—В—А–µ–Ї—Б–∞—В, —Ж–Є–Ї–ї–Њ—Б–њ–Њ—А–Є–љ –Р –Є –ї–µ—Д–ї—Г–љ–Њ–Љ–Є–і. –Я–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ–Є –Ї –љ–∞–Ј–љ–∞—З–µ–љ–Є—О —Ж–Є—В–Њ—Б—В–∞—В–Є—З–µ—Б–Ї–Є—Е –Є–Љ–Љ—Г–љ–Њ–і–µ–њ—А–µ—Б—Б–∞–љ—В–Њ–≤ —Б—З–Є—В–∞—О—В—Б—П: –∞–Ї—В–Є–≤–љ—Л–є –≤–Њ–ї—З–∞–љ–Њ—З–љ—Л–є –љ–µ—Д—А–Є—В –Є –≥–µ–љ–µ—А–∞–ї–Є–Ј–Њ–≤–∞–љ–љ—Л–є –≤–∞—Б–Ї—Г–ї–Є—В; –≤—Л—Б–Њ–Ї–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –±–Њ–ї–µ–Ј–љ–Є –Є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М –Ї –У–Ъ; —А–∞–Ј–≤–Є—В–Є–µ –њ–Њ–±–Њ—З–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є –У–Ъ —Г–ґ–µ –љ–∞ –њ–µ—А–≤—Л—Е —Н—В–∞–њ–∞—Е –ї–µ—З–µ–љ–Є—П; –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М —Г–Љ–µ–љ—М—И–µ–љ–Є—П –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–µ–є –і–Њ–Ј—Л –њ—А–µ–і–љ–Є–Ј–Њ–ї–Њ–љ–∞. –Т–≤–µ–і–µ–љ–Є–µ –≤ –ї–µ—З–µ–±–љ—Л–µ —Б—Е–µ–Љ—Л —Ж–Є—В–Њ—Б—В–∞—В–Є–Ї–Њ–≤ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ–Њ–і–∞–≤–Є—В—М –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –±–Њ–ї–µ–Ј–љ–Є –љ–∞ —Д–Њ–љ–µ –±–Њ–ї–µ–µ –љ–Є–Ј–Ї–Є—Е –і–Њ–Ј –У–Ъ, —Г–≤–µ–ї–Є—З–Є—В—М –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М –±–Њ–ї—М–љ—Л—Е, –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М —Б –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ –ґ–Є–Ј–љ–µ–љ–љ–Њ –≤–∞–ґ–љ—Л—Е –Њ—А–≥–∞–љ–Њ–≤. –†–µ–≥—Г–ї—П—А–љ–Њ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ –Є –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л–є –њ–Њ–і–±–Њ—А –і–Њ–Ј—Л –њ—А–µ–њ–∞—А–∞—В–∞ –њ—А–Є —В—Й–∞—В–µ–ї—М–љ–Њ–Љ –Љ–Њ–љ–Є—В–Њ—А–Є–љ–≥–µ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–Љ—Г —Б–љ–Є–ґ–µ–љ–Є—О —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є.
–¶–Є–Ї–ї–Њ—Д–Њ—Б—Д–∞–Љ–Є–і (–¶–§) – –њ—А–µ–њ–∞—А–∞—В –≤—Л–±–Њ—А–∞ –њ—А–Є –≤–Њ–ї—З–∞–љ–Њ—З–љ–Њ–Љ –љ–µ—Д—А–Є—В–µ (–Т–Э) –Є —В—П–ґ–µ–ї–Њ–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–Є –¶–Э–°. –Э–∞–Ј–љ–∞—З–µ–љ–Є–µ –¶–§ —З–∞—Б—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Ї–Њ–љ—В—А–Њ–ї–Є—А–Њ–≤–∞—В—М –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П –°–Ъ–Т, —А–µ—Д—А–∞–Ї—В–µ—А–љ—Л–µ –Ї –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є –≤—Л—Б–Њ–Ї–Є–Љ–Є –і–Њ–Ј–∞–Љ–Є –У–Ъ (—В–∞–Ї–Є–µ –Ї–∞–Ї —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є—П, –љ–µ–є—А–Њ–ї—О–њ—Г—Б, –ї–µ–≥–Њ—З–љ—Л–µ –≥–µ–Љ–Њ—А—А–∞–≥–Є–Є, —Б–Є—Б—В–µ–Љ–љ—Л–є –≤–∞—Б–Ї—Г–ї–Є—В –Є –і—А.). –Я—А–µ–њ–∞—А–∞—В –љ–∞–Ј–љ–∞—З–∞–µ—В—Б—П –µ–ґ–µ–Љ–µ—Б—П—З–љ–Њ –њ–Њ 0,5–1 –≥/–Љ2 –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ –Ї–∞–њ–µ–ї—М–љ–Њ –≤ —В–µ—З–µ–љ–Є–µ 6 –Љ–µ—Б., –Ј–∞—В–µ–Љ –µ–ґ–µ–Ї–≤–∞—А—В–∞–ї—М–љ–Њ –≤ —В–µ—З–µ–љ–Є–µ 2 –ї–µ—В –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –њ—Г–ї—М—Б–—В–µ—А–∞–њ–Є–µ–є –Љ–µ—В–Є–ї–њ—А–µ–і–љ–Є–Ј–Њ–ї–Њ–љ–Њ–Љ –Є –њ—А–Є–µ–Љ–Њ–Љ –У–Ъ –≤–љ—Г—В—А—М [81–84].
–Р–Ј–∞—В–Є–Њ–њ—А–Є–љ (–Р–Ч–Р) –Є—Б–њ–Њ–ї—М–Ј—Г—О—В –і–ї—П –њ–Њ–і–і–µ—А–ґ–∞–љ–Є—П –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–є –¶–§ —А–µ–Љ–Є—Б—Б–Є–Є –Т–Э, –њ—А–Є —А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л—Е –Ї –У–Ъ —Д–Њ—А–Љ–∞—Е –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ–Њ–є –≥–µ–Љ–Њ–ї–Є—В–Є—З–µ—Б–Ї–Њ–є –∞–љ–µ–Љ–Є–Є –Є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–Є, –∞ —В–∞–Ї–ґ–µ –њ–Њ—А–∞–ґ–µ–љ–Є—П—Е –Ї–Њ–ґ–Є. –°—В–∞–љ–і–∞—А—В–љ–∞—П —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–∞—П –і–Њ–Ј–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 2–3 –Љ–≥ –љ–∞ 1 –Ї–≥ –Љ–∞—Б—Б—Л —В–µ–ї–∞ –≤ —Б—Г—В–Ї–Є, –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ—Л–є —Н—Д—Д–µ–Ї—В –љ–∞ —Д–Њ–љ–µ –ї–µ—З–µ–љ–Є—П —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –љ–µ —А–∞–љ–µ–µ 6–9 –Љ–µ—Б. [85–89].
–Ь–µ—В–Њ—В—А–µ–Ї—Б–∞—В (–Ь–Ґ–•) –Є–љ–Њ–≥–і–∞ –љ–∞–Ј–љ–∞—З–∞—О—В –њ—А–Є —А–µ—Д—А–∞–Ї—В–µ—А–љ–Њ–Љ –Ї –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є –У–Ъ –∞—А—В—А–Є—В–µ –Є –њ–Њ—А–∞–ґ–µ–љ–Є—П—Е –Ї–Њ–ґ–Є. –Ы–µ—З–µ–љ–Є–µ –Ь–Ґ–• —В–∞–Ї–ґ–µ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ —В–∞–Ї–Є–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П –°–Ъ–Т, –Ї–∞–Ї –∞–ї–Њ–њ–µ—Ж–Є—П, –њ–ї–µ–≤—А–Є—В –Є —Б–ї–∞–±–Њ—Б—В—М; —Г –њ–Њ–ї–Њ–≤–Є–љ—Л –±–Њ–ї—М–љ—Л—Е –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Г–Љ–µ–љ—М—И–Є—В—М —Б—Г—В–Њ—З–љ—Г—О –і–Њ–Ј—Г –У–Ъ [90,91]. –¶–Є–Ї–ї–Њ—Б–њ–Њ—А–Є–љ (< 5 –Љ–≥ –љ–∞ 1 –Ї–≥ –Љ–∞—Б—Б—Л —В–µ–ї–∞ –≤ —Б—Г—В–Ї–Є) – –њ—А–µ–њ–∞—А–∞—В –≤—В–Њ—А–Њ–≥–Њ —А—П–і–∞ –њ—А–Є –љ–µ—Д—А–Њ—В–Є—З–µ—Б–Ї–Њ–Љ —Б–Є–љ–і—А–Њ–Љ–µ, —Б–≤—П–Ј–∞–љ–љ–Њ–Љ —Б –Љ–µ–Љ–±—А–∞–љ–Њ–Ј–љ—Л–Љ –≤–Њ–ї—З–∞–љ–Њ—З–љ—Л–Љ –љ–µ—Д—А–Є—В–Њ–Љ, –Є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–Є [92,93].
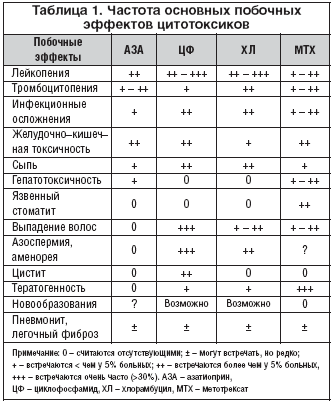
–Я—А–Њ–±–ї–µ–Љ–∞–Љ–Є –Є–Љ–Љ—Г–љ–Њ—Б—Г–њ—А–µ—Б—Б–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є –±–Њ–ї—М–љ—Л—Е –°–Ъ–Т –њ—А–Њ–і–Њ–ї–ґ–∞—О—В –Њ—Б—В–∞–≤–∞—В—М—Б—П –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –ї–µ—З–µ–љ–Є—П –Є –≤—Л—Б–Њ–Ї–∞—П —З–∞—Б—В–Њ—В–∞ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є (—В–∞–±–ї. 1) [7]. –Я–Њ–њ—Л—В–Ї–Є —Г–Љ–µ–љ—М—И–Є—В—М —В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М —Б—Е–µ–Љ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –њ—А–Є —Б–Њ—Е—А–∞–љ–µ–љ–Є–Є –Є—Е —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–µ–і–њ—А–Є–љ–Є–Љ–∞—О—В—Б—П –Ј–∞ —Б—З–µ—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Є–Љ–Љ—Г–љ–Њ—Б—Г–њ—А–µ—Б—Б–∞–љ—В–Њ–≤, –Є –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М –Љ–Є–Ї–Њ—Д–µ–љ–Њ–ї–∞—В–∞ –Љ–Њ—Д–µ—В–Є–ї–∞ (–Ь–Ь–§).
–Т –Ї–Њ–љ—Ж–µ –•–• –≤. —Б—В–∞–ї–Є –њ–Њ—П–≤–ї—П—В—М—Б—П –њ–µ—А–≤—Л–µ —Б–Њ–Њ–±—Й–µ–љ–Є—П –Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –Ь–Ь–§ —Г –±–Њ–ї—М–љ—Л—Е –°–Ъ–Т, –≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –њ—А–Є —А–µ—Д—А–∞–Ї—В–µ—А–љ–Њ—Б—В–Є –Ї —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л–Љ –Љ–µ—В–Њ–і–∞–Љ –ї–µ—З–µ–љ–Є—П [8,9]. –Ъ –љ–∞—Б—В–Њ—П—Й–µ–Љ—Г –≤—А–µ–Љ–µ–љ–Є —А–µ–Ј—Г–ї—М—В–∞—В—Л –†–Ъ–Ш (–±–Њ–ї–µ–µ 1500 –±–Њ–ї—М–љ—Л—Е) –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є –Њ–і–Є–љ–∞–Ї–Њ–≤—Г—О (–∞ –њ–Њ —А—П–і—Г –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Є –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї—Г—О) —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Ь–Ь–§ –≤ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–є –і–Њ–Ј–µ 2–3 –≥/—Б—Г—В. –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –¶–§ —Г –±–Њ–ї—М–љ—Л—Е –Т–Э (–≤ –Ї–∞—З–µ—Б—В–≤–µ –Є–љ–і—Г–Ї—Ж–Є–Њ–љ–љ–Њ–є –Є –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–µ–є —В–µ—А–∞–њ–Є–Є) –њ—А–Є –ї—Г—З—И–µ–є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є [10,62]. –Ю—В–Љ–µ—З–µ–љ–Њ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ –љ–∞ —Н–Ї—Б—В—А–∞—А–µ–љ–∞–ї—М–љ—Л–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П –°–Ъ–Т: –∞–љ–µ–Љ–Є—О, —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є—О, –њ–Њ—А–∞–ґ–µ–љ–Є–µ –Ї–Њ–ґ–Є, –∞–ї—М–≤–µ–Њ–ї–Є—В. –Х—Б—В—М –і–∞–љ–љ—Л–µ –Њ–± —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ь–Ь–§ –њ—А–Є –љ–µ–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –∞ —В–∞–Ї–ґ–µ –њ—А–Є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Ї –њ—А–µ–і—И–µ—Б—В–≤—Г—О—Й–µ–є –Є–Љ–Љ—Г–љ–Њ—Б—Г–њ—А–µ—Б—Б–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є [11,12]. –Я—А–Є–µ–Љ–ї–µ–Љ—Л–є —Б–њ–µ–Ї—В—А –њ–Њ–±–Њ—З–љ—Л—Е —П–≤–ї–µ–љ–Є–є, –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є, –і—А—Г–≥–Є–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ –Ь–Ь–§ (—Б–µ–ї–µ–Ї—В–Є–≤–љ–∞—П –Є–Љ–Љ—Г–љ–Њ—Б—Г–њ—А–µ—Б—Б–Є—П, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –≤–≤–Є–і—Г –љ–Є–Ј–Ї–Њ–є —З–∞—Б—В–Њ—В—Л –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –Є –≥–µ–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, –Њ—В—Б—Г—В—Б—В–≤–Є–µ –Љ—Г—В–∞–≥–µ–љ–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П –Є –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ –≥–Њ–љ–∞–і—Л, –∞–љ—В–Є–∞—В–µ—А–Њ–≥–µ–љ–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –Є –і—А.) –њ–Њ–Ј–≤–Њ–ї—П—О—В —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М –Ь–Ь–§ –Ї–∞–Ї –Њ–і–Є–љ –Є–Ј –љ–∞–Є–±–Њ–ї–µ–µ –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤ –ї–µ—З–µ–љ–Є–Є –±–Њ–ї—М–љ—Л—Е –°–Ъ–Т [12–14].
–Ю—Б–Њ–±–Њ–µ –Љ–µ—Б—В–Њ –≤ –ї–µ—З–µ–љ–Є–Є –±–Њ–ї—М–љ—Л—Е –°–Ъ–Т –Ј–∞–љ–Є–Љ–∞—О—В –∞–Љ–Є–љ–Њ—Е–Є–љ–Њ–ї–Є–љ–Њ–≤—Л–µ –њ—А–Њ–Є–Ј–≤–Њ–і–љ—Л–µ (–Р–Я). –•–ї–Њ—А–Њ—Е–Є–љ —Д–Њ—Б—Д–∞—В–∞ –Є –≥–Є–і—А–Њ–Ї—Б–Є—Е–ї–Њ—А–Њ—Е–Є–љ —Б—Г–ї—М—Д–∞—В–∞ (–Я–ї–∞–Ї–≤–µ–љ–Є–ї) –≤ —В–µ—З–µ–љ–Є–µ –Љ–љ–Њ–≥–Є—Е –ї–µ—В —Б —Г—Б–њ–µ—Е–Њ–Љ –њ—А–Є–Љ–µ–љ—П–ї–Є—Б—М –њ—А–Є –°–Ъ–Т, –≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –њ—А–Є –љ–µ–≤—Л—Б–Њ–Ї–Њ–є –Є —Г–Љ–µ—А–µ–љ–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –±–Њ–ї–µ–Ј–љ–Є [27–29].
–Ф–µ—В–∞–ї—М–љ–Њ–µ –Є–Ј—Г—З–µ–љ–Є–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –і–µ–є—Б—В–≤–Є—П –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –≤—Л—П–≤–Є–≤—И–µ–µ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–є, –∞–љ—В–Є–∞–≥—А–µ–≥–∞–љ—В–љ—Л–є, –≥–Є–њ–Њ–ї–Є–њ–Є–і–µ–Љ–Є—З–µ—Б–Ї–Є–є, —Д–Њ—В–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ—Л–є, –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ—Л–є, –∞–љ—В–Є–Љ–Є–Ї—А–Њ–±–љ—Л–є, –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є—З–µ—Б–Ї–Є–є –Є –∞–љ–∞–ї—М–≥–µ—В–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В—Л, –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ –њ–Њ––љ–Њ–≤–Њ–Љ—Г –≤–Ј–≥–ї—П–љ—Г—В—М –љ–∞ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Р–Я –њ—А–Є –°–Ъ–Т [26] (—В–∞–±–ї. 2).
–Ф–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ—А–Є–µ–Љ –Р–Я –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Б–љ–Є–ґ–∞–µ—В —З–∞—Б—В–Њ—В—Г –Њ–±–Њ—Б—В—А–µ–љ–Є–є –°–Ъ–Т, –Ї–∞–Ї —Г–Љ–µ—А–µ–љ–љ—Л—Е, —В–∞–Ї –Є —В—П–ґ–µ–ї—Л—Е, –Є –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Б–љ–Є–Ј–Є—В—М –і–Њ–Ј—Г –У–Ъ [30–32]. –•–Њ—А–Њ—И–Њ –Є–Ј–≤–µ—Б—В–љ–∞ –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–∞—П —А–Њ–ї—М –Р–Я: –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л–µ —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л–µ –Є –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–і—В–≤–µ—А–і–Є–ї–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–≥–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –і–∞–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Г –±–Њ–ї—М–љ—Л—Е –∞–љ—В–Є—Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–љ—Л–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ [33–36]. –Я–Њ–ї—Г—З–µ–љ—Л –і–∞–љ–љ—Л–µ –Њ –њ—А–Њ—В–µ–Ї—В–Є–≤–љ–Њ–Љ –і–µ–є—Б—В–≤–Є–Є –Р–Я –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –њ–Њ—А–∞–ґ–µ–љ–Є—П –ґ–Є–Ј–љ–µ–љ–љ–Њ –≤–∞–ґ–љ—Л—Е –Њ—А–≥–∞–љ–Њ–≤: –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –≥–Є–і—А–Њ–Ї—Б–Є—Е–ї–Њ—А–Њ—Е–Є–љ–∞ (–Я–ї–∞–Ї–≤–µ–љ–Є–ї–∞) —Б–љ–Є–ґ–∞–ї–Њ —А–Є—Б–Ї –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –њ–Њ—З–µ—З–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –љ–∞ 70% –Є –њ–Њ–і–і–µ—А–ґ–Є–≤–∞–ї–Њ —А–µ–Љ–Є—Б—Б–Є—О –≤–Њ–ї—З–∞–љ–Њ—З–љ–Њ–≥–Њ –љ–µ—Д—А–Є—В–∞ [37,38]. –Т—Л—П–≤–ї–µ–љ–Њ, —З—В–Њ —А–∞–љ–љ–µ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Р–Я —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –Є–љ–і–µ–Ї—Б–∞ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П, –Њ—В—А–∞–ґ–∞—О—Й–µ–≥–Њ –љ–µ–Њ–±—А–∞—В–Є–Љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤–љ—Г—В—А–µ–љ–љ–Є—Е –Њ—А–≥–∞–љ–Њ–≤ [39,40]. –Ь–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ LUMINA –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Њ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–µ —А–∞–Ј–ї–Є—З–Є—П –≤ —З–∞—Б—В–Њ—В–µ –Є —Б—В—А—Г–Ї—В—Г—А–µ –ї–µ—В–∞–ї—М–љ–Њ—Б—В–Є –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –њ—А–Є–µ–Љ–∞ –Р–Я: –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞ –Њ—В–Љ–µ—З–µ–љ–Њ –Љ–µ–љ—М—И–µ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —Б–Љ–µ—А—В–µ–є, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –љ–µ –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–Њ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е –Є—Б—Е–Њ–і–Њ–≤ –≤—Б–ї–µ–і—Б—В–≤–Є–µ —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є [41,42]. –Т—Л—Б–Ї–∞–Ј–∞–љ–Њ –њ—А–µ–і–њ–Њ–ї–Њ–ґ–µ–љ–Є–µ –Њ –њ—А–Њ—В–µ–Ї—В–Є–≤–љ–Њ–Љ –і–µ–є—Б—В–≤–Є–Є –Р–Я –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —А–∞–Ј–≤–Є—В–Є—П –љ–µ–Њ–њ–ї–∞–Ј–Љ —Г –±–Њ–ї—М–љ—Л—Е –°–Ъ–Т [43]. –Ш–Љ–µ—О—В—Б—П —Б–≤–µ–і–µ–љ–Є—П –Њ —Б–љ–Є–ґ–µ–љ–Є–Є —Г—А–Њ–≤–љ—П —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞, –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–Љ –і–µ–є—Б—В–≤–Є–Є –љ–∞ –Ї–Њ—Б—В–љ—Л–є –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ, —Б–љ–Є–ґ–µ–љ–Є–Є —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П —Б–∞—Е–∞—А–љ–Њ–≥–Њ –і–Є–∞–±–µ—В–∞ 2––≥–Њ —В–Є–њ–∞ [44–50]. –Т —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –Р–Я –≤ –њ–µ—А–Є–Њ–і –≥–µ—Б—В–∞—Ж–Є–Є –Є –њ—А–Є –≥—А—Г–і–љ–Њ–Љ –≤—Б–Ї–∞—А–Љ–ї–Є–≤–∞–љ–Є–Є [51–57]. –Ъ—А–∞–є–љ–µ –≤–∞–ґ–љ—Л –і–ї—П –±–Њ–ї—М–љ—Л—Е –°–Ъ–Т, —Б–Ї–ї–Њ–љ–љ—Л—Е –≤—Б–ї–µ–і—Б—В–≤–Є–µ —Б–∞–Љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–є –Є–Љ–Љ—Г–љ–Њ—Б—Г–њ—А–µ—Б—Б–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Ї —А–∞–Ј–≤–Є—В–Є—О –Є–љ—Д–µ–Ї—Ж–Є–є, –∞–љ—В–Є–Љ–Є–Ї—А–Њ–±–љ—Л–µ —Б–≤–Њ–є—Б—В–≤–∞ –Р–Я [60]. –Э–µ–і–∞–≤–љ–Њ –±—Л–ї–∞ –њ–Њ–Ї–∞–Ј–∞–љ–∞ –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є—П —В–µ—А–∞–њ–Є–Є –Р–Я —Б –±–Њ–ї–µ–µ —З–µ–Љ –і–µ—Б—П—В–Є–Ї—А–∞—В–љ—Л–Љ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —З–∞—Б—В–Њ—В—Л –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є [61].
–Ю—В–ї–Є—З–Є—В–µ–ї—М–љ–Њ–є –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—М—О –Р–Я —П–≤–ї—П–µ—В—Б—П –љ–Є–Ј–Ї–∞—П —З–∞—Б—В–Њ—В–∞ –њ–Њ–±–Њ—З–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є, —В—А–µ–±—Г—О—Й–Є—Е –њ—А–µ–Ї—А–∞—Й–µ–љ–Є—П –ї–µ—З–µ–љ–Є—П, –њ—А–Є —Н—В–Њ–Љ —В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М –≥–Є–і—А–Њ–Ї—Б–Є—Е–ї–Њ—А–Њ—Е–Є–љ–∞ (–Я–ї–∞–Ї–≤–µ–љ–Є–ї–∞) –≤ –і–≤–∞ —А–∞–Ј–∞ –љ–Є–ґ–µ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —Е–ї–Њ—А–Њ—Е–Є–љ–Њ–Љ [57–59].
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Б–Њ–≤—А–µ–Љ–µ–љ–љ–∞—П —Б—В—А–∞—В–µ–≥–Є—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Р–Я —Г –±–Њ–ї—М–љ—Л—Е –°–Ъ–Т –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –≤–Ї–ї—О—З–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤ —Б—Е–µ–Љ—Г –ї–µ—З–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е —Б –і–µ–±—О—В–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –±–µ–Ј –Њ—В–Љ–µ–љ—Л –і–∞–ґ–µ –њ—А–Є –љ–∞—Б—В—Г–њ–ї–µ–љ–Є–Є —А–µ–Љ–Є—Б—Б–Є–Є. –•–Њ—А–Њ—И–Є–є –њ—А–Њ—Д–Є–ї—М –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –Р–Я, –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М –Я–ї–∞–Ї–≤–µ–љ–Є–ї, —Б–Ї–Њ–ї—М —Г–≥–Њ–і–љ–Њ –і–Њ–ї–≥–Њ –≤ —В–µ—З–µ–љ–Є–µ –±–Њ–ї–µ–Ј–љ–Є.
–Т–љ—Г—В—А–Є–≤–µ–љ–љ—Л–є –Є–Љ–Љ—Г–љ–Њ–≥–ї–Њ–±—Г–ї–Є–љ (–Т–Т–Ш–У) —Б —Г—Б–њ–µ—Е–Њ–Љ –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П –і–ї—П –ї–µ—З–µ–љ–Є—П –љ–µ–Ї–Њ—В–Њ—А—Л—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є –°–Ъ–Т, —В–∞–Ї–Є—Е –Ї–∞–Ї —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є—П, –њ–Њ—А–∞–ґ–µ–љ–Є–µ –¶–Э–°, –∞–љ—В–Є—Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–љ—Л–є —Б–Є–љ–і—А–Њ–Љ –Є –љ–µ—Д—А–Є—В. –Я—А–µ–њ–∞—А–∞—В –≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –њ—А–Є–Љ–µ–љ—П–µ—В—Б—П –њ—А–Є —Г–≥—А–Њ–ґ–∞—О—Й–Є—Е –і–ї—П –ґ–Є–Ј–љ–Є —Б–Њ—Б—В–Њ—П–љ–Є—П—Е, —Н—Д—Д–µ–Ї—В –љ–∞—Б—В—Г–њ–∞–µ—В –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –±—Л—Б—В—А–Њ, –≤ —В–µ—З–µ–љ–Є–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –і–љ–µ–є, –Њ–і–љ–∞–Ї–Њ –±—Л–≤–∞–µ—В, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –љ–µ–њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ—Л–Љ [23,24]. –°—Е–µ–Љ—Л –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –љ–µ —Б—В–∞–љ–і–∞—А—В–Є–Ј–Є—А–Њ–≤–∞–љ—Л: –Њ–±—Л—З–љ–Њ –њ—А–Є–Љ–µ–љ—П–µ–Љ–∞—П –і–Њ–Ј–∞ –Т–Т–Ш–У –≤–∞—А—М–Є—А—Г–µ—В –Њ—В 0,4 –і–Њ 2 –≥ –љ–∞ 1 –Ї–≥ –Љ–∞—Б—Б—Л —В–µ–ї–∞ –≤ —Б—Г—В–Ї–Є –≤ —В–µ—З–µ–љ–Є–µ 4–5 –і–љ–µ–є [73]. –Ь–љ–µ–љ–Є–µ –Њ–± —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Т–Т–Ш–У —Г –±–Њ–ї—М–љ—Л—Е –Т–Э –њ—А–Њ—В–Є–≤–Њ—А–µ—З–Є–≤—Л. Orbach H., –њ—А–Њ–∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–≤ –Є–Љ–µ—О—Й–Є–µ—Б—П –≤ –ї–Є—В–µ—А–∞—В—Г—А–µ —Б–Њ–Њ–±—Й–µ–љ–Є—П –Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –Т–Т–Ш–У —Г –±–Њ–ї—М–љ—Л—Е –°–Ъ–Т, —Б—А–∞–≤–љ–Є–≤–∞–µ—В –њ—А–µ–њ–∞—А–∞—В —Б «–Њ–±–Њ—О–і–Њ–Њ—Б—В—А—Л–Љ –Љ–µ—З–Њ–Љ». –° –Њ–і–љ–Њ–є —Б—В–Њ—А–Њ–љ—Л, —В–µ—А–∞–њ–Є—П –Т–Т–Ш–У —Г 106 –±–Њ–ї—М–љ—Л—Е —Б –Т–Э –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ –њ—А–Є–≤–Њ–і–Є–ї–∞ –Ї —Б–љ–Є–ґ–µ–љ–Є—О –њ—А–Њ—В–µ–Є–љ—Г—А–Є–Є, —Г–≤–µ–ї–Є—З–µ–љ–Є—О –Ї–ї–Є—А–µ–љ—Б–∞ –Ї—А–µ–∞—В–Є–љ–Є–љ–∞ –Є —А–µ–≥—А–µ—Б—Б—Г –љ–µ—Д—А–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П —Г 76 –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Т–Т–Ш–У –њ–Њ —А–∞–Ј–ї–Є—З–љ—Л–Љ –њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ, –Њ—В–Љ–µ—З–µ–љ–Њ —А–∞–Ј–≤–Є—В–Є–µ –љ–µ—Д—А–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В–Є, –њ—А–Є —Н—В–Њ–Љ –≤ 31% —Б–ї—Г—З–∞–µ–≤ –њ–Њ—В—А–µ–±–Њ–≤–∞–ї–Њ—Б—М –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –≥–µ–Љ–Њ–і–Є–∞–ї–Є–Ј–∞. –Я—А–Є –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –±—Л–ї–Є –≤—Л—П–≤–ї–µ–љ—Л –≤–∞–Ї—Г–Њ–ї–Є–Ј–∞—Ж–Є—П –Є –љ–∞–±—Г—Е–∞–љ–Є–µ –њ—А–Њ–Ї—Б–Є–Љ–∞–ї—М–љ—Л—Е –Ї–∞–љ–∞–ї—М—Ж–µ–≤ [25]. –Ф–∞–љ–љ–Њ–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–µ –њ–Њ–і—З–µ—А–Ї–Є–≤–∞–µ—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –Њ–±–і—Г–Љ–∞–љ–љ–Њ–≥–Њ –њ–Њ–і—Е–Њ–і–∞ –Ї –љ–∞–Ј–љ–∞—З–µ–љ–Є—О –Т–Т–Ш–У —Г –±–Њ–ї—М–љ—Л—Е —Б –њ–Њ—З–µ—З–љ—Л–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ –Є —В—Й–∞—В–µ–ї—М–љ–Њ–≥–Њ –Љ–Њ–љ–Є—В–Њ—А–Є–љ–≥–∞.
–°–Њ–≤–µ—А—И–µ–љ—Б—В–≤–Њ–≤–∞–љ–Є–µ –Ј–љ–∞–љ–Є—П –Є–Љ–Љ—Г–љ–Њ–њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –°–Ъ–Т –њ–Њ–≤–ї–µ–Ї–ї–Њ –Ј–∞ —Б–Њ–±–Њ–є —А–∞–Ј—А–∞–±–Њ—В–Ї—Г –Є –≤–љ–µ–і—А–µ–љ–Є–µ –њ—А–Є–љ—Ж–Є–њ–Є–∞–ї—М–љ–Њ –љ–Њ–≤–Њ–≥–Њ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є—П – –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –≥–µ–љ–љ–Њ––Є–љ–ґ–µ–љ–µ—А–љ—Л—Е –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –•–Њ—А–Њ—И–Њ –Є–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ —Д—Г–љ–і–∞–Љ–µ–љ—В–∞–ї—М–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –њ—А–Є –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е, –Є –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М –њ—А–Є –°–Ъ–Т, –Є–Љ–µ—О—В –Т––Ї–ї–µ—В–Ї–Є, –Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ—Л–µ –Ј–∞ —Б–Є–љ—В–µ–Ј –∞—Г—В–Њ–∞–љ—В–Є—В–µ–ї –Є –њ—А–µ–Ј–µ–љ—В–Є—А–Њ–≤–∞–љ–Є–µ –∞—Г—В–Њ–∞–љ—В–Є–≥–µ–љ–Њ–≤ –Ґ––Ї–ї–µ—В–Ї–∞–Љ [15,19]. –С–Њ–ї—М—И–Є–µ –љ–∞–і–µ–ґ–і—Л —Г –±–Њ–ї—М–љ—Л—Е –°–Ъ–Т, –±–µ–Ј—Г—Б–ї–Њ–≤–љ–Њ, —Б–≤—П–Ј–∞–љ—Л —Б —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–Њ–Љ, –Ї–Њ—В–Њ—А—Л–µ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є —А–µ–Ї–Њ–Љ–±–Є–љ–∞–љ—В–љ—Л–µ —Е–Є–Љ–µ—А–љ—Л–µ –Љ–Њ–љ–Њ–Ї–ї–Њ–љ–∞–ї—М–љ—Л–µ –∞–љ—В–Є—В–µ–ї–∞ –Ї –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–љ—Л–Љ —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ –ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ – CD20 [16]. –Ф–µ–є—Б—В–≤–Є–µ —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–∞ –љ–∞–њ—А–∞–≤–ї–µ–љ–Њ –љ–∞ –њ–Њ–і–∞–≤–ї–µ–љ–Є–µ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Т––Ї–ї–µ—В–Њ–Ї –Ј–∞ —Б—З–µ—В –∞–љ—В–Є—В–µ–ї–Њ––Ј–∞–≤–Є—Б–Є–Љ–Њ–є –Ї–ї–µ—В–Њ—З–љ–Њ–є –Є –Ї–Њ–Љ–њ–ї–µ–Љ–µ–љ—В––Ј–∞–≤–Є—Б–Є–Љ–Њ–є —Ж–Є—В–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В–Є, –Є–љ–≥–Є–±–Є—Ж–Є–Є –Ї–ї–µ—В–Њ—З–љ–Њ–є –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є–Є –Є –Є–љ–і—Г–Ї—Ж–Є–Є –∞–њ–Њ–њ—В–Њ–Ј–∞ –Т––ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤. –Ю—Б–љ–Њ–≤–љ–Њ–є –Љ–Є—И–µ–љ—М—О —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–∞ —П–≤–ї—П—О—В—Б—П –Ї–ї–µ—В–Ї–Є––њ—А–µ–і—И–µ—Б—В–≤–µ–љ–љ–Є–Ї–Є, –љ–µ–Ј—А–µ–ї—Л–µ, –Ј—А–µ–ї—Л–µ –Є –љ–∞–Є–≤–љ—Л–µ –Т––ї–Є–Љ—Д–Њ—Ж–Є—В—Л, –Ј–∞ –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ –њ–ї–∞–Ј–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Ї–ї–µ—В–Њ–Ї, –љ–∞ –Љ–µ–Љ–±—А–∞–љ–∞—Е –Ї–Њ—В–Њ—А—Л—Е CD20 –љ–µ —Н–Ї—Б–њ—А–µ—Б—Б–Є—А—Г–µ—В—Б—П [17, 18].
–Ъ –љ–∞—Б—В–Њ—П—Й–µ–Љ—Г –≤—А–µ–Љ–µ–љ–Є –љ–∞–Ї–Њ–њ–ї–µ–љ –Њ–њ—Л—В –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–∞ —Г –±–Њ–ї–µ–µ —З–µ–Љ 400 –±–Њ–ї—М–љ—Л—Е –°–Ъ–Т. –Я–Њ–Ї–∞–Ј–∞–љ–Є–µ–Љ –Ї –љ–∞–Ј–љ–∞—З–µ–љ–Є—О –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –њ–Њ–і–∞–≤–ї—П—О—Й–µ–Љ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ —П–≤–Є–ї–Њ—Б—М —В—П–ґ–µ–ї–Њ–µ —В–µ—З–µ–љ–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П (—Г –њ–Њ–ї–Њ–≤–Є–љ—Л – –њ—А–Њ–ї–Є—Д–µ—А–∞—В–Є–≤–љ—Л–є –Т–Э), —А–µ—Д—А–∞–Ї—В–µ—А–љ–Њ–µ –Ї —Б—В–∞–љ–і–∞—А—В–љ—Л–Љ –Љ–µ—В–Њ–і–∞–Љ –ї–µ—З–µ–љ–Є—П. –Ю—Б–љ–Њ–≤–љ–∞—П —З–∞—Б—В—М –±–Њ–ї—М–љ—Л—Е –њ–Њ–ї—Г—З–∞–ї–Є –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є—О —А–њ–Є—В—Г–Ї—Б–Є–Љ–∞–±–Њ–Љ (4 –Є–љ—Д—Г–Ј–Є–Є –≤ –љ–µ–і–µ–ї—О –Є–Ј —А–∞—Б—З–µ—В–∞ 375 –Љ–≥/–Љ2 ), –Є 30% – —Б–Њ—З–µ—В–∞–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ —Б –¶–§. –Т —Ж–µ–ї–Њ–Љ –ї–µ—З–µ–љ–Є–µ —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–Њ–Љ –њ—А–Є–≤–Њ–і–Є–ї–Њ –Ї –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–Љ—Г —Б–љ–Є–ґ–µ–љ–Є—О –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –±–Њ–ї–µ–µ —З–µ–Љ —Г 80%. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–∞ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї—Б—П –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–є –і–Є–љ–∞–Љ–Є–Ї–Њ–є –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ –Ї–ї—Г–±–Њ—З–Ї–∞—Е –њ–Њ –і–∞–љ–љ—Л–Љ –њ–Њ–≤—В–Њ—А–љ—Л—Е –±–Є–Њ–њ—Б–Є–є. –Э–∞—А—П–і—Г —Б –њ–Њ–і–∞–≤–ї–µ–љ–Є–µ–Љ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Т–Э, –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –і–µ–є—Б—В–≤–Є–µ —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–∞ –љ–∞ —Н–Ї—Б—В—А–∞—А–µ–љ–∞–ї—М–љ—Л–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П –°–Ъ–Т (–Ї–Њ–ґ–љ—Л–є —Б–Є–љ–і—А–Њ–Љ, –њ–Њ—А–∞–ґ–µ–љ–Є–µ –¶–Э–°, –∞—А—В—А–Є—В) [20]. –Ю—Б–Њ–±—Л–є –Є–љ—В–µ—А–µ—Б –≤—Л–Ј—Л–≤–∞—О—В –і–∞–љ–љ—Л–µ –Њ –±—Л—Б—В—А–Њ–Љ —А–∞–Ј–≤–Є—В–Є–Є —Г–ї—Г—З—И–µ–љ–Є—П —Г –±–Њ–ї—М–љ—Л—Е —Б —В—П–ґ–µ–ї—Л–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ –¶–Э–° (–њ–Њ—В–µ—А—П —Б–Њ–Ј–љ–∞–љ–Є—П, —Б—Г–і–Њ—А–Њ–≥–Є, –∞—В–∞–Ї—Б–Є—П, –і–µ–Ј–Њ—А–Є–µ–љ—В–∞—Ж–Є—П), —Ж–Є—В–Њ–њ–µ–љ–Є—З–µ—Б–Ї–Є–Љ–Є –Ї—А–Є–Ј–∞–Љ–Є, –Ї–∞—В–∞—Б—В—А–Њ—Д–Є—З–µ—Б–Ї–Є–Љ –∞–љ—В–Є—Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–љ—Л–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ [21]. –Я–Њ–ї—Г—З–µ–љ–љ—Л–µ –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–∞—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–∞ —Г –±–Њ–ї—М–љ—Л—Е —Б –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–Љ–Є –≤–∞—А–Є–∞–љ—В–∞–Љ–Є —В–µ—З–µ–љ–Є—П –°–Ъ–Т –Є –њ—А–Є —А–∞–Ј–≤–Є—В–Є–Є –Ї—А–Є—В–Є—З–µ—Б–Ї–Є—Е —Б–Њ—Б—В–Њ—П–љ–Є–є, –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ —Г–≥—А–Њ–ґ–∞—О—Й–Є—Е –ґ–Є–Ј–љ–Є –±–Њ–ї—М–љ—Л—Е [22,65]. –Х—Б—В—М —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤–∞ –≤—Л—Б–Њ–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ–Њ–≤—В–Њ—А–љ—Л—Е –Ї—Г—А—Б–Њ–≤ —В–µ—А–∞–њ–Є–Є —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–Њ–Љ –≤ —Б–ї—Г—З–∞–µ —А–∞–Ј–≤–Є—В–Є—П –Њ–±–Њ—Б—В—А–µ–љ–Є—П.
–†–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П —Г –±–Њ–ї—М–љ—Л—Е –°–Ъ–Т –љ–µ–Ї–Њ—В–Њ—А—Л—Е –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А–Њ–≤, —В–∞–Ї–Є—Е –Ї–∞–Ї —В–∞–ї–Є–і–Њ–Љ–Є–і, –±–Є–љ–і–∞—А–Є—В –Є –љ—Г–Ї–ї–µ–Њ–Ј–Є–і–љ—Л–µ –∞–љ–∞–ї–Њ–≥–Є (—Д–ї—Г–і–∞—А–∞–±–Є–љ, –Љ–Є–Ј–Њ—А–Є–±–Є–љ, –ї–µ—Д–ї—Г–љ–Њ–Љ–Є–і) [63,66]. –†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є in vitro —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ —Б–Є–љ–µ—А–≥–Є—З–љ–Њ–Љ –і–µ–є—Б—В–≤–Є–Є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –љ—Г–Ї–ї–µ–Њ–Ј–Є–і–љ—Л—Е –∞–љ–∞–ї–Њ–≥–Њ–≤ –Є —Ж–Є–Ї–ї–Њ—Д–Њ—Б—Д–∞–Љ–Є–і–∞; –њ–Њ–і–Њ–±–љ—Л–µ —Б—Е–µ–Љ—Л –ї–µ—З–µ–љ–Є—П —Б —Г—Б–њ–µ—Е–Њ–Љ –≤ —В–µ—З–µ–љ–Є–µ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–Є —Г–ґ–µ –њ—А–Є–Љ–µ–љ—П—О—В—Б—П –≤ –Њ–љ–Ї–Њ–ї–Њ–≥–Є–Є. –І—В–Њ –Ї–∞—Б–∞–µ—В—Б—П –±–Њ–ї—М–љ—Л—Е –°–Ъ–Т, —В–Њ –њ–Њ—П–≤–Є–ї–Є—Б—М —Б–Њ–Њ–±—Й–µ–љ–Є—П –Њ–± —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –і–∞–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Г –±–Њ–ї—М–љ—Л—Е —Б –≤–Њ–ї—З–∞–љ–Њ—З–љ—Л–Љ –љ–µ—Д—А–Є—В–Њ–Љ, –і–Њ–Ї–∞–Ј–∞–љ–Њ –Є—Е —Б—В–µ—А–Њ–Є–і–—Б–±–µ—А–µ–≥–∞—О—Й–µ–µ –і–µ–є—Б—В–≤–Є–µ [63,64].
–Ф–Њ–ї–≥–Њ –Њ—Б–њ–∞—А–Є–≤–∞–ї—Б—П —Д–∞–Ї—В –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –Њ—А–∞–ї—М–љ—Л—Е –Ї–Њ–љ—В—А–∞—Ж–µ–њ—В–Є–≤–Њ–≤ –Є —Н—Б—В—А–Њ–≥–µ–љ––Ј–∞–Љ–µ—Б—В–Є—В–µ–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є —Г –±–Њ–ї—М–љ—Л—Е –°–Ъ–Т. –Ъ –љ–∞—Б—В–Њ—П—Й–µ–Љ—Г –≤—А–µ–Љ–µ–љ–Є –љ–µ –њ–Њ–ї—Г—З–µ–љ–Њ —Г–±–µ–і–Є—В–µ–ї—М–љ—Л—Е –і–∞–љ–љ—Л—Е –Њ –љ–µ–≥–∞—В–Є–≤–љ–Њ–Љ –≤–ї–Є—П–љ–Є–Є –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–∞ —В–µ—З–µ–љ–Є–µ –Њ—Б–љ–Њ–≤–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Љ–Њ–і—Г–ї—П—В–Њ—А–Њ–≤ —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤, –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–љ–∞—П –љ–∞ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л—Е –Љ–Њ–і–µ–ї—П—Е –°–Ъ–Т, –њ–Њ–Ј–≤–Њ–ї–Є–ї–∞ –њ–Њ––љ–Њ–≤–Њ–Љ—Г –≤–Ј–≥–ї—П–љ—Г—В—М –љ–∞ –њ–µ—А—Б–њ–µ–Ї—В–Є–≤—Л –Є—Е –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П —Г –ї—О–і–µ–є. –Ю–і–љ–∞–Ї–Њ –љ–µ–ї—М–Ј—П –Ј–∞–±—Л–≤–∞—В—М, —З—В–Њ —В–∞–Ї–∞—П —В–µ—А–∞–њ–Є—П –і–Њ–ї–ґ–љ–∞ –њ—А–Њ–≤–Њ–і–Є—В—М—Б—П —Б –Њ—Б—В–Њ—А–Њ–ґ–љ–Њ—Б—В—М—О –≤–≤–Є–і—Г –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ–≥–Њ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Њ–±–Њ—Б—В—А–µ–љ–Є—П –°–Ъ–Т –Є —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, –Њ—Б–Њ–±–µ–љ–љ–Њ —Г –±–Њ–ї—М–љ—Л—Е —Б–Њ –≤—В–Њ—А–Є—З–љ—Л–Љ –∞–љ—В–Є—Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–љ—Л–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ (–Р–§–°) [76–78].
–Э–∞–ї–Є—З–Є–µ —Г –±–Њ–ї—М–љ—Л—Е –°–Ъ–Т –≤—В–Њ—А–Є—З–љ–Њ–≥–Њ –Р–§–° —В–∞–Ї–ґ–µ –≤–љ–Њ—Б–Є—В —Б–≤–Њ–Є –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –≤ —Б—Е–µ–Љ—Л –ї–µ—З–µ–љ–Є—П. –Ю—Б–љ–Њ–≤–љ–Њ–є –Ј–∞–і–∞—З–µ–є —Г –і–∞–љ–љ–Њ–є –Ї–∞—В–µ–≥–Њ—А–Є–Є –±–Њ–ї—М–љ—Л—Е —П–≤–ї—П–µ—В—Б—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –њ–Њ–≤—В–Њ—А–љ—Л—Е —В—А–Њ–Љ–±–Њ–Ј–Њ–≤, –≤ —Б–≤—П–Ј–Є —Б —З–µ–Љ —И–Є—А–Њ–Ї–Њ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В—Л –љ–µ–њ—А—П–Љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П –Є –∞–љ—В–Є–∞–≥—А–µ–≥–∞–љ—В—Л. –С–Њ–ї—М—И–Є–µ –љ–∞–і–µ–ґ–і—Л –≤–Њ–Ј–ї–∞–≥–∞—О—В—Б—П –љ–∞ –≤–љ–µ–і—А–µ–љ–Є–µ –љ–Њ–≤—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ–Њ–є —В–µ—А–∞–њ–Є–Є —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –∞—А–≥–Є–љ–∞–ї–Њ–≤, –≥–Є—Г–Є–і–Є–љ–Њ–≤, –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ—Л—Е –њ–µ–њ—В–Є–і–Њ–≤ –Є –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ—Л—Е –∞–≥–µ–љ—В–Њ–≤ [75,79].
–Т–∞–ґ–љ—Л–Љ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–µ–Љ —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є —П–≤–ї—П–µ—В—Б—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –Є –ї–µ—З–µ–љ–Є–µ —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є (—А–∞–љ–љ–µ–≥–Њ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞, –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞, –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Є –і—А.), –Ї–Њ—В–Њ—А–∞—П –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –љ–µ –Љ–µ–љ–µ–µ –љ–µ–≥–∞—В–Є–≤–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –ґ–Є–Ј–љ–µ–љ–љ—Л–є –њ—А–Њ–≥–љ–Њ–Ј, —З–µ–Љ —Б–∞–Љ–∞ –°–Ъ–Т. –≠—В–Њ –Њ–њ—А–µ–і–µ–ї—П–µ—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М —И–Є—А–Њ–Ї–Њ–≥–Њ –≤–љ–µ–і—А–µ–љ–Є—П —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л—Е, –≥–Є–њ–Њ–ї–Є–њ–Є–і–µ–Љ–Є—З–µ—Б–Ї–Є—Е, –∞–љ—В–Є–Њ—Б—В–µ–Њ–њ–Њ—А–µ—В–Є—З–µ—Б–Ї–Є—Е –Є –∞–љ—В–Є–Љ–Є–Ї—А–Њ–±–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ [71–73]. –Я–Њ—Б–Ї–Њ–ї—М–Ї—Г –љ–µ–Ї–Њ—В–Њ—А—Л–µ –Є–Ј –љ–Є—Е, –љ–∞–њ—А–Є–Љ–µ—А —Б—В–∞—В–Є–љ—Л –Є –±–Є—Б—Д–Њ—Б—Д–Њ–љ–∞—В—Л, –Њ–±–ї–∞–і–∞—О—В –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є –Є –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї–Є—А—Г—О—Й–µ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О, –Є—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ –Љ–Њ–ґ–µ—В –њ–Њ–≤—Л—Б–Є—В—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—П [74].
–Э–µ —В–µ—А—П–µ—В —Б–≤–Њ–µ–є –∞–Ї—В—Г–∞–ї—М–љ–Њ—Б—В–Є –і–Є–µ—В–Є—З–µ—Б–Ї–Є–є —А–µ–ґ–Є–Љ, —В–∞–Ї –Ї–∞–Ї –Є–Љ–µ—О—В—Б—П –і–∞–љ–љ—Л–µ –Њ –≤–ї–Є—П–љ–Є–Є –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л—Е –≤–µ—Й–µ—Б—В–≤ –љ–∞ –Љ–µ—Е–∞–љ–Є–Ј–Љ —А–∞–Ј–≤–Є—В–Є—П –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П. –Я–Њ–љ–Є–ґ–µ–љ–љ–Њ–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –≤ –њ–Є—Й–µ –ї–Є–љ–Њ–ї–µ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –≤–µ–і–µ—В –Ї —Б–љ–Є–ґ–µ–љ–Є—О —Б–Є–љ—В–µ–Ј–∞ –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤ –Є –ї–µ–є–Ї–Њ—В—А–Є–µ–љ–Њ–≤, —З—В–Њ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ. –Я–Њ–≤—Л—И–µ–љ–Є–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –≤ –њ–Є—Й–µ –љ–µ–љ–∞—Б—Л—Й–µ–љ–љ—Л—Е –ґ–Є—А–љ—Л—Е –Ї–Є—Б–ї–Њ—В —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В–Є –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –Є —Д–Є–±—А–Њ–Ј–Њ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П [80]. –°–Є–љ–µ—А–≥–Є–Ј–Љ –і–Є–µ—В—Л –Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Љ–Њ–ґ–µ—В –Њ–Ї–∞–Ј–∞—В—М—Б—П –Ї—А–∞–є–љ–µ –њ–Њ–ї–µ–Ј–љ—Л–Љ —Г –±–Њ–ї—М–љ—Л—Е –°–Ъ–Т.
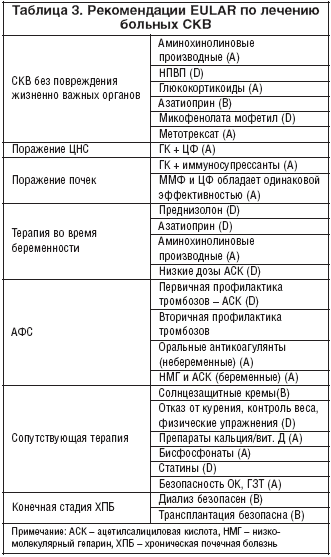
–°—В–∞–љ–і–∞—А—В–љ—Л–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ –ї–µ—З–µ–љ–Є—О –±–Њ–ї—М–љ—Л—Е –°–Ъ–Т, —Б —Г–Ї–∞–Ј–∞–љ–Є–µ–Љ —Г—А–Њ–≤–љ–µ–є –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ—Б—В–Є, –њ—А–Є–≤–µ–і–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ 3 [70].
–Ъ—Г—А–∞—Ж–Є—П –±–Њ–ї—М–љ—Л—Е –°–Ъ–Т –і–∞–ґ–µ –љ–∞ —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–Љ —Н—В–∞–њ–µ –њ—А–Њ–і–Њ–ї–ґ–∞–µ—В –Њ—Б—В–∞–≤–∞—В—М—Б—П –Њ–і–љ–Њ–є –Є–Ј –љ–∞–Є–±–Њ–ї–µ–µ —Б–ї–Њ–ґ–љ—Л—Е –њ—А–Њ–±–ї–µ–Љ —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є–Є. –Я–Њ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ —Б—Е–µ–Љ—Л –љ–µ –≤—Б–µ–≥–і–∞ —Г–і–Њ–≤–ї–µ—В–≤–Њ—А—П—О—В –Ї–ї–Є–љ–Є—Ж–Є—Б—В–Њ–≤. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Г –Љ–љ–Њ–≥–Є—Е –±–Њ–ї—М–љ—Л—Е –і–∞–ґ–µ —А–∞–љ–љ–µ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –∞–і–µ–Ї–≤–∞—В–љ—Л—Е –і–Њ–Ј –У–Ъ –Є —Ж–Є—В–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–µ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Є–Ј–±–µ–ґ–∞—В—М –љ–µ–Њ–±—А–∞—В–Є–Љ–Њ–≥–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П –≤–љ—Г—В—А–µ–љ–љ–Є—Е –Њ—А–≥–∞–љ–Њ–≤ –Є –љ–µ—А–µ–і–Ї–Њ –∞—Б—Б–Њ—Ж–Є–Є—А—Г–µ—В—Б—П —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ —В—П–ґ–µ–ї—Л—Е, –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ —Б–Љ–µ—А—В–µ–ї—М–љ—Л—Е –њ–Њ–±–Њ—З–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є. –С–Њ–ї—М–љ—Л–µ –°–Ъ–Т –љ—Г–ґ–і–∞—О—В—Б—П –≤ –∞–і–µ–Ї–≤–∞—В–љ–Њ–Љ –Ї–Њ–љ—В—А–Њ–ї–µ –љ–µ —В–Њ–ї—М–Ї–Њ –Њ—Б–љ–Њ–≤–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –љ–Њ –Є –≤ –Ї–Њ—А—А–µ–Ї—Ж–Є–Є —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є. –Э–µ—А–µ–і–Ї–Њ –≤–Њ–Ј–љ–Є–Ї–∞—О—В –њ–Њ–Ї–∞–Ј–∞–љ–Є—П –Ї –љ–∞–Ј–љ–∞—З–µ–љ–Є—О –і–µ—Б—П—В–Ї–∞ –Є –±–Њ–ї–µ–µ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П –Ї–Њ—В–Њ—А—Л—Е —В–∞–Ї–ґ–µ —Б–ї–µ–і—Г–µ—В —Г—З–Є—В—Л–≤–∞—В—М.
–°—Г–Љ–Љ–Є—А—Г—П –≤—Л—И–µ—Б–Ї–∞–Ј–∞–љ–љ–Њ–µ, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –≤—Б–µ –±–Њ–ї—М–љ—Л–µ —Б –Љ–Њ–Љ–µ–љ—В–∞ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –і–Є–∞–≥–љ–Њ–Ј–∞ –°–Ъ–Т –љ—Г–ґ–і–∞—О—В—Б—П –≤ –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –У–Ъ –Є –Р–Я. –Я—А–Є –љ–∞–ї–Є—З–Є–Є –њ–Њ–Ї–∞–Ј–∞–љ–Є–є –Ї —В–µ—А–∞–њ–Є–Є –і–Њ–±–∞–≤–ї—П—О—В—Б—П —Ж–Є—В–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є–µ –њ—А–µ–њ–∞—А–∞—В—Л, –њ—А–Њ–≤–Њ–і–Є—В—Б—П –њ—Г–ї—М—Б–—В–µ—А–∞–њ–Є—П –Є–ї–Є –і—А—Г–≥–Є–µ –Є–љ—В–µ–љ—Б–Є–≤–љ—Л–µ –Љ–µ—В–Њ–і—Л –ї–µ—З–µ–љ–Є—П, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –≥–µ–љ–љ–Њ––Є–љ–ґ–µ–љ–µ—А–љ—Л—Е –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ (—В–∞–±–ї. 4). –Я—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–µ –≤–∞—А–Є–∞–љ—В—Л –°–Ъ–Т —Б –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ –ґ–Є–Ј–љ–µ–љ–љ–Њ –≤–∞–ґ–љ—Л—Е –Њ—А–≥–∞–љ–Њ–≤ —В—А–µ–±—Г—О—В –љ–µ–Ј–∞–Љ–µ–і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ —А–µ—И–µ–љ–Є—П –Њ–± –Є–љ—В–µ–љ—Б–Є—Д–Є–Ї–∞—Ж–Є–Є –ї–µ—З–µ–љ–Є—П –Є –Њ–± –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –∞–≥—А–µ—Б—Б–Є–≤–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤. –Т—Б–µ –±–Њ–ї—М–љ—Л–Љ –°–Ъ–Т —Б –і–µ–±—О—В–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ–Њ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–Љ –њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ –і–ї—П –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–є —В–µ—А–∞–њ–Є–Є.
–Ф–Њ—Б—В–Є–ґ–µ–љ–Є–µ –Њ—Б–љ–Њ–≤–љ–Њ–є —Ж–µ–ї–Є –ї–µ—З–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е –°–Ъ–Т – —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Є –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є – –Њ–њ—А–µ–і–µ–ї—П–µ—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –Є–Ј—Г—З–µ–љ–Є—П –љ–Њ–≤—Л—Е –њ–Њ–і—Е–Њ–і–Њ–≤ –Ї —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є –°–Ъ–Т –Ј–∞ —Б—З–µ—В –≤–љ–µ–і—А–µ–љ–Є—П –љ–Њ–≤—Л—Е —Б—Е–µ–Љ –Є –љ–Њ–≤—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤.


–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. Merrell M., Shulman L.E. Determination of prognosis in chronic disease, illustrated by systemic lupus erythematosus. J.Chronic Dis., 1955, 1, 12–32.
2. Abu–Shakra M., Urowitz M.B., Gladman D.D., Gough J. Mortality studies in systemic lupus erythematosus. Results from a single center.1. Causes of death. J.Rheum., 1995, 22, 7, 1259–1264.
3. Pistiner M., Wallace D.J., Nessim S. et al. Lupus erythematosus in the 1980s: a survey of 570 patients. Sem.Arthr. Rheum., 1991, 21, 55–64.
4. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є. –†–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є—П. 2––µ –Є–Ј–і–∞–љ–Є–µ, –Є—Б–њ—А–∞–≤–ї–µ–љ–љ–Њ–µ –Є –і–Њ–њ–Њ–ї–љ–µ–љ–љ–Њ–µ. –Я–Њ–і —А–µ–і. –∞–Ї–∞–і. –†–Р–Ь–Э –Х.–Ы.–Э–∞—Б–Њ–љ–Њ–≤–∞. –Ь–Њ—Б–Ї–≤–∞, «–У–≠–Ю–Ґ–Р–†––Ь–µ–і–Є–∞», 2010.
5. Parker B.J., Bruce I.N. High dose methylprednisolone therapy for the treatment of severe systemic lupus erythematosus. Lupus, 2007, v. 16., p. 387–393.
6. –Ы–µ—З–µ–љ–Є–µ —А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —Г–і–∞—А–љ—Л–Љ–Є –і–Њ–Ј–∞–Љ–Є –Љ–µ—В–Є–ї–њ—А–µ–і–љ–Є–Ј–Њ–ї–Њ–љ–∞. –Я–Њ—Б–Њ–±–Є–µ –і–ї—П –≤—А–∞—З–µ–є. –Я–Њ–і —А–µ–і. –∞–Ї–∞–і. –†–Р–Ь–Э, –њ—А–Њ—Д. –Т.–Р. –Э–∞—Б–Њ–љ–Њ–≤–Њ–є. –Ъ–Є–µ–≤, 2006, 1–28.
7. Clements P.J., Davis J. Cytotoxic drugs: their clinical application to the rheumatic diseases. Sem. Arthr. Rheum., 1986, 15 (4), 231–254.
8. Dooley M.A., Cosio F.G., Nachman P.H. et al. Mycophenolate mofetil therapy in lupus nephritis: clinical observations. J Am Soc Nephrol., 1999, 10, 833–839.
9. Karim M.Y., Alba P., Cuadrado M.J. et al. Mycophenolate mofetil for systemic lupus erythematosus refractory to other immunosuppressive agents. Rheum. (Oxford), 2002, 41, 876–882.
10. Moore R.A., Derry S./ Systematic review and meta–analysis of randomized trials and cohort studies of mycophenolate mofetil in lupus nephritis//Arthr. Res.& Ther., 2006, 8, R 182.
11. Boumpas D.T., Sidiropoulos P., Bertsias G./Optimum therapeutic approaches for lupus nephritis: what therapy and for whom?//Nat.Clin. Pract. Rheum., 2005, 1 (1), 22–30.
12. Tse K.C., Tang C.S.O., Lio W.I. et al. / Quality of life comparison between corticosteroid–and–mycophenolate mofetil and corticosteroid–and–oral cyclophosphamide in the treatment of severe lupus nephritis//Lupus, 2006, 15, 371–379.
13. Robson R., Cecka J.M., Opelz G./Prospective registry–based observational cohort study of the long–term risk of malignancies in renal transplant patients treared with mycophenolate mofetil//Am. J.Trans., 2005, 5, 2954–2960.
14. Dissanayake I.R., Goodman G.R., Bowman A.R. et al./ Mycophenolate mofetil: a promising new immunosuppressant that does not cause bone loss in the rat// Transplantation, 1998, 65, 275–278.
15. Chambers S.A., Isenberg D.A./ Anti–B cell therapy (Rituximab) in the treatment of autoimmune disease// Lupus, 2005, 14, 210–214.
16. Vasoo S., Hughes G.R.V./ Theory, targets and therapy in systemic lupus erythematosus// Lupus, 2005, 14, 181–188.
17. Jonson P., Glennie M./ The mechanisms of action of Rituximab in the elimination of tumor cells// Semin. Oncol., 2003, Feb, 30 (suppl. 2), 3–8.
18. Anolik J.H., Barnard J., Cappione A. Et al./ Rituximab improves peripheral B cell abnormalities in human systemic lupus erythematosus// Autoimmunity Rev., 2006, 5, 18–24.
19. –Э–∞—Б–Њ–љ–Њ–≤ –Х.–Ы./ –Э–Њ–≤—Л–µ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є—П —В–µ—А–∞–њ–Є–Є —А–µ–≤–Љ–∞—В–Њ–Є–і–љ–Њ–≥–Њ –∞—А—В—А–Є—В–∞: –њ–µ—А—Б–њ–µ–Ї—В–Є–≤—Л –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Љ–Њ–љ–Њ–Ї–ї–Њ–љ–∞–ї—М–љ—Л—Е –∞–љ—В–Є—В–µ–ї –Ї –Т––ї–Є–Љ—Д–Њ—Ж–Є—В–∞–Љ (–†–Є—В—Г–Ї—Б–Є–Љ–∞–±)// –†–Ь–Ц, 2006, 14 (25), 1178–1782.
20. –°–Њ–ї–Њ–≤—М–µ–≤ –°.–Ъ., –Ъ–Њ—В–Њ–≤—Б–Ї–∞—П –Ь.–Р., –Э–∞—Б–Њ–љ–Њ–≤ –Х.–Ы./ –†–Є—В—Г–Ї—Б–Є–Љ–∞–± –≤ –ї–µ—З–µ–љ–Є–Є —Б–Є—Б—В–µ–Љ–љ–Њ–є –Ї—А–∞—Б–љ–Њ–є –≤–Њ–ї—З–∞–љ–Ї–Є// –†–Ь–Ц, 2005, 13 (26), 1731–1735.
21. Sfikakis P.P., Boletis J.N., Tsokos G.C./ Rituximab anti–B–cell therapy in systemic lupus erythematosus: pointing to the future// Curr.Opin. Rheum., 2005, 17, 550–557.
22. –Э–∞—Б–Њ–љ–Њ–≤ –Х.–Ы., –°–Њ–ї–Њ–≤—М–µ–≤ –°.–Ъ./ –Я–µ—А—Б–њ–µ–Ї—В–Є–≤—Л –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Љ–Њ–љ–Њ–Ї–ї–Њ–љ–∞–ї—М–љ—Л—Е –∞–љ—В–Є—В–µ–ї –Ї –Т––ї–Є–Љ—Д–Њ—Ж–Є—В–∞–Љ (–†–Є—В—Г–Ї—Б–Є–Љ–∞–±) –њ—А–Є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е —А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е// –Э–∞—Г—З–љ.––њ—А–∞–Ї—В. –†–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є—П, 2007,1, 4–8.
23. Yu Z., Lennon V.A./ Mechanism of intravenous immunoglobulin therapy in antibody–mediated autoimmune disease//N.Engl. J. Med., 1999, 340, 227–228.
24. Toubi E., Kessel A., Shoenfeld Y./ High–dose intravenous immunoglobulins: an option in the treatment of systemic lupus erythematosus// Hum. Immunol., 2005, 66, 395–402.
25. Orbach H., Tishler M., Shoenfeld Y./ Intravenous immunoglobulin and the kidney – a two–edged sword// Sem. Arthr. Rheum., 2004, 34, 593–601.
26. –Э–∞—Б–Њ–љ–Њ–≤ –Х.–Ы./–Р–љ—В–Є–Љ–∞–ї—П—А–Є–є–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л. –Т –Ї–љ. «–Я—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–∞—П —В–µ—А–∞–њ–Є—П —А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є//–Ь–Њ—Б–Ї–≤–∞, «–Ь––°–Є—В–Є», 1996, 169–182.
27. Callen J.P./ Management of skin disease in patients with lupus erythematosus// Best. Pract. Res. Clin. Rheum., 2002, 16 (2), 245–264.
28. Dubois E.L./Antimalarials in the management of discoid and systemic lupus erythematosus//Sem. Arthr. Rheum., 1978, 8, 35–51.
29. Rudnicki R.D., Greshman G.E., Rothfield N.F./ The efficacy of antimalatials in systemic lupus erythematosus//J. Rheum., 1975,2, 323–330.
30. Rothfield N./ Efficacy of antimalarials in systemic lupus erythematosus// Am.J.Med., 1988, 85 (suppl. 4A), 53–56.
31. Canadian Hydroxychloroquine Study Group. A randomized study of the effect of withdrawing hydroxychloroquine sulfate in systemic lupus erythematosus// N.Engl. J.Med., 1991, 324, 150–154.
32. Canadian Hydroxychloroquine Study Group. A long–term study of hydroxychloroquine withdrawal on exacerbation in systemic lupus erythematosus// Lupus, 1998, 7, 80–85.
33. Wallace D. Does hydroxychloroquine sulfate prevent clot formation in systemic lupus erythematosus?//Arthr. Rheum., 1987, 30, 1435–1436.
34. Petri M., Hellmann D., Hochberg M. et al./ Arterial thrombotic events (TE) in SLE; the Baltimore Lupus Cohort study// Arthr. Rheum., 1994, 37, S297.
35. Petri M., Hochberg M., Hellman D. et al./ Incidence and predictors of thrombotic events in SLE: protective role of hydroxychloroquine// Arthr. Rheum., 1992, 35, 54–55.
36. Ruiz–Irastorza G., Egurbide M.V., Pijoan J.I. et al./ Effect of antimalarials on thrombosis and survival in patients with systemic lupus erythematosus// Lupus, 2006, 15, 577–583.
37. Pons–Estel G.J., Danila M., McGwin G. et al./ Protective effect of hydroxychloroquine on renal damage in patients with systemic lupus erythematosus: data from a multiethnic cohort// Presented at ACR 2008 meeting, San Francisco, California, 2008, presentation 2061. www.newswise.com/articles/view/545511/ –Њ—В 31.08.2010.
38. Kasitanon N., Fine D.M., Haas M. et al./ Hydroxychloroquine use predicts complete renal remission within 12 month among patients treated with mycophenolate mofetil therapy for membranous lupus nephritis// Lupus, 2006, 15, 366–370.
39. Molad I., Gorshtein A., Wysenbeek A.J. et al./ Protective effect of hydroxychloroquine in systemic lupus erythematosus. Prospective long–term study of an Israeli cohort// Lupus, 2002, 11 (6), 356–361.
40. Fessler B.J., Alrcon G.S., McGwin G. et al./ Systemic lupus erythematosus in three ethnic groups: XYI. Association of hydroxychloroquine use with reduced risk of damage accrual// Arthr. Rheum., 2005, 52, 1473–1480.
41. Alarcon G.S., McGwin G., Bertoli A. et al./ Effect of hydroxychloroquine on the survival of patients with systemic lupus erythematosus: data from LUMINA, a multiethnic US cohort// Ann.Rheum.Dis., 2007, 66, 1168–1172.
42. Ruiz–Irastorza G., Egurbide M., Pijoan J. et al./ Effects of antimalarials on thrombosis and survival in patients with systemic lupus erythematosus// Lupus, 2006, 15, 577–583.
43. Ruiz–Irastorza G., Ugarte A., Egurbide M.V. et al./ Antimalarials may influence the risk of malignancy in systemic lupus erythematosus// Ann Rheum Dis 2007, 66: 815–817.
44. Wallace D.J., Metzger A.L., Stecher V.J. et al./ Cholesterol–lowering effect of hydroxychloroquine in patients with rheumatic diseases: a reversial of deleterious effects of steroids on lipids//Am.J.Med., 1990, 89, 322–326.
45. Hodis H.N., Quismorio J., Wickham E./ The lipid, lipoprotein, and apolipoprotein effects of hydroxychloroquine in patients with systemic lupus erythematosus// J.Rheum., 1993, 20, 661–665.
46. Mok C., Mak A., Ma K./ Bone mineral density in postmenopausal Chinese patients with systemic lupus erythematosus// Lupus, 2005, 14, 106–112.
47. Lakshminarauanan S., Walsh S., Mohanraj M., Rothfield N./ Factors associated with low bone mineral density in female patients with systemic lupus erythematosus// J. Rheum., 2001, 28, 102–108.
48. Shojania K., Koehler B.E., Elliott T./ Hypoglykemia induced by hydroxychloroquine in a type II diabetic treated for polyarthritis// J. Theum., 1999, 26 (1), 195–196.
49. Quatraro A., Consoli G., Magno M. et al./ Hydroxychloroquine in decompensated, treatment–refractory noninsulin–dependent diabetes mellitus: a new job for an old drug?// Ann. Intern/ Med., 1990, 112 (9), 678–681.
50. Wasko M., Hubert H., Lingala V. et al./ Hydroxychloroquine and risk of diabetes in patients with rheumatoid arthritis// JAMA, 2007, 298 (2), 187–193.
51. Parke A.L., West B./ Hydroxychloroquine in pregnant patients with systemic lupus erythematosus// J. Rheum., 1996, 23, 1715–1718.
52. Ruiz–Irastorza G., Khamashta M.A. Lupus and pregnancy: ten questions and some answers. Lupus, 2008, 17 (5), 416–420.
53. Levy M., Buskila D., Gladman D.D. et al./ Pregnancy outcome following first trimester exposure to chloroquine// Am. J. Perinat., 1991, 174–178.
54. Parke A.L., Rothfield N.F./ Antimalarial drugs in pregnancy: the North American experience// Lupus, 1996, 5, 567–569.
55. Levy R.A., Vilela V.S., Cataldo M.J. et al./ Hydroxychloroquine in lupus pregnancy: double–blind and placebo–controlled study// Lupus, 2001, 10, 401–404.
56. Costedoat–Chalumeau N., Amoura Z., Huong D.L. et al./ Safety of hydroxychloroquine in pregnant patients with connective tissue diseases: a review of literature// Autoimmun. Rev., 2005, 4, 111–115.
57. Fries J.F., Williams C.A., Ramey D., Bloch D.A./ The relative toxicity of disease–modifying antirheumatic drugs// Arthr. Rheum., 1993, 36, 297–306.
58. Easterbrook M./ An ophthalmological view on the efficacy and safety of chloroquine versus hydroxychloroquine// J. Rheum., 1999, 26, 1866–1867.
59. Rynes R.I./ Antimalarial drugs in the treatment of rheumatological diseases// Br.J.Rheum., 1997, 36, 799–805.
60. Rolain J.M., Colson P., Raoult D. Recycling of chloroquine and its hydroxyl analogue to face bacterial, fungal and viral infections in the 21th century. Int.J. Antimicrob. Agents, 2007, 30, 297–308.
61. Ruiz–Irastorza G., Egurbide M.V., Olivarez N. Vitamin D deficiency in systemic lupus erythematosus: prevakence, predictors and clinical consequences. Rheum., 2008, 47, 920–923.
62. Appel G.B., Contreras G., Dooley M.A. et al. Mycophenolate mofetil versus Cyclophosphamide for induction treatment of lupus nephritis. J.Am.Soc. Nephrol., 2009, 20, 1103–1112.
63. Illei G.G., Yarboro C.H., Kuroiwa T. et al. Long–term effects of combination treatment with fludarabine and low–dose pulse cyclophosphamide in patients with lupus nephritis. Rheumatology 2007, 46: 952–956.
64. Kawasaki Y. Mizoribine^ a new approach in the treatment of renal disease. Clin. And Develop. Immunology, 2009.
65. Hughes G. Rituximab: an update. Lupus, 2007, 16, 529–531.
66. Safety and efficacy of leflunomide in the treatment of lupus nephritis refractory or intolerant to traditional immunosuppressive therapy: an open label trial. Ann. Rheum. Dis., 2006, 65, 417–418.
67. Chatham W.W., Kimberly R.P. Treatment of lupus with corticosteroids. Lupus, 2001, 10, 140–147.
68. Parker B.J., Bruce I.N. High dose methylprednisolone therapy for the treatment of severe systemic lupus erythematosus. Lupus, 2007, 16, 387–393.
69. Hoes J.N., Jacobs J.W.G., Boers M. EULAR evidence–based recommendations on the management of systemic glucocorticoid therapy in rheumatic diseases. Ann. Rheum. Dis., 2007, 66, 1560–156.
70. Bertsias G.K., Ioannidis J.P.A., Bombardieri S., et al. EULAR recommendations for the management of Systemic Lupus Erythematosus. Report of a Task Force of the European Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann. Rheum. Dis., 2008, 67, 195–205.
71. Austin H.A., Klippel J.H., Balow J.E. et al. Therapy of lupus nephritis. Controlled trial of prednisone and cytotoxic drugs. N. Engl. J.Med., 1986. 314, 614–619.
72. Wajed J., Ahmad Y., Durington P.N. Prevention of cardiovascular disease in systemic lupus erythematosus – proposed guidelines for risk factor management. Rheum., 2003, 43, 7–12.
73. Haubitz M. Exploring new territory: the move towards individualized treatment. Lupus, 2007, 16, 227–231.
74. Yeap S.S., Fauzi A.R., Kong N. et al. A comparison of calcium, calcitriol and alendronate in corticosteroid–treated premenopausal patients with systemic lupus erythematosus. J.Rheum., 2008, 35, 2344–2349.
75. Ruiz–Irastorza G., Hunt B., Khamashta M. A systematic review of secondary thromboprophylaxis in patients with antiphospholipid antibodies. Arthr. Rheum., 2007, 57 (8), 1487–1495.
76. Petri M. Sex hormones and systemic lupus erythematosus. Lupus, 2008, 17, 412–415.
77. Petri M., Kim M.Y., Kalumian K.C. et al. Combined oral contraceptives in women with systemic lupus erythematosus. N Engl. J/ Med., 2005, 353, 2550–2558.
78. Buyon J., Petri M., Kim M. et al. The effect of combined estrogen and progesterone hormone replacement therapy on disease activity in systemic lupus erythematosus: a randomised trial. Ann. Intern. Med., 2005, 142, 953–962.
79. Lockshin M.D., Derksen R. New developments in lupus–associated antiphospholipid syndrome. Lupus, 2008, 17, 443–446.
80. Langley–Evans S.C., Carrington L.J. Diet and the developing immune system. Lupus, 2006, 15 (11), 746–752.
81. Wallace D.J./ Management of lupus erythematosus: recent insigtns// Current Opin. In Rheum., 2002, 14, 212–219.
82. Bansal VK, Beto JA. Treatment of lupus nephritis, a meta–analysis of clinical trials. Am J Kidney Dis 1997:29:193–9.
83. Flanc RS, Roberts MA, Strippoli GFM et al. Treatment for lupus nephritis. In: The Cochrane Library, Issue 2, 2004. www.cochrane.org/review/on/ab002922.html –Њ—В 31.08.2010.
84. Houssiau F./ Thirty years of cyclophosphamide: assessing the evidence// Lupus, 2007, 16, 212–216.
85. Contreras G., Tozman E., Nahar N., Metz D. Maintenance therapies for proliferative lupus nephritis: mycophenolate mofetil, azathioprine and intravenous cyclophosphamide. Lupus, 2005, 14, 33–38.
86. Nossent, HC, Koldingsnes, W. Long–term efficacy of azathioprine treatment for proliferative lupus nephritis. Rheumatology (Oxford) 2000; 39:969.
87. Goebel, KM, Gassel, WD, Goebel, FD. Evaluation of azathioprine in autoimmune thrombocytopenia and lupus erythematosus. Scand J Haematol 1973; 10:28.
88. Callen JP, Spencer LV, Bhatnagar Burruss J, et al. Azathioprine: an effective, corticosteroid–sparing therapy for patients with recalcitrant cutaneous lupus erythematosus or with recalcitrant cutaneous leukocytoclastic vasculitis. Arch Dermatol 1991; 127: 515–522.
89. Callen JP. Treatment of cutaneous lesions in patients with lupus erythematosus. Dermatol Clin 1994; 12:201–206.
90. Carneiro JRM, Sato El. Double blind, randomised, placebo controlled clinical trial of methotrexate in systemic lupus erythematosus. J Rheumatol 1999; 26: 1275–9.
91. –Э–∞—Б–Њ–љ–Њ–≤ –Х.–Ы. –Ь–µ—В–Њ—В—А–µ–Ї—Б–∞—В. –Я–µ—А—Б–њ–µ–Ї—В–Є–≤—Л –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –≤ —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є–Є//–Ь., –§–Є–ї–Њ–Љ–∞—В–Є—Б, 2005, 154–179.
92. Chen Q., Liu Z., Hu W. et al. Class Y lupus nephritis: a clinicopathologic study in 152 patients. J. Nephrol., 2003, 16, 126–132.
93. Sugiyama –Ь., –Юgasawara –Э, Kaneko H et al. Effect of extremely low dose cyclosporine treatment on the thrombocytopenia in systemic lupus erythematosus. Lupus, 1998; 7 (1):53–56.












