В последние десятилетия в ревматологии произошли существенные изменения, связанные в первую очередь с активным внедрением в клиническую практику так называемых генно–инженерных биологических препаратов (ГИБП), действие которых направлено на специфические компоненты патогенеза ревматических заболеваний (РЗ). По мере накопления мирового клинического опыта стало понятно, что применение этих препаратов ассоциируется с нарастающим риском развития инфекций разнообразной природы и локализации.
На сегодняшний день механизмы, лежащие в основе нарастания риска инфекций, обусловленных применением ГИБП, до конца не раскрыты. Однако восприимчивость больных к определенным типам инфекций может быть объяснена тем, что «мишенями» указанных препаратов являются ключевые компоненты иммунной защиты человека, а именно фактор некроза опухоли–a (ФНО–a), интерлейкин–1, интерлейкин–6 (ИЛ–6), В– и Т–лимфоциты и др.
Обсуждение вопросов, связанных с ассоциацией «ГИБП–инфекции», необходимо вести с учетом фонового риска развития инфекционных осложнений, обусловленного как наличием аутоиммунного РЗ, так и необходимостью назначения иных широко применяемых антиревматических препаратов, обладающих иммуносупрессивным действием.
О высокой частоте коморбидных инфекций (КИ), осложняющих течение РА, известно в течение последних 45 лет. КИ у больных РА развиваются в 1,5 раза чаще, чем в популяции, и занимают 2–3–е место по частоте среди причин смерти этих пациентов [1]. По данным российских исследований, в 2002–2005 гг. (т.е. до активного применения ГИБП) частота КИ у стационарного контингента больных составляла 9,7%. При этом частота вторичных инфекций была максимальной среди пациентов с ревматоидным артритом (РА) – 38,1% [2].
В соответствии с результатами когортного исследования к наиболее частым инфекционным осложнениям РА относятся (в порядке убывания): септический артрит, остеомиелит, инфекции кожи и мягких тканей, пневмония [3]. По данным этих же авторов, основными предикторами развития КИ при РЗ являются хронические заболевания легких, лейкопения, внесуставные проявления болезни, наличие ревматоидного фактора, увеличение СОЭ, а также лечение глюкокортикоидами [4]. В ходе годового проспективного исследования показано, что применение метотрексата у больных РА вело к достоверному повышению общего числа вторичных КИ по сравнению с контролем (62,5 и 47% соответственно, р<0,05) [5].
Ингибиторы фактора некроза
опухоли–a
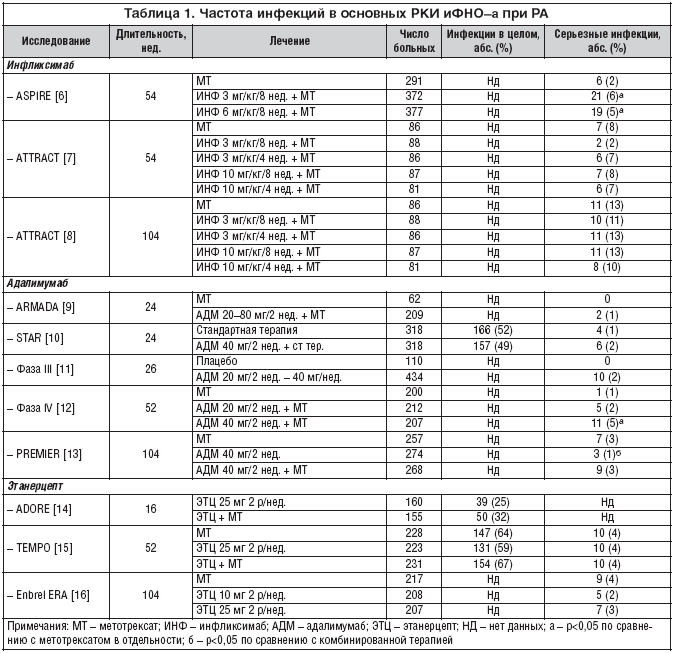
Открытие основных провоспалительных цитокинов, прежде всего фактора некроза опухоли–a (ФНО–a), привело к созданию группы препаратов (инфликсимаб, адалимумаб, этанерцепт), блокирующих его действие. Применение ингибиторов ФНО–a (иФНО–a), в первую очередь при РА, имело большой успех. Однако в ходе клинических исследований была выявлена такая проблема, как увеличение частоты развития и тяжести течения инфекций, включая оппортунистические (инвазивные микозы, пневмоцистная пневмония и др.), а также повышенный риск реактивации латентной инфекции, в первую очередь туберкулеза (ТВ). Помимо этого регистрировались случаи тяжелых инфекций (пневмония, сепсис, бактериальный артрит, поражение кожи и мягких тканей и др.), в том числе с летальным исходом. Данные, касающиеся риска развития инфекций, были весьма противоречивыми. Так, в большинстве рандомизированных контролируемых исследований (РКИ) указывалось на низкую частоту развития тяжелых инфекций, схожую с таковой для иных БПВП (в частности, метотрексата) или в целом для больных РА (табл. 1). В то же время применение иФНО–α в реальной клинической практике при РА и других РЗ привело к явному нарастанию частоты инфекций, включая тяжелые. В ходе рандомизированного исследования, включавшего 709 пациентов с различными РЗ, британские авторы констатировали, что при активном применении иФНО–α в период с 1997 по 2004 г. частота развития серьезных инфекций, т.е. требовавших госпитализации и парентерального применения антибиотиков, возросла с 3,4 до 10,5 на 100 пациенто–лет [17]. Еще более впечатляющи данные швейцарских исследователей, согласно которым на фоне терапии инфликсимабом и этанерцептом серьезные инфекции развились в 18,3% случаев. При этом ежегодная частота серьезных инфекций у больных РА при лечении указанными ГИБП увеличилась с 0,008 до 0,181 на 100 пациенто–лет, т.е. в 22 (!) раза [18].
По данным крупного когортного исследования, включавшего более 5 тыс. больных РА, риск развития верифицированных бактериальных инфекций у пациентов, получавших иФНО–α, по сравнению с таковыми, принимавшими метотрексат, был в 2 раза выше в целом и в 4 раза выше в течение первых 6 мес. терапии [19].
Повышенная частота развития инфекционных осложнений при лечении иФНО–α подтверждается данными национальных регистров. Так, среди больных РА, включенных в Британский регистр биологических препаратов, частота серьезных инфекционных осложнений в течение первых 90 дней терапии иФНО–α превышала таковую при лечении БПВП как в целом, так и для этанерцепта, инфликсимаба и адалимумаба в отдельности (в 4,6, 4,1, 5,6 и 3,9 раза соответственно) [20]. По данным Германского регистра, частота развития серьезных бактериальных инфекций при лечении РА этанерцептом составила 6,4, инфликсимабом – 6,2, БПВП – 2,3 на 100 пациенто–лет (р=0,016) [21]. Анализ данных Шведского регистра показал, что частота развития серьезных инфекций на фоне стартовой иФНО–α–терапии составила 5,4, а при неэффективности последней и замене одного иФНО–α на другой – 10 на 100 пациенто–лет [22]
Учитывая, что ФНО–α играют ключевую роль в формировании гранулемы посредством индукции апоптоза и в ее сохранении, предполагается, что блокирование этого цитокина ведет к развитию (или обострению уже имеющейся) гранулематозной инфекции. В этом отношении достаточно показательны результаты исследования J. Keane et al., основанного на анализе базы данных AERS (Adverse Effects Report System) Американской комиссии по надзору за пищевыми продуктами и лекарствами (Food&Drug Administration – FDA), куда стекаются все спонтанные сообщения о нежелательных реакциях как от врачей, так и от производителей препаратов. Оказалось, что на фоне активного внедрения инфликсимаба в лечение больных РА частота активной ТВ–инфекции увеличилась в 4 раза [23]. По данным испанского регистра BIOBADASER, частота активного ТВ у больных РА на фоне лечения иФНО–α возрастала в 6,2 раза [24]. В Швеции за период 1999–2001 гг. констатировано 4–кратное увеличение риска развития ТВ [25]. В результате 3–летнего проспективного исследования, выполненного во Франции (RATIO), выявлено 69 новых случаев ТВ у больных РЗ, получавших иФНО–a. Из них 36 больных получали инфликсимаб, 28 – адалимумаб и 5 – этанерцепт. При анализе методом «случай–контроль» оказалось, что применение инфликсимаба или адалимумаба сопровождалось повышением риска ТВ–инфекции по сравнению с этанерцептом, в 13,3 и 17,1 раза соответственно. По мнению исследователей, данный факт обусловлен различиями в механизме действия двух видов иФНО–a на мембранно–связанный ФНО и, следовательно, различным влиянием на эффекторные и регуляторные Т–клетки. Другими факторами риска развития ТВ были возраст, первый год лечения иФНО–a и проживание в эндемичном регионе [26]. Сходные данные представлены в Британском регистре биологических препаратов, где активная ТВ–инфекция диагностирована у 29 больных, получавших иФНО–a. По сравнению с этанерцептом риск развития ТВ возрастал в 2,84 раза для инфликсимаба и в 3,53 – для адалимумаба [27]. Предполагается, что на ранних этапах лечения иФНО–a происходит реактивация латентного ТВ–процесса, а в более поздние сроки – развитие ТВ–инфекции de novo. У таких пациентов могут вознинуть проблемы в лечении ТВ, обусловленные низкой эффективностью стандартных терапевтических схем [28].
Вышеизложенное вызвало необходимость разработки рекомендаций по раннему выявлению, диагностике и профилактике ТВ при планировании и проведении иФНО–a – терапии у больных РЗ. В настоящее время соответствующие рекомендации разработаны и внедрены в клиническую практику в различных странах, в т.ч. в России [29].
Данные исследований, касающихся применения иФНО–a у больных, инфицированных вирусом гепатита В (HBV) и С (HCV), представляются неоднозначными. В частности, у больных с HBV показана важная роль ФНО–a в клиренсе и, при взаимодействии с интерфероном, подавлении вирусной репликации. Следовательно, ингибиция ФНО–a может привести к снижению элиминации и нарастанию репликации HBV и, таким образом, к рецидиву гепатита. Подтверждением этому служат описания случаев реактивации HBV–инфекции, ведущей к развитию фульминантного гепатита у больных РА и болезнью Стилла на фоне терапии инфликсимабом [30,31]. В соответствии с опубликованным в 2008 г. консенсусом по применению ГИБП при РЗ назначение иФНО–a не показано больным с верифицированной HBV–инфекцией [32]. Однако ряд авторов полагает, что при наличии четких показаний и отсутствии альтернативы иФНО–a–терапия может быть (с осторожностью!) проведена у HBV–носителей при обязательном профилактическом применении противовирусных препаратов расширенного спектра (ламивудин, энтекавир и др.). Последние назначают за 2–4 недели до начала иФНО–a–терапии и продолжают по меньшей мере 6–12 мес. после ее окончания [33,34].
Случаи реактивации HCV при лечении ГИБП на сегодняшний день не описаны. Тем не менее интерес исследователей к этой проблеме по–прежнему велик. Известно, что ФНО–a наряду с другими провоспалительными цитокинами вырабатывается при HCV–инфекции и, следовательно, играет важную роль в естественном течении болезни. Показано, что ФНО–a может индуцировать продукцию трансформирующего фактора роста–b, экспрессия которого тесно связана с гистологической выраженностью активности процесса и долькового некроза у больных с хронической HCV–инфекцией. Более того, высокие уровни ФНО–a оказывают негативное влияние на ответ макроорганизма больного HCV при терапии интерфероном [35]. Следовательно, блокирование ФНО–a могло бы иметь благоприятные последствия для больных с HCV–инфекцией. Показано, что комбинация этанерцепта со стандартной противовирусной терапией (интерферон + рибавирин) приводила к более благоприятному результату (p=0,04) [36]. Однако длительность терапии в этом исследовании не превышала 3–9 мес. Для окончательной оценки безопасности применения иФНО–a, равно и других ГИБП при РЗ в сочетании с HCV, необходимы крупномасштабные исследования с более длительными сроками лечения и наблюдения.
Таким образом, повышенный риск развития инфекций – это нежелательное явление, специфичное для всей группы иФНО–a. Наличие его в целом не зависит от конкретного механизма блокады ФНО, технологии производства, способа введения и других характеристик препарата. Частота серьезных бактериальных инфекций при лечении иФНО–a возрастает в 2–4 раза, особенно в первые 90 дней лечения, и увеличивается при сочетании с метотрексатом. По данным плацебо–контролируемых исследований, частота инфекций и их структура являются примерно одинаковыми для инфликсимаба, этанерцепта (кроме TB) и адалимумаба.
Ритуксимаб
Ритуксимаб представляет собой генно–инженерные химерные (т.е. состоящие из человеческого и мышиного белка) моноклональные антитела к CD–20–антигену В–клеток. Основное показание для его назначения – лечение среднетяжелого и тяжелого РА, резистентного к иФНО–a. Кроме того, ритуксимаб с успехом применяют и при других РЗ (системная красная волчанка, синдром Шегрена, васкулиты и др.).
По данным РКИ (табл. 2), при лечении ритуксимабом отмечено повышение частоты развития инфекций (в т.ч. серьезных инфекций дыхательных и мочевыводящих путей), однако достоверных отличий от препаратов сравнения не наблюдалось. В частности, в рамках IIB фазы исследований [38] частота инфекций составила 28% среди больных, получавших терапию метотрексатом, и 35% для каждой из групп ритуксимаба. В ходе исследования REFLEX показатели серьезных инфекций составили 3,7 и 5,2 на 100 пациенто–лет для плацебо и ритуксимаба соответственно [39]. По данным РКИ, в целом частота серьезных инфекций среди больных РА, получавших ритуксимаб, составила 5,0, в группе контроля 3,4, на 100 пациенто–лет [40]. При длительном проспективном наблюдении за обширной когортой больных РА (1053 человека), получавших ≥1 инъекции ритуксимаба, показана сохраняющаяся (но не нарастающая) частота развития инфекций (включая тяжелые) (табл. 3) [41].
Данные, свидетельствующие о повышении риска развития ТВ или оппортунистических инфекций, вызываемых условно–патогеными возбудителями, у больных, принимавших ритуксимаб по поводу РА, отсутствуют. В то же время имеются описания случаев реактивации HBV–инфекции у больных с лимфомами. Это может накладывать ограничения на применение ритуксимаба при РА в сочетании с упомянутой инфекцией. Заслуживают внимания факты успешного и безопасного применения ритуксимаба у больных с криоглобулинемическим васкулитом, ассоциированным с HCV [42]. Тем не менее у некоторых из этих пациентов имели место случаи транзиторной HCV–виремии [43]. В соответствии с рекомендациями Французского общества ревматологов, у больных с активными HBV– и HCV–инфекциями вопрос о назначении ритуксимаба необходимо решать только после консультации гепатолога [44].
Таким образом, применение ритуксимаба, как и других иммуномодулирующих препаратов, повышает риск развития инфекций у больных РА. Частота развития серьезных инфекций составляет 5/100 пациенто–лет и существенно не меняется после повторных инъекций препарата. Несмотря на отсутствие указаний на развитие ТВ в рамках исследований по ритуксимабу, необходимо подчеркнуть, что подавляющее большинство больных, включенных в РКИ, составляли пациенты с предшествующей безуспешной иФНО–a–терапией. Следовательно, всем им уже проводили скрининг на ТВ. По мнению экспертов уже упоминавшегося консенсуса–2008, в настоящее время недостаточно данных для принятия решения о необходимости (или нецелесообразности) скринингового обследования на ТВ пациентов с РА до начала применения ритуксимаба. Поэтому врачу следует сохранять настороженность в отношении возможного развития ТВ на фоне терапии этим препаратом.
Абатацепт
Абатацепт представляет собой растворимую гибридную белковую молекулу, состоящую из 2 компонентов – внеклеточного домена CTLA4 и фрагмента Fc глобулина IgG1. Связываясь с CD80/86, молекулы CTLA4 конкурентно препятствуют взаимодействию с ними CD28 на поверхности Т–лимфоцитов, тем самым блокируя активацию последних.
В ходе РКИ частота развития инфекций (включая серьезные) при лечении абатацептом была достаточно низкой (табл. 2). Однако в ходе годового исследования AIM серьезные инфекции преобладали в группе пациентов, получавших абатацепт [47]. При оценке безопасности абатацепта в реальной клинической практике (исследование ASSURE) частота инфекционных осложнений, включая тяжелые инфекции, достоверно не отличалась от контроля (56,0 и 54,1%, 2,9 и 1,9% соответственно) [48]. Продемонстрировано нарастание частоты серьезных инфекций при комбинации абатацепта с другими иФНО–a [49]. В целом при оценке 5 крупных РКИ частота развития серьезных инфекций при лечении абатацептом превышала таковую в контроле (3 и 1,3% соответственно). Наиболее частой локализацией серьезных инфекций были органы дыхания (пневмония, бронхит, синусит), урогенитальный тракт (пиелонефрит), кожа и мягкие ткани, а также пищеварительная система (дивертикулит). Зарегистрировано 6 случаев ТВ, что составило 0,06 на 100 пациенто–лет. Также отмечено нарастание частоты герпес–вирусной инфекции по сравнению с контролем (2 и 1% соответственно). Случаев развития HBV, HCV, ВИЧ– и JC–вирусной инфекции не наблюдалось [51,52].
Таким образом, лечение абатацептом ассоциируется с умеренным риском развития бактериальных инфекций, возрастающим при одновременном применении абатацепта и иФНО–a.
Тоцилизумаб
Тоцилизумаб – препарат, являющийся рекомбинантным гуманизированным моноклональным антителом к человеческому рецептору интерлейкина–6 (ИЛ–6), блокирующим оба сигнальных пути ИЛ–6–зависимой клеточной активации.
В настоящее время программа клинических исследований тоцилизумаба включает около 4 тыс. больных РА, что позволяет составить определенное впечатление не только об эффективности, но и о безопасности этого препарата.
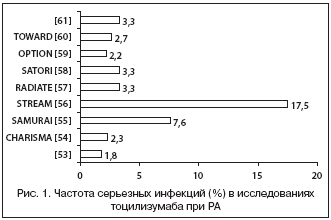
Как видно из рисунка 1, частота серьезных инфекций, развивавшихся при лечении тоцилизумабом, была аналогичной таковой у больных, получавших иФНО–a. Также сходной была структура инфекционных осложнений, которые включали пневмонию, флегмону, herpes zoster–инфекцию, бактериальный артрит и реактивацию, латентных инфекций, в т.ч. микобактериальных. В отдельных случаях серьезные инфекции приводили к летальному исходу. Описано 2 случая развития ТВ у больных РА, длительно (1,5 и 2 года) получавших тоцилизумаб [62], что обусловливает необходимость проведения соответствующего скрининга до начала лечения. Кроме того, по мнению экспертов Японского колледжа ревматологов [63], в целях минимизации развития оппортунистических инфекций больные с РА перед назначением тоцилизумаба должны соответствовать следующим условиям; а) число лейкоцитов периферической крови ≥4000/мм3, б) число лимфоцитов периферической крови ≥1000/мм3, в) отрицательный сывороточный тест на 1,3–b–D–глюкан (маркер глубоких инвазивных микозов).
При формировании антибактериальной защиты макроорганизма особая роль ИЛ–6 состоит еще и в том, что он, с одной стороны, являясь эндогенным пирогеном, инициирует повышение температуры тела, с другой – стимулирует продукцию белков острой фазы. Вследствие этого при лечении больных РА тоцилизумабом клинические (лихорадка, слабость) и лабораторные (повышение СОЭ и СРБ) симптомы инфекционного процесса могут быть стертыми или отсутствовать. Следовательно, необходимо сохранять высокую степень настороженности с целью раннего выявления инфекционных осложнений, в т.ч. серьезных. В качестве казуистики приводят описание случая тяжелой пневмонии с минимальными поначалу клиническими проявлениями и развитием шокового состояния в течение 1–х суток от начала терапии тоцилизумабом [64].
Вакцинация
В настоящее время в арсенале врачей имеется достаточное количество антиинфекционных препаратов. Но только с их помощью решить все проблемы, связанные с инфекциями в ревматологии, как и в других областях медицины, невозможно. Поэтому в ближайшем будущем большое внимание будет уделено созданию, совершенствованию и активному внедрению в клиническую практику различных вакцин.
В соответствии с рекомендациями Центра по контролю за заболеваниями (Center of Disease Control – CDC) и Североамериканского общества по инфекционным болезням от 2009 г., всем взрослым пациентам с иммуносупрессией, обусловленной как самим заболеванием, так и применением иммуномодулирующих препаратов, целесообразно проведение вакцинации против гриппа и пневмококковой инфекции [65,66]. Данное положение с полным правом можно экстраполировать на большинство больных РЗ, включая и категорию пациентов, рассматриваемую в настоящей статье.
Не могут ли механизмы, которые обусловливают повышенную восприимчивость больных РЗ к инфекциям, вызвать ослабленный иммунный ответ на вакцину? Не приведет ли вызванная вакциной активация иммунной системы к развитию или обострению уже имеющегося РЗ? Эти два вопроса оставались до последнего времени главными сдерживающими факторами широкого применения вакцинации в ревматологии. Имеющиеся на сегодняшний день данные свидетельствуют об отсутствии какого–либо негативного влияния иммунизации на течение основного РЗ, а также о сохранении или небольшом статистически незначимом уменьшении уровня индуцируемых вакциной противоинфекционных антител, в т.ч. у больных РА, получающих ГИБП.
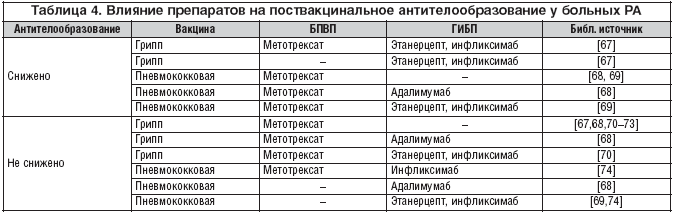
Данные о влиянии иФНО–a на поствакцинальный иммунный ответ суммированы в таблице 4. В работе Kaine и соавт. [68] после назначения противогриппозной вакцины протективный уровень антител у больных РА, получавших адалимумаб, не отличался от такового в плацебо–контроле (98 и 94,55% соответственно). По данным этих же авторов, протективные уровни антител после введения 23–валентной полисахаридной пневмококковой вакцины также были аналогичными в указанных группах (85,9 и 81,7% соответственно). В проспективном когортном исследовании голландских авторов [75] протективный уровень антител в ответ на вакцинацию против гриппа сохранялся у 80% больных, получавших иФНО–a, 82–93% – прочие БПВП и 89–94% – в здоровом контроле. Поствакцинальные титры антипневмококковых антител у больных РА, получавших иФНО–a, не отличались от таковых в контроле и значимо превосходили данные, полученные при лечении метотрексатом [69].
Таким образом, вакцинация против гриппа и пневмококковой инфекции имеет важное значение в курации больных РА, получающих ГИБП, несмотря на то, что в некоторых исследованиях иммунный ответ на указанные вакцины был неполным. Назначение живых вакцин противопоказано. Иммунизацию указанными вакцинами целесообразно проводить не менее чем за 4 недели до начала лечения ГИБП. В целях отработки более четких показаний для вакцинации и оценки влияния на ее результаты различных ГИБП необходимы дальнейшие многоцентровые крупномасштабные исследования.
В заключение считаем целесообразным акцентировать внимание врачей на наиболее важных моментах, связанных с минимизацией влияния инфекции на терапию ГИБП.
На исходном этапе:
• тщательный отбор больных в строгом соответствии с показаниями;
• исключение больных с клинически значимой инфекцией в активной форме;
• тщательное обследование с целью выявления латентной инфекции, соответствующее лечение в случае ее обнаружения, отсрочка начала терапии ГИБП;
• крайняя осторожность при решении вопроса о лечении ГИБП у больных с повышенной восприимчивостью к инфекциям, с хронической инфекцией или наличием в анамнезе рецидивирующих инфекций.
Во время и после лечения:
• информация больных о возможности ГИБП повышать способность к развитию инфекций;
• инструктаж больных о необходимости немедленного обращения к врачу при появлении во время или после лечения ГИБП симптомов инфекции (повышение tº тела, общая слабость, кашель или гриппоподобные симптомы) или признаков, позволяющих заподозрить туберкулез (субфебрилитет, длительно сохраняющийся кашель, снижение массы тела и др.);
• тщательное наблюдение как минимум в течение 6 мес. после окончания лечения ГИБП (в частности, иФНО–a);

Литература
1. Sokka T, Abelson B, Pincus T.Mortality in rheumatoid arthritis: 2008 update. Clin Exp Rheumatol. 2008;26(5 Suppl 51): 35–61.
2. Белов Б.С., Балабанова Р.М., Манукян С.Г., Полянская М.В., Оттева Э.Н., Сороцкая В.Н., Марусенко И.М., Прокопьева Н.Л. Коморбидные инфекции при ревматических заболеваниях. XVI Росс. нац. конгр. «Человек и лекарство»: Тез. докл. М., 2007. С. 527.
3. Doran MF, Crowson CS, Pond GR, O’Fallon WM, Gabriel SE Frequency of infection in patients with rheumatoid arthritis compared with controls: a population–based study. Arthritis Rheum. 2002;46(9):2287–2293.
4. Doran MF, Crowson CS, Pond GR, O’Fallon WM, Gabriel SE Predictors of infection in rheumatoid arthritis. Arthritis Rheum. 2002;46(9):2294–2300.
5. van der Veen MJ., van der Heide A., Kruize AA., Bijlsma JWJ. Infection rate and use antibiotics in patients with rheumatoid arthritis treated with methotrexate. Ann. Rheum. Dis., 1994; 53: 224–228.
6. St Clair EW, van der Heijde DM, Smolen JS, Maini RN, Bathon JM, Emery P, Keystone E, Schiff M, Kalden JR, Wang B, Dewoody K, Weiss R, Baker D; Active–Controlled Study of Patients Receiving Infliximab for the Treatment of Rheumatoid Arthritis of Early Onset Study Group.Combination of infliximab and methotrexate therapy for early rheumatoid arthritis: a randomized, controlled trial. Arthritis Rheum. 2004;50(11):3432–3443.
7. Lipsky PE, van der Heijde DM, St Clair EW, Furst DE, Breedveld FC, Kalden JR, Smolen JS, Weisman M, Emery P, Feldmann M, Harriman GR, Maini RN; Anti–Tumor Necrosis Factor Trial in Rheumatoid Arthritis with Concomitant Therapy Study Group. Infliximab and methotrexate in the treatment of rheumatoid arthritis. Anti–Tumor Necrosis Factor Trial in Rheumatoid Arthritis with Concomitant Therapy Study Group. N Engl J Med. 2000;343(22):1594–1602.
8. Maini RN, Breedveld FC, Kalden JR, Smolen JS, Furst D, Weisman MH, St Clair EW, Keenan GF, van der Heijde D, Marsters PA, Lipsky PE; Anti–Tumor Necrosis Factor Trial in Rheumatoid Arthritis with Concomitant Therapy Study Group.Sustained improvement over two years in physical function, structural damage, and signs and symptoms among patients with rheumatoid arthritis treated with infliximab and methotrexate. Arthritis Rheum. 2004;50(4):1051–1065.
9. Weinblatt ME, Keystone EC, Furst DE, Moreland LW, Weisman MH, Birbara CA, Teoh LA, Fischkoff SA, Chartash EK Adalimumab, a fully human anti–tumor necrosis factor alpha monoclonal antibody, for the treatment of rheumatoid arthritis in patients taking concomitant methotrexate: the ARMADA trial. Arthritis Rheum. 2003;48(1):35–45.
10. Furst DE, Schiff MH, Fleischmann RM, Strand V, Birbara CA, Compagnone D, Fischkoff SA, Chartash EK. Adalimumab, a fully human anti tumor necrosis factor–alpha monoclonal antibody, and concomitant standard antirheumatic therapy for the treatment of rheumatoid arthritis: results of STAR (Safety Trial of Adalimumab in Rheumatoid Arthritis). J Rheumatol. 2003;30(12):2563–2571.
11. van de Putte LB, Atkins C, Malaise M, Sany J, Russell AS, van Riel PL, Settas L, Bijlsma JW, Todesco S, Dougados M, Nash P, Emery P, Walter N, Kaul M, Fischkoff S, Kupper H. Efficacy and safety of adalimumab as monotherapy in patients with rheumatoid arthritis for whom previous disease modifying antirheumatic drug treatment has failed. Ann Rheum Dis. 2004;63(5):508–516.
12. Keystone EC, Kavanaugh AF, Sharp JT, Tannenbaum H, Hua Y, Teoh LS, Fischkoff SA, Chartash EK Radiographic, clinical, and functional outcomes of treatment with adalimumab (a human anti–tumor necrosis factor monoclonal antibody) in patients with active rheumatoid arthritis receiving concomitant methotrexate therapy: a randomized, placebo–controlled, 52–week trial. Arthritis Rheum. 2004;50(5):1400–1411.
13. Breedveld FC, Weisman MH, Kavanaugh AF, Cohen SB, Pavelka K, van Vollenhoven R, Sharp J, Perez JL, Spencer–Green GT. The PREMIER study: A multicenter, randomized, double–blind clinical trial of combination therapy with adalimumab plus methotrexate versus methotrexate alone or adalimumab alone in patients with early, aggressive rheumatoid arthritis who had not had previous methotrexate treatment. Arthritis Rheum. 2006;54(1):26–37.
14. van Riel PL, Taggart AJ, Sany J, Gaubitz M, Nab HW, Pedersen R, Freundlich B, MacPeek D; Add Enbrel or Replace Methotrexate Study Investigators. Efficacy and safety of combination etanercept and methotrexate versus etanercept alone in patients with rheumatoid arthritis with an inadequate response to methotrexate: the ADORE study Ann Rheum Dis. 2006; 65(11): 1478–1483.
15. Klareskog L, van der Heijde D, de Jager JP, Gough A, Kalden J, Malaise M, Martin Mola E, Pavelka K, Sany J, Settas L, Wajdula J, Pedersen R, Fatenejad S, Sanda M; TEMPO (Trial of Etanercept and Methotrexate with Radiographic Patient Outcomes) study investigators. Therapeutic effect of the combination of etanercept and methotrexate compared with each treatment alone in patients with rheumatoid arthritis: double–blind randomised controlled trial. Lancet. 2004;363(9410):675–681.
16. Genovese MC, Bathon JM, Martin RW, Fleischmann RM, Tesser JR, Schiff MH, Keystone EC, Wasko MC, Moreland LW, Weaver AL, Markenson J, Cannon GW, Spencer–Green G, Finck BK. Etanercept versus methotrexate in patients with early rheumatoid arthritis: two–year radiographic and clinical outcomes. Arthritis Rheum. 2002; 46(6):1443–1450.
17. Salliot C, Gossec L, Ruyssen–Witrand A, Luc M, Duclos M, Guignard S, Dougados M. Infections during tumour necrosis factor–alpha blocker therapy for rheumatic diseases in daily practice: a systematic retrospective study of 709 patients.Rheumatology. 2007; 46(2):327–334.
18. Kroesen S, Widmer AF, Tyndall A, Hasler P Serious bacterial infections in patients with rheumatoid arthritis under anti–TNF–alpha therapy. Rheumatology. 2003; 42(5): 617–621.
19. Curtis JR, Patkar N, Xie A, Martin C, Allison JJ, Saag M, Shatin D, Saag KG. Risk of serious bacterial infections among rheumatoid arthritis patients exposed to tumor necrosis factor alpha antagonists. Arthritis Rheum. 2007;56(4):1125–1133.
20. Dixon WG, Symmons DP, Lunt M, Watson KD, Hyrich KL, Silman AJ; British Society for Rheumatology Biologics Register Control Centre Consortium; British Society for Rheumatology Biologics Register. Serious infection following anti–tumor necrosis factor alpha therapy in patients with rheumatoid arthritis: Lessons from interpreting data from observational studies. //Arthritis Rheum. 2007;56(9):2896–2904.
21. Listing J, Strangfeld A, Kary S, Rau R, von Hinueber U, Stoyanova–Scholz M,Gromnica–Ihle E, Antoni C, Herzer P, Kekow J, Schneider M, Zink A. Infections in patients with rheumatoid arthritis treated with biologic agents.// Arthritis Rheum. 2005 N;52(11):3403–3412.
22. Askling J, Fored CM, Brandt L, Baecklund E, Bertilsson L, Feltelius N, Coster L, Geborek P, Jacobsson LT, Lindblad S, Lysholm J, Rantapaa–Dahlqvist S, Saxne T, van Vollenhoven RF, Klareskog L. Time–dependent increase in risk of hospitalisation with infection among Swedish RA patients treated with TNF antagonists. Ann Rheum Dis. 2007; 66(10):1339–1344.
23. Keane J, Gershon S, Wise RP, Mirabile–Levens E, Kasznica J, Schwieterman WD, Siegel JN, Braun MM. Tuberculosis associated with infliximab, a tumor necrosis factor alpha–neutralizing agent. N Engl J Med. 2001; 345(15): 1098–1104.
24. Gomez–Reino JJ, Carmona L, Valverde VR, Mola EM, Montero MD; BIOBADASER Group. Treatment of rheumatoid arthritis with tumor necrosis factor inhibitors may predispose to significant increase in tuberculosis risk: a multicenter active–surveillance report. Arthritis Rheum. 2003;48(8):2122–2127.
25. Askling J, Fored CM, Brandt L, Baecklund E, Bertilsson L, Coster L, Geborek P, Jacobsson LT, Lindblad S, Lysholm J, Rantapaa–Dahlqvist S, Saxne T, Romanus V, Klareskog L, Feltelius N. Risk and case characteristics of tuberculosis in rheumatoid arthritis associated with tumor necrosis factor antagonists in Sweden. Arthritis Rheum. 2005; 52(7): 1986–1992.
26. Tubach F, Salmon D, Ravaud P, Allanore Y, Goupille P, Breban M, Pallot–Prades B, Pouplin S, Sacchi A, Chichemanian RM, Bretagne S, Emilie D, Lemann M, Lorthololary O, Mariette X; Research Axed on Tolerance of Biotherapies Group. Risk of tuberculosis is higher with anti–tumor necrosis factor monoclonal antibody therapy than with soluble tumor necrosis factor receptor therapy: The three–year prospective french research axed on tolerance of biotherapies registry. Arthritis Rheum. 2009;60(7):1884–1894.
27. Dixon WG, Hyrich KL, Watson KD, Lunt M, Symmons DPM. Drug–specific risk of tuberculosis in patient with rheumatoid arthritis treated with anti–TNF therapy: results from the BSR biologic register (BSRBR). Ann Rheum Dis. 2008; 67 (suppl II): 178.
28. Taylor JC, Orkin R, Lanham J. Tuberculosis following therapy with infliximab may be refractory to antibiotic therapy. Rheumatology 2003;42: 901–902.
29. Диагностика туберкулезной инфекции при планировании и проведении терапии блокаторами ФНО–а у больных ревматическими заболеваниями: Пособие для врачей. Ред. М.И. Перельман, Е.Л. Насонов. М., 2008. 40 с.
30. Michel M, Duvoux C, Hezode C, Cherqui D. Fulminant hepatitis after infliximab in a patient with hepatitis B virus treated for an adult onset still’s disease. J Rheumatol. 2003; 30(7):1624–1625.
31. Ostuni P, Botsios C, Punzi L, Sfriso P, Todesco S. Hepatitis B reactivation in a chronic hepatitis B surface antigen carrier with rheumatoid arthritis treated with infliximab and low dose methotrexate. Ann Rheum Dis. 2003; 62(7):686–687.
32. Furst DE, Keystone EC, Kirkham B, Kavanaugh A, Fleischmann R, Mease P, Breedveld FC, Smolen JS, Kalden JR, Burmester GR, Braun J, Emery P, Winthrop K, Bresnihan B, De Benedetti F, Dorner T, Gibofsky A, Schiff MH, Sieper J, Singer N, Van Riel PL, Weinblatt ME, Weisman MH. Updated consensus statement on biological agents for the treatment of rheumatic diseases, 2008. Ann Rheum Dis. 2008;67 (Suppl 3):2–25.
33. Vassilopoulos D, Calabrese LH Risks of immunosuppressive therapies including biologic agents in patients with rheumatic diseases and co–existing chronic viral infections. Curr Opin Rheumatol. 2007;19(6):619–625.
34. Zingarelli S, Frassi M, Bazzani C, Scarsi M, Puoti M, Airo P. Prophylaxis and therapy of HBV infection in 20 patients treated with disease modifying antirheumatic drugs or with biological agents for rheumatic diseases. J Rheumatol. 2009;36(6):1188–1194.
35. Peterson JR, Hsu FC, Simkin PA, Wener MH. Effect of tumor necrosis factor alpha antagonists on serum transaminases and viraemia in patients with rheumatoid arthritis and chronic hepatitis C infection. Ann Rheum Dis 2003; 62: 1078–1082.
36. Zein NN and Etanercept Study Group. Etanercept as an adjuvant to interferon and ribavirin in treatment–naive patients with chronic hepatitis C virus infection: a phase 2 randomised, double–blind, placebo–controlled study. J Hepatol.2005; 42: 315–322.
37. Emery P, Fleischmann R, Filipowicz–Sosnowska A, Schechtman J, Szczepanski L, Kavanaugh A, Racewicz AJ, van Vollenhoven RF, Li NF, Agarwal S, Hessey EW, Shaw TM; DANCER Study Group. The efficacy and safety of rituximab in patients with active rheumatoid arthritis despite methotrexate treatment: results of a phase IIB randomized, double–blind, placebo–controlled, dose–ranging trial. Arthritis Rheum. 2006;54(5):1390–1400.
38. Edwards JC, Szczepanski L, Szechinski J, Filipowicz–Sosnowska A, Emery P, Close DR, Stevens RM, Shaw T. Efficacy of B–cell–targeted therapy with rituximab in patients with rheumatoid arthritis N Engl J Med. 2004;350(25):2572–2581.
39. Cohen SB, Emery P, Greenwald MW, Dougados M, Furie RA, Genovese MC, Keystone EC, Loveless JE, Burmester GR, Cravets MW, Hessey EW, Shaw T, Totoritis MC; REFLEX Trial Group. Rituximab for rheumatoid arthritis refractory to anti–tumor necrosis factor therapy: Results of a multicenter, randomized, double–blind, placebo–controlled, phase III trial evaluating primary efficacy and safety at twenty–four weeks.Arthritis Rheum. 2006;54(9):2793–2806.
40. Looney RJ, Srinivasan R, Calabrese LH. The effects of rituximab on immunocompetency in patients with autoimmune disease. Arthritis Rheum. 2008;58(1):5–14.
41. van Vollenhoven R, Emery P, Bingham C, Keystone E, Greenwald M, Moreland LW et al. Long–term safety data from extended follow–up and repeat use of rituximab in rheumatoid arthritis. Ann Rheum Dis 2007; 66 (Suppl II): 88.
42. Ahmed MS, Wong CF Should rituximab be the rescue therapy for refractory mixed cryoglobulinemia associated with hepatitis C? J Nephrol 2007; 20: 350–356/
43. Lake–Bakaar G, Dustin L, McKeating J, Newton K, Freeman V, Frost SD. Hepatitis C virus and alaninaminitransferase kinetics following B–lymphocyte depletion with rituximab: evidence for significant role of humoral immunity in the control of viremia in chronic HCV liver disease. Blood. 2007;109(2):845–846.
44. Pham T, Fautrel B, Gottenberg JE, Goupille P, Hachulla E, Masson C, Morel J, Mouthon L, Saraux A, Schaeverbeke T, Wendling D, Mariette X. Rituximab (MabThera) therapy and safety management. Joint Bone Spine 2008; 75 (Suppl 1): 1–99.
45. Kremer JM, Westhovens R, Leon M, Di Giorgio E, Alten R, Steinfeld S, Russell A, Dougados M, Emery P, Nuamah IF, Williams GR, Becker JC, Hagerty DT, Moreland LW. Treatment of rheumatoid arthritis by selective inhibition of T–cell activation with fusion protein CTLA4Ig. N Engl J Med. 2003;349(20):1907–1915.
46. Genovese MC, Becker JC, Schiff M, Luggen M, Sherrer Y, Kremer J, Birbara C, Box J, Natarajan K, Nuamah I, Li T, Aranda R, Hagerty DT, Dougados M. Abatacept for rheumatoid arthritis refractory to tumor necrosis factor alpha inhibition. N Engl J Med. 2005; 353(11): 1114–1123.
47. Kremer JM, Genant HK, Moreland LW, Russell AS, Emery P, Abud–Mendoza C, Szechinski J, Li T, Ge Z, Becker JC, Westhovens R. Effects of abatacept in patients with methotrexate–resistant active rheumatoid arthritis: a randomized trial. Ann Intern Med. 2006;144(12):865–876.
48. Weinblatt M, Combe B, Covucci A, Aranda R, Becker JC, Keystone E. Safety of the selective costimulation modulator abatacept in rheumatoid arthritis patients receiving background biologic and nonbiologic disease–modifying antirheumatic drugs: A one–year randomized, placebo–controlled study. Arthritis Rheum. 2006;54(9):2807–2816.
49. Weinblatt M, Schiff M, Goldman A, Kremer J, Luggen M, Li T, Chen D, Becker JC. Selective costimulation modulation using abatacept in patients with active rheumatoid arthritis while receiving etanercept: a randomised clinical trial Ann Rheum Dis. 2007; 66(2):228–234.
50. Schiff M, Keiserman M, Codding C, Songcharoen S, Berman A, Nayiager S, Saldate C, Li T, Aranda R, Becker JC, Lin C, Cornet PL, Dougados M. Efficacy and safety of abatacept or infliximab vs placebo in ATTEST: a phase III, multi–centre, randomised, double–blind, placebo–controlled study in patients with rheumatoid arthritis and an inadequate response to methotrexate. Ann Rheum Dis. 2008;67(8):1096–1103.
51. Sibilia J, Westhovens R. Safety of T–cell co–stimulation modulation with abatacept in patients with rheumatoid arthritis.Clin Exp Rheumatol. 2007; (5 Suppl 46):46–56.
52. Smitten A, Simon T Qi K et al. Hospitalized infections in the abatacept RA clinical development program: an updated epidemiological assessment with >10,000 person–years of exposure. Arthritis Rheum 2008; 58 (Suppl 9): 786–787.
53. Nishimoto N, Yoshizaki K, Miyasaka N, Yamamoto K, Kawai S, Takeuchi T, Hashimoto J, Azuma J, Kishimoto T. Treatment of rheumatoid arthritis with humanized anti–interleukin–6 receptor antibody: a multicenter, double–blind, placebo–controlled trial. Arthritis Rheum. 2004 Jun;50(6):1761–1769.
54. Maini RN, Taylor PC, Szechinski J, Pavelka K, Broll J, Balint G, Emery P, Raemen F, Petersen J, Smolen J, Thomson D, Kishimoto T; CHARISMA Study Group. Double–blind randomized controlled clinical trial of the interleukin–6 receptor antagonist, tocilizumab, in European patients with rheumatoid arthritis who had an incomplete response to methotrexate. Arthritis Rheum. 2006 Sep;54(9):2817–2829.
55. Nishimoto N, Hashimoto J, Miyasaka N, Yamamoto K, Kawai S, Takeuchi T, Murata N, van der Heijde D, Kishimoto T. Study of active controlled monotherapy used for rheumatoid arthritis, an IL–6 inhibitor (SAMURAI): evidence of clinical and radiographic benefit from an x ray reader–blinded randomised controlled trial of tocilizumab Ann Rheum Dis. 2007 Sep;66(9):1162–1167.
56. Nishimoto N, Miyasaka N, Yamamoto K, Kawai S, Takeuchi T, Azuma J. Long–term safety and efficacy of tocilizumab, an anti–interleukin–6 receptor monoclonal antibody, in monotherapy, in patients with rheumatoid arthritis (the STREAM study): evidence of safety and efficacy in a 5–year extension study. Ann Rheum Dis published online 19 Nov 2008. www.ard.bmj.com.
57. Emery P, Keystone E, Tony HP, Cantagrel A, van Vollenhoven R, Sanchez A, Alecock E, Lee J, Kremer J. IL–6 receptor inhibition with tocilizumab improves treatment outcomes in patients with rheumatoid arthritis refractory to anti–tumour necrosis factor biologicals: results from a 24–week multicentre randomised placebo–controlled trial. Ann Rheum Dis. 2008;67(11):1516–1523.
58. Nishimoto N, Miyasaka N, Yamamoto K, Kawai S, Takeuchi T, Azuma J, Kishimoto T. Study of active controlled tocilizumab monotherapy for rheumatoid arthritis patients with an inadequate response to methotrexate (SATORI): significant reduction in disease activity and serum vascular endothelial growth factor by IL–6 receptor inhibition therapy. Mod Rheumatol. 2009;19(1):12–19.
59. Smolen JS, Beaulieu A, Rubbert–Roth A, Ramos–Remus C, Rovensky J, Alecock E, Woodworth T, Alten R; OPTION Investigators. Effect of interleukin–6 receptor inhibition with tocilizumab in patients with rheumatoid arthritis (OPTION study): a double–blind, placebo–controlled, randomised trial. Lancet. 2008;371(9617):987–997.
60. Genovese MC, McKay JD, Nasonov EL, Mysler EF, da Silva NA, Alecock E, Woodworth T, Gomez–Reino JJ.. Interleukin–6 receptor inhibition with tocilizumab reduces disease activity in rheumatoid arthritis with inadequate response to disease–modifying antirheumatic drugs: the tocilizumab in combination with traditional disease–modifying antirheumatic drug therapy study. Arthritis Rheum. 2008;58(10):2968–2980.
61. Hirabayashi Y, Ishii T, Harigae H.. Clinical efficacy of tocilizumab in patients with active rheumatoid arthritis in real clinical practice. Rheumatol Int. 2009 Published online: 22 August 2009 www. springerlink.com/content/hr7j313w331526t6/
62. Nishimoto N, Miyasaka N, Yamanaka K, Kawai S, Takeuchi T, Ito K, Kakehi T. Safety profile of tocilizumab in Japanese patients with rheumatoid arthritis –incidences of infections in Japanese long–term clinical studies– . Ann Rheum Dis 2008;67 (Suppl II):335.
63. Koike R, Harigai M, Atsumi T, Amano K, Kawai S, Saito K, Saito T, Yamamura M, Matsubara T, Miyasaka N. Japan College of Rheumatology 2009 guidelines for the use of tocilizumab, a humanized anti–interleukin–6 receptor monoclonal antibody, in rheumatoid arthritis. Mod Rheumatol. 2009; 19(4):351–357.
64. Fujiwara H, Nishimoto N, Hamano Y, Asanuma N, Miki S, Kasayama S, Suemura M.Masked. Early symptoms of pneumonia in patients with rheumatoid arthritis during tocilizumab treatment: a report of two cases. Mod Rheumatol. 2009;19(1):64–68.
65. Recommended Adult Immunization Schedule: United States, 2009. Ann Intern Med 2009;150(1):40–44.
66. Pickering LK, Baker CJ, Freed GL, Gall SA, Grogg SE, Poland GA, Rodewald LE, Schaffner W, Stinchfield P, Tan L, Zimmerman RK, Orenstein WA. Immunization Programs for Infants, Children, Adolescents, and Adults: Clinical Practice Guidelines by the Infectious Diseases Society of America. Clin Infect Dis 2009; 49:817–840.
67. Kapetanovic MC, Saxne T, Nisson JA, Geborec P. Influenza vaccination as model for testing immune modulation induced by anti–TNF and methotrexate therapy in rheumatoid arthritis patients. Rheumatology 2007; 46: 608–611.
68. Kaine JL, Kivitz AJ, Birbara C, Luo AY. Immune Responses Following Administration of Influenza and Pneumococcal Vaccines to Patients with Rheumatoid Arthritis Receiving Adalimumab. J Rheumatol 2007;34:272–279.
69. Kapetanovic MC, Saxne T, Sjoholm A, Truedsson L, Jonsson G, Geborek P. Influence of methotrexate, TNF blockers and prednisolone on antibody responses to pneumococcal piolysaccharide vaccine in patients with rheumatoid arthritis. Rheumatology 2006; 45: 106–111.
70. Fomin I, Caspi D, Levy V, Varsano N, Shalev Y, Paran D, Levartovsky D, Litinsky I, Kaufman I, Wigler I, Mendelson E, Elkayam O. Vaccination against influenza in rheumatoid arthritis: the effect of disease modifying drugs, including TNFa blockers. Ann Rheum Dis 2006;65:191–194.
71. Chalmers A, Scheifele D, Patterson C, Williams D, Weber J, Shuckett R, Teufel A. Immunization of patients with rheumatoid arthritis against influenza: a study of vaccine safety and immunogenicity. J Rheumatol 1994; 21: 1203–1206.
72. Del Porto F, Lagana B, Biselli R, Donatelli I, Campitelli L, Nisini R, Cardelli P, Rossi F, D’Amelio R. Influenza vaccine administration in patients with systemic lupus erythematosus and rheumatoid arthritis. Safety and immunogenicity. Vaccine 2006; 24: 3217–3223.
73. Francioni C, Rosi P, Fioravanti A, Megale F, Pipitone N, Marcolongo R. Vaccination against influenza in patients with rheumatoid arthritis: clinical and antibody response. Recenti Prog Med 1996; 87: 145–149.
74. Visvanathan S, F. Keenan GF, Baker DG,. Levinson AL,. Wagner CL. Response to pneumococcal vaccine in patients with early rheumatoid arthritis receiving infliximab plus methotrexate or methotrexate alone. J Rheumatol 2007;34: 952–957.
75. Gelinck LBS, van der Bijl AE, Beyer WEP, Visser IG, Huizinga TWJ, van Hogezand RA, Rimmelzwaan GF, Kroon FP The effect of anti–tumour necrosis factor a treatment on the antibody response to influenza vaccination. Ann Rheum Dis 2008; 67: 713–716.












