Препараты хондроитина сульфата (ХС; Структум) обрели теоретическую базу, обосновывающую возможность влияния на течение остеоартроза, совсем недавно, в 90–е годы XX в. При этом обоснование касалось в большей мере механизмов влияния на хрящевую ткань, чем влияние на болевой синдром при этом заболевании.
Структум представляет собой сульфатированный гликозаминогликан, состоящий из полисахаридной цепи с повторяющейся дисахаридной последовательностью N–ацетилгалактозамина и глюкуроновой кислоты, он имеет молекулярную массу 18–33 кДа. Обычно он находится в связи с протеинами как часть протеогликанов, наиболее важным из которых является аггрекан. Молекула хондроитина сульфата может насчитывать в цепи более 100 остатков сахаров, сульфатированых в различных положениях, что придает молекуле полианионную структуру с высокой гидрофильностью. В суставном хряще высокое содержание ХС играет роль в создании высокого осмотического потенциала, дающего плотность и упругость хрящевому матриксу [1]. При остеоартрозе структура ХС в хрящевом матриксе меняется с появлением более длинных молекулярных цепей и появлением новых эпитопов, являющихся мишенью для антител. На клеточных культурах хондроцитов человека было показано стимулирующее действие хондроитина сульфата (в концентрации 100–1000 мкг/мл) на синтез протеогликанов без отчетливого влияния на синтез коллагена 2–го типа. В присутствии ИЛ–1b хондроитин сульфат препятствует действию цитокинов на протеогликаны, коллаген 2–го типа и синтез простагландина Е, что, как было показано на моделях, приводит к снижению коллагенолитической активности и к повышению продукции компонентов матрикса [2]. ХC обладает противовоспалительной активностью, за счет ингибирования синтеза протеолитических ферментов, в частности металлопротеиназ [3], и оксида азота [4]. В последние годы появились данные, подтверждающие противовоспалительную активность ХС. Один из механизмов связан с подавлением активности индуцируемого ИЛ–1bβ фактора каппа–В (IL–1beta–induced NF–kappaB) и торможением фосфориляции митоген–активируемой протеинкиназы (р38MAPK). Кроме того, определено значимое уменьшение активируемого апоптоза хондроцитов.
Один из основных вопросов, который крайне важен для обоснования медицинского применения пероральных препаратов ХС, связан с абсорбцией его молекул из желудочно–кишечного тракта. Исследования фармакокинетики препаратов ХС однозначно свидетельствуют о значимой абсорбции активного вещества. Кислые полисахариды проникают в системный кровоток из желудка за счет снижения их отрицательного заряда в кислой среде. Аналогию можно провести с высокой абсорбцией кислот, составляющих большую часть НПВП. В работе Conte на здоровых добровольцах [5] было показано, что при пероральном приеме ХС в дозе 500 мг абсолютная биодоступность составляет 13,2%. При этом в плазме дополнительно определяется часть полисахаридов с молекулярной массой менее 5 kDa (средняя молекулярная масса молекул ХС в препаратах сильно варьирует, но превышает 8 кDa). Объем распределения при пероральном приеме выше 6 л, что свидетельствует о распределении ХС в тканях. В одной из работ Conte [6] было показано, что пятидневный прием ХС в дозе 800 мг/сут. приводит к изменению состава синовиальной жидкости. Сравнение в группах больных, на протяжении 5 дней принимавших (n=8) и не принимавших ХС (n=5), показало, что в случае приема препарата в синовиальной жидкости у больных остеоартрозом (ОА) значимо падает активность N–ацетилглюкозаминидазы и увеличивается содержание гиалуроновой кислоты. Таким образом, данные исследований свидетельствуют о том, что ХС поступает из желудочно–кишечного тракта в системный кровоток, достигает синовиальной жидкости и оказывает влияние на ее состав.
Перейдем к основному показанию для медицинского применения Структума. ОА, очевидно, является самым частым ревматическим заболеванием. В старших возрастных группах частота встречаемости превышает 50%. В 1995 г. среди взрослого населения России было зарегистрировано более 980 тыс. больных ОА [Фоломеева О.М., Амирджанова В.Н., 2006]. В США ОА находится на 2–м месте среди причин нетрудоспособности, уступая место только ишемической болезни сердца. Среди причин госпитализаций ОА стоит на первом месте среди заболеваний опорно–двигательного аппарата, значительно опережая ревматоидный артрит. Довольно важно, что в дальнейшем прогнозируется прирост частоты этого заболевания в популяции [7]. В свою очередь, вынужденное уменьшение двигательной активности больных ОА приводит к нарастанию риска развития сердечно–сосудистых заболеваний и остеопороза. Высокая распространенность и прогрессирующее течение ОА ставят его в ряд наиболее социально значимых заболеваний.
Прорыв в хирургических технологиях, позволяющий широко использовать эндопротезирование коленных и тазобедренных суставов, значительно улучшил перспективы больных ОА. При этом выведения на рынки препаратов, значимо улучшающих результаты лечения больных ОА, за последнее десятилетие не произошло. Следует признать, что терапевтические возможности лекарственной терапии на сегодняшний момент довольно ограничены. Симптоматическое действие нестероидных противовоспалительных препаратов позволяет снизить интенсивность болевого синдрома, однако, обладая негативным влиянием на желудочно–кишечный тракт, они не предотвращают деструктивные изменения хрящевой ткани и субхондральной кости. Рекомендуемый в руководствах парацетамол в низких дозах слабо влияет на купирование болевого синдрома, а повышение доз резко увеличивает риски серьезных осложнений терапии. Надежды на серьезный прорыв в терапевтическом подходе к лечению ОА в связи с появлением диацереина оправдались не в полной мере. В соответствии с данными Кокрановского обзора оказалось, что препарат не влиял на прогрессирование заболевания при ОА коленных суставов, а интенсивность болевого синдрома в сравнении с плацебо снижался лишь на 5 мм по 100 миллиметровой шкале [8].
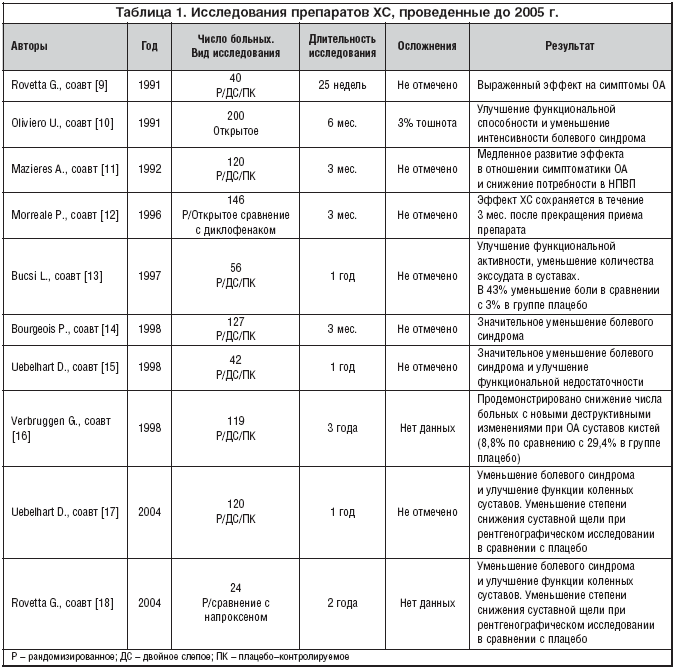
Таким образом, несмотря на появление новых перспективных препаратов для лечения ОА, ХС традиционно остается препаратом выбора, обладающим обширной базой доказательных исследований эффективности и безопасности. Результаты исследований ХС при лечении ОА, проведенных до 2005 г., представлены в таблице 1.
В России накоплен достаточно большой опыт использования препаратов Структума. Одно из исследований пероральной лекарственной формы ХС включало более 500 больных ОА коленных и тазобедренных суставов. На фоне лечения отмечено достоверное снижение индекса Лекена (в 2 раза при гонартрозе и в 2,5 раза при коксартрозе, p<0,05), боли в покое (в 3,8 раза при гонартрозе и в 3 раза при коксартрозе, p<0,05), боли при ходьбе (p<0,05) и потребности в НПВП (в 5,7 раз при гонартрозе и в 4,6 раз при коксартрозе). В целом клиническое улучшение отмечено у 90,2% пациентов. После завершения исследования лечебный эффект сохранялся в течение 4,1 мес. при коксартрозе и 4,6 мес. при гонартрозе [19]. Позднее была проведена оценка отдаленных эффектов 6–месячной терапии Структумом приблизительно у 70% этих больных. Оказалось, что терапия Структумом в течение даже относительно короткого периода в дальнейшем способствовала снижению частоты обострений заболевания, госпитализации и обращений больных в поликлиники. Общее состояние больных ОА через 1 год после окончания лечения Структумом, оцениваемые больным и врачом, свидетельствовали о сохранении эффекта у 40% больных. Частота обострений заболеваний ЖКТ, АГ и ИБС у больных, леченных Структумом, также оказалось ниже, чем у больных, постоянно получавших НПВП [23].
Иные результаты, не подтвердившие различий в клинической эффективности ХС и глюкозамина от плацебо у больных гонартрозом, были получены в 2006 г. в исследовании GAIT [20]. Дизайн исследования соответствовал современным требованиям для подобных работ, а численность включенных пациентов позволяла констатировать высокую мощность исследования. Основной целью было избрано доказательство эффективности и безопасности монопрепаратов ХС и глюкозамина и их комбинации в сравнении с плацебо и целекоксибом. Каждая из 5 групп больных ОА насчитывала более чем 300 больных. Следует заметить, что ХС значимо уменьшал припухание суставов в сравнении с плацебо. В начале исследования у 28,3% больных отмечался этот симптом, к завершению 24–й нед. – только у 12,4%, в группе плацебо снижение было недостоверным, 28,1 и 19,9% соответственно. Данное исследование не показало преимущества ХС по сравнению с другими группами. Однако обращает на себя внимание необычно высокий показатель эффективности терапии в группе плацебо, достигавший для шкалы боли WOMAC 60% (и именно этот факт является наиболее критикуемым аспектом исследования GAIT, свидетельствующим, по–видимому, о не совсем корректных критериях включения пациентов в исследование и сложности в трактовке полученных данных). Малая доля больных в группах была с умеренным и выраженным болевым синдромом (в среднем 20–25%).
Последний мета–анализ, включивший результаты исследования GAIT, не выявил достоверного влияния ХС, глюкозамина и их комбинации на больных ОА в сравнении с плацебо. Вместе с тем авторы этой работы не считают ее результат поводом для отказа от терапии ХС [21]. В обсуждении работы дана информация о том, что, возможно, для обнаружения эффекта была недостаточна статистическая мощность мета–анализа, в связи с тем, что необходимо обнаружить очень небольшую разницу в действии на болевой синдром, которая разделяет лекарственные препараты от плацебо. Авторы планируют завершить анализ данных с учетом необходимости повышения мощности анализа лишь к концу 2011 г.
В этой связи следует озвучить результаты недавней работы, проведенной в европейских клинических центрах [22]. Многоцентровое исследование было выполнено в виде двойного слепого плацебо–контролированного с рандомизацией 622 больных ОА коленных суставов. 309 больных получали ХС в дозе 800 мг/сут., 313 больных – плацебо. Продолжительность терапии составила 2 года. В работе оценивалась минимальная величина суставной щели по наиболее зарекомендовавшему себя методу оценки толщины хряща в латеральных отделах – Lyon–schuss view. К завершению 2–го года различия в степени потери величины суставной щели оказались высоко достоверными: в группе принимавших ХС потеря составила 0,07 мм, в группе плацебо – 0,31 мм; доля больных со снижением величины суставной щели более 0,25 мм составила 28 и 41%, соответственно. Время снижения интенсивности боли было значительно меньше у больных, принимающих ХС. Отличий в переносимости плацебо и ХС обнаружено не было. Эта обширная работа выполнена после опубликования результатов американского исследования GAIT. Причины столь различных результатов могут быть весьма разнообразны, включая особенности набора популяции, качество оценок состояния больных и др. В то же время нельзя не упомянуть, что присутствующие на рынке США препараты ХС и глюкозамина не подвергаются регулированию FDA, т.к. не относятся к лекарственным препаратам, а в странах Европы проводится тщательная оценка качества части продуктов, которые являются медицинскими препаратами, содержащими ХС и глюкозамин,
Таким образом, на сегодняшний момент препараты ХС сохраняют свое ведущее место в спектре лекарственных средств, применяемых для лечения ОА. Большой объем работ, подтверждающих эффективность ХС, в т.ч. наличие хондропротекторной активности, и бесспорная безопасность при длительном применении дают основание рекомендовать их для лечения больных с различной локализацией остеоартроза.
Литература
1. Hardingham T.E. Chondroitin sulfate and joint disease. Osteoarthritis Cartilage, 1998, 6, 3–5.
2. Bassleer C.T., Comban J.P., Bougaret S., et al.: Effects of chondroitin sulfate and interleukin–1on human articular chondrocytes cultivated in clusters. Osteoarthritis Cartilage, 1998, 6, 196–204.
3. Chou M.M., Vergnolle N., McDougall J.J., et al. Effects of chondroitin and glucosamine sulfate in a dietary bar formulation on inflammation, interleukin–1beta, matrix metalloprotease–9, and cartilage damage in arthritis. Exp Biol Med (Maywood), 2005, 230, 255–62.
4. Chan P.S., Caron J.P., Rosa G.J., et al. Glucosamine and chondroitin sulfate regulate gene expression and synthesis of nitric oxide and prostaglandin E(2) in articular cartilage explants. Osteoarthritis Cartilage, 2005, 13, 387–94.
5. Conte A., et al. Metabolic fate of exogenous chondroitin sulphate in man. Drug Research. 1991, 7, 768–72.
6. Conte A., et al. Biochemical and pharmacokinetic aspects oral treatment with condroitin sulphate. Drug Research. 1995, 8, 918–925.
7. Arden N., Nevitt M.C. Osteoarthritis: epidemiology. Best Pract Res Clin Rheumatol., 2006, 20, 3–25.
8. Fidelix T.S., Soares B., Fernandes Moca Trevisani V. Diacerein for osteoarthritis (Review). Cochrane Musculoskeletal Group. Edited (no change to conclusions), published in Issue 1, 2009.
9. Rovetta G. Galactosaminoglycuronoglycan sulfate (Matrix) in therapy of tibiofibular osteoarthritis of the knee. Drugs Exp Clin Res., 1991, 17, 53–57.
10. Oliviero U., Sorrentino G.P., De Paola P., et al: Effects of the treatment with Matrix on elderly people with chronic articular degeneration. Drugs Exp Clin Res., 1991, 17, 45–51
11. Mazieres A., et al. Rev. Rhum. Mal. Osteoartic., 1992, 59, 466.
12. Morreale P., Manopulo R., Galati M. et al . Comparison of the antiinflammatory efficacy of chondroitin sulfate and diclofenac sodium in patients with knee osteoarthritis. J Rheumatol 1996, 23, 1385–91.
13. Bucsi L., Poor G. Efficacy and tolerability of oral chondroitin sulfate as a symptomatic slow–acting drug for osteoarthritis (SYSADOA) in the treatment of knee osteoarthritis. Osteoarthritis Cartilage, 1998, 6(suppl A), 31–6.
14. Bourgeois P., Chales G., Dehais J., et al . Efficacy and tolerability of chondroitin sulfate 1200 mg/day vs chondroitin sulfate 3 × 400 mg/day vs placebo. Osteoarthritis Cartilage, 1998, 6(suppl A), 25–30.
15. Uebelhart D., Thonar E.J., Delmas P.D., et al. Effects of oral chondroitin sulfate on the progression of knee osteoarthritis: A pilot study. Osteoarthritis Cartilage, 1998, 6(suppl A), 39–46.
16. Verbruggen G., Goemaere S., Veys E.M. Chondroitin sulfate: S/DMOAD (structure/disease modifying anti–osteoarthritis drug) in the treatment of finger joint OA. Osteoarthritis Cartilage, 1998, 6(suppl A), 37–38.
17. Uebelhart D., et al. Osteoarthr. Cart., 2004, 12, 269.
18. Rovetta G. Drugs Exp Clin Res., 2004, 30, 11.
19. Алексеева Л.И., Архангельская Г.С., Давыдова А.Ф. и др. Отдаленные результаты применения Структума (по материалам многоцентрового исследования) // Терапевтический архив. 2003. № 75. С. 82–86.
20. Sawitzke A.D., Shi H., Finco M.F., et al. The effect of glucosamine and/or chondroitin sulfate on the progression of knee osteoarthritis: a report from the glucosamine/chondroitin arthritis intervention trial. Arthritis Rheum., 2008, 58, 3183–91
21. Wandel S., et al. Effects of glucosamine, chondroitine, or placebo in patients with osteoarthritis of hip or knee: network meta–analysis. BMJ, 2010,341, 46–75.
22. Kahan A., Uebelhart D., De Vathaire F., et al. Long–term effects of chondroitins 4 and 6 sulfate on knee osteoarthritis: the study on osteoarthritis progression prevention, a two–year, randomized, double–blind, placebo–controlled trial. Arthritis Rheum., 2009, 60(2), 524–33.
23. Алексеева Л.И., Архангельская Г.С., Давыдова А.Ф., и др. Отдаленные результаты применения препарата структум (по материалам многоцентрового исследования). Украiнський ревматологiчний журнал, 2006, 23: 73–78.












