ОА – наиболее широко распространенное заболевание практически во всех популяциях. Рентгенографические признаки заболевания выявляются приблизительно у 50% людей в возрасте 55 лет и у 80% лиц старше 75 лет. При этом ОА остается основной причиной нетрудоспособности в США и других развитых странах.
Причины ОА мультифакториальны. Наиболее тесно с риском возникновения заболевания ассоциированы возраст и пол, большое значение имеют также механические, гормональные и генетические факторы.
Суставной хрящ – специализированная ткань, покрывающая костные поверхности диартрозных суставов, важнейшими функциями которой являются адаптация сустава к механической нагрузке (сжатие при нагрузке и восстановление при ее снятии) и обеспечение движения в суставе без трения суставных поверхностей. Суставной хрящ состоит из матрикса и погруженных в него хондроцитов.
Хондроциты – клетки, обеспечивающие нормальное протекание обменных процессов (ремоделирование) хрящевой ткани. Они участвуют в регуляции синтеза (анаболизм) и деградации (катаболизм) компонентов хрящевого матрикса, которые в норме находятся в сбалансированном состоянии. Полагают, что в основе патогенеза ОА лежит преобладание катаболических процессов над анаболическими, связанное с патологией хондроцитов. Функциональная активность этих клеток регулируется очень большим количеством биологически активных медиаторов, и сами они синтезируют значительное число медиаторов, принимающих участие в регуляции обмена хрящевой ткани в норме и патологии. Например, под действием провоспалительного цитокина интерлейкина–1 хондроциты синтезируют протеолитические ферменты (так называемые матриксные протеиназы), вызывающие деградацию коллагена и протеогликанов хряща. Характерной особенностью хондроцитов при ОА является гиперэкспрессия циклооксигеназы (ЦОГ)–2 (фермент, индуцирующий синтез простагландинов, принимающих участие в развитии воспаления) и индуцируемой формы синтетазы оксида азота (фермент, регулирующий образование оксида азота, оказывающего токсическое действие на хрящ).
Матрикс содержит две главные макромолекулы, протеогликаны (Пг) и коллаген. Коллагеновые фибриллы, состоящие в основном из коллагена II типа, обеспечивают сопротивление растяжению, тогда как коллагены VI, IX, X и XI типов ответственны за различные взаимодействия в матриксе. Цепи гликозаминогликанов (ГАГ) образуют высокомолекулярные комплексы с гиалуроновой кислотой, которые, в свою очередь, удерживаются в коллагеновых фибриллах. Способность хряща выдерживать давление обусловлена отрицательно заряженными ГАГ, ограничивающими содержание воды. Высокая концентрация Пг внутри хряща держит коллагеновую сеть под напряжением, т.о. способствуя распределению нагрузки, которая воздействует на хрящ, и обеспечивая восстановление ткани после прекращения действия нагрузки. При потере даже небольшого количества ГАГ сопротивление матрикса хряща к воздействию физической силы уменьшается, и поверхность хряща становится чувствительной к повреждению. Однако эта частичная потеря ГАГ может восполняться за счет усиления синтетической активности Х–ов. На ранних стадиях хрящ толще, чем нормальный, но при прогрессировании ОА развивается истончение суставной поверхности. Хрящ становится более мягким и рыхлым, могут появляться глубокие язвы, простирающиеся до кости, часто только в одной части сустава – области, несущей нагрузку. Однако даже если хрящ в остальных областях может выглядеть интактным, он биохимически и метаболически не нормален.
Субхондральная кость в участках, лишенных хряща, склерозируется, при этом нарушается ее микроархитектоника. Гистологические исследования показывают, что костномозговой канал кости инфильтрируется липидами, холестерином и фибрином. Продукты деградации хряща приобретают антигенные свойства и при попадании в синовиальную жидкость провоцируют синовит. Синовиальное воспаление способствует нарушению метаболизма синовиоцитов, которые являются основными источниками гиалуроновой кислоты (ГУК) и синовиальной жидкости. Медиаторы воспаления, высвобождающиеся из синовиальных клеток, способствуют повышению проницаемости сосудов и усиленной трансфузии плазмы в синовиальную жидкость, что приводит к снижению концентрации в ней ГУК. В совокупности со снижением молекулярного веса ГУК вследствие нарушения ее синтеза синовиоцитами это приводит к снижению вязкоэластических и лубрикантных свойств синовиальной жидкости и способности защищать суставной хрящ.
Наиболее важным клиническим симптомом ОА является боль, обычно небольшая в начале, от легкой до умеренной по интенсивности, усиливается при нагрузке сустава и уменьшается в покое. Появление боли в течение ночи свидетельствует о более тяжелом заболевании. Интересно, что боль при ОА – это не просто результат структурных изменений в пораженном суставе, но скорее исход комплексного взаимодействия между структурными изменениями, механизмами периферической и центральной боли и субъективными составляющими боли, на которые, в свою очередь, влияют образование, пол и психосоциальные факторы.
Диагностика ОА в подавляющем большинстве случаев не вызывает больших трудностей и основывается на клинических и рентгенологических (сужение суставной щели, краевые остеофиты) признаках. Исключение составляют больные с признаками воспаления суставов (например, при генерализованном ОА, поражающем мелкие суставы кистей). Кроме того, иногда возникают проблемы при дифференциальной диагностике первичного и вторичного ОА, связанного с метаболическими и другими заболеваниями.
Фармакотерапия ОА до недавнего времени была направлена скорее на уменьшение симптомов болезни, нежели на ее причину. Анальгетики, нестероидные противовоспалительные препараты (НПВП) и стероиды составляли основу лечения ОА. Однако побочные эффекты большинства этих лекарственных средств заставили пересмотреть показания к их широкому назначению больным ОА и способствовали разработке препаратов, способных контролировать течение болезни. К таким препаратам относится хондроитин сульфат (ХС).
ХС является основным компонентом большинства тканей и присутствует преимущественно в экстрацеллюлярном матриксе. Наиболее богаты им соединительная ткань, хрящ, кожа, стенки сосудов и костная ткань, а также связки и сухожилия.
ХС представляет собой гликозаминогликан (ГАГ). Это полисахаридная цепь, построенная из дисахаридов, образованных уроновыми кислотами (глюкуроновой, галактуроновой и идуроновой), N–ацетилгексозаминами и нейтральными сахаридами. Данные полисахаридные цепи не способны к самостоятельному существованию в тканях и соединяются ковалентной связью с белками, образуя протеогликаны (ПГ). Кроме ХС, к ГАГ относятся гепаран сульфат, дерматан сульфат, кератан сульфат и ГУК. ГАГ выполняют ряд важных функций, таких как транспорт воды (за счет высокой гидрофильности), аминокислот и липидов в аваскулярных участках суставного хряща, определяют вязкоэластические и механические свойства ткани.
ПГ являются полианионами и способны к дальнейшей агрегации с формированием «сетчатых» структур. Подобные структуры ПГ вместе с фибриллами коллагена обусловливают основные свойства экстрацеллюлярного матрикса, который занимает до 98% объема хрящевой ткани. Сочетание свойств этих компонентов обеспечивает растяжимость ткани и ее устойчивость к компрессии.
Отправной точкой для дегенерации хряща является потеря ПГ, неспособность ПГ образовывать полноценные агрегаты и появление механических разрывов в коллагеновой сети. В то же время в экпериментальных моделях ОА было показано, что на ранних стадиях заболевания наблюдается усиление метаболизма хрящевой ткани с усилением синтеза компонентов матрикса. Повышение синтеза одного из классов ПГ – аггрекана (с молекулярным весом более 500 кДа) сопровождается структурными изменениями в цепях ХС, которые становятся более длинными и содержат больше эпитопов, распознаваемых специфическими моноклональными антителами [1]. Биологические причины подобных изменений в цепях ХС не совсем ясны, но предполагается, что это специфическая функция определенных последовательностей в цепи ХС, отвечающих за репарацию ткани.
ПГ суставного хряща представляет собой макромолекулу с большой вариабельностью размеров и структуры. Типичная молекула имеет молекулярный вес около 2500 кДа и состоит из центрального белка (200–300 кДа), примерно 100 цепей ХС и от 60 до 130 цепей кератан сульфата. Данные цепи присоединяются к белку ковалентными связями. Свойства ПГ в целом определяют в основном гликозаминогликановые цепи (их число, длина и размер). Но некоторые исследования ПГ, выделенных из гиалинового хряща, показали, что также может варьировать и размер центрального протеина.
Молекула ПГ условно разделяется на несколько регионов. N–концевая часть молекулы молекулярной массой 60–70 кДа является ГУК–связующим регионом и содержит гликозаминогликановые цепи, N–связанные олигосахариды и участок, взаимодействующий со связующим белком, через который мономеры ПГ присоединяются к ГУК, что позволяет формировать крупную молекулу. Смежный участок центрального протеина (молекулярный вес около 30 кДа) является кератан сульфат–связующим регионом и содержит более 60% цепей кератан сульфата. С–концевая часть является ХС–связующим участком и содержит большую часть ХС–цепей. Взаимодействие С–концевых участков белка обеспечивает образование димеров ПГ.
В гистологических исследованиях было показано, что фибриллярная коллагеновая соединительная ткань содержит другой тип ПГ (молекулярный вес всего 90–120 кДа), в состав которого входят гликозаминогликановые цепи, содержащие, помимо ХС, дерматан сульфат. В структуру этого класса ПГ входит центральный белок, который имеет молекулярный вес 40–50 кДа, и 1–2 гликозаминогликановые цепи. На центральном протеине присутствуют в основном N–связанные олигосахариды. Данный класс ПГ, в свою очередь, разделяется на 2 субпопуляции, отличающиеся по антигенным свойствам, обусловленным дерматан сульфат–содержащими цепями. Было выявлено, что поликлональные антитела выявляют только второй тип дерматан сульфат–содержащих цепей. Анализ аминокислотных последовательностей выявил, что N–терминальная часть ПГ с дерматан сульфатом 2 типа идентична ПГ кожи, в то время как ПГ, в состав которого входит дерматан сульфат 1 типа, не имеет данных N–концевых последовательностей. Основные ПГ костной ткани – это ПГ с небольшим молекулярным весом, содержащие только ХС–цепи.
ХС представляет собой гетерогенный класс полисахаридов, что обусловлено наличием разного числа сульфатных групп, присоединяющихся в различных позициях, и различиями в молекулярном весе. В зависимости от дисахаридных последовательностей ХС подразделяется на ХС типа А (хондроитин–4–сульфат), ХС типа С (хондроитин–6–сульфат) и ХС типа В, связанный с цепями дерматан сульфата, описаны ХС типа Д и Е. Различие в числе и позиции сульфатных групп дисахаридов, входящих в полисахаридные цепи, обусловливает разнообразие структуры и функции ГАГ.
ХС выполняет большое количество биологических функций. Высокосульфатированный ХС влияет на формирование нервной ткани. В процессе развития сетчатки у млекопитающих ХС помогает контролировать начало дифференциации ганглиев. Взаимодействие между ХС и фибронектином очень важно для нормальной морфологии экстрацеллюлярного матрикса и межклеточного взаимодействия. В очаге воспаления активированные моноциты/макрофаги продуцируют хондроитин–4–сульфат. 2 формы хондроитин–4–сульфата: ХС А и ХС В – способны активировать определенные мононуклеарные клетки периферической крови. ХС А активирует моноциты, ХС В – пролиферацию В–клеток. Хондроитин–6–сульфат не вызывает подобных эффектов. Было показано, что специфические моноклональные антитела блокируют ХС В–индуцированную пролиферацию В–лимфоцитов. Эти данные свидетельствуют о том, что хондроитин–4–сульфат можно отнести к новому классу иммунологических медиаторов в очаге воспаления.
При пероральном приеме биодоступность препарата составляет 15%. Фармакокинетические исследования показали, что при приеме внутрь он хорошо адсорбируется и обнаруживается в высоких концентрациях в синовиальной жидкости [2,3]. В исследованиях in vitro получены доказательства, что ХС обладает противовоспалительной активностью и способен оказывать влияние на метаболизм хрящевой ткани. ХС и его фракции могут ингибировать клеточный хемотаксис, уменьшать фагоцитоз и высвобождение лизоцима, а также защищать клеточные мембраны от воздействия кислородных радикалов. Было показано, что ХС вызывает увеличение содержания РНК в хондроцитах, коррелирующее с повышением синтеза ПГ и коллагена, и ингибирует активность лейкоцитарной эластазы [4]. Также было обнаружено, что ХС способен ингибировать ИЛ–1 стимулированный синтез простагландинов фибробластами, ингибировать ИЛ–1 зависимый синтез коллагеназы и активность агреканазы [5,6,7]. В экспериментальном исследовании ОА у кроликов, вызванного инъекцией химопапаина, было установлено, что у животных, получавших ХС в/м или per os до введения повреждающего хрящ агента, наблюдалась меньшая потеря ПГ хряща, чем в контроле [8]. В исследовании in vitro [9], было выявлено, что добавление ХС в клеточную культуру приводило к повышению концентрации ПГ в экстрацеллюлярном матриксе и дозозависимому снижению коллагенолитической активности.
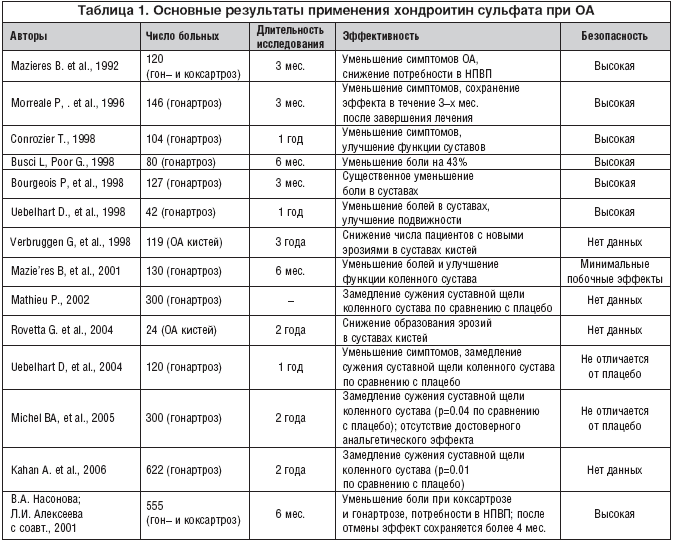
ХС используется в лечебной практике более 20 лет. За это время было проведено более 20 контролируемых исследований эффективности препарата при ОА, в которых доказан симптоматический эффект ХС при ОА коленных, тазобедренных и суставах кистей (табл. 1).
В 1992 г. Mazieres B. c соавт. было проведено двойное слепое плацебо–контролируемое исследование, в которое вошло 120 пациентов с ОА коленных суставов, принимавших ХС в дозе 1 г/сут. по интермиттирующей схеме (3 месяца приема, 2 месяца наблюдения). Основным критерием эффективности была потребность больных в НПВП. По завершению 3–месячной терапии пациенты, принимавшие ХС, испытывали значительно меньшую потребность в НПВП, причем эта тенденция сохранялась в течение последующего наблюдения. Помимо этого, было отмечено достоверное снижение интенсивности боли в коленных суставах по визуальной аналоговой шкале (ВАШ), уменьшение функционального индекса Лекена и улучшение оценки общего состояния здоровья пациентами. Переносимость препарата была хорошей, и все больные закончили исследование [10].
В 1998 году симптом модифицирующие свойства ХС были подтверждены в другом рандомизированном двойном слепом плацебо–контролируемом исследовании Bucsi L. и Poor G., в котором проводилось сравнение эффективности ХС в дозе 800 мг/сут. (40 больных) с плацебо (40 больных) в течение 6 месяцев. В исследование вошли пациенты с 1–3 рентгенологической стадией гонартроза по Келлгрену. Клинические симптомы оценивались в начале, через 1, 3 и 6 месяцев терапии. У больных, получавших ХС, отмечено достоверное улучшение по индексу Лекена, выраженности боли по ВАШ и времени прохождения 20 метров. Потребность в приеме парацетамола была ниже в группе больных, принимавших ХС, но различия не были достоверными [11].
Bourgeois P. с соавт. провели многоцентровое рандомизированное двойное слепое контролируемое исследование. В исследование вошло 127 больных с гонартрозом с 1–3 стадиями гонартроза по Келлгрену: 40 больных, принимали ХС в дозе 1200 мг/сут. в виде геля per os, 43 больных – аналогичную дозу ХС в капсулах (400 мг х 3 раза в сутки) и 44 больных получали плацебо. Длительность терапии составила 3 месяца. В обеих группах больных, принимавших ХС, отмечалость значительное снижение интенсивности боли (оцененной по ВАШ) и индекса Лекена (р<0,01) по сравнению с группой плацебо. Переносимость терапии была хорошей, все больные закончили исследование. Авторы заключили, что ХС уменьшает клинические симптомы ОА и улучшает функциональную способность суставов. Эффективность ХС, принимаемого в дозе 1200 мг/сут. однократно, не отличалась от эффективности 3–кратного приема 400 мг ХС [12].
Способность ХС влиять на симтомы ОА была доказана в исследовании Morreale P. с соавт., которые оценили эффективность ХС у 146 пациентов с гонартрозом. 74 больных получали ХС по 400 мг 3 раза в сутки в течение 3 месяцев с последующим 3–месячным наблюдением. 72 больных принимали диклофенак 150 мг/сут., на фоне которого отмечалось уменьшение боли в коленных суставах к 10–му дню терапии, и возобновление ее через очень короткий промежуток времени после прерывания лечения. В группе ХС симптоматический эффект отмечался через 1 месяц от начала терапии и сохранялся в течение 3 месяцев после ее окончания. Индекс Лекена через 3 месяца лечения снизился на 78% от исходного, по окончании 3 месяцев наблюдения он оставался на 64,4% ниже первоначального значения. В группе диклофенака снижение индекса составило 62,6%, через 3 месяца после прекращения приема диклофенака – только 29,7%. Т.о., в этом исследовании авторы показали не только более высокую эффективность ХС, но и выраженный эффект последействия препарата по сравнению с традиционной терапией НПВП [13].
Способность ХС контролировать течение ОА продемонстрировано в ходе одногодичного рандомизированного плацебо–контролируемого исследования, которое включало 42 больных с симптоматическим ОА коленных суставов обоих полов в возрасте 35–78 лет [14]. Для оценки ширины суставной щели коленного сустава использовался компьютеризированный анализ. Группа ХС принимала препарат в дозе 800 мг/сут. Помимо клинической оценки ОА (выраженность боли и функциональная недостаточность), проводилась оценка ширины суставной щели в медиальном отделе тибио–феморального сустава, а также уровень биохимических маркеров костного и хрящевого метаболизма. Исследование подтвердило, что ХС вызывает достоверное уменьшение болевого синдрома и функциональной недостаточности. Через год изменения ширины суставной щели в группе ХС не наблюдалось, в то время как в группе плацебо отмечено заметное ее сужение. Отмечалась стабилизация костного и хрящевого обмена на фоне приема ХС. И хотя исследование было пилотным и включало небольшое число больных, авторам удалость показать, что ХС способен не только влиять на симптомы ОА, но и оказывать структурно модифицирующее действие, т.е. стабилизировать ширину суставной щели в тибио–феморальном суставе.
В другом РКИ после 1 года лечения 100 пациентов с остеоартрозом коленных суставов в виде 2 трехмесячных курсов хондроитина сульфата 800 мг/сут. отмечено снижение индекса Лекена на 36% против 23% в группе плацебо. Подобное же соотношение получено и по другим вторичным показателям. В группе хондроитина не отмечено рентгенологических признаков сужения суставной щели, в то время как в группе плацебо сужение было значительным. Таким образом, получены доказательства того, что хондроитин сульфат уменьшает боль и улучшает функцию коленного сустава. Замедление рентгенологического прогрессирования сужения суставной щели при использовании хондроитина расценено как дополнительное доказательство в пользу его структурно–модифицирующих свойств [15].
Важные результаты получены в процессе 6–месячного открытого рандомизированного многоцентрового (9 центров) исследования эффективности и безопасности ХС в России, в которое было включено 555 пациентов с ОА коленного или тазобедренного суставов I–III стадий. Основную группу составили 192 пациента, контрольную группу – 363 пациента. Препарат назначали в дозе 1,5 г/сут. в течение первых 3 недель, затем 1 г/сут. На фоне лечение отмечена достоверная положительная динамика индекса Лекена (в 2 раза при гонартрозе и в 2,5 раза при коксартрозе, p<0,05), боли в покое (в 3,8 раз при гонартрозе и в 3 раза при коксартрозе, p<0,05) и при ходьбе (p<0,05) и потребности в НПВП (в 5,7 раз при гонартрозе и в 4,6 раз при коксартрозе). В целом клиническое улучшение отмечено у 90,2% пациентов. После завершения исследования лечебный эффект сохранялся в течение 4,1 мес. при коксартрозе и 4,6 мес. при гонартрозе. Интересные данные были получены при анализе динамики ОА за год после окончания лечения ХС, свидетельствующие о том, что терапия ХС в течение даже относительно короткого периода времени способствовала в дальнейшем снижению частоты обострений заболевания, а следовательно, госпитализаций и обращений больных в поликлиники, что, безусловно, имеет важное значение с точки зрения улучшения качества жизни больных ОА [16].
Мета–анализ 7 исследований, включавших 372 пациента с ОА коленных суставов, леченных ХС в дозе 800–1600 мг/сут. в течение 6 месяцев и более, показал достоверное уменьшение боли и и функционального индекса Лекена по сравнению с плацебо [17].
В другом мета–анализе 15 рандомизированных контролируемых исследований за период с 1966 по 1999 гг. (404 больных ОА с преимущественным поражением коленных и тазобедренных суставов) свидетельствуют об эффективности препарата по сравнению с плацебо по влиянию на болевой синдром, функциональный индекс Лекена, уменьшению дозы принимаемых НПВП и анальгетиков, кроме того, отмечена хорошая переносимость ХС [18], в которых исследовался эффект хондроитина и глюкозамина при остеоартрозе коленных суставов, получен обобщенный эффект для глюкозамина 0,44 (95% доверительный интервал, 0,24–0,64), для хондроитина 0,78 (95% CI, 0,60–0,95) [9].
В 1998 г. опубликованы результаты рандомизированного двойного слепого плацебо–контролируемого проспективного исследования хондроитин сульфата у больных ОА суставов кистей. В исследование вошло 119 больных, 34 больных принимали ХС 1200 мг/сут., 85 больных – плацебо. Длительность терапии составила 3 года, в течение которых ежегодно проводилась рентгеногафия кистей. В группе ХС за 3–летний период выявлено достоверное уменьшение числа новых эрозий в суставах кистей [19].
Эти данные были подтверждены исследованиями Rovetta G с соавт. на основании лечения 24 больных ХС в дозе 800 мг/сут. в течение 2 лет [20].
Дальнейшие исследования ХС были направлены на изучение структурно–модифицирующих свойства препарата при ОА коленных суставов. Исследование, проведенное Michel BA с соавт., было первым, в котором использовалась структурная «конечная точка» (динамика изменения ширины суставной щели) в качестве главного критерия оценки действия ХС. Было показано, что терапия ХС в дозе 800 мг/сут. в течение 2 лет оказывала статистически достоверное стабилизирующее влияние на ширину суставной щели у больных гонартрозом [21]. В 2006 году на сессии EULAR Kahan A. c соавт. доложили результаты исследования «STOPP», согласующиеся с результатами предыдущей работы. На основании анализа результатов лечения ХС в течение 2 лет 622 больных гонартрозом было показано замедление прогрессирования заболевания у пациентов, леченных ХС, по сравнению с плацебо–группой.
Как известно, ХС является нетоксичной субстанцией, поскольку это природный компонент, входящий в состав соединительной ткани человека и животных. Результаты многочисленных приведенных исследований свидетельствуют о прекрасной переносимости препарата. Более того, длительное использование ХС в некоторых европейских странах (во Франции с 1969 года, в Швейцарии с 1982 года, в Италии с 1990 года) не выявило развитие каких либо токсических реакций.
Таким образом, экспериментальные и клинические исследования свидетельствуют о статистически достоверном уменьшении болевого синдрома у больных ОА коленных, тазобедренных и суставов кистей на фоне терапии ХС по сравнению с плацебо. При ОА коленных суставов отмечено улучшение функционального индекса Лекена и уменьшение суточной потребности в НПВП и анальгетиках. Кроме того, эффект после отмены ХС сохраняется в среднем в течение 3 месяцев в отношении болевого синдрома и функции суставов. Чрезвычайно интересны данные по влиянию ХС на прогрессирование ОА суставов кистей (образование «новых» эрозий) и коленных суставов (рентгенологическая динамика суставной щели), вместе с тем они требуют дальнейших подтверждений. И хотя механизм действия препарата на различные патогенетические звенья заболевания до конца не ясен, приведенные данные доказывают эффективность ХС при ОА, на основании чего он внесен в рекомендации EULAR по лечению ОА коленных, тазобедренных и суставов кистей.
Литература
1. Hardingham TE, Fosang AJ, Dubhia J. The structure, function and turnover of aggrecan, the large aggregating proteoglycan from cartilage. Aur J Clin Chem Clin Biochem, 1994, 32:249–257.
2. Сonte A, De Bernardi M, Palmieri L et al. Metabolic fate of exogenous chondroitin–sulfate in man. Arzeim–Forch/Drug Res, 1991, 41:768–72.
3. Palmieri L, Сonte A, Giovannini L et al. Metabolic fate of exogenous chondroitin–sulfate in the experimental animal. Arzeim–Forch/Drug Res, 1990, 40:319–23.
4. Baici A., Bradamante P. Interaction between human leukocyte elastase and chondroitin sulfate. Chem. Biol. Interaction, 1984, 51:1–11
5. Lippielo L., Grande D. In vitro chondroprotection of glucosamine and chondroitin sulfate in a rabbit model of a OA and demonstration of metabolic synergy on chondrocyte in vitro. Ann. Rheum. Dis., 2000, 59 (Suppl 1):266
6. Yaron I., Shirasi R., Judovich R., Yaron M. Chondroitin sulfate inhibits prostaglandin E2 production in synovial cell cultures and reverses IL–1 inhibition of cartilage synthesis. Ann. Rheum. Dis., 2000, 59 (Suppl 1):265
7. Ronca F,Palmieri Let al. Anti–inflammatory activity of chondroitin sulfate. Osteoarthritis Cartilage 1998; 6 (suppl A): 14–21.
8.Uebelhart D, Thonar E, Zhang J, Williams J. Protective effect of exogenous 4,6–sulfatе in the acute degradation of articular cartilage in the rabbits/ Osteoart.&Cartilage 1998,6,(supplement A): 6–13.
9. Bassleer C, Henrotin Y, Franchimont P. In vitro evaluation of drugs proposed as chondroprotective agents. Int J Tissue React. 1992, 14:231–241.
10. Mazieres, B., Loyau, G., Menkes,C. J., Valat, J. P., Dreiser, R. L., Charlot,J., and Masounabe–Puyanne, A. (1992). Chondroitin sulfate for the treatment of coxarthrosis andgonarthrosis: A prospective, multicenter, placebo–controlled, double–blind trial with fivemonths follow–up. Rev. Rhum. Mal. Osteoarthric. 59, 466–472.
11. Bucsi L, Poor G. Efficacy and tolerability of oral chondroitin sulfate as a symptomatic slow– acting drug for osteoarthritis (SYSADOA) in the treatment of knee osteoarthritis. Osteoarthritis & Cartilage 1998; 6:31–36.
12. Bourgeois, P., Chales, G., Dehais, J., Delcambre, B., Kuntz, J. L., and Rozemberg, S. (1998). Efficacy and tolerability of chondroitin sulfate 1200 mg/day vs chondroitin sulfate 3400 mg/day vs placebo.OsteoarthritisCartilage6(Suppl.A),25–30.
13. Morreale, P., Manopulo, R., Galati, M., Boccanera, L., Saponati, G., and Bocchi, L. (1996). Comparison between the anti–inflammatory efficacy of chondroitin sulfate and diclofenac sodium in patients with knee osteoarthritis. J. Rheumatol. 23, 1358–1391.
14. Uebelhart, Thonar E, Delmas P et al. Effects of oral chondroitin sulfate on the progression of knee osteoarthritis: a pilot study. Osteoarthritis Cartilage 1998; 6 (suppl A): 39–46.
15. Uebelhart D, Malaise M, Marcolongo R, DeVathaire F, Piperno M, Mailleux E, Fioravanti A, Matoso L, Vignon E. Intermittent treatment of knee osteoarthritis with oral chondroitin sulfate: a one–year, randomized, double–blind, multicenter study versus placebo. Osteoarthritis Cartilage. 2004 Apr;12(4):269–76.
16. Алексеева Л.И., Архангельская Г.С., Давыдова А.Ф., Кармильцева Е.А., Коган K. M., Maзуров В.И., Ребров A.П, Рябицева O.Ф, Шемеровская T.Г, Якушин С.С. Многоцентровое исследование структума в России. Тер. Архив 2003, 75, 82–86.
17. Leeb BF, Schweitzer H, Montag K, Smolen JS. A meta–analysis of chondroitinsulfate in the treatment of osteoarthritis. Osteoarthritis Cartilage, 1999,7, Suppl A, abstr 130.
18. McAlindon TE, LaValley MP, Gulin JP, Felson DT. Glucosamine and chondroitin for treatment of osteoarthritis: a systematic quality assessment and meta–analysis. JAMA. 2000 Mar 15;283(11):1469–75.
19. Verbruggen, G., Goemaere, S., and Veys, E. M. (1998). Chondroitin sulfate: S/DMOAD (structure/disease modifying anti–osteoarthritis drug) in the treatment of finger joint OA. Osteoarthritis Cartilage 6(Suppl A), 37–38.
20. Rovetta G, Monteforte P, Molfetta G, Balestra G. A two–years study of chondroitin suffate in erosive osteoarthritis of the hand: behavior of erosions, osteophytes, pain and hand dysfunction. Drug Exp Clin Res 2004; 30(1):11–16
21. Michel, B. A., Stucki, G., Frey, D., DeVathaire, F., Vignon, E., Bruehlmann, P., and Uebelhart, D. (2005). Chondroitin 4 and 6 sulfate in osteoarthritis of the knee: A randomized, controlled trial. Arthritis Rheum. 52 (3), 779–786.












