–Ю–Р —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –≤–Њ –≤—Б–µ—Е –њ–Њ–њ—Г–ї—П—Ж–Є—П—Е. –†–µ–љ—В–≥–µ–љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є–µ –њ—А–Є–Ј–љ–∞–Ї–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –≤—Л—П–≤–ї—П—О—В—Б—П –њ—А–Є–±–ї–Є–Ј–Є—В–µ–ї—М–љ–Њ —Г 50% –ї—О–і–µ–є –≤ –≤–Њ–Ј—А–∞—Б—В–µ 55 –ї–µ—В –Є —Г 80% –ї–Є—Ж —Б—В–∞—А—И–µ 75 –ї–µ—В. –Я–Њ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–Љ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є—П–Љ, —Н—В–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ —П–≤–ї—П–µ—В—Б—П –Љ—Г–ї—М—В–Є—Д–∞–Ї—В–Њ—А–Є–∞–ї—М–љ—Л–Љ, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ—Л–Љ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–µ–Љ –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е –Є —Б—А–µ–і–Њ–≤—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —Б–Њ –Љ–љ–Њ–≥–Є–Љ–Є –њ—А–Є–Ј–љ–∞–љ–љ—Л–Љ–Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є —А–Є—Б–Ї–∞ (–≤–Њ–Ј—А–∞—Б—В, –њ–Њ–ї, –љ–∞—Б–ї–µ–і—Б—В–≤–µ–љ–љ–∞—П –њ—А–µ–і—А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ–Њ—Б—В—М, –Є–Ј–±—Л—В–Њ—З–љ—Л–є –≤–µ—Б, –Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Є–µ –Є –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Л–µ —Д–∞–Ї—В–Њ—А—Л). –°–Њ–≥–ї–∞—Б–љ–Њ —Н—В–Њ–Љ—Г, –Ю–Р –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –≥—А—Г–њ–њ—Г –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —Б—Г—Б—В–∞–≤–Њ–≤ —А–∞–Ј–ї–Є—З–љ–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–Є, –Ї–Њ—В–Њ—А—Л–µ –Є–Љ–µ—О—В —Б—Е–Њ–і–љ—Л–µ –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ, –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П.
–Э–µ—Б–Љ–Њ—В—А—П –љ–∞ –≤—Л—Б–Њ–Ї—Г—О —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –Ю–Р, –њ–∞—В–Њ–≥–µ–љ–µ–Ј —Н—В–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –≤—Б–µ –µ—Й–µ –і–Њ –Ї–Њ–љ—Ж–∞ –љ–µ –Є–Ј—Г—З–µ–љ. –Ф–∞–љ–љ—Л–µ –Њ —В–Њ–Љ, —З—В–Њ –њ—А–Є –Ю–Р –≤ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –њ—А–Њ—Ж–µ—Б—Б –≤–Њ–≤–ї–µ–Ї–∞–µ—В—Б—П –љ–µ —В–Њ–ї—М–Ї–Њ —Б—Г—Б—В–∞–≤–љ—Л–є —Е—А—П—Й, –љ–Њ –Є —Б—Г–±—Е–Њ–љ–і—А–∞–ї—М–љ–∞—П –Ї–Њ—Б—В—М, —Б–Є–љ–Њ–≤–Є–∞–ї—М–љ–∞—П –Њ–±–Њ–ї–Њ—З–Ї–∞, –Ї–∞–њ—Б—Г–ї–∞ —Б—Г—Б—В–∞–≤–∞ –Є –њ–µ—А–Є–∞—А—В–Є–Ї—Г–ї—П—А–љ—Л–µ —В–Ї–∞–љ–Є (—Б–≤—П–Ј–Ї–Є, –Љ—Л—И—Ж—Л), –њ—А–Є–≤–µ–ї–Є –Ї –њ–Њ–љ–Є–Љ–∞–љ–Є—О –µ–≥–Њ –Ї–∞–Ї «–Њ—А–≥–∞–љ–љ–Њ–є» –њ–∞—В–Њ–ї–Њ–≥–Є–Є [4].
–Т–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –љ–∞ —Б—Г—Б—В–∞–≤–љ—Л–є —Е—А—П—Й —А–∞–Ј–ї–Є—З–љ—Л—Е –Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Є—Е –Є —Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤, –≤–Ї–ї—О—З–∞—П –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ, –њ—А–Є–≤–Њ–і–Є—В –Ї –і–µ–≥—А–∞–і–∞—Ж–Є–Є –Љ–∞–Ї—А–Њ–Љ–Њ–ї–µ–Ї—Г–ї –Љ–∞—В—А–Є–Ї—Б–∞ —Е—А—П—Й–∞. –У–Њ–Љ–µ–Њ—Б—В–∞–Ј —Н–Ї—Б—В—А–∞—Ж–µ–ї–ї—О–ї—П—А–љ–Њ–≥–Њ –Љ–∞—В—А–Є–Ї—Б–∞ –Ј–∞–≤–Є—Б–Є—В –Њ—В –±–∞–ї–∞–љ—Б–∞ –Љ–µ–ґ–і—Г –Ї–∞—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–Љ–Є –Є –∞–љ–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Њ—Ж–µ—Б—Б–∞–Љ–Є, –љ–∞—А—Г—И–µ–љ–Є–µ –Ї–Њ—В–Њ—А–Њ–≥–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —А–∞–Ј–≤–Є—В–Є—О –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Я—А–Є—З–µ–Љ –љ–∞ —А–∞–љ–љ–Є—Е —Б—В–∞–і–Є—П—Е –±–Њ–ї–µ–Ј–љ–Є –љ–∞–±–ї—О–і–∞–µ—В—Б—П —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л–є –≥–Є–њ–µ—А–Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–є –Њ—В–≤–µ—В —Е–Њ–љ–і—А–Њ—Ж–Є—В–Њ–≤ –љ–∞ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –њ—А–Њ—В–µ–Њ–≥–ї–Є–Ї–∞–љ–Њ–≤ –≤ –Љ–∞—В—А–Є–Ї—Б–µ —Е—А—П—Й–∞, –Ї–Њ—В–Њ—А—Л–є, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ, –Є–Љ–µ–µ—В –њ—А–Њ—В–µ–Ї—В–Є–≤–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –Є —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ—В—Б—П –Ї–∞–Ї –њ—А–Њ—В–Є–≤–Њ–і–µ–є—Б—В–≤–Є–µ —А–∞–Ј–ї–Є—З–љ—Л–Љ —Б—А–µ–і–Њ–≤—Л–Љ —Д–∞–Ї—В–Њ—А–∞–Љ, –Ј–∞–њ—Г—Б–Ї–∞—О—Й–Є–Љ –њ—А–Њ—Ж–µ—Б—Б –і–µ–≥—А–∞–і–∞—Ж–Є–Є —Е—А—П—Й–∞. –Я—А–Є –і–∞–ї—М–љ–µ–є—И–µ–Љ —А–∞–Ј–≤–Є—В–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ —Б–љ–Є–ґ–∞–µ—В—Б—П —Б–Є–љ—В–µ–Ј —Е–Њ–љ–і—А–Њ—Ж–Є—В–∞–Љ–Є –Њ—Б–љ–Њ–≤–љ—Л—Е –Љ–∞–Ї—А–Њ–Љ–Њ–ї–µ–Ї—Г–ї: –њ—А–Њ—В–µ–Њ–≥–ї–Є–Ї–∞–љ–Њ–≤ –Є –Ї–Њ–ї–ї–∞–≥–µ–љ–∞ II —В–Є–њ–∞, – –Є –њ–Њ–≤—Л—И–∞–µ—В—Б—П —Б–Є–љ—В–µ–Ј –Ї–Њ–ї–ї–∞–≥–µ–љ–∞ I, III, –• —В–Є–њ–Њ–≤. –Р–Ї—В–Є–≤–∞—Ж–Є—П —Е–Њ–љ–і—А–Њ—Ж–Є—В–Њ–≤ –њ—А–Є–≤–Њ–і–Є—В, —Б –Њ–і–љ–Њ–є —Б—В–Њ—А–Њ–љ—Л, –Ї —Г—Е—Г–і—И–µ–љ–Є—О —Б–Є–љ—В–µ–Ј–∞ –њ–Њ–ї–љ–Њ—Ж–µ–љ–љ—Л—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –Љ–∞—В—А–Є–Ї—Б–∞ —Е—А—П—Й–∞, –∞ —Б –і—А—Г–≥–Њ–є – –Ї –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤ (–Є–љ—В–µ—А–ї–µ–є–Ї–Є–љ–∞–1, –Є–љ—В–µ—А–ї–µ–є–Ї–Є–љ–∞–6, —Д–∞–Ї—В–Њ—А–∞ –љ–µ–Ї—А–Њ–Ј–∞ –Њ–њ—Г—Е–Њ–ї–Є– α), —Ж–Є–Ї–ї–Њ–Њ–Ї—Б–Є–≥–µ–љ–∞–Ј—Л 2, –Њ–Ї—Б–Є–і–∞ –∞–Ј–Њ—В–∞ [7].
–Т–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ —А–∞–Ј–≤–Є—В–Є–Є –Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є–≥—А–∞–µ—В –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ —Б–Є–љ–Њ–≤–Є–∞–ї—М–љ–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є (—Б–Є–љ–Њ–≤–Є—В). –Т –Ј–∞—А—Г–±–µ–ґ–љ–Њ–є –ї–Є—В–µ—А–∞—В—Г—А–µ –≤–Љ–µ—Б—В–Њ —В–µ—А–Љ–Є–љ–∞ «–Ю–Р» –Є—Б–њ–Њ–ї—М–Ј—Г—О—В —В–µ—А–Љ–Є–љ «–Њ—Б—В–µ–Њ–∞—А—В—А–Є—В», —З—В–Њ –≤–њ–Њ–ї–љ–µ –Њ–њ—А–∞–≤–і–∞–љ–Њ, —В–∞–Ї –Ї–∞–Ї –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Є—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –њ—А–Є –Ю–Р (–љ–µ–є—В—А–Њ—Д–Є–ї—М–љ–∞—П –Є –Љ–∞–Ї—А–Њ—Д–∞–≥–∞–ї—М–љ–∞—П –Є–љ—Д–Є–ї—М—В—А–∞—Ж–Є—П) –≤ —Б–Є–љ–Њ–≤–Є–Є, —Е—А—П—Й–µ –Є —Б—Г–±—Е–Њ–љ–і—А–∞–ї—М–љ–Њ–є –Ї–Њ—Б—В–Є –≤—Л—П–≤–ї—П–µ—В—Б—П —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Љ–µ–і–Є–∞—В–Њ—А–Њ–≤ [4,5]. –Я–Њ–ї–∞–≥–∞—О—В, —З—В–Њ –њ—А–Њ—Ж–µ—Б—Б—Л, –њ—А–Њ–Є—Б—Е–Њ–і—П—Й–Є–µ –≤ —Б—Г–±—Е–Њ–љ–і—А–∞–ї—М–љ–Њ–є –Ї–Њ—Б—В–Є –Є —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –Є–Ј–Љ–µ–љ–µ–љ–Є–µ–Љ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –Њ—Б—В–µ–Њ–±–ї–∞—Б—В–Њ–≤, —П–≤–ї—П—О—В—Б—П —З–∞—Б—В—М—О –Њ–±—Й–µ–≥–Њ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –њ—А–Є –Ю–Р [6]. –Т –њ—А–Њ—Ж–µ—Б—Б–µ —А–∞–Ј–≤–Є—В–Є—П –Ю–Р —Б—Г–±—Е–Њ–љ–і—А–∞–ї—М–љ–∞—П –Ї–Њ—Б—В—М –њ–Њ–і–≤–µ—А–≥–∞–µ—В—Б—П —Б–Ї–ї–µ—А–Њ–Ј–Є—А–Њ–≤–∞–љ–Є—О –≤ —Г—З–∞—Б—В–Ї–∞—Е, –ї–Є—И–µ–љ–љ—Л—Е —Е—А—П—Й–∞, —З—В–Њ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –љ–∞—А—Г—И–µ–љ–Є–µ–Љ –µ–µ –Љ–Є–Ї—А–Њ–∞—А—Е–Є—В–µ–Ї—В–Њ–љ–Є–Ї–Є. –Т —А—П–і–µ –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –±—Л–ї–Њ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ, —З—В–Њ –Ї–Њ—Б—В–љ–Њ–Љ–Њ–Ј–≥–Њ–≤–Њ–є –Ї–∞–љ–∞–ї –Є–љ—Д–Є–ї—М—В—А–Є—А—Г–µ—В—Б—П –ї–Є–њ–Є–і–∞–Љ–Є, —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–Њ–Љ –Є —Д–Є–±—А–Є–љ–Њ–Љ. –Я—А–Њ–і—Г–Ї—В—Л –і–µ–≥—А–∞–і–∞—Ж–Є–Є —Е—А—П—Й–∞ –Њ–±–ї–∞–і–∞—О—В –∞–љ—В–Є–≥–µ–љ–љ—Л–Љ–Є —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є –Є, –њ–Њ–њ–∞–і–∞—П –≤ —Б–Є–љ–Њ–≤–Є–∞–ї—М–љ—Г—О –ґ–Є–і–Ї–Њ—Б—В—М, –њ—А–Њ–≤–Њ—Ж–Є—А—Г—О—В —Б–Є–љ–Њ–≤–Є–∞–ї—М–љ–Њ–µ –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ, –њ—А–Є–≤–Њ–і—П—Й–µ–µ –Ї –љ–∞—А—Г—И–µ–љ–Є—О –Њ–±–Љ–µ–љ–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –≤ —Б–Є–љ–Њ–≤–Є–Њ—Ж–Є—В–∞—Е, –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ —З–µ–≥–Њ —Б—В—А–∞–і–∞–µ—В –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ —Н–љ–і–Њ–≥–µ–љ–љ—Л—Е –≥–Є–∞–ї—Г—А–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –Є —Б–Є–љ–Њ–≤–Є–∞–ї—М–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є. –Я–Њ–Љ–Є–Љ–Њ —Н—В–Њ–≥–Њ –Љ–µ–і–Є–∞—В–Њ—А—Л –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П, –њ—А–Њ–і—Г—Ж–Є—А—Г—О—Й–Є–µ—Б—П –≤ —Б–Є–љ–Њ–≤–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Ї–∞—Е, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—В –њ–Њ–≤—Л—И–µ–љ–Є—О –њ—А–Њ–љ–Є—Ж–∞–µ–Љ–Њ—Б—В–Є —Б–Њ—Б—Г–і–Њ–≤ –Є —Г—Б–Є–ї–µ–љ–љ–Њ–є —В—А–∞–љ—Б—Д—Г–Ј–Є–Є –њ–ї–∞–Ј–Љ—Л –≤ —Б–Є–љ–Њ–≤–Є–∞–ї—М–љ—Г—О –ґ–Є–і–Ї–Њ—Б—В—М, —З—В–Њ –≤–µ–і–µ—В –Ї —Г–Љ–µ–љ—М—И–µ–љ–Є—О –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≥–Є–∞–ї—Г—А–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –Є —Б–љ–Є–ґ–µ–љ–Є—О –≤—П–Ј–Ї–Њ—Н–ї–∞—Б—В–Є—З–µ—Б–Ї–Є—Е –Є –ї—Г–±—А–Є–Ї–∞–љ—В–љ—Л—Е —Б–≤–Њ–є—Б—В–≤ —Б–Є–љ–Њ–≤–Є–∞–ї—М–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є –Є, –Ї–∞–Ї —Б–ї–µ–і—Б—В–≤–Є–µ, –µ–µ –Ј–∞—Й–Є—В–љ—Л—Е –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–µ–є [6].
–Т—Л—И–µ–Њ–њ–Є—Б–∞–љ–љ—Л–µ –њ—А–Њ—Ж–µ—Б—Б—Л –њ—А–Є–≤–Њ–і—П—В –Ї –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—О –±–Њ–ї–Є – –Њ—Б–љ–Њ–≤–љ–Њ–≥–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—П–≤–ї–µ–љ–Є—П –Ю–Р – –Є –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є –і–µ—Д–Њ—А–Љ–∞—Ж–Є–Є —Б—Г—Б—В–∞–≤–Њ–≤ —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є. –†–µ–љ—В–≥–µ–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –Ю–Р —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П —Б—Г–ґ–µ–љ–Є–µ–Љ —Б—Г—Б—В–∞–≤–љ–Њ–є —Й–µ–ї–Є, –Њ—Б—В–µ–Њ—Д–Є—В–Њ–Ј–Њ–Љ, —Б—Г–±—Е–Њ–љ–і—А–∞–ї—М–љ—Л–Љ —Б–Ї–ї–µ—А–Њ–Ј–Њ–Љ –Є –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ–Љ –Ї–Є—Б—В.
–І–∞—Й–µ –≤—Б–µ–≥–Њ –≤ –њ—А–Њ—Ж–µ—Б—Б –≤–Њ–≤–ї–µ–Ї–∞—О—В—Б—П –љ–∞–≥—А—Г–Ј–Њ—З–љ—Л–µ —Б—Г—Б—В–∞–≤—Л (–Ї–Њ–ї–µ–љ–љ—Л–µ, —В–∞–Ј–Њ–±–µ–і—А–µ–љ–љ—Л–µ), –Љ–µ–ї–Ї–Є–µ —Б—Г—Б—В–∞–≤—Л –Ї–Є—Б—В–µ–є (–і–Є—Б—В–∞–ї—М–љ—Л–µ –Є –њ—А–Њ–Ї—Б–Є–Љ–∞–ї—М–љ—Л–µ –Љ–µ–ґ—Д–∞–ї–∞–љ–≥–Њ–≤—Л–µ —Б—Г—Б—В–∞–≤—Л, –њ–µ—А–≤—Л–є –њ—П—Б—В–љ–Њ––Ј–∞–њ—П—Б—В–љ—Л–є —Б—Г—Б—В–∞–≤) –Є –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Є–Ї. –Э–∞–Є–±–Њ–ї–µ–µ –≤–∞–ґ–љ–Њ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –Є–Љ–µ–µ—В –њ–Њ—А–∞–ґ–µ–љ–Є–µ –Ї–Њ–ї–µ–љ–љ—Л—Е –Є —В–∞–Ј–Њ–±–µ–і—А–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤, —П–≤–ї—П—О—Й–µ–µ—Б—П –Њ—Б–љ–Њ–≤–љ–Њ–є –њ—А–Є—З–Є–љ–Њ–є —Б–љ–Є–ґ–µ–љ–Є—П –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є –Є –Є–љ–≤–∞–ї–Є–і–Є–Ј–∞—Ж–Є–Є –±–Њ–ї—М–љ—Л—Е, —Б—В—А–∞–і–∞—О—Й–Є—Е –Ю–Р.
–Ы–µ—З–µ–љ–Є–µ –Ю–Р –љ–∞–њ—А–∞–≤–ї–µ–љ–Њ –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –љ–∞ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –±–Њ–ї–Є, —Г–ї—Г—З—И–µ–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–Є —Б—Г—Б—В–∞–≤–Њ–≤, –Ј–∞–Љ–µ–і–ї–µ–љ–Є–µ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –±–Њ–ї–µ–Ј–љ–Є –Є, –≤ –Ї–Њ–љ–µ—З–љ–Њ–Љ —Б—З–µ—В–µ, –љ–∞ —Г–ї—Г—З—И–µ–љ–Є–µ –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є –±–Њ–ї—М–љ—Л—Е.
–Я–µ—А–≤—Л–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ –ї–µ—З–µ–љ–Є—О –Ю–Р –Ї—А—Г–њ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤ –±—Л–ї–Є –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ—Л –≤ 1995 –≥., –Ї–Њ—В–Њ—А—Л–µ –њ–Њ –Љ–µ—А–µ –љ–∞–Ї–Њ–њ–ї–µ–љ–Є—П –љ–Њ–≤—Л—Е –і–∞–љ–љ—Л—Е –і–Њ–њ–Њ–ї–љ—П–ї–Є—Б—М –Є –Є–Ј–Љ–µ–љ—П–ї–Є—Б—М (—В–∞–±–ї. 1). –Ф–ї–Є—В–µ–ї—М–љ–Њ–µ –≤—А–µ–Љ—П —Б–њ–Є—Б–Њ–Ї –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Њ–≥—А–∞–љ–Є—З–Є–≤–∞–ї—Б—П –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–Љ–Є —Б—А–µ–і—Б—В–≤–∞–Љ–Є, –≤–ї–Є—П—О—Й–Є–Љ–Є –љ–∞ –±–Њ–ї—М –Є –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ –≤ —Б—Г—Б—В–∞–≤–∞—Е (—Б–Є–Љ–њ—В–Њ–Љ––Љ–Њ–і–Є—Д–Є—Ж–Є—А—Г—О—Й–Є–µ —Б—А–µ–і—Б—В–≤–∞). –Я—А–µ–і–ї–∞–≥–∞–ї–Њ—Б—М –љ–∞—З–Є–љ–∞—В—М –ї–µ—З–µ–љ–Є–µ —Б –њ—А–Њ—Б—В—Л—Е –∞–љ–∞–ї—М–≥–µ—В–Є–Ї–Њ–≤ – –∞—Ж–µ—В–Њ–Љ–Є–љ–Њ—Д–µ–љ–∞ (–њ–∞—А–∞—Ж–µ—В–∞–Љ–Њ–ї) – –Є –і–∞–ї–µ–µ, –њ—А–Є –Є—Е –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є, –љ–∞–Ј–љ–∞—З–∞—В—М –Э–Я–Т–Я –Є–Ј –≥—А—Г–њ–њ—Л –¶–Ю–У–2–—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –Є, –њ—А–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є, –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ –Э–Я–Т–Я –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –≥–∞—Б—В—А–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ—Л–Љ–Є —Б—А–µ–і—Б—В–≤–∞–Љ–Є –њ—А–Є –љ–∞–ї–Є—З–Є–Є —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є —Б–Њ —Б—В–Њ—А–Њ–љ—Л –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ –њ—А–Њ–≤–µ–і–µ–љ–љ—Л–µ —Д–∞—А–Љ–∞–Ї–Њ—Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є –љ–µ —В–Њ–ї—М–Ї–Њ —И–Є—А–Њ–Ї–Њ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Э–Я–Т–Я –≤ —А–µ–∞–ї—М–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ, –љ–Њ –Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–є –њ—А–Њ—Ж–µ–љ—В —А–∞–Ј–ї–Є—З–љ—Л—Е –њ–Њ–±–Њ—З–љ—Л—Е –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є [8,9], –Њ—Б–Њ–±–µ–љ–љ–Њ —Г –±–Њ–ї—М–љ—Л—Е –≤ —Б—В–∞—А—И–Є—Е –≤–Њ–Ј—А–∞—Б—В–љ—Л—Е –≥—А—Г–њ–њ–∞—Е —Б —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є, –њ–Њ—Н—В–Њ–Љ—Г –њ–Њ—Б–ї–µ–і–љ–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є, —Б–Њ–Ј–і–∞–љ–љ—Л–µ –µ–≤—А–Њ–њ–µ–є—Б–Ї–Є–Љ–Є –Є –∞–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Є–Љ–Є —Г—З–µ–љ—Л–Љ–Є, –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ—Л–µ –≤ —Д–µ–≤—А–∞–ї–µ 2008 –≥., –≥–Њ–≤–Њ—А—П—В –Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Є —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е, –Є –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Э–Я–Т–Я –њ—А–Є –Ю–Р –≤ –Љ–Є–љ–Є–Љ–∞–ї—М–љ—Л—Е —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л—Е –і–Њ–Ј–∞—Е –Є, –њ–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є, –Ї–Њ—А–Њ—В–Ї–Є–Љ–Є –Ї—Г—А—Б–∞–Љ–Є [10]. –Ю—Б–Њ–±—Г—О –Њ—Б—В–Њ—А–Њ–ґ–љ–Њ—Б—В—М —Б–ї–µ–і—Г–µ—В –њ—А–Њ—П–≤–ї—П—В—М –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –Э–Я–Т–Я —Г –њ–Њ–ґ–Є–ї—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Њ—Б–Њ–±–µ–љ–љ–Њ –њ—А–Є –љ–∞–ї–Є—З–Є–Є —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є.
–Т 2003 –≥. EULAR (–Х–≤—А–Њ–њ–µ–є—Б–Ї–∞—П –∞–љ—В–Є—А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–∞—П –ї–Є–≥–∞) –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–ї–∞ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ –ї–µ—З–µ–љ–Є—О –Ю–Р –Ї–Њ–ї–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤, –≤ –Ї–Њ—В–Њ—А—Л–µ –±—Л–ї–∞ –≤–Ї–ї—О—З–µ–љ–∞ –і—А—Г–≥–∞—П –≥—А—Г–њ–њ–∞ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤, –љ–∞–Ј—Л–≤–∞–µ–Љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –Ј–∞–Љ–µ–і–ї–µ–љ–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П (SYSADOA – symptomatic slow acting drugs for osteoarthritis), –Њ–±–ї–∞–і–∞—О—Й–Є—Е —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є–Љ –Є –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–Љ —Б—В—А—Г–Ї—В—Г—А–љ–Њ––Љ–Њ–і–Є—Д–Є—Ж–Є—А—Г—О—Й–Є–Љ –і–µ–є—Б—В–≤–Є–µ–Љ. –≠—В–∞ –≥—А—Г–њ–њ–∞ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤–µ—Б—М–Љ–∞ –њ—А–Є–≤–ї–µ–Ї–∞—В–µ–ї—М–љ–∞ –Є –њ–Њ –њ—А–Є—З–Є–љ–µ –≤—Л—Б–Њ–Ї–Њ–є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П [11].
–•–Њ–љ–і—А–Њ–Є—В–Є–љ —Б—Г–ї—М—Д–∞—В (–•–°) – –љ–∞–Є–±–Њ–ї–µ–µ –Є–Ј—Г—З–µ–љ–љ—Л–є –њ—А–µ–њ–∞—А–∞—В –Є–Ј —Н—В–Њ–є –≥—А—Г–њ–њ—Л. –Ю–љ –њ—А–Є—Б—Г—В—Б—В–≤—Г–µ—В –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤ —Н–Ї—Б—В—А–∞—Ж–µ–ї–ї—О–ї—П—А–љ–Њ–Љ –Љ–∞—В—А–Є–Ї—Б–µ –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —В–Ї–∞–љ–µ–є, –≤–Ї–ї—О—З–∞—П –Ї–Њ–ґ—Г, –Ї–Њ—Б—В—М, —Е—А—П—Й, —Б–≤—П–Ј–Ї–Є, —Б—Г—Е–Њ–ґ–Є–ї–Є—П. –Я–Њ —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є —Б—В—А—Г–Ї—В—Г—А–µ –•–° – —Б—Г–ї—М—Д–∞—В–Є—А–Њ–≤–∞–љ–љ—Л–є –≥–ї–Є–Ї–Њ–Ј–∞–Љ–Є–љ–Њ–≥–ї–Є–Ї–∞–љ, —Б–Њ—Б—В–Њ—П—Й–Є–є –Є–Ј –і–ї–Є–љ–љ—Л—Е –љ–µ—А–∞–Ј–≤–µ—В–≤–ї–µ–љ–љ—Л—Е –њ–Њ–ї–Є—Б–∞—Е–∞—А–Є–і–љ—Л—Е —Ж–µ–њ–µ–є —Б –њ–Њ–≤—В–Њ—А—П—О—Й–Є–Љ–Є—Б—П –Њ—Б—В–∞—В–Ї–∞–Љ–Є N––∞—Ж–µ—В–Є–ї–≥–∞–ї–∞–Ї—В–Њ–Ј–∞–Љ–Є–љ–∞ –Є –≥–ї—О–Ї—Г—А–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л. –С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ N––∞—Ж–µ—В–Є–ї–≥–∞–ї–∞–Ї—В–Њ–Ј–∞–Љ–Є–љ–Њ–≤—Л—Е –Њ—Б—В–∞—В–Ї–Њ–≤ —Б—Г–ї—М—Д–∞—В–Є—А–Њ–≤–∞–љ—Л –≤ 4––Љ –Є 6––Љ –њ–Њ–ї–Њ–ґ–µ–љ–Є—П—Е: —Е–Њ–љ–і—А–Њ–Є—В–Є–љ–4–—Б—Г–ї—М—Д–∞—В –Є —Е–Њ–љ–і—А–Њ–Є—В–Є–љ–6–—Б—Г–ї—М—Д–∞—В. –†–∞–Ј–љ–Њ–≤–Є–і–љ–Њ—Б—В–Є –•–° –Њ—В–ї–Є—З–∞—О—В—Б—П –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–Љ –≤–µ—Б–Њ–Љ –Є –Є–Љ–µ—О—В, —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —А–∞–Ј–ї–Є—З–Є—П –≤ —З–Є—Б—В–Њ—В–µ –Є –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В–Є. –Я–Њ–ї–Є—Б–∞—Е–∞—А–Є–і–љ—Л–µ —Ж–µ–њ–Є, –Њ–±—А–∞–Ј—Г—П –Ї–Њ–≤–∞–ї–µ–љ—В–љ—Л–µ —Б–≤—П–Ј–Є —Б –±–µ–ї–Ї–∞–Љ–Є, –Њ–±—А–∞–Ј—Г—О—В –њ—А–Њ—В–µ–Њ–≥–ї–Є–Ї–∞–љ—Л, –Ї–Њ—В–Њ—А—Л–µ —Б–Њ–≤–Љ–µ—Б—В–љ–Њ —Б –Љ–∞–Ї—А–Њ–Љ–Њ–ї–µ–Ї—Г–ї–∞–Љ–Є –Ї–Њ–ї–ї–∞–≥–µ–љ–∞ (–≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ II —В–Є–њ–∞) –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—В —Г–љ–Є–Ї–∞–ї—М–љ—Л–µ —Б–≤–Њ–є—Б—В–≤–∞ —Н–Ї—Б—В—А–∞—Ж–µ–ї–ї—О–ї—П—А–љ–Њ–≥–Њ –Љ–∞—В—А–Є–Ї—Б–∞: —А–∞—Б—В—П–ґ–Є–Љ–Њ—Б—В—М —В–Ї–∞–љ–Є –Є –µ–µ —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В—М –Ї –Ї–Њ–Љ–њ—А–µ—Б—Б–Є–Є. –Ь–Њ–ї–µ–Ї—Г–ї–∞ –•–° —Б–Є–ї—М–љ–Њ –Ј–∞—А—П–ґ–µ–љ–∞ –Є –Њ–±–ї–∞–і–∞–µ—В –њ–Њ–ї–Є–∞–љ–Є–Њ–љ–љ—Л–Љ–Є —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є, –±–ї–∞–≥–Њ–і–∞—А—П —З–µ–Љ—Г —Г—З–∞—Б—В–≤—Г–µ—В –≤ —В—А–∞–љ—Б–њ–Њ—А—В–µ –≤–Њ–і—Л, –∞–Љ–Є–љ–Њ–Ї–Є—Б–ї–Њ—В –Є –ї–Є–њ–Є–і–Њ–≤ –≤ –∞–≤–∞—Б–Ї—Г–ї—П—А–љ—Л—Е —Г—З–∞—Б—В–Ї–∞—Е —Е—А—П—Й–∞, —З—В–Њ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –≤—П–Ј–Ї–Њ—Н–ї–∞—Б—В–Є—З–љ—Л–µ –Є –Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Є–µ —Б–≤–Њ–є—Б—В–≤–∞ —В–Ї–∞–љ–Є [12].
–§–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –≤—Л–њ–Њ–ї–љ–µ–љ–љ—Л–µ –љ–∞ —З–µ–ї–Њ–≤–µ–Ї–µ –Є —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е, –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –њ—А–µ–њ–∞—А–∞—В —Е–Њ—А–Њ—И–Њ –∞–і—Б–Њ—А–±–Є—А—Г–µ—В—Б—П –Є –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–µ—В—Б—П –≤ –≤—Л—Б–Њ–Ї–Є—Е –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П—Е –≤ —Б–Є–љ–Њ–≤–Є–∞–ї—М–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є. –С–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М –њ—А–µ–њ–∞—А–∞—В–∞ –њ—А–Є –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–Љ –њ—А–Є–µ–Љ–µ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 12–15% [12,13].
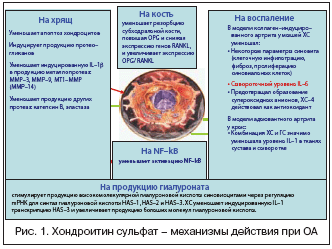
–Ь–µ—Е–∞–љ–Є–Ј–Љ –і–µ–є—Б—В–≤–Є—П –•–° –Љ–љ–Њ–≥–Њ–≥—А–∞–љ–µ–љ, –њ—А–µ–њ–∞—А–∞—В –Њ–±–ї–∞–і–∞–µ—В –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ –і–µ–є—Б—В–≤–Є–µ–Љ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–∞ –≤—Б–µ –Ј–≤–µ–љ—М—П –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –Ю–Р (—А–Є—Б. 1). –Т —Б–µ—А–Є–Є —А–∞–±–Њ—В –Є–Ј—Г—З–µ–љ–Њ –≤–ї–Є—П–љ–Є–µ –•–° –љ–∞ —Е—А—П—Й. –Ґ–∞–Ї, –≤ –Љ–Њ–і–µ–ї–Є —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ–Њ–≥–Њ –Ю–Р —Г –Љ—Л—И–µ–є –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –•–° –≤—Л–Ј—Л–≤–∞–ї–Њ –Ј–љ–∞—З–Є–Љ–Њ–µ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –∞–њ–Њ–њ—В–Њ–Ј–∞ —Е–Њ–љ–і—А–Њ—Ж–Є—В–Њ–≤ [14]. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е in vitro –•–° —Г–≤–µ–ї–Є—З–Є–≤–∞–ї –њ—А–Њ–і—Г–Ї—Ж–Є—О –њ—А–Њ—В–µ–Њ–≥–ї–Є–Ї–∞–љ–Њ–≤ —Е–Њ–љ–і—А–Њ—Ж–Є—В–∞–Љ–Є, –≤ –Љ–Њ–і–µ–ї–Є —Е–Є–Љ–Њ–њ–∞–њ–∞–Є–љ––Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П —Б—Г—Б—В–∞–≤–љ–Њ–≥–Њ —Е—А—П—Й–∞ –Є –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–µ –Є –≤–љ—Г—В—А–Є–Љ—Л—И–µ—З–љ–Њ–µ, –≤ –Љ–µ–љ—М—И–µ–є —Б—В–µ–њ–µ–љ–Є, –µ–≥–Њ –≤–≤–µ–і–µ–љ–Є–µ –Њ–Ї–∞–Ј—Л–≤–∞–ї–Њ –њ—А–Њ—В–µ–Ї—В–Є–≤–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –љ–∞ —Е—А—П—Й –Є –Ј–љ–∞—З–Є–Љ–Њ –њ–Њ–≤—Л—И–∞–ї–Њ —Б–Є–љ—В–µ–Ј –њ—А–Њ—В–µ–Њ–≥–ї–Є–Ї–∞–љ–Њ–≤ [15]. –Т–∞–ґ–љ–µ–є—И–∞—П —А–Њ–ї—М –≤ –Њ–±–Љ–µ–љ–µ —Н–Ї—Б—В—А–∞—Ж–µ–ї–ї—О–ї—П—А–љ–Њ–≥–Њ –Љ–∞—В—А–Є–Ї—Б–∞ —Е—А—П—Й–∞ –њ—А–Є–љ–∞–і–ї–µ–ґ–Є—В –Љ–µ—В–∞–ї–ї–Њ–њ—А–Њ—В–µ–∞–Ј–∞–Љ (–Ь–Ь–Я), –Њ—В –Ї–Њ—В–Њ—А—Л—Е –Ј–∞–≤–Є—Б–Є—В –і–µ–≥—А–∞–і–∞—Ж–Є—П –≤—Б–µ—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –Љ–∞—В—А–Є–Ї—Б–∞. –≠—В–Є —Н–љ–і–Њ–њ–µ–њ—В–Є–і–∞–Ј—Л (—Б—В—А–Њ–Љ–µ–ї–Є–Ј–Є–љ, –Є–ї–Є –Ь–Ь–Я–3, –Ї–Њ–ї–ї–∞–≥–µ–љ–∞–Ј–∞, –Є–ї–Є –Ь–Ь–Я–13 –Є –≥–µ–ї–∞—В–Є–љ–∞–Ј–∞, –Є–ї–Є –Ь–Ь–Я–9) —Б–µ–Ї—А–µ—В–Є—А—Г—О—В—Б—П –≤ –ї–∞—В–µ–љ—В–љ–Њ–є –њ—А–Њ—Н–љ–Ј–Є–Љ–љ–Њ–є —Д–Њ—А–Љ–µ, –∞–Ї—В–Є–≤–Є—А—Г—О—В—Б—П —Н–Ї—Б—В—А–∞—Ж–µ–ї–ї—О–ї—П—А–љ–Њ, –∞ –∞–Ї—В–Є–≤–љ—Л–µ —Д–Њ—А–Љ—Л –Є–љ–≥–Є–±–Є—А—Г—О—В—Б—П –њ—Г—В–µ–Љ —Б–≤—П–Ј—Л–≤–∞–љ–Є—П —Б —В–Ї–∞–љ–µ–≤—Л–Љ–Є –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є –Љ–µ—В–∞–ї–ї–Њ–њ—А–Њ—В–µ–Є–љ–∞–Ј –Є–ї–Є —Б a2––Љ–∞–Ї—А–Њ–≥–ї–Њ–±—Г–ї–Є–љ–Њ–Љ. –С–ї–Њ–Ї–∞–і–∞ —Н—В–Є—Е —Н–љ–Ј–Є–Љ–Њ–≤ –Љ–Њ–ґ–µ—В —Г–Љ–µ–љ—М—И–∞—В—М —В—П–ґ–µ—Б—В—М –Ю–Р––њ–Њ—А–∞–ґ–µ–љ–Є—П. –Я–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –•–° –љ–∞ 28% –Є–љ–≥–Є–±–Є—А—Г–µ—В —Б–Є–љ—В–µ–Ј –Ь–Ь–Я–3 (–Ї–ї—О—З–µ–≤–Њ–µ –Ј–≤–µ–љ–Њ –≥–Њ–Љ–µ–Њ—Б—В–∞–Ј–∞ —Б—Г—Б—В–∞–≤–љ—Л—Е –њ—А–Њ—В–µ–Њ–≥–ї–Є–Ї–∞–љ–Њ–≤) —Е–Њ–љ–і—А–Њ—Ж–Є—В–∞–Љ–Є, –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ—Л–є –Є–љ—В–µ—А–ї–µ–є–Ї–Є–љ–Њ–Љ–1b (–Ш–Ы–1b) [16]. –Т –Љ–Њ–і–µ–ї–Є –Ю–Р —Г –Ї—А—Л—Б –•–° –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞–ї –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Ь–Ь–Я–9, –њ—Г—Б–Ї–Њ–≤–Њ–≥–Њ –Љ–Њ–Љ–µ–љ—В–∞ —Е—А—П—Й–µ–≤–Њ–є –Є –Ї–Њ—Б—В–љ–Њ–є –і–µ–≥—А–∞–і–∞—Ж–Є–Є [17]. –Э–µ–і–∞–≤–љ–Њ –±—Л–ї–Њ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–Њ, —З—В–Њ –•–° —Б–љ–Є–ґ–∞–µ—В –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ—Г—О –ї–Є–њ–Њ–њ–Њ–ї–Є—Б–∞—Е–∞—А–Є–і–∞–Љ–Є –Ь–Ь–Я–13 –≤ —Е–Њ–љ–і—А–Њ—Ж–Є—В–∞—Е, —З—В–Њ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ –∞–Ї—В–Є–≤–∞—Ж–Є–Є —А38 –Љ–Є—В–Њ–≥–µ–љ––∞–Ї—В–Є–≤–Є—А–Њ–≤–∞–љ–љ–Њ–є –±–µ–ї–Ї–Њ–≤–Њ–є –Ї–Є–љ–∞–Ј—Л –Є —Н–Ї—Б—В—А–∞—Ж–µ–ї–ї—О–ї—П—А–љ–Њ–є —Б–Є–≥–љ–∞–ї—М–љ–Њ–є —А–µ–≥—Г–ї–Є—А—Г—О—Й–µ–є –Ї–Є–љ–∞–Ј—Л 1/2 [18]. –Т –і—А—Г–≥–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –•–° —Г–Љ–µ–љ—М—И–∞–ї –Ш–Ы–1b –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ—Г—О —Н–Ї—Б–њ—А–µ—Б—Б–Є—О –Ь–Ь–Я–13 —Е–Њ–љ–і—А–Њ—Ж–Є—В–∞–Љ–Є [19].
–Ъ–ї—О—З–µ–≤—Г—О —А–Њ–ї—М –≤ —А–∞–Ј–≤–Є—В–Є–Є –Ю–Р –Є–≥—А–∞–µ—В –Ш–Ы–1b, –Њ–љ –Њ—В–≤–µ—В—Б—В–≤–µ–љ–µ–љ –Ј–∞ –і–µ–≥–µ–љ–µ—А–∞—Ж–Є—О –Љ–љ–Њ–≥–Є—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ —Н–Ї—Б—В—А–∞—Ж–µ–ї–ї—О–ї—П—А–љ–Њ–≥–Њ –Љ–∞—В—А–Є–Ї—Б–∞ –≤ —В–Ї–∞–љ—П—Е —Б—Г—Б—В–∞–≤–∞. –≠—В–Њ—В —Ж–Є—В–Њ–Ї–Є–љ –Є–љ–і—Г—Ж–Є—А—Г–µ—В –Ї–∞—Б–Ї–∞–і –Ї–∞—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤, –≤–Ї–ї—О—З–∞—П –њ–Њ–≤—Л—И–µ–љ–Є–µ —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –і—А—Г–≥–Є—Е –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е —Ж–Є–Њ–Ї–Є–љ–Њ–≤, —В–∞–Ї–Є—Е –Ї–∞–Ї –§–Э–Ю–a, –Ш–Ы–6, –Ь–Ь–Я, –Є–љ–і—Г—Ж–Є–±–µ–ї—М–љ—Г—О —Д–Њ—А–Љ—Г —Б–Є–љ—В–∞–Ј—Л –∞–Ј–Њ—В–∞, —Ж–Є–Ї–ї–Њ–Њ–Ї—Б–Є–≥–µ–љ–∞–Ј—Л–2 –Є –і—А—Г–≥–Є—Е. –Ф–Њ –њ–Њ—Б–ї–µ–і–љ–µ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –∞–Ї—В–Є–≤–∞—Ж–Є—П —Ж–Є–Ї–ї–Њ–Њ–Ї—Б–Є–≥–µ–љ–∞–Ј—Л —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–ї–∞—Б—М –≤ –Ї–∞—З–µ—Б—В–≤–µ –Ї–ї—О—З–µ–≤–Њ–≥–Њ –Љ–Њ–Љ–µ–љ—В–∞ —Б–Є–љ—В–µ–Ј–∞ –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤. –Ю–і–љ–∞–Ї–Њ –љ–µ–і–∞–≤–љ–Њ –±—Л–ї –Є–і–µ–љ—В–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ —Д–µ—А–Љ–µ–љ—В, –Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ—Л–є –Ј–∞ –Є–Ј–Љ–µ—А–Є–Ј–∞—Ж–Є—О –љ–µ–∞–Ї—В–Є–≤–љ–Њ–≥–Њ –њ—А–µ–і—И–µ—Б—В–≤–µ–љ–љ–Є–Ї–∞ –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–∞ –≤ –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ –Х2 (PGES), –±—Л–ї–Є –Є–і–µ–љ—В–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ—Л 3 –µ–≥–Њ –Є–Ј–Њ—Д–Њ—А–Љ—Л [20] (—В–∞–±–ї. 2). –С—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ mPGES–1 —Н–Ї—Б–њ—А–µ—Б—Б–Є—А—Г–µ—В—Б—П –≤ –∞—А—В–Є–Ї—Г–ї—П—А–љ—Л—Е —В–Ї–∞–љ—П—Е —З–µ–ї–Њ–≤–µ–Ї–∞ –µ–≥–Њ —Г—А–Њ–≤–µ–љ—М —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П –њ–Њ—Б–ї–µ —Б—В–Є–Љ—Г–ї—П—Ж–Є–Є –Ш–Ы–1b [21]. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є in vitro –•–° –њ–Њ–і–∞–≤–ї—П–ї –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ—Г—О –Ш–Ы–1b —Н–Ї—Б–њ—А–µ—Б—Б–Є—О –≥–µ–љ–Њ–≤ NO —Б–Є–љ—В–∞–Ј—Л, –¶–Ю–У–2 –Є mPGES–1 [22]. –С–Њ–ї–µ–µ —В–Њ–≥–Њ, –љ–µ–і–∞–≤–љ–Њ —Б–Њ–Њ–±—Й–Є–ї–Є, —З—В–Њ –•–° —Г–Љ–µ–љ—М—И–∞–ї –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ—Г—О –Ш–Ы–1b —Д–Њ—Б—Д–Њ—А–Є–ї–∞—Ж–Є—О —А38 –Љ–Є—В–Њ–≥–µ–љ––∞–Ї—В–Є–≤–Є—А–Њ–≤–∞–љ–љ–Њ–є –±–µ–ї–Ї–Њ–≤–Њ–є –Ї–Є–љ–∞–Ј—Л –Є —Н–Ї—Б—В—А–∞—Ж–µ–ї–ї—О–ї—П—А–љ–Њ–є —Б–Є–≥–љ–∞–ї—М–љ–Њ–є —А–µ–≥—Г–ї–Є—А—Г—О—Й–µ–є –Ї–Є–љ–∞–Ј—Л ½ –Є —В—А–∞–љ—Б–∞–Ї—В–Є–≤–∞—Ж–Є—О —П–і–µ—А–љ–Њ–≥–Њ —Д–∞–Ї—В–Њ—А–∞–kB, —З—В–Њ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–Њ—Б—М –∞–љ—В–Є–Ї–∞—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ. Cho —Б —Б–Њ–∞–≤—В. [23] –њ–Њ–Ї–∞–Ј–∞–ї–Є –љ–∞ –љ–µ–Ї–Њ—В–Њ—А—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е –Љ–Њ–і–µ–ї—П—Е, —З—В–Њ –ї–µ—З–µ–љ–Є–µ –•–° –Ј–љ–∞—З–Є–Љ–Њ —Г–Љ–µ–љ—М—И–∞–ї–Њ —Г—А–Њ–≤–µ–љ—М –Ш–Ы–6 –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ.
–•–° —Б—В–Є–Љ—Г–ї–Є—А—Г–µ—В –њ—А–Њ–і—Г–Ї—Ж–Є—О –≤—Л—Б–Њ–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є –≥–Є–∞–ї—Г—А–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л —Б–Є–љ–Њ–≤–Є–Њ—Ж–Є—В–∞–Љ–Є —З–µ—А–µ–Ј —А–µ–≥—Г–ї—П—Ж–Є—О m–†–Э–Ъ –і–ї—П —Б–Є–љ—В–∞–Ј –≥–Є–∞–ї—Г—А–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л HAS–1, HAS–2, and HAS–3. –•–° —Г–Љ–µ–љ—М—И–∞–µ—В –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ—Г—О –Ш–Ы–1 —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є—О HAS3 –Є —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В –њ—А–Њ–і—Г–Ї—Ж–Є—О –±–Њ–ї—М—И–Є—Е –Љ–Њ–ї–µ–Ї—Г–ї –≥–Є–∞–ї—Г—А–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л [24].
–Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –•–° —Г–Љ–µ–љ—М—И–∞–µ—В —А–µ–Ј–Њ—А–±—Ж–Є—О —Б—Г–±—Е–Њ–і—А–∞–ї—М–љ–Њ–є –Ї–Њ—Б—В–Є, –њ–Њ–≤—Л—И–∞—П OPG –Є —Б–љ–Є–ґ–∞—П —Н–Ї—Б–њ—А–µ—Б—Б–Є—О –≥–µ–љ–Њ–≤ RANKL, –Є —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В —Н–Ї—Б–њ—А–µ—Б—Б–Є—О OPG/ RANKL [24].
–≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –•–° –і–Њ–Ї–∞–Ј–∞–љ–∞ –≤–Њ –Љ–љ–Њ–≥–Є—Е —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л—Е –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е (—В–∞–±–ї. 3, 4). –†–µ–Ј—Г–ї—М—В–∞—В—Л –Љ–µ—В–∞––∞–љ–∞–ї–Є–Ј–Њ–≤ (—А–Є—Б. 2) –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є –µ–≥–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ–ї–∞—Ж–µ–±–Њ –≤ –і–≤–Њ–є–љ—Л—Е —Б–ї–µ–њ—Л—Е –њ–ї–∞—Ж–µ–±–Њ––Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е —Г –±–Њ–ї—М–љ—Л—Е —Б –Ю–Р –Ї–Њ–ї–µ–љ–љ—Л—Е –Є —В–∞–Ј–Њ–±–µ–і—А–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤.
–Ь–µ—В–∞––∞–љ–∞–ї–Є–Ј 7 –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –≤–Ї–ї—О—З–∞–≤—И–Є—Е 372 –њ–∞—Ж–Є–µ–љ—В–∞ —Б –Ю–Р –Ї–Њ–ї–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤, –ї–µ—З–µ–љ–љ—Л—Е –•–° –≤ –і–Њ–Ј–µ 800–1600 –Љ–≥/—Б—Г—В. –≤ —В–µ—З–µ–љ–Є–µ 6 –Љ–µ—Б. –Є –±–Њ–ї–µ–µ, –њ–Њ–Ї–∞–Ј–∞–ї –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –±–Њ–ї–Є –Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ –Є–љ–і–µ–Ї—Б–∞ –Ы–µ–Ї–µ–љ–∞ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ–ї–∞—Ж–µ–±–Њ [26].
–Т –і—А—Г–≥–Њ–Љ –Љ–µ—В–∞––∞–љ–∞–ї–Є–Ј–µ 15 —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Ј–∞ –њ–µ—А–Є–Њ–і —Б 1966 –њ–Њ 1999 –≥. (404 –±–Њ–ї—М–љ—Л—Е –Ю–Р —Б –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ –Ї–Њ–ї–µ–љ–љ—Л—Е –Є —В–∞–Ј–Њ–±–µ–і—А–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤) —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ –≤–ї–Є—П–љ–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞ (–њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ–ї–∞—Ж–µ–±–Њ) –љ–∞ –±–Њ–ї–µ–≤–Њ–є —Б–Є–љ–і—А–Њ–Љ, —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–є –Є–љ–і–µ–Ї—Б –Ы–µ–Ї–µ–љ–∞, –њ–Њ—В—А–µ–±–љ–Њ—Б—В—М –≤ –Э–Я–Т–Я –Є –∞–љ–∞–ї—М–≥–µ—В–Є–Ї–∞—Е [27]. –Ф–∞–љ–љ—Л–µ –і–≤—Г—Е –њ–Њ—Б–ї–µ–і–љ–Є—Е –Љ–µ—В–∞––∞–љ–∞–ї–Є–Ј–Њ–≤ –†–Ъ–Ш, –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е –Ј–∞ –њ–µ—А–Є–Њ–і —Б 1992 –њ–Њ 2005 –≥., –њ–Њ–і—В–≤–µ—А–ґ–і–∞—О—В —Б–Є–Љ–њ—В–Њ–Љ––Љ–Њ–і–Є—Д–Є—Ж–Є—А—Г—О—Й–Є–µ —Б–≤–Њ–є—Б—В–≤–∞ –•–°. Bana G. —Б —Б–Њ–∞–≤—В. –њ—А–Њ–∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ—Л —А–µ–Ј—Г–ї—М—В–∞—В—Л 7 –†–Ъ–Ш –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –•–° –њ—А–Є –Ю–Р —В/–±–µ–і—А–µ–љ–љ—Л—Е –Є –Ї–Њ–ї–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤. –Ю—В–Љ–µ—З–µ–љ–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В–Є –±–Њ–ї–Є –≤ —Б—Г—Б—В–∞–≤–∞—Е –Є –Є–љ–і–µ–Ї—Б–∞ –Ы–µ–Ї–µ–љ–∞ [28]. Uebelhart D. —Б —Б–Њ–∞–≤—В. [29] –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є 6 –†–Ъ–Ш, –≤ –Ї–Њ—В–Њ—А—Л—Е –Њ—Ж–µ–љ–Є–≤–∞–ї–Є—Б—М —Б—В—А—Г–Ї—В—Г—А–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Ї–∞–Ї –њ–µ—А–≤–Є—З–љ—Л–µ –Є –≤—В–Њ—А–Є—З–љ—Л–µ «–Ї–Њ–љ–µ—З–љ—Л–µ» —В–Њ—З–Ї–Є –љ–µ —Г–і–∞–ї–Њ—Б—М –њ—А–Є–≤–µ—Б—В–Є —З–µ—В–Ї–Є—Е –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤ –љ–∞–ї–Є—З–Є—П —Г –•–° —Б—В—А—Г–Ї—В—Г—А–љ–Њ –Љ–Њ–і–Є—Д–Є—Ж–Є—А—Г—О—Й–Є—Е —Б–≤–Њ–є—Б—В–≤, –љ–Њ —А–µ–Ј—Г–ї—М—В–∞—В—Л –µ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ—А–Є –Ю–Р –Ї–Њ–ї–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤ –Є —Б—Г—Б—В–∞–≤–Њ–≤ –Ї–Є—Б—В–µ–є –і–∞—О—В –Љ–љ–Њ–≥–Њ —Д–∞–Ї—В–Њ–≤ –≤ –њ–Њ–і–і–µ—А–ґ–Ї—Г —Н—В–Њ–є –≥–Є–њ–Њ—В–µ–Ј—Л. –Т 2008 –≥. –љ–∞ –Ј–∞—Б–µ–і–∞–љ–Є–Є –∞–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Њ–≥–Њ –Њ–±—Й–µ—Б—В–≤–∞ –њ–Њ –Ю–Р M. Hochberg –і–Њ–ї–Њ–ґ–Є–ї —А–µ–Ј—Г–ї—М—В–∞—В—Л –Љ–µ—В–∞––∞–љ–∞–ї–Є–Ј–∞ –Є –њ–Њ–і—З–µ—А–Ї–љ—Г–ї —Б—В—А—Г–Ї—В—Г—А–љ–Њ––Љ–Њ–і–Є—Д–Є—Ж–Є—А—Г—О—Й–Є–µ —Б–≤–Њ–є—Б—В–≤–∞ –•–°. –Т 2009 –≥. Young Ho Lee —Б —Б–Њ–∞–≤—В. –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–ї–Є –і–∞–љ–љ—Л–µ –Љ–µ—В–∞––∞–љ–∞–ї–Є–Ј–∞, –≤ –Ї–Њ—В–Њ—А—Л–є –±—Л–ї–Є –≤–Ї–ї—О—З–µ–љ—Л 6 –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є (1502 –±–Њ–ї—М–љ—Л—Е –Ю–Р), –Є –Њ–љ–Є –њ–Њ–і—В–≤–µ—А–і–Є–ї–Є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –•–° –Є –≥–ї—О–Ї–Њ–Ј–∞–Љ–Є–љ —Б—Г–ї—М—Д–∞—В–∞ –Ј–∞–Љ–µ–і–ї—П—В—М —А–µ–љ—В–≥–µ–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –Ю–Р –≤ —В–µ—З–µ–љ–Є–µ 2–3 –ї–µ—В –ї–µ—З–µ–љ–Є—П —Н—В–Є–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ [30].
–Т 2006 –≥. –≤ –°–®–Р –Ј–∞–≤–µ—А—И–µ–љ–Њ –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤–Њ–µ –і–≤–Њ–є–љ–Њ–µ –њ–ї–∞—Ж–µ–±–Њ––Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤ 5 –≥—А—Г–њ–њ–∞—Е –±–Њ–ї—М–љ—Л—Е –≥–Њ–љ–∞—А—В—А–Њ–Ј–Њ–Љ –њ–Њ —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–Љ—Г –Є–Ј—Г—З–µ–љ–Є—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –•–°, –≥–ї—О–Ї–Њ–Ј–∞–Љ–Є–љ–∞ –≥–Є–і—А–Њ—Е–ї–Њ—А–Є–і–∞ (–У–У), —Ж–µ–ї–µ–Ї–Њ–Ї—Б–Є–±–∞, –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –•–° –Є –У–У —Б –њ–ї–∞—Ж–µ–±–Њ [Glucosamine/Chondroitin Arthritis Intervention Trial (GAIT)]. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –њ–Њ–і —Н–≥–Є–і–Њ–є –Э–∞—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ –Є–љ—Б—В–Є—В—Г—В–∞ –Ј–і–Њ—А–Њ–≤—М—П –°–®–Р [31]. –Ъ–∞–ґ–і–∞—П –Є–Ј 5 –≥—А—Г–њ–њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Р –љ–∞—Б—З–Є—В—Л–≤–∞–ї–∞ –±–Њ–ї–µ–µ 300 —З–µ–ї–Њ–≤–µ–Ї. –Ш —Е–Њ—В—П —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–µ –і–µ–є—Б—В–≤–Є–µ –•–° –Є –њ–ї–∞—Ж–µ–±–Њ –±—Л–ї–Њ —Б—Е–Њ–і–љ—Л–Љ, –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –і—А—Г–≥–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —В–Њ–ї—М–Ї–Њ –•–° –Ј–љ–∞—З–Є–Љ–Њ —Г–Љ–µ–љ—М—И–∞–ї –њ—А–Є–њ—Г—Е–∞–љ–Є–µ –Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –≤—Л–њ–Њ—В–∞ –≤ —Б—Г—Б—В–∞–≤–∞—Е –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ–ї–∞—Ж–µ–±–Њ. –Т –љ–∞—З–∞–ї–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Н—В–Є —Б–Є–Љ–њ—В–Њ–Љ—Л –Њ—В–Љ–µ—З–∞–ї–Є—Б—М —Г 28,3% –±–Њ–ї—М–љ—Л—Е, –Ї –Ј–∞–≤–µ—А—И–µ–љ–Є—О 24 –љ–µ–і–µ–ї—М – —В–Њ–ї—М–Ї–Њ —Г 12,4%, –≤ –≥—А—Г–њ–њ–µ –њ–ї–∞—Ж–µ–±–Њ —Б–љ–Є–ґ–µ–љ–Є–µ —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –±–Њ–ї–µ–Ј–љ–Є –±—Л–ї–Њ –љ–µ–і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ (28,1 –Є 19,9% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ).
–Ф–ї—П –•–° –њ–Њ–ї—Г—З–µ–љ—Л –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤–∞ –µ–≥–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–Є –Ю–Р —Б—Г—Б—В–∞–≤–Њ–≤ –Ї–Є—Б—В–µ–є. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –•–° –≤ —В–µ—З–µ–љ–Є–µ 3 –ї–µ—В –њ—А–Є –Ю–Р —Б—Г—Б—В–∞–≤–Њ–≤ –Ї–Є—Б—В–µ–є –≤—Л–Ј—Л–≤–∞–ї–Њ –њ—А–Њ—В–µ–Ї—В–Є–≤–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –њ–Њ—П–≤–ї–µ–љ–Є—П «–љ–Њ–≤—Л—Е» —Н—А–Њ–Ј–Є–є [32].
–Т –†–Њ—Б—Б–Є–Є –і–ї—П –ї–µ—З–µ–љ–Є—П –Ю–Р –њ—А–Є–Љ–µ–љ—П–µ—В—Б—П –њ—А–µ–њ–∞—А–∞—В –°—В—А—Г–Ї—В—Г–Љ (–Ч–Р–Ю «–§–∞—А–Љ–§–Є—А–Љ–∞ “–°–Њ—В–µ–Ї—Б”», –Я—М–µ—А –§–∞–±—А –Ь–µ–і–Є–Ї–∞–Љ–µ–љ—В), –Ї–Њ—В–Њ—А—Л–є –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –•–° –њ—В–Є—З—М–µ–≥–Њ –њ—А–Њ–Є—Б—Е–Њ–ґ–і–µ–љ–Є—П (–•4–° –Є –•6–°), —Б –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є –Љ–∞—Б—Б–Њ–є 180–300 kDA. –≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –•–° –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ—Л –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤—Л–Љ 6––Љ–µ—Б—П—З–љ—Л–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ–Љ –≤ –†–Њ—Б—Б–Є–Є, –Ї–Њ—В–Њ—А–Њ–µ –≤–Ї–ї—О—З–∞–ї–Њ –±–Њ–ї–µ–µ 500 –±–Њ–ї—М–љ—Л—Е –Ю–Р –Ї–Њ–ї–µ–љ–љ—Л—Е –Є —В–∞–Ј–Њ–±–µ–і—А–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤. –Э–∞ —Д–Њ–љ–µ –ї–µ—З–µ–љ–Є—П –°—В—А—Г–Ї—В—Г–Љ–Њ–Љ –±—Л–ї–Њ –Њ—В–Љ–µ—З–µ–љ–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –Є–љ–і–µ–Ї—Б–∞ –Ы–µ–Ї–µ–љ–∞, –±–Њ–ї–Є –≤ –њ–Њ–Ї–Њ–µ, –њ—А–Є —Е–Њ–і—М–±–µ –Є –њ–Њ—В—А–µ–±–љ–Њ—Б—В–Є –≤ –Э–Я–Т–Я —Г –±–Њ–ї—М–љ—Л—Е –≥–Њ–љ–∞—А—В—А–Њ–Ј–Њ–Љ –Є –Ї–Њ–Ї—Б–∞—А—В—А–Њ–Ј–Њ–Љ. –Я–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М –њ—А–µ–њ–∞—А–∞—В–∞ –±—Л–ї–∞ –Њ—З–µ–љ—М —Е–Њ—А–Њ—И–µ–є, –Ј–∞ –≤—А–µ–Љ—П –љ–∞–±–ї—О–і–µ–љ–Є—П –Є–Ј –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤—Л–±—Л–ї–Є —В–Њ–ї—М–Ї–Њ 2,1% –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –•–° [33].
–°–ї–µ–і—Г–µ—В –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М –≤—Л—Б–Њ–Ї—Г—О –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –•–°, –Њ—В–Љ–µ—З–µ–љ–љ—Г—О –≤–Њ –≤—Б–µ—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е. –Я–Њ –Њ—Ж–µ–љ–Ї–µ EULAR –•–° —П–≤–ї—П–µ—В—Б—П —Б–∞–Љ—Л–Љ –±–µ–Ј–Њ–њ–∞—Б–љ—Л–Љ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–Љ —Б—А–µ–і—Б—В–≤–Њ–Љ –і–ї—П –ї–µ—З–µ–љ–Є—П –Ю–Р, –Њ–љ –Є–Љ–µ–µ—В –Ј–љ–∞—З–µ–љ–Є–µ —В–Њ–Ї—Б–Є—З–љ–Њ—Б—В–Є, —А–∞–≤–љ–Њ–µ 6 –њ–Њ 100 –±–∞–ї—М–љ–Њ–є —И–Ї–∞–ї–µ [11]. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –љ–µ –≤—Л—П–≤–Є–ї–Є –Ї–∞–Ї–Є—Е––ї–Є–±–Њ –Ј–љ–∞—З–Є–Љ—Л—Е –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –Є–ї–Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –њ–µ—А–µ–і–Њ–Ј–Є—А–Њ–≤–Ї–Є –њ—А–µ–њ–∞—А–∞—В–∞ –њ—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ–Љ –µ–≥–Њ –њ—А–Є–µ–Љ–µ [34]. –Э–µ–Љ–∞–ї–Њ–≤–∞–ґ–љ—Л–Љ –∞—Б–њ–µ–Ї—В–Њ–Љ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є —П–≤–ї—П–µ—В—Б—П –Њ—В—Б—Г—В—Б—В–≤–Є–µ –Ј–љ–∞—З–Є–Љ–Њ–≥–Њ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–≥–Њ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П –•–° —Б –Є–Ј–≤–µ—Б—В–љ—Л–Љ–Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–Љ–Є —Б—А–µ–і—Б—В–≤–∞–Љ–Є, —З—В–Њ –Њ—З–µ–љ—М –≤–∞–ґ–љ–Њ –і–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Р, —З–∞—Б—В–Њ –Є—Б–њ–Њ–ї—М–Ј—Г—О—Й–Є—Е –і–Њ–≤–Њ–ї—М–љ–Њ —И–Є—А–Њ–Ї–Є–є —Б–њ–µ–Ї—В—А –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –і–ї—П –ї–µ—З–µ–љ–Є—П —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є.
–Я—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Є —Б–Њ—Е—А–∞–љ–Є—В—М —В–≤–µ—А–і—Г—О –њ–Њ–Ј–Є—Ж–Є—О –•–° (–°—В—А—Г–Ї—В—Г–Љ) –≤ –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ—Л—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е 2008 –≥., —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ—Б—В—М –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Ї–Њ—В–Њ—А–Њ–≥–Њ –љ–µ –≤—Л–Ј—Л–≤–∞–µ—В —Б–Њ–Љ–љ–µ–љ–Є—П [10].
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ—Б–ї–µ–і–љ–Є—Е –ї–µ—В –Љ–µ–љ—П—О—В, —Е–Њ—В—П –Є –Љ–µ–і–ї–µ–љ–љ–Њ, —Б—Г—Й–µ—Б—В–≤—Г—О—Й–µ–µ –і–ї–Є—В–µ–ї—М–љ–Њ–µ –≤—А–µ–Љ—П –≤–Њ—Б–њ—А–Є—П—В–Є–µ –Ю–Р –Ї–∞–Ї –љ–µ–Њ—В–≤—А–∞—В–Є–Љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –≤–Њ–Ј–љ–Є–Ї–∞—О—Й–µ–≥–Њ —Б –≤–Њ–Ј—А–∞—Б—В–Њ–Љ –Є –љ–µ—Г–Ї–ї–Њ–љ–љ–Њ –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–≥–Њ. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Љ–љ–Њ–≥–Є–µ —Б—А–µ–і—Б—В–≤–∞ —Б —Е–Њ—А–Њ—И–Њ –Є–Ј—Г—З–µ–љ–љ—Л–Љ –і–µ–є—Б—В–≤–Є–µ–Љ –љ–∞ —Б–Є–Љ–њ—В–Њ–Љ—Л –±–Њ–ї–µ–Ј–љ–Є –Њ–±–ї–∞–і–∞—О—В –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ—Л–Љ–Є —Б—В—А—Г–Ї—В—Г—А–љ–Њ––Љ–Њ–і–Є—Д–Є—Ж–Є—А—Г—О—Й–Є–Љ–Є —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –љ–∞–і–µ—П—В—М—Б—П –љ–∞ –Є–Ј–Љ–µ–љ–µ–љ–Є–µ –µ—Б—В–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ —В–µ—З–µ–љ–Є—П –Ю–Р –Є —Г–ї—Г—З—И–µ–љ–Є–µ –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є –±–Њ–ї—М–љ—Л—Е.




–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. Laurence RC, Helmick CG, Arnett PC et all. Estimates of the prevalence of arthritis and selected musculoskeletal disoders in United States/ Arthritis Rheum 1998; 41:778–99.
2. Unites States Senate Committee on Helth, Education, Labor and Pensions, Sub committee on Aging. Center for Disease Control s role in combating the burden of arthritis. Washington, D.C.: Department of Health and Human Services, 2004.
3. –§–Њ–ї–Њ–Љ–µ–µ–≤–∞ –Ю.–Ь., –Р–Љ–Є—А–і–ґ–∞–љ–Њ–≤–∞ –Т.–Э., –ѓ–Ї—Г—И–µ–≤–∞ –Х.–Ю. –Є –і—А. –Р–љ–∞–ї–Є–Ј —Б—В—А—Г–Ї—В—Г—А—Л –•III –Ї–ї–∞—Б—Б–∞ –±–Њ–ї–µ–Ј–љ–µ–є. –†–Њ—Б.—А–µ–≤–Љ–∞—В–Њ–ї. 1998; 1:2–7.
4. Martel–Pelletier J, Lajeunesse D, Pelletier JP : Etiopathogenesis of osteoarthritis. In Arthritis and Allied Conditions: A Textbook of Rheumatology . Edited by: Koopman WJ, Moreland LW, Baltimore: Lippincott, William Wikins; 2005:2199–2296
5. Felson DT., Laurence RC, et all. Osteoarthritis : new insight. Part II : Treatment approach. Ann.Intern. Med.2000;133: 726–737
6. Laurence D., Massicotte F., Pelletier JP, Martel–Pelletier J : Subchondral bone sclerosis in osteoarthritis : not just an innocept bystander. Modem Rheumatology 2003:13:7–14.
7. «Osteoarthritis. Clinical and Experimental aspects» Ed.J.– E.Register, Pelletier JP, Pelletier Y.Henrotin. Springer, 1999.
8. Cappell MS, Schein JR. Diagnosis and treatment of nonsteroidal anti–inflamatory drug–associated upper gastrointestinal toxicity. Gastrointerol. Clin. N. Am.2000; 29: 97–124
9. Tenenbaum –Ю. The epidemiology of nonsteroidal anti–inflamatory drugs. Can. J.Gastrointerol 1999; 13: 119–122.
10. Zhang W, Moscovitz RW, Nuki G., et al.OARSI recommendations for the manegement of hip and knee osteoarthritis, Part II: OARSI evidence–based, expert consensus guidelines. Osteoarthritis Cartilage 2008 Feb; 16(2):137–162
11. Jordan KMM, Arden NK. EULAR Recommendations 2003: an evidence based approach to the management of knee osteoarthritis:Report of a Task Force of the Standing Committee for International Clinical Studies Including Terapeutic Trials ( ESCISIT). Ann Rheum Dis, 2003; 62: 1145–1155.
12. Conte A, Volpi N, Palmieri L et al. Biochemical and pharmacological aspects of oral treatment with chondroitin sulfate. Arzneim/Drug Res. 1995; 45:918–925.
13. Volpi N. Oral bioavailability of chondroitin sulfate (Chondrosulf) and its constituents in healthy male volunteers. Osteoarthritis Cartilage 2002 Oct; 10(10):768–77.
14. Caraglia M., Beninati S, D Alessandro AM. et al. Alternative therapy of earth elements increases the chondroprotective effects of chondroitin sulfate in mice. Exp Mol Med 2005; 37: 476–81.
15. Uebelhart D, Thonar EJ, Williams JM. Protective effect of exogenous chondroitin 4,6–sulfate in the acute degradation of articular cartilage in the rabbit. Osteoarthritis Cartilage 1998; 6 Suppl A:6–13.
16. Monfort J, Nacher M, Montell E. et al. Chondroitin sulfate and Hyaluronic acid (500–730 kDa) inhibit stromelysin–1 synthesis in human osteoarthritic chondrocytes. Drugs Exp Clin Res 2005; 31: 71–6.
17. Chou MM, Vergnolle N, McDougall JJ, Wallace JL et al. Effects of chondroitin and glucosamine sulfate in a dietary bar formulation on inflammation, interleukin–1beta, matrix metalloprotease–9, and cartilage damage in arthritis. Exp Biol Med 2005; 230:255–62
18. Holzmann J, Brandl N, Zemann A. et al. Assorted effects of TGFbeta and chondroitin sulfate on p38 and ERK1/2 activation levels in human articular chondrocytes stimulated with LPS. Osteoarthritis Cartilage 2006; 14:519–25.
19. Verbruggen G, Veys EM. Influence of sulphated glycosaminoglycans upon proteoglycan metabolism of the synovial lining cells. Acta Rhumatol Belg 1977; 1:75–92
20. Monfort J, Pellietier J–P, Garcia–Giralt N, Martel–Pellietier J. Biochemical basis of the effect of chondroitin sulfate on osteoarthritis articular tissues. Ann Rheum Dis, 2008; 67: 735–740.
21. Li X, Afif H, Cheng S. et al. Expression and regulation of microsomal prostaglandin E synthase–1 in human osteoarthritic cartilage and chondrocytes. J Rheumatol 2005; 32:887–95
22. Chan PS, Caron JP, Orth MW. Shot–term gene expression changes in cartilage explants stimulated with interleukin beta glusglucosamine and chondroitin sulfate. J rheumatol 2006; 33:1329–40
23. Cho SY, Sim JS, Jeong CY. et al. Effects of low molecular weight chondroitin sulfate on type II collagen–induced arthritis in DBA/1J mice. Biol Pharm Bull 2004; 27:47–51.
24. Maha David–Raoudi, Brigitte Deschrevel, Sylvain Leclercq, et al. Chondroitin sulfate increases hyaluronan production by human synoviocytes through differential regulation of hyaluronan synthases: Role of p38 and Akt Arthr&Rheum 2009;60:760–770
25. Kwan Tat S, Pelletier JP, Lajeunesse D. Et al. The differential expression of osteoprotegerin (OPG) and receptor of nuclear factor kB ligand (RANKL) in human osteoarthritic subchondral bone osteoblasts is an indicator of the metabolic state of these disease cell. Clin Exp Rheumatol. In press.
26. Leeb B.F., Schweitzer H., Montag K., Smolen J.S. A meta–analysis of chondroitinsulfate in
the treatment of osteoarthritis. Osteoarthritis Cartilage, 1999, 7, Suppl A, abstr 130.
27. McAlindon TE, LaValley MP, Gulin JP, Felson DT. Glucosamine and chondroitin for
treatment of osteoarthritis: a systematic quality assessment and meta–analysis. JAMA. 2000 Mar
15;283(11):1469–75.
28. Bana G., Jamard B., Verrouil E., Mazieres B. Chondroitin sulfate in the management of hip
and knee OA: an overview. Adv. Pharmacol., 2006, 53:507–522.
29. Uebelhart D., Knols R., de Bruin E.D., Verbruggen G. Chondroitin sulfate as a structure–
modifying agent. Adv. Pharmacol., 2006, 53:475–488.
30. Youyg Ho Lee, Jin–Hyun Woo et al. Effect of glucosamin or chondroitin sulfate on the osteoarthritis progression: a meta–analysis. Rheumatol Int, Published on line: 21 June 2009.
31. Clegg DO, Domenia J.Reda, Cristal L.Harris at al. Glucosamine,Chondroitin sulfate, and two in combination for painful knee Osteoarthritis. The New England Journal of Medicine. 2006, vol.354: 795–808.
32. Verbruggen G., Goemaere, S., and Veys, E. M. Chondroitin sulfate: SYDMOAD (structure/disease modifying anti–osteoarthritis drug) in the treatment of finger joint OA. Osteoarthritis Cartilage, 1998, 6(Suppl A): 37–38.
33. –Э–∞—Б–Њ–љ–Њ–≤–∞ –Т.–Р., –Р–ї–µ–Ї—Б–µ–µ–≤–∞ –Ы.–Ш., –Р—А—Е–∞–љ–≥–µ–ї—М—Б–Ї–∞—П –У.–°., –Ф–∞–≤—Л–і–Њ–≤–∞ –Р.–§. –Є –і—А. –Ш—В–Њ–≥–Є –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤–Њ–≥–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –°—В—А—Г–Ї—В—Г–Љ –≤ –†–Њ—Б—Б–Є–Є. –Ґ–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–є –∞—А—Е–Є–≤, 2001, N11: 84–87
34. Hathcock JN, Shao A. Risk assessment for Glucosamine and chondroitin sulfate. Regulatory Toxicology and Pharmacology, 2007; 47:78–83.












