–°–Њ–≥–ї–∞—Б–љ–Њ —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –і–∞–љ–љ—Л–Љ –≤ –†–§ –љ–∞—Б—З–Є—В—Л–≤–∞–µ—В—Б—П –±–Њ–ї–µ–µ 14 –Љ–ї–љ. –±–Њ–ї—М–љ—Л—Е —Б –Ю–Р –Ї—А—Г–њ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤ –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є. –Я—А–Є —Н—В–Њ–Љ —А–Є—Б–Ї —Г—В—А–∞—В—Л —В—А—Г–і–Њ—Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –њ—А–Є –Ю–Р –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є —В–∞–Ї –ґ–µ –≤–µ–ї–Є–Ї, –Ї–∞–Ї –њ—А–Є —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е, –Њ—Б–Њ–±–µ–љ–љ–Њ —Г –ї–Є—Ж —Б—В–∞—А—И–µ–є –≤–Њ–Ј—А–∞—Б—В–љ–Њ–є –≥—А—Г–њ–њ—Л.
–Т –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –њ—А–Њ—Ж–µ—Б—Б –њ—А–Є –Ю–Р –≤–Њ–≤–ї–µ—З–µ–љ—Л –≥–Є–∞–ї–Є–љ–Њ–≤—Л–є —Е—А—П—Й, —Б—Г–±—Е–Њ–љ–і—А–∞–ї—М–љ–∞—П –Ї–Њ—Б—В—М, —Б–Є–љ–Њ–≤–Є—П, —Б–≤—П–Ј–Њ—З–љ—Л–є –∞–њ–њ–∞—А–∞—В, –Љ—Л—И—Ж—Л, —Б—Г—Е–Њ–ґ–Є–ї–Є—П. –Ш–Љ–µ—О—В—Б—П –і–∞–љ–љ—Л–µ –Њ —В–Њ–Љ, —З—В–Њ –њ–µ—А–≤–Є—З–љ–Њ—Б—В—М –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –≤ –њ–∞—А–∞–∞—А—В–Є–Ї—Г–ї—П—А–љ—Л—Е —В–Ї–∞–љ—П—Е – –Њ–±–ї–∞—Б—В–Є —Н–љ—В–µ–Ј–Њ–≤, —З—В–Њ –љ–∞–≤–Њ–і–Є—В –љ–∞ –Љ—Л—Б–ї—М –Њ «—А–µ–∞–Ї—В–Є–≤–љ–Њ–Љ» –љ–∞—З–∞–ї–µ –±–Њ–ї–µ–Ј–љ–Є, –Є –ї–Є—И—М –њ—А–Є –µ–µ —Е—А–Њ–љ–Є–Ј–∞—Ж–Є–Є –≤–Њ–≤–ї–µ–Ї–∞—О—В—Б—П –≤–љ—Г—В—А–Є—Б—Г—Б—В–∞–≤–љ—Л–µ —В–Ї–∞–љ–Є —Б –і–µ—Б—В—А—Г–Ї—Ж–Є–µ–є —Е—А—П—Й–∞, —Б—Г–±—Е–Њ–љ–і—А–∞–ї—М–љ–Њ–є –Ї–Њ—Б—В–Є –Є –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ–Љ –Њ—Б—В–µ–Њ—Д–Є—В–Њ–Ј–∞, –љ–∞—А—Г—И–µ–љ–Є–µ–Љ –Ї–Њ–љ–≥—А—Г—Н–љ—В–љ–Њ—Б—В–Є —Б—Г—Б—В–∞–≤–Њ–≤.
–Ю—Б–љ–Њ–≤–љ—Л–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ –њ—А–Њ—П–≤–ї–µ–љ–Є–µ–Љ –Ю–Р —П–≤–ї—П–µ—В—Б—П –±–Њ–ї—М, –љ–Њ—Б—П—Й–∞—П –њ–Њ–ї–Є–Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ—Л–є –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ–Љ, –±–Є–Њ–Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Є–Љ–Є –Є –њ—Б–Є—Е–Њ—Н–Љ–Њ—Ж–Є–Њ–љ–∞–ї—М–љ—Л–Љ–Є –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є.
–Я–Њ –і–∞–љ–љ—Л–Љ –∞—А—В—А–Њ—Б–Ї–Њ–њ–Є–Є –њ—А–Є–Ј–љ–∞–Ї–Є —Б–Є–љ–Њ–≤–Є—В–∞ –њ—А–Є –Ю–Р –≤—Л—П–≤–ї—П—О—В—Б—П –≤ 58–78% —Б–ї—Г—З–∞–µ–≤ –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –Њ—В–і–µ–ї–∞—Е –Ї–Њ–ї–µ–љ–љ–Њ–≥–Њ —Б—Г—Б—В–∞–≤–∞. –Ь–†–Ґ –≤—Л—П–≤–ї—П–µ—В –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –њ—А–Є–Ј–љ–∞–Ї–Є –≤ –Љ—П–≥–Ї–Є—Е —В–Ї–∞–љ—П—Е, —Е—А—П—Й–µ –Є –Ї–Њ—Б—В–љ—Л—Е —Б—В—А—Г–Ї—В—Г—А–∞—Е —Г 81% –±–Њ–ї—М–љ—Л—Е [2].
–Т –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –Ю–Р, –њ–Њ–Љ–Є–Љ–Њ –±–Є–Њ–Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Є—Е –Є –≤–Њ–Ј—А–∞—Б—В–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є, –≤–ї–Є—П—О—Й–Є—Е –љ–∞ –і–µ–≥—А–∞–і–∞—Ж–Є—О —Е—А—П—Й–∞, –≤–∞–ґ–љ–∞—П —А–Њ–ї—М –Њ—В–≤–Њ–і–Є—В—Б—П –≤–Њ—Б–њ–∞–ї–µ–љ–Є—О –Є –і–Є—Б—А–µ–≥—Г–ї—П—Ж–Є–Є —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤–Њ–≥–Њ –Ї–∞—Б–Ї–∞–і–∞, –Ї–Њ—В–Њ—А–∞—П —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –љ–∞—А—Г—И–µ–љ–Є—О –±–∞–ї–∞–љ—Б–∞ –Љ–µ–ґ–і—Г –∞–љ–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–Љ–Є –Є –Ї–∞—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Њ—Ж–µ—Б—Б–∞–Љ–Є. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е in vitro –Є in vivo —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–∞ —А–Њ–ї—М –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤ – –Ш–Ы–1 –Є –§–Э–Ю– α –≤ –њ–∞—В–Њ–ї–Њ–≥–Є–Є —Е—А—П—Й–∞, –∞ —В–∞–Ї–ґ–µ –Њ–Ї—Б–Є–і–∞ –∞–Ј–Њ—В–∞ –Є –і–µ–≥—А–∞–і–Є—А—Г—О—Й–Є—Е –Љ–∞—В—А–Є–Ї—Б —Е—А—П—Й–∞ —Н–љ–Ј–Є–Љ–Њ–≤ – –Љ–µ—В–∞–ї–ї–Њ–њ—А–Њ—В–µ–Є–љ–∞–Ј [3–6].
–°–ї–µ–і—Г–µ—В –њ—А–Є–љ–Є–Љ–∞—В—М –≤–Њ –≤–љ–Є–Љ–∞–љ–Є–µ, —З—В–Њ –њ—А–Є —Б—В–∞—А–µ–љ–Є–Є –њ—А–Њ–Є—Б—Е–Њ–і—П—В –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤ —Б—В—А—Г–Ї—В—Г—А–µ –Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є–Є –ґ–Є–Ј–љ–µ–љ–љ–Њ –≤–∞–ґ–љ—Л—Е –Њ—А–≥–∞–љ–Њ–≤ –Є —В–Ї–∞–љ–µ–є: —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П –Љ–∞—Б—Б–∞ –њ–µ—З–µ–љ–Є, –Ј–∞–Љ–µ–і–ї—П–µ—В—Б—П –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є–µ, —Б–љ–Є–ґ–∞–µ—В—Б—П —Д–Є–ї—М—В—А–∞—Ж–Є–Њ–љ–љ–∞—П –Є —Н–Ї—Б–Ї—А–µ—В–Њ—А–љ–∞—П —Д—Г–љ–Ї—Ж–Є–Є –њ–Њ—З–µ–Ї, –њ–Њ–≤—Л—И–∞–µ—В—Б—П –≤–µ—Б —В–µ–ї–∞ –Ј–∞ —Б—З–µ—В –њ–Њ–і–Ї–Њ–ґ–љ–Њ––ґ–Є—А–Њ–≤–Њ–є –Ї–ї–µ—В—З–∞—В–Ї–Є –њ—А–Є —Б–љ–Є–ґ–µ–љ–Є–Є –Љ—Л—И–µ—З–љ–Њ–є –Љ–∞—Б—Б—Л. –Т—Л—И–µ–Є–Ј–ї–Њ–ґ–µ–љ–љ–Њ–µ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –≤—Л–±–Њ—А–∞ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–µ —В–Њ–ї—М–Ї–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л—Е –і–ї—П –ї–µ—З–µ–љ–Є—П –Ю–Р, –љ–Њ –Є —Б–Њ–≤–Љ–µ—Б—В–Є–Љ—Л—Е —Б –і—А—Г–≥–Є–Љ–Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–Љ–Є —Б—А–µ–і—Б—В–≤–∞–Љ–Є. –Ю—Б–Њ–±–Њ–µ –≤–љ–Є–Љ–∞–љ–Є–µ —Б–ї–µ–і—Г–µ—В —Г–і–µ–ї—П—В—М –Є—Е –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є.
–Х–≤—А–Њ–њ–µ–є—Б–Ї–Њ–є –∞–љ—В–Є—А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Њ–є –ї–Є–≥–Њ–є —А–∞–Ј—А–∞–±–Њ—В–∞–љ—Л —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ –ї–µ—З–µ–љ–Є—О —А–∞–Ј–ї–Є—З–љ—Л—Е –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–є –Ю–Р – –Ї–Њ–ї–µ–љ–љ—Л—Е, —В–∞–Ј–Њ–±–µ–і—А–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤ –Є —Б—Г—Б—В–∞–≤–Њ–≤ –Ї–Є—Б—В–µ–є, –Њ—Б–љ–Њ–≤–∞–љ–љ—Л–µ –љ–∞ –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ–µ [7–9].
–Т –њ–Њ—Б–ї–µ–і–љ–Є—Е —А—Г–Ї–Њ–≤–Њ–і—Б—В–≤–∞—Е (2008 –≥.) –њ–Њ –ї–µ—З–µ–љ–Є—О –Ю–Р –Ї–Њ–ї–µ–љ–љ—Л—Е –Є —В–∞–Ј–Њ–±–µ–і—А–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤ 93% —З–ї–µ–љ–Њ–≤ —Н–Ї—Б–њ–µ—А—В–љ–Њ–є –Ї–Њ–Љ–Є—Б—Б–Є–Є –≤—Л—Б–Ї–∞–Ј–∞–ї–Є—Б—М –≤ –њ–Њ–і–і–µ—А–ґ–Ї—Г –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –љ–µ—Б—В–µ—А–Њ–Є–і–љ—Л–µ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л (–Э–Я–Т–Я) –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є —Н—В–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П.
–Э–Я–Т–Я – –њ—А–µ–њ–∞—А–∞—В—Л –њ–µ—А–≤–Њ–≥–Њ —А—П–і–∞ —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –Ю–Р. –Ю—Б–љ–Њ–≤–љ–Њ–є –Љ–µ—Е–∞–љ–Є–Ј–Љ –і–µ–є—Б—В–≤–Є—П –Э–Я–Т–Я —Б–≤—П–Ј–∞–љ —Б –Є—Е —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О –Є–љ–≥–Є–±–Є—А–Њ–≤–∞—В—М —Ж–Є–Ї–ї–Њ–Њ–Ї—Б–Є–≥–µ–љ–∞–Ј—Г –Є –Њ—Б–Њ–±–µ–љ–љ–Њ –¶–Ю–У–2, —Г—З–∞—Б—В–≤—Г—О—Й—Г—О –≤ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–Є –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –∞–ї—М–≥–Њ–≥–µ–љ–Њ–≤ – –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤ [10,11].
–Э–µ–ї—М–Ј—П –љ–µ –њ—А–Є–љ–Є–Љ–∞—В—М –≤–Њ –≤–љ–Є–Љ–∞–љ–Є–µ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —З–∞—Б—В–Њ–µ —А–∞–Ј–≤–Є—В–Є–µ —А–∞–Ј–ї–Є—З–љ—Л—Е –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ —Г –±–Њ–ї—М–љ—Л—Е, –њ—А–Є–љ–Є–Љ–∞—О—Й–Є—Е –Э–Я–Т–Я, —З—В–Њ —Б–≤—П–Ј–∞–љ–Њ —Б –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є–µ–Љ –¶–Ю–У–1. –≠—В–∞ –њ—А–Њ–±–ї–µ–Љ–∞ —Б—В–∞–ї–∞ –Њ—Б–Њ–±–µ–љ–љ–∞ –∞–Ї—В—Г–∞–ї—М–љ–Њ–є –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –≤ —Б–≤—П–Ј–Є —Б —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –ґ–Є–Ј–љ–Є –љ–∞—Б–µ–ї–µ–љ–Є—П –љ–∞—И–µ–є –њ–ї–∞–љ–µ—В—Л. –Ы–Є—Ж–∞ —Б—В–∞—А—И–Є—Е –≤–Њ–Ј—А–∞—Б—В–љ—Л—Е –≥—А—Г–њ–њ —Б –і–Є–∞–≥–љ–Њ–Ј–Њ–Љ –Ю–Р, —Г –Ї–Њ—В–Њ—А—Л—Е —А–Є—Б–Ї –Э–Я–Т–Я––Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –Њ—Б–Њ–±–µ–љ–љ–Њ –≤—Л—Б–Њ–Ї, –њ—А–Є–љ–Є–Љ–∞—О—В —Н—В–Є –њ—А–µ–њ–∞—А–∞—В—Л –њ—А–Є–Љ–µ—А–љ–Њ –≤ 4 —А–∞–Ј–∞ —З–∞—Й–µ, —З–µ–Љ –Љ–Њ–ї–Њ–і—Л–µ. –Т—Л—Б–Њ–Ї–∞—П —В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М –Э–Я–Т–Я —Г –ї–Є—Ж –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ —Б–≤—П–Ј–∞–љ–∞ —Б —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є –Є –њ—А–Є–µ–Љ–Њ–Љ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤, —Г–≤–µ–ї–Є—З–Є–≤–∞—О—Й–Є—Е —А–Є—Б–Ї –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –Э–Я–Т–Я. –°–Њ–≥–ї–∞—Б–љ–Њ —Б—Г—Й–µ—Б—В–≤—Г—О—Й–Є–Љ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ –±–Њ–ї—М–љ—Л–Љ —Б —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П —В–∞–Ї–Є—Е —П–≤–ї–µ–љ–Є–є —Б–Њ —Б—В–Њ—А–Њ–љ—Л –Ц–Ъ–Ґ –і–Њ–ї–ґ–љ—Л –љ–∞–Ј–љ–∞—З–∞—В—М—Б—П –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ –Э–Я–Т–Я —Б–Њ–≤–Љ–µ—Б—В–љ–Њ —Б –≥–∞—Б—В—А–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А–∞–Љ–Є (–±–ї–Њ–Ї–∞—В–Њ—А–∞–Љ–Є –њ—А–Њ—В–Њ–љ–љ–Њ–є –њ–Њ–Љ–њ—Л) –Є–ї–Є —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ –Э–Я–Т–Я. –Я–∞—Ж–Є–µ–љ—В–∞–Љ —Б –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л—Е –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –њ–∞—А–∞–ї–ї–µ–ї—М–љ–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –љ–Є–Ј–Ї–Є—Е –і–Њ–Ј –∞—Ж–µ—В–Є–ї—Б–∞–ї–Є—Ж–Є–ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л. –Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —В–∞–Ї–ґ–µ —Г—З–Є—В—Л–≤–∞—В—М, —З—В–Њ –њ–Њ–ґ–Є–ї—Л–µ –±–Њ–ї—М–љ—Л–µ –љ–µ—А–µ–і–Ї–Њ –њ—А–Є–љ–Є–Љ–∞—О—В –Є –і—А—Г–≥–Є–µ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ —Б—А–µ–і—Б—В–≤–∞ –і–ї—П –ї–µ—З–µ–љ–Є—П —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –Ї–Њ—В–Њ—А—Л–µ –і–∞–ї–µ–Ї–Њ –љ–µ –≤—Б–µ–≥–і–∞ —Б–Њ–≤–Љ–µ—Б—В–Є–Љ—Л —Б –њ—А–Є–µ–Љ–Њ–Љ –Э–Я–Т–Я. –Т—Б–µ —Н—В–Њ —В—А–µ–±—Г–µ—В –≤–і—Г–Љ—З–Є–≤–Њ–≥–Њ –њ–Њ–і—Е–Њ–і–∞ –≤—А–∞—З–∞ –Ї –љ–∞–Ј–љ–∞—З–µ–љ–Є—О –±–Њ–ї—М–љ–Њ–Љ—Г –Ю–Р —В–Њ–≥–Њ –Є–ї–Є –Є–љ–Њ–≥–Њ –Э–Я–Т–Я. –Т–∞–ґ–љ–Њ —Г—З–Є—В—Л–≤–∞—В—М, —З—В–Њ –љ–µ–Ї–Њ—В–Њ—А—Л–µ –Э–Я–Т–Я —Б–њ–Њ—Б–Њ–±–љ—Л –Њ–Ї–∞–Ј—Л–≤–∞—В—М –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ —Е—А—П—Й–∞ (–љ–∞–њ—А–Є–Љ–µ—А, –Є–љ–і–Њ–Љ–µ—В–∞—Ж–Є–љ), –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—П –і–∞–ї—М–љ–µ–є—И–µ–Љ—Г –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—О –Ю–Р , –Њ—Б–Њ–±–µ–љ–љ–Њ –≤ –њ–Њ–ґ–Є–ї–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Є—Е –Э–Я–Т–Я, –њ–Њ–і–∞–≤–ї—П—О—Й–Є—Е –≤—Л—А–∞–±–Њ—В–Ї—Г –Ї–∞–Ї –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е, —В–∞–Ї –Є —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤ —Б–Њ–њ—А—П–ґ–µ–љ–Њ —Б –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ —А–Є—Б–Ї–Њ–Љ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П «–Э–Я–Т–Я––≥–∞—Б—В—А–Њ–њ–∞—В–Є–є», –њ–Њ—П–≤–ї–µ–љ–Є–µ–Љ –Є –љ–∞—А–∞—Б—В–∞–љ–Є–µ–Љ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–Є –Є —А—П–і–∞ –і—А—Г–≥–Є—Е –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є, —З—В–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Г—З–Є—В—Л–≤–∞—В—М –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є —Н—В–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤ –њ–Њ–ґ–Є–ї–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ [12 ].
–Ф–ї—П –±–Њ–ї—М—И–µ–є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є —В–µ—А–∞–њ–Є–Є –±–Њ–ї—М–љ—Л–Љ –Ю–Р, –Њ—Б–Њ–±–µ–љ–љ–Њ –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞, —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–µ –Є–љ–≥–Є–±–Є—В–Њ—А—Л –¶–Ю–У–2. –Т—Б–µ –±–Њ–ї—М—И—Г—О –њ–Њ–њ—Г–ї—П—А–љ–Њ—Б—В—М –Ј–∞–≤–Њ–µ–≤—Л–≤–∞–µ—В –њ–µ—А–≤—Л–є –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї—М –љ–Њ–≤—Л—Е —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Э–Я–Т–Я – –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ [13]. –Ь–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ (–Р–Љ–µ–ї–Њ—В–µ–Ї—Б) –Њ—В–љ–Њ—Б–Є—В—Б—П –Ї –≥—А—Г–њ–њ–µ –њ—А–Њ–Є–Ј–≤–Њ–і–љ—Л—Е —Н–љ–Њ–ї–Є–Ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л, –Ї–∞–Ї –Є –њ–Є—А–Њ–Ї—Б–Є–Ї–∞–Љ, –љ–Њ –Њ—В–ї–Є—З–∞–µ—В—Б—П –Њ—В –њ–Њ—Б–ї–µ–і–љ–µ–≥–Њ –љ–µ–±–Њ–ї—М—И–Є–Љ –Є–Ј–Љ–µ–љ–µ–љ–Є–µ–Љ —Б—В—А—Г–Ї—В—Г—А—Л. –Ь–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ (–Є–Ј–±–Є—А–∞—В–µ–ї—М–љ–Њ) –њ–Њ–і–∞–≤–ї—П–µ—В –¶–Ю–У–2 –Є –ї–Є—И—М –≤ –±–Њ–ї—М—И–Є—Е –і–Њ–Ј–∞—Е – —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї—Г—О –¶–Ю–У–1, —Б –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є–µ–Љ –Ї–Њ—В–Њ—А–Њ–є —Б–≤—П–Ј–∞–љ—Л –Э–Я–Т–Я––≥–∞—Б—В—А–Њ–њ–∞—В–Є—П, —Г—Е—Г–і—И–µ–љ–Є–µ –њ–Њ—З–µ—З–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –Є –і—А. –Ь–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –љ–µ –≤—Б—В—Г–њ–∞–µ—В –≤–Њ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–µ —Б –і—А—Г–≥–Є–Љ–Є –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–∞–Љ–Є, –≤–Ї–ї—О—З–∞—П —Ж–Є—В–Њ—Б—В–∞—В–Є–Ї–Є, —Б–µ—А–і–µ—З–љ—Л–µ –≥–ї–Є–Ї–Њ–Ј–Є–і—Л, –і–Є—Г—А–µ—В–Є–Ї–Є –Є –і—А—Г–≥–Є–µ, —З—В–Њ –Є–Љ–µ–µ—В –±–Њ–ї—М—И–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –і–ї—П —А–∞—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –±–Њ–ї—М–љ—Л—Е —Б —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є, –Њ—Б–Њ–±–µ–љ–љ–Њ –≤ –њ–Њ–ґ–Є–ї–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ [14 ].
–Ю–і–љ–∞ –Є–Ј –њ–µ—А–≤—Л—Е —А–∞–±–Њ—В –њ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ–∞ –≤ –і–Њ–Ј–µ 7,5 –Љ–≥/—Б—Г—В. –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б «–Ј–Њ–ї–Њ—В—Л–Љ —Б—В–∞–љ–і–∞—А—В–Њ–Љ» –Э–Я–Т–Я – –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї–Њ–Љ (100 –Љ–≥/—Б—Г—В.) –њ—А–Њ–≤–µ–і–µ–љ–Њ –≤ –і–≤–Њ–є–љ–Њ–Љ —Б–ї–µ–њ–Њ–Љ 4––љ–µ–і–µ–ї—М–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є MELISSA (423 –±–Њ–ї—М–љ—Л—Е –Ю–Р), –≤ –Ї–Њ—В–Њ—А–Њ–Љ –њ—А–Є–љ—П–ї–Є —Г—З–∞—Б—В–Є–µ 27 —Б—В—А–∞–љ, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –†–Њ—Б—Б–Є—П [15 ].
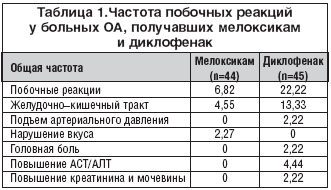
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –љ–Њ–≤—Л–є —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–є –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –¶–Ю–У–2 –њ—А–µ–њ–∞—А–∞—В –њ–Њ –∞–љ–∞–ї—М–≥–µ—В–Є—З–µ—Б–Ї–Њ–Љ—Г —Н—Д—Д–µ–Ї—В—Г, —Г–ї—Г—З—И–µ–љ–Є—О —Б–Њ—Б—В–Њ—П–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–µ —Г—Б—В—Г–њ–∞–ї –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї—Г, –љ–Њ –њ—А–µ–≤–Њ—Б—Е–Њ–і–Є–ї –µ–≥–Њ –њ–Њ –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є. –Т —А–Њ—Б—Б–Є–є—Б–Ї–Њ–є –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ, –њ–Њ–±–Њ—З–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є –±—Л–ї–Њ –≤ 3 —А–∞–Ј–∞ –Љ–µ–љ—М—И–µ, —З–µ–Љ –њ—А–Є –њ—А–Є–µ–Љ–µ –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї–∞ (—В–∞–±–ї. 1) [16].
–Ъ –љ–∞—Б—В–Њ—П—Й–µ–Љ—Г –≤—А–µ–Љ–µ–љ–Є –њ–Њ–ї—Г—З–µ–љ –±–Њ–ї—М—И–Њ–є —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л–є –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є –Љ–∞—В–µ—А–Є–∞–ї, –њ–Њ–Ї–∞–Ј–∞–≤—И–Є–є, —З—В–Њ –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ –≤ –і–Њ–Ј–µ 7,5 –Љ–≥ –≤ —Б—Г—В–Ї–Є (–Њ–і–љ–Њ–Ї—А–∞—В–љ–Њ –њ—А–Є–љ–Є–Љ–∞–µ–Љ–∞—П —В–∞–±–ї–µ—В–Ї–∞) –≤—Л—Б–Њ–Ї–Њ—Н—Д—Д–µ–Ї—В–Є–≤–µ–љ –њ—А–Є –Ю–Р.
–°—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–µ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ–∞ –≤ –і–Њ–Ј–µ 7,5 –Љ–≥ –Є 15 –Љ–≥ –Є —В–∞–Ї–Є—Е –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Э–Я–Т–Я, –Ї–∞–Ї –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї –љ–∞—В—А–Є—П (100 –Љ–≥) –Є –њ–Є—А–Њ–Ї—Б–Є–Ї–∞–Љ (20 –Љ–≥) –њ–Њ–Ї–∞–Ј–∞–ї–Є —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л–є —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В –Є —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –Љ–µ–љ—М—И—Г—О —З–∞—Б—В–Њ—В—Г –њ–Њ–±–Њ—З–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є. –Ю—В–Љ–µ–љ–∞ –њ—А–µ–њ–∞—А–∞—В–∞ –Є–Ј––Ј–∞ –љ–Є–Ј–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –≤–Њ –≤—Б–µ—Е —В—А–µ—Е –≥—А—Г–њ–њ–∞—Е –љ–µ –њ—А–µ–≤—Л—И–∞–ї–∞ 1,7% [16].
–С–Њ–ї—М—И–Њ–µ –≤–љ–Є–Љ–∞–љ–Є–µ —Г–і–µ–ї—П–µ—В—Б—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П –±–Њ–ї—М–љ—Л–Љ–Є –Ю–Р, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –Є–Љ–µ–љ–љ–Њ —Н—В–Є –њ–∞—Ж–Є–µ–љ—В—Л —Б—В—А–∞–і–∞—О—В –Є —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –≤–љ—Г—В—А–µ–љ–љ–Є–Љ–Є –±–Њ–ї–µ–Ј–љ—П–Љ–Є, —З—В–Њ –Њ—В—П–≥–Њ—Й–∞–µ—В –њ—А–Є–µ–Љ –Э–Я–Т–Я. –°—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–µ 6––Љ–µ—Б—П—З–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ–∞ (7,5 –Љ–≥) –Є –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї–∞–—А–µ—В–∞—А–і (100 –Љ–≥) –њ—А–Њ–≤–µ–і–µ–љ–Њ —Г 335 –±–Њ–ї—М–љ—Л—Е –Ю–Р —Б –±–Њ–ї—П–Љ–Є –Є –њ—А–Є–њ—Г—Е–ї–Њ—Б—В—М—О –Ї–Њ–ї–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤ –Є –±–Њ–ї—П–Љ–Є –≤ —В–∞–Ј–Њ–±–µ–і—А–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–∞—Е. –°—А–∞–≤–љ–Є–Љ–Њ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ —Г–ї—Г—З—И–µ–љ–Є–µ –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е, –∞ –њ–Њ–±–Њ—З–љ—Л–µ – —Г 11,6 –Є 14% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ [17].
–Т–∞–ґ–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ–∞ –±—Л–ї–Є –њ—А–Њ–≤–µ–і–µ–љ—Л —Г –±–Њ–ї—М–љ—Л—Е —Б —А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є —Б—В–∞—А—И–Є—Е –≤–Њ–Ј—А–∞—Б—В–љ—Л—Е –≥—А—Г–њ–њ —Б —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ –њ–Њ—З–µ–Ї. –Ґ–∞–Ї, 4––љ–µ–і–µ–ї—М–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±–Њ–ї—М–љ—Л–Љ–Є —Б —А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є (—Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В 70 –ї–µ—В) –Є —Г–Љ–µ—А–µ–љ–љ—Л–Љ–Є –њ–Њ—З–µ—З–љ—Л–Љ–Є –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є (–Ї–ї–Є—А–µ–љ—Б –Ї—А–µ–∞—В–Є–љ–Є–љ 25–60 –Љ–ї/–Љ–Є–љ.) –њ–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ –њ—А–Є–µ–Љ –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ–∞ –≤ –і–Њ–Ј–µ 15 –Љ–≥ –љ–µ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–Љ–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є –Ї–ї–Є—А–µ–љ—Б–∞ –Ї—А–µ–∞—В–Є–љ–Є–љ–∞ –Є –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ –Ї—А–µ–∞—В–Є–љ–Є–љ–∞, –Љ–Њ—З–µ–≤–Є–љ—Л –Є –Ї–∞–ї–Є—П –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є. –Я—А–Є —Н—В–Њ–Љ –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –≤ –≤–Є–і–µ –Ц–Ъ–Ґ-–љ–∞—А—Г—И–µ–љ–Є–є –Њ—В–Љ–µ—З–µ–љ—Л —Г 5% –±–Њ–ї—М–љ—Л—Е. –Т —Н—В–Њ–є –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е —В–∞–Ї–ґ–µ –љ–µ –Њ—В–Љ–µ—З–µ–љ–Њ –∞–Ї–Ї—Г–Љ—Г–ї–Є—А–Њ–≤–∞–љ–Є—П –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ–∞ [18].
–Ю–±—А–∞—Й–∞—О—В –љ–∞ —Б–µ–±—П –≤–љ–Є–Љ–∞–љ–Є–µ –і–∞–љ–љ—Л–µ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ (18 –Љ–µ—Б.) –ї–µ—З–µ–љ–Є—П –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ–Њ–Љ –≤ –і–Њ–Ј–µ 15 –Љ–≥ 357 –±–Њ–ї—М–љ—Л—Е –†–Р. –Я–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–є —Н—Д—Д–µ–Ї—В –≤ –≤–Є–і–µ —Г–Љ–µ–љ—М—И–µ–љ–Є—П –±–Њ–ї–µ–є –≤ —Б—Г—Б—В–∞–≤–∞—Е –њ—А–Є –і–≤–Є–ґ–µ–љ–Є–Є, –љ–Њ—З–љ—Л—Е —Б—Г—Б—В–∞–≤–љ—Л—Е –±–Њ–ї–µ–є, —Г—В—А–µ–љ–љ–µ–є —Б–Ї–Њ–≤–∞–љ–љ–Њ—Б—В–Є –Њ—В–Љ–µ—З–µ–љ —Г –њ–Њ–і–∞–≤–ї—П—О—Й–µ–≥–Њ —З–Є—Б–ї–∞ –±–Њ–ї—М–љ—Л—Е. –Ю—В–Љ–µ–љ–Є—В—М –њ—А–µ–њ–∞—А–∞—В –Є–Ј––Ј–∞ –Њ—В—Б—Г—В—Б—В–≤–Є—П —Н—Д—Д–µ–Ї—В–∞ –њ—А–Є—И–ї–Њ—Б—М —Г 10,9% –±–Њ–ї—М–љ—Л—Е –Є —Г 13,2% –Є–Ј––Ј–∞ –њ–Њ–±–Њ—З–љ—Л—Е –Ц–Ъ–Ґ–—А–µ–∞–Ї—Ж–Є–є, –Њ–і–љ–∞–Ї–Њ –њ–µ–њ—В–Є—З–µ—Б–Ї–∞—П —П–Ј–≤–∞ —А–∞–Ј–≤–Є–ї–∞—Б—М —В–Њ–ї—М–Ї–Њ —Г 1% –±–Њ–ї—М–љ—Л—Е [19]. –Р–љ–∞–ї–Њ–≥–Є—З–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л –њ—А–Є —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–є –Њ—Ж–µ–љ–Ї–µ –њ–Є—А–Њ–Ї—Б–Є–Ї–∞–Љ–∞ –Є –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ–∞ [20].
–Я—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ, –∞ —В–∞–Ї–ґ–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –і—А—Г–≥–Є—Е –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ —В–Њ–Љ, —З—В–Њ –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ —П–≤–ї—П–µ—В—Б—П –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –њ–µ—А–≤–Њ–≥–Њ —А—П–і–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Ю–Р, –Њ—Б–Њ–±–µ–љ–љ–Њ —Б—В–∞—А—И–µ–є –≤–Њ–Ј—А–∞—Б—В–љ–Њ–є –≥—А—Г–њ–њ—Л, –±–ї–∞–≥–Њ–і–∞—А—П –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П–Љ –µ–≥–Њ —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є–Ї–Є, —Г–і–Њ–±—Б—В–≤—Г –њ—А–Є–Љ–µ–љ–µ–љ–Є—П (–Њ–і–љ–Њ–Ї—А–∞—В–љ—Л–є –њ—А–Є–µ–Љ), —Е–Њ—А–Њ—И–µ–є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є –Є —Б–Њ–≤–Љ–µ—Б—В–Є–Љ–Њ—Б—В–Є —Б –і—А—Г–≥–Є–Љ–Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–Љ–Є —Б—А–µ–і—Б—В–≤–∞–Љ–Є.
–≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Э–Я–Т–Я –≤ —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–Љ –ї–µ—З–µ–љ–Є–Є –Ю–Р –і–Њ–Ї–∞–Ј–∞–љ–∞ –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л–Љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П–Љ–Є. –І—В–Њ –ґ–µ –Ї–∞—Б–∞–µ—В—Б—П –Є—Е –≤–ї–Є—П–љ–Є—П –љ–∞ —А–∞–Ј–≤–Є—В–Є–µ –Ю–Р, —В–Њ –Є—Е —А–Њ–ї—М –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ –Є–Ј—Г—З–µ–љ–∞ –Є –і–∞–љ–љ—Л–µ –њ–Њ –≤–ї–Є—П–љ–Є—О –љ–∞ —Е—А—П—Й –љ–µ—А–µ–і–Ї–Њ —Г–Ї–∞–Ј—Л–≤–∞—О—В –љ–∞ –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ, —З—В–Њ –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, –Ї–∞—Б–∞–µ—В—Б—П –Є–љ–і–Њ–Љ–µ—В–∞—Ж–Є–љ–∞ [21].
–Ю—Б–Њ–±—Л–є –Є–љ—В–µ—А–µ—Б –≤—Л–Ј—Л–≤–∞–µ—В –≤–Њ–њ—А–Њ—Б –Њ –≤–ї–Є—П–љ–Є–Є –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ–∞ –љ–∞ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –Ю–Р.
–≠—Д—Д–µ–Ї—В –Э–Я–Т–Я, –≤ —В–Њ–Љ —З–Є—Б–ї–µ —Ж–µ–ї–µ–Ї–Њ–Ї—Б–Є–±–∞, –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ–∞ –Є –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї–∞ –љ–∞ —Д—Г–љ–Ї—Ж–Є—О –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–∞ –Х2, –¶–Ю–У–2 —Н–Ї—Б–њ—А–µ—Б—Б–Є—О, —Г—А–Њ–≤–µ–љ—М –љ–Є—В—А–Є—В–Њ–≤, –љ–∞–ї–Є—З–Є–µ –Ь–Ь–Я–1 –Є –Ь–Ь–Я–13, –∞–Ї—В–Є–≤–∞—Ж–Є—О —П–і–µ—А–љ–Њ–≥–Њ —Д–∞–Ї—В–Њ—А–∞ –Ї–∞–њ–њ–∞ –Т –Є–Ј—Г—З–∞–ї–Є –љ–∞ —Б—В–Є–Љ—Г–ї–Є—А–Њ–≤–∞–љ–љ—Л—Е —Б–Є–љ–Њ–≤–Є–Њ—Ж–Є—В–∞—Е –Є —Е–Њ–љ–і—А–Њ—Ж–Є—В–∞—Е –±–Њ–ї—М–љ—Л—Е –Ю–Р. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ –Э–Я–Т–Я –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Б–љ–Є–ґ–∞—О—В —Г—А–Њ–≤–µ–љ—М –Ь–Ь–Я–1 –≤ –Њ–±–Њ–Є—Е —В–Є–њ–∞—Е –Ї–ї–µ—В–Њ–Ї, –∞ –Ь–Ь–Я–13 –≤ —Е–Њ–љ–і—А–Њ—Ж–Є—В–∞—Е, —З—В–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ–± –Њ—В—Б—Г—В—Б—В–≤–Є–Є –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ —В–µ—З–µ–љ–Є–µ –Ю–Р. –≠—В–Є –њ—А–µ–њ–∞—А–∞—В—Л –≤–ї–Є—П–ї–Є –њ–Њ–Ј–Є—В–Є–≤–љ–Њ –љ–∞ —Г—А–Њ–≤–µ–љ—М –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–∞ –Х2 –Є —Б–љ–Є–ґ–∞–ї–Є —Н–Ї—Б–њ—А–µ—Б—Б–Є—О –¶–Ю–У–2 [22]. –°—Е–Њ–і–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Я–У–Х2 –Њ—В–Љ–µ—З–µ–љ—Л [10] –≤ –Ї—Г–ї—М—В—Г—А–µ —З–µ–ї–Њ–≤–µ—З–µ—Б–Ї–Є—Е —Е–Њ–љ–і—А–Њ—Ж–Є—В–Њ–≤, —З—В–Њ –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞–ї–Њ —Е–Њ–љ–і—А–Њ–ї–Є–Ј–Є—Б –Є –љ–∞—А—Г—И–µ–љ–Є—П —Б–Є–љ—В–µ–Ј–∞ –њ—А–Њ—В–µ–Њ–≥–ї–Є–Ї–∞–љ–Њ–≤ –Є –Ї–Њ–ї–ї–∞–≥–µ–љ–∞ II —В–Є–њ–∞.
–Я–Њ–Ј–Є—В–Є–≤–љ—Л–є —Н—Д—Д–µ–Ї—В –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ–∞ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —Б—Г–њ—А–µ—Б—Б–Є–Є –і–µ—Б—В—А—Г–Ї—В–Є–≤–љ—Л—Е —Н–љ–Ј–Є–Љ–Њ–≤ –Ь–Ь–Я–2 –Є –Ь–Ь–Я–9 –љ–∞ —А–∞–љ–љ–Є—Е —Б—В–∞–і–Є—П—Е –Ю–Р –Њ—В–Љ–µ—В–Є–ї–Є –Є –і—А—Г–≥–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–Є [23]. –Ю–љ–Є –Є–Ј—Г—З–∞–ї–Є –Ї—Г–ї—М—В—Г—А—Г —В–Ї–∞–љ–Є —Б—Г—Б—В–∞–≤–љ–Њ–≥–Њ —Е—А—П—Й–∞, –Љ–µ–љ–Є—Б–Ї–∞ –Є —Б–Є–љ–Њ–≤–Є–Є, –≤–Ј—П—В—Л—Е –њ—А–Є –∞—А—В—А–Њ—Б–Ї–Њ–њ–Є–Є. –Ю–Ї–∞–Ј–∞–ї–Њ—Б—М, —З—В–Њ –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ, –Ї–∞–Ї –Є –Љ–µ—В–Є–ї–њ—А–µ–і–љ–Є–Ј–Њ–ї–Њ–љ, —Б–њ–Њ—Б–Њ–±–µ–љ –њ–Њ–і–∞–≤–ї—П—В—М —Б–µ–Ї—А–µ—Ж–Є—О –Ь–Ь–Я–2 –≤–Њ –≤—Б–µ—Е —В–Ї–∞–љ–µ–≤—Л—Е –Ї—Г–ї—М—В—Г—А–∞—Е –Є –Ь–Ь–Я–9 –≤ —Б–Є–љ–Њ–≤–Є–Є, –∞ —В–∞–Ї–ґ–µ —Б–љ–Є–ґ–∞—В—М —Б–µ–Ї—А–µ—Ж–Є—О —Г—А–Њ–Ї–Є–љ–∞–Ј–љ–Њ–≥–Њ —В–Є–њ–∞ –Я–Р.
–Ь–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ –њ–Њ–≤—Л—И–∞–µ—В —Б–Є–љ—В–µ–Ј –Љ–∞—В—А–Є—З–љ—Л—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ —Е—А—П—Й–∞, –њ—А–µ–і—Г–њ—А–µ–ґ–і–∞–µ—В –∞–њ–Њ–њ—В–Њ–Ј —Е–Њ–љ–і—А–Њ—Ж–Є—В–Њ–≤ [24].
–Т –њ—А–Њ—Ж–µ—Б—Б–∞—Е –і–µ–≥—А–∞–і–∞—Ж–Є–Є —Е—А—П—Й–∞ –њ—А–Є –Ю–Р –≤–µ–і—Г—Й–∞—П —А–Њ–ї—М –Њ—В–≤–Њ–і–Є—В—Б—П –Ш–Ы–1, –Ї–Њ—В–Њ—А—Л–є —Б–њ–Њ—Б–Њ–±–µ–љ —Б–љ–Є–ґ–∞—В—М –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —В–Ї–∞–љ–µ–≤–Њ–≥–Њ –Є–љ–≥–Є–±–Є—В–Њ—А–∞ –Љ–µ—В–∞–ї–ї–Њ–њ—А–Њ—В–µ–Є–љ–∞–Ј (–Ґ–Ш–Ь–Я). –Ь–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–ї –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Ї–Њ–ї–ї–∞–≥–µ–љ–∞–Ј—Л, –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–є –Ш–Ы–1, –љ–Њ –љ–µ –≤–ї–Є—П–ї –љ–∞ –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Ґ–Ш–Ь–Я –Є –µ–≥–Њ –±–Є–Њ—Б–Є–љ—В–µ–Ј [25].
–Ь–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ –≤ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є—Е –і–Њ–Ј–∞—Е –љ–µ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В —Б–Є–љ—В–µ–Ј –Ш–Ы–1 –≤ –Ї—Г–ї—М—В—Г—А–µ —Е–Њ–љ–і—А–Њ—Ж–Є—В–Њ–≤ –Є –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –Є–љ–≥–Є–±–Є—А—Г—О—Й–µ–≥–Њ –і–µ–є—Б—В–≤–Є—П –љ–∞ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –њ—А–Њ—В–µ–Њ–≥–ї–Є–Ї–∞–љ–Њ–≤ [26–29].
–•–Њ–љ–і—А–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ–∞ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Њ –Є –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е [30]. –Р–≤—В–Њ—А—Л –Є–Ј—Г—З–∞–ї–Є —Б –њ–Њ–Љ–Њ—Й—М—О –Є–љ—Б—В—А—Г–Љ–µ–љ—В–∞–ї—М–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ (–∞—А—В—А–Њ—Б–Ї–Њ–њ–Є–Є, —Б–Њ–љ–Њ–≥—А–∞—Д–Є–Є, –Ь–†–Ґ) —Б–Њ—Б—В–Њ—П–љ–Є–µ —Е—А—П—Й–∞ —Г 80 –±–Њ–ї—М–љ—Л—Е –≥–Њ–љ–∞—А—В—А–Њ–Ј–Њ–Љ, –ї–µ—З–µ–љ–љ—Л—Е –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ–Њ–Љ, —Е–Њ–љ–і—А–Њ–Є—В–Є–љ —Б—Г–ї—М—Д–∞—В–Њ–Љ –Є –≥–ї—О–Ї–Њ–Ј–∞–Љ–Є–љ —Б—Г–ї—М—Д–∞—В–Њ–Љ –≤ —В–µ—З–µ–љ–Є–µ 18 –Љ–µ—Б. –Ъ –Ї–Њ–љ—Ж—Г –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б—Г–ґ–µ–љ–Є–µ —Б—Г—Б—В–∞–≤–љ–Њ–є —Й–µ–ї–Є ≥0,5 –Љ–Љ —Б –Љ–µ–і–Є–∞–ї—М–љ–Њ–Љ –Њ—В–і–µ–ї–µ –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–≥–Њ —Б—Г—Б—В–∞–≤–∞ –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М —Г 5% –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –≥–ї—О–Ї–Њ–Ј–∞–Љ–Є–љ —Б—Г–ї—М—Д–∞—В, –Є —Г 20% –ї–µ—З–µ–љ–љ—Л—Е –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ–Њ–Љ –Є–ї–Є —Е–Њ–љ–і—А–Њ–Є—В–Є–љ —Б—Г–ї—М—Д–∞—В–Њ–Љ. –£ 80% –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ, –љ–µ –Њ—В–Љ–µ—З–µ–љ–Њ —Б—Г–ґ–µ–љ–Є—П —Б—Г—Б—В–∞–≤–љ–Њ–є —Й–µ–ї–Є. –£ –љ–Є—Е –ґ–µ –љ–µ –њ–Њ–ї—Г—З–µ–љ–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є –≤ —В–Њ–ї—Й–Є–љ–µ —Б—Г—Б—В–∞–≤–љ–Њ–≥–Њ —Е—А—П—Й–∞. –Э–∞ –љ–∞—З–∞–ї—М–љ–Њ–є —Б—В–∞–і–Є–Є –Ю–Р –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ –Њ–±–ї–∞–і–∞–ї —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О —В–Њ—А–Љ–Њ–Ј–Є—В—М –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М —Е–Њ–љ–і—А–Њ–њ–∞—В–Є–Є (–њ–Њ –і–∞–љ–љ—Л–Љ –Ь–†–Ґ). –Р–≤—В–Њ—А—Л –і–µ–ї–∞—О—В –Ј–∞–Ї–ї—О—З–µ–љ–Є–µ, —З—В–Њ –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ, –Ї–∞–Ї –Є –≥–ї—О–Ї–Њ–Ј–∞–Љ–Є–љ– –Є —Е–Њ–љ–і—А–Њ–Є—В–Є–љ —Б—Г–ї—М—Д–∞—В, –Њ–±–ї–∞–і–∞–µ—В –љ–µ —В–Њ–ї—М–Ї–Њ —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є–Љ –і–µ–є—Б—В–≤–Є–µ–Љ, –љ–Њ –Є —Б–њ–Њ—Б–Њ–±–µ–љ –Ј–∞–Љ–µ–і–ї—П—В—М –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –Ю–Р –Ї–Њ–ї–µ–љ–љ–Њ–≥–Њ —Б—Г—Б—В–∞–≤–∞.
–Я—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л–µ –ї–Є—В–µ—А–∞—В—Г—А–љ—Л–µ –і–∞–љ–љ—Л–µ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ —В–Њ–Љ, —З—В–Њ –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ –Љ–Њ–ґ–љ–Њ —Б—З–Є—В–∞—В—М –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –≤—Л–±–Њ—А–∞ –і–ї—П –ї–µ—З–µ–љ–Є—П –Ю–Р —Б—А–µ–і–Є –Э–Я–Т–Я.
–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. –§–Њ–ї–Њ–Љ–µ–µ–≤–∞ –Ю.–Ь., –У–∞–ї—Г—И–Ї–Њ –Х.–Р., –≠—А–і–µ—Б –®.–§. –†–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М —А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –≤ –њ–Њ–њ—Г–ї—П—Ж–Є—П—Е –≤–Ј—А–Њ—Б–ї–Њ–≥–Њ –љ–∞—Б–µ–ї–µ–љ–Є—П –†–Њ—Б—Б–Є–Є –Є –°–®–Р. –Э–∞—Г—З–љ–Њ––њ—А–∞–Ї. –†–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є—П, 2008,4,4–13
2. Song I.H., Burmester G.R.,Backhause M. et al. Knee osteoarthritis. Efficacy of a new method of contrast –enhanced musculoskeletal ultrasonography in detection of synovitis in patients with knee osteoarthritis in comparison with magnetic resonance imaging. Ann.rheum.dis.,2008,1(67),19–25
3. Goldring M.B., Berenbaum F. The regulation of chondrocyte function by proinflamatory mediators: prostaglandins and nitric oxide.Clin.Orthop.,2004,37–46
4. Goldring M.B., Otero M., Tsuchimochi K. et al. Defining the roles of inflammatory and anabolic cytokines in cartilage metabolism.Ann.rheum.Dis., 2008,67,suppl.III,75–82
5. Kobayashi M.,Sjurei G.R.,Mousa A. et al. Role of interleukin –1 and tumor necrosis factor alpha in matrix degradation of humor osteoarthritis cartilage.Arth.Rheum.,2005,52,128–35
6. Bondeson J.,Wainwright S.D.,Lauder S. et al. The role of synovial macrophages and macrophage produced cytokines in driving aggrecanases matrix metalloproteinase’s and other destructive and in– flamatory responses in osteoarthritis. Arthritis.Res.Ther.,2006,8,187
7. Jordan K.M.,Arden N.K.,Doherty M. et al. EULAR recommendation 2003: an evidence based approach to the management of knee osteoarthritis : report of a fast force of ESCISIT. Ann.Rheum.Dis.,2003,62,1145–55
8. Zhand W., Doherty M., Arden N. et al. EULAR evidence based recommendations for the management of hip osteoarthritis: report of a fask force of the ESCISIT. Ann.Rheum.Dis.,2005,64,669–81
9. Zhand W., Doherty M., Leeb B.F. et al. EULAR evidence – based recommendations of hand osteoarthritis: a report a task force of the ESCISIT. Ann.Rheum.Dis.,2009,8 ,8–17
10. Biaco F.,Guitian R.,Moreno I. et al. NSaiDs effect on COX–1 and COX–2 activity in human articular chonolrocytes.Arthr.Rheum.,1997,40,88
11. Reginster J.Y.,Pelletier J.P.,Martel–Pellecher J.,Henrotin Y. Osteoarthritis .Clinical and experimental aspects.1999,370–387
12. Wolfe M.,Lichtenstein D.R.,Sinhg G. Gastrointestinal toxicity on non–steroidal anti–inflammatory drugs.N.Engl.J.Med.,1999,24,1888–1899
13. Boutsen Y, Esselinckx W. Novel nonsteroidal anti–inflammatory drugs. Acta Gastroenterol. Belg. ,1999,62(4):421–424
14. –Э–∞—Б–Њ–љ–Њ–≤ –Х.–Ы. –°–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–µ —Г—З–µ–љ–Є–µ –Њ —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Є–љ–≥–Є–±–Є—В–Њ—А–∞—Е –¶–Ю–У–2: –љ–Њ–≤—Л–µ –∞—Б–њ–µ–Ї—В—Л –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ–∞ (–Љ–Њ–≤–∞–ї–Є—Б–∞).–Э–∞—Г—З–љ.––њ—А–∞–Ї—В–Є—З.—А–µ–≤–Љ–∞—В–Њ–ї.,2001,1,58–62
15. Hawkey C.,Kahan A.,Steinbruck K.et al. Gastrointestinal tolerability of meloxicam compared to diclofenac in osteoarthritis patients. International MELISSA Study Group. Meloxicam Large Scale International Study Safety Assessment. Br.J.Rheumatol.,1988,37,937–945
16. –¶–≤–µ—В–Ї–Њ–≤–∞ –Х.–°. –Ь–Њ–≤–∞–ї–Є—Б –≤ —В–µ—А–∞–њ–Є–Є –Њ—Б—В–∞–Њ–∞—А—В—А–Њ–Ј–∞. –Э–∞—Г—З–љ–Њ––њ—А–∞–Ї—В–Є—З. –†–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є,2001,1,67–71
17. Hosie J, Distel M, Bluhmki E.Meloxicam in osteoarthritis: a 6–month, double–blind comparison with diclofenac sodium.Br. J. Rheumatol., 1996;35 (1):39–43
18. Bevis PJ, Bird HA, Lapham G.An open study to assess the safety and tolerability of meloxicam 15 mg in subjects with rheumatic disease and mild renal impairment.Br. J. Rheumatol., 1996 ;35 (1):56–60
19. Girawan D., Abdurachman S.A., Djumhana A. et al. Comparison of endoscopic gastric mucosa features after administration of piroxicam to meloxicam and their correlation with dyspepsia symptoms in elderly patient with knee osteoarthritis. Acta. Med. Indones., 2004,36(4):202–206
20. Singh G.,Gagnier P.,Hwang E et.al. Osteoarthritis patients treated with meloxicam have a higher treatment satisfaction compared with other NSAIDs: results from the IMPROVE trial, a multi–center, randomized parallel–group, open label study of 1309 patients in a managed care setting.Ann.Rheum.Dis.,2002,61,suppl 1,421
21. Books P.M. Potter S.R.,Buchaman W. NSAID and osteoarthritis – help or hindrance? J.Rheumatol.,1982,9,3–5
22. Alvarez–Soria MA, Herrero–Beaumont G, Sanchez–Pernaute O et al. Diacerein has a weak effect on the catabolic pathway of human osteoarthritis synovial fibroblast—comparison to its effects on osteoarthritic chondrocytes. Rheumatology (Oxford), 2008 ,47(5),627–33
23. Chu SC, Yang SF, Lue KH. et al Naproxen, meloxicam and methylprednisolone inhibit urokinase plasminogen activator and inhibitor and gelatinases expression during the early stage of osteoarthritis. Clin Chim Acta., 2008,387(1–2),90–6
24. Ding C. Do NSAIDs affect the progression of osteoarthritis? Inflammation. 2002 Jun;26(3):139–42
25. Sadowski T, Steinmeyer J. Effects of non–steroidal antiinflammatory drugs and dexamethasone on the activity and expression of matrix metalloproteinase–1, matrix metalloproteinase–3 and tissue inhibitor of metalloproteinases–1 by bovine articular chondrocytes. Osteoarthritis Cartilage. 2001 Jul;9(5):407–15
26. Rainsford KD. Profile and mechanisms of gastrointestinal and other side effects of nonsteroidal antiinflammatory drugs (NSAIDs). Am J Med. 1999 Dec 13;107(6A):27S–35S;
27. Rainsford K.D.,Jing C.,Smith F,C.Effects of meloxicam,conepared with other NSAIDs,on cartilage proteoglican metatolism,synovial prostaglanolin E2,and production of interleukin 1,6,8 in human and pocine explants in organ culture.J.Rharm.Pharmacol.,1997,49,991–8
28. Rainsford K.D.,Skerry T.M.,Chindemi P. et al. Effects of the NSAIDs meloxicam and indometacin on cartilage proteoglican syathesis and joint responses to calcium pyrophosphate crystals in dogs. Veterin.Research Comm.,1999,23,101–13
29. Blot L, Marcelis A, Devogelaer JP, Manicourt DH. Effects of diclofenac, aceclofenac and meloxicam on the metabolism of proteoglycans and hyaluronan in osteoarthritic human cartilage. Br J Pharmacol. 2000 Dec;131(7):1413–21
30. –Ш–Њ–љ–Є—З–µ–љ–Њ–Ї –Э.–У.–¶–≤–µ—В–Ї–Њ–≤–∞ –Х.–°., –Ъ–∞—А—Г—Б–Є–љ–Њ–≤ –Я.–°. –Є —Б–Њ–∞–≤—В.–Т–ї–Є—П–љ–Є–µ —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –љ–∞ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –Њ—Б—В–µ–Њ–∞—А—В—А–Њ–Ј–∞ –Ї–Њ–ї–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤.–Э–∞—Г—З–љ–Њ––њ—А–∞–Ї—В–Є—З. –†–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є—П,2005,3,31












