Для цитирования. Имаметдинова Г.Р., Чичасова Н.В. Нестероидные противовоспалительные препараты при лечении заболеваний суставов // РМЖ. 2015. No 25. С. 1491–1495.
Заболевания опорно-двигательного аппарата являются одной из самых частых причин обращения пациентов к врачу. Широкая распространенность в популяции, многолетнее персистирование боли и воспаления, неуклонное прогрессирование, быстрое развитие инвалидизации, ухудшение качества жизни, уменьшение ее продолжительности, а также значительный экономический ущерб для больных и общества определяют не только клиническую, но и социальную значимость хронических заболеваний опорно-двигательного аппарата [1–3].Основными симптомами заболеваний опорно-двигательного аппарата являются боль и воспаление. В большинстве случаев боль в различных структурах опорно-двигательного аппарата носит хронический характер, а наиболее частая причина ее развития – хроническое воспаление в синовиальной оболочке. Длительное персистирование боли и воспаления неизменно приводит к деструкции суставов и утрате функции опорно-двигательного аппарата. Лечение хронической боли и воспаления является сложной задачей, требует проведения многолетней комплексной противовоспалительной терапии, одним из компонентов которой являются нестероидные противовоспалительные препараты (НПВП).
НПВП относятся к числу наиболее широко применяемых в клинической практике лекарственных препаратов [4]. Их использует примерно каждый 4-й человек на планете, каждый 3-й – в возрасте старше 60 лет [5]. Хорошо известно, что основным механизмом действия НПВП является подавление активности циклооксигеназы (ЦОГ) [6]. При этом большинство положительных эффектов НПВП (подавление воспаления, боли, лихорадки) связаны с подавлением активности ЦОГ-2, а побочных реакций – с подавлением активности ЦОГ-1 [7–9]. По механизму действия НПВП разделяют на неселективно подавляющие активность ЦОГ-1 и ЦОГ-2 (н–НПВП) и селективно подавляющие активность ЦОГ-2 (с–НПВП). С-НПВП эффективны в лечении боли и воспаления при более низкой частоте развития побочных реакций по сравнению с н-НПВП.
Подавление ЦОГ-1 обусловливает широкий спектр побочных реакций н-НПВП. Наиболее частым является поражение желудочно-кишечного тракта (ЖКТ) (НПВП-гастропатия) [10, 11], что нередко становится основанием для прерывания лечения. Следует подчеркнуть отсутствие связи между субъективными побочными эффектами и эндоскопически выявляемыми язвами и тяжелыми ЖКТ-осложнениями. Так, в 58–80% случаев язвы на фоне анальгетического эффекта НПВП бессимптомны [12]. Однако клиницисты должны четко выделять факторы риска развития тяжелых осложнений со стороны ЖКТ – язвенного кровотечения и сердечно-сосудистой системы (ССС): инфаркта миокарда, инсульта.
В 2015 г. опубликованы новые клинические рекомендации «Рациональное применение нестероидных противовоспалительных препаратов в клинической практике», подготовленные Ассоциацией ревматологов России, Российским обществом по изучению боли, Российской гастроэнтерологической ассоциацией, Российским кардиологическим обществом, Ассоциацией травматологов-ортопедов России [13]. Совместное обсуждение на экспертном совете выработало единый подход к выделению факторов риска нежелательных явлений со стороны ЖКТ и ССС. Основные положения, представленные в рекомендациях, включают: структурированный подход к назначению НПВП, стратификацию сердечно-сосудистых факторов риска, алгоритм назначения НПВП.
Алгоритм назначения НПВП в соответствии с рекомендациями представлен в таблице 1. Согласно этим рекомендациям, с-НПВП показаны при умеренном риске кардиоваскулярных осложнений и умеренном и высоком риске ЖКТ-осложнений.

Известно, что н-НПВП отрицательно влияют на хрящ и утяжеляют течение артроза, оказывают негативное влияние на функцию печени и почек, а у больных, имеющих сопутствующие заболевания бронхов, могут вызывать бронхоспазм, усугублять течение бронхиальной астмы.
В последние годы появляются все новые данные о частоте сопутствующей патологии у пациентов с заболеваниями опорно-двигательного аппарата. Необходимость в противовоспалительной терапии, подчас длительной, чаще возникает у лиц пожилого возраста, как правило, имеющих коморбидные состояния и сопутствующую им терапию. По мнению многих авторов [14–17], наиболее частыми коморбидными состояниями являются артериальная гипертензия (АГ), ишемическая болезнь сердца (ИБС), сахарный диабет, патология ЖКТ. С одной стороны, это факторы риска непереносимости НПВП, а с другой стороны, прием НПВП усугубляет течение АГ, застойной сердечной недостаточности, уменьшает эффективность антигипертензивной терапии [18–22].
Таким образом, препарат для лечения хронической боли и воспаления должен обладать не только высокой эффективностью, но и хорошим профилем безопасности. В этом плане интерес представляет селективный ингибитор ЦОГ-2 нимесулид, который уже около 30 лет с успехом используют врачи разных специальностей. По своему анальгетическому, противовоспалительному и жаропонижающему действию нимесулид не уступает н-НПВП, а по некоторым данным, даже несколько их превосходит [23].
Результаты целого ряда исследований in vitro и ex vivo свидетельствуют, что нимесулид более селективно ингибирует ЦОГ-2, чем ЦОГ-1 [24–28] (рис. 1).
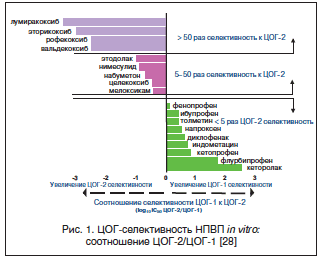
В терапевтических концентрациях нимесулид ингибирует 88% активности ЦОГ-2 и 45% активности ЦОГ-1 [29]. При этом если воздействие на ЦОГ-1 прекращается по истечении 24 ч, то воздействие на ЦОГ-2 продолжается намного дольше [30], и это различие сохраняется при длительном применении [31]. Этот своеобразный механизм действия объясняет низкое число осложнений со стороны ЖКТ. Весьма интересным является тот факт, что низкую частоту поражения ЖКТ на фоне лечения нимесулидом связывают не только с ЦОГ-2 селективностью препарата, но и с антигистаминным действием, приводящим к снижению секреции соляной кислоты в желудке [32]. Также установлено, что нимесулид обладает способностью ингибировать интерлейкин-1β (IL–1β) в культуре синовиальных фибробластов [33]. Имеются данные о том, что наряду с ингибицией ЦОГ нимесулид обладает целым рядом ЦОГ-независимых механизмов, среди которых особенно важное значение имеет его способность ингибировать апоптоз хондроцитов [34]. Кроме того, препарат и его метаболиты проявляют непосредственно антиоксидантную активность в отношении различных свободных радикалов [35]. Нимесулид снижает дегрануляцию протеогликанов, угнетает активность эластазы, коллагеназы, стромелизина, подавляет гиперальгезию, индуцированную брадикинином и фактором некроза опухоли-α (ФНО-α) [25, 27, 36]. Препарат способен подавлять активность провоспалительных цитокинов: интерлейкина-6, ФНО-α, металлопротеиназ, фермента фосфодиэстеразы IV, активирующего макрофагальную и нейтрофильную активность [25, 37, 38].
Короткий период полувыведения (1,8–4,7 ч), быстрое достижение максимальной концентрации в плазме крови и синовиальной жидкости обусловливает высокую скорость наступления анальгетического эффекта и уменьшение частоты побочных эффектов нимесулида. При пероральном приеме препарат быстро и практически полностью абсорбируется независимо от приема пищи. Благодаря своим биохимическим свойствам нимесулид легко попадает в очаг воспаления. Концентрация свободного нимесулида непосредственно в очаге воспаления (особенно в ткани сустава), где рН среды более низкий, может быть намного выше его плазменной концентрации [39, 40].
Результаты исследований, проведенных отечественными и зарубежными авторами, подтверждают высокую эффективность нимесулида при лечении острой [41, 42] и хронической боли. Так, показано, что эффективность нимесулида была сопоставима с эффективностью диклофенака [43] и напроксена [44] у больных остеоартрозом (ОА) и ревматоидным артритом (РА) [44, 45].
Оценке безопасности нимесулида посвящен целый ряд краткосрочных и пролонгированных исследований. По данным мировой литературы, частота побочных явлений при лечении нимесулидом колеблется в пределах 6,8–36% с четкой зависимостью от дозы и длительности приема препарата. В частности, при анализе результатов нескольких клинических исследований, включавших 22 938 больных ОА, пролеченных нимесулидом в дозе 100–400 мг в течение 5–21 сут (в среднем 12 сут), общая частота побочных реакций составила 8,2% [47]. По данным другого многоцентрового исследования, в котором участвовали 12 607 пациентов с различными ревматическими и ортопедическими заболеваниями, на фоне лечения нимесулидом 400–200 мг/сут в течение 21 сут частота развития побочных эффектов составила 6,8% [48]. Как свидетельствуют результаты многочисленных исследований, проведенных отечественными и зарубежными авторами, нимесулид характеризуется хорошей переносимостью в отношении ЖКТ. Так, Kriegel W. et al. проводили сравнительное исследование 370 больных ОА, получавших нимесулид 200 мг/сут и напроксен 750 мг/сут в течение 12 мес. Эффективность обоих препаратов оказалась сопоставимой, а общее число лекарственных осложнений при использовании нимесулида в сравнении с напроксеном оказалось ниже: 47,5 и 54,5% соответственно [44].
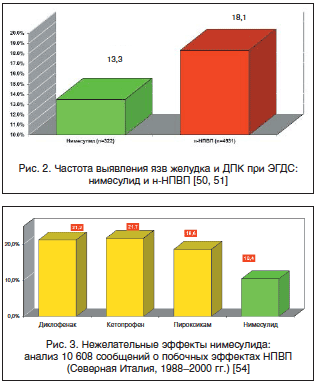
Особого внимания заслуживают исследования, проводящиеся в условиях реальной клинической практики. Bradbury F. представил данные о частоте ЖКТ-осложнений при использовании диклофенака, нимесулида и ибупрофена. Суммарная частота поражения ЖКТ при использовании нимесулида была достоверно ниже по сравнению с таковой диклофенака (12,1%) и не отличалась от таковой ибупрофена – 8,1% и 8,6% соответственно [49]. Отечественными авторами была проведена оценка безопасности применения нимесулида в реальной клинической практике у 322 больных ревматическими заболеваниями, получавших нимесулид в суточной дозе 200 мг длительные сроки (12 мес.). Ни у кого из этих больных не было серьезных осложнений со стороны ЖКТ – кровотечения или перфорации язвы. Язвы желудка и двенадцатиперстной кишки (ДПК) были обнаружены у 13,3% больных [50]. Данные, полученные в ходе ранее проведенного эндоскопического исследования 4931 больных, получавших н-НПВП, продемонстрировали более высокую частоту развития язв верхних отделов ЖКТ – 18,1% больных [51] (рис. 2). Следует обратить внимание на данные популяционного исследования, в котором проводилась оценка риска развития ЖКТ-кровотечения на фоне приема различных НПВП. Было показано, что относительный риск развития кровотечения для нимесулида составил 3,2, для диклофенака – 3,7, мелоксикама – 5,7 [52]. Результаты эндоскопического исследования, проведенного А.Е. Каратеевым, продемонстрировали, что при использовании нимесулида поражение верхних отделов ЖКТ возникало значительно реже, чем при применении диклофенака, кетопрофена, индометацина – суммарное число язв желудка и ДПК составило 4,4% и 14,6% соответственно [53]. При анализе 10 608 спонтанных сообщений о серьезных побочных эффектах НПВП за период 1988–2000 гг., проведенном итальянскими учеными [54], оказалось, что частота побочных реакций со стороны ЖКТ на фоне приема нимесулида была в 2 раза ниже, чем на фоне препаратов сравнения (рис. 3).
Большой интерес представляют исследования безопасности применения нимесулида в высокой суточной дозе. Так, применение нимесулида в суточной дозе 400 мг у больных РА продемонстрировало не только высокую эффективность, но и хорошую переносимость препарата [55]. Позднее отечественными авторами было проведено многоцентровое исследование эффективности и безопасности нимесулида в суточных дозах 200 и 400 мг в сравнении с диклофенаком 100 и 200 мг/сут в течение 4-х нед. с ЭГДС-контролем при раннем РА. Результаты исследования продемонстрировали, что эффективность нимесулида была несколько выше, чем диклофенака, а развитие язв и множественных эрозий желудка или ДПК на фоне приема нимесулида было достоверно ниже, чем у больных, принимавших диклофенак, – 1,3% и 5,9% соответственно [45]. Совсем недавно были опубликованы результаты популяционного исследования, проведенного итальянскими учеными. Оценивался риск развития НПВП-ассоциированных осложнений со стороны ЖКТ у 588 827 пациентов при 3 623 341 назначений различных НПВП за период с 2001 по 2008 г. Следует особо подчеркнуть, что низкий риск развития серьезных ЖКТ-осложнений на фоне приема нимесулида был сопоставим с таковым у целекоксиба [56].
Аспекты кардиоваскулярной безопасности с-НПВП широко обсуждаются в мировой литературе. По результатам анализа, проведенного А. Helin-Salmivaara еt al., значение относительного риска инфаркта миокарда для нимесулида составило 1,69, что не превышало суммарного риска для всего класса [57]. По данным отечественных авторов, из 322 больных РА инфаркт миокарда был зафиксирован у 1 мужчины 68 лет с длительным анамнезом ИБС и АГ. Стойкое повышение АД отмечено у 11,5% больных, у 2 больных с наличием высокой степени риска АГ в анамнезе была выявлена отрицательная динамика на ЭКГ [50]. Следует отметить, что в исследованиях, проведенных зарубежными авторами (результаты которых упоминались выше), значимого повышения частоты кардиоваскулярных осложнений на фоне приема нимесулида не отмечалось [43, 44].
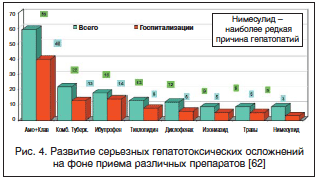
Вопросы гепатотоксичности нимесулида многократно обсуждались медицинской общественностью на протяжении нескольких последних лет. Анализ литературных данных свидетельствует о том, что гепатотоксичность нимесулида не выше, чем у других НПВП [58]. При кратковременном использовании нимесулида (не более 30 дней) повышение АЛТ и АСТ в 2 и более раз отмечается лишь у 0,4% больных, а при длительном (более 6 мес.) – частота подобных изменений не превышает 1,5% [59, 60]. У 322 больных, получавших нимесулид в течение 12 мес., не было выявлено ни одного случая развития клинических симптомов поражения печени (желтухи, гепатомегалии, симптомов печеночной недостаточности). Повышение уровня печеночных трансаминаз (АСТ, АЛТ) более чем в 2 раза было зарегистрировано в 7 случаях (2,2%) у больных РА, получавших еще и метотрексат и лефлуномид [50]. В самом крупном популяционном исследовании гепатотоксичности нимесулида [61] представлен анализ частоты лекарственного поражения печени у 397 537 пациентов, получавших различные НПВП за период 1997–2001 гг. Было показано, что нимесулид вызывал гепатопатии в 35,5 случая на 100 тыс. пациентов, что значительно реже, чем диклофенак – 39,2 и ибупрофен – 44,6. По данным испанских исследователей [62], за 10-летний период применения нимесулида серьезные гепатотоксические осложнения развивались крайне редко (рис. 4). Интересны результаты, полученные отечественными авторами в ходе изучения влияния нимесулида на функцию печени при лечении подагрического артрита. Как известно, пациенты с подагрой зачастую имеют метаболические нарушения и высокую частоту злоупотребления алкоголем, что повышает риск развития побочных реакций со стороны печени. Однако на фоне использования нимесулида в дозах до 400 мг/сут отсутствовала отрицательная динамика биохимических показателей крови, свидетельствующих о поражении печеночных клеток или холестазе [63].
Результаты метаанализа за 10-летний период (с 1988 по 1997 г.) продемонстрировали, что на 100 тыс. пациентов, принимавших нимесулид, отмечено только 11 случаев возможной связи почечных осложнений с приемом препарата, из которых только в 4-х проводилась монотерапия нимесулидом [64].
Установлено, что нимесулид крайне редко вызывает усиление бронхоспазма у больных, страдающих бронхиальной астмой и гиперчувствительностью к ацетилсалициловой кислоте или другим НПВП, поскольку не обладает перекрестной реактивностью с ацетилсалициловой кислотой и н-НПВП в отношении индукции обострения астмы и является одним из препаратов выбора (среди с-НПВП) у этих больных [25, 65].
Как уже упоминалось, экспериментальные данные продемонстрировали отсутствие у нимесулида отрицательного действия на хрящ [33, 34]. Несколько позже W. Kullch et al. в пилотном клиническом исследовании отметили положительное влияние нимесулида на течение ОА тазобедренных и коленных суставов [66].
Результаты научных исследований и большой клинический опыт применения нимесулида свидетельствуют о его высокой анальгетической и противовоспалительной активности и хорошей переносимости. Все вышесказанное послужило основанием для появления целого ряда дженериков этого препарата. Недавно в России появился новый дженерик нимесулида – Немулекс® в виде гранул для приготовления суспензии. Такая лекарственная форма препарата обеспечивает более быстрое наступление клинического эффекта по сравнению с таблетированной формой. Отличительной особенностью Немулекса является отсутствие в его составе высококалорийного полисахарида мальтодекстрина, что позволяет назначать препарат пациентам с СД, избыточной массой тела, нарушением обмена веществ.
К настоящему времени уже имеются данные о результатах открытых проспективных краткосрочных (10–15 дней) клинических исследований препарата в суточной дозе 200 мг в ревматологической и неврологической практике [67–69].
Так, положительный эффект препарата Немулекс® в отношении основных клинических проявлений анкилозирующего спондилита у 30 больных продемонстрирован в исследовании НАУТИЛУС. По данным авторов, клинически значимого улучшения достигли 60% пациентов, при этом выраженность боли в спине уменьшилась в 2 раза. Побочные реакции включали повышение АСТ, АЛТ у 10% пациентов (купировались в течение 1 нед. на фоне диеты и назначения гепатопротекторов) и диспетические проявления у 10% пациентов (без наличия эрозивных изменений ЖКТ при проведении ЭГДС-контроля) [67].
Еще одно исследование было посвящено оценке эффективности и безопасности препарата Немулекс® в сравнении с диклофенаком, индометацином у 30 больных ОА. По данным авторов, эффективность всех препаратов была сопоставимой и не различалась статистически. Однако при использовании Немулекса анальгетический эффект развивался примерно на 2 дня раньше, чем у препаратов сравнения. Побочные эффекты на фоне приема Немулекса отмечались у 4 пациентов (13% случаев). У 3 больных имели место диспептические расстройства, у 1 – подъем АД. Побочные реакции были слабо выражены и не требовали отмены препарата [68].
По данным Д.И. Лахина, у 30 больных ОА через 15 дней лечения отмечены исчезновение признаков синовита, достоверное уменьшение боли (с 69,3±0,74 до 21±0,29), а также улучшение функции суставов у всех пациентов. Среди побочных реакций фигурировали только признаки гастропатии у 2 (6,7%) пациентов (при наличии в анамнезе язвенной болезни желудка). По мнению подавляющего большинства пациентов (23 человека – 76,6%), переносимость лечения была хорошей, у 7 (23,3%) – удовлетворительной [69].
В амбулаторных условиях проведено исследование, включавшее 49 пациентов с дорсопатией. Все пациенты получали комплексное лечение, включающее Немулекс® и Хондрогард. Через 15 дней большинство пациентов (29 человек – 59,5%) отметили исчезновение болей в спине. 2 пациента (4%) отметили появление дискомфорта в эпигастрии, что привело к самостоятельной отмене препарата. При этом, по данным автора, контрольная ЭГДС патологических изменений не выявила [72].
Таким образом, результаты исследований показали, что Немулекс® обладает отчетливым анальгетическим и противовоспалительным свойствами в сочетании с хорошей переносимостью. Тем не менее, учитывая короткие сроки и небольшое количество исследований, целесообразно изучить эффективность и безопасность препарата в более длительные сроки на различных когортах пациентов.












