Именно поэтому проблема эффективного контроля боли находится в центре внимания практикующих врачей, исследователей и организаторов медицины. Особое значение вопросы рациональной анальгезии имеют при ведении пациентов с заболеваниями опорно-двигательного аппарата, такими как остеоартроз (ОА), боль в нижней части спины (БНЧС), ревматоидный артрит (РА) и др., поскольку боль в суставах и позвоночнике является их основным проявлением [1–3].
По своей природе боль неспецифична, и хотя причины ее появления могут быть разными, она развивается в соответствии с общими патогенетическим закономерностями. Так, этиология боли в плече, связанной с поражением мышц так называемой «вращающей манжетки» плечевого сустава, боли при ОА и БНЧС различна. Но основные элементы патогенеза боли остаются общими – это локальное воспаление, болезненное напряжение мышц, повреждение соединительнотканных структур, нарушение биомеханики, дисфункция ноцицептивной системы («центральная сенситизация»). Поэтому и подходы к лечению боли также будут общими, с использованием единых фармакологических и нефармакологических средств [2, 3].
В любом случае лечение боли должно быть комплексным, с учетом различных элементов ее развития, каждый из которых может (и должен) стать мишенью для терапевтического воздействия. Местное воспаление контролируется с помощью противовоспалительных средств – нестероидных противовоспалительных препаратов (НПВП), локального введения глюкокортикоидов, в определенной степени – при использовании так называемых хондропротекторов (хондроитина сульфат, глюкозамин, диацереин и неомыляемые соединения авокадо и сои), поскольку последние, по современным представлениям, обладают собственным противовоспалительным потенциалом. Основным инструментом снижения болезненного напряжения мышц являются миорелаксанты. Особое внимание следует уделить коррекции биомеханических нарушений – контролю веса и использованию различных ортопедических изделий. Наличие признаков дисфункции ноцицептивной системы – показание для назначения антиконвульсантов и определенных антидепрессантов, используемых для лечения нейропатической боли [2–5].
К средствам первой линии при проведении анальгетической терапии относятся НПВП: их применение оправданно (как было указано выше) значительной ролью воспаления в развитии острой и хронической боли. Следует отметить, что использование НПВП в России имеет свою специфику. Как известно, основные анальгетики – это парацетамол, НПВП и опиоиды. Первый из них, так называемый простой анальгетик, обладает умеренным анальгетическим потенциалом и не имеет значимого противовоспалительного действия, поэтому назначается в основном при умеренно выраженной боли. Он рекомендуется как препарат выбора для обезболивания при многих болезнях (в частности, при ОА), но не из-за своей эффективности, а благодаря хорошей переносимости и относительной безопасности. Но по своему анальгетическому действию парацетамол отчетливо уступает НПВП; при этом короткий период выведения препарата требует его назначения 3–4 р./сут, что достаточно неудобно при продолжительном лечении. Поэтому российские врачи относительно редко применяют парацетамол при ОА и БНЧС – нозологических формах, которые являются главной причиной развития хронической боли в современной популяции [2].
Доказательством преимущества НПВП перед парацетамолом стали результаты российского исследования ДИНАМО. В ходе этой работы в течение 1 года проводилось сравнение эффективности нимесулида в дозе 100–200 мг/сут и парацетамола 3 г/сут у больных ОА. Нимесулид оказался существенно эффективнее: можно сказать, что 1 таблетка этого препарата (а многие больные испытывали облегчение после приема 100 мг нимесулида в течение 1 сут) оказывала лучшее действие, чем 6 таблеток парацетамола [6].
Традиционно наиболее сильным средством для купирования выраженной боли считаются опиоиды. Во многих странах мира они широко используются для контроля хронической неонкологической боли. Однако в нашей стране из-за жестких ограничений на выписку опиоидов амбулаторное назначение препаратов этого ряда (даже относительно «мягкого» трамадола или его комбинации с парацетамолом) при ОА и БНЧС крайне затруднено. Поэтому в настоящее время в России единственным классом анальгетиков, приемлемым с точки зрения эффективности и доступности для врачей терапевтических специальностей, оказались именно НПВП.
Несмотря на обилие НПВП на российском фармакологическом рынке (а сегодня мы имеем в своем распоряжении 18 различных препаратов), ни один из представителей этой лекарственной группы не может считаться идеальным по своим фармакологическим свойствам. Тем не менее, оценивая динамику использования НПВП, можно указать на определенных лидеров. Одним из таких препаратов в нашей стране, несомненно, является нимесулид. Масштаб его применения в России можно оценить по объему продаж: с 2006 по 2010 г. реализация нимесулида выросла с 7 млн до 18 млн упаковок в год. На сегодняшний день этот препарат по уровню использования обгоняют лишь диклофенак, который представлен в нашей стране почти сотней дженериков, и безрецептурный анальгетик ибупрофен [7].
Причины его популярности в нашей стране не раз обсуждались российскими и зарубежными экспертами. Эта тема особенно интересна в свете серьезных ограничений на использование нимесулида, которые приняты в нескольких государствах из-за вызывающей серьезные сомнения (по крайней мере, у автора настоящего обзора) «высокой» гепатотоксичности этого препарата [8].
Собственно, причина успеха нимесулида очевидна – это яркий представитель своего класса, преимущества которого отмечены многими экспертами [9, 10]. Здесь будет уместно привести характеристику этого препарата, данную в 2006 г. британским профессором К. Рейнсфордом (K.D. Rainsford): «Нимесулид является НПВП, оказывающим обезболивающее, противовоспалительное и жаропонижающее действие благодаря уникальным химическим и фармакокинетическим свойствам и обладающим многофакторным механизмом действия, который выходит за пределы его селективной ингибиторной активности в отношении фермента ЦОГ-2» [11].
Нимесулид очень удобен в качестве ургентного обезболивающего средства, поскольку его высокая биодоступность обеспечивает весьма быстрый клинический эффект. Уже через 30 мин после перорального приема достигается значимая концентрация препарата в крови, составляющая не менее 25% от максимальной, а полный обезболивающий и противовоспалительный эффект развивается через 1–3 ч [11–13].
Лечебное действие всех НПВП связано с блокадой циклооксигеназы (ЦОГ) -2, а характерные для них осложнения со стороны ЖКТ в основном определяются снижением активности ЦОГ-1 в слизистой оболочке ЖКТ. Но ЦОГ-1 также принимает участие в развитии воспаления, и поэтому локальное снижение ее активности в области повреждения следует рассматривать как положительный фактор. Таким действием обладает нимесулид, который лишь в небольшой степени влияет на «структурную» ЦОГ–1 слизистой желудка, но существенно снижает эффекты этого фермента в области воспаления [11–13].
Анальгетическое действие НПВП определяется не только периферическим, но и центральным действием вследствие их способности проникать в ткань ЦНС и влиять на элементы патогенеза хронической боли, связанной с активацией центральных ноцицептивных структур (феномен «взвинчивания», «центральной сенситизации») [14–17]. Наличие у нимесулида «центральных эффектов» подтверждают данные экспериментальных исследований, таких как работа M. Bianchi et al. Эти ученые исследовали концентрацию простагландина (ПГ) Е2 и фактора некроза опухоли-α (ФНО-α) в ликворе крыс после периферической болевой стимуляции. Концентрация обеих субстанций при развитии боли резко возрастала: ПГЕ2 с 30 до 180 пг/мл и ФНО-α с 12 до 40 пг/мл. Однако если до появления боли животному вводился нимесулид или парацетамол, концентрация ПГЕ2 не повышалась в сравнении с контролем; аналогичный эффект, правда, несколько менее выраженный, давал трамадол. В отношении ФНО-α ситуация была иной: до уровня контроля концентрацию этого вещества снижали лишь нимесулид или комбинации парацетамола с трамадолом, но ни парацетамол, ни трамадол по отдельности такого действия не производили [18].
Как было отмечено К. Рейнсфордом, нимесулид обладает рядом фармакологических эффектов, не зависимых от блокады ЦОГ-2. В частности, он подавляет гиперпродукцию главных провоспалительных цитокинов (интерлейкин-6, ФНО-α), снижает активность металлопротеиназ, ответственных за разрушение гликопротеинового комплекса хрящевой ткани при ОА, имеет антигистаминный эффект. Среди этих свойств следует особо отметить способность подавлять фермент фосфодиэстеразу-4 и тем самым снижать активность макрофагов и нейтрофилов, играющих принципиальную роль в патогенезе острой воспалительной реакции [11, 12].
Терапевтический потенциал нимесулида подтверждается серией клинических испытаний. Так, имеются данные о его использовании при послеоперационном обезболивании. Например, в работе A. Binning et al. 94 пациентам, перенесшим артроскопическую операцию, в качестве анальгетика на 3 дня назначались нимесулид 200 мг, напроксен 1000 мг или плацебо. Согласно результатам исследования, оба НПВП демонстрировали превосходство над плацебо. Но нимесулид, в сравнении с препаратом контроля, обеспечивал более высокий обезболивающий эффект в первые 6 ч после операции [19].
Нимесулид отлично действует при остром воспалении околосуставных мягких тканей: энтезитах, бурситах и тендинитах. В этой ситуации он не уступает (или даже оказывается сильнее) «традиционным» НПВП. Так, W. Wober et al. провели исследование, в ходе которого 122 пациента с субакромиальным бурситом и тендинитом в течение 2 нед. принимали нимесулид 200 мг/сут или диклофенак 150 мг/сут. При этом «хороший» или «отличный» ответ на лечение несколько чаще отмечался у лиц, принимавших нимесулид, – 82,3%, в сравнении с 78% в группе диклофенака. Субъективная оценка переносимости использованных лекарств демонстрировала еще более значимое преимущество нимесулида: 96,8% больных оценили его переносимость как «хорошую» или «отличную», в то время как аналогичную оценку диклофенаку дали лишь 72,9% (р<0,05) [20].
Нимесулид эффективен при лечении острой БНЧС. По результатам клинического испытания, проведенного T. Pohjolainen et al. (n=102), нимесулид 100 мг 2 р./сут превосходил ибупрофен в дозе 600 мг 3 р./сут как по выраженности обезболивающего эффекта, так и по восстановлению функции позвоночника. К 10-му дню терапии использование нимесулида обеспечило улучшение функциональной активности более чем в 2 раза. Среди больных, получавших нимесулид, индекс Освестри снизился в среднем с 38 до 15 баллов (-23), что достоверно отличалось от данных относительно ибупрофена – с 35 до 20 (-15), р=0,02. При этом в сравнении с препаратом контроля нимесулид почти в 2 раза реже (7 и 13% соответственно) вызывал побочные эффекты со стороны ЖКТ [21].
Успешным было применение нимесулида при БНЧС и в работе L. Konstantinovic et al. Авторы изучали действие лазеротерапии у 546 больных с люмбоишиалгией, которые в качестве базового лечения получали нимесулид в дозе 200 мг/сут. В соответствии с планом работы пациенты получали нимесулид + настоящую лазеротерапию, или только нимесулид, или сочетание этого препарата и ложной лазеротерапии. Согласно полученным данным, в 1-й группе эффект был максимальным – уровень обезболивания достоверно превосходил результаты, полученные в 2-х контрольных группах. Тем не менее весьма интересно отметить тот факт, что нимесулид сам по себе и в комбинации с плацебо лазера существенно облегчал не только «механическую» боль в спине, но и радикулярную (невропатическую) боль. В среднем интенсивность боли уменьшилась в каждой из групп на 44, 18 и 22 мм (по визуально-аналоговой шкале). Переносимость лечения была очень хорошей, и прием нимесулида не сопровождался серьезными нежелательными реакциями [22].
Нимесулид показал себя весьма удачным средством для длительного контроля основных симптомов при ревматических заболеваниях (РЗ), таких как ОА. Так, P. Locker et al. провели сравнение нимесулида 200 мг или этодолака 600 мг у 199 больных ОА в ходе 3-месячного исследования. Эффективность нимесулида 80% больных оценили как «хорошую» или «превосходную», аналогичную оценку этодолаку дали лишь 68% [23].
E. Huskisson et al. сравнили нимесулид 200 мг/сут с диклофенаком 150 мг/сут у 279 больных ОА в течение полугода. Эффективность изучаемых препаратов, которая оценивалась по динамике самочувствия пациентов и функциональному индексу Лекена, была практически одинаковой. Однако переносимость нимесулида была значительно лучше: ЖКТ-осложнения были отмечены у 36% больных, получавших этот препарат, и у 47% – принимавших диклофенак (p<0,05) [24].
W. Kriegel et al. провели масштабное (n=370) 12-месячное исследование нимесулида при ОА, где препаратом сравнения был напроксен в дозе 750 мг/сут. Результаты этой работы оказались близки к данным, которые получили E. Huskisson et al. Эффективность обоих препаратов оказалась сопоставимой, хотя нимесулид показал некоторое преимущество: динамика суммарного индекса WOMAC к моменту окончания исследования была 22,5 и 19,9% соответственно. В сравнении с напроксеном частота осложнений на фоне приема нимесулида была ниже – 54,5 и 47,5% соответственно [25]. Нужно отметить, что в приведенных выше работах при использовании нимесулида не было отмечено серьезных осложнений со стороны ССС.
Одним из главных достоинств нимесулида является хорошая переносимость со стороны пищеварительной системы. Это показывают, в частности, данные F. Bradbury, который оценил переносимость нимесулида (n=3807), диклофенака (n=3553) и ибупрофена (n=1470) в реальной клинической практике. Общая частота ЖКТ-осложнений на фоне приема нимесулида (8,1%) оказалась ниже в сравнении с таковой при приеме диклофенака (12,1%), правда, не отличалась от таковой на фоне применения ибупрофена – 8,6% [26].
Преимущество нимесулида было также показано в работе итальянских эпидемиологов A. Conforti et al., которые провели анализ 10 608 спонтанных сообщений о серьезных побочных эффектах (1988–2000 гг.), связанных с приемом различных НПВП. Нимесулид становился причиной развития тех или иных осложнений со стороны ЖКТ в 2 раза реже, чем другие НПВП. Число спонтанных сообщений о проблемах, связанных с этим препаратом, составило лишь 10,4% от их общего числа. При этом доля сообщений об осложнениях при использовании диклофенака составила 21,2%, кетопрофена – 21,7%, пироксикама – 18,6% случаев [27].
Еще одним недавним исследованием, подтверждающим хорошую переносимость нимесулида, стала работа M. Shrivastava et al. Они провели анализ 2639 сообщений о нежелательных реакциях при использовании различных лекарств, полученных органами здравоохранения Центральной Индии в 2005–2009 гг., 336 сообщений (12,7%) были связаны с НПВП. Причем нимесулид упоминался значительно реже, чем другие препараты; жалобы на это лекарство были в 6,25% случаев, в то время как на ибупрофен – в 51,9%, на диклофенак – в 27,1%, на парацетамол – в 6,55% [28].
J. Laporte et al. провели масштабное популяционное исследование, в котором оценивалась опасность развития ЖКТ-кровотечения на фоне приема различных НПВП. Данные были получены при анализе причин 2813 эпизодов этого осложнения и 7193 пациентов в качестве контроля. Нимесулид оказался более безопасен, чем многие другие популярные в Европе НПВП: риск кровотечения (по показателю отношения шансов (ОШ)) для нимесулида составил 3,2, для диклофенака – 3,7, для мелоксикама – 5,7, для рофекоксиба – 7,2 [29].
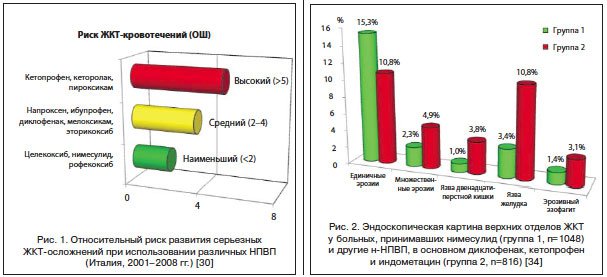
В 2013 г. были опубликованы результаты популяционного исследования J. Castellsague et al. в одной из областей Италии (2001–2008 гг.), которые оценили риск развития НПВП-ассоциированных осложнений со стороны ЖКТ. Анализируемую группу составили 588 827 пациентов, получавших различные НПВП; был отмечен 3031 эпизод серьезных ЖКТ-осложнений. Суммарно НПВП значимо повышали риск развития патологии ЖКТ: ОШ – 3,28. Однако индивидуальные значения этого риска существенно различались. Нимесулид, как и селективные ЦОГ-2 ингибиторы целекоксиб и рофекоксиб, демонстрировал наименьший риск (рис. 1) [30].
Риск осложнений со стороны ССС при использовании нимесулида, по всей видимости, определялся лишь в одной крупной работе. В ходе масштабного популяционного исследования, проведенного в Финляндии, было проанализировано 33 309 эпизодов инфаркта миокарда, при этом контроль составили 138 949 лиц, соответствующих по полу и возрасту. Согласно полученным результатам, ОШ инфаркта для нимесулида составил 1,69. Это значение было близким соответствующему показателю, определенному для мелоксикама, набуметона, этодолака и других НПВП [31].
В нашей стране изучение достоинств и недостатков нимесулида проводится на протяжении более чем 15 лет. За период с 1995 по 2009 г. в России было проведено 21 испытание, в которых нимесулид назначался в дозе от 200 до 400 мг/сут на срок от 7 дней до 12 мес. (всего 1590 больных). Этот препарат использовался у больных ОА, РА, БНЧС, после острых травм, стоматологических операций и в комплексном лечении урологических заболеваний. В группах контроля пациенты получали другие НПВП, парацетамол, трамадол и гомеопатический препарат артрофоон (n=526) [32].
Согласно данным анализа, нимесулид суммарно не уступал или превосходил по эффективности препараты сравнения. Число больных, у которых отмечалось значимое улучшение, составляло от 40 до 90%. В отношении развития побочных эффектов нимесулид также показал себя очень неплохо. Так, число больных с диспепсией при использовании нимесулида составило 9,1%, препаратов сравнения – 10,8%; язвы ЖКТ развились у 1,6 и 10,6% (p<0,001); повышение АД отмечалось у 1,6 и 5,5% (p<0,001); повышение уровня печеночных ферментов – у 0,9 и 2,5% (p<0,05); потребовалась отмена у 1,4 и 2,5% (p<0,05). У единичных больных наблюдались отеки и кожные аллергические реакции [32].
Несколько лет назад был проведен ретроспективный анализ частоты осложнений со стороны ЖКТ, кардиоваскулярной системы и печени у 322 пациентов с ревматическими заболеваниями, которые не менее 1 года постоянно принимали нимесулид в дозе 200 мг/сут.
Ни у кого из этих больных не было серьезных осложнений со стороны ЖКТ – кровотечения или перфорации язвы. Язвы желудка и ДПК были обнаружены у 13,3% обследованных пациентов, это примерно на треть меньше, чем число язв, возникающих на фоне приема неселективных НПВП (н-НПВП). В частности, ранее нами было показано, что в группе из 4931 больного, получавшего н-НПВП (преимущественно диклофенак), язвы верхних отделов ЖКТ были выявлены у 18,1%.
Несмотря на наличие серьезного коморбидного фона (заболевания ССС), за 12-месячный период приема нимесулида инфаркт миокарда развился лишь у 1-го пациента, и еще у 2-х пациенток на фоне приема нимесулида была отмечена отрицательная динамика ЭКГ, описанная как «постинфарктный кардиосклероз». Стойкое повышение АД в период госпитализации было отмечено у 11,5% больных. Существенное повышение уровня трансаминаз (более чем в 2 раза в сравнении с нормой) возникло лишь у 7 (2,2%), а клинически выраженная патология печени (желтуха и симптомы печеночной недостаточности) не была выявлена ни у кого из этих пациентов [33].
Недавно нами был проведен ретроспективный анализ результатов эндоскопических исследований верхних отделов ЖКТ, выполненных за период с 2011 по 2013 г. в клинике ФГБНУ «НИИР им. В.А. Насоновой» 1048 больным, регулярно получавшим нимесулид (16,8% мужчин и 83,2% женщин, средний возраст – 50,9±13,9 года). Контроль составили результаты выполненного в тот же период обследования больных, получавших другие н-НПВП, в основном диклофенак, кетопрофен и индометацин (n=816, 35,3% мужчин и 64,7% женщин, средний возраст – 47,9±14,6 года). Результаты этого исследования представлены на рисунке 2. Как видно, патология верхних отделов ЖКТ при использовании нимесулида возникала значительно реже, чем при использовании других популярных НПВП. Так, суммарное число язв желудка и ДПК составило 4,4 и 16,6% соответственно [34].
Говоря о безопасности нимесулида, нельзя не обратить внимание на проблему осложнений со стороны печени. НПВП-гепатопатия представляет собой проявление метаболической идиосинкразии и возникает редко (в сравнении с другими лекарственными осложнениями). По данным многолетней статистики, серьезные гепатотоксические осложнения, проявляющиеся выраженным внутрипеченочным холестазом или острой печеночной недостаточностью, возникают примерно у 1 из 10 тыс. больных, регулярно принимающих НПВП [35, 36].
Что касается нимесулида, то за 15-летний период (1985–2000 гг.) применения этого препарата в 50 различных странах было отмечено лишь 192 случая серьезных осложнений со стороны печени. Учитывая, что на 2000 г. нимесулидом было пролечено 280 млн больных, суммарная частота опасных гепатотоксических реакций – менее 1 случая на 1 млн проведенных курсов лечения [37].
Но в начале нового века отношение к проблеме гепатотоксичности нимесулида стало абсолютно иным. Контролирующие органы ряда европейских стран, последней из которых была Ирландия, прекратили использование этого препарата на своей территории, основываясь на статистике отдельных сообщений о тяжелых гепатотоксических реакциях. Так, фармаконадзор Ирландии (IMB) обосновал свою резолюцию информацией о 53 эпизодах серьезных осложнений со стороны печени, отмеченных за 12 лет использования нимесулида в этой стране. 9 подобных осложнений привели к развитию острой печеночной недостаточности с летальным исходом в 4-х случаях [38].
Однако основной орган Европейского союза, обеспечивающий контроль над оборотом лекарственных препаратов, – European Medicines Agency (EMEA), после рассмотрения этой проблемы не нашел оснований для прекращения использования нимесулида (пресс-релиз от 21.09.2007). EMEA было принято компромиссное решение рекомендовать ограничение длительности приема нимесулида в странах Европы (не более 15 дней) в дозе, не превышающей 200 мг/сут. С этой целью странам – членам Евросоюза было предложено изъять из аптечной сети упаковки, которые содержали более 30 стандартных доз нимесулида в виде таблеток или саше [39].
Повторное обсуждение проблемы гепатотоксичности нимесулида было проведено медицинским руководством Евросоюза 23 июня 2011 г. Последнее решение ЕМЕА подтвердило основные положения, обозначенные в пресс-релизе от 21.09.2007: достоинства нимесулида при кратковременном купировании острой боли явно превышают его недостатки, что делает оправданным его дальнейшее использование [40].
Непредвзятый анализ имеющихся литературных данных показывает, что гепатотоксичность нимесулида не выше, чем у многих других представителей класса НПВП. По данным клинических исследований, негативная динамика лабораторных биохимических показателей, свидетельствующая о развитии патологии печени, отмечается при использовании нимесулида с такой же частотой, как и на фоне приема других НПВП. При назначении нимесулида коротким курсом (не более 30 дней) повышение уровня печеночных ферментов в 2 и более раз отмечается лишь у 0,4% больных и не превышает 1,5% при длительном многомесячном приеме [11, 12].
Важные данные о реальной гепатотоксичности нимесулида можно почерпнуть из работы D. Sanchez-Matienzo et al., которые провели сопоставление частоты осложнений, связанных с приемом разных НПВП [41]. Материалом для анализа являлись спонтанные сообщения практикующих врачей, собранные со всего мира американской организацией, занимающейся контролем за оборотом лекарственных средств (FDA) и ВОЗ. Так, на 2003 г. ВОЗ получила 185 253 таких сигнала, большинство из которых, естественно, касалось типичных для НПВП осложнений со стороны ЖКТ и ССС. При этом число сообщений об осложнениях со стороны печени составило для всех НПВП лишь 2,7%. У диклофенака эта пропорция была иной – доля сообщений о гепатотоксических реакциях среди всех осложнений, связанных с этим препаратом, выросла до 4,7%. Наименее удачной эта пропорция оказалась для нимесулида – 14,4%. Основываясь на этих цифрах, казалось бы, можно решить, что нимесулид более опасен для печени, чем другие НПВП.
Однако ситуация представляется совершенно в другом свете при анализе абсолютных цифр. Так, общее число сообщений о гепатотоксических реакциях при использовании диклофенака было 990, ибупрофена – 590, а нимесулида – лишь 152. Самое главное, что угрожающая жизни патология – печеночная недостаточность – была зафиксирована ВОЗ у 21 больного, получавшего диклофенак, у 32 больных, получавших ибупрофен. И лишь в 4-х случаях это осложнение развилось на фоне приема нимесулида [41].
G. Traversa et al. провели анализ частоты гепатотоксических реакций у 397 537 больных, получавших НПВП, за период с 1997 по 2001 г. Суммарная частота осложнений со стороны печени на фоне приема этих препаратов составила 29,8 на 100 тыс. пациентов-лет. Суммарный риск развития гепатотоксических реакций у принимавших НПВП оказался на 40% выше в сравнении с лицами, не получавшими этих препаратов (ОШ 1,4). Частота серьезных осложнений со стороны печени при использовании нимесулида составила 35,3 случая на 100 тыс. человек в год, что было меньше, чем при приеме диклофенака (39,2), кеторолака (66,8) и ибупрофена (44,6), хотя и выше, чем в целом по группе. Как видно, в реальной практике нимесулид не демонстрирует более высокой гепатотоксичности, чем многие другие НПВП [42].
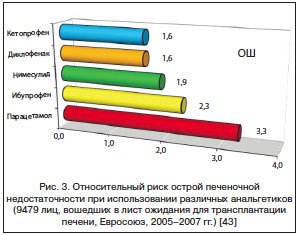
Принципиальное значение имеет исследование S. Gulmez et al., которые провели анализ причин развития острой печеночной недостаточности у 9479 лиц, вошедших в список нуждающихся в экстренной трансплантации печени в странах Евросоюза в 2005–2007 гг. Это потенциально фатальное осложнение было вызвано приемом НПВП лишь в 40 случаях, при этом 192 случая оказались связаны с приемом парацетамола. Относительный риск острой печеночной недостаточности для различных препаратов представлен на рисунке 3. Можно видеть, что нимесулид был менее опасен для печени, чем парацетамол и ибупрофен, и фактически не отличается от таких препаратов, как диклофенак и кетопрофен [43].
Таким образом, объективный анализ существующих источников не подтверждает мнение о какой-либо особой гепатотоксичности нимесулида. По всей видимости, это представление сформировалось на фоне пристального внимания мировой общественности к безопасности НПВП как класса в последнее десятилетие и не имеет под собой серьезной рациональной основы.
Клинические преимущества и популярность нимесулида определяют появление новых дженериков этого препарата. Одним из них является Немулекс®, представляющий собой быстрорастворимые гранулы для приготовления раствора. Этот препарат, активно входящий в российскую медицинскую практику, проходит клиническую проверку. Так, на сегодняшний день уже опубликовано несколько клинических исследований, в которых этот препарат использовался при ОА и БНЧС [44–46].
Наиболее крупным из них стала работа Ю.В. Поляковой и соавт., в ходе которой Немулекс® 200 мг/сут был назначен 30 больным ОА, испытывавшим острые суставные боли. Контроль составили 3 группы по 20 больных ОА, получавших диклофенак 100–150 мг/сут, индометацин 100–150 мг/сут или ибупрофен 800–1200 мг/сут. По суммарному эффекту Немулекс® как минимум не уступал другим НПВП. В то же время авторы отметили его важное достоинство – быстродействие. Так, среднее время до купирования боли при использовании препарата Немулекс® составило 2,05±0,31 дня, при применении препаратов контроля – 3,4±0,48, 4,7±0,37 и 6,7±0,51 дня соответственно (р<0,05) [44].
Конечно, в такого рода открытых исследованиях нередко дается завышенная оценка изучаемым лекарствам – тем не менее результаты исследований могут рассматриваться как веский довод в пользу хорошего качества нового дженерика нимесулида.
Завершая настоящий обзор, следует еще раз отметить, что нимесулид имеет важные преимущества в сравнении со многими другими популярными НПВП. Эта позиция подтверждается данными многочисленных исследований. Российские врачи имеют собственный (и весьма обширный) опыт использования нимесулида при самой различной патологии. Большую ценность этому опыту придают национальные особенности применения нимесулида, в частности распространенная практика его назначения на длительный срок. При этом данные отечественных исследований показывают, что частота осложнений со стороны ЖКТ и ССС на фоне приема нимесулида значительно меньше, чем при применении других н-НПВП (прежде всего диклофенака).
Вопрос о том, обладает ли нимесулид какой-либо особенной гепатотоксичностью, по всей видимости, требует дополнительного и непредвзятого обсуждения. Из представленного материала видно, что это не подтверждается результатами клинических и эпидемиологических работ. Важный факт: в нашей стране нимесулид принимали миллионы людей, при этом многие – совершенно бесконтрольно и длительно, но при этом в отечественной литературе нет ни одного описания клинически значимых гепатотоксических реакций у российских пациентов.
Таким образом, на сегодняшний день нимесулид может считаться одним из наиболее хороших – по соотношению эффективности и безопасности – представителей группы НПВП. Появление недорогих и качественных дженериков нимесулида (таких как Немулекс®) существенно расширяет возможности применения этого препарата в нашей стране.
Резюме
• Одним из наиболее популярных анальгетиков в нашей стране является нимесулид.
• Главные достоинства нимесулида: быстродействие, хорошее противовоспалительное действие, низкая (в сравнении с традиционными НПВП) частота диспепсии.
• В России было проведено более 20 клинических исследований, подтвердивших терапевтический потенциал и относительную безопасность этого препарата.
• Серьезные гепатотоксические реакции при использовании нимесулида возникают не чаще, чем при использовании многих других НПВП, таких как ибупрофен и диклофенак.
• Хотя нимесулид известен в России почти 20 лет, и его принимали миллионы жителей нашей страны, нет описаний случаев тяжелого поражения печени, вызванного этим препаратом, у российских пациентов.
• Появление недорогих и качественных дженериков нимесулида (Немулекс®) расширяет возможности применения этого препарата в нашей стране.
Литература
1. Насонов Е.Л., Насонова В.А. Фармакотерапия боли: взгляд ревматолога // Consilium medicum. 2000. № 2 (12). С. 7–14.
2. Боль (практическое руководство для врачей)
под ред. Яхно Н.Н., Кукушкина М.Л. М.: Изд-во РАМН, 2012. 512 c.
3. Makris U., Abrams R., Gurland B., Reid M.C. Management of persistent pain in the older patient: a clinical review // JAMA. 2014 Aug 27. Vol. 312 (8). Р. 825–836. doi: 10.1001/jama.2014.9405.
4. Blondell R.D., Azadfard M., Wisniewski A.M. Pharmacologic therapy for acute pain // Am Fam Physician. 2013 Jun 1. Vol. 87 (11). Р. 766–772.
5. Crofford LJ. Use of NSAIDs in treating patients with arthritis // Arthritis Res Ther. 2013. Vol. 15. Suppl 3. Р. 2. doi: 10.1186/ar4174. Epub 2013 Jul 24.
6. Алексеева Л.И., Каратеев А.Е., Попкова Т.В. и др. Эффективность и безопасность длительного применения нимесулида у больных остеоартрозом: результаты 12-месячного открытого контролируемого исследования ДИНАМО (Длительное Использование Нимесулида при Артрозе Многофакторная Оценка) // Научно-практическая ревматология. 2009. № 4. С. 64–72.
7. Барскова В.Г. Письмо редактора // Совр. ревматол. 2011. № 2. С. 82–83.
8. Kshirsagar N.A., Bachhav S.S. Nimesulide controversy: a comparison of EU and Indian scenario // Int J Risk Saf Med. 2013. Vol. 25 (4). Р. 239–246. doi: 10.3233/JRS-130602.
9. Насонов Е.Л. Эффективность и переносимость нестероидного противовоспалительного препарата. Нимесулид: новые данные // РМЖ. 2001. № 15. С. 6–8.
10. Mattia C., Ciarcia S., Muhindo A., Coluzzi F. Nimesulide: 25 years later // Minerva Med. 2010. Vol. 101 (4). Р. 285–293.
11. Rainsford K.D. Nimesulide -- a multifactorial approach to inflammation and pain: scientific and clinical consensus  // Curr Med Res Opin. 2006 Jun. Vol. 22 (6). Р. 1161–1170.
12. Bennett A. Nimesulide a well established cyclooxygenase-2 inhibitor with many other pharmacological properties relevant to inflammatory diseases. In: Therapeutic Roles of Selective COX-2 Inhibitors. Editors Vein J.R., Botting R.M., William Harvey Press. Р. 524–540.
13. Camu F. The role of COX-2 inhibitors in pain modulation // Drug. 2003. Vol. 63 (suppl.). Р. 1–7.
14. Mehta V., Johnston A., Cheung R. et al. Intravenous parecoxib rapidly leads to COX-2 inhibitory concentration of valdecoxib in the central nervous system // Clin Pharmacol Ther. 2008. Vol. 83 (3). Р. 430–435.
15. Dembo G., Park S., Kharasch E. Central nervous system concentrations of cyclooxygenase-2 inhibitors in humans // Anesthesiology. 2005. Vol. 102 (2). Р. 409–415.
16. McCrory C., Fitzgerald D. Spinal prostaglandin formation and pain perception following thoracotomy: a role for cyclooxygenase-2 // Chest. 2004. Vol. 125 (4). Р. 1321–1327.
17. Tassorelli C., Greco R., Sandrini G., Nappi G. Central components of the analgesic/antihyperalgesic effect of nimesulide: studies in animal models of pain and hyperalgesia // Drugs. 2003. Vol. 63. Suppl 1. Р. 9–22.
18. Bianchi M., Martucci C., Ferrario P., et al. Increased Tumor Necrosis Factor- and Prostaglandin E2 Concentrations in the Cerebrospinal Fluid of Rats with Inflammatory Hyperalgesia: The Effects of Analgesic Drugs // Anest Analg. 2007. Vol. 104. Р. 949–954.
19. Binning A. Nimesulide in the treatment of postoperative pain: a double-blind, comparative study in patients undergoing arthroscopic knee surgery // Clin J Pain. 2007. Vol. 23 (7). Р. 565–570.
20. Wober W., Rahlfs V., Buchl N. et al. Comparative efficacy and safety of the non-steroidal anti-inflammatory drugs nimesulide and diclofenac in patients with acute subdeltoid bursitis and bicipital tendinitis // Int J Clin Pract. 1998. Vol. 52 (3). Р. 169–175.
21. Pohjolainen T., Jekunen A., Autio L., Vuorela H. Treatment of acute low back pain with the COX-2-selective anti-inflammatory drug nimesulide: results of a randomized, double-blind comparative trial versus ibuprofen // Spine. 2000. Vol. 25 (12). Р. 1579–1585.
22. Konstantinovic L., Kahjun Z., Milovanovic A. et al. Acute low back pain with radiculopathy: a double – blind, randomized, placebo-controlled study // Photomed laser surg. 2010. Vol. 28 (4). Р. 555–560.
23. Lücker P., Pawlowski C., Friedrich I. et al. Double-blind, randomised, multi-centre clinical study evaluating the efficacy and tolerability of nimesulide in comparison with etodalac in patients suffering from osteoarthritis of the knee // Eur J Rheumatol Inflamm. 1994. Vol. 14 (2). Р. 29–38.
24. Huskisson E., Macciocchi A., Rahlfs V. et al. Nimesulide versus diclofenac in the treatment of osteoarthritis of the hip or knee: an active controlled equivalence study // Curr Ther Res. 1999. Vol. 60. Р. 253–265.
25. Kriegel W., Korff K., Ehrlich J. et al. Double-blind study comparing the long-term efficacy of the COX-2 inhibitor nimesulide and naproxen in patients with osteoarthritis // Int J Clin Pract. 2001. Vol. 55 (8). Р. 510–514.
26. Bradbury F. How important is the role of the physician in the correct use of a drug? An observational cohort study in general practice // Int. J. Clin. Pract. (Suppl). 2004. Vol. 144. Р. 27–32.
27. Conforti A., Leone R., Moretti U., Mozzo F., Velo G. Adverse drug reactions related to the use of NSAIDs with a focus on nimesulide: results of spontaneous reporting from a Northern Italian area // Drug Saf. 2001. Vol. 24. Р. 1081–1090.
28. Shrivastava M.P., Chaudhari H.V., Dakhale G.N. et al. Adverse drug reactions related to the use of non-steroidal anti-inflammatory drugs: results of spontaneous reporting from central India // J Indian Med Assoc. 2013 Feb. Vol. 111 (2). Р. 99–102, 106.
29. Laporte J., Ibanez L., Vidal X., Vendrell L., Leone R. Upper gastrointestinal bleeding associated with the use of NSAIDs: newer versus older agents // Drug Safety. 2004. Vol. 27. Р. 411–420.
30. Castellsague J., Pisa F., Rosolen V., Drigo D., Riera-Guardia N., Giangreco M., Clagnan E., Tosolini F., Zanier L., Barbone F., Perez-Gutthann S. Risk of upper gastrointestinal complications in a cohort of users of nimesulide and other nonsteroidal anti-inflammatory drugs in Friuli Venezia Giulia, Italy // Pharmacoepidemiol Drug Saf. 2013 Apr. Vol. 22 (4). Р. 365–375. doi: 10.1002/pds.3385. Epub 2012 Dec 11.
31. Helin-Salmivaara A., Virtanen A., Veslainen R. et al. NSAID use and the risk of hospitalisation for first myocardial infarction in the general population: a national case-control study from Finland // Eur. Heart. 2006. Vol. 27. Р. 1657–1663.
32. Каратеев А.Е. Российский опыт применения нимесулида: обзор клинических испытаний // Consilium medicum. 2011. № 13 (9). С. 89–95.
33. Каратеев А.Е., Алексеева Л.И., Братыгина Е.А., Аширова Т.Б. Оценка частоты развития побочных эффектов при длительном применении нимесулида в реальной клинической практике // РМЖ. 2009. № 17 (21). С. 1466–1472.
34. Каратеев А.Е. Сравнительная оценка влияния нимесулида на верхние отделы желудочно-кишечного тракта // Лечащий врач. 2014. № 7. С. 51–55.
35. Каратеев А.Е., Насонова В.А. НПВП-ассоциированная гепатопатия: проблема нимесулида // Научн.-практ. ревматол. 2004. № 1. С. 34–37.
36. Каратеев А.Е., Барскова В.Г. Безопасность нимесулида: эмоции или взвешенная оценка? // Consilium medicum. 2007. № 9. С. 60–64.
37. HELSINN’s response. На сайте: HELSINN, 2002, 12. На сайте: http://www.pharmabiz.com.
38. Irish Board Suspends Marketing of Drugs Containing Nimesulide На сайте: http://www.imb.ie.
39. Press release. European Medicines Agency recommends restricted use of nimesulid-containing medicinal products. Doc. Ref. EMEA/432604/2007 На сайте: http://www.emea.europa.eu.
40. Press release. 23/06/2011 European Medicines Agency concludes review of systemic nimesulide-containing medicines. На сайте: http://www.ema.europa.eu/ema.
41. Sanchez-Matienzo D., Arana A., Castellsague J., Perez-Gutthann S. Hepatic disorders in patient treated with COX-2 selective inhibitors or nonselective NSAIDs: A case/noncase analysis of spontaneous reports // Clinical Therapeutics. 2006. Vol. 28 (8). Р. 1123–1132.
42. Traversa G., Bianchi C., Da Cas R. et al. Cohort study of hepatotoxity associated with nimesulide and other non-steroidal anti-inflammatory drugs // BMJ. 2003. Vol. 327. Р. 18–22.
43. Gulmez S.E., Larrey D., Pageaux G.P. et al. Transplantation for acute liver failure in patients exposed to NSAIDs or paracetamol (acetaminophen): the multinational case-population SALT study // Drug Saf. 2013 Feb. Vol. 36 (2). Р. 135–144. doi: 10.1007/s40264-012-0013-7.
44. Полякова Ю.В., Сивордова Л.Е., Симакова Е.С. и сотр. Опыт применения препарата Немулекс® в лечении суставного синдрома при остеоартрозе // РМЖ. 2013. № 6. С. 311–313.
45. Лахин Д.И. Опыт применения препарата Немулекс в комплексном лечении больных остеоартрозом // РМЖ. 2013.Болевой синдром. С. 16–18.
46. Гутянский О.Г. Опыт применения Немулекса и Хондрогарда в амбулаторной практике при лечении дорсопатий // РМЖ. 2014. № 10. С. 756–759.












