Одним из наиболее важных достоинств нимесулида является относительно низкая частота развития осложнений со стороны желудочно–кишечного тракта (ЖКТ). Хорошо известно, что именно развитие патологии ЖКТ, относящейся к числу «класс–специфических» осложнений НПВП, является одним из основных факторов, определяющих соотношение риск/польза для этого класса лекарственных препаратов. Данные, подтверждающие благоприятную переносимость нимесулида в отношении ЖКТ, были получены российскими и зарубежными учеными в ходе серии проспективных и когортных наблюдательных исследований [12,13].
Однако необходимо отметить, что эти данные базируются преимущественно на результатах относительно кратковременных исследований или наблюдений (не более 1–3 мес.). При этом отмечается явный дефицит сведений о возможности развития подобных осложнений при длительном – многомесячном – использовании этого препарата.
С другой стороны, в настоящее время пристальное внимание исследователей, практических врачей и организаторов медицины приковано к проблеме кардиоваскулярных осложнений НПВП. В этом плане безопасность нимесулида изучена явно недостаточно. Имеются отдельные данные, демонстрирующие преимущества нимесулида в сравнении с диклофенаком, в отношении частоты развития и дестабилизации артериальной гипертензии [9,14]. Однако полученные этими авторами результаты базируются на относительно кратковременных исследованиях протяженностью не более месяца.
Серьезной проблемой, являющейся предметом общеевропейской дискуссии, является оценка реального риска развития гепатотоксических реакций при длительном использовании нимесулида [15–17]. Как и в отношении кардиоваскулярных осложнений, в данной ситуации мы наблюдаем очевидный пробел в наших знаниях, причина которого определяется недостаточным числом наблюдений за риском развития гепатопатии у больных, длительно принимающих нимесулид.
Таким образом, на сегодняшний день мы не имеем достаточной информации о безопасности продолжительного приема нимесулида. Это вызывает удивление, поскольку именно в нашей стране нимесулид традиционно рассматривается как препарат, который целесообразно использовать именно для длительной терапии хронической боли, в т.ч. у больных с ревматическими заболеваниями.
Цель исследования: ретроспективный анализ частоты развития побочных эффектов со стороны ЖКТ, кардиоваскулярной системы и печени у больных РЗ, длительно принимавших нимесулид.
Исследуемая группа: исследуемую группу составили 322 больных с различными ревматическими заболеваниями, поступивших для стационарного лечения в клинику НИИР РАМН в 2007–2008 гг. и соответствующих критериям отбора:
• Зафиксированный в медицинской документации факт использования нимесулида не менее 12 мес. до поступления в клинику НИИР РАМН и продолжение его приема в течение периода госпитализации.
• Проведение эндоскопического исследования верхних отделов ЖКТ (ЭГДС) в период госпитализации на фоне приема нимесулида.
• Систематический контроль артериального давления и проведение ЭКГ на фоне приема нимесулида.
• Не менее чем 2–кратное проведение биохимического анализа крови с определением АСТ, АЛТ за период госпитализации.
ЭГДС, систематический контроль АД, ЭКГ и биохимический анализ крови проводились не в рамках клинического исследования безопасности НПВП, а являлись элементами обычной программы обследования госпитализированных больных.
В исследование не включались пациенты, которые на фоне приема нимесулида регулярно получали эффективные средства для профилактики развития осложнений со стороны верхних отделов ЖКТ (ингибиторы протонной помпы).
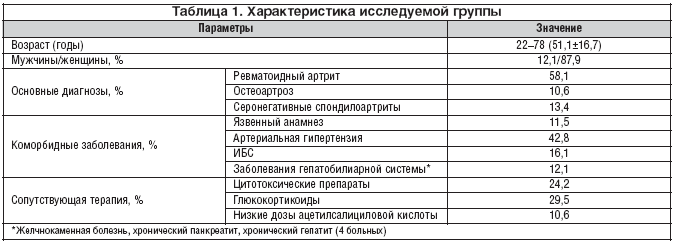
Характеристика исследуемой группы представлена в таблице 1: как видно, большую часть больных составляли женщины среднего и старшего возраста (18,6% были лица 65 лет и старше), страдавшие ревматоидным артритом и имевшие серьезный коморбидный фон – особенно в плане патологии сердечно–сосудистой системы. Так, 16% больных имели диагностированную ишемическую болезнь сердца (ИБС). Следует также отметить нередкое выявление сопутствующих заболеваний гепатобилиарной зоны (прежде всего желчнокаменной болезни) и наличие язвенного анамнеза более чем у 10% обследованных пациентов. Немаловажно, что наличие системных воспалительных заболеваний суставов определило тот факт, что более трети больных получали помимо нимесулида глюкокортикоиды и цитотоксические препараты (в основном метотрексат и лефлюнамид). Нередкое сочетание ревматических заболеваний и ИБС стало причиной длительного сочетанного приема нимесулида и низких доз ацетилсалициловой кислоты у 10,6% пациентов.
Методы
В ходе исследования нами проводилась оценка всех возможных осложнений, развитие которых могло быть связано с негативным действием нимесулида (т.е. зафиксированных в период его использования). В качестве таковых оценивались:
• со стороны верхних отделов ЖКТ – частота выявления язв желудка и/или двенадцатиперстной кишки;
• со стороны сердечно–сосудистой системы – четко зафиксированный факт развития инфаркта миокарда или ишемического инсульта за изучаемый период (12 мес.), а также выявление дестабилизации артериальной гипертензии (повышение АД > 140/90 мм рт.ст., зафиксированное не менее 2 раз), за период госпитализации;
• со стороны печени – частота эпизодов клинически значимой (в 2 и более раз в сравнении с нормальными показателями) повышения уровня АЛТ.
Результаты
Частота побочных эффектов, отмеченных в период госпитализации на фоне приема нимесулида, представлена в таблице 2.
В изучаемой когорте мы не отметили угрожающих жизни осложнений со стороны ЖКТ – таких, как кровотечение или перфорации язвы. Суммарно язвы при проведении ЭГДС были выявлены более чем у 10% обследованных пациентов. Однако большинство из этих эпизодов не сопровождались четкой клинической картиной, т.е. представляли собой классические «бессимптомные» НПВП–индуцированные язвы.
В период госпитализации инфаркт миокарда не развился ни у кого из данных пациентов. В тоже время, за 12–месячный предшествующий период это опасное осложнение было достоверно зафиксировано у одного мужчины 68 лет, страдающего РА, получавшего дополнительно метилпреднизолон 8 мг/сут. и метотрексат 10 мг/неделю. В качестве сопутствующей патологии этот больной имел ИБС и высокую артериальную гипертензию. У двух других пациенток на фоне приема нимесулида была отмечена отрицательная динамика ЭКГ, трактованная кардиологом как «постинфарктный кардиосклероз» вследствие перенесенного инфаркта миокарда.
Среди обследованных пациентов ни во время госпитализации, ни в течение 12–месячного предшествующего периода не было отмечено эпизодов ишемического инсульта.
В тоже время стойкое повышение АД в период госпитализации было отмечено у 11,5% больных. Среди лиц, исходно имевших эту патологию, частота дестабилизации АД была существенно выше, чем в целом по группе, и составила 26,8%.
Мы не зафиксировали эпизодов клинически выраженной патологии печени – желтухи, гепатомегалии, симптомов печеночной недостаточности. При этом существенное повышение печеночных ферментов было отмечено лишь у больных РА, получавших, помимо нимесулида, цитотоксические препараты (метотрексат или лефлуномид).
Обсуждение полученных результатов
Полученные данные призваны в определенной мере заполнить пробел в наших знаниях о безопасности длительного использования нимесулида – одного из наиболее популярных представителей НПВП в России. Конечно, отсутствие контрольной группы существенно ограничивает значимость результатов исследования. Тем не менее они дают представление о риске наиболее значимых «класс–специфических» осложнений, связанных с использованием этого препарата.
Частоту эндоскопических язв при использовании нимесулида возможно сопоставить с данными предшествующих эндоскопических исследований, проводившихся в клинике НИИР. Так, язвы желудка и/или ДПК были выявлены у 18,1% из 4931 больных, регулярно принимавших неселективные НПВП, преимущественно диклофенак [18]. Таким образом, на фоне длительного непрерывного приема нимесулида эндоскопические язвы выявляются почти на треть реже (на 26,6%), чем у больных, принимающих традиционные НПВП.
Следует учесть, что проведение эндоскопического исследования верхних отделов ЖКТ не является стандартным методом, который проводится всем пациентам НИИР. Во всех 322 случаях ЭГДС проводилась в плановом порядке по тем или иным показаниям, определенным лечащими врачами. Поэтому наши результаты не могут, разумеется, считаться истинной частотой развития эндоскопических язв на фоне приема нимесулида (их частота будет существенно ниже) – подобные данные могут быть получены лишь в ходе специальных исследований, во время которых ЭГДС проводится всем больным, принимающим этот препарат.
Следует также отметить, что изучаемая когорта была отягощена серьезными факторами риска НПВП–гастропатии – более 10% имели язвенный анамнез, 18,6% были старше 65 лет и 10% принимали низкие дозы ацетилсалициловой кислоты.
Обращаясь к данным литературы, следует отметить, что четкой информации о ЖКТ–переносимости нимесулида при длительном применении недостаточно. На сегодняшний день для этого препарата мы не имеем данных о масштабных проспективных исследованиях, в которых проводилось изучение частоты серьезных ЖКТ–осложнений (кровотечения) и их основного «суррогатного» маркера (эндоскопических язв). Тем не менее есть веские данные, подтверждающие лучшую переносимость нимесулида в сравнении с традиционными НПВП.
Так, ирландский ученый Bradbury F. провел оценку частоты ЖКТ–осложнений при использовании диклофенака (n=3553), нимесулида (n=3807) и ибупрофена (n=1470) в реальной клинической практике. Суммарная частота этой патологии при использовании нимесулида была существенно меньше в сравнении с диклофенаком – 12,1%, хотя и не отличалась от ибупрофена – 8,1% и 8,6% [12].
Существенно меньшая частота ЖКТ–осложнений при использовании нимесулида была продемонстрирована итальянскими эпидемиологами Conforti A. и сотр. Они проанализировали 10 608 сообщений о серьезных побочных эффектах (1988–2000), связанных с приемом различных НПВП. Согласно полученным данным, что нимесулид был причиной развития тех или иных осложнений со стороны ЖКТ в 2 раза реже, чем иные НПВП, число «жалоб» на этот препарат составило 10,4% от общего числа сообщений. При этом диклофенак был причиной проблем в 21,2%, кетопрофен – в 21,7%, а пироксикам – в 18,6% случаях [19].
Масштабное эпидемиологическое исследовании Laporte J. и сотр. оценивало риск развития ЖКТ–кровотечения на фоне приема различных НПВП в реальной клинической практике. В работе проводился анализ причин 2813 эпизодов опасного ЖКТ–кровотечения, при этом соответствующий контроль составили 7193 пациента без данного осложнения. Нимесулид показал большую безопасность, чем многие другие НПВП, популярные в Европе. Так, относительный риск кровотечения для нимесулида составил 3,2, для диклофенака – 3,7, мелоксикама – 5,7, а рофекоксиба – 7,2 [20].
В нашей стране важные данные по этому вопросу были получены О.Н. Минушкиным, который представил анализ данных многоцентрового исследования эффективности и безопасности нимесулида. Нимесулид был назначен 600 больным РЗ в дозе 200 мг/сут., длительность непрерывного приема составляла от 1 до 3 мес. По результатам работы, какие–либо осложнения со стороны ЖКТ были выявлены лишь у ~ 9% больных. При этом, хотя не менее 10% больных в исследуемой группе имели язвенный анамнез, не было отмечено ни одного эпизода ЖКТ–кровотечения или перфорации язвы [13].
В ходе исследования эффективности высоких доз НПВП при раннем РА серьезная патология ЖКТ – язвы и множественные эрозии желудка или двенадцатиперстной кишки (ДПК) на фоне приема нимесулида 200–400 мг/сут. – была выявлена лишь у 2 (1,3%). При этом в контрольной группе (прием диклофенака 100–200 мг/сут.), подобные осложнения возникли у 7 больных (5,9%) (р=0,042) [10].
Другое российское исследование было посвящено оценке частоты рецидивов НПВП–индуцированных язв на фоне приема нимесулида. По плану работы, нимесулид 200 мг/сут. использовался у 20 больных, непосредственно перед этим закончившим курсовое противоязвенное лечение по поводу язвы или множественных (более 10) эрозий желудка и/или ДПК, возникших при использовании других НПВП. Соответствующий по полу, возрасту и диагнозу основного заболевания контроль составляли 20 пациентов, которым после заживления НПВП–индуцированных язв и множественных эрозий был назначен диклофенак 100 мг/сут. в виде ректальных свечей. Через 2 мес. наблюдения рецидив язвы был отмечен лишь у 1 больного, принимавшего нимесулид (5,6%), и у трети больных (33,3%), получавших свечи с диклофенаком (р<0,05) [21].
Изучение кардиоваскулярной переносимости нимесулида представляло для нас особый интерес. Хорошо известно, что проблема риска сердечно–сосудистых катастроф при использовании НПВП в последние годы привлекает пристальное внимание мировой медицинской общественности [1].
Согласно нашим данным, инфаркт миокарда на фоне приема нимесулида развился лишь у одного больного, имеющего множественные кардиоваскулярные факторы риска – прежде всего, диагностированную ИБС и стойкую артериальную гипертензию. Эта кардиоваскулярная патология была выявлена задолго до начала приема нимесулида. В двух других эпизодах были отмечены лишь косвенные признаки, указывающие на возможность развития инфаркта миокарда (ретроспективный характер исследования не позволил провести точную диагностику). Тем не менее у обеих пациенток также отмечалась артериальная гипертензия, развившаяся до начала использования нимесулида. Таким образом, во всех трех случаях причинная связь между приемом нимесулида и развитием кардиоваскулярных осложнений представляется недостаточно явной.
В мировой медицинской литературе вопрос сравнительного риска развития инфаркта миокарда при использовании нимесулида, по всей видимости, был освещен лишь в одной крупной работе, проведенной финскими учеными. В ходе эпидемиологического исследования было проанализировано 33309 эпизодов инфаркта миокарда, при этом контроль, соответствующий по полу и возрасту, составили 138949 лиц. По результатам статистического анализа, значение относительного риска инфаркта для нимесулида составило 1,69. Это значение приближалось к соответствующим показателям для мелоксикама, набуметона, этодалака и неселективных НПВП [22].
Для оценки риска инфаркта миокарда и ишемического инсульта, связанных с использованием НПВП, принципиальное значение имеет дестабилизация артериальной гипертензии – важнейший фактор риска, а возможно, удачный «суррогатный маркер» опасных кардиоваскулярных осложнений.
В нашем исследовании дестабилизация артериальной гипертензии была отмечена у 26,8% больных, которые исходно (до начала приема нимесулида) уже имели эту патологию. В целом этот показатель близок данным, полученным для других НПВП. Так, по данным крупных международных исследований, в которых изучалось влияние НПВП на АД в группах больных, страдавших артериальной гипертензией (таких, как CRESCENT) [23], аналогичный показатель составлял 16–30% для различных препаратов.
Следует принять во внимание, что подбор эффективной антигипертензивной терапии у пациентов, включенных в наше исследование (для достижения «целевого» уровня АД), не был целью госпитализации. При этом многие российские пациенты, страдающие артериальной гипертензией, не получают адекватной антигипертензивной терапии и не придерживаются назначенных им схем терапевтического контроля АД [24].
Оценка влияния нимесулида на риск дестабилизации артериальной гипертензии в нашей стране уже изучалась. Так, большой интерес представляют результаты исследования В.И. Мазурова и сотр., в котором определялась динамика АД (по данным суточного мониторирования) у 40 больных с ОА, имевших артериальную гипертензию, на фоне приема нимесулида или диклофенака. Через 30 дней наблюдения у больных, получавших нимесулид, не было отмечено дестабилизации АД. Использование же диклофенака сопровождалось четкой негативной динамикой. Так, на фоне приема нимесулида среднее систолическое давление изменилось с 143 до 140 мм рт.ст., в то время как при использовании диклофенака повысилось с 147 до 156 мм рт.ст. (p<0,05) [14].
Аналогичные данные – фактическое отсутствие негативного влияния нимесулида на АД – было ранее продемонстрировано в работе, проведенной в НИИР. При этом изучаемую группу составляли мужчины, страдавшие хроническим подагрическим артритом, имеющие серьезный кардиоваскулярный коморбидный фон [9].
Обсуждая безопасность нимесулида, мы должны остановить особое внимание на проблеме риска гепатотоксических реакций, поскольку этот вопрос в последние годы был темой активной дискуссии.
Согласно результатам нашего исследования, значимое (более чем в 2 раза) повышение уровня АЛТ отмечалось лишь у 7 больных (2,2%), длительно – в течение не менее 12 мес. – и регулярно принимавших нимесулид. При этом 5 из них составили пациенты с РА, которых получали (ранее или на момент госпитализации) метотрексат. Необходимо отметить, что ни у одного пациента, поступившего в клинику НИИР РАМН и принимавшего нимесулид в течение года, не было зафиксировано клинических признаков поражения печени.
Полученные нами данные представляются дополнительным свидетельством отсутствия у нимесулида «особой» гепатотоксичности, выделяющей его среди других НПВП.
Важно отметить, что НПВП–гепатопатия, представляющая собой проявление метаболической идиосинкразии, является очень редкой патологией. По многолетней статистике, тяжелые гепатотоксические осложнения, проявляющиеся клинически выраженным внутрипеченочным холестазом или острой печеночной недостаточностью, развиваются примерно у 1 из 10 тыс. больных, регулярно принимающих НПВП [1,16,26].
Что касается нимесулида, то за 15–летний (~50 различных стран, 1985–2000 гг.) период применения этого препарата в мировой клинической практике, было зафиксировано всего 192 эпизода значимых осложнений со стороны печени. Учитывая, что на 2000 г. нимесулидом было пролечено 280 млн больных, суммарная частота опасных гепатотоксических реакций, таким образом, составляет менее 0,1 эпизода на 100 тыс. лечебных курсов [26–28].
Однако в XXI в. отношение к проблеме гепатотоксичности нимесулида изменилось: контролирующие органы ряда европейских стран, последней из которых была Ирландия, прекратили использование этого препарата на своей территории. Обоснованием этого решения стала статистика отдельных сообщений о тяжелых гепатотоксических реакциях. Например, контролирующий орган Ирландии (IMB) основывал свою резолюцию информацией о 53 эпизодах серьезных осложнений со стороны печени, отмеченных за 12 лет использования нимесулида в этой стране. Девять подобных осложнений привели к развитию острой печеночной недостаточности, завершившейся летальным исходом у 4 больных [29].
Однако EMEA (European Medicines Agency) – основной орган Европейского союза, обеспечивающий контроль над оборотом лекарственных препаратов в Европе, – после обсуждения сложившейся ситуации не нашел достаточных оснований для прекращения использования нимесулида (Пресс–релиз от 21.09.07). При этом было принято компромиссное решение рекомендовать ограничить использование нимесулида в странах Европы курсом не более 15 дней в дозе, не превышающей 200 мг/сут. В тоже время государствам – членам Евросоюза было рекомендовано изъять из аптечной сети упаковки нимесулида, содержащие более 30 стандартных доз этого препарата [30].
Это решение стало предметом активного обсуждения на ежегодной конференции НИИР РАМН, прошедшей в ноябре 2007 г., в ходе специального заседания, на котором были представлены российские и зарубежные данные, касающиеся использования нимесулида в клинической практике. Согласно позиции ведущих экспертов–ревматологов, достоинства нимесулида существенно преобладают над его недостатками, поэтому на сегодняшний день нет необходимости в каких–либо мерах по ограничению его использования в России [31].
На самом деле объективный анализ имеющихся литературных данных показывает, что гепатотоксичность нимесулида не выше, чем у многих других представителей класса НПВП [25]. Результаты РКИ показывают, что отрицательная динамика изменений лабораторных биохимических показателей, свидетельствующих о повреждении печени, отмечается при использовании нимесулида с такой же частотой, как и на фоне приема других НПВП. При назначении нимесулида коротким курсом (не более 30 дней) повышение АЛТ и АСТ в 2 и более раз отмечается лишь у 0,4% больных, а при длительном многомесячном приеме частота подобных изменений не превышает 1,5% [26,27].
Масштабных эпидемиологических работ, в которых изучалась сравнительная гепатотоксичность НПВП, относительно немного. Среди них наиболее значимой представляется работа итальянских ученых Traversa G. и сотр. В ходе популяционного исследования анализировалась частота гепатотоксических реакций у 397537 больных за период с 1997 по 2001 г. Суммарная частота данных осложнений на фоне приема НПВП составила 29,8 на 100 тыс. пациентов–лет. Соответственно, показатель относительного риска гепатотоксических реакций для всех НПВП составил 1,4. Индивидуальная частота серьезных осложнений со стороны печени при использовании нимесулида составила 35,3 на 100 тыс. человек–лет – меньше, в сравнении с диклофенаком (39,2), кеторолаком (66,8) и ибупрофеном (44,6) [15].
Гепатотоксичность нимесулида в реальной клинической практике можно оценить на основании российского опыта применения этого препарата для лечения острого и хронического подагрического артрита. Пациенты, страдающие подагрой, имеют комбинацию факторов, негативно влияющих на функцию печени. Это метаболические нарушения, жировой гепатоз, желчнокаменная болезнь, прием алкоголя и пищи, содержащей большое количество жиров. Сотрудниками НИИР был проведен анализ влияния нимесулида на биохимические показатели функции печени у 81 мужчины с подагрическим артритом, которым в качестве анальгетика и противовоспалительного средства был назначен нимесулид 100–400 мг/сут. Важно отметить, что существенная часть больных исходно имела повышение значения АЛТ. Однако после курсового применения нимесулида отрицательной динамики биохимических показателей, свидетельствующих о повреждении печеночных клеток или холестазе, отмечено не было [17].
Имеется относительно немного клинических исследований, в которых эффективность и безопасность нимесулида изучалась в течение длительного времени. Такие работы имеют для изучаемого нами вопроса большую ценность. Так, Locker P. и сотр., провели сравнение нимесулида 200 мг или этодолака 600 мг у 199 больных остеоартрозом в ходе 3–месячного исследования. Лечебное действие нимесулида оказалось более высоким – его оценили как «хорошее» или «превосходное» 80% больных, в то время как этодолак получил аналогичную оценку лишь у 68% больных. Надо отметить, что этодолак относится к селективным НПВП и считается препаратом с очень хорошей переносимостью. Тем не менее общее число побочных эффектов в обеих лечебных группах не различалось [32]. В масштабном исследовании Huskisson E. и сотр. нимесулид 200 мг/сут. сравнивался с диклофенаком 150 мг/сут. у 279 больных ОА. В этой работе длительность наблюдения составила 6 мес. Терапевтический эффект лекарств, который оценивался по динамике самочувствия больных и функциональному индексу Лекена, практически не различался. Но нимесулид достоверно лучше переносился – так, развитие гастроинтестинальных осложнений было зафиксировано соответственно у 36 и 47% пациентов (p<0,05) [11].
Наиболее крупным и продолжительным на сегодняшний день исследованием нимесулида стала работа Kriegel W. и сотр. Они изучали эффективность и безопасность нимесулида 200 мг и напроксена 750 мг у 370 больных ОА в течение 12 мес. Аналогично результатам, полученным Huskisson E., эффективность обоих препаратов оказалась сопоставимой, правда, с некоторым преимуществом нимесулида. Так, изменение суммарного индекса WOMAC ко времени завершения работы составило –22,5 и –19,9%. Общее число лекарственных осложнений при использовании нимесулида в сравнении с напроксеном также оказалось ниже – 47,5 и 54,5% [33]. Необходимо отметить, что во всех трех исследованиях на фоне приема нимесулида не было зафиксировано значимого повышения частоты кардиоваскулярных осложнений.
Таким образом, на основании собственных данных и анализа доступных литературных источников мы можем заключить, что длительный прием нимесулида не ассоциируется с чрезмерно высоким риском развития класс–специфических кардиоваскулярных осложнений. При этом частота осложнений со стороны ЖКТ, определяемая по важнейшему «суррогатному маркеру» (эндоскопическим язвам), на фоне приема этого препарата ниже в сравнении с традиционными НПВП. Длительное использование нимесулида также не ассоциировалось с существенным нарастанием частоты опасных гепатотоксических реакций. Благоприятная переносимость этого эффективного обезболивающего и противовоспалительного препарата определяет возможность его применения в течение длительного времени.

Литература
1. Каратеев А.Е., Яхно Н.Н., Лазебник Л.Б. и сотр. Применение нестероидных противовоспалительных препаратов. Клинические рекомендации. Москва, «ИМА–ПРЕСС», 2009, 167 с.
2. Насонов Е.Л. Эффективность и переносимость нестероидного противовоспалительного препарата. Нимесулид: новые данные. РМЖ, 2001, 15: 6–8
3. Балабанова Р.М., Белов Б.С., Чичасова Н.В. и др. Эффективность нимесулида при ревматоидном артрите Фарматека, 2004, № 7, 55–58.
4. Wober W., Rahlfs V., Buchl N. et al. Comparative efficacy and safety of the non–steroidal anti–inflammatory drugs nimesulide and diclofenac in patients with acute subdeltoid bursitis and bicipital tendinitis. Int J Clin Pract. 1998,52(3), 169–175.
5. Facchini R., Selva G., Peretti G. Tolerability of nimesulide and ketoprofen in paediatric patients with traumatic or surgical fractures. Drugs. 1993;46 Suppl 1: 238–241.
6. Binning A. Nimesulide in the treatment of postoperative pain: a double–blind, comparative study in patients undergoing arthroscopic knee surgery. Clin J Pain. 2007, 23(7): 565–570.
7. Pohjolainen T., Jekunen A., Autio L., Vuorela H. Treatment of acute low back pain with the COX–2–selective anti–inflammatory drug nimesulide: results of a randomized, double–blind comparative trial versus ibuprofen. Spine, 2000, 25(12), 1579–1585.
8. Klumb E. The treatment of acute gout arthritis. Double–blind randomized comparative study between nimesulid and indomethacin. Revista Brasileira De Medicine. 1996; 53: 540–546
9. Барскова В.Г., Насонова В.А., Цапина Т.Н., и др. Эффективность и безопасность применения нимесулида (нимесил) у больных подагрическим артритом. Клин. Мед. 2004; 12; 49–54.
10. Каратеев А.Е., Каратеев Д.Е., Лучихина Е.Л. и др. Эффективность и безопасность монотерапии высокими дозами НПВП при раннем артрите. РМЖ, 2006, 16, 24–29.
11. Huskisson E., Macciocchi A., Rahlfs V., et al. Nimesulide versus diclofenac in the treatment of osteoarthritis of the hip or knee: an active controlled equivalence study. Curr Ther Res 1999, 60, 253–265.
12. Bradbury F. How important is the role of the physician in the correct use of a drug? An observational cohort study in general practice. Int. J. Clin. Pract. (Suppl). 2004, 144, 27–32.
13. Минушкин О.Н. Использование препарата «Найз» у больных, страдающих сочетанной патологией суставов и поражением верхних отделов желудочно–кишечного тракта. Научо–практическая ревматология 2003; 5: 72–76.
14. Мазуров В.И., Лила А.М. Отчет о результатах пилотного исследования по сравнительной оценке влияния найза (нимесулида) и диклофенака на гемодинамические показатели у больных остеоартрозом в сочетании с эссенциальной артериальной гипертензией, кафедра терапии 1 им. Э.Э.Эйхвальда с курсом ревматологии Медицинской академии последипломного образования, Санкт–Петербург, 2007 г.
15. Traversa G., Bianchi C., Da Cas R., et al. Cohort study of hepatotoxity associated with nimesulide and other non–steroidal anti–inflammatory drugs. BMJ, 2003, 327, 18–22
16. Rainsford K. Nimesulide – a multifactorial approach to inflammation and pain: scientific and clinical consensus. Curr Med Res Opin. 2006, 22(6), 1161–1170.
17. Каратеев А.Е., Барскова В.Г. Безопасность нимесулида: эмоции или взвешенная оценка? Consilium medicum, 2007, 9, 60–64.
18. Каратеев А.Е., Насонова В.А. Развитие и рецидивирование язв желудка и двенадцатиперстной кишки у больных, принимающих нестероидные противовоспалительные препараты: влияние стандартных факторов риска. Тер. Архив, 2008, 5, 62–66.
19. Conforti A., Leone R., Moretti U., Mozzo F., Velo G. Adverse drug reactions related to the use of NSAIDs with a focus on nimesulide: results of spontaneous reporting from a Northern Italian area. Drug Saf., 2001, 24, 1081–1090.
20. Laporte J., Ibanez L., Vidal X., Vendrell L., Leone R. Upper gastrointestinal bleeding associated with the use of NSAIDs: newer versus older agents. Drug Safety 2004, 27, 411–420.
21. Каратеев А., Каратеев Д., Насонов Е. Гастродуоденальная переносимость нимесулида (НИМЕСИЛ, Berlin Chemie) у больных с язвенным анамнезом: первое проспективное исследование безопасности селективных ЦОГ–2 ингибиторов у больных с высоким риском развития НПВП–индуцированных гастропатий. Научно–практическая ревматология 2003; 1: 45–48.
22. Helin–Salmivaara A., Virtanen A., Veslainen R., et al. NSAID use and the risk of hospitalisation for first myocardial infarction in the general population: a national case–control study from Finland. Eur. Heart, 2006, 27, 1657–1663.
23. Sowers J., White W., Pitt B., et al. The effects of cycloxygenase –2 inhibitors and nonsteroidal anti–inflammatory therapy on 24–houar blood pressure in patients with hypertension, osteoarthritis, and type 2 diabetes mellitus. Arch Intern Med 2005; 165: 161–168
24. Чазова И.Е. Современная классификация артериальной гипертонии и подходы к лечению. www.medinfa.ru
25. Каратеев А.Е., Насонова В.А. НПВП – ассоциированная гепатопатия: проблема нимесулида. Научн. Практ. Ревматол., 2004, 1, 34–37
26. Boelsterli U. Nimesulide and hepatic adverse affects: roles of reactive metabolites and host factors. Int. J. Clin. Pract., 2002, supl. 128, 30–36.
27. Boelsterli U. Mechanisms of NSAID–induced hepatotoxicity: focus on nimesulide. Drug Saf. 2002, 25, 633–648.
28. HELSINN’s response. На сайте: HELSINN, 2002, 12. http://www.pharmabiz.com.
29. Irish Board Suspends Marketing of Drugs Containing Nimesulide http://www.imb.ie.
30. Press release. European Medicines Agency recommends restricted use of nimesulid–containing medicinal products. Doc. Ref. EMEA/432604/2007 На сайте: http://www.emea.europa.eu.
31. БОЛЬ: информационный портал. Новости: Казнить или помиловать нимесулид? http://www.paininfo.ru/press/1164.html
32. Lucker P., Pawlowski C., Friedrich I., et al. Double–blind, randomised, multi–centre clinical study evaluating the efficacy and tolerability of nimesulide in comparison with etodalac in patients suffering from osteoarthritis of the knee. Eur J Rheumatol Inflamm., 1994, 14(2): 29–38.
33. Kriegel W., Korff K., Ehrlich J., et al. Double–blind study comparing the long–term efficacy of the COX–2 inhibitor nimesulide and naproxen in patients with osteoarthritis. Int J Clin Pract. 2001, 55(8): 510–514












