Несмотря на достижения современной ревматологии, вопросы ведения пациентов с системными васкулитами, к числу которых относится гранулематоз с полиангиитом, остаются весьма актуальными на сегодняшний день.
Гранулематоз с полиангиитом (Вегенера) (ГПА) – тяжелое заболевание, в основе которого лежат некротизирующее гранулематозное воспаление с вовлечением верхних и нижних дыхательных путей и некротизирующий васкулит преимущественно сосудов мелкого и среднего калибра (капилляров, венул, артериол, артерий и вен). Часто развивается некротизирующий гломерулонефрит [1, 2].
Распространенность заболевания – 8,5 (2–12) на 1 млн населения. Средний возраст начала заболевания – 45 (21–76) лет. Территориально более распространен в странах Северной Европы [1].
Морфологически при ГПА полиангиит сопровождается полиморфно-клеточной гранулематозной воспалительной реакцией. Такая гранулематозная ткань помимо скоплений нейтрофилов, окруженных антиген-презентирующими клетками, макрофагов, многоядерных гигантских клеток, CD4+CD28-эффекторных T-клеток памяти Th1 типа, Т-клеток, секретирующих интерлейкин (ИЛ) -17, гистиоцитов и эозинофилов, содержит фокусы аутоантиген-специфичных CD20 В-лимфоцитов и плазматических клеток, способных продуцировать антинейтрофильные цитоплазматические антитела (АНЦА). Кроме того, В-клетки являются источником цитокинов (ИЛ-6, -10, фактор некроза опухоли альфа, проявляют свойства антиген-презентирующих клеток, могут дифференцироваться в длительно живущие клетки памяти [1, 4]. Т-клетки являются источником разнообразных цитокинов, играющих ключевую роль на всех этапах реализации сложных механизмов АНЦА-ассоциированного сосудистого повреждения. Функциональный дефицит T-регуляторных клеток лежит в основе хронического аутоиммунного воспаления при ассоциированных васкулитах (АНЦА-СВ) [1, 5].
Отличительный лабораторный признак ГПА – наличие АНЦА в сыворотке крови, причем более характерно выявление антител к протеиназе-3, хотя эти антитела определяются не у всех пациентов, могут отсутствовать в фазе ремиссии, а также могут быть выявлены и при других заболеваниях.
Международным стандартом определения АНЦА является поэтапное лабораторное обследование, включающее:
– непрямую иммунофлуоресценцию (НИФ) на нейтрофилах здоровых доноров, фиксированных этанолом;
– последующее подтверждение специфичности АНЦА (наличие антител к протеиназе-3 или миелопероксидазе) при помощи иммуноферментного анализа (ИФА) [1, 6].
Цитоплазматический тип свечения при НИФ (цАНЦА) или антитела к протеиназе-3 высокочувствительны и специфичны для ГПА (>90%) [7].
Классификационные критерии ГПА (требуется не менее 2-х из 4-х признаков):
1. Воспаление носа и полости рта (гнойные, кровянистые выделения из носа, язвы в полости рта).
2. Изменения в легких при рентгенологическом исследовании (узелки, инфильтраты, полости).
3. Изменения мочи (гематурия, эритроцитарные цилиндры в осадке мочи).
4. Данные биопсии (гранулематозное воспаление в стенке артерии или пери- и экстраваскулярном пространстве) [1, 3].
Для оценки клинической активности АНЦА-СВ предложен Бирмингемский индекс активности васкулита (Birmingham Vasculitis Activity Score, BVAS). В зависимости от локализации поражения признаки заболевания разделены на 9 групп (табл. 1), при расчете индекса активности суммируются максимальные значения баллов, полученные в каждой группе (суммарный индекс не превышает 63 балла). При оценке активности принимают во внимание обусловленные васкулитом симптомы, имеющиеся на момент осмотра, а также появившиеся или прогрессировавшие в течение последнего месяца [1, 8].
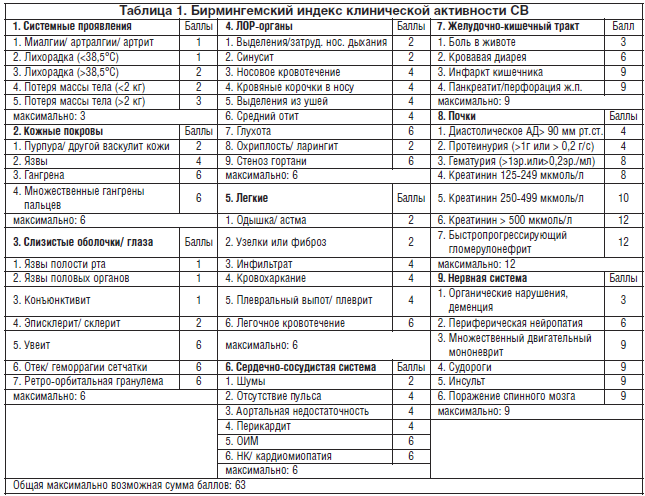
Фазы клинического течения АНЦА-СВ:
1. Активная фаза – BVAS ≤63 баллов.
2. Частичная ремиссия – уменьшение в результате проводимого лечения индекса клинической активности на 50% от исходного.
3. Полная ремиссия – 0–1 балл BVAS.
4. Умеренное обострение – появление клинических признаков заболевания с увеличением общей суммы баллов BVAS до 5.
5. Тяжелое обострение – вовлечение жизненно важных органов или систем (легких, почек, ЦНС, сердечно-сосудистой системы) с индексом активности >6 баллов, требующее активного патогенетического лечения [1, 4].
Рефрактерное течение – отсутствие обратного развития клинических проявлений заболевания или увеличение клинической активности, несмотря на проводимую в течение 6 нед. стандартную патогенетическую терапию циклофосфаном и глюкокортикоидами.
Без лечения прогноз у больных ГПА неблагоприятный, особенно при наличии поражения почек и/или легких. Интенсивная иммуносупрессивная терапия позволяет достичь ремиссии у большинства больных, однако у 40–60% из них на фоне поддерживающего лечения развиваются рецидивы ГПА, требующие повторного назначения индукционной терапии. Значительно реже заболевание приобретает молниеносное фульминантное течение с быстрым развитием угрожающих жизни осложнений, таких как легочное кровотечение, быстропрогрессирующий гломерулонефрит или острое повреждение почек.
Основная цель фармакотерапии – подавление иммунопатологических реакций, лежащих в основе заболевания для достижения полной ремиссии ГПА. Лечение подразделяют на 3 этапа:
– индукция ремиссии (короткий курс агрессивной терапии);
– поддержание ремиссии (длительная терапия иммуносупрессорами);
– лечение рецидивов [1, 8].
Основными препаратами в схеме лечения ГПА считаются цитостатические препараты, такие как циклофосфамид, метотрексат, азатиоприн, микофенолата мофетил, а также глюкокортикостероиды. Хирургическое вмешательство может потребоваться при деформации носа, стенозе гортани, обструкции слезных каналов, бронхиальном стенозе, дисфункции евстахиевых труб. План лечения каждому пациенту составляется индивидуально, в соответствии с его формой заболевания, тяжестью проявлений и реакцией на терапию. Людям с вовлечением в процесс почек и тяжелым течением болезни чаще назначают циклофосфамид и преднизолон на начальном этапе. Через 3–6 мес. циклофосфан меняют на метотрексат или азатиоприн. Пациентам с мягкими формами заболевания назначают сочетание метотрексата с преднизолоном. Постепенно дозы этих препаратов уменьшают до минимальной поддерживающей в стадии ремиссии заболевания.
В последнее время хорошо себя зарекомендовали, особенно при рефрактерном течении заболевания, генно-инженерные биологические препараты (ГИБП), в частности ритуксимаб [5, 9, 10]. Появляются сообщения об успешном применении тоцилизумаба в лечении ГПА [11].
Ритуксимаб – химерное моноклональное антитело мыши/человека, которое специфически связывается с трансмембранным антигеном CD20. Этот антиген расположен на пре-В-лимфоцитах и зрелых В-лимфоцитах, но отсутствует на стволовых гемопоэтических клетках, про-В-клетках, нормальных плазматических клетках, клетках других тканей. Экспрессированный на клетке СD20 после связывания с антителом перестает поступать с клеточной мембраны во внеклеточное пространство. CD20 не циркулирует в плазме в виде свободного антигена и поэтому не конкурирует за связывание с антителом. Ритуксимаб связывается с антигеном CD20 на В-лимфоцитах и инициирует иммунологические реакции, опосредующие лизис В-клеток. Возможные механизмы клеточного лизиса включают комплемент-зависимую цитотоксичность, антитело-зависимую клеточную цитотоксичность и индукцию апоптоза. Число В-клеток в периферической крови после первого введения препарата снижается ниже нормы и начинает восстанавливаться у пациентов с гематологическими злокачественными заболеваниями через 6 мес., достигая нормальных значений через 12 мес. после завершения терапии, однако в некоторых случаях продолжительность периода восстановления количества В-клеток может быть больше. У пациентов с гранулематозом с полиангиитом и микроскопическим полиангиитом снижение числа CD20-положительных B-клеток до уровня <10 клеток/мкл происходит после 2-х первых инфузий ритуксимаба и у большинства пациентов сохраняется на данном уровне в течение 6 мес.
Тоцилизумаб – рекомбинантное гуманизированное моноклональное антитело к человеческому рецептору ИЛ-6 из подкласса иммуноглобулинов IgG1. Тоцилизумаб селективно связывается и подавляет как растворимые, так и мембранные рецепторы ИЛ-6 (sIL-6R и mIL-6R). ИЛ-6 является многофункциональным цитокином, вырабатываемым различными типами клеток, и участвует в паракринной регуляции, системных физиологических и патологических процессах, таких как стимуляция секреции Ig, активация Т-клеток, стимуляция выработки белков острой фазы в печени и стимуляция гемопоэза. ИЛ-6 вовлечен в патогенез различных заболеваний, в т. ч. воспалительных заболеваний, остеопороза и новообразований.
Приводим случай собственного наблюдения пациента с ГПА, получавшего различную иммуносупрессивную терапию, в т. ч. с применением 2-х ГИБП: ритуксимаба и тоцилизумаба.
Пациент М., 75 лет, наблюдается в клинике факультетской терапии (ФТ) Военной медицинской академии (ВМА) с 2013 г. с диагнозом: «Гранулематоз с полиангиитом (Вегенера), АНЦА-позитивный (анти-П3) с поражением легких (очаги распада в нижней доле правого легкого, пневмофиброз), почек (нефропатия), суставов (полиартралгии), анемия, лихорадка, активность 2–3 ст. Дыхательная недостаточность 1 ст. Функциональная недостаточность суставов (ФНС) 1 ст. Хроническая болезнь почек (ХБП) С4 А3».
Считает себя больным с января 2012 г., когда впервые отметил подъемы температуры тела до 37,3–37,4°С по ночам. Вышеуказанные симптомы продолжались до апреля 2012 г. Амбулаторно выполнена компьютерная томография (КТ) органов грудной клетки (ОГК), выявлены множественные участки уплотнения легочной ткани правого легкого. С целью исключения микотической природы вышеуказанных образований консультирован микологом, исключена грибковая природа очагов в легком, рекомендовано повторное КТ-исследование легких через 3 мес. В январе 2013 г. повторно стала повышаться температура тела до 37,7–37,8°С, появились боли и отек плечевых, локтевых, коленных суставов, мелких суставов кистей. Принимал самостоятельно нестероидные противовоспалительные препараты (НПВП) с временным положительным эффектом. В апреле 2013 г. в связи с усилением болей в суставах, сохраняющейся лихорадкой госпитализирован в клинику военно-полевой терапии (ВПТ) ВМА. При обследовании выявлены протеинурия, гематурия, высокая острофазовая активность. На фоне проводимой инфузионно-метаболической терапии НПВП уменьшилась интенсивность суставного синдрома, нормализовалась температура тела. После выписки из клиники отмечался периодический подъем температуры тела до 39°С, сохранялись боли и отек вышеперечисленных суставов, появилось обильное отделяемое из носа. В мае 2013 г. очередная госпитализация в клинику ВПТ в связи с сохраняющимися миалгиями, артралгиями, субфебрильной лихорадкой. Впервые консультирован ревматологом, по рекомендации которого выполнен ряд обследований. Выявлен высокий титр цитоплазматического типа свечения АНЦА (цАНЦА) (1:1000), диагностирован АНЦА-ассоциированный васкулит. На фоне проводимой терапии (преднизолон 60 мг/сут, азатиоприн 100 мг/сут, пульс-терапия метилпреднизолоном 500 мг № 3, циклофосфамидом 600 мг однократно) достигнута положительная динамика в виде купирования лихорадки, миалгий, уменьшения общей слабости. В июле и октябре 2013 г. дважды находился на стационарном лечении в клинике ФТ для оценки активности заболевания, коррекции проводимой терапии. Проведена гистологическая верификация диагноза (гистологическое исследование кожно-мышечного лоскута: в сосочковом и сосочково-ретикулярном слое наблюдаются разволокнение, небольшой отек и слабовыраженный фиброз, периваскулярная лимфогистиоцитарная, макрофагальная и лейкоцитарная инфильтрация, очаговая пролиферация эндотелия сосудов. Заключение: вялотекущий васкулит). Назначена поддерживающая терапия эндоксаном и преднизолоном. На фоне проводимой терапии сохранялись мочевой синдром, явления почечной недостаточности. Течение васкулита было расценено как рефрактерное. Принято решение направить пациента в антицитокиновый центр СПб МАПО с целью решения вопроса о проведении биологической анти-В-клеточной терапии. В марте 2014 г. выполнены 2 введения ритуксимаба 1000 мг. В качестве поддерживающей терапии назначены азатиоприн 100 мг/сут и преднизолон 10 мг/сут. Клинически была достигнута ремиссия. В конце 2014 г. проходил стационарное обследование и лечение в нефрологическом отделении СПбГМУ им. акад. И.П. Павлова. На амбулаторном этапе по рекомендации врача отменен азатиоприн, постепенно снижалась доза преднизолона до 5 мг/сут (в июле 2015 г.).
С 1.08.2015 г. – подъем температуры до фебрильных цифр, боль в подлопаточной области справа, усиливающаяся при глубоком вдохе, сухой кашель. 3.08.2015 госпитализирован в клинику ВПТ с диагнозом: «Внебольничная пневмония», начата антибактериальная терапия. При дальнейшем обследовании по данным КТ ОГК 6.08.2015: КТ-признаки абсцессов (дренированных) нижней доли правого легкого, воспалительных изменений костальной плевры на уровне нижней доли. Вентиляционные и интерстициальные изменения в нижних долях легких. Аортокоронаросклероз. В ходе обследования очаг деструкции в легочной ткани расценен как прогрессирование системного васкулита. Показания к выполнению инвазивных дренирующих операций отсутствовали. С 14 по 31.08.2015 пациент находился в клинике ВПТ с диагнозом: «АНЦА-ассоциированный васкулит с поражением легких, почек, суставов, нервной системы, анемия, лихорадка, активность 2–3 ст. ФНС 1 ст. ХБП 4 ст.». Проведена пульс-терапия солу-медролом № 3 с последующим переходом на пероральный преднизолон 40 мг/сут. Пациенту также проводился курс антибактериальной терапии: ванкомицин 1000 мг/сут, левофлоксацин 200 мг/сут. На фоне терапии достигнута положительная динамика в виде нормализации температуры тела, снижения активности воспалительного процесса (уменьшение скорости оседания эритроцитов (СОЭ), С-реактивного белка нарастания уровня гемоглобина). Однако по данным КТ ОГК от 19.08.2015 отмечалась отрицательная динамика в виде появления жидкости в правой плевральной полости и увеличения размеров абсцессов. 21.08.2015 выполнена плевральная пункция, эвакуировано 700 мл экссудата. На контрольной КТ ОГК 24.08.2015 данных за наличие жидкости не получено. В клинике ВПТ пациент консультирован нефрологом, фтизиатром, торакальным хирургом; рекомендовано исключение туберкулезного процесса. Выполнен ряд обследований крови и смывов бронхиального дерева с целью исключения туберкулезного поражения легких, данных за туберкулез не получено.
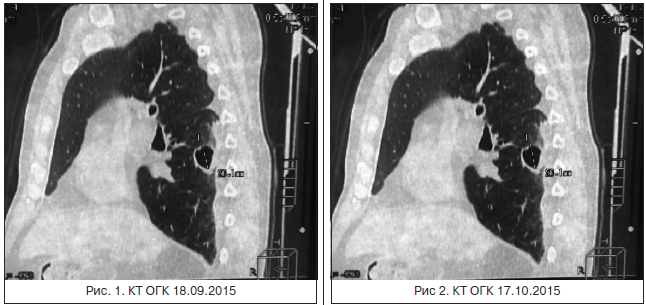
При очередном поступлении в клинику ФТ 11.11.2015 для проведения биологической терапии ритуксимабом предъявлял жалобы на общую слабость, недомогание, периодические головные боли, кровянистые корки в носу. Находился на поддерживающей терапии азатиоприном 100 мг/сут и преднизолоном 20 мг/сут. На момент поступления в клинику у пациента наблюдались умеренное отделяемое из носовых ходов, небольшое количество кровянистых корочек. На коже ногтевых фаланг 2–4 пальцев кистей умеренный отек, гиперемия, участки шелушения кожных покровов. Гипотрофия мышц верхних и нижних конечностей. Перкуторно отмечалось притупление легочного звука ниже угла лопатки справа, аускультативно – жесткое дыхание, в нижних отделах обоих легких ослабленное, единичные крепитирующие хрипы. Лабораторно в гемограмме обращала на себя внимание лейкопения (1,69х109/л), анемия легкой степени тяжести (гемоглобин – 93 г/л, полихромазия, базофильная зернистость эритроцитов), тромбоцитопения 1 степени (125х109/л), СОЭ – 46 мм/час. В биохимическом анализе крови выявлено повышение показателей азотистого обмена (креатинин – 207,2 мкмоль/л, мочевина – 16,9 ммоль/л), скорость клубочковой фильтрации – 26 мл/мин, гипопротеинемия (57,1 г/л), гипоальбуминемия (34,7 г/л). В общем анализе мочи отмечались протеинурия 0,33 г/л, минимальная лейкоцитурия, микрогематурия. С целью уточнения генеза гематологических нарушений выполнены стернальная пункция, исследование крови на антитела к тромбоцитам и лейкоцитам, данных, свидетельствующих о заболевании крови, не получено. Для оценки иммунного статуса выполнена развернутая иммунограмма: на фоне лейкопении и абсолютной лимфопении отмечается снижение абсолютного числа основных субпопуляций T- и NK-клеток. В то же время анализ процентного содержания Т-клеток свидетельствует об активации как Т-хелперов, так и Т-ЦТЛ, что проявляется ростом процента общих Т-клеток (CD3+=91,5%), цитотоксических Т-лимфоцитов (СD3+CD8+=36,8%), активированных CD25+-(CD3+CD25+=25%) и HLA-DR+-T-лимфоцитов (CD3+HLA-DR+=43%), активированных цитотоксических СD38+-T-лимфоцитов (CD3+CD8brightCD38+=22,9%). Наряду с этим наблюдается активация NK-клеток, что подтверждается увеличением процента активированных СD38+NK-клеток (CD3-CD8dimCD38+=36,5%). При оценке В-лимфоцитов выявлен выраженный вторичный В-клеточный иммунодефицит, характеризующийся резким снижением количества всех субпопуляций В-лимфоцитов. Концентрация иммуноглобулинов классов А, М, G, уровень циркулирующих иммунных комплексов в сыворотке крови – в пределах нормы. Также выполнено определение уровня интерлейкина-6 в сыворотке крови и культуре лимфоцитов: выявлена повышенная спонтанная продукция ИЛ-6 (474 пг/мл при норме 30–280 пг/мл). На контрольной КТ ОГК: в нижней доле правого легкого в S6, S10 по ходу утолщенной костальной плевры до 4 мм сохраняются 2 полостных образования, одно из них 2-камерное, неправильной формы с неровными бугристыми контурами, в динамике с уменьшением толщины стенок до 1–2 мм, размеры образований несколько увеличились до 20 х 44 х 26 мм (ранее – 18 х 45 х 21 мм), 17 х 20 х 34 мм (ранее – 14 х 18 х 28 мм). Внутренний контур фестончатый, в полости определяется газ без формирования уровней жидкостей (дренированы), к образованиям подходят субсегментарные бронхи с выраженно утолщенными стенками. Перифокальная легочная ткань несколько уплотнена. Пневматизация легочной ткани в нижних долях легких снижена по типу «матового стекла» с утолщением междольковых перегородок. В S 1/2, 6 левого легкого сохраняются очаговые уплотнения легочной ткани диаметром до 3 мм (прежними) фиброзного генеза. В остальных сегментах легких очаговые и инфильтративные изменения не выявлены. Ход и проходимость трахеи, главных, долевых, сегментарных бронхов не нарушены, стенки бронхов диффузно утолщены. Свободной жидкости в плевральных полостях нет. Внутригрудные и подмышечные лимфатические узлы не увеличены. Заключение: КТ-признаки абсцессов (дренированных) нижней доли правого легкого, воспалительных изменений костальной плевры на уровне нижней доли. Вентиляционные и интерстициальные изменения в нижних долях легких. Очаговые изменения в верхней доле левого легкого. Аортокоронаросклероз. По сравнению с данными КТ от 7.10.2015: отрицательная динамика за счет некоторого увеличения размеров полостных образований в нижней доле правого легкого.
По рекомендации торакального хирурга выполнены повторная фибробронхоскопия (ФБС) и анализ промывных вод бронхов на микобактерии туберкулеза (МБТ) (методом РТ-ПЦР – ДНК М. tub Complex не обнаружены, микроскопия люминесцентная – МБТ не выявлены). Пациенту проводились инфузионно-метаболическая терапия, терапия иммуноглобулинами: иммуноглобулин (иммуноглобулин человека нормальный) 150 мл (7,5 г) в/в капельно № 5); р-р Вессел-Дуэ-Ф 20 мл в/в капельно №10. При достижении уровня лейкоцитов 4 х 109/л назначен методжект п/к 10 мг/нед. После консультации фтизиатра по результатам КТ, ФБС и анализа промывных вод бронхов на МБТ данных, свидетельствующих о наличии туберкулеза, у пациента не получено, противопоказаний к проведению ГИБТ, в частности тоцилизумабом, не выявлено. Пациенту выполнено введение 800 мг тоцилизумаба. Инфузию перенес удовлетворительно, осложнений, побочных эффектов не было. В последующем выполнено еще 2 введения тоцилизумаба с периодичностью 1 раз/мес. На фоне терапии у пациента достигнута положительная клиническая динамика заболевания в виде уменьшения одышки, отсутствия лихорадки, снижения интенсивности суставного и кожного синдромов. Лабораторно нормализовался уровень лейкоцитов, повысился уровень показателей красной крови и тромбоцитов (при выписке эритроциты – 3,47 х 1012/л, Нв – 100 г/л, тромбоциты – 105 х 109/л, лейкоциты – 4,83 х 109/л), повысился уровень общего белка (общий белок – 72,3 г/л, альбумин – 44,5 г/л, глобулины – 27,8 г/л), показатели азотистого обмена и уровень протеинурии сохранялись прежними. Пациент выписан для продолжения лечения амбулаторно. В настоящее время пациент получает метотрексат 15 мг/нед. и преднизолон 20 мг/нед. (с планируемым постепенным снижением дозы ГКС до минимальной поддерживающей), а также тоцилизумаб 800 мг/мес.
Особенности данного клинического случая:
– поздний дебют заболевания;
– относительно благоприятное течение болезни;
– опыт успешного применения 2-х ГИБП (анти-В-клеточная терапия ритуксимабом и антагонистом ИЛ-6 тоцилизумабом);
– выраженное подавление В-клеточного иммунитета после введения мабтеры с компенсаторной гиперактивацией Т-клеточного иммунитета и гиперпродукцией ИЛ-6;
– положительный эффект от применения ингибитора ИЛ-6 тоцилизумаба у пациента с ГПА.












