В 2007 году в России был создан регистр пациентов с РА, получающих лечение препаратом ритуксимаб «АРБИТР», и были открыты 87 центров генно–инженерной биологической терапии. В апреле 2009 г. Российский регистр АРБИТР вступил в сотрудничество с Европейскими Регистрами по ритуксимабу при ревматоидном артрите (CERERRA). В настоящее время CERERRA включает 10 стран Европы (Данию, Испанию, Нидерланды, Норвегию, Словению, Финляндию, Чехию, Швейцарию, Швецию и Россию).
Целью настоящей работы было исследование терапевтического потенциала и безопасности препарата ритуксимаб в условиях реальной клинической практики по материалам Российского регистра АРБИТР.
Материалы и методы
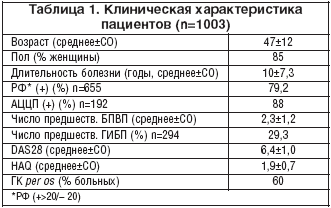
В работе представлены данные о применении РТМ у 1003 больных РА, включенных в Российский регистр АРБИТР. Их общая клиническая характеристика представлена в таблице 1. Среди больных преобладали женщины среднего возраста с высокой активностью заболевания; 79,2% были позитивными по ревматоидному фактору (РФ), у 88% определялись антитела к циклическому цитруллинированному пептиду (АЦЦП). До назначения РТМ пациенты без достаточного эффекта получали активную терапию БПВП (в среднем 2,3 препарата), 60% больных лечились глюкокортикоидами (ГК) и у 29% ранее отмечалась неэффективность или непереносимость ингибиторов ФНО–α, преимущественно инфликсимаба.
РТМ применялся в основном по классической схеме: в виде медленных внутривенных инфузий по 1000 мг в 1 и 15–й дни, с внутривенной премедикацией метилпреднизолоном (100 мг).
Всем больным проводилось стандартное клинико–лабораторное обследование, включавшее определение числа припухших (воспаленных) и болезненных суставов, СОЭ, СРБ, биохимическое исследование крови, маркеры вируса гепатитов В и С, ВИЧ.
Результаты лечения оценивались через каждые 8 недель по критериям EULAR, основным критерием эффективности проводимой терапии считался результат, полученный к 24–й неделе каждого курса. Повторные курсы лечения РТМ проводились в среднем через 7–9 месяцев.
Результаты и обсуждение
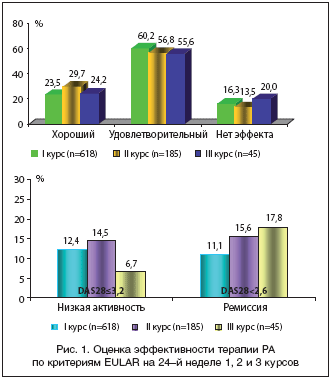
У большинства больных, получавших лечение РТМ, отмечался весьма высокий лечебный эффект (рис. 1). При оценке клинического эффекта по критериям EULAR после первого курса РТМ (через 24 нед.) хороший и удовлетворительный результат регистрировался у 83,7% пациентов, после проведения второго курса – у 86,5%, а после третьего – у 79,8% больных. Статистических различий по эффективности между курсами зарегистрировано не было. Частота развития ремиссий нарастала в зависимости от количества проведенных курсов лечения и составила после 1–го курса 11,1%, после 2–го – 15,6%, а после 3–го – 17,8% пациентов.
Большинство пациентов получали РТМ в стандартной дозе (две инфузии по 1000 мг с интервалом в две недели), у 41 больного препарат назначался по 500 мг с таким же интервалом. 396 пациентов получили два курса РТМ, 125 – 3 курса. Результаты назначения различных доз представлены на рисунке 2. Оказалось, что при использовании двух основных доз РТМ различий в клиническом эффекте трех курсов получено не было.
Возможность использовать РТМ в различных дозах оценивалось в ряде исследований – SERENE, MIRROR и IMAGE [4–6], где также было установлено, что клинический эффект доз 500 мг и 1000 мг существенно не различался. Важно отметить, что применение обеих доз препарата по сравнению с назначением плацебо обнаружило отчетливое антидеструктивное действие. Однако при использовании дозы РТМ 1000 мг рентгенологическое прогрессирование у больных ранним РА в течение 2 лет наблюдения тормозилось достоверно больше [7,8].
В настоящее время широко обсуждается вопрос относительно определения предикторов хорошего ответа на конкретный генно–инженерный биологический препарат (ГИБП). Принимая во внимание механизм действия РТМ (устранение В–клеток, которые играют важную роль в патогенезе РА), особое внимание было сосредоточено на уровне продуцируемых В–клетками аутоантител – РФ и АЦЦП, высоко специфичных для РА. В ряде предшествующих работ указывалось, что РТМ значительно более эффективен у РФ–позитивных больных по сравнению с серонегативными [9,10]. Отдельные авторы считали даже, что у РФ–негативных пациентов РТМ вообще не оказывает лечебного действия [11,12], что впоследствии не подтвердилось.
За последние годы определенно установлено, что при РФ–негативном РА РТМ также эффективен [13,14]. Это связывается с тем, что устранение В–клеток приводит не только к прекращению выработки аутоантител, но и к выключению антиген–представляющей функции этих клеток. Такой механизм действия РТМ должен проявиться независимо от наличия аутоантител. Тем не менее вопрос об особенностях терапевтического эффекта РТМ в зависимости от наличия или отсутствия аутоантител остается актуальным и до конца не решенным. Поэтому нами специально был проведен анализ оценки эффективности назначения РМТ в зависимости от наличия в сыворотке крови РФ и АЦЦП (рис. 3).
Данные анализа показали, что больные с РФ–позитивным РА достигли достоверно большего уменьшения DAS28 по сравнению с РФ–негативными пациентами к 3 и 6–му месяцам наблюдения. В эти же сроки наблюдалась тенденция к более высокой эффективности и у пациентов с АЦЦП–позитивным РА, однако достоверных различий между сравниваемыми группами у наших больных получено не было. При сравнении результатов лечения пациентов с одновременным наличием или отсутствием РФ и АЦЦП достоверно более выраженное улучшение регистрировалось у больных с наличием обоих аутоантител к 3–му месяцу терапии. Эта тенденция сохранялась и к 6–му месяцу, но степень уменьшения DAS28 в обеих группах не различалась. Возможно, это связано с более медленным развитием эффекта у серонегативных пациентов.
Очень важным является вопрос о том, когда необходимо проводить повторные курсы РТМ больным РА. Ранее считалось, что повторное назначение этого препарата показано при появлении первых признаков обострения РА («лечение по показаниям» – ЛП) и не ранее 6 месяцев после первого курса. В настоящее время, помимо этого принципа терапии, существует также другая стратегия проведения повторных курсов РТМ в соответствии с принципом «treatment to target» (TT), т.е. лечением до достижения цели, а именно клинической ремиссии. При этом подходе повторный курс РТМ назначается через 6 мес после первого курса, если к этому времени не достигнута клиническая ремиссия. Такая стратегия представляется более перспективной, поскольку она закрепляет эффект первого курса РТМ, не ожидая очередного обострения РА, и позволяет более строго контролировать активность заболевания. По данным P. Emery и соавт., частота значительного улучшения (АКР70), сохраняющегося в течение не менее 6 мес., при использовании стратегии ТТ составляла 12,3%, а стратегии ЛП – только 5,1% [15].
Наш анализ зависимости лечебного эффекта РТМ от длительности интервала между курсами назначения этого препарата на материале регистра АРБИТР подтверждает преимущества стратегии ТТ (рис. 4).
При длительности этого интервала менее 35 недель активность РА к началу 2–го курса РТМ была достоверно ниже, чем при назначении препарата через более длительный период времени.
Аналогичным образом у больных, получивших повторный курс РТМ менее чем через 28 недель после первого курса, частота обострений РА была достоверно ниже, чем у пациентов с более длительным интервалом между курсами (рис. 5), и составила 43,5 и 71% соответственно. Эта закономерность сохранялась и при проведении 3–го курса РТМ – соответствующие показатели составили 40 и 76,2%.
Результаты рандомизированных клинических исследований показали, что эффективность РТМ в лечении больных РА существенно повышается, если он применяется в комбинации с метотрексатом (МТ) [16]. Однако существует категория больных РА, у которых имеются непереносимость МТ или противопоказания к его назначению, что приводит к использованию РТМ в виде монотерапии либо в комбинации с другими БПВП, прежде всего лефлуномидом (ЛЕФ). Вопрос об эффективности такой комбинации представляется весьма актуальным.
В настоящее время накапливаются собственные данные по использованию комбинированной терапии РТМ вместе с МТ и ЛЕФ [17,18].
Среди больных Российского регистра, завершивших 24–недельный период наблюдения 1–го курса, у 404 РТМ комбинировался с МТ, у 55 – с ЛЕФ. У 90 пациентов РТМ применялся в качестве монотерапии (РТМ–моно). Для второго курса соответствующие цифры составили 128, 14 и 15 пациентов.
При оценке клинического эффекта по критериям EULAR после первого курса РТМ (через 24 нед.) в группе РТМ+МТ хороший и удовлетворительный результат был зарегистрирован у 85,4% пациентов, в группе РТМ+ЛЕФ у 85,5%, а в группе РТМ–моно у 74,4%; после проведения второго курса – у 88,3, 78,6 и 73,3% соответственно. Частота развития ремиссий составила в группе РТМ+МТ после 1–го курса лечения 11,9%, после 2–го – 13,9%, в группе РТМ+ЛЕФ 10,9% и 14,3%, а в группе РТМ–моно 6,7 и 13,3% соответственно. Статистических различий по эффективности между курсами зарегистрировано не было.
Следует отметить, что среди получавших комбинированную терапию РТМ+ЛЕФ нуждалось в проведении повторного курса РТМ в течение года достоверно меньшее число пациентов (17,1%), чем при назначении РТМ+МТ (36,9%) и РТМ–моно (36%).
Побочные эффекты встречались достоверно чаще в группе больных, получающих РТМ–моно – 46,3%, по сравнению с РТМ+МТ −31,9%, и РТМ+ЛЕФ – 28,6%. В то же время частота инфекций при комбинировании РТМ с ЛЕФ оказалась выше, чем при его сочетании с МТ (табл. 1).
Сходные данные получены J. Narvaez и соавт. [19], которые сопоставили эффективность комбинированной терапии РТМ+МТ и РТМ+ЛЕФ и не обнаружили статистически достоверных различий по эффективности и частоте побочных эффектов.
Несколько лучшие результаты комбинированного лечения РТМ+ЛЕФ были получены при анализе данных Немецкого регистра пациентов с РА, получающих терапию РТМ [20]. Было проанализировано 995 пациентов, среди которых 442 получали РТМ+МТ, 90 – РТМ+ЛЕФ и 213 – РТМ–моно. Хороший и удовлетворительный эффект (критерии EULAR) у пациентов, получавших комбинированную терапию РТМ+ЛЕФ, отмечался у 78%, РТМ+МТ – у 65%, РТМ–моно – у 61%. Частота тяжелых инфекционных осложнений составила 1,6, 1,1 и 0,5%, а инфузионных реакций – 5,1, 6,7 и 3,8% соответственно.
Таким образом, комбинация РТМ+ЛЕФ по своей эффективности и переносимости не обнаружила существенных отличий от общепризнанной и широко применяемой комбинации РТМ+МТ. Поэтому сочетание РТМ+ЛЕФ может считаться обоснованной альтернативой комбинации РТМ+МТ в тех случаях, когда она оказывается невозможной (в частности, в связи с плохой переносимостью МТ).
Комбинирование с ЛЕФ может существенно дополнить терапевтический потенциал РТМ. Последний является анти–В–клеточным препаратом, выключающим В–клеточное звено из последовательности аутоиммунных реакций при РА (представление аутоантигена, продукция аутоантител и др.). В то же время ЛЕФ свойственно отчетливое подавление пролиферации Т–клеток и нарастание в них содержания иммуносупрессорного белка р53, способного вызвать апоптоз соответствующих клеток [21]. В основе лечебного эффекта комбинации ритуксимаба и лефлуномида лежит, по–видимому, качественный синергизм этих препаратов, обеспечивающий их воздействие на обе главные популяции лимфоцитов и поэтому приводящий к более выраженному подавлению аутоиммунного ревматоидного процесса.
Одним из основных принципов современной фармакотерапии РА является раннее (в пределах 3–6 мес после появления первых симптомов болезни) назначение классических БПВП, прежде всего метотрексата [22]. При их недостаточной эффективности, а также при исходной высокой активности болезни и наличии неблагоприятных прогностических признаков обосновано применение ГИБП [23]. Ранняя активная терапия РА увеличивает шансы прервать аутоиммунный ревматоидный процесс и добиться стойкой ремиссии болезни до развития ее необратимых последствий.
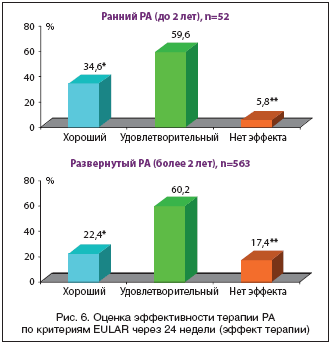
На материале Российского регистра нами был проведен сравнительный анализ эффективности РТМ у больных с ранним (длительность заболевания до 2 лет) и развернутым (длительность заболевания более 2 лет) РА. Среди больных с ранним РА 24–недельный период наблюдения завершили 52 пациента; с развернутым РА – 563. В обеих группах больные были сопоставимы по основным демографическим и клиническим параметрам. Достоверные различия наблюдались только по частоте назначения БПВП, глюкокортикоидов (ГК) и рентгенологической стадии болезни, что полностью соответствует различиям в длительности РА между пациентами сопоставляемых групп. Так, в группе больных с ранним РА количество ранее назначенных БПВП составило 1,3±0,8, а у больных с развернутой стадией РА 2,4±1,2; сопутствующая терапия ГК проводилась у 55 и 69% соответственно. В группе больных с ранним РА преобладали больные со второй рентгенологической стадией, в группе с развернутым РА – с третьей.
В результате терапии РТМ хороший и удовлетворительный эффект по критериям EULAR наблюдался при раннем РА у 94,2% пациентов, а при развернутой стадии болезни – у 82,6% (рис. 6). Более того, при раннем РА частота развития хорошего эффекта была достоверно выше и составила 34,6% по сравнению с 22,4% при развернутом РА. Частота развития ремиссий также была достоверно выше в группе больных с ранним РА и составила 20,8% по сравнению с 10,3% при развернутом РА (рис. 7).
Изучению эффективности РТМ при раннем РА было посвящено международное исследование IMAGE [6,7]. В этом исследовании была показана высокая клиническая эффективность РТМ, его тормозящее влияние на прогрессирование костной деструкции и безопасность применения у больных с ранним РА на протяжении 2 лет. Хороший и удовлетворительный эффект препарата через год наблюдения был достигнут у 86%, а через 2 года – у 92%. Развитие ремиссий (при использовании стандартной дозы препарата – 2 инфузии по 1000 мг с интервалом в 2 недели) через год регистрировалось у 31% пациентов, а через 2 года – у 32,3%.
Таким образом, накапливается собственный и международный опыт по применению РТМ у больных с ранним РА, демонстрирующий высокую клиническую эффективность и возможность стойкого торможения костной деструкции при раннем назначении анти–В–клеточной терапии.
В настоящее время накоплен также большой опыт относительно безопасности препарата РТМ в клинических исследованиях и в национальных регистрах.
R. van Vollenhoven и соавт. проанализировали результаты назначения РТМ в клинических исследованиях 3189 пациентам в течение 9 лет (9342 пациенто/лет). Более половины больных получили повторные курсы препарата (до 15 курсов). Наиболее часто при назначении РТМ встречались инфузионные реакции: после первой инфузии первого курса – 23%, после второй инфузии этого курса – 9%. В дальнейшем их частота существенно снижалась и после первой инфузии 6–го курса составила 5%, а после второй – 3%. Частота других побочных эффектов, в том числе серьезных и инфекционных, была такой же, как в общей популяции тяжелых больных РА, и в целом не нарастала при повторных курсах. Оппортунистические инфекции регистрировались редко; наблюдался один случай развития прогрессирующей мультифокальной лейкоэнцефалопатии [24].
P. Tak и соавт. у больных ранним РА отметили развитие побочных эффектов при использовании РТМ в дозе 2х1000 мг у 79% больных, в дозе 2х500 мг – у 76%, при монотерапии метотрексатом – у 81%. Частота серьезных побочных эффектов составила 10, 9 и 10% соответственно. Важно отметить, что серьезные инфекции при монотерапии метотрексатом наблюдались чаще (5%), чем при назначении РТМ в дозе 2х1000 мг (3%) и 2х500 мг (2%) [8].
По данным Французского национального регистра, частота тяжелых инфекций при использовании РТМ в реальной клинической практике была незначительно выше, чем в клинических исследованиях. Факторы риска для развития таких осложнений включали сопутствующие хронические заболевания легких и сердца, а также наличие внесуставных проявлений РА и низкий уровень иммуноглобулина G до назначения РТМ [25].
По данным Российского регистра, переносимость РТМ в целом оказалась хорошей. Среди 1003 больных побочные эффекты регистрировались у 192 (19,1%). Общее число нежелательных явлений составило 327. Серьезные побочные эффекты встретились у 31 пациента (3,1%) и явились причиной отмены препарата у 18 (1,8%). Они включали отек Квинке у 6 пациентов, выраженную крапивницу у 3, развитие сердечной недостаточности – у 2, инсульт – у 2 больных. Остальные серьезные побочные эффекты встретились однократно: острый инфаркт миокарда, тромбоэмболия легочной артерии, нефропатия, острое ощущение удушья и злокачественная опухоль. Связь перечисленных проявлений с назначением РТМ весьма вероятна для реакций, имеющих очевидную аллергическую природу (отек Квинке, крапивница, ощущение удушья), в остальных случаях такая связь не представляется убедительной. 16 из 18 рассмотренных нежелательных явлений развились после первого курса РТМ.
Инфузионные реакции отмечены у 87 больных. Наиболее часто они встречались при проведении первой инфузии первого курса – в 7,1%; после второй инфузии они развились только в 1,5% случаев. В дальнейшем частота инфузионных реакций оставалась очень низкой – в пределах 3,3–0,9%.
Инфекционные побочные эффекты имели место в 129 случаях и у большинства больных выражались в развитии острых воспалительных заболеваний верхних дыхательных путей и кожных герпетических высыпаний. Их количество после первого курса составило 93, после второго – 27 и после третьего – 9.
Таким образом, анализ материалов Российского регистра подтверждает высокую терапевтическую эффективность и хорошую переносимость РТМ при лечении РА. Количество побочных эффектов препарата относительно невелико и уменьшается при проведении повторных курсов. В условиях реальной клинической практики его назначение приводит к значительному улучшению и в части случаев к клинической ремиссии как при РФ–позитивном, так и при РФ–негативном РА. Тем не менее наличие РФ может считаться одним из предикторов положительного ответа на назначение РТМ. Результаты анти–В–клеточной терапии могут быть существенно улучшены при раннем применении РТМ и при проведении его повторных курсов до появления симптомов обострения заболевания в соответствии с современной стратегией целенаправленного лечения. Можно полагать, что дальнейшее накопление материалов регистра АРБИТР позволит еще более усовершенствовать терапию РТМ.






Литература
1. Насонов Е.Л. Новые направления в лечении ревматоидного артрита: место ритуксимаба. Consilium medicum, 2008, №2, с.7–14.
2. Насонов Е.Л., Александрова Е.Н. Применение Ритуксимаба при ревматоидном артрите:2010. Науч–практич ревматол 2010; 4(Прил.1): 10–40.
3. Smolen J.S., Keystone E.C., Emery P. et al. Consensus statement on the use of rituximab in patients with rheumatoid arthritis. Ann.Rheum.Dis., 2007, v.66, p.143–150.
4. Emery P., Deodhard A., Rigby W.F. et al. Efficacy and Safety of different dose and treatment of Rituximab: a randomized, placebo–controlled trial in patients who are biologically naive with active rheumatoid arthritis and inadequate response to methotrexate (Study Evaluating Rituximab’s Efficacy in MTX inadequate responders (SERENA)). Ann Rheum Dis 2010;69:1629–35.
5. Rubbert–Roth A., Tak P.P., Zebrini C. et al. Efficacy and safety of various repeated treatment dosing regimens in Rituximab in patients with active rheumatoid arthritis: results of a phase III randomized study (MIRROR). J.Rheumatol 2010;12 May.
6. Tak P.P., Rigby W.F., Rubbert–Roth A. Et al. Inhibition of joint damage and improved clinical outcomes with a combination of rituximab (RTX) and methotrexate (MTX) in patients (pts) with early active rheumatoid arthritis (RA) who are naive to MTX: a randomized, active comparator, placebo–controlled trial. Ann Rheum Dis 2009; 68(Supl. 3):75].
7. Tak P.P., Rigby W.F., Rubbert–Roth A. et al. Rituximab in combination with methotrexate (MTX) significantly inhibits joint damage in patients with early active RA who are naive to MTX: two–year radiographic outcomes from a randomized, active comparator, placebo–controlled trial (IMAGE). Ann Rheum Dis 2010; 69(Supl. 3):67.
8. Tak P.P., Rigby W.F., Rubbert–Roth A. et al. Inhibition of joint damage and improved clinical outcоmes with rituximab plus methotrexate in early active rheumatoid arthritis: the IMAGE trial. Ann Rheum Dis 2011;70: 39–46.)
9. Quartuccio, L., et al., Rheumatoid factor positivity rather than Anti–CCP positivity, a lower disability and a lower number of anti–TNF agents failed are associated with response to rituximab in rheumatoid arthritis. Rheumatology (Oxford), 2009. 48(12): p. 1557–9.
10. Isaacs J.D. et al. Autoantibody–positive RA patients have enhanced clinical response to rituximab when compared with seronegative patients. Ann Rheum Dis 2009;68(Suppl.3):442.
11. Edwards, J.C., M.J. Leandro, and G. Cambridge, B lymphocyte depletion therapy with rituximab in rheumatoid arthritis. Rheum Dis Clin North Am, 2004. 30(2): p. 393–403.
12. De Vita, S., et al., Effectiveness of selective B cell blockade in the treatment of rheumatoid arthritis: evidence for a pathogenetic role of B cells. Arthritis Rheum, 2002. 46(8): p. 2029–33.
13. Cohen, S.B., et al., Rituximab for rheumatoid arthritis refractory to anti–tumor necrosis factor therapy: Results of a multicenter, randomized, double–blind, placebo–controlled, phase III trial evaluating primary effectiveness and safety at twenty–four weeks. Arthritis Rheum, 2006. 54(9): p. 2793–806.
14. Emery, P., et al., The effectiveness and safety of rituximab in patients with active rheumatoid arthritis despite methotrexate treatment: results of a phase IIB randomized, double–blind, placebo–controlled, dose–ranging trial. Arthritis Rheum, 2006. 54(5): p. 1390–400.
15. Emery P., Mease P.J., Rubbert–Roth A., et al. Retreatment with rituximab based on a treatment to target approach provides better disease control than treatment as needed in patients with RA. Ann Rheum Dis 2010;69(Suppl.3):382.
16. Edwards J.C.W., Szczepanski L., Szechinski J. et al. Efficacy of B–cell–targeted therapy with rituximab in patients with rheumatoid arthritis. NewEng.J.Med., 2004, v.350, p.2572–2581.
17. Насонов Е.Л., Лукина Г.В., Я.А. Сигидин Я.А. и др. Комбинированная терапия ритуксимабом и лефлуномидом при ревматоидном артрите (предварительные результаты Российского регистра АРБИТР). Научно–практическая ревматологии.2011;1:
18. Насонов Е.Л., Лукина Г.В., Я.А. Сигидин Я.А. Перспективы комбинированной терапии ревматоидного артрита – лефлуномид и генно–инженерные биологические препараты. Клин.фарм. терап. 2011.1:
19. Narvaez J, Torne CD, Ruiz JM, et al. Comparative effectiveness of rituximab in combination with either methotrexate or leflunomide in the treatment of rheumatoid arthritis. Arthritis Rheum 2010; 62 (Suppl.): S748.
20. Wendler J., Soerensen H.,Tony H., et al. Effectiveness and safety of rituximab (RTX)–monotherapy compared to RTX–combination therapy with methotrexate (MTX) and leflunomide (LEF) in the German RTX treatment of active rheumatoid arthritis (RA) in daily practice trial. Ann Rheum Dis; 2009; 68 (suppl.3): 76.
21. Breedveld F.C., Dayer J.–M. Leflunomide: mode of action in the treatment of rheumatoid arthritis. Ann Rheum Dis 2000; 59: 841–849.
22. Ревматоидный артрит. В кн. Насонов Е.Л. (ред.). Ревматология: Клинические рекомендации. Москва, 2010, 2–е изд., с.90–231.
23. Saag K.G., Teng G.G., Patkar N.M. et al. American College of Rheumatology 2008 recommendations for the use of nonbiologic and biologic disease–modifying antirheumatic drugs in rheumatoid arthritis. Arthr.Rheum., 2008, v.59, p.762–784.).
24. Van Vollenhoven R., Emery P., Bingham C.O. et al. Long–term safety of rituximab: follow–up of the RA clinical trials and retreatment population. Ann Rheum Dis 2010, 69 (suppl.3): 66.
25. Gottenberg J.E., Ravaud P., Bardin T. еt al. Prospective follow–up of rituximab treatment in 2000 patients with refractory rheumatoid arthritis included in the AIR registry: risk factors of severe infections. Ann Rheum Dis 2010, 69 (suppl.3): 67.








.gif)



