До середины 1980–х гг. не существовало унифицированного определения ОА. Обычно его трактовали как заболевание неизвестной этиологии, при котором первично поражается хрящ (в отличие от ревматоидного артрита, при котором первично поражается синовиальная оболочка), указывали на дегенеративный характер патологического процесса. В определении ОА, предложенном на семинаре «Новые горизонты в остеоартрозе» (США, 1995 г.), проведенном American Academy of Orthopaedic Surgeons, подчеркивается, что ОА включает в себя несколько нозологий: «ОА – это группа перекрещивающихся заболеваний, которые имеют различную этиологию, но одинаковые биологические, морфологические и клинические исходы. Патологический процесс поражает не только суставной хрящ, но и распространяется на весь сустав, включая субхондральную кость, мягкие внутри– и периартикулярные ткани, связки, капсулу, синовиальную оболочку, мышцы. В конечном счете происходит дегенерация суставного хряща с его разволокнением, образованием трещин, ульцирацией и полной его потерей» [4–6].
Несмотря на то, что ОА рассматривается как системная патология хрящевых структур синовиальных суставов, отдельные, преимущественно нагрузочные суставы привлекают к себе особое внимание. К ним в первую очередь относятся коленные и тазобедренные суставы, определяющие при тяжелом поражении инвалидизацию больного. Неудивительно, что при изучении этих суставов особое значение придается ранней диагностике ОА, особенностям факторов риска развития патологии, лечению, профилактике и прогнозированию.
ОА коленного сустава (КС), гонартроз (ГА), привлекает к себе особое внимание исследователей прежде всего вследствие значительной распространенности, прогрессирующего течения с ранней инвалидизацией пациента, а также в связи с постоянством болевого синдрома, существенно нарушающего двигательную активность, способствующего развитию депрессии, что, несомненно, ухудшает качество жизни больного [7,8].
Чтобы лучше понять роль биомеханической системы КС, необходимо вспомнить особенности его анатомического строения и функции. КС состоит из трех компонентов: феморопателлярного (ПФО), латерального и медиального тибиофеморальных отделов (ТФО). Каждая из этих областей может быть отдельно поражена ОА либо возможны различные комбинации поражений. Наиболее часто встречаются изолированное поражение медиального ТФО и комбинированное поражение ПФО и медиального ТФО. В среднем медиальный ТФО поражается в 75%, латеральный ТФО – в 26%, а ПФО – в 48% случаев [9].
Потеря суставного хряща обычно наиболее выражена в ПФО и на суставной поверхности большеберцовой кости в ТФО на участке, наименее всего покрытом менисками. По данным магнитно–резонансной томографии (МРТ), наряду с поражением суставного хряща при ГА поражаются мениски. Остеофитоз наиболее выражен в латеральном ТФО, тогда как максимальную деструкцию суставного хряща обнаруживают в медиальном ТФО [10].
Диагностика ГА основана на анализе факторов риска заболевания, клинических симптомов, результатов инструментальных и лабораторных исследований.
ГА возникает вследствие взаимодействия множества генетических и средовых факторов. В немногочисленных исследованиях было установлено, что ГА чаще встречается у женщин негроидной расы, чем у представительниц европеоидной расы. Появились данные о том, что группа факторов риска ГА ПФО сустава отличается от факторов риска поражения медиального ТФО. Первый связан в большей мере с семейным анамнезом, а второй – с ожирением.
Среди многочисленных этиологических факторов развития ГА наибольшее значение придается общим конституциональным (возраст, пол, масса тела, наследственность, репродуктивные особенности) и местным неблагоприятным механическим факторам (профессия, особенности быта и др.) [1,10–14].
Наиболее частым ранним клиническим проявлением ГА является диффузная, непостоянная боль в коленном суставе, обычно возникающая сразу или после нагрузки на сустав. Боль при манифестном ГА является не столь выраженной, как при других артритах, более локальной, однако с прогрессированием болезни приобретает стойкий характер. Механизм возникновения боли при ОА до конца не изучен.
Возможные причины возникновения боли при ГА:
1. Известно, что при ОА повышается внутрикостное давление в субхондральной кости вследствие затруднения венозного оттока. Предполагают, что этот механизм ответственен за выраженный болевой синдром – длительный, возникающий в покое, ночью.
2. Нарушение биомеханики в пораженном суставе способствует развитию вторичных периартикулярных синдромов – бурситов, теносиновитов. Вовлечение в патологический процесс околосуставных тканей является частой причиной болей при ГА на ранних стадиях патологического процесса.
3. Синовит различной степени выраженности нередко сопровождает ГА, способствует усилению болей [15,16].
Боль, обусловленная воспалением, давно является предметом серьезного внимания. В настоящее время механизмы боли, обусловленной воспалением, активно изучаются. Синовит при ГА может быть субклиническим, слабым, умеренным, значительным; по распространенности – ограниченным, диффузным; иметь не только диагностическое, но и патогенетическое значение. Обнаружение медиаторов воспаления в синовиальной жидкости больных ГА, в том числе и на ранней стадии, привело к пересмотру существовавшей ранее концепции патогенеза заболевания как «неизбежного результата процесса старения суставов». Появились немногочисленные данные о том, что воспаление, возможно, играет инициирующую роль в развитии ОА [17–19].
Несмотря на бурное развитие в последние годы таких современных методов медицинской визуализации, как МРТ, рентгеновская компьютерная томография (КТ), артроскопия, расширение возможностей ультразвуковой диагностики, рентгенография остается наиболее распространенным методом диагностики и контроля эффективности лечения ОА в целом и ГА в частности. Это обусловлено доступностью данного метода, простотой исследования, экономичностью и достаточной информативностью.
В целом рентгенологическая диагностика ГА основана на выявлении сужения рентгенсуставной щели (РСЩ), остеофитов (ОФ), субхондрального склероза (СС), причем основное значение имеет степень сужения РСЩ.
Сужение РСЩ соответствует уменьшению объема суставного хряща, а СС и ОФ на краях суставных поверхностей большинство исследователей рассматривают как ответную реакцию костной ткани на увеличение механической нагрузки на сустав, что, в свою очередь, является результатом дегенеративных изменений и уменьшения в объеме суставного хряща. Перечисленное важно не только для диагностики, но и для оценки эффективности проводимого лечения и прогрессирования заболевания [1,10,20,21].
Рентгенологическое исследование КС положено в основу определения стадии ГА. Традиционно с этой целью используют классификацию Kellgren J. и Lawrence J., основанную на оценке степени выраженности сужения РСЩ, наличия ОФ и СС. К ранним рентгенологическим признакам ГА (соответствуют 0–II стадиям) по Kellgren–Lawrence относят:
• вытягивание и заострение краев межмыщелкового возвышения большеберцовой кости (в месте прикрепления крестообразной связки);
• небольшое сужение РСЩ, чаще в медиальном отделе сустава;
• заострение краев суставных поверхностей мыщелков бедренной и большеберцовой кости, чаще в медиальном отделе сустава [22].
Важным является тот факт, что для ранней диагностики ГА необходимо оценить все отделы сустава: медиальный и латеральный ТФО и медиальный и латеральный ПФО.
Применение ультразвукового исследования (УЗИ), сонографии в ревматологии – относительно новое и перспективное направление. В последнее десятилетие методика УЗИ получила широкое распространение как техника визуализации при обследовании пациентов с ревматическими заболеваниями суставов, а также контроля за лечением. Обычно артросонография (АСГ) используется для оценки патологии мягких тканей и выявления жидкости, но позволяет также визуализировать хрящ и поверхности костных структур.
Ряд несомненных достоинств – неинвазивность (в отличие от артроскопии), доступность, простота, экономичность (в сравнении с КТ и МРТ) – обеспечили методу УЗИ суставов приоритет среди других методов инструментальной визуализации опорно–двигательного аппарата. УЗИ высокоинформативно в отношении мелких деталей поверхности костей, связочно–сухожильного аппарата, позволяет выявлять и контролировать воспалительные изменения в тканях. Преимуществом УЗИ перед рентгенографией является также то, что положение датчика определяется исключительно целями, поставленными исследователем, поэтому в отличие от рентгенографии нет необходимости строгого позиционирования пациента для получения стандартных проекций.
Как известно, рентгенография в большинстве случаев позволяет определить поражение КС при вовлечении в патологический процесс элементов кости. Часто эти изменения уже необратимы, лечение таких больных затруднено. Преимуществом АСГ КС является возможность выявить ранние признаки поражения всех структур сустава, которые практически не определяются рентгенологически. Методика АСГ КС позволяет определять основные признаки патологии сустава – травматических повреждений, дегенеративно–дистрофических и воспалительных процессов. При АСГ КС в зависимости от позиционирования датчика возможна визуализация сухожилия четырехглавой мышцы бедра, контуров верхнего полюса надколенника, супрапателлярной сумки (верхнего заворота), исследование которой особенно важно для диагностики дегенеративно–дистрофических и воспалительных поражений.
При ГА в норме синовиальная оболочка не визуализируется, при наличии синовита отмечаются увеличение размеров супрапателлярной сумки, выпрямление складок, наличие избытка жидкости, утолщение синовии. УЗИ позволяет также визуализировать ПФО сустава, в частности гиалиновый хрящ, и наличие или отсутствие над ним избытка жидкости. Благодаря визуализации суставного хряща латерального и медиального мыщелков бедренной кости можно судить о степени его деградации уже на самых ранних стадиях ГА, когда рентгенологическое исследование еще не дает информации о сужении суставной щели. Обнаружение при АСГ изменений формы суставных поверхностей бедренной кости, краевых (даже самых мелких) ОФ позволяет выявить самые ранние проявления ГА на «дорентгенологической» стадии процесса. При УЗИ подколенной ямки возможна визуализация кист Бейкера [23–27].
Несмотря на высокую информативность МРТ в диагностике ранних стадий ГА, данное исследование пока не нашло широкого применения, главным образом в связи с высокой стоимостью проведения диагностической манипуляции.
Необходимо отметить, что лабораторные методы исследования малоинформативны в диагностике ОА. В большинстве случаев у больных с ОА отсутствуют изменения в анализах крови и мочи, за исключением случаев с выраженным синовитом, когда могут возникать увеличение СОЭ, гипергаммаглобулинемия, повышение уровней белков острой фазы. Исследование синовиальной жидкости значительных отличий от нормальных показателей не выявляет.
В последние годы ведется активный поиск возможных биологических маркеров (БМ) воспаления, деградации и репарации тканей суставов (главным образом, хрящевой и костной). БМ должны отражать эти динамические изменения, служить предикторами прогноза ОА и маркерами эффективности патогенетического лечения. Открытие новых и более глубокое изучение известных БМ позволит лучше понять механизмы патогенеза ОА [28,29].
Лечение ОА и ГА в том числе до сих пор остается сложной задачей. Медицинское вмешательство при ОА может быть направлено на разные стадии болезненного процесса: образование больных, физические упражнения, анальгетики, нестероидные противовоспалительные препараты (НПВП), ортопедическую хирургию. Определенный пересмотр роли НПВП в лечении ОА способствовал созданию лекарств, прямо влияющих на прогрессирование заболевания.
Рекомендации Американской коллегии ревматологов и EULAR классифицируют все препараты для лечения ОА как симптом–модифицирующие либо как структурно–модифицирующие в зависимости от их способности влиять на прогрессирование заболевания [30]. Для группы структурно–модифицирующих препаратов рекомендуется проспективная оценка рентгенологических изменений.
Эффективность при ОА ряда таких препаратов, как хондроитинсульфат (ХС) и глюкозамин (ГАм), уже доказана в многочисленных рандомизированных клинических исследованиях, проводившихся, главным образом, в период с 1984 по 2003 гг.
Благодаря доказанной эффективности ГАм и ХС в виде монотерапии появились предпосылки для создания комбинированных препаратов. Применение комбинации ХС и ГАм, по–видимому, является более перспективным. Так, на экспериментальной модели было показано, что сочетание ХС и ГАм увеличивало продукцию ГАГ хондроцитами на 96,9% по сравнению с 32% при назначении только ХС или только ГАм [31].
Исследования последних лет были направлены на изучение эффективности комбинации ХС и ГАм в лечении ОА [32–37].
В рекомендациях Общества по лечению остеоартрита OARSI дано следующее заключение по использованию ХС и ГАм в лечении ГА: лечение ГАм и/или ХС может обеспечить симптоматический эффект у больных ОА КС. При отсутствии ответа в течение 6 мес. прием этих препаратов следует прекратить (уровень доказательности Ia). У больных с симптомным ОА КС ГАм и ХС могут обладать структурно–модифицирующими эффектами (уровень доказательности Ib) [38].
Среди комбинированных препаратов наиболее широкое применение в лечении ОА нашел Терафлекс® (компания Bayer Health Care). В ранее проведенных исследованиях препарат продемонстрировал высокую эффективность в устранении симптомов ОА, главным образом ГА. Как было сказано выше, для оценки болезнь–модифицирующего влияния препарата необходимы длительные наблюдения, рентгенологический контроль структурных изменений в суставе.
В этой связи нами было проведено исследование, целью которого было оценить влияние длительной терапии Терафлексом® (3–летнее наблюдение) на темпы рентгенологического прогрессирования ГА.
Обследовано 244 амбулаторных пациента с достоверным диагнозом ГА, давших письменное согласие на участие в исследовании. Диагностика заболевания осуществлялась на основе критериев ГА Aмериканской коллегии ревматологов [39]. При отсутствии рентгенологических критериев диагноз устанавливался на основании сочетания клинических симптомов (боль механического характера, скованность в суставах <30 мин., ограничение функции) и выявленной при АСГ неровности контура суставных поверхностей костей, образующих сустав. Рентгенологическая стадия ГА оценивалась по классификации Келлгрена–Лоуренса.
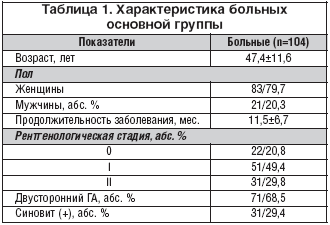
Пациенты с ГА были разделены на основную и контрольную группы. В основную группу вошли 104 пациента с ГА, которым с момента включения в исследование была начата терапия Терафлексом®: 83 (79,7%) женщины и 21 (20,3%) мужчина, средний возраст пациентов – 47,4±11,6 года, средняя длительность ГА – 11,5±6,7 мес. В соответствии с классификацией Келлгрена–Лоуренса 0 стадия ГА имела место у 22 (20,8%) больных, I – у 51 (49,4%), II – у 31 (29,8%) исследованного. Характеристика больных основной группы представлена в таблице 1. Терафлекс® назначался по 1 капсуле 3 раза/сут. на протяжении 1 мес., далее по 1 капсуле 2 раза/сут. в течение последующих 5 мес. Повторные курсы лечения Терафлексом® в дозе 2 капсулы препарата в сутки в течение 2 мес. повторяли с интервалом 1 мес. Общая длительность приема Терафлекса® на момент окончания исследования составила 3 года. При усилении болей в суставах больным разрешался прием диклофенака в суточной дозе 100 мг.
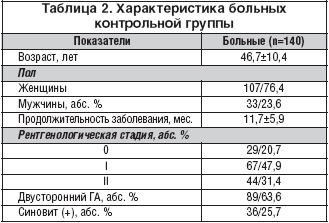
Контрольную группу составили 140 пациентов с ГА, в том числе 107 (76,4%) женщин и 33 (23,6%) мужчины, средний возраст – 46,7±10,4 года, средняя длительность ГА – 11,7±5,9 мес. В соответствии с классификацией Келлгрена–Лоуренса 0 стадия ГА имела место у 29 (20,7%) больных, I – у 67 (47,9%), II – у 44 (31,4%) исследованных. Характеристика больных контрольной группы представлена в таблице 2. Пациентам контрольной группы с момента включения в исследование был рекомендован прием 100 мг диклофенака в сутки в сочетании с различными видами физиолечения. При достижении положительного эффекта лечения диклофенак принимался лишь при усилении болей в суставах в суточной дозе 100 мг.
На момент включения в исследование основная и контрольная группы были сопоставимы по параметрам суставного синдрома.
Для оценки влияния проводимой терапии на рентгенологические показатели (степень сужения РСЩ и остеофитоз) всем больным на момент включения в исследование и в контрольные сроки наблюдения проводилась рентгенография КС в прямой, боковой и аксиальной проекциях в положении максимального разгибания колена с целью наилучшей визуализации передних отделов РСЩ, изучения латерального и медиального отделов ТФО.
1. РСЩ измерялась в наиболее суженном участке медиального отдела ТФО с использованием лупы с ценой деления 0,1 мм. Степень сужения РСЩ определялась полуколичественным методом в баллах: 0 – отсутствие сужения РСЩ; 1 балл – РСЩ 4,5–5 мм; 2 балла – РСЩ 4–4,5 мм; 3 балла – РСЩ <4 мм.
2. Выраженность остеофитоза оценивалась полуколичественным методом в баллах: 0 – ОФ отсутствуют; 1 балл – заострение суставных поверхностей; 2 балла – не более 2 мелких ОФ; 3 балла – 3 и более мелких ОФ.
Рентгенограммы оценивались одним врачом–рентгенологом.
Все вышеназванные рентгенологические показатели оценивались на момент включения в исследование и в контрольные сроки наблюдения: через 1, 2, 3 года лечения Терафлексом®. Статистическую обработку полученных данных проводили с помощью статистического пакета Statistica.
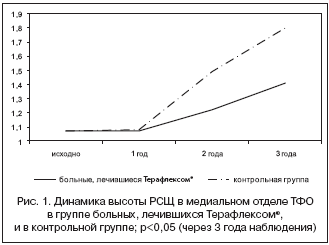
Следует отметить, что через 1 год лечения Терафлексом® отрицательная динамика высоты РСЩ практически отсутствовала. Через 2 и 3 года наблюдения различия в высоте РСЩ с исходными значениями не достигли статистической достоверности (рис. 1).
Одним из важных показателей прогрессирования структурных изменений в коленном суставе при ГА являются ОФ (увеличение их числа и размеров). По мнению ряда авторов, именно ОФ в большей степени, чем высота РСЩ, отражают отрицательную рентгенологическую динамику при ОА, и именно ОФ в большей степени ответственны за усугубление симптомов ГА [21,22].
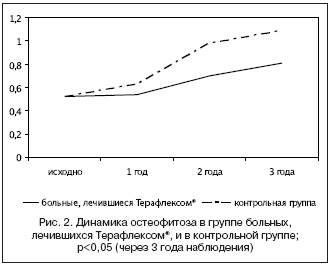
На фоне терапии Терафлексом® было выявлено незначительное прогрессирование остеофитоза через 1 год наблюдения. Через 2 и 3 года статистически значимые различия с исходными значениями этого показателя отсутствовали в группе больных, длительно лечившихся Терафлексом® (рис. 2).
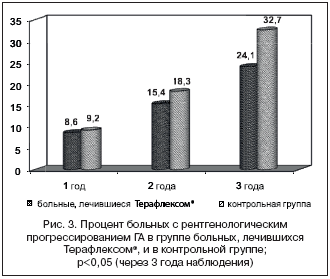
Рентгенологическое прогрессирование по Келлгрену–Лоуренсу на ≥1 рентгенологическую стадию на фоне длительной терапии Терафлексом® было констатировано у 9 (8,6%) пациентов через 1 год, у 15 (15,4%) – через 2 года, у 25 (24,1%) – через 3 года наблюдения (рис. 3).
В контрольной группе через 1 год лечения отрицательная динамика высоты РСЩ в медиальном отделе ТФО также отсутствовала. Через 2 года наблюдения значения высоты РСЩ не достигли статистической достоверности различий с исходными значениями. Однако уже через 3 года имела место статистически достоверная отрицательная динамика высоты РСЩ (р<0,05). Отрицательная динамика остеофитоза имела место через 1 и 2 года наблюдения. Через 3 года лечения были выявлены статистически значимые различия этого показателя с исходными значениями (р<0,05). В контрольной группе утяжеление рентгенологической стадии ГА было выявлено после 1 года наблюдения – у 13 (9,2%) пациентов, у 26 (18,3%) – через 2 года наблюдения, у 46 (32,7%) – через 3 года терапии (р<0,05).
Таким образом, в проведенном исследовании длительное лечение Терафлексом® оказало сдерживающее влияние на темпы прогрессирования структурных изменений в КС, что указывает на наличие у данного препарата возможного болезнь–модифицирующего эффекта. Однако дальнейшие исследования по изучению влияния Терафлекса® на течение ОА, безусловно, необходимы.
Литература
1. Алексеева Л.И. Современные представления о диагностике, лечении и профилактике остеоартроза // РМЖ. 2000. Т. 8. № 9. С. 377–382.
2. Вялков А.И., Гусев Е.И., Зборовский А.Б., Насонова В.А. Основные задачи Международной декады (The Bone and Joint Decade 2000–2010) в совершенствовании борьбы с наиболее распространенными заболеваниями опорно–двигательного аппарата в России // Научно–практич. ревматология. 2001. № 2. C. 4–11.
3. Felson D.T. Epidemiology of hip and knee osteoarthritis // Epidemical. Rev. 1988. № 10. P. 1–28.
4. Fautrel B., Hilliguin P., Rozenberg S. et al. Impact of osteoarthritis: results of nationwide survey of 10000 patients consuling for OA // Joint Bone Spine. 2005. Vol. 72. № 3. P. 235–240.
5. Jinks C., Jordan K., Croft P. Osteoarthritis as a public health problem: the impact of developing knee pain on physical function in adults living in the community: (KNEST3) // Rheumatology (Oxford). 2007. Vol. 46. № 5. P. 877–881.
6. Durmawan J., World Health Organisation – International League of Associations for Rheumatology Community Orientece Program for Control of Rheumatic Disease // Clin. Rheumatol. 2007. Vol. 26. № 6. P. 853–857.
7. Peat G., Thomas E., Duncan R. et al. Clinical classification criteria for knee osteoarthritis; performance in the general population and primary care // Ann. Rheum. Dis. 2006. № 65. P. 1363–1367.
8. Насонова В.А. Остеоартроз коленного сустава: причины развития, диагностика и профилактика // CONSILIUM MEDICUM. 2003. Т. 5. № 2. C. 46–51.
9. Felson D.T. Osteoarthritis of the knee // Clinical Practis. 2006. № 354. P. 841–848.
10. Мазуров В.И., Онущенко И.А. Остеоартроз. СПб.: МАПО, 2000.
11. Носкова А.С., Лаврухина А.А. Роль физической активности при остеоартрозе коленных суставов // Научно–практич. ревматология. 2007. № 5. C. 33–40.
12. Abel K., Reneland R., Kanamerer S. et al. Genome–wide SNP association: identification of susceptibility alleles for osteoarthritis // Autoimmun. Rev. 2006. Vol. 5. № 4. P. 258–263.
13. Englund M., Lohmander L.S. Risk factors for symptomatic knee osteoarthritis fifteen to twenty two years after meniscectomy // Arthritis Rheum. 2004. № 50. P. 2811–2819.
14. Felson D.T. Osteoarthritis new insights. Part 1: the disease and its risk factors // Ann. Intern. Med. 2000. № 133. P. 637–639.
15. Hill C.L., Hunter D.J., Niu J. et al. Changes in synovitis are associated with changes in pain in knee osteoarthritis // Digest for ours. Osteoarthritis. 2006. № 1. P. 3.
16. Цурко В.В. Остеоартроз: гериартрическая проблема // РМЖ. 2005. Т. 13. – № 24. – C. 1627–1631.
17. Benito M.J. Sinovial tissue inflammation in early and late osteoarthritis // Ann Rheum Dis. 2005. Vol. 64. № 9. P. 1263–1267.
18. Маколкин В.И. Остеоартроз коленного сустава // Тер. архив. 2005. Т. 77. № 5. C. 83–86.
19. Haywood L., Mc Williams D.F. Inflammation and angiogenesis in osteoarthritis // Arthritis Rheum. 2003. № 48. P. 2173–2177.
20. Buckland–Wright C. Review of the anatomical and radiological differences between fluoroscopic and non–fluoroscopic positioning of osteoarthritic knee / Workshop for Consensus in OA Imaging, 2005.
21. Ding C., Garnero P., Cicuttini F. et al. Knee cartilage defects: association with early radiographic osteoarthritis, decreased cartilage volume, increased joint surface area and type II collagen breakdown // Osteoarthritis and Cartilage. 2005. Vol. 13. № 3. P. 198–205.
22. Kellgren J.H., Lawrence J.S. Radiographic assessment of osteoarthritis // Ann. Rheum. Dis. 1957. № 16. P. 494–501.
23. Букина И.Е. Синовит и кисты Бейкера на ранних стадиях остеоартроза // Клин. мед. 2002. Т. 80. № 9. C. 27–30.
24. Букина И.Е., Мач Э.С., Пушкова И.Е. Возможности артросонографии для диагностики субклинического синовита у больных гонартрозом на ранних стадиях (предварительные данные) // Научно–практич. ревматология. 2002. № 2. C. 10–13.
25. Grassi W., Cervini C. Ultrasonography in rheumatology: an evolving technique // Ann. Rheum. Dis. 1998. Vol. 57. № 5. P. 268–271.
26. Hattori K., Mori K., Habata T. et al. Measurement of the mechanical condition of articular cartilage with an ultrasonic probe: quantitative evaluation using wavelet transformation // Cli. Biomech. (Bristol, Avon). 2003. № 18. P. 553–557.
27. Manger B., Kalden J.R. Joint and connective tissue ultrasonography – a rheumatologic bedside procedure? A German experience // Arthritis Rheum. 1995. № 38. P. 736–742.
28. Elliot A.L., Kraus V.B., Luta F. et al. Serum hyaluronan levels and radiographic knee and hip osteoarthritis in african americans and caucasians in the johnston county osteoarthritis project // Arthritis & Rheumatism. 2005. Vol. 52. № 1. P. 105–111.
29. Garnero P. Biochemical markers in osteoarthritis: will they measure up? // Nat. Clin. Pract. Rheumatol. 2006. Vol. 2. № 3. P. 116–117.
30. Jordan K.M., Arden N.K., Doherty M. et al. EULAR Recommendations 2003: an evidence based approach to the management of the knee osteoarthritis: Report or a Task force of the Standing Committee for International Clinical Studies Including Therapeutic Trials (ESCISI) // Ann Rheum Dis. 2003. Vol. 33. № 11. P. 2271–2279.
31. Lippielo L., Woodword J., Karpman D. et al. Beneficial effect of cartilage structure modifying agents tested in chondrocyte and rabbit instability model ostearthrosis // Arthritis Rheum. 1999. № 42. P. 256.
32. Алексеева Л.И., Чичасова Н.В., Беневоленская Л.И. и др. Комбинированный препарат “Артра” при лечении остеоартроза // Тер. архив. 2005. № 11. С. 69–75.
33. Алексеева Л.И., Чичасова Н.В., Мендель О.И. Результаты применения препарата Артра при гонартрозе // Научно–практич. ревматология. 2004. № 2. – C. 45–47.
34. Беневоленская Л.И., Алексеева Л.И., Зайцева Е.М. Эффективность препарата Терафлекс у больных с остеоартрозом коленных и тазобедренных суставов (открытое рандомизированное исследование) // Здоровье Украины. 2004. № 7. C. 40–45.
35. Елисеева Л.Н., Давыдова А.Ф., Кисьян Ж.А. Эффективность Терафлекса в лечении остеоартроза крупных суставов // Научно–практич. ревматология. 2006. № 2. C. 84.
36. Лила А.М., Мазуров В.И., Шидловская О.В., Шостак М.С. Терафлекс в комплексной терапии остеоартроза коленных суставов и остеохондроза позвоночника (результаты клинического исследования) // РМЖ. 2005. Т. 13. № 24. C. 1618–1622.
37. Маличенко С.Б., Колосова И.Р. Отчет: изучение клинической эффективности препарата Терафлекс компании «Сагмел» при суставном синдроме у женщин в физиологической и хирургической менопаузе // Здоровье Украины. 2005. № 6. C. 7–21.
38. Zhang W., Moskovitz R.W., Nuki G. et al. OARSI recommendations for the management of hip and knee osteoarthritis // Osteoarthritis and Cartilage. 2008. № 16. P. 137–162.
39. Altman R., Asch E., Bloch D. et al. Development of criteria for the classification and reporting of osteoarthritis. Classification of the arthritis of the knee // Arthritis Rheum. 1986. № 29. P. 1039–1049.












