–°–Њ–≥–ї–∞—Б–љ–Њ –Ъ–∞–љ–∞–і—Б–Ї–Њ–Љ—Г –Ї–Њ–љ—Б–µ–љ—Б—Г—Б—Г –њ–Њ –і–ї–Є—В–µ–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Э–Я–Т–Я, –Њ–Ї–Њ–ї–Њ 25% –љ–∞—Б–µ–ї–µ–љ–Є—П —Н—В–Њ–є —Б—В—А–∞–љ—Л –њ—А–Є–љ–Є–Љ–∞—О—В –Ї–Њ—А–Њ—В–Ї–Є–є –Ї—Г—А—Б —Г–Ї–∞–Ј–∞–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –∞ —Г 4% –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М —В–∞–Ї–Њ–є —В–µ—А–∞–њ–Є–Є —Б–Њ—Б—В–∞–≤–ї—П–µ—В 6 –Є –±–Њ–ї–µ–µ –Љ–µ—Б. –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –Њ–і–љ–Њ–≥–Њ –≥–Њ–і–∞ [1]. –Э–Я–Т–Я —П–≤–ї—П—О—В—Б—П —Б—А–µ–і—Б—В–≤–Њ–Љ –≤—Л–±–Њ—А–∞ –і–ї—П —Б—В–∞—А—В–Њ–≤–Њ–є —В–µ—А–∞–њ–Є–Є –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –љ–∞—Е–Њ–і—П—Й–Є—Е—Б—П –≤ –њ–Њ–ї–µ –Ј—А–µ–љ–Є—П –≤—А–∞—З–∞–—А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–∞, –Є —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П –Ї–∞–Ї –Њ—Б–љ–Њ–≤–љ—Л–µ —Б–Є–Љ–њ—В–Њ–Љ––Љ–Њ–і–Є—Д–Є—Ж–Є—А—Г—О—Й–Є–µ —Б—А–µ–і—Б—В–≤–∞. –Ю–љ–Є —В–∞–Ї–ґ–µ —И–Є—А–Њ–Ї–Њ –њ—А–Є–Љ–µ–љ—П—О—В—Б—П –і–ї—П –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є—П –±–Њ–ї–µ–≤—Л—Е —Б–Є–љ–і—А–Њ–Љ–Њ–≤ —А–∞–Ј–ї–Є—З–љ–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–Є, –≤–Ї–ї—О—З–∞—П —В—П–ґ–µ–ї—Л–µ –њ—А–Є—Б—В—Г–њ—Л –Љ–Є–≥—А–µ–љ–Є, –Њ–ї–Є–≥–Њ–Љ–µ–љ–Њ—А–µ—О, –њ–Њ—З–µ—З–љ—Г—О –Є –ґ–µ–ї—З–љ—Г—О –Ї–Њ–ї–Є–Ї—Г –Є —В.–і., –њ—А–Є —Н—В–Њ–Љ –Є—Е –∞–љ–∞–ї—М–≥–µ—В–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В –њ—А–µ–≤–Њ—Б—Е–Њ–і–Є—В –Є–ї–Є –Њ–Ї–∞–Ј—Л–≤–∞–µ—В—Б—П –њ–Њ –Љ–µ–љ—М—И–µ–є –Љ–µ—А–µ –љ–µ —Б–ї–∞–±–µ–µ —Н—Д—Д–µ–Ї—В–∞ –Љ–љ–Њ–≥–Є—Е –њ—А–Њ—Б—В—Л—Е –Є –Њ–њ–Є–Њ–Є–і–љ—Л—Е –∞–љ–∞–ї—М–≥–µ—В–Є–Ї–Њ–≤.
–Я—А–Є –љ–µ–Ї–Њ—В–Њ—А—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —Н—В–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–µ –Њ–≥—А–∞–љ–Є—З–Є–≤–∞–µ—В—Б—П —В–Њ–ї—М–Ї–Њ –њ–Њ–і–∞–≤–ї–µ–љ–Є–µ–Љ —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П, —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ –±–Њ–ї–Є –Є –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–µ–є –Є–ї–Є —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–Љ —Г–ї—Г—З—И–µ–љ–Є–µ–Љ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П –Њ–њ–Њ—А–љ–Њ––і–≤–Є–≥–∞—В–µ–ї—М–љ–Њ–≥–Њ –∞–њ–њ–∞—А–∞—В–∞. –Ґ–∞–Ї, –њ—А–Є –∞–љ–Ї–Є–ї–Њ–Ј–Є—А—Г—О—Й–µ–Љ —Б–њ–Њ–љ–і–Є–ї–Є—В–µ –Э–Я–Т–Я –њ—А–Є –Є—Е –і–ї–Є—В–µ–ї—М–љ–Њ–Љ –љ–µ–њ—А–µ—А—Л–≤–љ–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —Б–њ–Њ—Б–Њ–±–љ—Л —Б–љ–Є–Ј–Є—В—М —В–µ–Љ–њ—Л —А–µ–љ—В–≥–µ–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П [2], —З—В–Њ –љ–µ —Г–і–∞–µ—В—Б—П –і–Њ—Б—В–Є–≥–љ—Г—В—М –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ–Љ –±–∞–Ј–Є—Б–љ—Л—Е –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Є –≥–µ–љ–љ–Њ––Є–љ–ґ–µ–љ–µ—А–љ—Л—Е –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –Я—А–Є –Њ—Б—В–µ–Њ–∞—А—В—А–Њ–Ј–µ –Њ–љ–Є –Њ—В–ї–Є—З–∞—О—В—Б—П –Љ–љ–Њ–≥–Њ–њ–ї–∞–љ–Њ–≤—Л–Љ –і–µ–є—Б—В–≤–Є–µ–Љ. –С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –Є–Ј –љ–Є—Е, –≤–Ї–ї—О—З–∞—П —Б–∞–ї–Є—Ж–Є–ї–∞—В—Л, –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї, –љ–∞–њ—А–Њ–Ї—Б–µ–љ –Є –Є–љ–і–Њ–Љ–µ—В–∞—Ж–Є–љ, —В–Њ—А–Љ–Њ–Ј—П—В –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —Е–Њ–љ–і—А–Њ—Ж–Є—В–Њ–≤ –Є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—В –Є—Е –њ—А–µ–ґ–і–µ–≤—А–µ–Љ–µ–љ–љ–Њ–є –≥–Є–±–µ–ї–Є, —Б–љ–Є–ґ–∞—О—В —Б–Є–љ—В–µ–Ј –њ—А–Њ—В–µ–Њ–≥–ї–Є–Ї–∞–љ–Њ–≤, –Ї–Њ–ї–ї–∞–≥–µ–љ–∞ II —В–Є–њ–∞ –Є –≥–Є–∞–ї—Г—А–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –Є —Г—Б–Є–ї–Є–≤–∞—О—В –і–µ–≥–µ–љ–µ—А–∞—Ж–Є—О —Е—А—П—Й–∞. –Я–Є—А–Њ–Ї—Б–Є–Ї–∞–Љ –Є –Є–±—Г–њ—А–Њ—Д–µ–љ –љ–µ –≤–ї–Є—П—О—В –љ–∞ –∞–љ–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—Ж–µ—Б—Б—Л –≤ —Е—А—П—Й–µ–≤–Њ–є —В–Ї–∞–љ–Є, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –∞—Ж–µ–Ї–ї–Њ—Д–µ–љ–∞–Ї, –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ, –Ї–µ—В–Њ–њ—А–Њ—Д–µ–љ –Є –љ–Є–Љ–µ—Б—Г–ї–Є–і –і–Њ–Ј–Њ–Ј–∞–≤–Є—Б–Є–Љ–Њ —Б—В–Є–Љ—Г–ї–Є—А—Г—О—В —Б–Є–љ—В–µ–Ј –Љ–∞—В—А–Є–Ї—Б–∞ —Е—А—П—Й–∞ [3,4].
–Я—А–Є –Є–Ј—Г—З–µ–љ–Є–Є –≤–ї–Є—П–љ–Є—П 3––љ–µ–і–µ–ї—М–љ–Њ–≥–Њ –њ—А–Є–µ–Љ–∞ –љ–Є–Љ–µ—Б—Г–ї–Є–і–∞ –љ–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П –Њ—Б—В–µ–Њ–∞—А—В—А–Њ–Ј–∞, –∞ —В–∞–Ї–ґ–µ —Б–Є–љ—В–µ–Ј –Њ–ї–Є–≥–Њ–Љ–µ—А–љ–Њ–≥–Њ –Љ–∞—В—А–Є–Ї—Б–љ–Њ–≥–Њ –њ—А–Њ—В–µ–Є–љ–∞ (–°–Ю–Ь–†) – –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞ –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –Љ–∞—В—А–Є–Ї—Б–∞ —Е—А—П—Й–∞ –Є —Н–Ї—Б–њ—А–µ—Б—Б–Є—О –Љ–∞—В—А–Є–Ї—Б–љ—Л—Е –Љ–µ—В–∞–ї–ї–Њ–њ—А–Њ—В–µ–Є–љ–∞–Ј (–Ь–Ь–†), —П–≤–ї—П—О—Й–Є—Е—Б—П –≤–∞–ґ–љ—Л–Љ–Є —Д–µ—А–Љ–µ–љ—В–∞–Љ–Є –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –њ—А–Њ—В–µ–Њ–ї–Є–Ј–∞ —Е—А—П—Й–∞, –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –љ–∞—А—П–і—Г —Б –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В–Є –±–Њ–ї–Є –≤ —Б—Г—Б—В–∞–≤–∞—Е –Є —Г–ї—Г—З—И–µ–љ–Є–µ–Љ –Є—Е —Д—Г–љ–Ї—Ж–Є–Є –љ–∞–±–ї—О–і–∞–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Ь–Ь–†–3, –Ь–Ь–†–8 –Є –°–Ю–Ь–† –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є, —З—В–Њ —Г–Ї–∞–Ј—Л–≤–∞–µ—В –љ–∞ –њ–Њ–Ј–Є—В–Є–≤–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ –љ–∞ –Ї–∞—В–∞–±–Њ–ї–Є–Ј–Љ —Е—А—П—Й–∞ [5].
–Ъ–ї–∞—Б—Б –Э–Я–Т–Я –≤–Ї–ї—О—З–∞–µ—В –±–Њ–ї—М—И–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ —А–∞–Ј–ї–Є—З–∞—О—В—Б—П –њ–Њ –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –∞–љ—В–Є–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є –Є –∞–љ–∞–ї—М–≥–µ—В–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є, –њ—Г—В—П–Љ –≤–≤–µ–і–µ–љ–Є—П –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ, –Њ–±–ї–∞—Б—В–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П, —Б–њ–µ–Ї—В—А—Г –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є (–Э–ѓ) –Є –Ї–∞—В–µ–≥–Њ—А–Є–Є –Є–љ–≥–Є–±–Є—Ж–Є–Є —Ж–Є–Ї–ї–Њ–Њ–Ї—Б–Є–≥–µ–љ–∞–Ј—Л (–¶–Ю–У). –Я–Њ –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –Є–љ–≥–Є–±–Є—Ж–Є–Є –і–≤—Г—Е –Є–Ј–Њ—Д–Њ—А–Љ –¶–Ю–У –≤—Б–µ –Э–Я–Т–Я –њ–Њ–і—А–∞–Ј–і–µ–ї—П—О—В—Б—П –љ–∞ –њ—А–µ–њ–∞—А–∞—В—Л —Б –Є–Ј–±–Є—А–∞—В–µ–ї—М–љ—Л–Љ —В–Њ—А–Љ–Њ–ґ–µ–љ–Є–µ–Љ –¶–Ю–У–1 –Є–ї–Є –¶–Ю–У–2 (–љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ –Є —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ). –Я–Њ–ї–∞–≥–∞—О—В, —З—В–Њ –Э–Я–Т–Я –≤ –±–Њ–ї—М—И–µ–є —Б—В–µ–њ–µ–љ–Є —А–∞–Ј–ї–Є—З–∞—О—В—Б—П –Љ–µ–ґ–і—Г —Б–Њ–±–Њ–є –њ–Њ —Б–≤–Њ–µ–є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є, —З–µ–Љ –њ–Њ —Б–≤–Њ–µ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є. –Ю–љ–Є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—В —А–∞–Ј–≤–Є—В–Є—О –≥–∞—Б—В—А–Њ–Є–љ—В–µ—Б—В–Є–љ–∞–ї—М–љ—Л—Е, –њ–Њ—З–µ—З–љ—Л—Е, –њ–µ—З–µ–љ–Њ—З–љ—Л—Е, –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л—Е, –∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Є—Е –Є –і—А—Г–≥–Є—Е —А–µ–∞–Ї—Ж–Є–є, –Ї–Њ—В–Њ—А—Л–µ –≤—Б—В—А–µ—З–∞—О—В—Б—П —Г 12–19% –±–Њ–ї—М–љ—Л—Е (–Њ—В –і–Њ–≤–Њ–ї—М–љ–Њ –ї–µ–≥–Ї–Є—Е –і–Њ –љ–µ—Б–Њ–≤–Љ–µ—Б—В–Є–Љ—Л—Е —Б –ґ–Є–Ј–љ—М—О).
–Ю—Б–љ–Њ–≤–љ—Л–Љ–Є –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞–Љ–Є –і–µ–є—Б—В–≤–Є—П –Э–Я–Т–Я —П–≤–ї—П—О—В—Б—П –Є–љ–≥–Є–±–Є—Ж–Є—П —Б–Є–љ—В–µ–Ј–∞ –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –Я–У–Х2, —В–Њ—А–Љ–Њ–ґ–µ–љ–Є–µ –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є—П –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–є –∞—А–∞—Е–Є–і–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л, –Є–љ–≥–Є–±–Є—Ж–Є—П —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –¶–Ю–У–1 –Є –¶–Ю–У–2 –≤ –Ї—А–Њ–≤–Є –Є —В–Ї–∞–љ—П—Е, –≤–Ї–ї—О—З–∞—П –њ–Њ–і–∞–≤–ї–µ–љ–Є–µ –¶–Ю–У–2 –≤ –Ј–∞–і–љ–Є—Е —А–Њ–≥–∞—Е —Б–њ–Є–љ–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –Є –¶–Э–°, —Г–≥–љ–µ—В–µ–љ–Є–µ —Б–Є–љ—В–µ–Ј–∞ –ї–µ–є–Ї–Њ—В—А–Є–µ–љ–Њ–≤ [6]. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Њ–љ–Є –Є–љ–≥–Є–±–Є—А—Г–µ—В –Ш–Ы–1β, –Ш–Ы–6, –§–Э–Ю–α, –њ–Њ–і–∞–≤–ї—П—О—В –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є–µ –ї–Є–Ј–Њ—Б–Њ–Љ–∞–ї—М–љ—Л—Е —Д–µ—А–Љ–µ–љ—В–Њ–≤, —Б–љ–Є–ґ–∞—О—В —Н–Ї—Б–њ—А–µ—Б—Б–Є—О –Љ–Њ–ї–µ–Ї—Г–ї –∞–і–≥–µ–Ј–Є–Є (L–—Б–µ–ї–µ–Ї—В–Є–љ, VCAM–1), –њ–Њ–і–∞–≤–ї—П—О—В –њ—А–Њ–і—Г–Ї—Ж–Є—О –Њ–Ї—Б–Є–і–∞ –∞–Ј–Њ—В–∞, –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г—О—В —Б–≤–Њ–є—Б—В–≤–∞ –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–Њ–≤, –≤–Њ–Ј–і–µ–є—Б—В–≤—Г—О—В –љ–∞ —Б–≤–Њ–±–Њ–і–љ—Л–µ —А–∞–і–Є–Ї–∞–ї—Л, —В–Њ—А–Љ–Њ–Ј—П—В –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є—О —Б–Є–љ–Њ–≤–Є–Њ—Ж–Є—В–Њ–≤. –Э–µ–Ї–Њ—В–Њ—А—Л–µ –Э–Я–Т–Я —Б—В–Є–Љ—Г–ї–Є—А—Г—О—В —Б–Є–љ—В–µ–Ј –њ—А–Њ—В–µ–Њ–≥–ї–Є–Ї–∞–љ–Њ–≤ –Є –≥–Є–∞–ї—Г—А–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л, —Г—Б—В—А–∞–љ—П—О—В —В–Њ—А–Љ–Њ–ґ–µ–љ–Є–µ —Б–Є–љ—В–µ–Ј–∞ –≥–ї—О–Ї–Њ–Ј–∞–Љ–Є–љ–Њ–≥–ї–Є–Ї–∞–љ–Њ–≤ –Ш–Ы–1, —Г–≥–љ–µ—В–∞—О—В —Н–Ї—Б–њ—А–µ—Б—Б–Є—О –Љ–µ—В–∞–ї–ї–Њ–њ—А–Њ—В–µ–Є–љ–∞–Ј (–Ь–Ь–Я–1, –Ь–Ь–Я–3), —З—В–Њ –Є–Љ–µ–µ—В –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –њ—А–Є –ї–µ—З–µ–љ–Є–Є –Њ—Б—В–µ–Њ–∞—А—В—А–Њ–Ј–∞.
–Э–Є–Љ–µ—Б—Г–ї–Є–і —П–≤–ї—П–µ—В—Б—П —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–Љ –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–Љ –¶–Ю–У–2, –њ—А–Є—З–µ–Љ –≤ —Н—В–Њ–Љ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Њ–љ –њ—А–µ–≤–Њ—Б—Е–Њ–і–Є—В –Љ–љ–Њ–≥–Є–µ –і—А—Г–≥–Є–µ —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ –Э–Я–Т–Я, –љ–∞–њ—А–Є–Љ–µ—А –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ. –Ю–љ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤—Г–µ—В –љ–∞ —В—Г –Є–Ј–Њ—Д–Њ—А–Љ—Г —Ж–Є–Ї–ї–Њ–Њ–Ї—Б–Є–≥–µ–љ–∞–Ј—Л, –Ї–Њ—В–Њ—А–∞—П —Н–Ї—Б–њ—А–µ—Б—Б–Є—А—Г–µ—В—Б—П –њ—А–Є –≤–Њ—Б–њ–∞–ї–µ–љ–Є–Є, –њ—А–Є —Н—В–Њ–Љ –≤ –Љ–µ–љ—М—И–µ–є —Б—В–µ–њ–µ–љ–Є –≤–ї–Є—П–µ—В –љ–∞ –љ–Њ—А–Љ–∞–ї—М–љ—Л–µ —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—Ж–µ—Б—Б—Л, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ—Л–µ –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–∞–Љ–Є (—В–∞–±–ї. 1). –≠—В–Њ –Њ–њ—А–µ–і–µ–ї—П–µ—В –µ–≥–Њ –±–Њ–ї–µ–µ –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–є –њ—А–Њ—Д–Є–ї—М –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є, —З–µ–Љ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л—Е –Э–Я–Т–Я, —З—В–Њ –Є–Љ–µ–µ—В –±–Њ–ї—М—И–Њ–µ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ. –Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –≤ –≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–∞—Е –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ (–Ц–Ъ–Ґ) –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –Э–Я–Т–Я —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П –≤ —Б—А–µ–і–љ–µ–Љ –≤ 4 —А–∞–Ј–∞, –∞ —П–Ј–≤ – –≤ 5 —А–∞–Ј [7]. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ –Є–љ–≥–Є–±–Є—В–Њ—А—Л –¶–Ю–У–2 –∞—Б—Б–Њ—Ж–Є–Є—А—Г—О—В—Б—П —Б –Љ–µ–љ—М—И–Є–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ–Љ —Н–љ–і–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Є—Е —П–Ј–≤ –Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –≤ –Ц–Ъ–Ґ (–љ–∞ 59–61%) –Є —А–µ–ґ–µ –њ–Њ–і–≤–µ—А–≥–∞—О—В—Б—П –Њ—В–Љ–µ–љ–µ –≤ —Б–Є–ї—Г —Б–µ—А—М–µ–Ј–љ—Л—Е –Э–ѓ –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л–Љ–Є –Э–Я–Т–Я [1].
–Э–µ–Љ–µ–љ—М—И–µ–µ –Ј–љ–∞—З–µ–љ–Є–µ –Є–Љ–µ—О—В –Э–ѓ —Б–Њ —Б—В–Њ—А–Њ–љ—Л –љ–Є–ґ–љ–Є—Е –Њ—В–і–µ–ї–Њ–≤ –Ц–Ъ–Ґ, –Њ –Ї–Њ—В–Њ—А—Л—Е –Љ–µ–љ–µ–µ –Є–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ —Б–≤—П–Ј–∞–љ–Њ —Б —В—А—Г–і–љ–Њ—Б—В—П–Љ–Є –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Ї–Є—И–µ—З–љ–Є–Ї–∞. –Э–Я–Т–Я–—Н–љ—В–µ—А–Њ–њ–∞—В–Є—П –≤—Б—В—А–µ—З–∞–µ—В—Б—П —Г 77% –±–Њ–ї—М–љ—Л—Е, –і–ї–Є—В–µ–ї—М–љ–Њ –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –њ—А–µ–њ–∞—А–∞—В—Л —Н—В–Њ–є –≥—А—Г–њ–њ—Л. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –≤ –њ—А–µ–Њ–±–ї–∞–і–∞—О—Й–µ–Љ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ (87%) —Б—А–µ–і–Є –њ—А–Є—З–Є–љ –Ї–Є—И–µ—З–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П —Д–Є–≥—Г—А–Є—А—Г—О—В –Э–Я–Т–Я [7]. –Я–Њ—А–∞–ґ–µ–љ–Є–µ —В–Њ–љ–Ї–Њ–≥–Њ –Є —В–Њ–ї—Б—В–Њ–≥–Њ –Ї–Є—И–µ—З–љ–Є–Ї–∞ –њ—А–Њ—П–≤–ї—П–µ—В—Б—П –Њ—В–µ–Ї–Њ–Љ, —Н—А–Њ–Ј–Є—П–Љ–Є, —П–Ј–≤–∞–Љ–Є, —Б—В—А–Є–Ї—В—Г—А–∞–Љ–Є, –њ–µ—А—Д–Њ—А–∞—Ж–Є–µ–є –Є –њ–µ–љ–µ—В—А–∞—Ж–Є–µ–є, –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–µ–Љ, –∞–љ–µ–Љ–Є–µ–є, –і–Є—Б–њ–µ–њ—Б–Є–µ–є –Ї–Є—И–µ—З–љ–Є–Ї–∞, –Ї–Њ–ї–ї–∞–≥–µ–љ–Њ–≤—Л–Љ –Є–ї–Є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є–Љ –Ї–Њ–ї–Є—В–Њ–Љ, —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ —А–∞–Ј–і—А–∞–ґ–µ–љ–љ–Њ–є –Ї–Є—И–Ї–Є. Allison —Б —Б–Њ–∞–≤—В. [8] –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —Б–µ—А–Є–Є –∞—Г—В–Њ–њ—Б–Є–є –Њ–±–љ–∞—А—Г–ґ–Є–ї–Є —П–Ј–≤—Л –≤ —В–Њ–љ–Ї–Њ–є –Ї–Є—И–Ї–µ —Г 8,4% –±–Њ–ї—М–љ—Л—Е, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –Э–Я–Т–Я, –Є —В–Њ–ї—М–Ї–Њ –≤ 0,6% —Б–ї—Г—З–∞–µ–≤ – –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ, —Г –ї–Є—Ж, –љ–µ –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –і–∞–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л. –Я–Њ–Ј–ґ–µ –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ—А–Є–µ–Љ —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –¶–Ю–У–2 —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –Љ–µ–љ—М—И–Є–Љ —А–Є—Б–Ї–Њ–Љ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —Б–Њ —Б—В–Њ—А–Њ–љ—Л –љ–µ —В–Њ–ї—М–Ї–Њ –≤–µ—А—Е–љ–Є—Е, –љ–Њ –Є –љ–Є–ґ–љ–Є—Е –Њ—В–і–µ–ї–Њ–≤ –Ц–Ъ–Ґ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ—А–Є–µ–Љ–Њ–Љ —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л—Е –Э–Я–Т–Я.
–Э–Я–Т–Я —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—В—Б—П –Є –љ–µ—Д—А–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М—О. –Т–Њ–Ј–Љ–Њ–ґ–љ—Л —А–∞–Ј–≤–Є—В–Є–µ –∞–љ–∞–ї—М–≥–µ—В–Є—З–µ—Б–Ї–Њ–є –љ–µ—Д—А–Њ–њ–∞—В–Є–Є, –Є–љ—В–µ—А—Б—В–Є—Ж–Є–∞–ї—М–љ–Њ–≥–Њ –љ–µ—Д—А–Є—В–∞, –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–Њ–љ–Є–Є, –≥–Є–њ–µ—А–Ї–∞–ї–Є–µ–Љ–Є–Є, —Б–љ–Є–ґ–µ–љ–Є–µ –Ї–ї—Г–±–Њ—З–Ї–Њ–≤–Њ–є —Д–Є–ї—М—В—А–∞—Ж–Є–Є, –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Љ–Њ—З–µ–≤–Є–љ—Л –Є –Ї—А–µ–∞—В–Є–љ–Є–љ–∞. –Ю—Б—В—А–∞—П –њ–Њ—З–µ—З–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П —Г 0,5% –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –њ—А–Є–љ–Є–Љ–∞—О—В –Э–Я–Т–Я –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є 1,5 –Љ–µ—Б. [9], –њ—А–Є —Н—В–Њ–Љ —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –Љ–µ–љ—М—И–µ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—В —А–∞–Ј–≤–Є—В–Є—О —Н—В–Њ–≥–Њ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П.
–Я–µ—З–µ–љ—М —В–∞–Ї–ґ–µ —Г—П–Ј–≤–Є–Љ–∞ –њ—А–Є –њ—А–Є–µ–Љ–µ –Э–Я–Т–Я. –Т–Њ–Ј–Љ–Њ–ґ–љ—Л —В—А–∞–љ–Ј–Є—В–Њ—А–љ–Њ–µ –њ–Њ–≤—Л—И–µ–љ–Є–µ —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ—Л—Е –∞–Љ–Є–љ–Њ—В—А–∞–љ—Б—Д–µ—А–∞–Ј, –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ—Л–є –≥–µ–њ–∞—В–Є—В —Б —Г–Љ–µ—А–µ–љ–љ–Њ–є –њ–µ—З–µ–љ–Њ—З–љ–Њ––Ї–ї–µ—В–Њ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О, —Д—Г–ї–Љ–Є–љ–∞–љ—В–љ—Л–є –≥–µ–њ–∞—В–Є—В. –У–µ–њ–∞—В–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М –њ—А–Є—Б—Г—Й–∞ –≤—Б–µ–Љ –Э–Я–Т–Я, –љ–Њ –≤ –±–Њ–ї—М—И–µ–є —Б—В–µ–њ–µ–љ–Є – —Б—Г–ї–Є–љ–і–∞–Ї—Г, –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї—Г –Є —А–Њ—Д–µ–Ї–Њ–Ї—Б–Є–±—Г, –∞ —В–∞–Ї–ґ–µ –љ–Є–Љ–µ—Б—Г–ї–Є–і—Г, —Е–Њ—В—П —Н—В–Њ –Љ–љ–µ–љ–Є–µ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В—Б—П —Б–њ–Њ—А–љ—Л–Љ. –Я–Њ –і–∞–љ–љ—Л–Љ —Б–Њ–ї–Є–і–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –≤ –Ї–Њ—В–Њ—А–Њ–Љ –њ—А–Њ–≤–µ–і–µ–љ –∞–љ–∞–ї–Є–Ј 397 537 –±–Њ–ї—М–љ—Л—Е, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –Э–Я–Т–Я, –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М, —З—В–Њ —З–∞—Й–µ –≤—Б–µ–≥–Њ –≥–µ–њ–∞—В–Њ—Ж–µ–ї–ї—О–ї—П—А–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М –љ–∞–±–ї—О–і–∞–ї–∞—Б—М –њ—А–Є –њ—А–Є–µ–Љ–µ —Д–ї—Г—А–±–Є–њ—А–Њ—Д–µ–љ–∞, –Є–±—Г–њ—А–Њ—Д–µ–љ–∞ –Є –Ї–µ—В–Њ—А–Њ–ї–∞–Ї–∞ (97,8, 44,6 –Є 33,4 —Б–ї—Г—З–∞—П –љ–∞ 100 000 –њ–∞—Ж–Є–µ–љ—В–Њ––ї–µ—В —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ), –і–ї—П –љ–Є–Љ–µ—Б—Г–ї–Є–і–∞ —Н—В–Њ—В –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М —Б–Њ—Б—В–∞–≤–Є–ї 33,1 [10].
–Ф–ї—П –Э–Я–Т–Я —Е–∞—А–∞–Ї—В–µ—А–љ—Л –Є –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П. –І–∞—Й–µ –≤—Б–µ–≥–Њ –љ–∞–±–ї—О–і–∞—О—В—Б—П –њ–Њ–≤—Л—И–µ–љ–Є–µ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П (–Ї–∞–Ї —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ, —В–∞–Ї –Є –і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ), –љ–µ—Б—В–∞–±–Є–ї—М–љ–∞—П —Б—В–µ–љ–Њ–Ї–∞—А–і–Є—П, –Є–љ—Д–∞—А–Ї—В –Љ–Є–Њ–Ї–∞—А–і–∞, –∞ —В–∞–Ї–ґ–µ –љ–∞—А—Г—И–µ–љ–Є–µ –Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П, –≤ –Њ—Б–љ–Њ–≤–µ –Ї–Њ—В–Њ—А—Л—Е –ї–µ–ґ–∞—В —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П. –Х–і–Є–љ—Б—В–≤–µ–љ–љ—Л–Љ –Ї–∞—А–і–Є–Њ–Ј–∞—Й–Є—В–љ—Л–Љ –Э–Я–Т–Я —П–≤–ї—П–µ—В—Б—П –∞—Ж–µ—В–Є–ї—Б–∞–ї–Є—Ж–Є–ї–Њ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞. –Т–Њ –Љ–љ–Њ–≥–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —А–Є—Б–Ї –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є (–≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞) –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –¶–Ю–У–2 –≤—Л—И–µ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ–ї–∞—Ж–µ–±–Њ, –љ–Њ —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ —Б–Њ —Б—В–∞–љ–і–∞—А—В–љ—Л–Љ–Є –Э–Я–Т–Я [11].
–Ю–і–љ–∞–Ї–Њ –≤ –љ–µ–Ї–Њ—В–Њ—А—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –љ–µ –і–Њ–Ї–∞–Ј–∞–љ–∞ –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–∞—П –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–∞—П —В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –¶–Ю–У–2. –Ґ–∞–Ї, –≤ –њ—А–Њ–≥—А–∞–Љ–Љ–µ MEDAL, –Њ—Б–љ–Њ–≤–∞–љ–љ–Њ–є –љ–∞ –Є–Ј—Г—З–µ–љ–Є–Є 34 000 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–µ–≤–Љ–∞—В–Њ–Є–і–љ—Л–Љ –∞—А—В—А–Є—В–Њ–Љ –Є –Њ—Б—В–µ–Њ–∞—А—В—А–Њ–Ј–Њ–Љ, –≤—Л—Б–Њ–Ї–Њ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–є (—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–є) –Є–љ–≥–Є–±–Є—В–Њ—А –¶–Ю–У–2 —Н—В–Њ—А–Є–Ї–Њ–Ї—Б–Є–± –Є –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї –њ–Њ–Ї–∞–Ј–∞–ї–Є —Б—А–∞–≤–љ–Є–Љ—Г—О —З–∞—Б—В–Њ—В—Г —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –њ—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ–Љ –њ—А–Є–µ–Љ–µ (–≤ —Б—А–µ–і–љ–µ–Љ 18 –Љ–µ—Б.) [12].
–Э–Є–Љ–µ—Б—Г–ї–Є–і (–Э–∞–є–Ј –Є –і—А.) – —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–є –Є–љ–≥–Є–±–Є—В–Њ—А –¶–Ю–У–2. –Ю–љ —П–≤–ї—П–µ—В—Б—П 4––љ–Є—В—А–Њ–2—Д–µ–љ–Њ–Ї—Б–Є–Љ–µ—В–∞–љ–—Б—Г–ї—М—Д–Њ–љ–∞–ї–Є–і–Њ–Љ –Є –≤—Л–њ—Г—Б–Ї–∞–µ—В—Б—П –≤ –≤–Є–і–µ —В–∞–±–ї–µ—В–Њ–Ї, –≥—А–∞–љ—Г–ї, —Б—Г—Б–њ–µ–љ–Ј–Є–Є –Є –≥–µ–ї—П. –Ф–Њ—Б—В–Є–ґ–µ–љ–Є–µ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞ –љ–∞–±–ї—О–і–∞–µ—В—Б—П –Њ—Б–Њ–±–µ–љ–љ–Њ –±—Л—Б—В—А–Њ (—З–µ—А–µ–Ј 2 —З) –њ—А–Є –њ—А–Є–µ–Љ–µ –≥—А–∞–љ—Г–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є —Д–Њ—А–Љ—Л –Є —Б—Г—Б–њ–µ–љ–Ј–Є–Є (1,22–2 —З). –°—В–∞–±–Є–ї—М–љ—Л–є —Г—А–Њ–≤–µ–љ—М –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –і–µ—А–ґ–Є—В—Б—П –≤ —В–µ—З–µ–љ–Є–µ 24–48 —З –њ—А–Є –µ–ґ–µ–і–љ–µ–≤–љ–Њ–Љ –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–Љ –њ—А–Є–µ–Љ–µ 2 —А–∞–Ј–∞/—Б—Г—В. [13]. –°—А–µ–і–љ–Є–є –њ–µ—А–Є–Њ–і –њ–Њ–ї—Г–≤—Л–≤–µ–і–µ–љ–Є—П –≤–∞—А—М–Є—А—Г–µ—В—Б—П –Њ—В 1,80 –і–Њ 4,73 —З.
–С–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Н—Д—Д–µ–Ї—В—Л –љ–Є–Љ–µ—Б—Г–ї–Є–і–∞ –≤–Њ –Љ–љ–Њ–≥–Њ–Љ —Б—Е–Њ–ґ–Є —Б —Н—Д—Д–µ–Ї—В–∞–Љ–Є –і—А—Г–≥–Є—Е —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Э–Я–Т–Я. –Ю–љ —П–≤–ї—П–µ—В—Б—П –Ї–Њ–љ–Ї—Г—А–µ–љ—В–Њ–Љ –Є–љ–≥–Є–±–Є—В–Њ—А–∞ –¶–Ю–У–2 –Є —В–Њ—А–Љ–Њ–Ј–Є—В —Б–Є–љ—В–µ–Ј –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤ –≤ –Њ—З–∞–≥–µ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П. –£–≥–љ–µ—В–∞—О—Й–µ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –¶–Ю–У–1 –Љ–µ–љ–µ–µ –≤—Л—А–∞–ґ–µ–љ–Њ. –Я—А–µ–њ–∞—А–∞—В –ї–µ–≥–Ї–Њ —Б–≤—П–Ј—Л–≤–∞–µ—В—Б—П —Б –±–µ–ї–Ї–∞–Љ–Є –њ–ї–∞–Ј–Љ—Л (99%) –Є –њ—А–Њ–љ–Є–Ї–∞–µ—В –≤–Њ –≤—Б–µ —В–Ї–∞–љ–Є –Њ—А–≥–∞–љ–Є–Ј–Љ–∞, –±—Л—Б—В—А–Њ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–µ –Є –∞–љ–∞–ї—М–≥–µ—В–Є—З–µ—Б–Ї–Њ–µ –і–µ–є—Б—В–≤–Є–µ, –њ—А–Є—З–µ–Љ –≤ —В–Ї–∞–љ—П—Е —Б—Г—Б—В–∞–≤–∞ –Њ–љ –љ–∞–Ї–∞–њ–ї–Є–≤–∞–µ—В—Б—П –≤ –±–Њ–ї—М—И–µ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є, —З–µ–Љ –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є.
–Э–Є–Љ–µ—Б—Г–ї–Є–і –Є–љ–і—Г—Ж–Є—А—Г–µ—В –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–µ —Д–Њ—Б—Д–Њ—А–Є–ї–Є—А–Њ–≤–∞–љ–Є–µ –Є –∞–Ї—В–Є–≤–∞—Ж–Є—О –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–љ—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤, –∞ —В–∞–Ї–ґ–µ –∞–Ї—В–Є–≤–Є—А—Г–µ—В –Є—Е —Б–≤—П–Ј—Л–≤–∞–љ–Є–µ —Б –≥–µ–љ–∞–Љ–Є––Љ–Є—И–µ–љ—П–Љ–Є, —З—В–Њ –њ–Њ–≤—Л—И–∞–µ—В —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ї —Н–љ–і–Њ–≥–µ–љ–љ—Л–Љ –Є —Н–Ї–Ј–Њ–≥–µ–љ–љ—Л–Љ –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–∞–Љ. –°—А–µ–і–Є –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ–Љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –і–µ–є—Б—В–≤–Є—П –љ–Є–Љ–µ—Б—Г–ї–Є–і–∞ –Є–Љ–µ–µ—В –Ј–љ–∞—З–µ–љ–Є–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ —Б–Є–љ—В–µ–Ј —Д–∞–Ї—В–Њ—А–Њ–≤ –∞–Ї—В–Є–≤–∞—Ж–Є–Є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤, —Б–Є–љ—В–µ–Ј –ї–µ–є–Ї–Њ—В—А–Є–µ–љ–∞ –Т4, –∞–Ї—В–Є–≤–∞—Ж–Є—О –Є–љ—В–µ–≥—А–Є–љ–∞, –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —Н–ї–∞—Б—В–∞–Ј—Л, –Ї–Њ–ї–ї–∞–≥–µ–љ–∞–Ј—Л –Є —Б—В—А–Њ–Љ–µ–ї–Є–Ј–Є–љ–∞, —Н–Ї—Б–њ—А–µ—Б—Б–Є—О –Ш–Ы–6 –Є —Г—А–Њ–Ї–Є–љ–∞–Ј—Л, –∞ —В–∞–Ї–ґ–µ —Б–Є–љ—В–µ–Ј –Є–љ–≥–Є–±–Є—В–Њ—А–∞ –∞–Ї—В–Є–≤–∞—В–Њ—А–∞ –њ–ї–∞–Ј–Љ–Є–љ–Њ–≥–µ–љ–∞ –Є –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є–µ –≥–Є—Б—В–∞–Љ–Є–љ–∞ –±–∞–Ј–Њ—Д–Є–ї–∞–Љ–Є –Є —В—Г—З–љ—Л–Љ–Є –Ї–ї–µ—В–Ї–∞–Љ–Є [13,14]. –Э–Є–Љ–µ—Б—Г–ї–Є–і –Є–Љ–µ–µ—В –Ї–Њ—А–Њ—В–Ї–Є–є –њ–µ—А–Є–Њ–і –њ–Њ–ї—Г–≤—Л–≤–µ–і–µ–љ–Є—П –Є –љ–µ –Њ–±–ї–∞–і–∞–µ—В —В–µ–љ–і–µ–љ—Ж–Є–µ–є –Ї –Ї—Г–Љ—Г–ї—П—Ж–Є–Є. –Ю–љ –њ—А–Є–≥–Њ–і–µ–љ –і–ї—П –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є, —Г –Ї–Њ—В–Њ—А—Л—Е, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –љ–∞–±–ї—О–і–∞–µ—В—Б—П —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–µ —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–µ–µ —В–µ—З–µ–љ–Є–µ –±–Њ–ї–µ–Ј–љ–Є.
–Э–Є–Љ–µ—Б—Г–ї–Є–і—Г –њ—А–Є—Б—Г—Й —П—А–Ї–Њ –≤—Л—А–∞–ґ–µ–љ–љ—Л–є –Є –±—Л—Б—В—А–Њ –љ–∞—Б—В—Г–њ–∞—О—Й–Є–є –∞–љ–∞–ї—М–≥–µ—В–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В. –≠—В–Њ –і–µ–є—Б—В–≤–Є–µ —Б–≤—П–Ј–∞–љ–Њ –≤ –±–Њ–ї—М—И–µ–є —Б—В–µ–њ–µ–љ–Є —Б –Є–љ–≥–Є–±–Є—Ж–Є–µ–є –¶–Ю–У–2 –Є —А–µ–∞–ї–Є–Ј—Г–µ—В—Б—П –љ–∞ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–Љ —Г—А–Њ–≤–љ–µ –Ј–∞ —Б—З–µ—В –±–ї–Њ–Ї–∞–і—Л —Б–Є–љ—В–µ–Ј–∞ –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –∞–Ї—В–Є–≤–Є—А—Г—О—В –±–Њ–ї–µ–≤—Л–µ —А–µ—Ж–µ–њ—В–Њ—А—Л. –¶–µ–љ—В—А–∞–ї—М–љ—Л–є –Љ–µ—Е–∞–љ–Є–Ј–Љ –Љ–µ–љ–µ–µ –Ј–љ–∞—З–Є–Љ, –љ–Њ —В–∞–Ї–ґ–µ —Б–≤—П–Ј–∞–љ —Б —Г–≥–љ–µ—В–µ–љ–Є–µ–Љ —Б–Є–љ—В–µ–Ј–∞ –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –Њ–±—А–∞–Ј—Г—О—В—Б—П –≤ –¶–Э–° –Є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—В —Г—Б–Є–ї–µ–љ–Є—О –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–≥–љ–∞–ї–∞. –Т –Њ—В–љ–Њ—И–µ–љ–Є–Є –љ–Њ—Ж–Є—Ж–µ–њ—В–Є–≤–љ–Њ–є –±–Њ–ї–Є, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є –Њ—Б—В—А–Њ–є –±–Њ–ї–Є –≤ —Б–њ–Є–љ–µ –Є–ї–Є –Њ—Б—В—А–Њ–≥–Њ –њ—А–Є—Б—В—Г–њ–∞ –њ–Њ–і–∞–≥—А—Л, –∞–љ–∞–ї—М–≥–µ–Ј–Є—А—Г—О—Й–Є–µ —Н—Д—Д–µ–Ї—В—Л –љ–Є–Љ–µ—Б—Г–ї–Є–і–∞ —Б–ї–µ–і—Г–µ—В —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М –Ї–∞–Ї –љ–∞–Є–±–Њ–ї–µ–µ –∞–і–µ–Ї–≤–∞—В–љ–Њ–µ —А–µ—И–µ–љ–Є–µ –њ—А–Њ–±–ї–µ–Љ—Л [15].
–Э–Є–Љ–µ—Б—Г–ї–Є–і –Њ–±–ї–∞–і–∞–µ—В –≤—Л—Б–Њ–Ї–Є–Љ –∞–љ—В–Є–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ –њ–Њ—В–µ–љ—Ж–Є–∞–ї–Њ–Љ. –Я–Њ —Б–≤–Њ–µ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є 200 –Љ–≥/—Б—Г—В. –љ–Є–Љ–µ—Б—Г–ї–Є–і–∞ –Ї–∞–Ї –Љ–Є–љ–Є–Љ—Г–Љ –љ–µ —Б–ї–∞–±–µ–µ, —З–µ–Љ –Њ–±—Л—З–љ—Л–µ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–µ –і–Њ–Ј—Л –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї–∞, –њ–Є—А–Њ–Ї—Б–Є–Ї–∞–Љ–∞, —Н—В–Њ–і–Њ–ї–∞–Ї–∞, –Є–±—Г–њ—А–Њ—Д–µ–љ–∞, –Ї–µ—В–Њ–њ—А–Њ—Д–µ–љ–∞. –Я–Њ –і–∞–љ–љ—Л–Љ —А–Њ—Б—Б–Є–є—Б–Ї–Њ–≥–Њ –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤–Њ–≥–Њ 4––љ–µ–і–µ–ї—М–љ–Њ–≥–Њ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –љ–Є–Љ–µ—Б—Г–ї–Є–і (200 –Є 400 –Љ–≥) –њ—А–Є —А–∞–љ–љ–µ–Љ —А–µ–≤–Љ–∞—В–Њ–Є–і–љ–Њ–Љ –∞—А—В—А–Є—В–µ (n=228) –Њ–Ї–∞–Ј–∞–ї—Б—П —Б—А–∞–≤–љ–Є–Љ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–µ–љ —Б –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї–Њ–Љ –њ–Њ –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є—О –±–Њ–ї–Є –Є —Б–љ–Є–ґ–µ–љ–Є—О —З–Є—Б–ї–∞ –≤–Њ—Б–њ–∞–ї–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤ [16]. –≠—В–Є –і–∞–љ–љ—Л–µ –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В –±–Њ–ї—М—И–Њ–є –Є–љ—В–µ—А–µ—Б, —В.–Ї. —А–∞–љ–љ—П—П —Б—В–∞–і–Є—П —А–µ–≤–Љ–∞—В–Њ–Є–і–љ–Њ–≥–Њ –∞—А—В—А–Є—В–∞, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –Њ—Б–Њ–±–µ–љ–љ–Њ –≤—Л—Б–Њ–Ї–Њ–є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О. –І—В–Њ –Ї–∞—Б–∞–µ—В—Б—П –Њ—Б—В–µ–Њ–∞—А—В—А–Њ–Ј–∞, —В–Њ –Є–Љ–µ—О—В—Б—П –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л–µ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–µ –Ї–Њ–љ—В—А–Њ–ї–Є—А–Њ–≤–∞–љ–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –≤ –Ї–Њ—В–Њ—А—Л—Е —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –љ–Є–Љ–µ—Б—Г–ї–Є–і–∞ –љ–µ —Г—Б—В—Г–њ–∞–ї–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л—Е –Э–Я–Т–Я. –Ґ–∞–Ї, –њ—А–Є –Є–Ј—Г—З–µ–љ–Є–Є 370 –±–Њ–ї—М–љ—Л—Е –Њ—Б—В–µ–Њ–∞—А—В—А–Њ–Ј–Њ–Љ, –Ї–Њ—В–Њ—А—Л–µ –≤ —В–µ—З–µ–љ–Є–µ 6 –Љ–µ—Б. –њ—А–Є–љ–Є–Љ–∞–ї–Є –љ–Є–Љ–µ—Б—Г–ї–Є–і –Є–ї–Є –љ–∞–њ—А–Њ–Ї—Б–µ–љ, –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М, —З—В–Њ –Њ–љ–Є –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –Њ–і–Є–љ–∞–Ї–Њ–≤–Њ —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞–ї–Є —Б–љ–Є–ґ–µ–љ–Є—О –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В–Є –±–Њ–ї–Є, —А–∞–Ј—А–µ—И–µ–љ–Є—О —Б–Є–љ–Њ–≤–Є—В–∞ –Є –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П —Б—Г—Б—В–∞–≤–Њ–≤ [17].
–Э–Є–Љ–µ—Б—Г–ї–Є–і —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П —Е–Њ—А–Њ—И–µ–є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М—О. –≠—В–Њ –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –Њ—В–љ–Њ—Б–Є—В—Б—П –Ї –≥–∞—Б—В—А–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В–Є. –Р–љ–∞–ї–Є–Ј 10 608 —Б–ї—Г—З–∞–µ–≤ –Э–ѓ –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –Э–Я–Т–Я –њ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –њ–Њ–њ—Г–ї—П—Ж–Є–Њ–љ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї, —З—В–Њ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–µ —А–µ–∞–Ї—Ж–Є–Є —Б–Њ —Б—В–Њ—А–Њ–љ—Л –Ц–Ъ–Ґ –њ—А–Є –њ—А–Є–µ–Љ–µ –љ–Є–Љ–µ—Б—Г–ї–Є–і–∞ —А–∞–Ј–≤–Є–≤–∞–ї–Є—Б—М –≤ 10,4% —Б–ї—Г—З–∞–µ–≤, –∞ –њ—А–Є –њ—А–Є–µ–Љ–µ –њ–Є—А–Њ–Ї—Б–Є–Ї–∞–Љ–∞, –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї–∞ –Є –Ї–µ—В–Њ–њ—А–Њ—Д–µ–љ–∞ – –њ–Њ—З—В–Є –≤ 2 —А–∞–Ј–∞ —З–∞—Й–µ [18]. –Т –і—А—Г–≥–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є, –≤ –Ї–Њ—В–Њ—А–Њ–Љ —Б—А–∞–≤–љ–Є–≤–∞–ї–Є –Э–ѓ —Б–Њ —Б—В–Њ—А–Њ–љ—Л –Ц–Ъ–Ґ –њ—А–Є –њ—А–Є–µ–Љ–µ –љ–Є–Љ–µ—Б—Г–ї–Є–і–∞ –Є –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї–∞, –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –≤–Њ –≤—А–µ–Љ—П –њ—А–Є–µ–Љ–∞ –љ–Є–Љ–µ—Б—Г–ї–Є–і–∞ –Њ–љ–Є –±—Л–ї–Є –Ј–∞—Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ—Л —Г 8% –±–Њ–ї—М–љ—Л—Е, –∞ –≤–Њ –≤—А–µ–Љ—П –њ—А–Є–µ–Љ–∞ –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї–∞ – —Г 12,1% [19].
–Т –ї–Є—В–µ—А–∞—В—Г—А–µ —И–Є—А–Њ–Ї–Њ –Њ–±—Б—Г–ґ–і–∞–µ—В—Б—П –≤–Њ–њ—А–Њ—Б –Њ –≥–µ–њ–∞—В–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В–Є –љ–Є–Љ–µ—Б—Г–ї–Є–і–∞. –Ъ–∞–Ї –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –≤—Л—И–µ, –≥–µ–њ–∞—В–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М –њ—А–Є—Б—Г—Й–∞ –≤—Б–µ–Љ—Г –Ї–ї–∞—Б—Б—Г –Э–Я–Т–Я. –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –≥–µ–њ–∞—В–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є—Е —А–µ–∞–Ї—Ж–Є–є –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –љ–Є–Љ–µ—Б—Г–ї–Є–і–∞ –љ–µ –±–Њ–ї—М—И–µ, —З–µ–Љ —Г —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л—Е –Э–Я–Т–Я [10]. –Ю–љ–Є, –љ–µ—Б–Њ–Љ–љ–µ–љ–љ–Њ, –≤–Њ–Ј–Љ–Њ–ґ–љ—Л, –љ–Њ —А–∞–Ј–≤–Є–≤–∞—О—В—Б—П –Ї—А–∞–є–љ–µ —А–µ–і–Ї–Њ, –∞ —Б–µ—А—М–µ–Ј–љ—Л–µ —А–µ–∞–Ї—Ж–Є–Є –≤–Њ–Ј–љ–Є–Ї–∞—О—В —Г 1 –Є–Ј 10 000 –±–Њ–ї—М–љ—Л—Е, –њ—А–Є —Н—В–Њ–Љ —Б—Г–Љ–Љ–∞—А–љ–∞—П —З–∞—Б—В–Њ—В–∞ –њ–Њ–і–Њ–±–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —Б–Њ—Б—В–∞–≤–ї—П–µ—В –≤—Б–µ–≥–Њ 0,0001%. –Я—А–Њ–≤–µ–і–µ–љ–љ—Л–є –њ–Њ–і —Н–≥–Є–і–Њ–є –Ю–±—Й–µ–µ–≤—А–Њ–њ–µ–є—Б–Ї–Њ–≥–Њ –Њ—А–≥–∞–љ–∞ –њ–Њ –љ–∞–і–Ј–Њ—А—Г –Ј–∞ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–Љ–Є —Б—А–µ–і—Б—В–≤–∞–Љ–Є –∞–љ–∞–ї–Є–Ј –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –љ–Є–Љ–µ—Б—Г–ї–Є–і–∞ –њ–Њ–Ј–≤–Њ–ї–Є–ї —Б–і–µ–ї–∞—В—М –≤—Л–≤–Њ–і, —З—В–Њ –≥–µ–њ–∞—В–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М –і–∞–љ–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –љ–µ –≤—Л—И–µ, —З–µ–Љ —Г –і—А—Г–≥–Є—Е –Э–Я–Т–Я [20].
–Т –Ш–љ—Б—В–Є—В—Г—В–µ —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є–Є –†–Р–Ь–Э –њ—А–Њ–≤–µ–і–µ–љ —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л–є –∞–љ–∞–ї–Є–Ј –Є—Б—В–Њ—А–Є–є –±–Њ–ї–µ–Ј–љ–Є 322 –±–Њ–ї—М–љ—Л—Е, –і–ї–Є—В–µ–ї—М–љ–Њ –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –љ–Є–Љ–µ—Б—Г–ї–Є–і –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б —Ж–Є—В–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є. –Ф–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М —В–∞–Ї–Њ–є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є —Б–Њ—Б—В–∞–≤–Є–ї–∞ 12 –Є –±–Њ–ї–µ–µ –Љ–µ—Б. –Т —Н—В–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –љ–µ –±—Л–ї–Њ –Ј–∞—Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–Њ —Н–њ–Є–Ј–Њ–і–Њ–≤ –ґ–µ–ї—В—Г—Е–Є, —Г–≤–µ–ї–Є—З–µ–љ–Є—П –њ–µ—З–µ–љ–Є –Є–ї–Є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–Є –њ–µ—З–µ–љ–Њ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є. –Ч–љ–∞—З–Є–Љ–Њ–µ –њ–Њ–≤—Л—И–µ–љ–Є–µ —В—А–∞–љ—Б–∞–Љ–Є–љ–∞–Ј –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М —Г 7 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (2,2%). –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П —Б–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –≤ —А–µ–∞–ї—М–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –љ–Є–Љ–µ—Б—Г–ї–Є–і —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В —В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М –Љ–µ—В–Њ—В—А–µ–Ї—Б–∞—В–∞ –Є —Г—Б–Є–ї–Є–≤–∞–µ—В –і–µ–є—Б—В–≤–Є–µ —Ж–Є–Ї–ї–Њ—Б–њ–Њ—А–Є–љ–∞, –Ї–∞–Ї —Н—В–Њ –љ–∞–±–ї—О–і–∞–µ—В—Б—П –Є –њ—А–Є –ї–µ—З–µ–љ–Є–Є –і—А—Г–≥–Є–Љ–Є –Э–Я–Т–Я.
–•–Њ—В—П –љ–Є–Љ–µ—Б—Г–ї–Є–і –њ–µ—А–µ–љ–Њ—Б–Є—В—Б—П –ї—Г—З—И–µ, —З–µ–Љ –Љ–љ–Њ–≥–Є–µ –Э–Я–Т–Я, –њ—А–Є –µ–≥–Њ –і–ї–Є—В–µ–ї—М–љ–Њ–Љ –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –Љ–Њ–ґ–µ—В —А–∞–Ј–≤–Є—В—М—Б—П –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–∞—П –љ–µ–њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М. –°–љ–Є–ґ–µ–љ–Є–µ —Б–њ–µ–Ї—В—А–∞ –Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –Э–ѓ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –њ—Г—В–µ–Љ —Г–Љ–µ–љ—М—И–µ–љ–Є—П –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П –Є –і–Њ–Ј—Л, —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –Ј–∞—Й–Є—В–Њ–є —Б–ї–Є–Ј–Є—Б—В–Њ–є –ґ–µ–ї—Г–і–Ї–∞ –Є 12––њ–µ—А—Б—В–љ–Њ–є –Ї–Є—И–Ї–Є, –≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є –њ—А–Њ—В–Њ–љ–љ–Њ–є –њ–Њ–Љ–њ—Л, —В—Й–∞—В–µ–ї—М–љ—Л–Љ —Г—З–µ—В–Њ–Љ —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є—Е –Є –Ї–Њ–Љ–Њ—А–±–Є–і–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –Ї–Њ–љ—В—А–Њ–ї–µ–Љ –Ј–∞ –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–є —В–µ—А–∞–њ–Є–µ–є —Б–Њ —Б–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ—Л–Љ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ–Љ –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є.
–Ю–і–љ–Є–Љ –Є–Ј —Б–њ–Њ—Б–Њ–±–Њ–≤ —Г–Љ–µ–љ—М—И–µ–љ–Є—П –≤–µ—А–Њ—П—В–љ–Њ—Б—В–Є —А–∞–Ј–≤–Є—В–Є—П –Э–ѓ —П–≤–ї—П–µ—В—Б—П –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –ї–Њ–Ї–∞–ї—М–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ —В–µ—А–∞–њ–Є–Є, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є –Э–Я–Т–Я–—Б–Њ–і–µ—А–ґ–∞—Й–Є—Е –Љ–∞–Ј–µ–є, –Ї—А–µ–Љ–Њ–≤ –Є–ї–Є –≥–µ–ї–µ–є. –Э–∞—А—Г–ґ–љ—Л–µ —Д–Њ—А–Љ—Л –Э–Я–Т–Я, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –±–Њ–ї–µ–µ –±–µ–Ј–Њ–њ–∞—Б–љ—Л –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —В–∞–±–ї–µ—В–Є—А–Њ–≤–∞–љ–љ—Л–Љ–Є –Є–ї–Є –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ—Л–Љ–Є, —В.–Ї. –њ—А–Є —Н—В–Њ–Љ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –љ–∞–Љ–љ–Њ–≥–Њ –љ–Є–ґ–µ, —З–µ–Љ –њ—А–Є —Б–Є—Б—В–µ–Љ–љ–Њ–Љ –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є [21].
–Ь–µ—Б—В–љ–∞—П (–ї–Њ–Ї–∞–ї—М–љ–∞—П) —В–µ—А–∞–њ–Є—П –Э–Я–Т–Я –њ–Њ–Ј–≤–Њ–ї—П–µ—В –і–Њ—Б—В–Є–≥–љ—Г—В—М —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л—Е –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–є –њ—А–µ–њ–∞—А–∞—В–∞ –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –≤ –Љ–µ—Б—В–µ –µ–≥–Њ –∞–њ–њ–ї–Є–Ї–∞—Ж–Є–Є, –њ–Њ—А–Њ–є –љ–∞–Љ–љ–Њ–≥–Њ –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є—Е, —З–µ–Љ –њ—А–Є –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–Љ –Є–ї–Є –≤–љ—Г—В—А–Є–Љ—Л—И–µ—З–љ–Њ–Љ –µ–≥–Њ –≤–≤–µ–і–µ–љ–Є–Є. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Љ–∞–Ј–µ–є –Є –≥–µ–ї–µ–є –њ—А–Є–≤–Њ–і–Є—В –Ї —Б–љ–Є–ґ–µ–љ–Є—О –і–Њ–Ј—Л –Э–Я–Т–Я, –њ—А–Є–љ–Є–Љ–∞–µ–Љ—Л—Е —Б–Є—Б—В–µ–Љ–љ–Њ, –њ—А–Є —Н—В–Њ–Љ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –Њ–±—Й–Є–є –Ї—А–Њ–≤–Њ—В–Њ–Ї –Є, —Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, –µ–≥–Њ –љ–∞–Ї–Њ–њ–ї–µ–љ–Є–µ –≤ –Њ—А–≥–∞–љ–∞—Е, —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л—Е –Ї –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ–Љ—Г –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—О –Э–Я–Т–Я. –Ґ–∞–Ї–∞—П —В–µ—А–∞–њ–Є—П —П–≤–ї—П–µ—В—Б—П —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–Љ –і–Њ–њ–Њ–ї–љ–µ–љ–Є–µ–Љ –Ї —Б–Є—Б—В–µ–Љ–љ–Њ –љ–∞–Ј–љ–∞—З–∞–µ–Љ—Л–Љ –Э–Я–Т–Я –Є –Њ–і–љ–Є–Љ –Є–Ј –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є —А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–Є—Е—Б—П –±–Њ–ї—М—О –Є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ –њ—А–Њ—Ж–µ—Б—Б–Њ–Љ –≤ —Б—Г—Б—В–∞–≤–∞—Е, –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Є–Ї–µ –Є –њ–µ—А–Є–∞—А—В–Є–Ї—Г–ї—П—А–љ—Л—Е –Љ—П–≥–Ї–Є—Е —В–Ї–∞–љ—П—Е.
–Ф–ї—П –ї–Њ–Ї–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є —А–∞–Ј—А–∞–±–Њ—В–∞–љ—Л —В—А–µ–±–Њ–≤–∞–љ–Є—П, –Ї–Њ—В–Њ—А—Л–µ –≤–Ї–ї—О—З–∞—О—В —Б–ї–µ–і—Г—О—Й–Є–µ –њ–Њ–ї–Њ–ґ–µ–љ–Є—П. –Ь–µ—Б—В–љ–Њ –њ—А–Є–Љ–µ–љ—П–µ–Љ—Л–є –њ—А–µ–њ–∞—А–∞—В –і–Њ–ї–ґ–µ–љ –±—Л—В—М —Н—Д—Д–µ–Ї—В–Є–≤–µ–љ –њ—А–Є –њ–Њ–і–ї–µ–ґ–∞—Й–µ–є –ї–µ—З–µ–љ–Є—О –њ–∞—В–Њ–ї–Њ–≥–Є–Є, –њ—А–Њ–љ–Є–Ї–∞—В—М –≤ —В–Ї–∞–љ–Є––Љ–Є—И–µ–љ–Є, –љ–µ –≤—Л–Ј—Л–≤–∞—В—М –Љ–µ—Б—В–љ—Л—Е —В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є—Е –Є –∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Є—Е —А–µ–∞–Ї—Ж–Є–є, –µ–≥–Њ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –љ–µ –і–Њ–ї–ґ–љ–∞ –і–Њ—Б—В–Є–≥–∞—В—М —Г—А–Њ–≤–љ—П, –њ—А–Є–≤–Њ–і—П—Й–µ–≥–Њ –Ї –Ј–∞–≤–Є—Б–Є–Љ—Л–Љ –Њ—В –і–Њ–Ј—Л –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–Љ —Н—Д—Д–µ–Ї—В–∞–Љ, –∞ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ –Є –≤—Л–≤–µ–і–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ –і–Њ–ї–ґ–љ—Л –±—Л—В—М —В–∞–Ї–Є–Љ–Є –ґ–µ, –Ї–∞–Ї –њ—А–Є —Б–Є—Б—В–µ–Љ–љ–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є. –°—В–µ–њ–µ–љ—М –њ—А–Њ–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –ї–Њ–Ї–∞–ї—М–љ–Њ–≥–Њ –Э–Я–Т–Я –Ј–∞–≤–Є—Б–Є—В –Њ—В –µ–≥–Њ –ї–Є–њ–Њ—Д–Є–ї—М–љ–Њ—Б—В–Є –Є —Б–Њ—Б—В–Њ—П–љ–Є—П –±–∞—А—М–µ—А–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –Ї–Њ–ґ–Є, –∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–µ–є –і–µ–є—Б—В–≤—Г—О—Й–µ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞, –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–є –і–Њ–Ј–Њ–є, –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—Й–µ–є –∞–љ–∞–ї—М–≥–µ—В–Є—З–µ—Б–Ї–Њ–µ –Є –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ. –Я–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Љ–∞–Ј—П–Љ–Є –≥–µ–ї–Є —П–≤–ї—П—О—В—Б—П –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–є —Д–Њ—А–Љ–Њ–є, —В–∞–Ї –Ї–∞–Ї –Њ–љ–Є –ї—Г—З—И–µ –њ—А–Њ–љ–Є–Ї–∞—О—В –≤ –Њ—А–≥–∞–љ—Л––Љ–Є—И–µ–љ–Є.
–Ф–µ–є—Б—В–≤—Г—О—Й–Є–Љ –љ–∞—З–∞–ї–Њ–Љ –≥–µ–ї—П –Э–∞–є–Ј —П–≤–ї—П–µ—В—Б—П 1% –љ–Є–Љ–µ—Б—Г–ї–Є–і. –Ш–Љ–µ–µ—В—Б—П –≤—Б–µ –±–Њ–ї—М—И–µ –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤ —В–Њ–≥–Њ, —З—В–Њ –Э–Я–Т–Я –і–ї—П –Љ–µ—Б—В–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є –љ–Є–Љ–µ—Б—Г–ї–Є–і, —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ —Г–Љ–µ–љ—М—И–∞—О—В –±–Њ–ї—М –Є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—В —А–∞–Ј—А–µ—И–µ–љ–Є—О –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –њ—А–Є –Њ—Б—В—А—Л—Е –Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е —Б–Њ—Б—В–Њ—П–љ–Є—П—Е –Є –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –њ—А–Є –Њ—Б—В–µ–Њ–∞—А—В—А–Њ–Ј–µ [22]. –†–∞–љ–µ–µ —Б–Њ–Њ–±—Й–∞–ї–Њ—Б—М, —З—В–Њ –∞–љ–∞–ї—М–≥–µ—В–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В –ї–Њ–Ї–∞–ї—М–љ–Њ–≥–Њ –љ–Є–Љ–µ—Б—Г–ї–Є–і–∞ –њ—А–µ–≤–Њ—Б—Е–Њ–і–Є—В –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л–є —Н—Д—Д–µ–Ї—В –њ–Є—А–Њ–Ї—Б–Є–Ї–∞–Љ–∞, –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї–∞ –Є –њ–ї–∞—Ж–µ–±–Њ [23]. –Я—А–Є —Н—В–Њ–Љ, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ —В–Њ, —З—В–Њ —Н—В–Є –і–∞–љ–љ—Л–µ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В, —З—В–Њ –Э–Я–Т–Я –і–ї—П –Љ–µ—Б—В–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Љ–Њ–≥—Г—В –Њ–Ї–∞–Ј—Л–≤–∞—В—М –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л, –љ–µ –≤—Л–Ј—Л–≤–∞—П —Б–Є—Б—В–µ–Љ–љ—Л—Е –њ–Њ–±–Њ—З–љ—Л—Е —П–≤–ї–µ–љ–Є–є, –Љ–љ–Њ–≥–Є–µ –≤—А–∞—З–Є –њ—А–µ–і–≤–Ј—П—В–Њ –Њ—В–љ–Њ—Б—П—В—Б—П –Ї –љ–∞–Ј–љ–∞—З–µ–љ–Є—О —Г–Ї–∞–Ј–∞–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, —Б–Њ–Љ–љ–µ–≤–∞—П—Б—М –≤ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –њ—А–Њ–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –Э–Я–Т–Я —В—А–∞–љ—Б–і–µ—А–Љ–∞–ї—М–љ–Њ –Є –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –і–µ–є—Б—В–≤—Г—О—Й–µ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞.
–Т —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Г –±–Њ–ї—М–љ—Л—Е –≥–Њ–љ–∞—А—В—А–Њ–Ј–Њ–Љ –≤ –і–≤—Г—Е –њ–∞—А–∞–ї–ї–µ–ї—М–љ—Л—Е –≥—А—Г–њ–њ–∞—Е –Є–Ј—Г—З–∞–ї–Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О –љ–Є–Љ–µ—Б—Г–ї–Є–і–∞ –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ —В–∞–±–ї–µ—В–Њ–Ї (100 –Љ–≥ 2 —А–∞–Ј–∞/—Б—Г—В.) –Є –љ–Є–Љ–µ—Б—Г–ї–Є–і–∞ –≥–µ–ї—П, –Ї–Њ—В–Њ—А—Л–є –љ–∞–љ–Њ—Б–Є–ї–Є –љ–∞ –Њ–±–ї–∞—Б—В—М –Ї–Њ–ї–µ–љ–љ–Њ–≥–Њ —Б—Г—Б—В–∞–≤–∞. –Ъ–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –љ–Є–Љ–µ—Б—Г–ї–Є–і–∞ –≤ –њ–ї–∞–Ј–Љ–µ –Њ–Ї–∞–Ј–∞–ї–∞—Б—М –≤ 300 —А–∞–Ј –≤—Л—И–µ (3631,9 –љ–≥/–Љ–ї), –∞ –≤ —Б–Є–љ–Њ–≤–Є–∞–ї—М–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є – –≤ 100 —А–∞–Ј –≤—Л—И–µ (2080,7 –љ–≥/–Љ–ї) –њ—А–Є –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –ї–Њ–Ї–∞–ї—М–љ—Л–Љ [24]. –Э–Є–Љ–µ—Б—Г–ї–Є–і –њ—А–Њ–љ–Є–Ї–∞–ї —В—А–∞–љ—Б–і–µ—А–Љ–∞–ї—М–љ–Њ –њ—А–Є –Љ–µ—Б—В–љ–Њ–Љ –љ–∞–љ–µ—Б–µ–љ–Є–Є –Є –њ—А–Є—Б—Г—В—Б—В–≤–Њ–≤–∞–ї –≤ —Б–Є–љ–Њ–≤–Є–∞–ї—М–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є –≤ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є 22,1±10,5 –љ–≥/–Љ–ї, –њ—А–Є —Н—В–Њ–Љ –µ–≥–Њ —Б—А–µ–і–љ—П—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є –њ–Њ—Б–ї–µ –Љ–µ—Б—В–љ–Њ–≥–Њ –љ–∞–љ–µ—Б–µ–љ–Є—П –±—Л–ї–∞ –њ–Њ—З—В–Є –≤–і–≤–Њ–µ –Љ–µ–љ—М—И–µ, —З–µ–Љ –≤ —Б–Є–љ–Њ–≤–Є–∞–ї—М–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є (11,8±3,0 –љ–≥/–Љ–ї).
–Т —Н—В–Њ–Љ –ґ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–Є –Њ—Б—В–µ–Њ–∞—А—В—А–Њ–Ј–∞ –њ–Њ—Б–ї–µ 7––і–љ–µ–≤–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –ї–Њ–Ї–∞–ї—М–љ—Л–Љ –љ–Є–Љ–µ—Б—Г–ї–Є–і–Њ–Љ –≤ –≤–Є–і–µ –≥–µ–ї—П: –Њ—В–Љ–µ—З–∞–ї–Є—Б—М —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –±–Њ–ї–Є, —Г–ї—Г—З—И–µ–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–Є –Ї–Њ–ї–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤, –∞ —В–∞–Ї–ґ–µ —Г–і–Њ–≤–ї–µ—В–≤–Њ—А–µ–љ–љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—П –њ–Њ –Њ—Ж–µ–љ–Ї–∞–Љ –±–Њ–ї—М–љ—Л—Е –Є –≤—А–∞—З–∞. –Э–Є –≤ –Њ–і–љ–Њ–Љ —Б–ї—Г—З–∞–µ –љ–µ –±—Л–ї–Њ –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–Њ –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е –Ї–Њ–ґ–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є. –≠—В–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ –њ–Њ—Б–ї–µ –Љ–µ—Б—В–љ–Њ–≥–Њ –љ–∞–љ–µ—Б–µ–љ–Є—П –љ–Є–Љ–µ—Б—Г–ї–Є–і –њ—А–Њ–љ–Є–Ї–∞–µ—В –≤ —Б–Є–љ–Њ–≤–Є–∞–ї—М–љ—Г—О –ґ–Є–і–Ї–Њ—Б—В—М, —Б–Є–љ–Њ–≤–Є—О –Є –њ–µ—А–Є–∞—А—В–Є–Ї—Г–ї—П—А–љ—Л–µ –Љ—П–≥–Ї–Є–µ —В–Ї–∞–љ–Є. –Я–Њ–ї—Г—З–µ–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ–Њ–і—В–≤–µ—А–і–Є–ї–Є, —З—В–Њ –њ—А–Є –Љ–µ—Б—В–љ–Њ–Љ –љ–∞–љ–µ—Б–µ–љ–Є–Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –њ–ї–∞–Ј–Љ–µ –Њ—З–µ–љ—М –Љ–∞–ї–∞ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–Љ –њ—А–Є –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–Љ –≤–≤–µ–і–µ–љ–Є–Є –Є —З—В–Њ —Б–Є—Б—В–µ–Љ–љ—Л–µ –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –њ–Њ—П–≤–ї—П—О—В—Б—П –≥–Њ—А–∞–Ј–і–Њ —А–µ–ґ–µ.
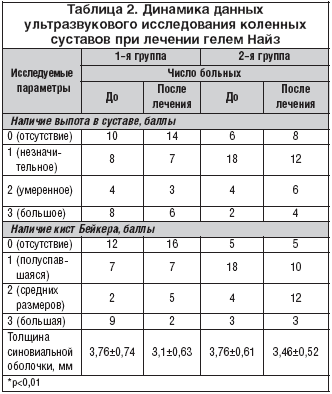
–†.–Ь. –С–∞–ї–∞–±–∞–љ–Њ–≤–∞ –Є —Б–Њ–∞–≤—В. [25] –њ—А–Њ–≤–µ–ї–Є –Њ—В–Ї—А—Л—В–Њ–µ —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–µ 2––љ–µ–і–µ–ї—М–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≥–µ–ї—П –љ–Є–Љ–µ—Б—Г–ї–Є–і–∞ (–≥–µ–ї—М –Э–∞–є–Ј, Dr. Reddy’s Lab) (1–—П –≥—А—Г–њ–њ–∞) –Є –≥–µ–ї—П –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї–∞ (2–—П –≥—А—Г–њ–њ–∞) –њ—А–Є —А–µ–≤–Љ–∞—В–Њ–Є–і–љ–Њ–Љ –∞—А—В—А–Є—В–µ (—В–∞–±–ї. 2). –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї–Њ –≤–Ї–ї—О—З–µ–љ–Њ 60 –±–Њ–ї—М–љ—Л—Е. –У–µ–ї—М –љ–∞–љ–Њ—Б–Є–ї—Б—П –љ–∞ –Ї–Њ–ї–µ–љ–љ—Л–є —Б—Г—Б—В–∞–≤. –≠—Д—Д–µ–Ї—В –љ–∞—Б—В—Г–њ–∞–ї –±—Л—Б—В—А–Њ (–≤ —Б—А–µ–і–љ–µ–Љ – —З–µ—А–µ–Ј 30 –Љ–Є–љ.), –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –∞–љ–∞–ї—М–≥–µ–Ј–Є–Є —Б–Њ—Е—А–∞–љ—П–ї–∞—Б—М –Њ—В 4 –і–Њ 6 —З, —З—В–Њ –і–Є–Ї—В—Г–µ—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М 3–—А–∞–Ј–Њ–≤–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –≥–µ–ї—П –≤ —В–µ—З–µ–љ–Є–µ —Б—Г—В–Њ–Ї. –Я—А–Њ—В–Є–≤–Њ–±–Њ–ї–µ–≤–Њ–µ –і–µ–є—Б—В–≤–Є–µ –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤ –і–≤—Г—Е –≥—А—Г–њ–њ–∞—Е –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л–Љ. –Я–Њ –і–∞–љ–љ—Л–Љ —Б–Њ–љ–Њ–≥—А–∞—Д–Є–Є –Њ—В–Љ–µ—З–µ–љ–Њ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –≤—Л–њ–Њ—В–∞ –≤ –Ї–Њ–ї–µ–љ–љ–Њ–Љ —Б—Г—Б—В–∞–≤–µ, —А–∞–Ј–Љ–µ—А–Њ–≤ –Ї–Є—Б—В –С–µ–є–Ї–µ—А–∞ –Є —В–Њ–ї—Й–Є–љ—Л —Б–Є–љ–Њ–≤–Є–∞–ї—М–љ–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є, —З—В–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–Љ —Н—Д—Д–µ–Ї—В–µ –ї–Њ–Ї–∞–ї—М–љ—Л—Е —Д–Њ—А–Љ. –Т 1––є –≥—А—Г–њ–њ–µ —З–Є—Б–ї–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–Њ–Ј–Є—В–Є–≤–љ—Л–Љ–Є —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ–Є –±—Л–ї–Њ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –±–Њ–ї—М—И–µ, —З–µ–Љ –≤–Њ 2––Њ–є. –Я—А–Њ–≤–µ–і–µ–љ–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–Њ–і—В–≤–µ—А–і–Є–ї–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М —Г—Б–Є–ї–µ–љ–Є—П –ї–µ—З–µ–±–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є —А–µ–≤–Љ–∞—В–Њ–Є–і–љ–Њ–≥–Њ –∞—А—В—А–Є—В–∞ –њ—А–Є –≤–Ї–ї—О—З–µ–љ–Є–Є –ї–Њ–Ї–∞–ї—М–љ—Л—Е –≥–µ–ї–µ–≤—Л—Е —Д–Њ—А–Љ –Э–Я–Т–Я. –Я–Њ –∞–љ–∞–ї—М–≥–µ—В–Є—З–µ—Б–Ї–Њ–Љ—Г —Н—Д—Д–µ–Ї—В—Г –≥–µ–ї—М –Э–∞–є–Ј –љ–µ —Г—Б—В—Г–њ–∞–µ—В «–Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Њ–Љ—Г» –Э–Я–Т–Я – –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї—Г. –Ю–љ –Љ–Њ–ґ–µ—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П –≤ –Ї–∞—З–µ—Б—В–≤–µ –∞–і–і–Є—В–Є–≤–љ–Њ–≥–Њ —Б—А–µ–і—Б—В–≤–∞ –і–ї—П —Г—Б–Є–ї–µ–љ–Є—П –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –Є –њ—А–Њ—В–Є–≤–Њ–±–Њ–ї–µ–≤–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П —Г –±–Њ–ї—М–љ—Л—Е —А–µ–≤–Љ–∞—В–Њ–Є–і–љ—Л–Љ –∞—А—В—А–Є—В–Њ–Љ –Є –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Б–љ–Є–Ј–Є—В—М –і–Њ–Ј—Г –Э–Я–Т–Я –њ—А–Є —Б–Є—Б—В–µ–Љ–љ–Њ–Љ –њ—А–Є–µ–Љ–µ.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –Є–љ–≥–Є–±–Є—В–Њ—А–∞ –¶–Ю–У–2 – –љ–Є–Љ–µ—Б—Г–ї–Є–і–∞ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Б–Њ–Ї—А–∞—В–Є—В—М –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –Э–ѓ, –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М –≥–∞—Б—В—А–Њ–Є–љ—В–µ—Б—В–Є–љ–∞–ї—М–љ—Л—Е, –Є —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —А–∞—Б—И–Є—А–Є—В—М –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Њ–Ї–∞–Ј–∞–љ–Є—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –њ–Њ–Љ–Њ—Й–Є –±–Њ–ї—М–љ—Л–Љ —Б —А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є. –Э–Є–Љ–µ—Б—Г–ї–Є–і –і–ї—П –ї–Њ–Ї–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –≤ –≤–Є–і–µ –≥–µ–ї—П –Э–∞–є–Ј –Љ–Њ–ґ–µ—В –±—Л—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ –і–ї—П –ї–µ—З–µ–љ–Є—П –Њ–≥—А–∞–љ–Є—З–µ–љ–љ–Њ–≥–Њ —З–Є—Б–ї–∞ –≤–Њ—Б–њ–∞–ї–µ–љ–Є–є —Б—Г—Б—В–∞–≤–Њ–≤ —А–∞–Ј–ї–Є—З–љ–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–Є, –њ—А–Њ—В–µ–Ї–∞—О—Й–Є—Е —Б –љ–Є–Ј–Ї–Њ–є –Є–ї–Є —Г–Љ–µ—А–µ–љ–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О, –Њ—Б—В–µ–Њ–∞—А—В—А–Њ–Ј–∞, –±–Њ–ї–µ–Ј–љ–µ–є –Љ—П–≥–Ї–Є—Е —В–Ї–∞–љ–µ–є –Є –і—А—Г–≥–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –њ—А–Є—З–µ–Љ –Ї–∞–Ї –≤ —А–µ–ґ–Є–Љ–µ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є, —В–∞–Ї –Є –≤ –Ї–∞—З–µ—Б—В–≤–µ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Ї —Б–Є—Б—В–µ–Љ–љ–Њ–Љ—Г –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –Э–Я–Т–Я. –≠—В–Њ –њ–Њ–Ј–≤–Њ–ї–Є—В –Є–љ—В–µ–љ—Б–Є—Д–Є—Ж–Є—А–Њ–≤–∞—В—М —А–µ–Ј—Г–ї—М—В–∞—В—Л –ї–µ—З–µ–љ–Є—П –±–µ–Ј –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–≥–Њ —А–∞–Ј–≤–Є—В–Є—П –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є.

–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. Rostom A., Muir R., Dube C. et al. Prevention of NSAID–related upper gastrointestinal toxicity: a meta–analysis of traditional NSAIDs with gastroprotection and COX–2 inhibitors // Drug Healthc Patient Saf. 2009; 1: 47–71.
2. Wanders A. Nonsteroidal antiinflammatory drugs reduce radiographic progression in patients with ankylosing spondylitis: A randomized clinical trial // Arthritis Rheum. 2005; 52: 1756–65.
3. Ding C. Do NSAID affect the progression of osteoarthritis? // Inflammation. 2002; 26: 139–42.
4. Mastbergen S.C., Jansen N.W.D., Bijlsma J.W.J. et al. Differential direct effects of cyclo–oxygenase–1/2 inhibition on proteoglycan turnover of human osteoarthritic cartilage: an in vitro study // Arthritis Research & Therapy 2006, 8. R2doi:10.1186/ar1846.
5. Kullich W.C., Niksic F., Clein G. Effects of nimesulide on mettaloproteinases and matrix degradation in osteoarthritis: a pilot clinical study // IJCP 2002; suppl 128: 24–9.
6. –Э–∞—Б–Њ–љ–Њ–≤ –Х.–Ы. –Э–µ—Б—В–µ—А–Њ–Є–і–љ—Л–µ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л (–Я–µ—А—Б–њ–µ–Ї—В–Є–≤—Л –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –≤ –Љ–µ–і–Є—Ж–Є–љ–µ). –Ь.: –Р–љ–Ї–Њ 2000. 143 —Б.
7. Lanas A. A review of the gastrointestinal safety data gastroenterologist's perspective // Rheumatology. 2010; 49 (Suppl 2): 3–10.
8. Allison M.C., Howatson A.G., Caroline M.G. et al. Gastrointestinal damage associated with the use of nonsteroidal antiinflammatory drugs // N Engl J Med 1992; 327: 749–54.
9. Winkelmayer W.C., Waikar S.S., Mogun H., Solomon D.H. Nonselective and cyclooxygenase–2–selective NSAIDs and acute kidney injury // Am J Med 2008; 121(12): 1092–98.
10. Traversa G., Bianchi C., Da Cas R. et al. Cohort study of hepatotoxity associated with nimesulide and other non–steroidal anti–inflammatory drugs // DMJ 2003; 327: 18–22.
11. Curtis S., Ko A., Bolognese J. et al. Pooled analysis of thrombotic cardiovascular events in clinical trials of the COX–2 selective Inhibitor etoricoxib // –°urr Med Res Opin 2006; 22: 2365–74.
12. Cannon C.P., Curtis S., FitzGerald G. et al. Cardiovascular outcomes with etoricoxib and diclofenac and rheumatoid arthritis in the Multinational Etoricoxib and Diclofenac Arthritis Long– term (MEDAL) programme: a randomized comparison // Lancet. 2006; 368: 1771–81.
13. Bennet –Р., Villa G. Nimesulid: an NSAID that preferentially inhibits COX–2, and has various uique pharmacological activities. Exp. Opin. // Pharmacotherapy 2000; 1: 277–6.
14. Nimesulide gel. 2000 Adis International Limited, 32 p.
15. –Т–Њ—А–Њ–±—М–µ–≤–∞ –Ю.–Т. –Э–Є–Љ–µ—Б—Г–ї–Є–і: —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Б–≤–Њ–є—Б—В–≤–∞ –Є —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М // –≠–§. –†–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є—П. –Ґ—А–∞–≤–Љ–∞—В–Њ–ї–Њ–≥–Є—П. –Ю—А—В–Њ–њ–µ–і–Є—П. 2011. вДЦ 2. –°. 20–24.
16. –Ъ–∞—А–∞—В–µ–µ–≤ –Р.–Х. –Э–Є–Љ–µ—Б—Г–ї–Є–і: –≤–Њ–њ—А–Њ—Б—Л –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –і–ї–Є—В–µ–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є // –§–∞—А–Љ–∞—В–µ–Ї–∞. 2008. вДЦ 4. –°. 90–95.
17. Kriegel W., Korff K.J., Ehrlich J.C., et al. Double–blind study comparing the long–term efficacy of the COX–2 inhibitior nimesulide and naproxen in patients with osteoarthritis // Int J Clin Pract 2001; 55: 510–14.
18. Conforti A., Leone R., Moretti U. et al. Adverse drug reactions related to the use of NSAIDs with a focus on nimesulide: results of spontaneous reporting from a Northen Italian area // Drug Saf 2001; 24: 16.
19. Bradbury F. How important is the role of the physician in the correct use of a drug? An observational cohort study in gereral practice // Int J Clin Pract 2004; su—Аpl 144: 27–32.
20. European Medicines Evalution agency. Committee for Proprietary Medical Products. CPMP/1724/04. htpp/www.emea.eu.int.
21. –Э–∞—Б–Њ–љ–Њ–≤–∞ –Т.–Р., –Э–∞—Б–Њ–љ–Њ–≤ –Х.–Ы. –†–∞—Ж–Є–Њ–љ–∞–ї—М–љ–∞—П —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є—П —А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є. –Ь.: –Ы–Є—В—В–µ—А—А–∞, 2003. 506 —Б.
22. Moore R.A., Tramer M.R., Carroll D. et al. Quantitative systematic review of topically applied non–steroidal anti–inflammatory drugs // BMJ. 1998; 316: 333–8.
23. Sengupta S., Velpandian T., Kabir S.R., Gupta S.K. Analgesic efficacy and pharmacokinetics of topical nimesulide gel in healthy human volunteers: double–blind comparison with piroxicam, diclofenac and placebo // Eur J Clin Pharmacol. 1998; 54: 541–47.
24. Erdogan F., Ergun H. , Gokay N.S. et al. The diffusion of nimesulide gel synovial fluid: a comparision between administration routes // Internat J Clin Pharmacol Therapeut 2006; 44: 270–75.
25. –С–∞–ї–∞–±–∞–љ–Њ–≤–∞ –†.–Ь., –§–µ–і–Є–љ–∞ –Ґ.–Я., –Ч–∞–њ—А—П–≥–∞–µ–≤–∞ –Ь.–Х., –Я—Г—И–Ї–Њ–≤–∞ –Ю.–Т. –≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –≥–µ–ї—П –Э–∞–є–Ј (–љ–Є–Љ–µ—Б—Г–ї–Є–і) –≤ –Ї–∞—З–µ—Б—В–≤–µ –∞–і–і–Є—В–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є —Г –±–Њ–ї—М–љ—Л—Е —А–µ–≤–Љ–∞—В–Њ–Є–і–љ—Л–Љ –∞—А—В—А–Є—В–Њ–Љ // –†–Ь–Ц. 2008. –Ґ. 16. вДЦ 10. –°. 684–687.












