В развитии РА в течение нескольких десятилетий основной считалась патология Т–клеточных иммунных реакций. Однако, за последние годы выяснено, что В–клетки могут участвовать в патогенезе РА не только как продуценты аутоантител (в частности, ревматоидного фактора – РФ), но и как антиген–представляющие клетки – представляя артритогенный аутоантиген Т–клеткам. В результате такого взаимодействия Т–клетки активируются и продуцируют провоспалительные цитокины. Характерно, что на В–клетках, как и на других известных антиген–представляющих клетках, имеются костимуляторные молекулы CD80 и CD86, участвующие в активации Т–лимфоцита путем взаимодействия с находящейся на его поверхности молекулой CD28.
Результаты экспериментальных исследований, свидетельствующие о фундаментальной роли В–лимфоцитов в нарушении Т–клеточного иммунного ответа при РА, послужили стимулом для изучения эффективности анти–В–клеточного препарата ритуксимаб для лечения этого заболевания.
Ритуксимаб (Мабтера) представляет собой генно–инженерное химерное моноклональное антитело, состоящее из человеческого и мышиного белка. Оно направлено против антигена CD20, находящегося на поверхности пре–В–клеток и зрелых В–клеток, но не на развивающихся из них плазматических клетках, которые являются продуцентами антител. Поэтому применение ритуксимаба приводит к резкому сокращению на длительный срок популяции зрелых В–клеток; количество вырабатывающих антитела плазматических клеток существенно не изменяется. Соответственно этому уровень антител не обнаруживает значительного снижения. CD20 отсутствует также на стволовых, дендритных и прo–В клетках, в связи с чем ритуксимаб не влияет на их функцию и количество. Период полувыведения ритуксимаба из сыворотки составляет около 20 дней [5].
В марте 2006 г. ритуксимаб был разрешен в США к применению при РА, и определились основные показания для его назначения – лечение среднетяжелого и тяжелого РА, резистентного к ингибиторам ФНО–a. В 2007 году было опубликовано обобщенное согласованное мнение европейских экспертов относительно применения ритуксимаба у больных РА [6]. В этом заявлении–консенсусе указывается, что целесообразность назначения ритуксимаба может рассматриваться не только после неэфективности предшествующего лечения ингибиторами ФНО–a, но и при наличии противопоказаний к этим средствам. Таким образом, признается, что ритуксимаб может быть первым среди биологических препаратов, назначаемых больному РА. У больных РА с сопутствующей В–клеточной лимфомой (в том числе в прошлом) ритуксимаб является препаратом выбора. Противопоказанием к его назначению считаются иммунные реакции на чужеродный белок, серьезные активные инфекции (острые или хронические) и тяжелая сердечная недостаточность.
Выраженность лечебного эффекта ритуксимаба у большинства пациентов с РА обычно видна к 8–16–й неделе после первой инфузии, т.е. заметно позже, чем при назначении ингибиторов ФНО–a [7]. Поэтому пациентов не следует ориентировать на быстрое развитие улучшения. Повторный курс лечения ритуксимабом по мнению авторов консенсуса следует назначать тем больным РА, у которых первый курс вызвал клиническое улучшение, но оно либо оказалось недостаточно выраженным, либо сменилось нарастанием активности болезни (увеличение индекса DАS на 0,6 и более). При этом повторный курс проводится не ранее, чем через 24 недели после первого курса. Оптимальные схемы повторного назначения ритуксимаба в настоящее время специально исследуются.
Проведенные рандомизированные исследования демонстрируют высокую эффективность ритуксимаба как у больных РА, резистентных к предшествующей терапии метотрексатом, так и при неэффективности ингибиторов ФНО–a [8,9].
Keystone и соавт. впервые показали, что лечение ритуксимабом приводит к достоверному торможению как хрящевой, так и костной суставной деструкции [10].
Несмотря на несомненное значение рандомизированных клинических исследований ритуксимаба, признается, что значение этих исследований для повседневной работы ревматологов ограничено [11], поскольку из них заведомо исключаются многие категории больных (пожилые, с сопутствующими заболеваниями и т.д.). Поэтому результаты применения ритуксимаба в реальной клинической практике являются очень важными для всесторонней характеристики препарата. Наиболее полное представление о возможностях препарата может быть достигнуто в результате создания его регистра, в котором участвуют все больные, получающие этот препарат и регистрируются все без исключения аспекты лечебного и побочного действия.
С сентября 2006 г. ритуксимаб разрешен для лечения РА в России. Перспективы применения ритуксимаба при РА и других заболеваниях обсуждались в предыдущих статьях [12,13].
В апреле 2007 г. был создан Российский регистр больных РА, получающих этот препарат. Первая статья о работе Российского регистра была опубликована в журнале «Терапевтический архив» в 2008 г. [14].
За год существования регистра в России было открыто 62 центра и включено 287 пациентов с РА. Также накапливается опыт по проведеню повторных курсов лечения ритуксимабом, на данном этапе уже 47 пациентов получили второй курс введения ритуксимаба. В данной статье суммируются годичные результаты работы регистра.
Материал и методы
В настоящее время полные сведения получены о 135 из 287 пациентов, и поэтому данное сообщение основано на результатах их динамического наблюдения. Все 135 пациентов наблюдались в течение 8 недель, 81 пациент – в течение 16 недель и 60 пациентов – в течение 24 недель после завершения курса лечения.
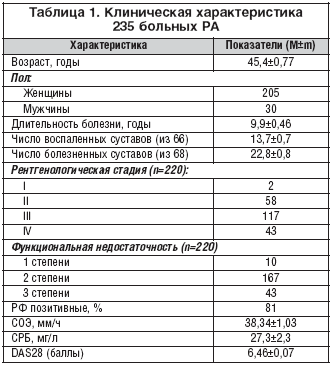
Общая характеристика больных представлена в таблице 1. Как видно из таблицы, подавляющее большинство пациентов были женщины среднего возраста, с высокой продолжительностью болезни, серопозитивные по ревматоидному фактору (РФ), с высокой активностью процесса. Следует специально отметить, что 20% пациентов имели максимальную степень нарушения функции суставов и IV рентгенологическую стадию.
У большинства пациентов (87%) отмечались системные проявления – лихорадка, слабость, похудание, генерализованная амиотрофия, ревматоидные узлы, перикардит, полинейропатия и др.
Показаниями к назначению ритуксимаба были: неэффективность инфликсимаба у 52 пациентов, его непереносимость у 16, неэффективность предшествующей терапии двумя и более стандартными базисными противовоспалительными препаратами (БПВП) у 133, непереносимость предшествующей терапии БПВП у 28, высокая лабораторная активность у 3, попытка добиться ремиссии у 2, неэффективность препарата абатацепт у 1. Таким образом, лечение препаратом ритуксимаб назначалось тяжелым больным РА, резистентным к терапии стандартными БПВП и ингибиторами ФНО– α.
По социальному статусу пациенты распределились следующим образом: 52,4% составили инвалиды II группы, 18% – III группы, 3% – I группы, 22,3% – работающие пациенты и 4,3% – не работающие без инвалидности.
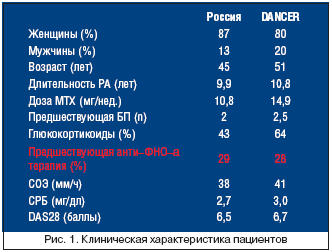
Примечательно, что при сравнении клинической характеристики пациентов Российского регистра и больных, включенных в международное иследование DANCER оказалось, что различия имелись только в дозе метотрексата (10,8 мг/нед. в России по сравнению с 14,9 в DANCER) и числу пациентов, получавших глюкокортикоиды (43% – Россия и 64% – DANCER) (рис. 1).
Основному большинству больных ритуксимаб вводился по классической схеме: 2 медленных внутривенных инфузии по 1000 мг каждая с 2–недельным интервалом между ними. Лишь единичные пациенты получили 2 инфузии по 500 мг. Препарат разводился изотоническим раствором хлорида натрия из расчета 1–2 мг/мл (до 4 мг/мл). При первой инфузии за первый час вводилось 50 мг, затем при отсутствии побочных эффектов доза увеличивалась на 50 мг/ч каждые 30 минут с максимальной скоростью введения 400 мг/ч. Нормальная длительность первой инфузии: 4 часа 15 минут. При повторных инфузиях (в случае хорошей переносимости ритуксимаба во время предыдущего назначения) за первый час вводилось 100 мг препарата, далее доза увеличивалась на 100 мг/ч каждые 30 минут с максимальной скоростью введения 400 мг/ч. Нормальная длительность второй инфузии: 3 часа 15 минут.
Перед каждым введением ритуксимаба проводилась премедикация – 100 мг метилпреднизолона внутривенно капельно.
Всем больным проводилось стандартное клиническое и лабораторное обследование, включавшее определение числа воспаленных и болезненных суставов, СОЭ, С–реактивного белка (СРБ), общий анализ крови и мочи, биохимические показатели, маркеры вирусов гепатита В, С и ВИЧ. Для оценки функционального состояния пациентов использовался Стэнфордский опросник HAQ, для обобщенной оценки эффективности терапии ритуксимабом – динамика суммарного показателя активности болезни DAS28.
У части больных определяли уровень В–клеток (СD19+) методом проточной цитофлюориметрии (Becton Dickinson, США), концентрацию IgM РФ, С–реактивного белка (СРБ), иммуноглобулинов (Ig) M, A и G высокочувствительным иммунонефелометрическим методом (анализатор BN 100, Dade Behring, Германия).
Результаты и обсуждение
В результате лечения ритуксимабом наблюдался значительный положительный эффект. Уже к 8–й неделе достоверно уменьшились такие показатели, как число воспаленных (ЧВС) и болезненных (ЧБС) суставов, СОЭ, СРБ, улучшилось качество жизни пациентов вследствие заметного увеличения их функциональных возможностей (по данным HAQ). Эти показатели достоверно продолжали снижаться в течение последующего периода наблюдения, достигая максимума к 16–й нед.
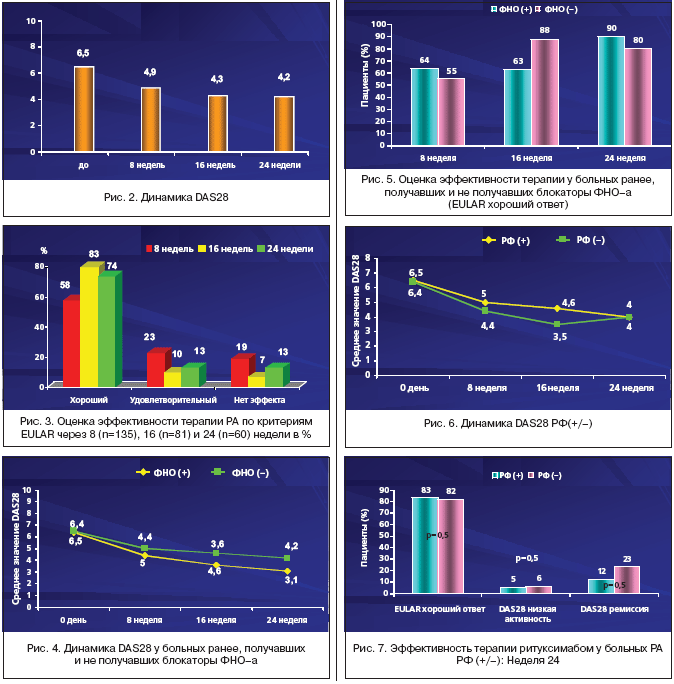
Эффективность терапии ритуксимабом подтверждена и при оценке динамики индекса DAD28 (рис. 2).
У всех наших пациентов до начала терапии отмечалось высокая активность РА (DAS28>5,1). Назначение ритуксимаба привело к ее значительному и стабильному снижению. Так, по динамике индекса DAS28 хороший и удовлетворительный результаты через 8 недель регистрировались у 81% больных, через 16 недель – у 93%, а через 24 недели – у 87% (рис. 3). При этом отмечена тенденция к постепенному нарастанию эффекта терапии. К 16 неделе низкая степень активности (DAS28<3,2) наблюдалась у 18,6% пациентов и ремиссия заболевания (DAS28<2,6) у 11,6%; к 24 неделе низкая степень активности была у 20,3%, а ремиссия заболевания развилась у 15,3%.
Близкие данные приводят и другие исследователи [15,16]. По данным P. Emery и соавт. [17] (исследование DANCER) частота развития ремиссий к 24 неделе составила 10%, низкая степень активности наблюдалась у 29% больных. Следует, однако, подчеркнуть, что во многих исследованиях к 24 неделе у ряда пациентов наблюдалась тенденция к обострению заболевания, что диктовало необходимость повторного назначения препарата.
Нами был проведен сравнительный анализ результатов назначения ритуксимаба (по DAS28) среди пациентов, ранее лечившихся без эффекта ингибиторами ФНО–a, и больных с неэффективностью стандартных БПВП, не получавших ингибиторы ФНО–a. Пациенты обеих групп не различались по индексу активности DAS28 на начальном этапе лечения. Достоверные различия были получены только к 24 неделе лечения. Оказалось, что результат терапии ритуксимабом оказался несколько лучше в группе пациентов, ранее получавших ингибиторов ФНО–a (рис. 4).
В то же время по частоте достижения отчетливого клинического улучшения («хороший ответ» по критериям EULAR) достоверных различий к 24 неделе получено не было (90% у ФНО+ и 80% у ФНО–), хотя некоторая тенденция к более высоким результатам была отмечена в группе ФНО+ (рис. 5).
При сравнении больных, серопозитивных (РФ+) и серонегативных (РФ–) по ревматоидному фактору, различий по исходной степени активности заболевания (по DAS28) и ее дальнейшей динамике к 24 неделе выявлено не было (рис. 6).
Пациенты РФ+ и РФ– не различались также по частоте развития хорошего ответа по критериям EULAR (83% и 82%, соответственно), низкой степени активности (5% по сравнению с 6%, соответственно) и частоте ремиссий (12% и 23%, соответственно) (рис. 7).
Сходные данные были получены N. Assous и соавт. по оценке эффективности ритуксимаба [18]. Данные этого исследования показали, что эффективность ритуксимаба составила 82% пациентов: умеренный ответ наблюдался у 46%, хороший у 36% (включая 12% ремиссий); не было ответа у 18% пациентов. Не было выявлено различий между пациентами имеющих противопоказания к назначению ингибиторов ФНО–a и их неэффективностью. А также не было различий между РФ(+) и РФ(–) больными в развитии клинического эффекта. Ценность данный работы заключается еще и в том, что в ней представлены результаты реальной клинической практики а не рандомизированного исследования [18].
Переносимость ритуксимаба по данным Российского регистра была хорошей. В основном регистрировались только инфузионные реакции в виде заложенности носа у 7 пациентов, першения и онемения глотки у 4 больных, гиперемии и зуда ушных раковин у 6, гриппоподобного синдрома у 5, колебания АД у 6, крапивницы у 2 пациентов. У 3 пациентов развились тяжелые нежелательные эффекты. У одной пациентки через 3 месяца после 2–й инфузии ритуксимаба развился геморрагический инсульт. У другой больной через 4 месяца после 2–й инфузии ритуксимаба развился острый инфаркт миокарда. В обеих случаях пациентки погибли, однако четкой связи с приемом препарата ритуксимаб нет: в анамнезе у одной из них тяжелая гипертонической болезнь, у другой тяжелая ИБС. Еще одной пациентке потребовалась госпитализация через 3 месяца после последней инфузии ритуксимаба в связи с развившейся метроррагией. Связи с приемом препарата также не отмечено. У 8 пациентов регистрировались инфекционные осложнения: ОРВИ у 2 больных, пиодермия у 1, пиелонефрит у 2, стафилококковый дерматит у 1, гнойный бурсит у 1, простой герпес у 1.
У одной больной с сердечной недостаточностью I стадии после 2–й инфузии наблюдалось усиление одышки и болей в области сердца, токсический гепатит отмечен у 1, флеботромбоз голени у 1, диарея у 1 больной. У всех пациентов после дополнительного лечения нежелательные явления были купированы.
Таким образом, в нашей стране накапливается собственный опыт по применению ритуксимаба у больных с РА. Полученные нами результаты подтверждают данные литературы о высокой эффективности и хорошей переносимости ритуксимаба у пациентов с наиболее тяжелыми формами РА, резистентными к терапии несколькими стандартными БПВП и ингибиторами ФНО– α. Внедрение этого препарата в ревматологическую практику существенно расширяет возможности эффективной терапии РА.
Ближайшими задачами в исследовании ритуксимаба являются разработка показаний к проведению его повторных курсов и оценка его антидеструктивного действия.
Литература
1. Furst DE, Breedveld FC, Kalden JR, et al. Updated consensus statement on biological agents for the treatment of rheumatic diseases, 2007. Ann Rheum Dis 2007; 65 (Suppl III); iii2–iii22.
2. Pincus T, Yazici Y, van Vollenhoven R. Why are only 50% of courses of anti–tumor necrosis factor agents continued for only 2 years in some setting? Need for long–term observations in standarв care to complement clinical trials. J Rheumatol 2006; 33: 2372–2375.
3. Wintrop KL. Risk and prevention of tuberculosis and other serious opportunistic infections associated with the inhibition of tumor necrosis factor. Nature Clin Pract Rheumatol 2006; 2: 602–610.
4. Козлов РС, Якушин СБ, Насонов ЕЛ. Инфекционные осложнения терапии блокаторами фактора некроза опухоли: предупрежден – значит вооружен. Клиническая Микробиология и антимикробная химиотерапия, 2006, 8:314–324.
5. Iacona I., Lazzarino M., Avanzini M.A. et al. Rituximab (IDEC–C2B8): validation of a sensitive enzyme–linked immunoassay applied to a clinical pharmacokinetic study. Ther. Drug Monitor., 2000, v.2, p.295–301.
6. Smolen J.S., Keystone E.C., Emery P. et al. Consensus statement on the use of rituximab in patients with rheumatoid arthritis. Ann.Rheum.Dis., 2007, v.66, p.143–150.
7. Furst D.E., Breedveld F.C., Kalden J.R. et al. Updated consensus statement on biological agents for the treatment of rheumatic diseases, 2007. Ann.Rheum.Dis., 2007, v.66, supl.III, iii2–iii22.
8. Emery P, Fleishmann R, Filipowicz–Sosnowska A, et al. for the DANCER Study group. The Efficacy and safety of rituximab in patients with active rheumatoid arthritis despite methotrexate treatment. Results of a phase IIb randomized, double–blind, placebo–controlled dose–range trial. Arthritis Rheum 2006; 54: 1390–1400.
9. Cohen SB, Emery P, Greenwald MW, et al. fоt the REFLEX Trial Group. Rituximab for rheumatoid arthritis refractory to anti–tumor necrosis factor therapy. Results of mulicenter, randomized, double–blind, placebo–controlled, phase III trial evaluating primary efficacy and safety at twenty–four weeks. Arthritis Rheum 2006; 54: 2793–2806.
10. Keystone E., Emery P., Peterfy C.G. et al. Prevention of joint structural damage at 1 year with rituximab in rheumatoid arthritis patients with an inadequate response to one or more TNF inhibitors (REFLEX study). Ann.Rheum.Dis., 2006, v.65, supl.II, p.58.
11. Zink A, Stangfeld A, Scheider M, et al. Effectiveness of tumor necrosis factor inhibitors in rheumatoid arthritis in an observational cohort study: comparison of patients according to their eligibility for major randomized clinical trias. Arthritis Rheum 2006; 54: 3399–407.
12. Насонов Е.Л. Новые направления терапии ревматоидного артрита: перспективы применения моноклональных антител к В–лимфоцитам (ритуксимаб). Русский Медицинский Журнал 2006, т. 14, № 25, с. 1778–1772.
13. Насонов Е.Л. Перспективы применения ритуксимаба при аутоиммунных заболеваниях человека. Русский Медицинский Журнал 2007, т. 15, № 26, с. 1958–1963.
14. Насонов Е.Л., Лукина Г.В., Сигидин Я.А., и соавт. Применение моноклональных антител к В–лимфоцитам (ритуксимаб) при ревматоидном артрите в России (предварительные результаты Российского регистра). Терапевтический архив 2008, т. 80, № 8, с. 57–62.
15. Kramm H, Hansen KE, Gowing E, Bridges A. Successful therapy of rheumatoid arthritis with rituximab. Renewed interest in the role of B cells in the pathogenesis of rheumatoid arthritis. J Clin Rheumatol. 2004; 10:28–32.
16. Josi RN, Masding A, Somerville M, et al. Rituximab therapy in patients with resistant rheumatoid arthritis: real–life experience. Rheumatology 2007on.line.
17. Scheinberg M, Hamerschlak N, Kutner JM, et al. Rituximab in refractory autoimmune diseases: Brazilian experience with 29 patients (2002–2004). Clin Exp Rheumatol 2006; 24: 65–69.
18. Assous N, Gossec L, Dieude P, et al. Rituximab therapy in rheumatoid arthritis in daily practice. The Journal of Rheumatology 2008; 31–34.












