–Ю–±–Њ—Б–љ–Њ–≤–∞–љ–љ—Л–µ –љ–∞–і–µ–ґ–і—Л –љ–∞ —А–∞–і–Є–Ї–∞–ї—М–љ–Њ–µ —Г–ї—Г—З—И–µ–љ–Є–µ –њ—А–Њ–≥–љ–Њ–Ј–∞ —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –±–Њ–ї—М–љ—Л—Е —Б–≤—П–Ј—Л–≤–∞—О—В—Б—П —Б –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М—О –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –±–∞–Ј–Є—Б–љ—Л—Е –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ (–С–Я–Т–Я) (–Њ—Б–Њ–±–µ–љ–љ–Њ –У–Ш–С–Я) –љ–∞ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ —А–∞–љ–љ–Є—Е —Б—А–Њ–Ї–∞—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –і–Њ –љ–∞—Б—В—Г–њ–ї–µ–љ–Є—П —Б—В–Њ–є–Ї–Є—Е —Б—В—А—Г–Ї—В—Г—А–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є. –≠—В–Њ –Њ—Б–Њ–±–µ–љ–љ–Њ –≤–∞–ґ–љ–Њ –і–ї—П –њ–µ–і–Є–∞—В—А–Є—З–µ—Б–Ї–Њ–є —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є–Є, —В.–Ї. –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е –і–Њ—Б—В–Є–ґ–µ–љ–Є–є –≥–µ–љ–љ–Њ––Є–љ–ґ–µ–љ–µ—А–љ—Л—Е —В–µ—Е–љ–Њ–ї–Њ–≥–Є–є –≤ –ї–µ—З–µ–љ–Є–Є —О–≤–µ–љ–Є–ї—М–љ—Л—Е –∞—А—В—А–Є—В–Њ–≤ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –≤–Ј–≥–ї—П–љ—Г—В—М –±–Њ–ї–µ–µ –Њ–њ—В–Є–Љ–Є—Б—В–Є—З–љ–Њ –љ–∞ —Б—Г–і—М–±—Г –і–µ—В–µ–є, —Б—В—А–∞–і–∞—О—Й–Є—Е —Н—В–Є–Љ —В—П–ґ–µ–ї—Л–Љ, —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–Љ, –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ –Є–љ–≤–∞–ї–Є–і–Є–Ј–Є—А—Г—О—Й–Є–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ–Љ [5–9].
–Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –У–Ш–С–Я –≤ –і–µ—В—Б–Ї–Њ–є —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –Є–Љ–µ–µ—В —А—П–і –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є, –Њ—В–ї–Є—З–љ—Л—Е –Њ—В –Є—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Г –≤–Ј—А–Њ—Б–ї—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Т –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М —Н—В–Њ –Њ—В–љ–Њ—Б–Є—В—Б—П –Ї —А–µ–≥–ї–∞–Љ–µ–љ—В–Є—А—Г—О—Й–Є–Љ –љ–∞—Ж–Є–Њ–љ–∞–ї—М–љ—Л–Љ–Є –Њ—А–≥–∞–љ–∞–Љ–Є, —А–µ–≥—Г–ї–Є—А—Г—О—Й–Є–Љ–Є –Њ–±–Њ—А–Њ—В –ї–µ–Ї–∞—А—Б—В–≤, –Њ–≥—А–∞–љ–Є—З–µ–љ–Є—П–Љ –Ї –њ—А–Є–Љ–µ–љ–µ–љ–Є—О —Г –і–µ—В–µ–є. –Т –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –§–µ–і–µ—А–∞—Ж–Є–Є –Є —Б—В—А–∞–љ–∞—Е –°–Э–У –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Є–љ–≥–Є–±–Є—В–Њ—А—Л –§–Э–Ю –љ–µ –Є–Љ–µ—О—В –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞–љ–Є–є –Ї –њ—А–Є–Љ–µ–љ–µ–љ–Є—О —Г –і–µ—В–µ–є, —З—В–Њ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –ї–Є–Љ–Є—В–Є—А—Г–µ—В –Є—Е –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –≤ –њ–µ–і–Є–∞—В—А–Є–Є. –°—В–∞—В—Г—Б –њ—А–µ–њ–∞—А–∞—В–Њ–≤ «off label» –і–ї—П –і–µ—В—Б–Ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –њ–Њ–і—А–∞–Ј—Г–Љ–µ–≤–∞–µ—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –і–Њ–≤–Њ–ї—М–љ–Њ —Б–ї–Њ–ґ–љ–Њ–є —О—А–Є–і–Є—З–µ—Б–Ї–Њ–є –њ—А–Њ—Ж–µ–і—Г—А—Л –њ–Њ–і–њ–Є—Б–∞–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–Љ –Є/–Є–ї–Є —А–Њ–і–Є—В–µ–ї—П–Љ–Є –Є–љ—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ —Б–Њ–≥–ї–∞—Б–Є—П, –њ–Њ–ї—Г—З–µ–љ–Є—П –Њ–і–Њ–±—А–µ–љ–Є—П –ї–Њ–Ї–∞–ї—М–љ—Л–Љ —Н—В–Є—З–µ—Б–Ї–Є–Љ –Ї–Њ–Љ–Є—В–µ—В–Њ–Љ, –£—З–µ–љ—Л–Љ —Б–Њ–≤–µ—В–Њ–Љ –Є–ї–Є –Ї–ї–Є–љ–Є–Ї–Њ–—Н–Ї—Б–њ–µ—А—В–љ–Њ–є –Ї–Њ–Љ–Є—Б—Б–Є–µ–є –ї–µ—З–µ–±–љ–Њ–≥–Њ —Г—З—А–µ–ґ–і–µ–љ–Є—П. –Ш–Љ–µ–љ–љ–Њ –≤ —Б–Є–ї—Г —Н—В–Њ–≥–Њ –і–Њ –њ–Њ—Б–ї–µ–і–љ–µ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –љ–∞–Є–±–Њ–ї–µ–µ –Њ–њ—А–∞–≤–і–∞–љ–љ–Њ–є –Є —А–µ–∞–ї–Є–Ј—Г–µ–Љ–Њ–є –љ–∞ –њ—А–∞–Ї—В–Є–Ї–µ —П–≤–ї—П–µ—В—Б—П —В–∞–Ї—В–Є–Ї–∞ –Њ–±—А–∞—Й–µ–љ–Є—П –Ї —Н—В–Њ–Љ—Г –Љ–Њ—Й–љ–Њ–Љ—Г —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–Љ—Г —Б—А–µ–і—Б—В–≤—Г –≤ –ї–µ—З–µ–љ–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–µ—Д—А–∞–Ї—В–µ—А–љ—Л–Љ–Є –≤–∞—А–Є–∞–љ—В–∞–Љ–Є —О–≤–µ–љ–Є–ї—М–љ–Њ–≥–Њ –∞—А—В—А–Є—В–∞ (–Ѓ–Р), —В.–µ. —В–Њ–ї—М–Ї–Њ –≤ —В–µ—Е —Б–Є—В—Г–∞—Ж–Є—П—Е, –Ї–Њ–≥–і–∞ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Є–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –ї–µ—З–µ–љ–Є—П –Њ–Ї–∞–Ј–∞–ї–Є—Б—М –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –Є—Б—З–µ—А–њ–∞–љ–љ—Л–Љ–Є. –° –Њ–і–љ–Њ–є —Б—В–Њ—А–Њ–љ—Л, —В–∞–Ї–Њ–є –њ–Њ–і—Е–Њ–і —Б–Њ–Ј–і–∞–µ—В –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ—Л–µ —Г—Б–ї–Њ–≤–Є—П –і–ї—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –њ—А—П–Љ–Њ –њ—А–Њ—В–Є–≤–Њ—А–µ—З–Є—В –≥–ї–∞–≤–љ–Њ–є –Ї–Њ–љ—Ж–µ–њ—Ж–Є–Є —А–∞—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є —А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є – —Б—В—А–∞—В–µ–≥–Є–Є «–њ–µ—А–µ–≤–µ—А–љ—Г—В–Њ–є –њ–Є—А–∞–Љ–Є–і—Л», —В.–µ. –Њ–њ–µ—А–µ–ґ–∞—О—Й–µ–є —В–∞–Ї—В–Є–Ї–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤ –љ–∞ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –±–Њ–ї–µ–µ —А–∞–љ–љ–Є—Е —Б—В–∞–і–Є—П—Е –±–Њ–ї–µ–Ј–љ–Є. –° –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, –њ–Њ–ї—Г—З–µ–љ–љ—Л–є –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є–є –Њ–њ—Л—В —Г—Б–њ–µ—И–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –§–Э–Ю––Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –њ—А–Є –љ–∞–Є–±–Њ–ї–µ–µ —Б–µ—А—М–µ–Ј–љ—Л—Е –≤–∞—А–Є–∞–љ—В–∞—Е –Ѓ–Р, –≤ —Б–Є—В—Г–∞—Ж–Є—П—Е –і–∞–ї–µ–Ї–Њ –Ј–∞—И–µ–і—И–Є—Е, –љ–µ–Њ–±—А–∞—В–Є–Љ—Л—Е –і–µ—Б—В—А—Г–Ї—В–Є–≤–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ —Б—Г—Б—В–∞–≤–∞—Е, –њ–Њ–Ј–≤–Њ–ї—П–µ—В —А–∞—Б—Б—З–Є—В—Л–≤–∞—В—М –љ–∞ –§–Э–Ю––Є–љ–≥–Є–±–Є—В–Њ—А—Л, –Ї–∞–Ї –љ–∞ —Б–њ–Њ—Б–Њ–± –њ—А–µ–Њ–і–Њ–ї–µ–љ–Є—П –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є —А–µ—Д—А–∞–Ї—В–µ—А–љ–Њ—Б—В–Є –і–ї—П —В—Л—Б—П—З —В—П–ґ–µ–ї–Њ –±–Њ–ї—М–љ—Л—Е –і–µ—В–µ–є, –Ј–∞–±–Њ–ї–µ–≤—И–Є—Е –Ѓ–Р –і–Њ «—Н—А—Л –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є».
–†–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—П –∞—Б–њ–µ–Ї—В—Л –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –∞–≥–µ–љ—В–Њ–≤ –њ—А–Є –Ѓ–Р, —Б–ї–µ–і—Г–µ—В –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М –µ—Й–µ –Њ–і–љ—Г –≤–∞–ґ–љ—Г—О –њ–µ–і–Є–∞—В—А–Є—З–µ—Б–Ї—Г—О –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—М. –Ю—В–і–µ–ї—М–љ—Л–Љ–Є –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–љ—Л–Љ–Є –њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ–Є –Ї –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –§–Э–Ю —Г –≤–Ј—А–Њ—Б–ї—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —П–≤–ї—П—О—В—Б—П —А–µ–≤–Љ–∞—В–Њ–Є–і–љ—Л–є –∞—А—В—А–Є—В, –∞–љ–Ї–Є–ї–Њ–Ј–Є—А—Г—О—Й–Є–є —Б–њ–Њ–љ–і–Є–ї–Є—В, –њ—Б–Њ—А–Є–∞—В–Є—З–µ—Б–Ї–Є–є –∞—А—В—А–Є—В –Є —Н–љ—В–µ—А–Њ–≥–µ–љ–љ—Л–µ –∞—А—В—А–Є—В—Л (–њ—А–Є –±–Њ–ї–µ–Ј–љ–Є –Ъ—А–Њ–љ–∞ –Є –љ–µ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–Љ —П–Ј–≤–µ–љ–љ–Њ–Љ –Ї–Њ–ї–Є—В–µ). –°—В–∞–љ–і–∞—А—В–∞–Љ–Є –Њ–Ї–∞–Ј–∞–љ–Є—П –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –њ–Њ–Љ–Њ—Й–Є —Г—Б–ї–Њ–≤–љ–Њ –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ—В—Б—П —В–Њ–ґ–і–µ—Б—В–≤–µ–љ–љ–Њ—Б—В—М —А–µ–≤–Љ–∞—В–Њ–Є–і–љ–Њ–≥–Њ –∞—А—В—А–Є—В–∞ –≤–Ј—А–Њ—Б–ї—Л—Е –Є –Ѓ–Р, —Е–Њ—В—П –≤ –і–µ–є—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Ѓ–Р – —Н—В–Њ –≥—А—Г–њ–њ–Њ–≤–Њ–µ –Њ–±–Њ–Ј–љ–∞—З–µ–љ–Є–µ —А—П–і–∞ —А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –і–µ—В—Б–Ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞, –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л—Е –≤ —А—Г–±—А–Є–Ї–µ –Ь.08 –Ь–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–Њ–є –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є –±–Њ–ї–µ–Ј–љ–µ–є –• –њ–µ—А–µ—Б–Љ–Њ—В—А–∞ –Є –≤–Ї–ї—О—З–∞—О—Й–Є—Е —О–≤–µ–љ–Є–ї—М–љ—Л–є —А–µ–≤–Љ–∞—В–Њ–Є–і–љ—Л–є –∞—А—В—А–Є—В (–Ѓ–†–Р), —О–≤–µ–љ–Є–ї—М–љ—Л–є –∞–љ–Ї–Є–ї–Њ–Ј–Є—А—Г—О—Й–Є–є —Б–њ–Њ–љ–і–Є–ї–Є—В (–Ѓ–Р–°), —О–≤–µ–љ–Є–ї—М–љ—Л–є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–є –∞—А—В—А–Є—В (–Ѓ–•–Р) [9,10]. –У–ї–∞–≤–љ–Њ–є –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—М—О —В–µ—З–µ–љ–Є—П —Н—В–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —Г –і–µ—В–µ–є —П–≤–ї—П–µ—В—Б—П –љ–µ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–є —Е–∞—А–∞–Ї—В–µ—А –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є –Є —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ —В–Є–њ–Є—З–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А—В–Є–љ—Л –Ї–Њ–љ–Ї—А–µ—В–љ–Њ–є –љ–Њ–Ј–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —Д–Њ—А–Љ—Л –њ–Њ –Є—Б—В–µ—З–µ–љ–Є–Є –Љ–љ–Њ–≥–Є—Е –ї–µ—В, –љ–µ—А–µ–і–Ї–Њ —Г–ґ–µ –≤–Њ –≤–Ј—А–Њ—Б–ї–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ. –≠—В–Њ–є –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—М—О —О–≤–µ–љ–Є–ї—М–љ–Њ–≥–Њ –љ–∞—З–∞–ї–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Њ–±—К—П—Б–љ—П–µ—В—Б—П —Б—Г—Й–µ—Б—В–≤—Г—О—Й–∞—П –љ–∞ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–є –і–µ–љ—М –≤ –і–µ—В—Б–Ї–Њ–є —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є–Є —Б–ї–Њ–ґ–љ–∞—П, –љ–µ—Г—А–µ–≥—Г–ї–Є—А–Њ–≤–∞–љ–љ–∞—П —Б–Є—В—Г–∞—Ж–Є—П —Б –Љ–љ–Њ–≥–Њ–Њ–±—А–∞–Ј–Є–µ–Љ —В–µ—А–Љ–Є–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Њ–±–Њ–Ј–љ–∞—З–µ–љ–Є–є (–Ѓ–†–Р, –Ѓ–•–Р, —О–≤–µ–љ–Є–ї—М–љ—Л–є –Є–і–Є–Њ–њ–∞—В–Є—З–µ—Б–Ї–Є–є –∞—А—В—А–Є—В (–Ѓ–Ш–Р)) [5,7,10–13]. –Ґ—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ –і–Њ–њ—Г—Б—В–Є–Љ—Л–Љ —П–≤–ї—П–µ—В—Б—П —Г–њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ —В–µ—А–Љ–Є–љ–∞ –Ѓ–†–Р –≤ –љ–µ–Њ–њ—А–∞–≤–і–∞–љ–љ–Њ —И–Є—А–Њ–Ї–Њ–Љ —Б–Љ—Л—Б–ї–µ, –і–∞–ґ–µ –≤ —В–µ—Е —Б–ї—Г—З–∞—П—Е, –Ї–Њ–≥–і–∞ –µ—Б—В—М –≤—Л—Б–Њ–Ї–∞—П –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М –Є–љ–Њ–≥–Њ, –Њ—В–ї–Є—З–љ–Њ–≥–Њ –Њ—В –Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є–є –Њ —А–µ–≤–Љ–∞—В–Њ–Є–і–љ–Њ–Љ –∞—А—В—А–Є—В–µ, –љ–Њ–Ј–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Е–Њ–і–∞. –Ґ–µ—А–Љ–Є–љ—Л –Ѓ–•–Р –Є –Ѓ–Ш–Р –њ–Њ–і—А–∞–Ј—Г–Љ–µ–≤–∞—О—В –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Њ–љ–љ—Л–є –њ–Њ–і—Е–Њ–і –Ї –і–Є–∞–≥–љ–Њ–Ј—Г (—В.–µ. –љ–µ –љ–Њ–Ј–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –і–Є–∞–≥–љ–Њ–Ј) —Б –≤—Л–і–µ–ї–µ–љ–Є–µ–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –≤–∞—А–Є–∞–љ—В–Њ–≤ –Є–ї–Є –Ї–∞—В–µ–≥–Њ—А–Є–є – —Б–Є—Б—В–µ–Љ–љ–Њ–≥–Њ, –њ–Њ–ї–Є–∞—А—В–Є–Ї—Г–ї—П—А–љ–Њ–≥–Њ, –Њ–ї–Є–≥–Њ–∞—А—В–Є–Ї—Г–ї—П—А–љ–Њ–≥–Њ, –њ—Б–Њ—А–Є–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ, –∞—А—В—А–Є—В–∞, —Б–Њ—З–µ—В–∞—О—Й–µ–≥–Њ—Б—П —Б —Н–љ—В–µ–Ј–Є—В–Њ–Љ.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ–Њ–і —В–µ—А–Љ–Є–љ–∞–Љ–Є –Ѓ–†–Р/–Ѓ–•–Р/–Ѓ–Ш–Р —Б–Ї—А—Л–≤–∞–µ—В—Б—П –≥—А—Г–њ–њ–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –Є–Љ–µ—О—Й–∞—П –Ї–Њ–љ–Ї—А–µ—В–љ—Л–µ –љ–Њ–Ј–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В—Л —Г –≤–Ј—А–Њ—Б–ї—Л—Е – —А–µ–≤–Љ–∞—В–Њ–Є–і–љ—Л–є –∞—А—В—А–Є—В, —Б–њ–Њ–љ–і–Є–ї–Њ–∞—А—В—А–Є—В—Л, –њ—Б–Њ—А–Є–∞—В–Є—З–µ—Б–Ї–Є–є –∞—А—В—А–Є—В. –Я—А–Є –≤—Б–µ—Е —Н—В–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ —А–∞–Ј–ї–Є—З–Є—П –≤ –Є—Е –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ, –Є–љ–≥–Є–±–Є—В–Њ—А—Л –§–Э–Ю –њ–Њ–Ї–∞–Ј–∞–ї–Є —Б–≤–Њ—О –≤—Л—Б–Њ–Ї—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В —А–∞—Б—Б—З–Є—В—Л–≤–∞—В—М –љ–∞ –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л–є —Н—Д—Д–µ–Ї—В –Є —Г –і–µ—В–µ–є. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –њ—А–Є —О–≤–µ–љ–Є–ї—М–љ–Њ–Љ –љ–∞—З–∞–ї–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є–Љ–µ—О—В—Б—П –Є —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–µ, –љ–µ—Е–∞—А–∞–Ї—В–µ—А–љ—Л–µ –і–ї—П –≤–Ј—А–Њ—Б–ї—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –≤–∞—А–Є–∞–љ—В—Л, –љ–∞–њ—А–Є–Љ–µ—А, –Ѓ–•–Р/–Ѓ–†–Р —Б –Р–Э–§––∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л–Љ —Г–≤–µ–Є—В–Њ–Љ, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–Љ –Њ–њ—Л—В –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –§–Э–Ю –Њ–Ї–∞–Ј–∞–ї—Б—П –≤–µ—Б—М–Љ–∞ —Г—Б–њ–µ—И–љ—Л–Љ, —Е–Њ—В—П –Є –њ—А–Њ—В–Є–≤–Њ—А–µ—З–Є–≤—Л–Љ.
–Ю—Б–Њ–±—Г—О –Ї–∞—В–µ–≥–Њ—А–Є—О –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Њ—В–ї–Є—З–љ—Г—О –Њ—В –≤–Ј—А–Њ—Б–ї—Л—Е –±–Њ–ї—М–љ—Л—Е –†–Р, –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В –±–Њ–ї—М–љ—Л–µ —Б–Є—Б—В–µ–Љ–љ—Л–Љ –≤–∞—А–Є–∞–љ—В–Њ–Љ –Ѓ–†–Р/–Ѓ–Ш–Р, –Ї–Њ—В–Њ—А—Л–Љ —Б–≤–Њ–є—Б—В–≤–µ–љ–µ–љ –љ–∞–Є–±–Њ–ї–µ–µ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–є –њ—А–Њ–≥–љ–Њ–Ј –Є–Ј––Ј–∞: 1) —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –ґ–Є–Ј–љ–µ—Г–≥—А–Њ–ґ–∞—О—Й–Є—Е —Б–Њ—Б—В–Њ—П–љ–Є–є –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –Љ–∞–љ–Є—Д–µ—Б—В–∞—Ж–Є–Є —Б–Є—Б—В–µ–Љ–љ—Л—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є (–њ–Њ–ї–Є—Б–µ—А–Њ–Ј–Є—В, —Б–Є–љ–і—А–Њ–Љ –∞–Ї—В–Є–≤–∞—Ж–Є–Є –Љ–∞–Ї—А–Њ—Д–∞–≥–Њ–≤ –Є –і—А.); 2) –і–µ—Б—В—А—Г–Ї—В–Є–≤–љ–Њ–≥–Њ –њ–Њ–ї–Є–∞—А—В—А–Є—В–∞ —Б –Љ–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ—Л–Љ–Є –∞–≤–∞—Б–Ї—Г–ї—П—А–љ—Л–Љ–Є –љ–µ–Ї—А–Њ–Ј–∞–Љ–Є –Ї—А—Г–њ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤, –Њ—Б–Њ–±–µ–љ–љ–Њ —В–∞–Ј–Њ–±–µ–і—А–µ–љ–љ—Л—Е; 3) –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є –Ј–∞–і–µ—А–ґ–Ї–Є —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–≥–Њ –Є –њ–Њ–ї–Њ–≤–Њ–≥–Њ —А–∞–Ј–≤–Є—В–Є—П; 4) –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ –≤—Л—Б–Њ–Ї–Њ–≥–Њ —Б—А–µ–і–Є –≤—Б–µ—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –≤–∞—А–Є–∞–љ—В–Њ–≤ –Ѓ–Р —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –∞–Љ–Є–ї–Њ–Є–і–Њ–Ј–∞ –≤–љ—Г—В—А–µ–љ–љ–Є—Е –Њ—А–≥–∞–љ–Њ–≤; 5) —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Ї –±–Њ–ї—М—И–Є–љ—Б—В–≤—Г –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤, –≤–Ї–ї—О—З–∞—П –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—О –С–Я–Т–Я. –Ф–ї—П —Б–Є—Б—В–µ–Љ–љ–Њ–≥–Њ –≤–∞—А–Є–∞–љ—В–∞ –Ѓ–†–Р/–Ѓ–Ш–Р —Е–∞—А–∞–Ї—В–µ—А–љ—Л –љ–∞–Є–±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–µ –Ј–љ–∞—З–µ–љ–Є—П –Њ—Б—В—А–Њ—Д–∞–Ј–Њ–≤—Л—Е –±–µ–ї–Ї–Њ–≤, –∞ —В–∞–Ї–ґ–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є, –Њ—В—А–∞–ґ–∞—О—Й–Є–µ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Н—Д—Д–µ–Ї—В—Л –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤ (—В—П–ґ–µ–ї–∞—П –∞–љ–µ–Љ–Є—П, –≥–Є–њ–µ—А–ї–µ–є–Ї–Њ—Ж–Є—В–Њ–Ј, —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–Ј, –≥–Є–њ–µ—А—Д–µ—А–Љ–µ–љ—В–µ–Љ–Є—П). –Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —В–Њ, —З—В–Њ –±–Њ–ї—М–љ—Л–µ —Б–Є—Б—В–µ–Љ–љ—Л–Љ –≤–∞—А–Є–∞–љ—В–Њ–Љ –Ѓ–†–Р/–Ѓ–Ш–Р –≤ —Б–Є–ї—Г –≤—Л—И–µ—Г–Ї–∞–Ј–∞–љ–љ—Л—Е –њ—А–Є—З–Є–љ –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В—Б—П –љ–∞–Є–±–Њ–ї–µ–µ –љ—Г–ґ–і–∞—О—Й–Є–Љ–Є—Б—П –≤ –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є –Ї–∞–љ–і–Є–і–∞—В–∞–Љ–Є, —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—П —Н—В–Њ–є –Ї–∞—В–µ–≥–Њ—А–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є –§–Э–Ю –і–Є—Б–Ї—Г—В–Є—А—Г–µ—В—Б—П –≤ –ї–Є—В–µ—А–∞—В—Г—А–µ –Є –≤—Л–Ј—Л–≤–∞–µ—В –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ—Л–µ —Б–Њ–Љ–љ–µ–љ–Є—П, —В.–Ї. –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є –±–Њ–ї–µ–µ –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ—Л–Љ —Б—З–Є—В–∞–µ—В—Б—П –±–ї–Њ–Ї–Є—А–Њ–≤–∞–љ–Є–µ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –і—А—Г–≥–Є—Е —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ –Љ–Є—А–Њ–≤–Њ–є –њ–µ–і–Є–∞—В—А–Є—З–µ—Б–Ї–Њ–є —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є–µ–є –љ–∞–Ї–Њ–њ–ї–µ–љ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–є –Њ–њ—Л—В –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –§–Э–Ю –Є –њ—А–Є —Б–Є—Б—В–µ–Љ–љ–Њ–Љ –≤–∞—А–Є–∞–љ—В–µ –Ѓ–Р, –Њ—Б–Њ–±–µ–љ–љ–Њ —Н—В–∞–љ–µ—А—Ж–µ–њ—В–∞, —З—В–Њ –±—Г–і–µ—В –і–∞–ї–µ–µ –Њ–±—Б—Г–ґ–і–µ–љ–Њ –њ–Њ–і—А–Њ–±–љ–µ–µ.
–Я–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б–Њ –≤–Ј—А–Њ—Б–ї—Л–Љ–Є –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –∞–љ—В–Є—Ж–Є—В–Њ–Ї–Є–љ–Њ–≤–Њ–є —В–µ—А–∞–њ–Є–Є —Г –і–µ—В–µ–є –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В—Б—П –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ –±–Њ–ї–µ–µ –±–µ–Ј–Њ–њ–∞—Б–љ—Л–Љ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є –Є –љ–µ–Њ–њ–ї–∞–Ј–Є–є, —З—В–Њ –њ–Њ–і—В–≤–µ—А–ґ–і–∞–µ—В—Б—П –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л–Љ–Є –і–∞–љ–љ—Л–Љ–Є –≤—Л–њ–Њ–ї–љ–µ–љ–љ—Л—Е –≤ —А–∞–Ј–љ—Л—Е —Б—В—А–∞–љ–∞—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є.
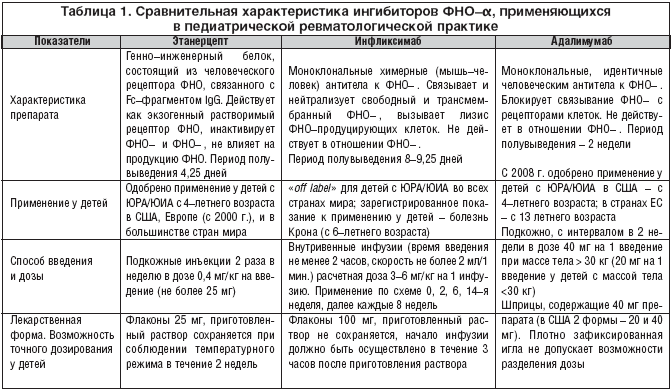
–Т–∞–ґ–љ–Њ–є –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—М—О, –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞—О—Й–µ–є –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–µ —В—А–µ–±–Њ–≤–∞–љ–Є—П, –њ—А–µ–і—К—П–≤–ї—П–µ–Љ—Л–µ –Ї –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–Љ —Д–Њ—А–Љ–∞–Љ, –њ—А–Є–Љ–µ–љ—П—О—Й–Є–Љ—Б—П —Г –і–µ—В–µ–є, —П–≤–ї—П–µ—В—Б—П –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –Њ–±–µ—Б–њ–µ—З–µ–љ–Є—П –љ–∞–Є–±–Њ–ї–µ–µ —В–Њ—З–љ–Њ–≥–Њ –і–Њ–Ј–Є—А–Њ–≤–∞–љ–Є—П –Є–Ј —А–∞—Б—З–µ—В–∞ –љ–∞ –Љ–∞—Б—Б–Њ–—А–Њ—Б—В–Њ–≤—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є —А–µ–±–µ–љ–Ї–∞. –Т —Н—В–Њ–Љ —Б–Љ—Л—Б–ї–µ —Б—А–µ–і–Є —В—А–µ—Е –Њ—Б–љ–Њ–≤–љ—Л—Е –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї–µ–є –§–Э–Ю––Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ (—Н—В–∞–љ–µ—А—Ж–µ–њ—В, –Є–љ—Д–ї–Є–Ї—Б–Є–Љ–∞–±, –∞–і–∞–ї–Є–Љ—Г–Љ–∞–±) –Њ–њ—В–Є–Љ–∞–ї—М–љ—Л–Љ –і–ї—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П —Г –і–µ—В–µ–є —П–≤–ї—П–µ—В—Б—П —Н—В–∞–љ–µ—А—Ж–µ–њ—В, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–љ—Л–є –Ї —Г–њ–Њ—В—А–µ–±–ї–µ–љ–Є—О –ї–Є–Њ—Д–Є–ї–Є–Ј–∞—В –Љ–Њ–ґ–µ—В —Б–Њ—Е—А–∞–љ—П—В—М—Б—П –њ—А–Є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–µ–Љ —В–µ–Љ–њ–µ—А–∞—В—Г—А–љ–Њ–Љ —А–µ–ґ–Є–Љ–µ –≤ —В–µ—З–µ–љ–Є–µ 2 –љ–µ–і–µ–ї—М –Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П –і–ї—П —Б–ї–µ–і—Г—О—Й–Є—Е –Є–љ—К–µ–Ї—Ж–Є–є. –Т —В–∞–±–ї–Є—Ж–µ 1 –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Њ —Б–Њ–њ–Њ—Б—В–∞–≤–ї–µ–љ–Є–µ –Њ—Б–љ–Њ–≤–љ—Л—Е —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –§–Э–Ю, –Ї–Њ—В–Њ—А—Л–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Г—З–Є—В—Л–≤–∞—В—М –њ—А–Є –≤—Л–±–Њ—А–µ –њ—А–µ–њ–∞—А–∞—В–∞.
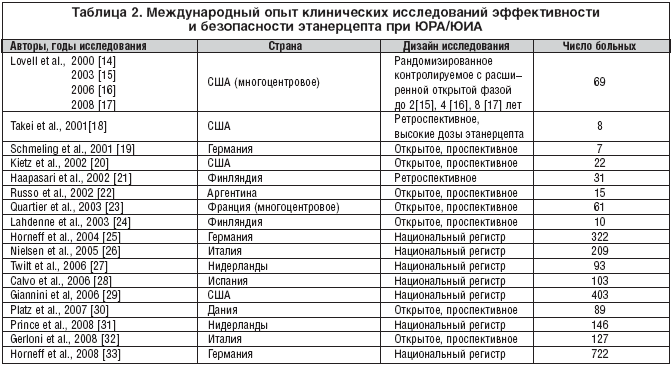
–°—А–µ–і–Є –≤—Б–µ—Е –У–Ш–С–Я, –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л—Е –≤ —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є–Є, –љ–∞–Є–±–Њ–ї–µ–µ –Њ–±—И–Є—А–љ—Л–є –Њ–њ—Л—В –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Г –і–µ—В–µ–є —Б —О–≤–µ–љ–Є–ї—М–љ—Л–Љ –∞—А—В—А–Є—В–Њ–Љ –≤ –Љ–Є—А–µ –љ–∞–Ї–Њ–њ–ї–µ–љ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —Н—В–∞–љ–µ—А—Ж–µ–њ—В–∞. –Т–∞–ґ–љ–Њ, —З—В–Њ —Н—В–Њ—В –Њ–њ—Л—В –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ –љ–µ —В–Њ–ї—М–Ї–Њ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–Љ–Є –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л–Љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П–Љ–Є (–†–Ъ–Ш), –≤ –Ї–Њ—В–Њ—А—Л–µ, –Ї–∞–Ї –Є–Ј–≤–µ—Б—В–љ–Њ, —А–µ–Ї—А—Г—В–Є—А—Г—О—В—Б—П —В—Й–∞—В–µ–ї—М–љ–Њ –Њ—В–Њ–±—А–∞–љ–љ—Л–µ –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б–Њ —Б—В—А–Њ–≥–Є–Љ–Є –Ї—А–Є—В–µ—А–Є—П–Љ–Є –±–Њ–ї—М–љ—Л–µ, –љ–Њ –Є –і–∞–љ–љ—Л–Љ–Є —А—П–і–∞ –љ–∞—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е —А–µ–≥–Є—Б—В—А–Њ–≤, —Б–Њ–і–µ—А–ґ–∞—Й–Є—Е –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—О –Њ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е —Б–Њ—В–љ—П—Е –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞—О—Й–Є—Е —Н—В–∞–љ–µ—А—Ж–µ–њ—В –≤ —Г—Б–ї–Њ–≤–Є—П—Е –Њ–±—Л—З–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–Є. –Т —В–∞–±–ї–Є—Ж–µ 2 —Б—Г–Љ–Љ–Є—А–Њ–≤–∞–љ—Л –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ—Л–µ –і–∞–љ–љ—Л–µ –Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —Н—В–∞–љ–µ—А—Ж–µ–њ—В–∞ —Г –і–µ—В–µ–є. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Ї –љ–∞—Б—В–Њ—П—Й–µ–Љ—Г –≤—А–µ–Љ–µ–љ–Є —Б—Д–Њ—А–Љ–Є—А–Њ–≤–∞–ї–∞—Б—М —Б–Њ–ї–Є–і–љ–∞—П –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–∞—П –±–∞–Ј–∞ –≤—Л—Б–Њ–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –њ—А–Є–µ–Љ–ї–µ–Љ–Њ–є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є —Н—В–∞–љ–µ—А—Ж–µ–њ—В–∞ –њ—А–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –≤–∞—А–Є–∞–љ—В–∞—Е –Ѓ–Р.
–Ь–µ—В–∞––∞–љ–∞–ї–Є–Ј —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Н—В–∞–љ–µ—А—Ж–µ–њ—В–∞ –њ—А–Є –Ѓ–Р –Њ–±–ї–µ–≥—З–∞–µ—В—Б—П —В–µ–Љ, —З—В–Њ –≤–Њ –≤—Б–µ—Е –њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е —Н—В–∞–љ–µ—А—Ж–µ–њ—В –њ—А–Є–Љ–µ–љ—П–ї—Б—П –њ–Њ –µ–і–Є–љ–Њ–є –Љ–µ—В–Њ–і–Є–Ї–µ –≤ –і–Њ–Ј–∞—Е 0,4 –Љ–≥/–Ї–≥ –≤–µ—Б–∞ –і–≤–∞–ґ–і—Л –≤ –љ–µ–і–µ–ї—О –њ–Њ–і–Ї–Њ–ґ–љ–Њ, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –Љ–µ—В–Њ—В—А–µ–Ї—Б–∞—В–Њ–Љ (–Њ–±—Л—З–љ–Њ –≤ –і–Њ–±–∞–≤–ї–µ–љ–Є–µ –Ї –Љ–µ—В–Њ—В—А–µ–Ї—Б–∞—В—Г –≤ —Б–ї—Г—З–∞–µ –µ–≥–Њ –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є) –Є–ї–Є –≤ –≤–Є–і–µ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є. –Ю—Ж–µ–љ–Ї–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —В–µ—А–∞–њ–Є–Є —В–∞–Ї–ґ–µ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї–∞—Б—М –њ–Њ —Г–љ–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–є –Љ–µ—В–Њ–і–Є–Ї–µ, —Б–њ–µ—Ж–Є–∞–ї—М–љ–Њ —А–∞–Ј—А–∞–±–Њ—В–∞–љ–љ–Њ–є –Њ–Ї–Њ–ї–Њ 10 –ї–µ—В –љ–∞–Ј–∞–і –і–ї—П –Њ–њ—В–Є–Љ–Є–Ј–∞—Ж–Є–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –≤ –і–µ—В—Б–Ї–Њ–є —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є–Є [34]. –Ь–µ—В–Њ–і–Є–Ї–∞ –Њ—Ж–µ–љ–Ї–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П –њ—А–Є –Ѓ–†–Р/–Ѓ–Ш–Р –≤ –≤–Є–і–µ –Ї—А–Є—В–µ—А–Є–µ–≤ ACR pedi 30,50,70 («–њ–µ–і–Є–∞—В—А–Є—З–µ—Б–Ї–Є–µ» –Ї—А–Є—В–µ—А–Є–Є –Р–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Њ–є –Ї–Њ–ї–ї–µ–≥–Є–Є —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Њ–≤ – 30, 50 –Є 70% –Њ—В–≤–µ—В–∞ –љ–∞ —В–µ—А–∞–њ–Є—О) –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Њ—В–ї–Є—З–∞–µ—В—Б—П –Њ—В –∞–љ–∞–ї–Њ–≥–Є—З–љ–Њ–≥–Њ –Є–љ—Б—В—А—Г–Љ–µ–љ—В–∞, –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ–Њ–≥–Њ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –њ—А–Є –†–Р –≤–Ј—А–Њ—Б–ї—Л—Е. –†–∞–Ј–ї–Є—З–Є—П –Ї–∞—Б–∞—О—В—Б—П: 1) –њ–µ—А–µ—З–љ—П –Њ—Ж–µ–љ–Є–≤–∞–µ–Љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є (6 –≤–Љ–µ—Б—В–Њ 8); 2) –њ–µ—А–µ—З–љ—П –њ–Њ–і–ї–µ–ґ–∞—Й–Є—Е –Њ—Ж–µ–љ–Ї–µ —Б—Г—Б—В–∞–≤–Њ–≤ (—Г—З–Є—В—Л–≤–∞–µ—В—Б—П –Ї–∞–ґ–і—Л–є –Є–Ј 75 —Б—Г—Б—В–∞–≤–Њ–≤ –Ј–∞ –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ —Г—З–Є—В—Л–≤–∞—О—Й–µ–≥–Њ—Б—П –Ј–∞ –Њ–і–Є–љ —Б—Г—Б—В–∞–≤ –њ—А–Њ–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–≥–Њ –Љ–µ–ґ—Д–∞–ї–∞–љ–≥–Њ–≤–Њ–≥–Њ –Є –і–Є—Б—В–∞–ї—М–љ–Њ–≥–Њ –Љ–µ–ґ—Д–∞–ї–∞–љ–≥–Њ–≤–Њ–≥–Њ —Б—Г—Б—В–∞–≤–∞ –Ї–∞–ґ–і–Њ–≥–Њ –Є–Ј 2–5 –њ–∞–ї—М—Ж–µ–≤ –љ–∞ —Б—В–Њ–њ–∞—Е; 3) –Ј–∞ –Љ–Є–љ–Є–Љ–∞–ї—М–љ—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —В–µ—А–∞–њ–Є–Є –њ—А–Є–љ–Є–Љ–∞–µ—В—Б—П 30% —Г–ї—Г—З—И–µ–љ–Є–µ (–≤–Љ–µ—Б—В–Њ 20% –њ—А–Є –†–Р –≤–Ј—А–Њ—Б–ї—Л—Е) –њ–Њ–і–ї–µ–ґ–∞—Й–Є—Е –Њ—Ж–µ–љ–Ї–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є. –Т –њ–µ–і–Є–∞—В—А–Є—З–µ—Б–Ї–Њ–є —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є–Є –Њ—Ж–µ–љ–Є–≤–∞–µ—В—Б—П 6 –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є:
• —З–Є—Б–ї–Њ «–∞–Ї—В–Є–≤–љ—Л—Е» —Б—Г—Б—В–∞–≤–Њ–≤ (–Є–Ј 75 —Б—Г—Б—В–∞–≤–Њ–≤)
• —З–Є—Б–ї–Њ —Б—Г—Б—В–∞–≤–Њ–≤ —Б –Њ–≥—А–∞–љ–Є—З–µ–љ–Є–µ–Љ —Д—Г–љ–Ї—Ж–Є–Є (–Є–Ј 75 —Б—Г—Б—В–∞–≤–Њ–≤)
• –°–Ю–≠ –Є/–Є–ї–Є –°–†–С
• –Њ–±—Й–∞—П –Њ—Ж–µ–љ–Ї–∞ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –±–Њ–ї–µ–Ј–љ–Є –њ–Њ –Љ–љ–µ–љ–Є—О –≤—А–∞—З–∞ (–Т–Р–®)
• –Њ—Ж–µ–љ–Ї–∞ –Њ–±—Й–µ–≥–Њ —Б–∞–Љ–Њ—З—Г–≤—Б—В–≤–Є—П (–∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –±–Њ–ї–µ–Ј–љ–Є) –њ–Њ –Љ–љ–µ–љ–Є—О –њ–∞—Ж–Є–µ–љ—В–∞ –Є–ї–Є –µ–≥–Њ —А–Њ–і–Є—В–µ–ї–µ–є (–Т–Р–®)
• –Њ—Ж–µ–љ–Ї–∞ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є —Б –њ–Њ–Љ–Њ—Й—М—О –Ю–њ—А–Њ—Б–љ–Є–Ї–∞ Childhood Health Assesment Quesionnare – CHAQ
–Ф–Є–љ–∞–Љ–Є–Ї–∞ –њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –ї–µ—З–µ–љ–Є—П –і–∞–µ—В –Њ—Б–љ–Њ–≤–∞–љ–Є–µ —Б—Г–і–Є—В—М –Њ —Б—В–µ–њ–µ–љ–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є: 30% —Г–ї—Г—З—И–µ–љ–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Б—З–Є—В–∞—В—М —Н—Д—Д–µ–Ї—В —Г–Љ–µ—А–µ–љ–љ–Њ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–Љ, 50% – —Е–Њ—А–Њ—И–Є–Љ; 70% – –Њ—З–µ–љ—М —Е–Њ—А–Њ—И–Є–Љ.
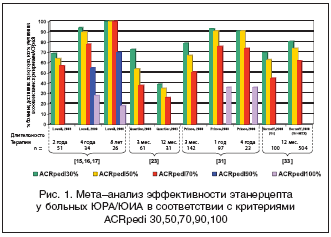
–Ю—Б–≤–µ—Й–∞—П –Њ–њ—Л—В –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Н—В–∞–љ–µ—А—Ж–µ–њ—В–∞ –њ—А–Є –Ѓ–Р, —Б–ї–µ–і—Г–µ—В –њ–Њ–і—А–Њ–±–љ–µ–µ –Њ—Б—В–∞–љ–Њ–≤–Є—В—М—Б—П –љ–∞ –≤—Л–њ–Њ–ї–љ–µ–љ–љ–Њ–Љ (–Є –њ—А–Њ–і–Њ–ї–ґ–∞—О—Й–µ–Љ—Б—П –і–Њ –љ–∞—Б—В–Њ—П—Й–µ–≥–Њ –≤—А–µ–Љ–µ–љ–Є) –≤ –°–®–Р –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є D. Lovell c —Б–Њ–∞–≤—В. [14–17], –њ–Њ—В–Њ–Љ—Г —З—В–Њ: 1) —Н—В–Њ –±—Л–ї–Њ –њ–µ—А–≤–Њ–µ —Б–µ—А—М–µ–Ј–љ–Њ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Н—В–∞–љ–µ—А—Ж–µ–њ—В–∞ —Г –і–µ—В–µ–є; 2) —Н—В–Њ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –њ–Њ–і—А–∞–Ј—Г–Љ–µ–≤–∞–≤—И–µ–µ 3––Љ–µ—Б—П—З–љ—Г—О –љ–∞—З–∞–ї—М–љ—Г—О –Њ—В–Ї—А—Л—В—Г—О —Д–∞–Ј—Г —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ 4––Љ–µ—Б—П—З–љ—Л–Љ –њ–ї–∞—Ж–µ–±–Њ––Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ–Љ; 3) —Н—В–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї–Њ –њ—А–Њ–і–Њ–ї–ґ–µ–љ–Њ –≤ –Њ—В–Ї—А—Л—В–Њ–Љ —А–µ–ґ–Є–Љ–µ –њ—А–Є–µ–Љ–∞ —Н—В–∞–љ–µ—А—Ж–µ–њ—В–∞ –≤–њ–ї–Њ—В—М –і–Њ –љ–∞—Б—В–Њ—П—Й–µ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –Є –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ—Л–µ –≤ 2008 –≥. —А–µ–Ј—Г–ї—М—В–∞—В—Л –Њ—Е–≤–∞—В—Л–≤–∞—О—В 8––ї–µ—В–љ–Є–є –њ–µ—А–Є–Њ–і –љ–µ–њ—А–µ—А—Л–≤–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Н—В–∞–љ–µ—А—Ж–µ–њ—В–∞ —Г –і–µ—В–µ–є —Б –њ–Њ–ї–Є–∞—А—В–Є–Ї—Г–ї—П—А–љ—Л–Љ –≤–∞—А–Є–∞–љ—В–Њ–Љ —В–µ—З–µ–љ–Є—П –Ѓ–†–Р. –Т —Н—В–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Є–Ј–љ–∞—З–∞–ї—М–љ–Њ –±—Л–ї–Њ –≤–Ї–ї—О—З–µ–љ–Њ 69 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —Г 74% –Є–Ј –Ї–Њ—В–Њ—А—Л—Е –Ї –Њ–Ї–Њ–љ—З–∞–љ–Є—О 3 –Љ–µ—Б—П—Ж–µ–≤ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Н—В–∞–љ–µ—А—Ж–µ–њ—В–∞ –≤ –Њ—В–Ї—А—Л—В–Њ–Љ —А–µ–ґ–Є–Љ–µ –±—Л–ї–Њ –і–Њ—Б—В–Є–≥–љ—Г—В–Њ 30% —Г–ї—Г—З—И–µ–љ–Є–µ –њ–Њ –Ї—А–Є—В–µ—А–Є—П–Љ ACR pedi. –Т –њ–ї–∞—Ж–µ–±–Њ––Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–є —Д–∞–Ј–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ—А–Њ—Ж–µ–љ—В –±–Њ–ї—М–љ—Л—Е, –і–Њ—Б—В–Є–≥—И–Є—Е 30% —Г–ї—Г—З—И–µ–љ–Є—П, —Г–≤–µ–ї–Є—З–Є–ї—Б—П –і–Њ 80% —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –≤ –≥—А—Г–њ–њ—Г —Н—В–∞–љ–µ—А—Ж–µ–њ—В–∞, –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б–Њ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —Н—В–Њ–≥–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –і–Њ 35% –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –њ–ї–∞—Ж–µ–±–Њ. –Я—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–Є–µ —В–µ—А–∞–њ–Є–Є —Н—В–∞–љ–µ—А—Ж–µ–њ—В–Њ–Љ –≤ —А–∞–Љ–Ї–∞—Е –і–∞–ї—М–љ–µ–є—И–µ–≥–Њ –Њ—В–Ї—А—Л—В–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤–њ–ї–Њ—В—М –і–Њ 8 –ї–µ—В –љ–µ–њ—А–µ—А—Л–≤–љ–Њ–≥–Њ –њ—А–Є–µ–Љ–∞ –њ–Њ–Ї–∞–Ј–∞–ї–Њ –і–∞–ї—М–љ–µ–є—И–µ–µ –љ–∞—А–∞—Б—В–∞–љ–Є–µ —Н—Д—Д–µ–Ї—В–∞, –Ї–∞–Ї —Н—В–Њ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Њ –љ–∞ –і–Є–∞–≥—А–∞–Љ–Љ–µ (—А–Є—Б. 1, 1–3–—П –≥—А—Г–њ–њ–∞ —Б—В–Њ–ї–±—Ж–Њ–≤). –Ґ–∞–Ї, —Б—А–µ–і–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Ј–∞–Ї–Њ–љ—З–Є–≤—И–Є—Е 8––ї–µ—В–љ–Є–є –њ–µ—А–Є–Њ–і –љ–µ–њ—А–µ—А—Л–≤–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Н—В–∞–љ–µ—А—Ж–µ–њ—В–∞ (—В–∞–Ї–Њ–≤—Л—Е –Њ—Б—В–∞–ї–Њ—Б—М 11) –±—Л–ї–Њ –Њ—В–Љ–µ—З–µ–љ–Њ –і–Њ—Б—В–Є–ґ–µ–љ–Є–µ –≤—Б–µ–Љ–Є 100% –±–Њ–ї—М–љ—Л—Е –Ї—А–Є—В–µ—А–Є–µ–≤ 30, 50 –Є 70% —Г–ї—Г—З—И–µ–љ–Є—П, –∞ —Г 18% – 100% —Г–ї—Г—З—И–µ–љ–Є—П [17].
–°—В–Њ–ї—М –Њ—З–µ–≤–Є–і–љ—Л–є –±–Њ–ї–µ–Ј–љ—М––Љ–Њ–і–Є—Д–Є—Ж–Є—А—Г—О—Й–Є–є —Н—Д—Д–µ–Ї—В —Н—В–∞–љ–µ—А—Ж–µ–њ—В–∞ –њ–Њ—Б—В–∞–≤–Є–ї –≤–Њ–њ—А–Њ—Б –њ–µ—А–µ–і —Г—З–µ–љ—Л–Љ–Є –Њ –≤–љ–µ—Б–µ–љ–Є–Є —Г—В–Њ—З–љ–µ–љ–Є–є –≤ –Љ–µ—В–Њ–і–Њ–ї–Њ–≥–Є—О –Њ—Ж–µ–љ–Ї–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤ –≤ —Г—Б–ї–Њ–≤–Є—П—Е –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –∞–≥–µ–љ—В–Њ–≤. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, –±—Л–ї–Њ —Б–Њ—З—В–µ–љ–Њ —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ—Л–Љ –≤–≤–µ–і–µ–љ–Є–µ –њ–Њ–љ—П—В–Є—П 90% –Є 100% —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –Ї—А–Є—В–µ—А–Є—П–Љ–Є ACR pedi (ACRpedi90 –Є ACRpedi100), –∞ —В–∞–Ї–ґ–µ –њ–Њ—В—А–µ–±–Њ–≤–∞–ї–Њ —А–∞–Ј—А–∞–±–Њ—В–Ї–Є –і–µ—Д–Є–љ–Є—Ж–Є–Є –њ–Њ–љ—П—В–Є—П «—А–µ–Љ–Є—Б—Б–Є—П» –њ—А–Є –Ѓ–†–Р/–Ѓ–Ш–Р. –° —В–∞–Ї–Є–Љ –Њ—В–ї–Є—З–љ—Л–Љ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–Љ –Ї–Њ–љ—В—А–∞—Б—В–Є—А—Г—О—В –і–∞–љ–љ—Л–µ, –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ—Л–µ –≤ —В–µ –ґ–µ –≥–Њ–і—Л Quartier P. —Б —Б–Њ–∞–≤—В., [23], –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ –≤ –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤–Њ–Љ 12––Љ–µ—Б—П—З–љ–Њ–Љ –Њ—В–Ї—А—Л—В–Њ–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –≤–Њ –§—А–∞–љ—Ж–Є–Є. –≠—В–Њ—В —Д–∞–Ї—В –Љ–Њ–ґ–µ—В —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤–Њ–≤–∞—В—М –Њ –±–Њ–ї–µ–µ «—А–∞—Д–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є» –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–є –њ–Њ–њ—Г–ї—П—Ж–Є–Є –≤ —Г—Б–ї–Њ–≤–Є—П—Е —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —А–µ–∞–ї—М–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–Њ–є. –°–ї–µ–і—Г–µ—В —В–∞–Ї–ґ–µ —Г—З–µ—Б—В—М, —З—В–Њ –≤—Б–µ –њ—Г–±–ї–Є–Ї–∞—Ж–Є–Є –Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –≤ —Н—В–∞–љ–µ—А—Ж–µ–њ—В–∞ –≤ –і–µ—В–µ–є –≤ 2000–2003 –≥–≥. –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –Ї–∞—Б–∞–ї–Є—Б—М —А–µ—Д—А–∞–Ї—В–µ—А–љ—Л—Е –Ї «—Б—В–∞–љ–і–∞—А—В–љ–Њ–є» —В–µ—А–∞–њ–Є–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –≤–∞—А–Є–∞–љ—В–Њ–≤, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –≤ –њ–Њ–і–∞–≤–ї—П—О—Й–µ–Љ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Б—А–µ–і–љ—П—П –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –±–Њ–ї–µ–Ј–љ–Є –∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–≤—И–Є–є—Б—П –Ї–Њ–≥–Њ—А—В—Л –±–Њ–ї—М–љ—Л—Е –±—Л–ї–∞ –љ–µ –Љ–µ–љ–µ–µ 5 –ї–µ—В. –£ —В–∞–Ї–Њ–≥–Њ –Ї–Њ–љ—В–Є–љ–≥–µ–љ—В–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞—В—М —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Ї–∞–Ї–Њ–є––ї–Є–±–Њ —В–µ—А–∞–њ–Є–Є –±–µ–Ј –∞–љ–∞–ї–Є–Ј–∞ —Д–∞–Ї—В–Њ—А–Њ–≤, –њ—А–Є–≤–µ–і—И–Є—Е –Ї —А–µ—Д—А–∞–Ї—В–µ—А–љ–Њ—Б—В–Є, –Љ–∞–ї–Њ–њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ–Њ.
–Ф–Њ—Б—В–∞—В–Њ—З–љ–Њ –Њ–њ—В–Є–Љ–Є—Б—В–Є—З–љ—Л–Љ–Є –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В—Б—П –љ–µ–і–∞–≤–љ–Њ –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ—Л–µ –і–∞–љ–љ—Л–µ –љ–∞—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е —А–µ–≥–Є—Б—В—А–Њ–≤ –њ–Њ–ї—Г—З–∞—О—Й–Є—Е —Н—В–∞–љ–µ—А—Ж–µ–њ—В –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Ѓ–Р –Є–Ј –Э–Є–і–µ—А–ї–∞–љ–і–Њ–≤ –Є –У–µ—А–Љ–∞–љ–Є–Є [31,33]. –Ґ–∞–Ї, —А–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П Prince F.H.M. —Б —Б–Њ–∞–≤—В. [31] –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ —Б—А–µ–і–Є –±–Њ–ї—М–љ—Л—Е –Ѓ–Ш–Р, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –љ–µ–њ—А–µ—А—Л–≤–љ–Њ —Н—В–∞–љ–µ—А—Ж–µ–њ—В –Њ—В 1 –і–Њ 5 –ї–µ—В —З–∞—Б—В–Њ—В–∞ –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —А–µ–Љ–Є—Б—Б–Є–Є —Б–Њ—Б—В–∞–≤–Є–ї–∞ –Њ—В 36 –і–Њ 50%.
–Э–µ—Б–Њ–Љ–љ–µ–љ–љ—Л–Љ –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤–Њ–Љ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є —Н—В–∞–љ–µ—А—Ж–µ–њ—В–∞ –Ї —Б—В–Њ–є–Ї–Њ–Љ—Г –њ–Њ–і–∞–≤–ї–µ–љ–Є—О –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —П–≤–ї—П—О—В—Б—П –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ Vojvodich F.P. —Б —Б–Њ–∞–≤—В. [35] –і–∞–љ–љ—Л–µ –Њ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–Є —В–µ–Љ–њ–Њ–≤ –ї–Є–љ–µ–є–љ–Њ–≥–Њ —А–Њ—Б—В–∞ —Г –±–Њ–ї—М–љ—Л—Е –Ѓ–Ш–Р –њ—А–µ–њ—Г–±–µ—А—В–∞—В–љ–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ 1––≥–Њ–і–Є—З–љ–Њ–є —В–µ—А–∞–њ–Є–Є —Н—В–∞–љ–µ—А—Ж–µ–њ—В–Њ–Љ. –≠—В–∞ —А–∞–±–Њ—В–∞ –Є–Љ–µ–µ—В –≤–∞–ґ–љ–Њ–µ –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –Ј–∞–і–µ—А–ґ–Ї–∞ —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–≥–Њ —А–∞–Ј–≤–Є—В–Є—П —П–≤–ї—П–µ—В—Б—П –Њ–і–љ–Є–Љ –Є–Ј —Б–µ—А—М–µ–Ј–љ—Л—Е, —Б–Њ—Ж–Є–∞–ї—М–љ–Њ––Ј–љ–∞—З–Є–Љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Ѓ–Р.
–Ф–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞–љ–љ—Л–є –Њ—В–≤–µ—В –љ–∞ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –±–∞–Ј–Є—Б–љ—Л—Е –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Є –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –∞–≥–µ–љ—В–Њ–≤ –Ј–∞–≤–Є—Б–Є—В –Њ—В –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–∞—А–Є–∞–љ—В–∞ –Ѓ–Р. –Я—А–Є —В–Њ–Љ, —З—В–Њ –Њ—Д–Є—Ж–Є–∞–ї—М–љ–Њ –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–љ—Л–Љ –њ–Њ–Ї–∞–Ј–∞–љ–Є–µ–Љ –Ї –њ—А–Є–Љ–µ–љ–µ–љ–Є—О —Н—В–∞–љ–µ—А—Ж–µ–њ—В–∞ –≤ –°–®–Р –Є —Б—В—А–∞–љ–∞—Е –Х–° —П–≤–ї—П–µ—В—Б—П –њ–Њ–ї–Є–∞—А—В–Є–Ї—Г–ї—П—А–љ—Л–є (–њ–Њ —В–µ—З–µ–љ–Є—О) –≤–∞—А–Є–∞–љ—В –Ѓ–†–Р/–Ѓ–Ш–Р, –Є–Љ–µ–µ—В—Б—П –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –±–Њ–ї—М—И–Њ–є –Њ–њ—Л—В –µ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Є –њ—А–Є –і—А—Г–≥–Є—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –≤–∞—А–Є–∞–љ—В–∞—Е. –•–Њ—А–Њ—И–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л —В–µ—А–∞–њ–Є–Є —Н—В–∞–љ–µ—А—Ж–µ–њ—В–Њ–Љ –њ–Њ–ї—Г—З–µ–љ—Л —Г –±–Њ–ї—М–љ—Л—Е —Б –Њ—Б–Њ–±–Њ–є –Ї–∞—В–µ–≥–Њ—А–Є–µ–є –Ѓ–Ш–Р – –њ—А–Є –∞—А—В—А–Є—В–µ, –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ–Њ–Љ —Б —Н–љ—В–µ–Ј–Є—В–Њ–Љ, —З—В–Њ, –њ–Њ —Б—Г—В–Є, –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –њ—А–µ—Б–њ–Њ–љ–і–Є–ї–Є—З–µ—Б–Ї–Є–µ —Б—В–∞–і–Є–Є –∞–љ–Ї–Є–ї–Њ–Ј–Є—А—Г—О—Й–µ–≥–Њ —Б–њ–Њ–љ–і–Є–ї–Њ–∞—А—В—А–Є—В–∞ –Є–ї–Є —А–Њ–і—Б—В–≤–µ–љ–љ—Л—Е –µ–Љ—Г –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є [25, 27,28,31–33,36–40].
–Я—А–Є–Љ–µ—З–∞—В–µ–ї—М–љ–Њ, —З—В–Њ —Б—А–µ–і–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –≤–Њ—И–µ–і—И–Є—Е –≤ –Р–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Њ–µ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–µ –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–µ –Є –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–µ –Њ—В–Ї—А—Л—В–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –і–Њ–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Б–Є—Б—В–µ–Љ–љ—Л–Љ –њ–Њ –і–µ–±—О—В—Г –≤–∞—А–Є–∞–љ—В–Њ–Љ, —Б–Њ—Б—В–∞–≤–ї—П–≤—И–∞—П 33% –≤ –љ–∞—З–∞–ї–µ –Њ—В–Ї—А—Л—В–Њ–є —Д–∞–Ј—Л, —Г–Љ–µ–љ—М—И–Є–≤—И–Є—Б—М –і–Њ 19% –Ї 4––Љ—Г –≥–Њ–і—Г –љ–∞–±–ї—О–і–µ–љ–Є—П [15–17]. –Я–Њ –і–∞–љ–љ—Л–Љ –Э–Є–і–µ—А–ї–∞–љ–і—Б–Ї–Њ–≥–Њ —А–µ–≥–Є—Б—В—А–∞ [31], —Б—А–µ–і–Є –±–Њ–ї—М–љ—Л—Е –Ѓ–Ш–Р, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е —Н—В–∞–љ–µ—А—Ж–µ–њ—В, –і–Њ 27% —Б–Њ—Б—В–∞–≤–ї—П—О—В –њ–∞—Ж–Є–µ–љ—В—Л —Б —Б–Є—Б—В–µ–Љ–љ—Л–Љ –њ–Њ –і–µ–±—О—В—Г –≤–∞—А–Є–∞–љ—В–Њ–Љ, —В–Њ–≥–і–∞ –Ї–∞–Ї –≤ –∞–љ–∞–ї–Њ–≥–Є—З–љ–Њ–Љ –Э–µ–Љ–µ—Ж–Ї–Њ–Љ —А–µ–≥–Є—Б—В—А–µ –і–Њ–ї—П –±–Њ–ї—М–љ—Л—Е —Б–Є—Б—В–µ–Љ–љ—Л–Љ –Ѓ–Ш–Р –љ–Є–ґ–µ (11,3% –Њ—В 504 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е —Н—В–∞–љ–µ—А—Ж–µ–њ—В –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –Љ–µ—В–Њ—В—А–µ–Ї—Б–∞—В–Њ–Љ –Є 8% –Њ—В 100 –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є—О —Н—В–∞–љ–µ—А—Ж–µ–њ—В–Њ–Љ). –Т–њ—А–Њ—З–µ–Љ, –Љ–Њ–ґ–љ–Њ –њ—А–µ–і–њ–Њ–ї–∞–≥–∞—В—М, —З—В–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–∞—П —З–∞—Б—В—М –±–Њ–ї—М–љ—Л—Е —Б–Є—Б—В–µ–Љ–љ—Л–Љ –≤–∞—А–Є–∞–љ—В–Њ–Љ –Њ–Ї–∞–Ј–∞–ї–∞—Б—М —Б–Ї–Њ–љ—Ж–µ–љ—В—А–Є—А–Њ–≤–∞–љ–љ–Њ–є —Б—А–µ–і–Є 118 –±–Њ–ї—М–љ—Л—Е, –Ї–Њ—В–Њ—А—Л–µ –±—Л–ї–Є –Є—Б–Ї–ї—О—З–µ–љ—Л –Є–Ј –∞–љ–∞–ї–Є–Ј–∞ [33], –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –њ–Њ–ї—Г—З–∞–ї–Є —Н—В–∞–љ–µ—А—Ж–µ–њ—В –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –і—А—Г–≥–Є–Љ–Є –±–∞–Ј–Є—Б–љ—Л–Љ–Є –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є (–С–Я–Т–Я) – –∞–Ј–∞—В–Є–Њ–њ—А–Є–љ–Њ–Љ, —Ж–Є–Ї–ї–Њ—Б–њ–Њ—А–Є–љ–Њ–Љ –Р, –ї–µ—Д–ї—Г–љ–Њ–Љ–Є–і–Њ–Љ, –Љ–Є–Ї–Њ—Д–µ–љ–Њ–ї–∞—В–Њ–Љ, —Ж–Є–Ї–ї–Њ—Д–Њ—Б—Д–∞–Љ–Є–і–Њ–Љ, —В–∞–ї–Є–і–Њ–Љ–Є–і–Њ–Љ, —В.–µ. –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є, –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –љ–∞–Ј–љ–∞—З–∞–µ–Љ—Л–Љ–Є –њ—А–Є —А–µ—Д—А–∞–Ї—В–µ—А–љ—Л—Е –≤–∞—А–Є–∞–љ—В–∞—Е —Б–Є—Б—В–µ–Љ–љ–Њ–≥–Њ –Ѓ–Р. –Т—Л—Б–Њ–Ї–Њ–є –і–Њ–ї–µ–є –±–Њ–ї—М–љ—Л—Е —Б–Є—Б—В–µ–Љ–љ—Л–Љ –Ѓ–Р (36%) –Љ–Њ–ґ–љ–Њ –Њ—В—З–∞—Б—В–Є –Њ–±—К—П—Б–љ–Є—В—М –љ–µ–Ї–Њ—В–Њ—А—Г—О —А–∞–Ј–љ–Є—Ж—Г –≤ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —В–µ—А–∞–њ–Є–Є –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є Quartier P. —Б —Б–Њ–∞–≤—В. [23] –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –і–∞–љ–љ—Л–Љ–Є –і—А—Г–≥–Є—Е –∞–≤—В–Њ—А–Њ–≤. –Ґ–µ–Љ –±–Њ–ї–µ–µ, —З—В–Њ –Ј–∞–Ї–Њ–љ–Њ–Љ–µ—А–љ–Њ—Б—В—М –±–Њ–ї–µ–µ –љ–Є–Ј–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Н—В–∞–љ–µ—А—Ж–µ–њ—В–∞ –њ—А–Є —Б–Є—Б—В–µ–Љ–љ–Њ–Љ –≤–∞—А–Є–∞–љ—В–µ –Ѓ–Р, —А–∞–≤–љ–Њ –Ї–∞–Ї –Є –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –С–Я–Т–Я, —Е–Њ—А–Њ—И–Њ –Є–Ј–≤–µ—Б—В–љ–∞ –Є –Њ—В–Љ–µ—З–∞–µ—В—Б—П –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –≤–Њ –≤—Б–µ—Е –њ—Г–±–ї–Є–Ї–∞—Ж–Є—П—Е [15,22–24,27,29,31–33,41].
–°–Ї–∞–Ј–∞–љ–љ–Њ–µ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Ј–∞–Ї–ї—О—З–Є—В—М, —З—В–Њ —Н—В–∞–љ–µ—А—Ж–µ–њ—В –Љ–Њ–ґ–µ—В –њ—А–Є–Љ–µ–љ—П—В—М—Б—П –љ–µ —В–Њ–ї—М–Ї–Њ –њ—А–Є «–Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Њ–Љ» –њ–Њ–ї–Є–∞—А—В–Є–Ї—Г–ї—П—А–љ–Њ–Љ, –љ–Њ –Є –њ—А–Є –і—А—Г–≥–Є—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –≤–∞—А–Є–∞–љ—В–∞—Е –Ѓ–Р, –Њ–і–љ–∞–Ї–Њ –љ–µ —Б–ї–µ–і—Г–µ—В —А–∞—Б—Б—З–Є—В—Л–≤–∞—В—М –љ–∞ –µ–≥–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Ї–Њ–љ—В—А–Њ–ї—П –Ј–∞ —Б–Є—Б—В–µ–Љ–љ—Л–Љ–Є –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є –±–Њ–ї–µ–Ј–љ–Є. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ –Є–Љ–µ—О—В—Б—П –µ–і–Є–љ–Є—З–љ—Л–µ –љ–∞–±–ї—О–і–µ–љ–Є—П —Г—Б–њ–µ—И–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Н—В–∞–љ–µ—А—Ж–µ–њ—В–∞ –і–∞–ґ–µ –њ—А–Є –љ–∞–Є–±–Њ–ї–µ–µ —В—П–ґ–µ–ї—Л—Е, –ґ–Є–Ј–љ–µ—Г–≥—А–Њ–ґ–∞—О—Й–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П—Е —Б–Є—Б—В–µ–Љ–љ–Њ–≥–Њ –Ѓ–Р – –∞–Љ–Є–ї–Њ–Є–і–Њ–Ј–µ –≤–љ—Г—В—А–µ–љ–љ–Є—Е –Њ—А–≥–∞–љ–Њ–≤ –љ–∞ —Б—В–∞–і–Є–Є —Г—А–µ–Љ–Є–Є [42] –Є —Б–Є–љ–і—А–Њ–Љ–µ –∞–Ї—В–Є–≤–∞—Ж–Є–Є –Љ–∞–Ї—А–Њ—Д–∞–≥–Њ–≤ (–Ь–Р–°) [43]. –Я–Њ—Б–ї–µ–і–љ–µ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ —Г—Б–њ–µ—И–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –Ь–Р–° —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —Н—В–∞–љ–µ—А—Ж–µ–њ—В–∞ —Г 7––ї–µ—В–љ–µ–≥–Њ –Љ–∞–ї—М—З–Є–Ї–∞ [45] –њ—А–Њ—В–Є–≤–Њ—А–µ—З–Є—В –њ—А–Њ—В–Є–≤–Њ–њ–Њ–ї–Њ–ґ–љ–Њ–Љ—Г –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–Љ—Г –њ—А–Є–Љ–µ—А—Г [44], –Ї–Њ–≥–і–∞ —Г –і–µ–≤–Њ—З–Ї–Є 4,5 –ї–µ—В —В–µ—А–∞–њ–Є—П —Н—В–∞–љ–µ—А—Ж–µ–њ—В–Њ–Љ –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–ї–∞ —А–∞–Ј–≤–Є—В–Є–µ –Ь–Р–°.
–Р–љ–∞–ї–Њ–≥–Є—З–љ—Л–µ «–њ–∞—А–∞–і–Њ–Ї—Б–∞–ї—М–љ—Л–µ» —Н—Д—Д–µ–Ї—В—Л –§–Э–Ю––Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –Њ–њ–Є—Б–∞–љ—Л –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —Б–ї—Г—З–∞–µ–≤ –≤–њ–µ—А–≤—Л–µ –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –љ–∞ —Д–Њ–љ–µ —В–µ—А–∞–њ–Є–Є –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є –§–Э–Ю —Г–≤–µ–Є—В–∞, –Ї–Њ–ґ–љ–Њ–≥–Њ –њ—Б–Њ—А–Є–∞–Ј–∞ –Є –±–Њ–ї–µ–Ј–љ–Є –Ъ—А–Њ–љ–∞ [23,32,33,45–47]. –Я—А–Є —Н—В–Њ–Љ —Г–Ї–∞–Ј–∞–љ–љ—Л–µ –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –∞–≥–µ–љ—В—Л –Љ–Њ–≥—Г—В —Б –≤—Л—Б–Њ–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М—О –њ—А–Є–Љ–µ–љ—П—В—М—Б—П –і–ї—П –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є—П –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —Г–Ї–∞–Ј–∞–љ–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є. –Ш–Ј –њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л—Е «–њ–∞—А–∞–і–Њ–Ї—Б–∞–ї—М–љ—Л—Е» —Н—Д—Д–µ–Ї—В–Њ–≤ –§–Э–Ю––Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –љ–∞–Є–±–Њ–ї—М—И–Є–є –Є–љ—В–µ—А–µ—Б –і–ї—П –њ–µ–і–Є–∞—В—А–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–Є –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В –≤–Ј–∞–Є–Љ–Њ–Њ—В–љ–Њ—И–µ–љ–Є—П –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є —Б —Г–≤–µ–Є—В–Њ–Љ. –Я—А–Є —В–Њ–Љ, —З—В–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –§–Э–Ю––Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –њ—А–Є —Г–≤–µ–Є—В–∞—Е –Є–Љ–µ–µ—В —Б–µ—А—М–µ–Ј–љ–Њ–µ —В–µ–Њ—А–µ—В–Є—З–µ—Б–Ї–Њ–µ –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–Є–µ, –≤ —В.—З. –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–љ–Њ–µ –љ–∞ –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Љ–Њ–і–µ–ї—П—Е –ґ–Є–≤–Њ—В–љ—Л—Е [49], —А–µ–Ј—Г–ї—М—В–∞—В—Л –ї–µ—З–µ–љ–Є—П —Н—В–∞–љ–µ—А—Ж–µ–њ—В–Њ–Љ —Г–≤–µ–Є—В–Њ–≤, –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л—Е —Б –Ѓ–Р, –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –њ—А–Њ—В–Є–≤–Њ—А–µ—З–Є–≤—Л [50–54] –Є –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г—О—В –њ—А—П–Љ–Њ –њ—А–Њ—В–Є–≤–Њ–њ–Њ–ї–Њ–ґ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л, —З—В–Њ —В—А–µ–±—Г–µ—В –і–∞–ї—М–љ–µ–є—И–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Є –њ–Њ–Є—Б–Ї–∞ —А–∞—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –Њ–±—К—П—Б–љ–µ–љ–Є–є.
–°–µ—А—М–µ–Ј–љ–Њ–є –њ—А–Њ–±–ї–µ–Љ–Њ–є –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є, –≤ —В.—З. –§–Э–Ю––Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤, —П–≤–ї—П–µ—В—Б—П –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ –≤—Л—Б–Њ–Ї–Є–є —А–Є—Б–Ї –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є –Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є. –Э–µ–Њ–і–љ–Њ–Ї—А–∞—В–љ–Њ —Г–њ–Њ–Љ–Є–љ–∞–≤—И–µ–µ—Б—П –≤ –і–∞–љ–љ–Њ–Љ –Њ–±–Ј–Њ—А–µ –≤—Л–њ–Њ–ї–љ–µ–љ–љ–Њ–µ –≤ –°–®–Р —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–µ –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Б –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ–Њ–є –Њ—В–Ї—А—Л—В–Њ–є —Д–∞–Ј–Њ–є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Н—В–∞–љ–µ—А—Ж–µ–њ—В–∞ —Г –і–µ—В–µ–є —Б –Ѓ–†–Р —Г–±–µ–і–Є—В–µ–ї—М–љ–Њ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Њ –≤—Л—Б–Њ–Ї—Г—О –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ —Б —А–µ–≥–Є—Б—В—А–∞—Ж–Є–µ–є –Њ—В 0 –і–Њ 0,04 –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —Б–Њ–±—Л—В–Є–є/–њ–∞—Ж–Є–µ–љ—В–Њ–≤/–ї–µ—В. –Ю–±–Њ–±—Й–µ–љ–Є–µ –≤—Б–µ—Е –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–љ—Л—Е –≤ –і–∞–љ–љ–Њ–Љ –Њ–±–Ј–Њ—А–µ –ї–Є—В–µ—А–∞—В—Г—А–љ—Л—Е –і–∞–љ–љ—Л—Е –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Б–Ї–∞–Ј–∞—В—М, —З—В–Њ —Г –і–µ—В–µ–є —Б –Ѓ–Р —З–∞—Б—В–Њ—В–∞ —А–∞–Ј–≤–Є—В–Є—П –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є, –њ–Њ––≤–Є–і–Є–Љ–Њ–Љ—Г, —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –љ–Є–ґ–µ, —З–µ–Љ —Г –≤–Ј—А–Њ—Б–ї—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ [27,30–33]. –Ъ—А–Њ–Љ–µ –Ј–∞–Ї–Њ–љ–Њ–Љ–µ—А–љ–Њ —Г–њ–Њ–Љ–Є–љ–∞—О—Й–Є—Е—Б—П –Ї–Њ–ґ–љ—Л—Е –∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Є—Е —А–µ–∞–Ї—Ж–Є–є –Є –Є–љ—В–µ—А–Ї—Г—А—А–µ–љ—В–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є, –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ —З–∞—Б—В–Њ (–і–Њ 0,139 –њ–∞—Ж–Є–µ–љ—В–Њ–≤/–ї–µ—В [33]) —А–µ–≥–Є—Б—В—А–Є—А—Г—О—В—Б—П –љ–µ–є—А–Њ–њ—Б–Є—Е–Є–∞—В—А–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П (–њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≥–Њ–ї–Њ–≤–љ–∞—П –±–Њ–ї—М, –∞–≥—А–µ—Б—Б–Є–≤–љ–Њ—Б—В—М, –≥–Є–њ–µ—А–≤–Њ–Ј–±—Г–і–Є–Љ–Њ—Б—В—М). –Т –ї–Є—В–µ—А–∞—В—Г—А–µ –љ–µ –Њ–њ–Є—Б–∞–љ–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ—Л—Е —Б–ї—Г—З–∞–µ–≤ —А–∞–Ј–≤–Є—В–Є—П –і–µ–Љ–Є–µ–ї–µ–љ–Є–Ј–Є—А—Г—О—Й–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є.
–Я—А–Є–Љ–µ—З–∞—В–µ–ї—М–љ–Њ, —З—В–Њ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Н—В–∞–љ–µ—А—Ж–µ–њ—В–∞ –≤ –і–µ—В—Б–Ї–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ —Г–њ–Њ–Љ–Є–љ–∞—О—В—Б—П —Б–ї—Г—З–∞–Є —А–∞–Ј–≤–Є—В–Є—П —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–∞, –Ї—А–Њ–Љ–µ –Њ–і–љ–Њ–≥–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П –≤ –Э–µ–Љ–µ—Ж–Ї–Њ–Љ –љ–∞—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–Љ —А–µ–≥–Є—Б—В—А–µ [33] – —А–∞–Ј–≤–Є—В–Є—П —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–љ–Њ–≥–Њ –∞—А—В—А–Є—В–∞ —Г —А–µ–±–µ–љ–Ї–∞, —Б—В—А–∞–і–∞—О—Й–µ–≥–Њ —Б–Є—Б—В–µ–Љ–љ—Л–Љ –≤–∞—А–Є–∞–љ—В–Њ–Љ –Ѓ–Ш–Р. –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ, –њ–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –∞–≤—В–Њ—А–Њ–≤ [23,31–33], –Є–Љ–µ–љ–љ–Њ –±–Њ–ї—М–љ—Л–µ —Б–Є—Б—В–µ–Љ–љ—Л–Љ –≤–∞—А–Є–∞–љ—В–Њ–Љ –Ѓ–†–Р/–Ѓ–Ш–Р —П–≤–ї—П—О—В—Б—П –љ–∞–Є–±–Њ–ї–µ–µ —Г—П–Ј–≤–Є–Љ–Њ–є –≥—А—Г–њ–њ–Њ–є –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є –љ–∞ —Д–Њ–љ–µ —В–µ—А–∞–њ–Є–Є —Н—В–∞–љ–µ—А—Ж–µ–њ—В–Њ–Љ, –≤–њ—А–Њ—З–µ–Љ, –Ї–∞–Ї –Є –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –і—А—Г–≥–Є—Е –С–Я–Т–Я. –Э–µ–Њ–±—К—П—Б–љ–Є–Љ—Л–Љ –Є, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ, —Б–ї—Г—З–∞–є–љ—Л–Љ —Б–Њ–±—Л—В–Є–µ–Љ —П–≤–Є–ї–∞—Б—М —А–µ–≥–Є—Б—В—А–∞—Ж–Є—П –≤ –і–≤—Г—Е —А–∞–Ј–ї–Є—З–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е [23,33] –њ–Њ –Њ–і–љ–Њ–Љ—Г —Б–ї—Г—З–∞—О –≤–њ–µ—А–≤—Л–µ –Љ–∞–љ–Є—Д–µ—Б—В–Є—А–Њ–≤–∞–≤—И–µ–є—Б—П –±–Њ–ї–µ–Ј–љ–Є –Ъ—А–Њ–љ–∞. –Ъ—А–Њ–Љ–µ 2 —Б–ї—Г—З–∞–µ–≤ –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–љ–Њ–є –Ї–∞—А—Ж–Є–љ–Њ–Љ—Л —Й–Є—В–Њ–≤–Є–і–љ–Њ–є –ґ–µ–ї–µ–Ј—Л –Є –Њ–і–љ–Њ–≥–Њ —Б–ї—Г—З–∞—П –љ–µ––•–Њ–і–ґ–Ї–Є–љ—Б–Ї–Њ–є –ї–Є–Љ—Д–Њ–Љ—Л [32,33], —Б–≤—П–Ј—М –Ї–Њ—В–Њ—А—Л—Е —Б —В–µ—А–∞–њ–Є–µ–є —Н—В–∞–љ–µ—А—Ж–µ–њ—В–Њ–Љ –±—Л–ї–∞ –њ–Њ—Б—В–∞–≤–ї–µ–љ–∞ –њ–Њ–і —Б–Њ–Љ–љ–µ–љ–Є–µ –∞–≤—В–Њ—А–∞–Љ–Є, –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–Є –≤ –Њ–і–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—О —Н—В–∞–љ–µ—А—Ж–µ–њ—В–∞ –њ—А–Є –Ѓ–Р –љ–µ –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–Њ —А–∞–Ј–≤–Є—В–Є–µ –љ–Њ–≤–Њ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–є, —Е–Њ—В—П –Ї –љ–∞—Б—В–Њ—П—Й–µ–Љ—Г –≤—А–µ–Љ–µ–љ–Є —Н—В–∞–љ–µ—А—Ж–µ–њ—В —Г–ґ–µ –њ–Њ–ї—Г—З–Є–ї–Є —В—Л—Б—П—З–Є –±–Њ–ї—М–љ—Л—Е –Ѓ–Р –≤ –Љ–Є—А–µ, –∞ –Љ–љ–Њ–≥–Є–µ –Є–Ј –љ–Є—Е – –≤ —В–µ—З–µ–љ–Є–µ —А—П–і–∞ –ї–µ—В.
–Я—А–Њ–±–ї–µ–Љ–∞ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є —В–µ—А–∞–њ–Є–Є —Н—В–∞–љ–µ—А—Ж–µ–њ—В–Њ–Љ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –і–µ—В—Б–Ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ —В—А–µ–±—Г–µ—В —Г–њ–Њ–Љ–Є–љ–∞–љ–Є—П –Є –∞—Б–њ–µ–Ї—В–Њ–≤ —А–µ–њ—А–Њ–і—Г–Ї—В–Є–≤–љ–Њ–≥–Њ –Ј–і–Њ—А–Њ–≤—М—П. –Я—А–Є —В–Њ–Љ, —З—В–Њ –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –њ–Њ–Ї–∞ –љ–µ –љ–∞–Ї–Њ–њ–ї–µ–љ–Њ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –Є–љ—Д–Њ—А–Љ–∞—Ж–Є–Є –Њ –≤–ї–Є—П–љ–Є–Є —В–µ—А–∞–њ–Є–Є —Н—В–∞–љ–µ—А—Ж–µ–њ—В–Њ–Љ –љ–∞ —Д–µ—А—В–Є–ї—М–љ–Њ—Б—В—М –Є –≤–Њ–Ј–Љ–Њ–ґ–љ—Г—О –њ–∞—В–Њ–ї–Њ–≥–Є—О –њ–ї–Њ–і–∞, —Г–Љ–µ—Б—В–љ–Њ –њ—А–Њ—Ж–Є—В–Є—А–Њ–≤–∞—В—М —Б–Њ–Њ–±—Й–µ–љ–Є–µ –Њ 7 —Б–ї—Г—З–∞—П—Е —Г—Б–њ–µ—И–љ–Њ–≥–Њ –Ј–∞–≤–µ—А—И–µ–љ–Є—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–Ї, —Б—В—А–∞–і–∞—О—Й–Є—Е –Ѓ–Ш–Р –Є –Ј–∞–±–µ—А–µ–Љ–µ–љ–µ–≤—И–Є—Е –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –≤ –њ–µ—А–Є–Њ–і –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Н—В–∞–љ–µ—А—Ж–µ–њ—В–∞ (–Њ—В 3,7 –і–Њ 48,1 –Љ–µ—Б—П—Ж–µ–≤).
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –љ–∞–Ї–Њ–њ–ї–µ–љ–љ—Л–є –Љ–Є—А–Њ–≤–Њ–є –њ–µ–і–Є–∞—В—А–Є—З–µ—Б–Ї–Њ–є —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є–µ–є –њ–Њ–Ј–Є—В–Є–≤–љ—Л–є –Њ–њ—Л—В –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Н—В–∞–љ–µ—А—Ж–µ–њ—В–∞ —Г –±–Њ–ї—М–љ—Л—Е –Ѓ–Р –њ–Њ–Ј–≤–Њ–ї—П–µ—В —А–∞—Б—Б—З–Є—В—Л–≤–∞—В—М –љ–∞ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Њ—В –≤–љ–µ–і—А–µ–љ–Є—П —Н—В–Њ–≥–Њ –≤—Л—Б–Њ–Ї–Њ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –≤ —А–Њ—Б—Б–Є–є—Б–Ї—Г—О —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї—Г—О –њ—А–∞–Ї—В–Є–Ї—Г.
–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. –Э–∞—Б–Њ–љ–Њ–≤ –Х.–Ы. –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ —Д–∞–Ї—В–Њ—А–∞ –љ–µ–Ї—А–Њ–Ј–∞ –Њ–њ—Г—Е–Њ–ї–Є –њ—А–Є —А–µ–≤–Љ–∞—В–Њ–Є–і–љ–Њ–Љ –∞—А—В—А–Є—В–µ: –Љ–µ—Б—В–Њ —Н—В–∞–љ–µ—А—Ж–µ–њ—В–∞. –Э–∞—Г—З–љ–Њ––њ—А–∞–Ї—В–Є—З–µ—Б–Ї–∞—П —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є—П 2008; вДЦ5, –њ—А–Є–ї–Њ–ґ–µ–љ–Є–µ: —Б—В—А.1–20.
2. Heiberg M.S., Nordvag B–Y., Mikkelsen K. et all. The Comparative Effectiveness of Tumor Necrosis Factor–Blocking Agents in patients with rheumatoid arthritis and patients with ankylosing spondylitis. A six–month, longitudinal, observational, multicenter study. Artr. Rheum. 2005; 52, 8: 2506–2512.
3. Ara R. M., Reynolds A. V., Conway P. The cost–effectiveness of etanercept in patients with severe ankylosing spondylitis in the UK. Rheumatology 2007; 46:1338–1344.
4. Kavanaugh A., Tutuncu Z., Catalan–Sanchez T. Update on anti–tumor necrosis factor therapy in the spondyloarthropathies including psoriatic arthritis. Curr Opin Rheumatol. 2006 18:347–353
5. Szer I.S., Kimura Y., Malleson P.N., Southwood T.R. Arthritis in children and adolescents: Juvenile idiopathic arthritis. Oxford university press. 456 p.
6. Carrasco R., Smith J.A., Lovell D. Biologic agents for the treatment of juvenile rheumatoid arthritis: current status. Paediatr Drugs 2004;6:137–146.
7. –Р–ї–µ–Ї—Б–µ–µ–≤–∞ –Х.–Ш., –Ы–Є—В–≤–Є—Ж–Ї–Є–є –Я.–§. –Ѓ–≤–µ–љ–Є–ї—М–љ—Л–є —А–µ–≤–Љ–∞—В–Њ–Є–і–љ—Л–є –∞—А—В—А–Є—В: —Н—В–Є–Њ–ї–Њ–≥–Є—П, –њ–∞—В–Њ–≥–µ–љ–µ–Ј, –Ї–ї–Є–љ–Є–Ї–∞, –∞–ї–≥–Њ—А–Є—В–Љ—Л –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П. –†—Г–Ї. –Ф–ї—П –≤—А–∞—З–µ–є, –њ—А–µ–њ–Њ–і–∞–≤–∞—В–µ–ї–µ–є, –љ–∞—Г—З–љ—Л—Е —Б–Њ—В—А—Г–і–љ–Є–Ї–Њ–≤. /–Я–Њ–і –Њ–±—Й. –†–µ–і. –Р.–Р.–С–∞—А–∞–љ–Њ–≤–∞. – –Ь.: –Т–Х–Ф–Ш, 2007; 308 —Б.
8. Wilkinson N., Jackson G., Gardner–Medwin J.. Biologic therapies for juvenile arthritis. Arch Dis Child 2003; 88: 186–191
9. Malleson PN, Petty RE. Remodelling the pyramid: a paediatric prospective. J Rheumatol 1990; 17: 867–868.
10. –Ъ—Г–Ј—М–Љ–Є–љ–∞ –Э.–Э., –°–∞–ї—Г–≥–Є–љ–∞ –°.–Ю., –Э–Є–Ї–Є—И–Є–љ–∞ –Ш.–Я. –Ѓ–≤–µ–љ–Є–ї—М–љ—Л–є –∞—А—В—А–Є—В – XXI –≤–µ–Ї. –Ъ–∞–Ї –Љ—Л —Б–µ–≥–Њ–і–љ—П –њ–Њ–љ–Є–Љ–∞–µ–Љ —В–µ—А–Љ–Є–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Њ–љ–љ—Л–µ –Ї—А–Є—В–µ—А–Є–Є? –Э–∞—Г—З–љ–Њ––њ—А–∞–Ї—В–Є—З–µ—Б–Ї–∞—П —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є—П. 2006, вДЦ4; —Б. 86–96.
11. –Э–Є–Ї–Є—И–Є–љ–∞ –Ш.–Я. –Ѓ–≤–µ–љ–Є–ї—М–љ—Л–є –∞—А—В—А–Є—В. –У–ї–∞–≤–∞ 28 –≤ –Ї–љ. –†–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є—П: –љ–∞—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–µ —А—Г–Ї–Њ–≤–Њ–і—Б—В–≤–Њ / –њ–Њ–і —А–µ–і. –Х.–Ы.–Э–∞—Б–Њ–љ–Њ–≤–∞, –Т.–Р.–Э–∞—Б–Њ–љ–Њ–≤–Њ–є. – –Ь. –У–≠–Ю–Ґ–Р–†––Ь–µ–і–Є–∞, 2008. – 720 —Б. (—Б.686–710).
12. Petty R.E., Southwood T.R., Baum J., Bhettay E., Glass D.N., Manners P. et al. Revision of the proposed classification criteria for juvenile idiopathic arthritis: Durban, 1997. J Rheumatol 1998; 25: 1991–1994.
13. Petty R.E., Southwood T.R., Manners P., Baum J., Glass D.N., Goldenberg J., et al. International League of Associations Rheumatology classification of juvenile idiopathic arthritis: second revision, Edmonton, 2001. J Rheumatol 2004; 31:390–392.
14. Lovell D.J., Giannini E.H., Reiff A., et al. Etanercept in children with polyarticular juvenile rheumatoid arthritis. N. Engl. J. Med., 2000, 16, 342(11), 763–769.
15. Lovell D.J., Giannini E.H., Reiff A., Jones O.Y., Schneider R., Olson J.C., et al. Long–term efficacy and safety of etanercept in children with polyarticular–course juvenile rheumatoid arthritis: interim results from an ongoing multicenter, open–label, extended–treatment trial. Arthritis Rheum 2003; 48: 218–226.
16. Lovell D.J., Reiff A., Jones O.Y., Schneider R., et al. Long–term safety and efficacy of etanercept in children with polyarticular–course juvenile rheumatoid arthritis. Arthritis Rheum 2006; 54: 1987–1994.
17. Lovell D.J., Reiff A., Ilowite N.T., Wallace C.A. et al. Safety and efficacy of up to eight years of continuous Etanercept therapy in patients with Juvenile rheumatoid arthritis. Arthritis Rheum 2008; 58; 5: 1496–1504
18. Takei S., Groh D., Bemstein B., Shaham B., Gallagher K., Reiff A. Safety and efficacy of high dose etanercept in treatment of juvenile rheumatoid arthritis. J Rheumatol 2001; 28: 1677–1678.
19. Schmeling H., Mathony K., Keysser G., Burdach S., Horneff G. A combination of etanercept and methatrexate for the treatment of refractory juvenile idiopathic arthritis: a pilot study. Ann Rheum Dis. 2001; 60: 410–412.
20. Kietz D.A., Pepmueller P.H., Moore T.L.. Clinical response to etanercept in polyarticular course juvenile rheumatoid arthritis. J Rheumatol 2001;28: 360–362.
21. Haapasaari J., Kautiainen H., Hanulla S., Pohjankoskki H., Hakala M. Good results from combining etanercept to prevailing DMARD therapy in refractory juvenile idiopathic arthritis. Clin Exp Reumatol 2002;20:867–70.
22. Russo R.A., Katsicas M.M., Zelazko M. Etanercept in systemic juvenile idiopathic arthritis. Clin Exp Reumatol 2002;20:723–726.
23. Quartier P, Taupin P, Bordeaut F, Lemelle I, Pillet P, Bost M, et al Efficacy of etanercept for the treatment of juvenile idiopathic arthritis according to the onset type. Arthritis Rheum. 2003; 48:1093–1101.
24. Lahdenne P, Vahasalo P, Honkanen V: Infliximab or etanercept in the treatment of children with refractory juvenile idiopathic arthritis: an open label study. Ann Rheum Dis 2003, 62:245–247.
25. Horneff G, Schmeling H, Biedermann T et al The German etanercept registry for treatment of juvenile idiopathic arthritis. Annals of the rheumatic Diseases 2004; 63(12): 1638–1644.
26. Nielsen S., Ruperto N., Simonini G., Alpigiani M.G. et al. Preliminary evidence that etanercept is more effective than methotrexate in suppressing inflammation and in reducing radiographic progression in JIA. ACR Congress 2005. Arthr. Rheum. 2005; 52 (Suppl. 82); abstr.128.
27. Twilt M., ten Cate R., van Rossum M.A.J., Wulfraat M.M., et al. Long–term follow–up of etanercept in the treatment of juvenile idiopathic arthritis; The Dutch national study. Ann Rheum Dis 2006; 65 (Suppl II): 572.
28. Calvo I., Lopez B., Merino R. et al. Etanercept in patients with juvenile idiopathic arthritis: results of a retrospective multicenter registry. Ann Rheum Dis 2006; 65 (Suppl II):440.
29. Giannini EH, Ilowite NT, Lovell DJ, Wallace CA, Rabinovich EC, Reiff AO, et al. A phase 4 registry of etanercept in children with juvenile rheumatoid arthritis. . Ann Rheum Dis. 2006;65 (Suppl 2):253
30. Platz M.A., Nielsen S. Adverse events to TNF–? blockers in juvenile idiopathic arthritis. XIV European Paediatric Rheumatol. Congress. Istambul, Turkey, 5–9 September, 2007. Abstract Book, p. 225.
31. Prince F.H.M., Twilt M., ten Cate R., Van Rossum M.A.J., et al. Long–term follow–up on effectiveness and safety of etanercept in JIA: the Dutch national register. Ann Rheum Dis published online 15 Apr 2008 doi:10.1136/ard.2007.087411
32. Gerloni V., Pontikaki I., Gattinara M., Fantini F. Focus on adverse events of tumor necrosis factor ? blockade in juvenile idiopathic arthritis in an open monocentric long–term prospective study of 163 patients. Ann Rheum Dis. 2008; 67: 1145–1152.
33. Horneff G., De Bock F., Foeldvari I., Girschick H.J., et al. Safety and efficacy of combination of Etanercept and Methotrexate compared to treatment with Etanercept only in patients with juvenile idiopathic arthritis (JIA). Preliminary data from the German JIA Registry. Ann Rheum Dis published online 15 Apr 2008; doi:10.1136/ard.2007.087593
34. Giannini EH, Ruperto N, Ravelli A, Lovell DJ, Felson DT, Martini A. Preliminary definition of improvement in juvenile arthritis. Arthritis Rheum 1997; 40:1202–1209.
35. Vojvodich F.P., Hansen J.B., Andersson U., Savendahl L., Hagalberg S. Etanercept treatment improves longitudinal growth in prepubertal children with juvenile idiopathic arthritis. J Rheumatol 2007;34:2481–2485
36. Reiff A, Henrickson M. Prolonged efficacy of etanercept in refractory juvenile ankylosing spondylitis [abstract 1434]. Arthritis Rheum. 2001;44:S292.
37. Tse S.M.L., Burgos–Vargas R., Laxer R.M. Anti–Tumor Necrosis Factor Blockade in the Treatment of Juvenile Spondylarthropathy. Artr Rheuml. 2005; 52; 7: 2103–2108.
38. Henrickson M, Reiff A. Prolonged efficacy of etanercept in refractory enthesitis–related arthritis. J Rheumatol 2004;31:2055–2061.
39. Horneff G, Schmeling H, Moebius D, Foeldvari I. Efficacy of etanercept in active refractory juvenile spondylarthropathy: prospective open study of 40 patients [abstract]. Arthritis Rheum. 2004;50 Suppl 9:S91.
40. Sulpice M, Deslandre CJ, Quartier P. Efficacy and safety of TNFalpha antagonist therapy in patients with juvenile spondyloarthropathies. Joint Bone Spine. 2008 Dec 11.
41. ten Cate R., van Suijlekom–Smit, LW, Brinkman DM et al. Etanecept in four children with therapy–resistant systemic juvenile idiopathic arthritis. Rheumatology (Oxford) 2002; 41: 228–229.
42. Hatemi G., Tascilar K., Ozdogan H. Tumor necrosis factor ? antagonists in the treatment of juvenile idiopathic arthritis patients with secondary amyloidosis. XIV European Paediatric Rheumatol. Congress. Istambul, Turkey, 5–9 September, 2007. Abstract Book, p.172.
43. Prahalad S, Bove KE, Dickens D, Lovell DJ, Grom A.. Etanercept in the treatment of macrophage activation syndrome. J Rheumatol. 2001;28:2120–2124.
44. Ramanan AV, Schneider R. Macrophage activation syndrome following initiation of etanercept in a child with systemic onset juvenile rheumatoid arthritis. J Rheumatol. 2003;30:401–403.
45. Schmeling H, Horneff G. Etanercept and uveitis in patients with juvenile idiopathic arthritis. Rheumatolgy (Oxford) 2005;44:1008–1011.
46. Saurenmann RK, Levin AV, Feldman BM, Laxer RM, Schneider R, Silverman ED. Risk of new–onset uveitis in patients with juvenile idiopathic arthritis treatment with anti–TNFalpha agent. J Pediatr 2006;149:833–836.
47. Saurenmann RK, Levin AV, Feldman BM, et al. Prevalence, risk factors, and outcome of uveitis in juvenile idiopathic arthritis. Arthritis Rheum 2007; 56:647–657.
48. Dekker L, Armbrust W, Rademarker DM, Praken B, Kuis W, Wuffraat MM. Safety of anti–TNFalpha therapy in children with juvenile idiopathic arthritis. Clin Exp Reumatol 2004;22:252–8.
49. Rabinovic –°.–Х. Use of Tumor Necrosis Factor Inhibitors in uveitis. Curr Opin Rheumatol. 2007;19(5):482–486
50. Saurenmann RK, Levin AV, Rose JB, et al. Tumour necrosis factor alpha inhibitors in the treatment of childhood uveitis. Rheumatology 2006; 45:982–989.
51. Foeldvari I, Nielsen S, Kummerle–Deschner J, et al. Tumor necrosis factor–alpha blocker in treatment of juvenile idiopathic arthritis–associated uveitis refractory to second–line agents: results of a multinational survey. J Rheumatol 2007; 34:1146–1150.
52. Reiff A, Takei S, Sadeghi S, et al. Etanercept therapy in children with treatment–resistant uveitis. Arthritis Rheum 2001; 44:1411–1415.
53. Smith JA, Thompson DJS, Whitcup SM, et al. A randomized, placebo–controlled, double–masked clinical trial of etanercept for the treatment of uveitis associated with juvenile idiopathic arthritis. Arthritis Rheum 2005; 53:18–23.
54. Tynjala P, Lindahl P, Honkanen V, et al. Infliximab and etanercept in the treatment of chronic uveitis associated with refractory juvenile idiopathic arthritis. Ann Rheum Dis 2007; 66:548–550. A total of 108 JIA children were evaluated in this study; they received anti–TNF–? therapy, mostly for the indication of arthritis and not uveitis. Uveitis flares per year were calculated for infliximab and compared with those for etanercept.
55. Pontikaki I., Gerloni V., Donati C., Fantini F. Pregnancy outcome in women affected by idiopatjic arthritis exposed to biological agents. XIV European Paediatric Rheumatol. Congress. Istambul, Turkey, 5–9 September, 2007. Abstract Book, p.167.












