–І—Г—В—М –±–Њ–ї–µ–µ –њ–Њ–ї—Г–≤–µ–Ї–∞ –љ–∞–Ј–∞–і —Б–Є–љ—В–µ–Ј –Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —Н–Ї–Ј–Њ–≥–µ–љ–љ—Л—Е –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–Њ–≤ (–У–Ъ) –њ–Њ–Ј–≤–Њ–ї–Є–ї–Є —Б –Њ–њ—В–Є–Љ–Є–Ј–Љ–Њ–Љ –≤–Ј–≥–ї—П–љ—Г—В—М –љ–∞ –њ—А–Њ–≥–љ–Њ–Ј —А–∞–љ–µ–µ –љ–µ–Є–Ј–ї–µ—З–Є–Љ—Л—Е —Б–Є—Б—В–µ–Љ–љ—Л—Е –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є. –Ю–і–љ–∞–Ї–Њ —Б –њ–Њ–Љ–Њ—Й—М—О –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є –У–Ъ –љ–µ –≤—Б–µ–≥–і–∞ —Г–і–∞–≤–∞–ї–Њ—Б—М –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–≤–µ–ї–Є—З–Є—В—М –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –ґ–Є–Ј–љ–Є, –њ—А–µ–і–Њ—В–≤—А–∞—В–Є—В—М –Њ—А–≥–∞–љ–љ–Њ–µ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–µ –Є —Б–Њ—Е—А–∞–љ–Є—В—М –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є. –Ь–љ–Њ–≥–Њ–ї–µ—В–љ–Є–є —Н–Љ–њ–Є—А–Є—З–µ—Б–Ї–Є–є –Њ–њ—Л—В –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї, —З—В–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–Љ—Г –Ї–Њ–љ—В–Є–љ–≥–µ–љ—В—Г –±–Њ–ї—М–љ—Л—Е –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є –Є–Љ–Љ—Г–љ–Њ—Б—Г–њ—А–µ—Б—Б–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –≤–Ї–ї—О—З–∞—О—Й–µ–є, –љ–∞—А—П–і—Г —Б –У–Ъ, —Ж–Є—В–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є–µ –њ—А–µ–њ–∞—А–∞—В—Л [2]. –Э–µ—Б–Љ–Њ—В—А—П –љ–∞ –љ–µ—Б–Њ–Љ–љ–µ–љ–љ—Л–µ –њ–ї—О—Б—Л —В–∞–Ї–Њ–≥–Њ —Б–Њ—З–µ—В–∞–љ–Є—П, –љ–µ—А–µ–і–Ї–Њ –∞–і–µ–Ї–≤–∞—В–љ–∞—П —В–µ—А–∞–њ–Є—П –ї–Є–Љ–Є—В–Є—А–Њ–≤–∞–ї–∞—Б—М —А–∞–Ј–≤–Є—В–Є–µ–Љ –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –Є –љ–µ–њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М—О —Ж–Є—В–Њ—В–Њ–Ї—Б–Є–Ї–Њ–≤. –°–Є—В—Г–∞—Ж–Є—П –њ–Њ—В—А–µ–±–Њ–≤–∞–ї–∞ –њ–µ—А–µ—Б–Љ–Њ—В—А–∞ –Є —Б–Њ–≤–µ—А—И–µ–љ—Б—В–≤–Њ–≤–∞–љ–Є—П —Б—Е–µ–Љ –Є–Љ–Љ—Г–љ–Њ—Б—Г–њ—А–µ—Б—Б–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –Ї–∞–Ї –Ј–∞ —Б—З–µ—В —Г–Љ–µ–љ—М—И–µ–љ–Є—П –і–Њ–Ј –Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П —А–µ–ґ–Є–Љ–Њ–≤ –≤–≤–µ–і–µ–љ–Є—П (—З—В–Њ –љ–µ –≤—Б–µ–≥–і–∞ –њ—А–Є–≤–Њ–і–Є–ї–Њ –Ї –ґ–µ–ї–∞–µ–Љ–Њ–Љ—Г —А–µ–Ј—Г–ї—М—В–∞—В—Г), —В–∞–Ї –Є –Ї —А–∞–Ј—А–∞–±–Њ—В–Ї–µ –Є –≤–љ–µ–і—А–µ–љ–Є—О —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Є–Љ–Љ—Г–љ–Њ—Б—Г–њ—А–µ—Б—Б–∞–љ—В–Њ–≤, –Њ–±–ї–∞–і–∞—О—Й–Є—Е –Љ–µ–љ—М—И–Є–Љ —Б–њ–µ–Ї—В—А–Њ–Љ –њ–Њ–±–Њ—З–љ—Л—Е –і–µ–є—Б—В–≤–Є–є –Є –ї—Г—З—И–µ–є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М—О [3,4].
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —Г –±–Њ–ї—М–љ—Л—Е —Б —Б–Є—Б—В–µ–Љ–љ—Л–Љ–Є —А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є –љ–∞–Ї–Њ–њ–ї–µ–љ –і–Њ—Б—В–∞—В–Њ—З–љ—Л–є –Њ–њ—Л—В –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Њ–і–љ–Њ–≥–Њ –Є–Ј –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Б —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ–є –Є–Љ–Љ—Г–љ–Њ—Б—Г–њ—А–µ—Б—Б–Њ—А–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О – –Љ–Є–Ї–Њ—Д–µ–љ–Њ–ї–∞—В–∞ –Љ–Њ—Д–µ—В–Є–ї–∞ (–Ь–Ь–§).
–Ь–Є–Ї–Њ—Д–µ–љ–Њ–ї–∞—В–∞ –Љ–Њ—Д–µ—В–Є–ї (–Ь–Ь–§) – —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є–є –Љ–Њ—А—Д–Њ–ї–Є–љ–Њ—Н—В–Є–ї–Њ–≤—Л–є —Н—Д–Є—А –Љ–Є–Ї–Њ—Д–µ–љ–Њ–ї—М–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л (–Ь–§–Ъ), –њ—А–Њ–і—Г–Ї—В–∞ –µ—Б—В–µ—Б—В–≤–µ–љ–љ–Њ–є —Д–µ—А–Љ–µ–љ—В–∞—Ж–Є–Є Penicillium stoloniferum, –Њ–±–ї–∞–і–∞—О—Й–µ–є –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–Љ–Є, –∞–љ—В–Є–≤–Є—А—Г—Б–љ—Л–Љ–Є, –∞–љ—В–Є–≥—А–Є–±–Ї–Њ–≤—Л–Љ–Є, –њ—А–Њ—В–Є–≤–Њ–Њ–њ—Г—Е–Њ–ї–µ–≤—Л–Љ–Є —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є. –Ь–§–Ъ, –Њ–±—А–∞–Ј—Г—О—Й–∞—П—Б—П –њ–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ –њ–µ—З–µ–љ–Њ—З–љ—Л—Е —Н—Б—В–µ—А–∞–Ј –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –Ь–Ь–§, —П–≤–ї—П–µ—В—Б—П –љ–µ–Ї–Њ–љ–Ї—Г—А–µ–љ—В–љ—Л–Љ –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–Љ –Є–љ–Њ–Ј–Є–љ–Љ–Њ–љ–Њ—Д–Њ—Б—Д–∞—В–і–µ–≥–Є–і—А–Њ–≥–µ–љ–∞–Ј—Л (–Ш–Ь–§–Ф–У) – —Д–µ—А–Љ–µ–љ—В–∞, –Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Ј–∞ –ї–Є–Љ–Є—В–Є—А—Г—О—Й—Г—О —Б—В–∞–і–Є—О —Б–Є–љ—В–µ–Ј–∞ de novo –≥—Г–∞–љ–Њ–Ј–Є–љ–Њ–≤—Л—Е –љ—Г–Ї–ї–µ–Њ—В–Є–і–Њ–≤, –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л—Е –і–ї—П —Б–Є–љ—В–µ–Ј–∞ –ї–Є–Љ—Д–Њ—Ж–Є—В–∞—А–љ–Њ–є –Ф–Э–Ъ. –Ь–§–Ъ –Њ–±—А–∞—В–Є–Љ–Њ –Є–љ–≥–Є–±–Є—А—Г–µ—В —Б–Є–љ—В–µ–Ј –Ф–Э–Ъ –Є –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є—О —Б—В–Є–Љ—Г–ї–Є—А–Њ–≤–∞–љ–љ—Л—Е –Т– –Є –Ґ––ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –Ї—А–Њ–≤–Є —З–µ–ї–Њ–≤–µ–Ї–∞, –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞—П –≤–ї–Є—П–љ–Є—П –љ–∞ –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –і–µ–ї—П—Й–Є—Е—Б—П –Ї–ї–µ—В–Њ–Ї –і—А—Г–≥–Є—Е —В–Є–њ–Њ–≤, —Г–≥–љ–µ—В–∞–µ—В –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ —Ж–Є—В–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є—Е –ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ in vivo. –Ш—Б—В–Њ—Й–µ–љ–Є–µ –Ј–∞–њ–∞—Б–Њ–≤ –≥—Г–∞–љ–Њ–Ј–Є–љ–Њ–≤—Л—Е –љ—Г–Ї–ї–µ–Њ—В–Є–і–Њ–≤ –њ–Њ–і –і–µ–є—Б—В–≤–Є–µ–Љ –Ь–§–Ъ –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ –≤–ї–Є—П–µ—В –љ–∞ –њ—А–Њ—Ж–µ—Б—Б –≥–ї–Є–Ї–Њ–Ј–Є–ї–Є—А–Њ–≤–∞–љ–Є—П –Љ–Њ–ї–µ–Ї—Г–ї, –Њ—Б—Г—Й–µ—Б—В–≤–ї—П—О—Й–Є—Е –∞–і–≥–µ–Ј–Є—О, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –Ј–∞—В—А—Г–і–љ–µ–љ–Є—О –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –Є –ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ –Є, –≤ –Ї–Њ–љ–µ—З–љ–Њ–Љ –Є—В–Њ–≥–µ, –њ–Њ–і–∞–≤–ї—П–µ—В –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–µ –ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ –≤ –Њ—З–∞–≥–Є –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П [5].
–Т –Ї—Г–ї—М—В—Г—А–µ –ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ —З–µ–ї–Њ–≤–µ–Ї–∞ –Є –Ї–ї–µ—В–Њ–Ї —Б–µ–ї–µ–Ј–µ–љ–Ї–Є –Ь–§–Ъ –њ–Њ–і–∞–≤–ї—П–µ—В –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –∞–љ—В–Є—В–µ–ї – –Њ—Б–љ–Њ–≤–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞–љ–љ—Л—Е –Т––ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤, –Є–љ–≥–Є–±–Є—А—Г–µ—В –∞–Ї—В–Є–≤–∞—Ж–Є—О –Љ–µ–Ј–∞–љ–≥–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Њ–Ї, –Є–Ј–±—Л—В–Њ—З–љ—Г—О –њ—А–Њ–і—Г–Ї—Ж–Є—О –Ї–Њ–ї–ї–∞–≥–µ–љ–∞ –Є –і—А—Г–≥–Є—Е –Љ–∞—В—А–Є—З–љ—Л—Е –±–µ–ї–Ї–Њ–≤, —Б–љ–Є–ґ–∞–µ—В –≤—Л—А–∞–±–Њ—В–Ї—Г –§–Э–Ю–a –Є –Ш–Ы–1 [6].
–Ь–§–Ъ –Є –Ь–Ь–§ –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –і–µ–ї—П—Й–Є—Е—Б—П –Ї–ї–µ—В–Њ–Ї —Б–Є—Б—В–µ–Љ—Л –Ї—А–Њ–≤–µ—В–≤–Њ—А–µ–љ–Є—П, –≤–Ї–ї—О—З–∞—П –Ї–ї–µ—В–Ї–Є––њ—А–µ–і—И–µ—Б—В–≤–µ–љ–љ–Є—Ж—Л –љ–µ–є—В—А–Њ—Д–Є–ї–Њ–≤ –Є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤, —В–Њ –µ—Б—В—М —Ж–Є—В–Њ—Б—В–∞—В–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В –Њ–≥—А–∞–љ–Є—З–Є–≤–∞–µ—В—Б—П –≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –ї–Є–Љ—Д–Њ—Ж–Є—В–∞–Љ–Є. –Я–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ –Ь–§–Ъ –љ–∞–±–ї—О–і–∞–µ—В—Б—П –і–Њ–Ј–Њ–Ј–∞–≤–Є—Б–Є–Љ–Њ–µ —Г–≥–љ–µ—В–µ–љ–Є–µ —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –Љ–∞—А–Ї–µ—А–Њ–≤ –∞–Ї—В–Є–≤–∞—Ж–Є–Є (CD134, —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ —Б–µ–Љ–µ–є—Б—В–≤–∞ –§–Э–Ю) –Є –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є–Є –ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ (—П–і–µ—А–љ–Њ–≥–Њ –∞–љ—В–Є–≥–µ–љ–∞ –њ—А–Њ–ї–Є—Д–µ—А–Є—А—Г—О—Й–Є—Е –Ї–ї–µ—В–Њ–Ї), –њ–Њ–і–∞–≤–ї–µ–љ–Є–µ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –њ–Њ–њ—Г–ї—П—Ж–Є–Є —Ж–Є—В–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є—Е –Ґ––ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ [7].
–°—Г—Й–µ—Б—В–≤—Г—О—В –Є –і—А—Г–≥–Є–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л, –Њ–±—К—П—Б–љ—П—О—Й–Є–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Ь–Ь–§ –њ—А–Є —А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е: —Н–ї–Є–Љ–Є–љ–∞—Ж–Є—П –∞–Ї—В–Є–≤–Є—А–Њ–≤–∞–љ–љ—Л—Е –Ґ––Ї–ї–µ—В–Њ–Ї –≤ –Њ—В–≤–µ—В –љ–∞ –∞–љ—В–Є–≥–µ–љ–љ—Л–µ —Б—В–Є–Љ—Г–ї—Л, —Б–љ–Є–ґ–µ–љ–Є–µ —Б–Є–љ—В–µ–Ј–∞ —Н–љ–і–Њ—В–µ–ї–Є–љ–∞–1 –≤ —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ—Л—Е –Є —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Л—Е –њ–Њ—З–µ—З–љ—Л—Е –Ї–ї–µ—В–Ї–∞—Е, —Б–љ–Є–ґ–µ–љ–Є–µ —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є TGF–b [8].
–Э–∞–Ї–Њ–њ–ї–µ–љ –Њ–њ—Л—В —Г—Б–њ–µ—И–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Ь–Ь–§ –њ—А–Є –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е: —Б–Є—Б—В–µ–Љ–љ–Њ–є –Ї—А–∞—Б–љ–Њ–є –≤–Њ–ї—З–∞–љ–Ї–µ, —Б–Є—Б—В–µ–Љ–љ—Л—Е –≤–∞—Б–Ї—Г–ї–Є—В–∞—Е, –њ—Б–Њ—А–Є–∞–Ј–µ, –њ—Г–Ј—Л—А—З–∞—В–Ї–µ, –∞—В–Њ–њ–Є—З–µ—Б–Ї–Њ–є —Н–Ї–Ј–µ–Љ–µ, –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ–Њ–є –≥–µ–Љ–Њ–ї–Є—В–Є—З–µ—Б–Ї–Њ–є –∞–љ–µ–Љ–Є–Є, –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е –Ї–Є—И–µ—З–љ–Є–Ї–∞, –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ–Њ–Љ –≥–µ–њ–∞—В–Є—В–µ, –њ–µ—А–≤–Є—З–љ–Њ–Љ –±–Є–ї–Є–∞—А–љ–Њ–Љ —Ж–Є—А—А–Њ–Ј–µ, –Љ–Є–∞—Б—В–µ–љ–Є–Є, –і–µ—А–Љ–∞—В–Њ–Љ–Є–Њ–Ј–Є—В–µ, —Б–Є—Б—В–µ–Љ–љ–Њ–є —Б–Ї–ї–µ—А–Њ–і–µ—А–Љ–Є–Є. –Ь–Ь–§ —И–Є—А–Њ–Ї–Њ –љ–∞–Ј–љ–∞—З–∞–µ—В—Б—П –њ—А–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е –њ–Њ—З–µ–Ї, –≤–Ї–ї—О—З–∞—П IgA––љ–µ—Д—А–Њ–њ–∞—В–Є—О, –Љ–µ–Љ–±—А–∞–љ–Њ–Ј–љ—Л–є –љ–µ—Д—А–Є—В, —Д–Њ–Ї–∞–ї—М–љ—Л–є —Б–µ–≥–Љ–µ–љ—В–∞—А–љ—Л–є –≥–ї–Њ–Љ–µ—А—Г–ї–Њ—Б–Ї–ї–µ—А–Њ–Ј, –≥–µ–њ–∞—В–Є—В––°––∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л–є –≥–ї–Њ–Љ–µ—А—Г–ї–Њ–љ–µ—Д—А–Є—В –Є –і–∞–ґ–µ —Б–Є–љ–і—А–Њ–Љ –У—Г–і–њ–∞—Б—З–µ—А–∞ [9]. –Т –і–∞–љ–љ–Њ–Љ –Њ–±–Ј–Њ—А–µ —Б—Г–Љ–Љ–Є—А–Њ–≤–∞–љ—Л –Є –њ—А–Њ–∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ—Л –ї–Є—В–µ—А–∞—В—Г—А–љ—Л–µ –і–∞–љ–љ—Л–µ, –Ї–∞—Б–∞—О—Й–Є–µ—Б—П —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –і–µ—Б—П—В–Є–ї–µ—В–љ–µ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Ь–Ь–§ –њ—А–Є –љ–∞–Є–±–Њ–ї–µ–µ —В—П–ґ–µ–ї—Л—Е —А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е.
–°–Є—Б—В–µ–Љ–љ–∞—П –Ї—А–∞—Б–љ–∞—П –≤–Њ–ї—З–∞–љ–Ї–∞ (–°–Ъ–Т)
–≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Ь–Ь–§ –±—Л–ї–∞ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–∞ –љ–∞ –Љ—Л—И–Є–љ—Л—Е –Љ–Њ–і–µ–ї—П—Е –≤–Њ–ї—З–∞–љ–Њ—З–љ–Њ–њ–Њ–і–Њ–±–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П: –Њ—В–Љ–µ—З–µ–љ–Њ —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ–µ–є –∞–љ—В–Є—В–µ–ї –Ї –і–≤—Г—Б–њ–Є—А–∞–ї—М–љ–Њ–є –Ф–Э–Ъ, –њ–Њ–Ј–і–љ–µ–µ —А–∞–Ј–≤–Є—В–Є–µ –љ–µ—Д—А–Є—В–∞, –Ј–∞–Љ–µ–і–ї–µ–љ–Є–µ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –њ–Њ—З–µ—З–љ–Њ–≥–Њ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –Є –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є –ґ–Є–≤–Њ—В–љ—Л—Е [10]. –Я–Њ–ї—Г—З–µ–љ–љ—Л–µ –≤ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞—Е –љ–∞ –ґ–Є–≤–Њ—В–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ–Њ—Б–ї—Г–ґ–Є–ї–Є –Њ—Б–љ–Њ–≤–∞–љ–Є–µ–Љ –≤–Ї–ї—О—З–µ–љ–Є—П –Ь–Ь–§ –≤ —Б—Е–µ–Љ—Г –ї–µ—З–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е –°–Ъ–Т, –≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ —Б –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ –њ–Њ—З–µ–Ї. –Я–µ—А–≤—Л–є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–є –Њ–њ—Л—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Ь–Ь–§ —Г –±–Њ–ї—М–љ—Л—Е —Б –≤–Њ–ї—З–∞–љ–Њ—З–љ—Л–Љ –≥–ї–Њ–Љ–µ—А—Г–ї–Њ–љ–µ—Д—А–Є—В–Њ–Љ (–Т–У–Э) –і–∞—В–Є—А–Њ–≤–∞–љ 1998 –≥–Њ–і–Њ–Љ, –Ї–Њ–≥–і–∞ –±—Л–ї –Њ—В–Љ–µ—З–µ–љ –≤—Л—А–∞–ґ–µ–љ–љ—Л–є —Н—Д—Д–µ–Ї—В –Ь–Ь–§ —Г 4 –±–Њ–ї—М–љ—Л—Е, —А–µ—Д—А–∞–Ї—В–µ—А–љ—Л—Е –Ї —Ж–Є–Ї–ї–Њ—Д–Њ—Б—Д–∞–Љ–Є–і—Г (–¶–§) –Є –і—А—Г–≥–Є–Љ –Є–Љ–Љ—Г–љ–Њ—Б—Г–њ—А–µ—Б—Б–∞–љ—В–∞–Љ [11].
–Ю–≥—А–Њ–Љ–љ—Л–є –≤–Ї–ї–∞–і –≤ —Г—В–Њ—З–љ–µ–љ–Є–µ —А–Њ–ї–Є –Ь–Ь–§ —Г –±–Њ–ї—М–љ—Л—Е –°–Ъ–Т –≤–љ–µ—Б–ї–Є —А–µ–Ј—Г–ї—М—В–∞—В—Л —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є (–†–Ъ–Ш), –≤ –Ї–Њ—В–Њ—А—Л—Е –њ—А–µ–њ–∞—А–∞—В –љ–∞–Ј–љ–∞—З–∞–ї—Б—П –Ї–∞–Ї –≤ –Є–љ–і—Г–Ї—Ж–Є–Њ–љ–љ—Г—О, —В–∞–Ї –Є –≤ –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й—Г—О —Д–∞–Ј—Г –ї–µ—З–µ–љ–Є—П (—В–∞–±–ї. 1). –Я–µ—А–≤–Њ–µ –†–Ъ–Ш —Г 42 –±–Њ–ї—М–љ—Л—Е —Б IY –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –Ї–ї–∞—Б—Б–Њ–Љ –Т–У–Э, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –і–≤–µ —А–∞–Ј–ї–Є—З–љ—Л—Е —Б—Е–µ–Љ—Л –Є–љ–і—Г–Ї—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ –≤ 2000 –≥–Њ–і—Г Chan T.M. –Є —Б–Њ–∞–≤—В. [13]. –С–Њ–ї—М–љ—Л–Љ –њ–µ—А–≤–Њ–є –≥—А—Г–њ–њ—Л –Ь–Ь–§ –љ–∞–Ј–љ–∞—З–∞–ї—Б—П –≤ —Б—Г—В–Њ—З–љ–Њ–є –і–Њ–Ј–µ 2 –≥ –≤ —В–µ—З–µ–љ–Є–µ 6 –Љ–µ—Б—П—Ж–µ–≤, —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ –њ—А–Є–µ–Љ–Њ–Љ –њ–Њ–ї–Њ–≤–Є–љ–љ–Њ–є –і–Њ–Ј—Л –Ь–Ь–§ –≤ —В–µ—З–µ–љ–Є–µ –њ–Њ–ї—Г–≥–Њ–і–∞. –С–Њ–ї—М–љ—Л–µ –≤—В–Њ—А–Њ–є –≥—А—Г–њ–њ—Л –њ–Њ–ї—Г—З–∞–ї–Є –¶–§ –Є–Ј —А–∞—Б—З–µ—В–∞ 2,5 –Љ–≥/–Ї–≥/—Б—Г—В. –≤ —В–µ—З–µ–љ–Є–µ 6 –Љ–µ—Б—П—Ж–µ–≤, –Ј–∞—В–µ–Љ –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–µ–є —В–µ—А–∞–њ–Є–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї—Б—П –∞–Ј–∞—В–Є–Њ–њ—А–Є–љ (–Р–Ч–Р) 1,5 –Љ–≥/–Ї–≥/—Б—Г—В. –°—Г—Й–µ—Б—В–≤–µ–љ–љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є –њ–Њ —З–∞—Б—В–Њ—В–µ —А–µ–Љ–Є—Б—Б–Є–є –≤ —Б—А–∞–≤–љ–Є–≤–∞–µ–Љ—Л—Е –≥—А—Г–њ–њ–∞—Е –љ–µ –Њ—В–Љ–µ—З–µ–љ–Њ (81% –≤ –≥—А—Г–њ–њ–µ –Ь–Ь–§ –Є 76% –≤ –≥—А—Г–њ–њ–µ –¶–§), –Њ–і–љ–∞–Ї–Њ –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М –Ь–Ь–§ –Њ–Ї–∞–Ј–∞–ї–∞—Б—М –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –ї—Г—З—И–µ. –І–∞—Б—В–Њ—В–∞ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Ј–∞ –њ–µ—А–Є–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є—П –±—Л–ї–∞ –≤—Л—И–µ –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –¶–§. –Ґ–∞–Ї–Є–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П, –Ї–∞–Ї –∞–Љ–µ–љ–Њ—А–µ—П, —Г—Б–Є–ї–µ–љ–љ–Њ–µ –≤—Л–њ–∞–і–µ–љ–Є–µ –≤–Њ–ї–Њ—Б –Є –ї–µ–є–Ї–Њ–њ–µ–љ–Є—П, –Є–Љ–µ–ї–Є –Љ–µ—Б—В–Њ —В–Њ–ї—М–Ї–Њ –љ–∞ —Д–Њ–љ–µ –ї–µ—З–µ–љ–Є—П –¶–§ –Є –љ–µ –≤—Б—В—А–µ—З–∞–ї–Є—Б—М —Г –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Ь–Ь–§.
Hu W. –Є —Б–Њ–∞–≤—В. –њ—А–Є —Б—А–∞–≤–љ–µ–љ–Є–Є –Ь–Ь–§ –Є –¶–§ –≤ –Ї–∞—З–µ—Б—В–≤–µ –Є–љ–і—Г–Ї—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є —Г 46 –±–Њ–ї—М–љ—Л—Е —Б IY –Ї–ї–∞—Б—Б–Њ–Љ –Т–У–Э –Њ–±–љ–∞—А—Г–ґ–Є–ї–Є –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–є –њ—А–Њ—Ж–µ–љ—В –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —А–µ–Љ–Є—Б—Б–Є–Є –љ–∞ —Д–Њ–љ–µ –Ь–Ь–§ [14]. –Р–љ–∞–ї–Њ–≥–Є—З–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ–Њ–ї—Г—З–µ–љ—Л Ginsler –Х. –Є —Б–Њ–∞–≤—В. –љ–∞ –±–Њ–ї—М—И–µ–Љ –Љ–∞—В–µ—А–Є–∞–ї–µ – —Г 140 –±–Њ–ї—М–љ—Л—Е —Б –∞–Ї—В–Є–≤–љ—Л–Љ –њ–Њ—З–µ—З–љ—Л–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ: —Б–Њ–њ–Њ—Б—В–∞–≤–ї–µ–љ–Є–µ —Б—В–∞–љ–і–∞—А—В–љ–Њ–є —Б—Е–µ–Љ—Л (–¶–§ –≤/–≤ –≤ –µ–ґ–µ–Љ–µ—Б—П—З–љ–Њ –≤ —В–µ—З–µ–љ–Є–µ –њ–Њ–ї—Г–≥–Њ–і–∞) –Є –Ь–Ь–§ –≤ –і–Њ–Ј–µ 1–3 –≥ –≤ —Б—Г—В–Ї–Є –≤ –Ї–∞—З–µ—Б—В–≤–µ –Є–љ–і—Г–Ї—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Њ –±–Њ–ї—М—И—Г—О —З–∞—Б—В–Њ—В—Г –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —А–µ–Љ–Є—Б—Б–Є–є –≤ –≥—А—Г–њ–њ–µ –Ь–Ь–§ –њ—А–Є –Љ–µ–љ—М—И–µ–є —З–∞—Б—В–Њ—В–µ —А–∞–Ј–≤–Є—В–Є—П –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ [15].
Contreras G. –Є —Б–Њ–∞–≤—В. –њ—А–Њ–∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–ї–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —А–∞–Ј–ї–Є—З–љ—Л—Е —Б—Е–µ–Љ –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–µ–є —В–µ—А–∞–њ–Є–Є —Г 59 –±–Њ–ї—М–љ—Л—Е —Б –њ—А–Њ–ї–Є—Д–µ—А–∞—В–Є–≤–љ—Л–Љ –Т–У–Э –њ–Њ—Б–ї–µ —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ–є –Є–љ–і—Г–Ї—Ж–Є–Њ–љ–љ–Њ–є —Д–∞–Ј—Л —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –¶–§. 20 –±–Њ–ї—М–љ—Л–Љ (1 –≥—А—Г–њ–њ–∞) –µ–ґ–µ–Ї–≤–∞—А—В–∞–ї—М–љ–Њ –≤–≤–Њ–і–Є–ї—Б—П –¶–§ –≤/–≤ –Є–Ј —А–∞—Б—З–µ—В–∞ 500 –Љ–≥/–Љ2. –Я–∞—Ж–Є–µ–љ—В—Л 2 –≥—А—Г–њ–њ—Л (19 —З–µ–ї–Њ–≤–µ–Ї) –њ–Њ–ї—Г—З–∞–ї–Є 1 –Љ–≥/–Ї–≥/—Б—Г—В. –Р–Ч–Р. –Т —В—А–µ—В—М–µ–є –≥—А—Г–њ–њ–µ 20 –±–Њ–ї—М–љ—Л—Е –њ—А–Є–љ–Є–Љ–∞–ї–Є –Ь–Ь–§ –≤ —Б—А–µ–і–љ–µ–є –і–Њ–Ј–µ 1500 –Љ–≥ –≤ —В–µ—З–µ–љ–Є–µ 1,5 –ї–µ—В, –Ј–∞—В–µ–Љ –Њ—В 250–1000 –Љ–≥. –Ф–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–ї—П–ї–∞ 25–30 –Љ–µ—Б—П—Ж–µ–≤. –Ч–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–Њ –њ—А–µ–≤–Њ—Б—Е–Њ–і—Б—В–≤–Њ –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–µ–є —В–µ—А–∞–њ–Є–Є –Р–Ч–Р –Є –Ь–Ь–§ –љ–∞–і –±–Њ–ї—О—Б–љ—Л–Љ –≤–≤–µ–і–µ–љ–Є–µ–Љ –¶–§. –†–∞–Ј–ї–Є—З–Є–є –Љ–µ–ґ–і—Г –Р–Ч–Р –Є –Ь–Ь–§ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ –±—Л–ї–Њ, –Ј–∞ –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ —В–µ–љ–і–µ–љ—Ж–Є–Є –Ї –±–Њ–ї—М—И–µ–є –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –њ–µ—А–Є–Њ–і–∞ —А–µ–Љ–Є—Б—Б–Є–Є —Г –±–Њ–ї—М–љ—Л—Е –љ–∞ —Д–Њ–љ–µ –Ь–Ь–§. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Ь–Ь–§ –Є –Р–Ч–Р –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М –±–Њ–ї–µ–µ –±–µ–Ј–Њ–њ–∞—Б–љ—Л–Љ, —З–µ–Љ –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–∞—П —В–µ—А–∞–њ–Є—П –¶–§. –Р–Љ–µ–љ–Њ—А–µ—П —А–∞–Ј–≤–Є–≤–∞–ї–∞—Б—М —Г 32% –±–Њ–ї—М–љ—Л—Е –љ–∞ —Д–Њ–љ–µ –¶–§ –Є –≤ 6–8% —Б–ї—Г—З–∞–µ–≤ –≤ –≥—А—Г–њ–њ–µ –Ь–Ь–§ –Є –Р–Ч–Р [16].
Karim M.Y. –Є —Б–Њ–∞–≤—В. –Њ–±–љ–∞—А—Г–ґ–Є–ї–Є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Г—О –і–Є–љ–∞–Љ–Є–Ї—Г –њ–Њ—З–µ—З–љ—Л—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤, —Б–љ–Є–ґ–µ–љ–Є–µ –±–∞–ї–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –°–Ъ–Т –Є —Г—А–Њ–≤–љ—П –∞–љ—В–Є—В–µ–ї –Ї –Ф–Э–Ъ, –Є —Б—В–µ—А–Њ–Є–і–—Б–±–µ—А–µ–≥–∞—О—Й–µ–µ –і–µ–є—Б—В–≤–Є–µ –Ь–Ь–§ —Г 21 –±–Њ–ї—М–љ–Њ–≥–Њ, —А–∞–љ–µ–µ —А–µ—Д—А–∞–Ї—В–µ—А–љ–Њ–≥–Њ –Ї –Є–Љ–Љ—Г–љ–Њ—Б—Г–њ—А–µ—Б—Б–Є–≤–љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–∞–Љ (–љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Њ–і–љ–Њ–≥–Њ –Є–ї–Є –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –Ї—Г—А—Б–Њ–≤ –¶–§, –Р–Ч–Р –Є –Љ–µ—В–Њ—В—А–µ–Ї—Б–∞—В–∞) [17]. Dunkan N. –Њ—В–Љ–µ—В–Є–ї –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї—Г—О —З–∞—Б—В–Њ—В—Г —А–∞–Ј–≤–Є—В–Є—П —А–µ–Љ–Є—Б—Б–Є–є —Г –±–Њ–ї—М–љ—Л—Е –љ–∞ —Д–Њ–љ–µ —В–µ—А–∞–њ–Є–Є –¶–§ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Ь–Ь–§. –Ю–і–љ–∞–Ї–Њ –љ–∞ —Д–Њ–љ–µ —В–µ—А–∞–њ–Є–Є –Ь–Ь–§ –љ–µ —А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–ї–Њ—Б—М –Њ–±–Њ—Б—В—А–µ–љ–Є–є –Ј–∞ –њ–µ—А–Є–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є—П, —В–Њ–≥–і–∞ –Ї–∞–Ї –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е —Б –¶–§ —З–∞—Б—В–Њ—В–∞ —А–µ—Ж–Є–і–Є–≤–Њ–≤ –і–Њ—Б—В–Є–≥–∞–ї–∞ 20% [18]. –Я—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Ь–Ь–§ –њ—А–Є –Љ–µ–Љ–±—А–∞–љ–Њ–Ј–љ–Њ–є –≤–Њ–ї—З–∞–љ–Њ—З–љ–Њ–є –љ–µ—Д—А–Њ–њ–∞—В–Є–Є (Y –Ї–ї–∞—Б—Б –њ–Њ –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є –Т–Ю–Ч), —Б—В–∞–љ–і–∞—А—В–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–µ —Б—Е–µ–Љ—Л –ї–µ—З–µ–љ–Є—П –Ї–Њ—В–Њ—А–Њ–є –Њ—В—Б—Г—В—Б—В–≤—Г—О—В –≤–≤–Є–і—Г –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –љ–µ–≤—Л—Б–Њ–Ї–Њ–є —З–∞—Б—В–Њ—В—Л –і–∞–љ–љ–Њ–є —Д–Њ—А–Љ—Л –њ–Њ—З–µ—З–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є (–Љ–µ–љ–µ–µ 20% –≤—Б–µ—Е –±–Њ–ї—М–љ—Л—Е —Б –≤–Њ–ї—З–∞–љ–Њ—З–љ—Л–Љ –љ–µ—Д—А–Є—В–Њ–Љ) –Є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Ї —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л–Љ —Б—Е–µ–Љ–∞–Љ –ї–µ—З–µ–љ–Є—П. Karim M.Y. –Є Pisoni C.N –љ–∞–Ј–љ–∞—З–∞–ї–Є –Ь–Ь–§ –≤ –і–Њ–Ј–µ 1–2 –≥ –≤ —Б—Г—В–Ї–Є (–≤ —Б—А–µ–і–љ–µ–Љ –≤ —В–µ—З–µ–љ–Є–µ 18 –Љ–µ—Б.) 10 –±–Њ–ї—М–љ—Л–Љ —Б –Љ–µ–Љ–±—А–∞–љ–Њ–Ј–љ—Л–Љ –љ–µ—Д—А–Є—В–Њ–Љ –Є –њ–Њ–ї—Г—З–Є–ї–Є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –≤ –≤–Є–і–µ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–≥–Њ —Б–љ–Є–ґ–µ–љ–Є—П —Б—Г—В–Њ—З–љ–Њ–є –њ—А–Њ—В–µ–Є–љ—Г—А–Є–Є –Є –њ–Њ–≤—Л—И–µ–љ–Є—П —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–Њ–≥–Њ –∞–ї—М–±—Г–Љ–Є–љ–∞ [19].
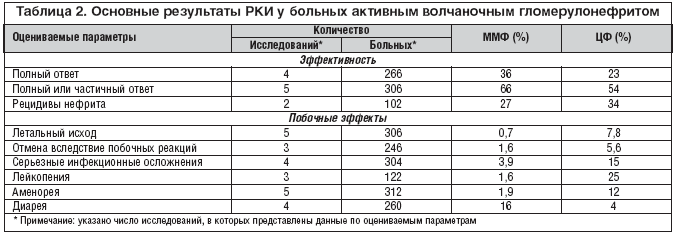
–°–Њ–≥–ї–∞—Б–љ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –Љ–µ—В–∞––∞–љ–∞–ї–Є–Ј–∞ Moore R.A. (2006 –≥–Њ–і), –Њ—Б–љ–Њ–≤–∞–љ–љ—Л—Е –љ–∞ –і–∞–љ–љ—Л—Е 6 —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є (370 –±–Њ–ї—М–љ—Л—Е –°–Ъ–Т, 197 –Є–Ј –Ї–Њ—В–Њ—А—Л—Е –њ–Њ–ї—Г—З–∞–ї–Є –Ь–Ь–§), 10 –Ї–Њ–≥–Њ—А—В–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є (212 –±–Њ–ї—М–љ—Л—Е —Б –≤–Њ–ї—З–∞–љ–Њ—З–љ—Л–Љ –љ–µ—Д—А–Є—В–Њ–Љ) –Є 8 –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –≤–Ї–ї—О—З–Є–≤—И–Є—Е 284 –±–Њ–ї—М–љ—Л—Е –°–Ъ–Т –Ї–∞–Ї —Б –њ–Њ—З–µ—З–љ—Л–Љ–Є, —В–∞–Ї –Є —Б –≤–љ–µ–њ–Њ—З–µ—З–љ—Л–Љ–Є –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є, –Ь–Ь–§ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –Њ—Б–љ–Њ–≤–љ—Л–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П –°–Ъ–Т –њ—А–Є –њ—А–Є–µ–Љ–ї–µ–Љ–Њ–Љ —Б–њ–µ–Ї—В—А–µ –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є –Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є —Б–µ—А—М–µ–Ј–љ—Л—Е –њ–Њ–±–Њ—З–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є [20]. –≠—В–Є–Љ –ґ–µ –∞–≤—В–Њ—А–Њ–Љ –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –Є–Љ–µ—О—Й–Є—Е—Б—П –Ї –љ–∞—Б—В–Њ—П—Й–µ–Љ—Г –≤—А–µ–Љ–µ–љ–Є —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –†–Ъ–Ш —Г –±–Њ–ї—М–љ—Л—Е –Т–У–Э –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–∞ –Њ–і–Є–љ–∞–Ї–Њ–≤–∞—П (–∞ –њ–Њ —А—П–і—Г –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ –Є –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–∞—П) —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Ь–Ь–§ –њ—А–Є —Б—А–∞–≤–љ–µ–љ–Є–Є –¶–§ –Є –ї—Г—З—И–∞—П –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М (—В–∞–±–ї. 2).
–Ш–Љ–µ—О—В—Б—П —Б–Њ–Њ–±—Й–µ–љ–Є—П –Є –Њ –і—А—Г–≥–Є—Е —В–Њ—З–Ї–∞—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Ь–Ь–§: —А–µ—Д—А–∞–Ї—В–µ—А–љ–∞—П —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є—П, –њ–Њ—А–∞–ґ–µ–љ–Є–µ –Ї–Њ–ґ–Є, –љ–µ–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М, –ї–µ–≥–Њ—З–љ—Л–є –∞–ї—М–≤–µ–Њ–ї–Є—В –Є –і—А. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–∞ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–∞—П –і–Є–љ–∞–Љ–Є–Ї–∞ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є (—Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –∞–љ—В–Є—В–µ–ї –Ї –і–≤—Г—Б–њ–Є—А–∞–ї—М–љ–Њ–є –Ф–Э–Ъ, –њ–Њ–≤—Л—И–µ–љ–Є–µ –°–3 –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞ –Ї–Њ–Љ–њ–ї–µ–Љ–µ–љ—В–∞), —Б–љ–Є–ґ–µ–љ–Є–µ –±–∞–ї–ї—М–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є, –і–Њ—Б—В–Є–ґ–µ–љ–Є–µ —Б—В–µ—А–Њ–Є–і—Б–±–µ—А–µ–≥–∞—О—Й–µ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ [9,12].
–Я—А–µ–і—Б—В–∞–≤–ї—П—О—В –Є–љ—В–µ—А–µ—Б —А–µ–Ј—Г–ї—М—В–∞—В—Л, —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—Й–Є–µ –Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Ь–Ь–§ –Њ–Ї–∞–Ј—Л–≤–∞—В—М –≤–ї–Є—П–љ–Є–µ –љ–∞ —Н–≤–Њ–ї—О—Ж–Є—О —В–µ—З–µ–љ–Є—П –°–Ъ–Т. –Я—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ—Л–µ –і–∞–љ–љ—Л–µ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є –Њ—В—Б—Г—В—Б—В–≤–Є–µ –Њ–±–Њ—Б—В—А–µ–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –Ь–Ь–§ —Г –±–Њ–ї—М–љ—Л—Е —Б –љ–∞—А–∞—Б—В–∞—О—Й–Є–Љ–Є —В–Є—В—А–∞–Љ–Є –∞–љ—В–Є—В–µ–ї –Ї –Ф–Э–Ъ. –•–Њ—А–Њ—И–∞—П –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М –њ—А–µ–њ–∞—А–∞—В–∞ –Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Є–µ–Љ–∞ –Љ–Њ–≥—Г—В —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—О –Ь–Ь–§ –Ї–∞–Ї —Б—А–µ–і—Б—В–≤–∞ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Њ–±–Њ—Б—В—А–µ–љ–Є–є, –Њ—Б–Њ–±–µ–љ–љ–Њ —Г –±–Њ–ї—М–љ—Л—Е —Б –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–Љ–Є –≤–∞—А–Є–∞–љ—В–∞–Љ–Є —В–µ—З–µ–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. [21].
–Ш–і–Є–Њ–њ–∞—В–Є—З–µ—Б–Ї–Є–µ
–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –Љ–Є–Њ–њ–∞—В–Є–Є (–Ш–Т–Ь)
–Э–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –≤—Б—В—А–µ—З–∞—О—Й–Є–Љ–Є—Б—П –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є —Н—В–Њ–є –≥—А—Г–њ–њ—Л —П–≤–ї—П—О—В—Б—П –і–µ—А–Љ–∞—В–Њ–Љ–Є–Њ–Ј–Є—В (–Ф–Ь) –Є –њ–Њ–ї–Є–Љ–Є–Њ–Ј–Є—В (–Я–Ь). –Я—А–Є –Ф–Ь –Є –Я–Ь —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л–Љ –≤–Є–і–Њ–Љ —В–µ—А–∞–њ–Є–Є —Б—З–Є—В–∞–µ—В—Б—П –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј –У–Ъ, –Ї–Њ—В–Њ—А—Л–µ —Г –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –і–∞—О—В –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–є —А–µ–Ј—Г–ї—М—В–∞—В. –Т —Б–ї—Г—З–∞–µ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –Є–ї–Є –њ–Њ—В—А–µ–±–љ–Њ—Б—В–Є –≤ –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є —Б–≤–µ—А—Е–≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј –У–Ъ –њ—А–Є–±–µ–≥–∞—О—В –Ї –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б—В–µ—А–Њ–Є–і–Њ–≤ —Б –Љ–µ—В–Њ—В—А–µ–Ї—Б–∞—В–Њ–Љ (–Ь–Ґ–•), –Р–Ч–Р, —Ж–Є–Ї–ї–Њ—Б–њ–Њ—А–Є–љ–Њ–Љ –Є–ї–Є –¶–§ [22]. –Я—А–Њ–±–ї–µ–Љ—Л —В–µ—А–∞–њ–Є–Є –Ш–Т–Ь –љ–∞ —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–Љ —Н—В–∞–њ–µ —Б–≤—П–Ј–∞–љ—Л –Ї–∞–Ї —Б –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М—О –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Є–µ–Љ–∞ –±–Њ–ї—М–љ—Л–Љ–Є –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј –У–Ъ, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –≤—Л—Б–Њ–Ї–Њ–є —З–∞—Б—В–Њ—В–µ –Є —Б—В–µ–њ–µ–љ–Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤, —В–∞–Ї –Є —Б –љ–µ–њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М—О –Є –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М—О —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л—Е —Ж–Є—В–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –Ґ—П–ґ–µ–ї—Л–µ –Ї–Њ–ґ–љ—Л–µ –њ–Њ—А–∞–ґ–µ–љ–Є—П –њ—А–Є –Ф–Ь —З–∞—Б—В–Њ —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—В –і–∞–ґ–µ –љ–∞ —Д–Њ–љ–µ –У–Ъ –Є —Ж–Є—В–Њ—В–Њ–Ї—Б–Є–Ї–Њ–≤. –Ь–Њ–љ–Є—В–Њ—А–Є–љ–≥ –Ї–Њ–ґ–љ—Л—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Љ—Л—И–µ—З–љ–Њ–є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–Њ–є –Њ—Б—Г—Й–µ—Б—В–≤–ї—П—В—М —В—А—Г–і–љ–µ–µ. –Я–ї–∞—Ж–µ–±–Њ––Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤ —В–Њ–≥–Њ –Є–ї–Є –Є–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Њ—Б—Г–њ—А–µ—Б—Б–∞–љ—В–∞ –Њ—В—Б—Г—В—Б—В–≤—Г—О—В, –њ–Њ—Н—В–Њ–Љ—Г –≤—Л–±–Њ—А –њ—А–µ–њ–∞—А–∞—В–∞ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В —Н–Љ–њ–Є—А–Є—З–µ—Б–Ї–Є –Є –Ј–∞–≤–Є—Б–Є—В –Њ—В —А—П–і–∞ —Д–∞–Ї—В–Њ—А–Њ–≤, –љ–∞–њ—А–Є–Љ–µ—А, —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є, –њ—А–µ–і—И–µ—Б—В–≤—Г—О—Й–µ–є —В–µ—А–∞–њ–Є–Є, –Є –і—А. [23].
–Т –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –њ–Њ—П–≤–ї—П—О—В—Б—П —Б–Њ–Њ–±—Й–µ–љ–Є—П –Њ–± —Г—Б–њ–µ—И–љ–Њ–Љ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Ь–Ь–§ —Г –±–Њ–ї—М–љ—Л—Е –Ш–Т–Ь.
V. Majithia –Є V. Harisdangkul –њ—А–µ–і—Б—В–∞–≤–Є–ї–Є –Њ–њ–Є—Б–∞–љ–Є–µ 7 –ґ–µ–љ—Й–Є–љ –Њ—В 17 –і–Њ 65 –ї–µ—В —Б –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ –і–Є–∞–≥–љ–Њ–Ј–Њ–Љ –Ш–Т–Ь (3 —Б –Я–Ь –Є 4 —Б –Ф–Ь), —Г –Ї–Њ—В–Њ—А—Л—Е —В–µ—А–∞–њ–Є—П —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л–Љ–Є –Є–Љ–Љ—Г–љ–Њ—Б—Г–њ—А–µ—Б—Б–Є–≤–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –±—Л–ї–∞ –ї–Є–±–Њ –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–є, –ї–Є–±–Њ –≤—Л–Ј—Л–≤–∞–ї–∞ —В—П–ґ–µ–ї—Л–µ –њ–Њ–±–Њ—З–љ—Л–µ —П–≤–ї–µ–љ–Є—П. –Ь–Ь–§ –љ–∞–Ј–љ–∞—З–∞–ї—Б—П –≤ –љ–∞—З–∞–ї—М–љ–Њ–є –і–Њ–Ј–µ 1 –≥ –њ—А–µ–њ–∞—А–∞—В–∞ —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –і–Њ 2 –≥ –≤ —Б—Г—В–Ї–Є. –Ы–µ—З–µ–љ–Є–µ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –≤ —В–µ—З–µ–љ–Є–µ 12–36 –Љ–µ—Б—П—Ж–µ–≤. –£ 6 –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –Њ—В–Љ–µ—З–µ–љ–∞ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–∞—П –і–Є–љ–∞–Љ–Є–Ї–∞ –Ї–Њ–ґ–љ–Њ–≥–Њ, –Љ—Л—И–µ—З–љ–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–Њ–≤ –Є —Г—А–Њ–≤–љ—П –Ї—А–µ–∞—В–Є–љ—Д–Њ—Б—Д–Њ–Ї–Є–љ–∞–Ј—Л (–Ъ–§–Ъ), —З—В–Њ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ —Б–љ–Є–Ј–Є—В—М –і–Њ–Ј—Г –њ—А–µ–і–љ–Є–Ј–Њ–ї–Њ–љ–∞. –Ґ–Њ–ї—М–Ї–Њ –Њ–і–љ–∞ –њ–∞—Ж–Є–µ–љ—В–Ї–∞ –Њ–Ї–∞–Ј–∞–ї–∞—Б—М —А–µ—Д—А–∞–Ї—В–µ—А–љ–Њ–є –Ї —В–µ—А–∞–њ–Є–Є –Ь–Ь–§ [24].
Gelber A. —Б —Б–Њ–∞–≤—В. –Њ—В–Љ–µ—В–Є–ї–Є —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –Ї–Њ–ґ–љ–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ —Г 4 –±–Њ–ї—М–љ—Л—Е —Б –Ф–Ь –љ–∞ —Д–Њ–љ–µ —В–µ—А–∞–њ–Є–Є –Ь–Ь–§ –≤ —В–µ—З–µ–љ–Є–µ 6–20 –Љ–µ—Б. [25]. Edge J.C. –Є —Б–Њ–∞–≤—В. –њ—А–Њ–≤–µ–ї–Є —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л–є –∞–љ–∞–ї–Є–Ј —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ь–Ь–§ —Г 12 –±–Њ–ї—М–љ—Л—Е —Б –Ф–Ь —Б –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М—О –Є —А–∞–Ј–≤–Є—В–Є–µ–Љ –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ —Б—В–∞–љ–і–∞—А—В–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –ї–µ—З–µ–љ–Є—П (–У–Ъ –Є —Ж–Є—В–Њ—В–Њ–Ї—Б–Є–Ї–Њ–≤). –£ 10 –Є–Ј 12 –±–Њ–ї—М–љ—Л—Е –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М —Г–ї—Г—З—И–µ–љ–Є–µ –Ї–Њ–ґ–љ–Њ–є –Є –Љ—Л—И–µ—З–љ–Њ–є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–Є —З–µ—А–µ–Ј 4–8 –љ–µ–і–µ–ї—М –Њ—В –љ–∞—З–∞–ї–∞ —В–µ—А–∞–њ–Є–Є –Ь–Ь–§ –≤ –і–Њ–Ј–µ 2–3 –≥—А–∞–Љ–Љ–∞ –≤ —Б—Г—В–Ї–Є [26].
Mastaglia F. —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Ь–Ь–§ –њ—А–Є –Ш–Т–Ь –≤ —Б–ї—Г—З–∞—П—Е –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ь–Ґ–• –Є –Р–Ч–Р, —Б—З–Є—В–∞—П –Ь–Ь–§ –±–Њ–ї–µ–µ –±–µ–Ј–Њ–њ–∞—Б–љ—Л–Љ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –і—А—Г–≥–Є–Љ–Є –Є–Љ–Љ—Г–љ–Њ—Б—Г–њ—А–µ—Б—Б–Є–≤–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є. –Я—А–µ–і–њ–Њ–ї–∞–≥–∞—О—В, —З—В–Њ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–∞—П —В–µ—А–∞–њ–Є—П —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Ь–Ь–§ —В–∞–Ї–ґ–µ –Љ–Њ–ґ–µ—В –Њ–Ї–∞–Ј—Л–≤–∞—В—М —Б—В–µ—А–Њ–Є–і–—Б–±–µ—А–µ–≥–∞—О—Й–µ–µ –і–µ–є—Б—В–≤–Є–µ [23, 24].
–°–Є—Б—В–µ–Љ–љ–∞—П —Б–Ї–ї–µ—А–Њ–і–µ—А–Љ–Є—П (–°–°–Ф)
–С–Њ–ї–µ–Ј–љ—М––Љ–Њ–і–Є—Д–Є—Ж–Є—А—Г—О—Й–Є–µ –њ—А–µ–њ–∞—А–∞—В—Л –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –Њ–±—Л—З–љ–Њ –љ–∞–Ј–љ–∞—З–∞—О—В—Б—П –±–Њ–ї—М–љ—Л–Љ –°–°–Ф —Б –і–Є—Д—Д—Г–Ј–љ–Њ–є —Д–Њ—А–Љ–Њ–є –Є –≤–Њ–≤–ї–µ—З–µ–љ–Є–µ–Љ –≤–љ—Г—В—А–µ–љ–љ–Є—Е –Њ—А–≥–∞–љ–Њ–≤, –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М –ї–µ–≥–Ї–Є—Е. –Т—Л–≤–Њ–і—Л –Њ–± —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ь–Ґ–•, –Р–Ч–Р, —Ж–Є–Ї–ї–Њ—Б–њ–Њ—А–Є–љ–∞ –Р –Є –¶–§ –Њ—Б–љ–Њ–≤–∞–љ—Л –љ–∞ —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–Љ –∞–љ–∞–ї–Є–Ј–µ –љ–µ–±–Њ–ї—М—И–Є—Е –≥—А—Г–њ–њ –±–Њ–ї—М–љ—Л—Е —Б –љ–µ–њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ—Л–Љ–Є –Ї—Г—А—Б–∞–Љ–Є –ї–µ—З–µ–љ–Є—П –Є –Ј–∞—З–∞—Б—В—Г—О –њ—А–Њ—В–Є–≤–Њ—А–µ—З–Є–≤—Л. –Ъ –љ–∞—Б—В–Њ—П—Й–µ–Љ—Г –≤—А–µ–Љ–µ–љ–Є –Њ—В—Б—Г—В—Б—В–≤—Г—О—В —Г–±–µ–і–Є—В–µ–ї—М–љ—Л–µ –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤–∞ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ —В–Њ–≥–Њ –Є–ї–Є –Є–љ–Њ–≥–Њ –≤–Є–і–∞ —В–µ—А–∞–њ–Є–Є. –Я—А–Є–љ—П—В–Њ —Б—З–Є—В–∞—В—М —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ—Л–Љ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Є–Љ–Љ—Г–љ–Њ—Б—Г–њ—А–µ—Б—Б–∞–љ—В–Њ–≤ –±–Њ–ї—М–љ—Л–Љ —Б –±—Л—Б—В—А–Њ –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–Є–Љ —В–µ—З–µ–љ–Є–µ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –Њ–≤–µ—А–ї–∞–њ–—Б–Є–љ–і—А–Њ–Љ–Њ–Љ –Є –Є–љ—В–µ—А—Б—В–Є—Ж–Є–∞–ї—М–љ—Л–Љ –ї–µ–≥–Њ—З–љ—Л–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ. –≠–Ї—Б–њ–µ—А—В—Л —А–µ–Ї–Њ–Љ–µ–љ–і—Г—О—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Ь–Ґ–• –≤ –Ї–∞—З–µ—Б—В–≤–µ –∞–љ—В–Є—Д–Є–±—А–Њ–Ј–љ–Њ–≥–Њ —Б—А–µ–і—Б—В–≤–∞ –њ—А–Є –≥–µ–љ–µ—А–∞–ї–Є–Ј–Њ–≤–∞–љ–љ–Њ–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–Є –Ї–Њ–ґ–Є –Є –¶–§ –њ—А–Є –Њ—Б—В—А–Њ–Љ –∞–ї—М–≤–µ–Њ–ї–Є—В–µ [27]. –Ю–і–љ–∞–Ї–Њ –њ—А–Њ–±–ї–µ–Љ—Л —В–µ—А–∞–њ–Є–Є –±–Њ–ї—М–љ—Л—Е –°–°–Ф –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л —В–∞–Ї–Њ–≤—Л–Љ —Г –±–Њ–ї—М–љ—Л—Е —Б –і—А—Г–≥–Є–Љ–Є —Б–Є—Б—В–µ–Љ–љ—Л–Љ–Є —А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є, —З—В–Њ —В–∞–Ї–ґ–µ —В—А–µ–±—Г–µ—В –љ–µ —В–Њ–ї—М–Ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Є—П –±–Њ–ї—М—И–Є—Е –њ–Њ –Њ–±—К–µ–Љ—Г –†–Ъ–Ш –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л—Е —Ж–Є—В–Њ—В–Њ–Ї—Б–Є–Ї–Њ–≤, –љ–Њ –Є –њ–Њ–Є—Б–Ї–∞ –љ–Њ–≤—Л—Е —Б—Е–µ–Љ –ї–µ—З–µ–љ–Є—П.
–Ъ –љ–∞—Б—В–Њ—П—Й–µ–Љ—Г –Љ–Њ–Љ–µ–љ—В—Г –≤ –ї–Є—В–µ—А–∞—В—Г—А–µ –Є–Љ–µ—О—В—Б—П —В–Њ–ї—М–Ї–Њ 3 —Б–Њ–Њ–±—Й–µ–љ–Є—П –Њ–± –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Ь–Ь–§ —Г –±–Њ–ї—М–љ—Л—Е –°–°–Ф.
–Т –њ–Є–ї–Њ—В–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є Stratton R.J. –Є —Б–Њ–∞–≤—В. —Г 13 –±–Њ–ї—М–љ—Л—Е —Б –і–Є—Д—Д—Г–Ј–љ–Њ–є —Д–Њ—А–Љ–Њ–є —Б–Є—Б—В–µ–Љ–љ–Њ–є —Б–Ї–ї–µ—А–Њ–і–µ—А–Љ–Є–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї—Б—П 5––і–љ–µ–≤–љ—Л–є –Ї—Г—А—Б –∞–љ—В–Є—В–Є–Љ–Њ—Ж–Є—В–∞—А–љ–Њ–≥–Њ –≥–ї–Њ–±—Г–ї–Є–љ–∞ —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ–Љ 2 –≥ –Ь–Ь–§ –≤ —В–µ—З–µ–љ–Є–µ 12 –Љ–µ—Б. –Ч–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–Њ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Ї–Њ–ґ–љ–Њ–≥–Њ —Б—З–µ—В–∞ –Є —Е–Њ—А–Њ—И–∞—П –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М –њ—А–µ–њ–∞—А–∞—В–∞ [28].
Liossis S.N.C. –Є —Б–Њ–∞–≤—В. –њ—А–Њ–≤–µ–ї–Є –Њ—В–Ї—А—Л—В–Њ–µ –љ–µ–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ь–Ь–§ —Г 6 –±–Њ–ї—М–љ—Л—Е –°–°–Ф —Б —Г–Љ–µ—А–µ–љ–љ—Л–Љ, –љ–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Њ—З–µ–≤–Є–і–љ—Л–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ –ї–µ–≥–Ї–Є—Е. –Я—А–µ–њ–∞—А–∞—В –љ–∞–Ј–љ–∞—З–µ–љ 5 –±–Њ–ї—М–љ—Л–Љ —Б –љ–µ–і–∞–≤–љ–Њ –њ–Њ—П–≤–Є–≤—И–Є–Љ–Є—Б—П –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є –∞–ї—М–≤–µ–Њ–ї–Є—В–∞ –Є 1 –±–Њ–ї—М–љ–Њ–Љ—Г —Б —Д–Є–±—А–Њ–Ј–Є—А—Г—О—Й–Є–Љ –∞–ї—М–≤–µ–Њ–ї–Є—В–Њ–Љ, —А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л–Љ –Ї —В–µ—А–∞–њ–Є–Є –¶–§. –°—Е–µ–Љ–∞ —В–µ—А–∞–њ–Є–Є –≤–Ї–ї—О—З–∞–ї–∞ –њ—А–Є–µ–Љ –љ–µ–≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј –њ—А–µ–і–љ–Є–Ј–Њ–ї–Њ–љ–∞ (7,5–10 –Љ–≥/—Б—Г—В.) –Є –Ь–Ь–§ –≤ –љ–∞—З–∞–ї—М–љ–Њ–є –і–Њ–Ј–µ 1 –≥ —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –і–Њ 2 –≥ –≤ —Б—Г—В–Ї–Є. –Я—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—П –≤–∞—А—М–Є—А–Њ–≤–∞–ї–∞ –Њ—В 12 –і–Њ 33 –Љ–µ—Б. (–≤ —Б—А–µ–і–љ–µ–Љ 16 –Љ–µ—Б.). –£–ґ–µ —З–µ—А–µ–Ј 4–6 –Љ–µ—Б. –ї–µ—З–µ–љ–Є—П —Г 5 –Є–Ј 6 –±–Њ–ї—М–љ—Л—Е –Њ—В–Љ–µ—З–µ–љ–Њ —Г–ї—Г—З—И–µ–љ–Є–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–Є –Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –ї–µ–≥–Њ—З–љ—Л—Е —В–µ—Б—В–Њ–≤, —Б–Њ—Е—А–∞–љ—П–≤—И–µ–µ—Б—П –њ–Њ –Љ–µ–љ—М—И–µ–є –Љ–µ—А–µ –≤ —В–µ—З–µ–љ–Є–µ –≥–Њ–і–∞ –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –Ь–Ь–§. –£ 1 –њ–∞—Ж–Є–µ–љ—В–Ї–Є –Ь–Ь–§ –±—Л–ї –Њ—В–Љ–µ–љ–µ–љ —З–µ—А–µ–Ј 10 –Љ–µ—Б. –≤ —Б–≤—П–Ј–Є —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ –њ–ї–µ–≤—А–Є—В–∞ [29].
–Т 2007 –≥–Њ–і—Г Nihtyanova S.I. –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–ї —А–µ–Ј—Г–ї—М—В–∞—В—Л —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ —В–µ—З–µ–љ–Є—П –Є –Є—Б—Е–Њ–і–Њ–≤ –°–°–Ф —Г 172 –±–Њ–ї—М–љ—Л—Е, 109 –Є–Ј –Ї–Њ—В–Њ—А—Л—Е –њ–Њ–ї—Г—З–∞–ї–Є –Ь–Ь–§ (79% –≤ —В–µ—З–µ–љ–Є–µ –±–Њ–ї–µ–µ –≥–Њ–і–∞). –Ю—Б–љ–Њ–≤–љ—Л–Љ–Є –њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ–Є –Ї –љ–∞–Ј–љ–∞—З–µ–љ–Є—О –њ—А–µ–њ–∞—А–∞—В–∞ —П–≤–ї—П–ї–Њ—Б—М –∞–Ї—В–Є–≤–љ–Њ–µ –њ–Њ—А–∞–ґ–µ–љ–Є–µ –Ї–Њ–ґ–Є –Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–Є–є –ї–µ–≥–Њ—З–љ—Л–є —Д–Є–±—А–Њ–Ј. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Ь–Ь–§, –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —З–∞—Й–µ –≤—Б—В—А–µ—З–∞–ї–Њ—Б—М –њ–Њ—А–∞–ґ–µ–љ–Є–µ –њ–Њ—З–µ–Ї (23% –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б 5% –≤ –Ї–Њ–љ—В—А–Њ–ї–µ). –Т —Ж–µ–ї–Њ–Љ —Б–Љ–µ—А—В–љ–Њ—Б—В—М –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ–µ –ї–µ–≥–Њ—З–љ–Њ–µ –њ–Њ—А–∞–ґ–µ–љ–Є–µ –Њ–Ї–∞–Ј–∞–ї–Є—Б—М –љ–Є–ґ–µ –љ–∞ —Д–Њ–љ–µ —В–µ—А–∞–њ–Є–Є –Ь–Ь–§. 5––ї–µ—В–љ—П—П –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М –≤ –≥—А—Г–њ–њ–µ –Ь–Ь–§ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 95,4% (–≤ –Ї–Њ–љ—В—А–Њ–ї–µ – 85,7%), —З—В–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –≤—Л—И–µ –≤—Б–µ—Е —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є—Е –і–∞–љ–љ—Л—Е –њ–Њ –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є –±–Њ–ї—М–љ—Л—Е –°–°–Ф [30].
Swigris J.J. –љ–∞–Ј–љ–∞—З–∞–ї –Ь–Ь–§ 28 –±–Њ–ї—М–љ—Л–Љ —Б –Є–љ—В–µ—А—Б—В–Є—Ж–Є–∞–ї—М–љ—Л–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ –ї–µ–≥–Ї–Є—Е (–≤ —А–∞–Љ–Ї–∞—Е —А–∞–Ј–ї–Є—З–љ—Л—Е —Б–Є—Б—В–µ–Љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —Б–Њ–µ–і–Є–љ–Є—В–µ–ї—М–љ–Њ–є —В–Ї–∞–љ–Є) –Ї–∞–Ї –≤ —Б–Њ—Б—В–∞–≤–µ –Є–љ–і—Г–Ї—Ж–Є–Њ–љ–љ—Л—Е —Б—Е–µ–Љ, —В–∞–Ї –Є –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–µ–є —В–µ—А–∞–њ–Є–Є. –Т —Б—А–µ–і–љ–µ–Љ —З–µ—А–µ–Ј –≥–Њ–і —Г –≤—Б–µ—Е –±–Њ–ї—М–љ—Л—Е –Њ—В–Љ–µ—З–µ–љ–∞ —Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є—П –ї–µ–≥–Њ—З–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є [31]. –Т–Њ–Ј–Љ–Њ–ґ–љ–Њ, –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –Ь–Ь–§ –њ—А–Є –ї–µ—З–µ–љ–Є–Є –ї–µ–≥–Њ—З–љ–Њ–≥–Њ —Д–Є–±—А–Њ–Ј–∞ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –≤ –ї–µ–≥–Њ—З–љ–Њ–є —В–Ї–∞–љ–Є TGF–b, –Њ–±–ї–∞–і–∞—О—Й–µ–≥–Њ —Д–Є–±—А–Њ–≥–µ–љ–љ—Л–Љ –і–µ–є—Б—В–≤–Є–µ–Љ [32].
–°–Є—Б—В–µ–Љ–љ—Л–µ –≤–∞—Б–Ї—Г–ї–Є—В—Л (–°–Т)
–Э–∞–Є–±–Њ–ї–µ–µ —В—П–ґ–µ–ї—Л–Љ–Є —Д–Њ—А–Љ–∞–Љ–Є –°–Т —П–≤–ї—П—О—В—Б—П –Р–Э–¶–Р––∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л–µ –≤–∞—Б–Ї—Г–ї–Є—В—Л, —В–∞–Ї–Є–µ –Ї–∞–Ї –≥—А–∞–љ—Г–ї–µ–Љ–∞—В–Њ–Ј –Т–µ–≥–µ–љ–µ—А–∞ (–У–Т) –Є –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Є–є –њ–Њ–ї–Є–∞–љ–≥–Є–Є—В (–Ь–Я–Р), —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–Є–µ—Б—П –≤—Л—Б–Њ–Ї–Њ–є —З–∞—Б—В–Њ—В–Њ–є —А–∞–Ј–≤–Є—В–Є—П –±—Л—Б—В—А–Њ –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–≥–Њ –≥–ї–Њ–Љ–µ—А—Г–ї–Њ–љ–µ—Д—А–Є—В–∞. –Т –Њ—В—Б—Г—В—Б—В–≤–Є–µ —В–µ—А–∞–њ–Є–Є —Б–Љ–µ—А—В–љ–Њ—Б—В—М –±–Њ–ї—М–љ—Л—Е –У–Т –≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤–Њ–≥–Њ –≥–Њ–і–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –і–Њ—Б—В–Є–≥–∞–µ—В 80%. –° –љ–∞—З–∞–ї–∞ 70–—Е –≥–Њ–і–Њ–≤ –њ—А–Њ—И–ї–Њ–≥–Њ –≤–µ–Ї–∞ —Б—В–∞–љ–і–∞—А—В–Њ–Љ –Є–љ–і—Г–Ї—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –У–Т —Б—З–Є—В–∞—О—В—Б—П –≤—Л—Б–Њ–Ї–Є–µ –і–Њ–Ј—Л –У–Ъ –Є –¶–§ –≤–љ—Г—В—А—М. –Т –і–∞–ї—М–љ–µ–є—И–µ–Љ –і–ї—П –њ–Њ–і–і–µ—А–ґ–∞–љ–Є—П —А–µ–Љ–Є—Б—Б–Є–Є –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Њ–±–Њ—Б—В—А–µ–љ–Є–є –њ—А–Њ–і–Њ–ї–ґ–∞–µ—В—Б—П –і–ї–Є—В–µ–ї—М–љ—Л–є –њ—А–Є–µ–Љ –¶–§ –≤–љ—Г—В—А—М, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –≤—Л—Б–Њ–Ї–Є–Љ –Ї—Г–Љ—Г–ї—П—В–Є–≤–љ—Л–Љ –і–Њ–Ј–∞–Љ –Є, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –±–Њ–ї—М—И–Њ–Љ—Г –њ—А–Њ—Ж–µ–љ—В—Г —А–∞–Ј–≤–Є—В–Є—П –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є. –°–∞–Љ—Л–Љ–Є —Б–µ—А—М–µ–Ј–љ—Л–Љ–Є —Г –±–Њ–ї—М–љ—Л—Е –У–Т —Б—З–Є—В–∞–µ—В—Б—П 30––Ї—А–∞—В–љ–Њ–µ –њ–Њ–≤—Л—И–µ–љ–Є–µ —А–Є—Б–Ї–∞ —А–∞–Ї–∞ –Љ–Њ—З–µ–≤–Њ–≥–Њ –њ—Г–Ј—Л—А—П –Є 10––Ї—А–∞—В–љ–Њ–µ –њ–Њ–≤—Л—И–µ–љ–Є–µ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –ї–Є–Љ—Д–Њ–Љ—Л [33]. –Я–Њ –Љ–љ–µ–љ–Є—О —Н–Ї—Б–њ–µ—А—В–Њ–≤ European Vasculitis Study Group, –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–Љ –≤—Л—Е–Њ–і–Њ–Љ –Є–Ј –і–∞–љ–љ–Њ–є —Б–Є—В—Г–∞—Ж–Є–Є —П–≤–ї—П–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ –і–Њ–Ј –¶–§ –≤ –њ–µ—А–Є–Њ–і –Є–љ–і—Г–Ї—Ж–Є–Є –Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Љ–µ–љ–µ–µ —В–Њ–Ї—Б–Є—З–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤ –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й—Г—О —Д–∞–Ј—Г, —В–∞–Ї –Ї–∞–Ї –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є—П –У–Ъ –њ–Њ—Б–ї–µ –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —А–µ–Љ–Є—Б—Б–Є–Є –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–∞ —Б–≤–Њ—О –љ–µ—Б–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ—Б—В—М –≤–≤–Є–і—Г –±–Њ–ї—М—И–Њ–є —З–∞—Б—В–Њ—В—Л —А–µ—Ж–Є–і–Є–≤–Њ–≤ [34].
–Ю–њ—Л—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Ь–Ь–§ —Г –±–Њ–ї—М–љ—Л—Е –°–Т –Ї –љ–∞—Б—В–Њ—П—Й–µ–Љ—Г –≤—А–µ–Љ–µ–љ–Є –Њ–≥—А–∞–љ–Є—З–µ–љ –ї–Є–±–Њ –љ–µ–±–Њ–ї—М—И–Є–Љ–Є –≥—А—Г–њ–њ–∞–Љ–Є –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –њ—А–µ–њ–∞—А–∞—В –≤ –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й—Г—О —Д–∞–Ј—Г –ї–µ—З–µ–љ–Є—П, –Є–ї–Є –µ–і–Є–љ–Є—З–љ—Л–Љ–Є —Б–Њ–Њ–±—Й–µ–љ–Є—П–Љ–Є –Њ –њ–Њ–њ—Л—В–Ї–∞—Е –≤–Ї–ї—О—З–µ–љ–Є—П –Ь–Ь–§ –≤ –Є–љ–і—Г–Ї—Ж–Є–Њ–љ–љ—Л–µ —Б—Е–µ–Љ—Л –њ—А–Є –љ–µ–њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є –¶–§. –Ф–∞–љ–љ–∞—П —Б–Є—В—Г–∞—Ж–Є—П –≤–њ–Њ–ї–љ–µ –Њ–±—К—П—Б–љ–Є–Љ–∞: –≤ –Њ—В—Б—Г—В—Б—В–≤–Є–µ –і–Њ—Б—В–Њ–≤–µ—А–љ—Л—Е –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–ґ–љ–Њ –њ–Њ–ї—Г—З–Є—В—М —В–Њ–ї—М–Ї–Њ –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –†–Ъ–Ш –Є –±–Њ–ї—М—И–Њ–Љ –Љ–∞—В–µ—А–Є–∞–ї–µ, –њ—А–∞–Ї—В–Є–Ї—Г—О—Й–Є–µ –≤—А–∞—З–Є –≤—Б–µ–≥–і–∞ —Б –Њ—Б—В–Њ—А–Њ–ґ–љ–Њ—Б—В—М—О –Њ—В–љ–Њ—Б—П—В—Б—П –Ї –љ–∞–Ј–љ–∞—З–µ–љ–Є—О –љ–Њ–≤—Л—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ—А–Є –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ —Б–Љ–µ—А—В–µ–ї—М–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е [35]. –Ю–і–љ–∞–Ї–Њ –Є–Љ–µ—О—Й–Є–µ—Б—П —Б–Њ–Њ–±—Й–µ–љ–Є—П –њ–Њ–Ј–≤–Њ–ї—П—О—В —Б–Њ –Ј–љ–∞–Ї–Њ–Љ «–њ–ї—О—Б» —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –≤–Ї–ї—О—З–µ–љ–Є—П –Ь–Ь–§ –≤ —Б—Е–µ–Љ—Л –ї–µ—З–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е –°–Т.
Nowack R. –Є —Б–Њ–≤—В. —Б–Њ–Њ–±—Й–∞–ї –Њ –і–ї–Є—В–µ–ї—М–љ–Њ–є –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–µ–є —В–µ—А–∞–њ–Є–Є –Ь–Ь–§ –≤ –і–Њ–Ј–µ 2 –≥/—Б—Г—В. —Г 9 –±–Њ–ї—М–љ—Л—Е —Б –У–Т –Є 2 –±–Њ–ї—М–љ—Л—Е —Б –Ь–Я–Р. –£ –≤—Б–µ—Е –±–Њ–ї—М–љ—Л—Е –Њ—В–Љ–µ—З–µ–љ–∞ –≤—Л—Б–Њ–Ї–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М –њ–∞—Г—Ж–Є–Є–Љ—Г–љ–љ—Л–є –љ–µ–Ї—А–Њ—В–Є–Ј–Є—А—Г—О—Й–Є–є –≤–∞—Б–Ї—Г–ї–Є—В. –Я–Њ—Б–ї–µ —Б—В–∞–љ–і–∞—А—В–љ–Њ–є –Є–љ–і—Г–Ї—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –¶–§ –Є –љ–Є–Ј–Ї–Є–Љ–Є –і–Њ–Ј–∞–Љ–Є –У–Ъ –≤–љ—Г—В—А—М –њ—А–Є–µ–Љ –Ь–Ь–§ –≤ —В–µ—З–µ–љ–Є–µ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–Є (–≤ —Б—А–µ–і–љ–µ–Љ 15 –Љ–µ—Б—П—Ж–µ–≤) –њ–Њ–Ј–≤–Њ–ї—П–ї –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—В—М —Б—В–∞–±–Є–ї—М–љ—Г—О —А–µ–Љ–Є—Б—Б–Є—О, –њ—А–Є —Е–Њ—А–Њ—И–µ–є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В–∞ [36].
Langford C.A. –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї –Ь–Ь–§ –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–µ–є —В–µ—А–∞–њ–Є–Є —Г 14 –±–Њ–ї—М–љ—Л—Е —Б –≥–µ–љ–µ—А–∞–ї–Є–Ј–Њ–≤–∞–љ–љ–Њ–є —Д–Њ—А–Љ–Њ–є –У–Т. –Я–Њ—В—А–µ–±–љ–Њ—Б—В—М –≤ –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –Ь–Ь–§ –±—Л–ї–∞ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–∞ —Б–Њ—Е—А–∞–љ–µ–љ–Є–µ–Љ –њ–Њ—Б–ї–µ –Є–љ–і—Г–Ї—Ж–Є–Є (–У–Ъ –Є –¶–§ –≤–љ—Г—В—А—М –њ–Њ —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л–Љ —Б—Е–µ–Љ–∞–Љ) –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ –Њ–і–љ–Њ–≥–Њ –Є –±–Њ–ї–µ–µ –ґ–Є–Ј–љ–µ–љ–љ–Њ –≤–∞–ґ–љ—Л—Е –Њ—А–≥–∞–љ–Њ–≤. –Т —Б—А–µ–і–љ–µ–Љ —З–µ—А–µ–Ј 8 –Љ–µ—Б—П—Ж–µ–≤ –Њ—В –љ–∞—З–∞–ї–∞ —В–µ—А–∞–њ–Є–Є –Ь–Ь–§ 12 –Є–Ј 14 –±–Њ–ї—М–љ—Л—Е –њ–Њ–ї–љ–Њ—Б—В—М—О –њ—А–µ–Ї—А–∞—В–Є–ї–Є –њ—А–Є–µ–Љ –њ—А–µ–і–љ–Є–Ј–Њ–ї–Њ–љ–∞ –Є –Њ—Б—В–∞–≤–∞–ї–Є—Б—М –љ–∞ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є –Ь–Ь–§. –†–µ—Ж–Є–і–Є–≤—Л –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–ї–Є—Б—М —Г 6 –±–Њ–ї—М–љ—Л—Е (–≤ —Б—А–µ–і–љ–µ–Љ —З–µ—А–µ–Ј 10 –Љ–µ—Б. –њ–Њ—Б–ї–µ –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —А–µ–Љ–Є—Б—Б–Є–Є) –Є –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –њ—А–Њ—П–≤–ї—П–ї–Є—Б—М —Б—Г—Б—В–∞–≤–љ—Л–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ, –ї–µ–≥–Њ—З–љ—Л–Љ–Є –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є –Є –ї–Є—Е–Њ—А–∞–і–Ї–Њ–є. –£ 8 –±–Њ–ї—М–љ—Л—Е –љ–∞ —Д–Њ–љ–µ –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–µ–≥–Њ –ї–µ—З–µ–љ–Є—П –Ь–Ь–§ –≤ –і–Њ–Ј–µ 1–2 –≥ –≤ —Б—Г—В–Ї–Є –Њ—В–Љ–µ—З–µ–љ–∞ –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є—П –њ–Њ—З–µ—З–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є. –Я—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М —А–µ–Љ–Є—Б—Б–Є–Є –≤ —Б—А–µ–і–љ–µ–Љ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 27 –Љ–µ—Б. (–Њ—В 6 –і–Њ 50 –Љ–µ—Б.) –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є —Б–µ—А—М–µ–Ј–љ—Л—Е –њ–Њ–±–Њ—З–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є [37].
Waiser J. –Є —Б–Њ–∞–≤—В. –њ—А–µ–і–њ—А–Є–љ—П–ї–Є –њ–Њ–њ—Л—В–Ї—Г –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Ь–Ь–§ –≤ –Ї–∞—З–µ—Б—В–≤–µ –Є–љ–і—Г–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П —В—П–ґ–µ–ї–Њ–≥–Њ –Р–Э–¶–Р––∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –≤–∞—Б–Ї—Г–ї–Є—В–∞ —Г –±–Њ–ї—М–љ–Њ–≥–Њ —Б –љ–µ–њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М—О –¶–§. –†–µ–Ј—Г–ї—М—В–∞—В–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ —П–≤–Є–ї–Є—Б—М –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є—П –њ–Њ—З–µ—З–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –Є —Б–љ–Є–ґ–µ–љ–Є–µ —В–Є—В—А–Њ–≤ –Р–Э–¶–Р [38].
–Т–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Ь–Ь–§ –≤ —Д–∞–Ј—Г –Є–љ–і—Г–Ї—Ж–Є–Є –Њ—Ж–µ–љ–Є–≤–∞–ї–∞—Б—М Joy M.S. –Є —Б–Њ–∞–≤—В. —Г 12 –±–Њ–ї—М–љ—Л—Е —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –љ–Њ–Ј–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є —Д–Њ—А–Љ–∞–Љ–Є —Б–Є—Б—В–µ–Љ–љ—Л—Е –≤–∞—Б–Ї—Г–ї–Є—В–Њ–≤. –Ъ—А–Є—В–µ—А–Є—П–Љ–Є –≤–Ї–ї—О—З–µ–љ–Є—П –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —П–≤–ї—П–ї–∞—Б—М —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М –Ї –¶–§ –Є–ї–Є —А–µ—Ж–Є–і–Є–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Ф–Њ—Б—В–Њ–≤–µ—А–љ–∞—П –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–∞—П –і–Є–љ–∞–Љ–Є–Ї–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —Г 10 –Є–Ј 12 –±–Њ–ї—М–љ—Л—Е —З–µ—А–µ–Ј 24 –љ–µ–і–µ–ї–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Ь–Ь–§ –њ–Њ–Ј–≤–Њ–ї–Є–ї–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—П–Љ –≤—Л—Б–Ї–∞–Ј–∞—В—М –њ—А–µ–і–њ–Њ–ї–Њ–ґ–µ–љ–Є–µ –Њ —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ—Б—В–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Ь–Ь–§ –≤ –Ї–∞—З–µ—Б—В–≤–µ –Є–љ–і—Г–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –њ—А–Є —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–µ–Љ –Є–ї–Є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–Є, –љ–µ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–µ–Љ—Б—П —Г–≥—А–Њ–ґ–∞—О—Й–Є–Љ–Є –і–ї—П –ґ–Є–Ј–љ–Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П–Љ–Є [39].
–Э–∞–Ј–љ–∞—З–µ–љ–Є–µ –Ь–Ь–§ –≤ –і–Њ–Ј–µ 2 –≥/—Б—Г—В. —Г 3 –±–Њ–ї—М–љ—Л—Е –∞—А—В–µ—А–Є–Є—В–Њ–Љ –Ґ–∞–Ї–∞—П—Б—Г –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ —Б–љ–Є–Ј–Є—В—М, –∞ –Ј–∞—В–µ–Љ –Є –њ–Њ–ї–љ–Њ—Б—В—М—О –њ—А–µ–Ї—А–∞—В–Є—В—М –њ—А–Є–µ–Љ –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–Њ–≤ [40]. –Х–і–Є–љ–Є—З–љ—Л–µ —Б–Њ–Њ–±—Й–µ–љ–Є—П —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ–± —Н—Д—Д–µ–Ї—В–µ –Ь–Ь–§ —Г –±–Њ–ї—М–љ—Л—Е —Б–Є–љ–і—А–Њ–Љ–Њ–Љ –І–∞—А–≥––°—В—А–Њ—Б—Б–∞ [41]. –Т –њ—А–Њ—В–Є–≤–Њ–њ–Њ–ї–Њ–ґ–љ–Њ—Б—В—М —Н—В–Њ–Љ—Г, –њ—А–Є –±–Њ–ї–µ–Ј–љ–Є –С–µ—Е—З–µ—В–∞ –љ–µ –Њ—В–Љ–µ—З–µ–љ–Њ –≤–ї–Є—П–љ–Є—П –Ь–Ь–§ –љ–∞ –Ї–Њ–ґ–љ–Њ–—Б–ї–Є–Ј–Є—Б—В—Л–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П [42].
–Э–µ—Б–Њ–Љ–љ–µ–љ–љ—Л–Љ–Є –і–Њ—Б—В–Њ–Є–љ—Б—В–≤–∞–Љ–Є –Ь–Ь–§ —П–≤–ї—П—О—В—Б—П —Б–µ–ї–µ–Ї—В–Є–≤–љ–∞—П –Є–Љ–Љ—Г–љ–Њ—Б—Г–њ—А–µ—Б—Б–Є—П —Б –Љ–µ–љ—М—И–Є–Љ —З–Є—Б–ї–Њ–Љ –њ–Њ–±–Њ—З–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є (–≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –Є –≥–µ–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є), —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –њ—А–µ–њ–∞—А–∞—В –≤ —В–µ—З–µ–љ–Є–µ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–Є; –Њ—В—Б—Г—В—Б—В–≤–Є–µ –Љ—Г—В–∞–≥–µ–љ–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П, –≥–Њ–љ–∞–і–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В–Є –Є –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ –Љ–Є–љ–µ—А–∞–ї—М–љ—Г—О –њ–ї–Њ—В–љ–Њ—Б—В—М –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є; –∞–љ—В–Є–∞—В–µ—А–Њ–≥–µ–љ–љ—Л–µ —Б–≤–Њ–є—Б—В–≤–∞.
–Ч–∞ –і–µ—Б—П—В–Є–ї–µ—В–љ–Є–є –њ–µ—А–Є–Њ–і –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Ь–Ь–§ –≤ —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є–Є –љ–∞–Є–±–Њ–ї—М—И–Є–є –Њ–њ—Л—В –љ–∞–Ї–Њ–њ–ї–µ–љ —Г –±–Њ–ї—М–љ—Л—Е –°–Ъ–Т. –Т–µ—Б–Њ–Љ–Њ—Б—В—М –њ–Њ–ї—Г—З–µ–љ–љ—Л–Љ –≤—Л–≤–Њ–і–∞–Љ –њ—А–Є–і–∞—О—В —А–µ–Ј—Г–ї—М—В–∞—В—Л –†–Ъ–Ш. –Я–Њ –Љ–љ–µ–љ–Є—О —Н–Ї—Б–њ–µ—А—В–Њ–≤ EULAR, –Њ–і–Є–љ–∞–Ї–Њ–≤–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Ь–Ь–§ –Є –¶–§ —Г –±–Њ–ї—М–љ—Л—Е —Б –∞–Ї—В–Є–≤–љ—Л–Љ –њ–Њ—З–µ—З–љ—Л–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ (–Ї–∞—В–µ–≥–Њ—А–Є—П –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ—Б—В–Є –Р) –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Б–і–µ–ї–∞—В—М –Њ–±–љ–∞–і–µ–ґ–Є–≤–∞—О—Й–Є–µ –≤—Л–≤–Њ–і—Л –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–µ–є –Љ–Њ–і–µ—А–љ–Є–Ј–∞—Ж–Є–Є –Є–Љ–Љ—Г–љ–Њ—Б—Г–њ—А–µ—Б—Б–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є [43]. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Ь–Ь–§ –≤–Ї–ї—О—З–µ–љ –≤ —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ–Љ—Л–µ —Б—Е–µ–Љ—Л –ї–µ—З–µ–љ–Є—П –љ–µ–Ї–Њ—В–Њ—А—Л—Е —Д–Њ—А–Љ –≤–Њ–ї—З–∞–љ–Њ—З–љ–Њ–≥–Њ –љ–µ—Д—А–Є—В–∞: –≤ –Ї–∞—З–µ—Б—В–≤–µ –Є–љ–і—Г–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –њ—А–Є –њ—А–Њ–ї–Є—Д–µ—А–∞—В–Є–≤–љ–Њ–Љ –Є –Љ–µ–Љ–±—А–∞–љ–Њ–Ј–љ–Њ–Љ –љ–µ—Д—А–Є—В–µ —Б —Г–Љ–µ—А–µ–љ–љ–Њ–є –Є –≤—Л—Б–Њ–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О –Є –і–ї—П –њ–Њ–і–і–µ—А–ґ–∞–љ–Є—П —А–µ–Љ–Є—Б—Б–Є–Є —Г –±–Њ–ї—М–љ—Л—Е –њ—А–Њ–ї–Є—Д–µ—А–∞—В–Є–≤–љ—Л–Љ –≤–Њ–ї—З–∞–љ–Њ—З–љ—Л–Љ –љ–µ—Д—А–Є—В–Њ–Љ [44].
–Я–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–∞—П –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ–Њ—Б—В—М –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Ь–Ь–§, –і–Њ–Ї–∞–Ј–∞–љ–љ–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є —Е–Њ—А–Њ—И–Є–є –њ—А–Њ—Д–Є–ї—М –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є –і–Є–Ї—В—Г—О—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –њ—А–Њ–≤–µ–і–µ–љ–Є—П —В—Й–∞—В–µ–ї—М–љ–Њ —Б–њ–ї–∞–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е, –Ј–љ–∞—З–Є–Љ—Л—Е –њ–Њ –Њ–±—К–µ–Љ—Г –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –і–ї—П —Г—В–Њ—З–љ–µ–љ–Є—П –±–Њ–ї–µ–µ –Ї–Њ–љ–Ї—А–µ—В–љ–Њ–≥–Њ –Љ–µ—Б—В–∞ –њ—А–µ–њ–∞—А–∞—В–∞ –≤ —В–µ—А–∞–њ–Є–Є –≤—Б–µ—Е —Б–Є—Б—В–µ–Љ–љ—Л—Е —А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є.

–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. Clements P.J., Davis J./ Cytotoxic drugs: their clinical application tj the rheumatic diseases// Sem. Arthr. Rheum., 1986, 15 (4), 231–254.
2. Mok C.C., Mak A., Chu W.P. et al./ Long–term survival of southern Chinese patients with systemic lupus erythematosus: a prospective study of all–age group// Medicine (Baltimore), 2005, 84 (4), 218–224.
3. Gescuk B.D., Davis J.C./Novel therapeutic agents for systemic lupus erythematosus//Curr.Opin. Rheum., 2002, 14 (5), 515–521.
4. Dooley M.A./ Meeting the challenges of drug development in SLE. Program and abstracts of the American College of Rheumatology 2005 Annual Scientific Meeting; November 13–17, 2005; San Diego, California.
5. Allison A.C./ Mechanisms of action of mycophenolate mofetil// Lupus, 2005, 14, 2–8.
6. Sollinger H.W./ Mycophenolate in transplantation// Clin. Transpl., 2004, 18, 485–492.
7. Zandman–Goddard G., Shoenfeld Y./ Mycophenolate mofetil in animal models of autoimmune disease// Lupus, 2005, 14, 12–16.
8. Lewis M.J., D’Cruz D./ Adhesion molecules, mycophenolate mofetil and systemic lupus erythematosus// Lupus, 2005, 14, 17–26.
9. Sinclair A., Baildon R./ Mycophenolate mofetil: an overview//Lupus, 2006, 15, 70–78.
10. McMurray R.W., Elbourne K.B., Lagoo A., Lai S./ Mycophenolate mofetil suppresses autoimmunity and mortality in the female NZB x NZW F1 mouse model of systemic lupus erythematosus// J.Rheum., 1998, 25, 2364–2370.
11. Glicklich D., Acharya A./ Mycophenolate mofetil therapy for lupus nephritis refractory to intravenous cyclophosphamide// Am. J.Kidney, 1998, 32, 318–322.
12. Doria A., Laccarino L., Arienti S. et al./ Mycophenolate mofetil and systemic lupus erythematosus// Lupus, 2006, 15, 44–54.
13. Chan T.M., Li F.K., Tang C.S. et al/ Efficacy of mycophenolate mofetil in patients with diffuse proliferative lupus nephritis/ N.Engl. J. Med., 2000, 343, 1156–1162.
14. Hu W., Liu Z., Chen H. et al./ Mycophenolate mofetil versus cyclophosphamide therapy for patients with diffuse proliferative lupus nephritis// Clin. Med. J., 2002, 115, 705–709.
15. Ginsler E.M., Aranow C., Merrill I.T. et al./ Toxicity and tolerability of mycophenolate mofetil versus intravenous cyclophosphamide in a multicenter trial as induction therapy for lupus nephritis// Arthr. Rheum., 2003, 48, 586.
16. Contreras G., Tozman E., Nahar N., Metz D./ Maintenance therapies for proliferative lupus nephritis: mycophenolate mofetil, azathioprine and intravenous cyclophosphamide// Lupus, 2005, 14, 33–38.
17. Karim M.Y., Alba P., Cuadrado M.J. et al./ Mycophenolate mofetil for systemic lupus erythematosus refractory to other immunosuppressive agents// Rheum. (Oxford), 2002, 41, 876–882.
18. Duncan N., Cairns T., Griffith M. et al./ Mycophenolate mofetil as treatment for the nephritic syndrome caused by lupus nephritis// J. Am. Soc. Nephrol., 2003, 14, 379.
19. Karim M.Y., Pisoni C.N., Ferro L. et al./ Reduction of proteinuria with mycophenolate mofetil in predominantly membranous lupus nephropathy// Rheum., 2005, 44, 1317–1321.
20. Moore R.A./Systematic review and meta–analysis of randomized trials and cohort studies of mycophenolate mofetil in lupus nephrithis//Arthr.Research&Therapy, 2006, 8, R182.
21. Bijl M., Horst G., Bootsma H. et al./ Mycophenolate mofetil prevents a clinical relapse in patients with systemic lupus erythematosus at risk//Ann.Rheum Dis., 2003, 62, 534–539.
22. Vermersch P., Stojkovic T., de Seze J./ Mycophenolate mofetil and neurological diseases//Lupus, 2005, 14, s42–s45.
23. –Р–љ—В–µ–ї–∞–≤–∞ –Ю.–Р., –•–Є—В—А–Њ–≤ –Р.–Э., –Э–∞—Б–Њ–љ–Њ–≤ –Х.–Ы./ –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –Љ–Є–Ї–Њ—Д–µ–љ–Њ–ї–∞—В–∞ –Љ–Њ—Д–µ—В–Є–ї–∞ –њ—А–Є –Є–і–Є–Њ–њ–∞—В–Є—З–µ—Б–Ї–Є—Е –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Љ–Є–Њ–њ–∞—В–Є—П—Е// –Э–∞—Г—З–љ–Њ––њ—А–∞–Ї. –†–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є—П, 2006, 3, 38–41.
24. Majithia V., Harisdangkul V./ Mycophenolate mofetil (CellCept): an alternative therapy for autoimmune inflammatory myopathy//Rheum., 2005, 44, 386–389.
25. Gelber A.C., Nousari H.C., Wigley F.M./ Mycophenolate mofetil in the treatment of severe skin manifestations of dermatomyositis: a series of 4 cases//J. Rheum., 2000,27, 1542–1545.
26. Edge C.J., Outland J.D., Dempsey J.R., Callen J.P./Mycophenolate mofetil as an effective corticosteroid–sparing therapy for recalcitrant dermatomyositis//Arch. Derm., 2006, 142, 65069.
27. Blank N., Max R., Lorenz H.–M./ The role of DMARDs in systemic sclerosis therapy// Rheum., 2006, 45, iii42–44.
28. Stratton R.J., Wilson H., Black C.M./ Pilot study of anti–thymocyte globulin plus mycophenolate mofetil in recent–ons Wegener’s granulomatosis or microscopic polyangiits Wegener’s granulomatosis or microscopic poly et diffuse scleroderma//Rheum., 2001, 40, 84–88.
29. Liossis S.N.C., Bounas A., Andonopoulos A.P./ Mycophenolate mofetil as first–line treatment improves clinically evident early scleroderma lung disease//Rheum., 2006, 45, 1005–1008.
30. Nihtyanova S.I., Brough G.M., Black C.M., Denton C.P./ Mycophenolate mofetil in diffuse cutaneous systemic sclerosis – a retrospective analysis// Rheum., 2007, 46, 442–445.
31. Swigris J.J., Olson A.L., Fisher A. et al./ Mycophenolate mofetil is safe, well tolerated, and preserves lung function in patients with connective tissue disease–related interstitial lung disease// Chest, 2006, 130, 30–36.
32. Guo H., Leung JCK, Chan LYY et al./ Modulation of intra–pulmonary TGF–b expression by mycophenolate mofetil in lupus prone MRL/lpr mice// Lupus, 2005, 14, 583–592.
33. Westman KWA, Bygren PG, Olsson H. et al./ Relapse rate, renal survival, and cancer morbidity in patients with Wegener’s granulomatosis or microscopic polyangiits with renal involvement//J.Am.Soc.Nephrol., 1998, 9, 842–852.
34. Little M.A., Pusey C.D./ Glomerulonephritis due to antineutrofil cytoplasm antibody–associated vasculitis: a update on approaches to management//Nephrol., 2005, 10, 368–376.
35. D’Cruz D.P./ Mycophenolate mofetil in systemic vasculitis// Lupus, 2005, 14, s55–s57.
36. Nowack R., Gobel U., Klooker P. et al./ Mycophenolate mofetil for maintenance therapy of Wegener’s granulomatosis or microscopic polyangiits: a pilot study in 11 patients with renal involvement//J.Am.Soc. Nephrol., 1999, 10, 1965–1971.
37. Langford C.A., Talar–Williams C., Sneller M.C./ Mycophenolate mofetil for remission maintenance in the treatment of Wegener’s granulomatosis// Arthr. Rheum., 2004, 51, 278–283.
38. Waiser J., Budde K., Braasch E., Neumayer H.H./ Treatment of acute c–ANCA–positive vasculitis with mycophenolate mofetil//Am.J.Kidney Dis., 1999, 34, e9.
39. Joy M.S., Hogan S.L., Jennette J.C. et al./ A pilot study using mycophenolate mofetil in relapsing or resistant ANCA small vessel vasculitis//Nephr. Dial. Transpl., 2005, 20 (12), 2725–2732.
40. Daina E., Schieppati A., Remuzzi G./ Mycophenolate mofetil for the treatment of Takayasu arteriits: report of three cases//Ann. Intern. Med., 1999, 130, 422–426.
41. Assaf C., Mewis G., Orfanos C.E., Geilen C.C./ Churg–Strauss syndrome: successful treatment with mycophenolate mofetil//Br.J.Dermatol., 2004, 150, 598–600.
42. Adler C., Mansmann U., Zouboulis C.C./ Mycophenolate mofetil is ineffective in the treatment of mucocutaneous Adamantiades–Behcet’s disease//Dermatology, 2001, 203, 322–324.
43. Bertsias G.K., Ioannidis J.P.A., Boletis J. et al./ EULAR recommendations for the management of Systemic Lupus Erythematosus (SLE) Report of a Task Force of the European Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT)//Ann.Rheum. Dis., 2007.
44. Boumpas D.T., Sidiropoulos P., Bertsias G./ Optimum therapeutic approaches for lupus nephritis: what therapy and for whom?//Nat. Clin. Pract.Rheum., 2005, 1(1), 22–30.












