Однако, несмотря на развитие новых фармакологических направлений в лечении воспалительных заболеваний суставов, необходимость в быстрой и доступной помощи по снятию боли и воспаления остается актуальной. НПВП не утратили своего значения как средства симптоматической терапии, влияющие на основные проявления воспаления: боль, припухлость, повышение температуры, нарушение функции суставов.
Адекватное применение этих препаратов способно эффективно уменьшать выраженность патологических симптомов, улучшать самочувствие больных, повышать их качество жизни, как в дебюте болезни, так и в процессе проведения и коррекции терапии.
Нельзя переоценить значение этого класса лекарственных средств в лечении ювенильных артритов (ЮА). Подбор препаратов для купирования активности заболеваний ревматологического круга в детском возрасте чрезвычайно сложен. По мнению ведущих фармакологов России, аутоиммунные заболевания относятся к разряду болезней с высоким риском лекарственных взаимодействий, ряд используемых при их лечении препаратов имеют достаточно узкий терапевтический коридор, а фармакокинетика в детском организме связана с существенными вариациями в развитии систем метаболизма и экскреции лекарственных веществ [4].
Таким образом, риск развития возможных побочных эффектов противоревматической терапии у детей остается достаточно высоким.
Серьезные нежелательные побочные явления (ПЯ) при использовании НПВП заключаются в отрицательном влиянии на слизистую желудочно–кишечного тракта, проявлении гепато– и нефротоксичности, возможных сердечно–сосудистых нарушениях. Известно, что частота их развития напрямую зависит от уровня концентрации препарата в плазме, но от этого также зависит и эффект от лечения, который обусловлен, в частности, уровнем накопления препарата в «органах-мишенях» [5].
Таким образом, основной задачей адекватной терапии ЮА является уменьшение выраженности неблагоприятных системных реакций при достижении оптимального терапевтического воздействия на очаг воспаления в синовиальной среде сустава.
Одним из путей решения этих задач служит введение лекарственного вещества непосредственно в очаг воспаления. Реализация этих намерений осуществляется с помощью применения методов локальной терапии противовоспалительными препаратами.
В ряде работ изучалась фармакокинетика вводимых чрескожно препаратов [6,7]. Исследование Reiss W. с соавт. в 1986 г. показало, что при локальном применении в системный кровоток поступало не более 6% лекарственного препарата [6].
В ходе сравнительного изучения концентрации диклофенака натрия в подкожной клетчатке и в плазме при использовании его локальных и пероральных форм, Brunner M. с соавт. обнаружили, что содержание диклофенака натрия в подкожной клетчатке и мышечной ткани было более чем в 1,5 раза выше после его местного использования, чем при применении пероральных форм, а концентрация в плазме в 50 раз ниже [8]. В результате исследований, проведенных на больших клинических группах, выявлена сравнимая эффективность пероральной терапии НПВП и локального лечения дегенеративных заболеваний суставов у взрослых [9,10].
В целом проблема выбора НПВП–терапии в детской практике сопряжена с определенными сложностями, так как достаточно большой арсенал лекарственных средств, применяемых у взрослых, в значительной степени сужается в отношении их использования у детей. Так, согласно Регистру лекарственных средств для пациентов раннего возраста к применению допущены только 2 препарата индольной и пропионовой групп: индометацин с раннего и ибупрофен с 3–месячного возраста. Только с 2005 года разрешена к применению суспензия нимесулида с 2 лет, таблетки диклофенака натрия можно использовать с 6 лет, а инъекционные формы препарата с 12 лет и т.д. [15].
Все это послужило поводом обращения к ибупрофену – препарату, синтезированному 50 лет назад группой ученых под руководством С. Адамса. Это был результат упорного поиска лекарственного средства, которое, помимо высокой терапевтической эффективности при лечении воспалительных заболеваний, имело бы низкий риск желудочно–кишечной токсичности.
Таким образом, среди большого числа НПВП ибупрофен обладает рядом преимуществ, позволяющих использовать его в детском возрасте:
• препарат имеет разрешение Фармакологического комитета РФ на применение в младших возрастных группах;
• обладает широким диапазоном терапевтического воздействия;
• не имеет серьезных ПЯ, что подтверждено крупномасштабными клиническими исследованиями [11–13].
Проведенное ранее в детской клинике ИР РАМН изучение препарата Нурофен показало его хорошую эффективность и переносимость при длительном (6 недель) применении у детей [14]. Однако, как и у любого НПВП, у Нурофена были отмечены побочные явления, частота которых увеличивалась в зависимости от длительности терапии.
Наличие двух лекарственных форм Нурофена (таблеток и суспензии для перорального и Нурофен геля для локального применения) послужило причиной их сочетанного использования в терапии ЮА для выявления особенностей терапевтического эффекта и переносимости.
Целью исследования явилась сравнительная оценка терапевтической эффективности сочетанного применения пероральной формы (таблетки или суспензия) препарата Нурофен с локальным использованием Нурофен геля и монотерапией пероральными препаратами Нурофена при лечении пациентов с ювенильными артритами (ЮА).
В ходе исследования решались задачи по выявлению возможных различий в динамике основных параметров воспаления в результате усиления фоновой терапии локальными методами лечения, а также оценивалась переносимость терапии.
Материалы и методы исследования
В работу включены 48 пациентов с ЮА в возрасте от 2 до 17 лет, находившихся на лечении в стационаре и поликлиническом отделении детской клиники ИР РАМН. В группу вошли 20 мальчиков и 28 девочек, более половины составили дети дошкольного возраста – 27 (56,2%).
Диагноз ЮРА ставился на основании критериев АСР (1986 г.), ЮХА соответствовал критериям EULAR (1994 г.), в группу с ЮА вошли пациенты, давность заболевания у которых не превышала 3 месяцев.
Критерии отбора:
• возраст от 2 до 17 лет,
• наличие ЮА с активным суставным синдромом,
• отсутствие эффекта от проводимой ранее терапии.
Критерии исключения:
• повышенная чувствительность к ибупрофену и ацетилсалициловой кислоте, а также патология печени и заболевания крови.
Проанализированы 2 группы пациентов по 24 человека в каждой. В соответствии с задачами исследования пациенты 1–й группы получали монотерапию Нурофеном (МТ) в дозе 35–40 мг/кг в сутки в виде суспензии (ибупрофен 100 мг/5 мл во флаконе с мерным шприцом) или таблеток (200 мг и 400 мг). Детям 2–й группы, помимо этого, была добавлена терапия Нурофеном гелем локально в дозе от 1 до 3 см препарата 3 раза в сутки (СТ). Нурофен гель назначался пациентам 2 группы через неделю после начала лечения пероральными формами препарата при их удовлетворительной переносимости. Продолжительность локального лечения составила две, а общая длительность терапии три недели. Оценка эффективности осуществлялась каждую неделю (7, 14 и 21–й день).
В исходном статусе отражались выраженность лихорадки, лимфоаденопатии, утренней скованности, клинические, биохимические и иммунологические параметры (АСТ, АЛТ, ГТП, уровень билирубина, холестерина, креатинина, РФ, АНФ, ЦИК), анализы крови и мочи.
Степень локальных нарушений оценивалась путем регистрации числа болезненных и припухших суставов; боли в покое, при движении, при пальпации с использованием визуальной аналоговой 100–миллиметровой шкалы (ВАШ); припухлости суставов в баллах. С целью объективизации выраженности локальных нарушений и их динамики в процессе лечения 18 пациентам первой группы (МТ) и 19 второй (СТ) проведено УЗ сканирование пораженных суставов.
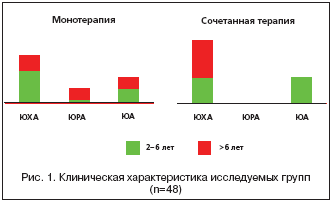
Группы были сопоставимы по возрасту (14 и 13 пациентов дошкольного возраста соответственно), однако среди детей, получавших дополнительно локальную терапию, было несколько больше больных ЮХА (10 и 17 соответственно) (рис. 1).
В 1 группу (МТ) вошли 4 пациента с ЮРА, у 2 был олиго– и у 2 полиартикулярный вариант с симметричным вовлечением в процесс мелких суставов кистей, локтевых, коленных и голеностопных сочленений; 13 с ЮХА который был представлен у 4 моноартикулярным поражением тазобедренного (1), коленного (2) и голеностопного (1) суставов; 9 детей имели олигоартикулярную форму заболевания с вовлечением преимущественно суставов нижних конечностей, и 7 пациентов с ЮА – 4 с моноартикулярным и 3 с олигоартикулярным поражением коленных и голеностопных суставов.
Во 2 группе (СТ) из 17 больных ЮХА у 5 был моноартрит коленного (4) и голеностопного (1) суставов, у 12 – олигоартикулярное поражение суставов нижних конечностей (9) и локтевых и лучезапястных суставов (3); из 7 детей с ЮА в этой группе у 5 отмечалось моноартикулярное вовлечение коленного (4) и голеностопного (1) суставов, двое детей в возрасте до 2 лет имели асимметричный олигоартикулярный синдром с поражением коленных, голеностопных и мелких суставов кисти. Пациентов с ЮРА во 2 группе не было.
Лабораторная активность заболевания в обеих группах не различалась (р>0,05) и характеризовалась умеренными отклонениями от нормальных показателей, имея средние значения Нв=128±5,75; Л=8,89±1,6; СОЭ от 26 до 50 мм/ч (14,46±5,04); СРБ менее 0,2.
РФ отрицателен у всех пациентов, у 4 детей 2 группы, отмечался АНФ от 1/40 до 1/160 сферического свечения, ЦИК составили 205±41,9, биохимические параметры и анализы мочи – в норме.
Из 48 пациентов, включенных в исследование, ранее не получали НПВП 7 детей первой и 8 второй группы, отсутствовал эффект от терапии НПВП у 17 больных первой и 15 – второй группы. Лечение базисными противовоспалительными препаратами (БПВП) осуществлялось 4 пациентам (3 в первой и 1 во второй группе соответственно). Никто из пациентов не получал терапию глюкокортикоидами.
Таким образом, исследуемые группы были представлены пациентами дошкольного и младшего школьного возраста с преимущественно хроническим течением ЮА, которые имели моно– и олигоартикулярные поражения, протекавшие с умеренной лабораторной активностью. Большинство детей к моменту включения в исследование не получали адекватной противоревматической терапии.
Оценка эффективности и переносимости препарата осуществлялась в течение 3 последующих визитов: на 7, 14 и 21–й день.
Эффективность лечения оценивалась по градациям: «значительное улучшение», «улучшение», «отсутствие эффекта», «ухудшение».
Под «значительным улучшением» подразумевалась положительная динамика всех показателей; под «улучшением» – превышение числа показателей с положительной динамикой над числом показателей с отрицательной динамикой на один и более или положительную динамику хотя бы одного показателя при отсутствии отрицательной динамики по другим показателям; «ухудшение» – отрицательная динамика хотя бы одного показателя при отсутствии положительной динамики других показателей или превышение числа показателей с отрицательной динамикой над числом показателей с положительной динамикой. При этом учитывалось мнение врача, пациента и его родителей.
Переносимость оценивалась по трем градациям: «хорошая», «удовлетворительная» и «плохая», учитывалось мнение врача и пациента.
Оценка нежелательных реакций терапии осуществлялась согласно классификации ВОЗ.
Статистическая обработка проведена с помощью критерия Вилкоксона и методов описательной статистики.
Результаты исследования
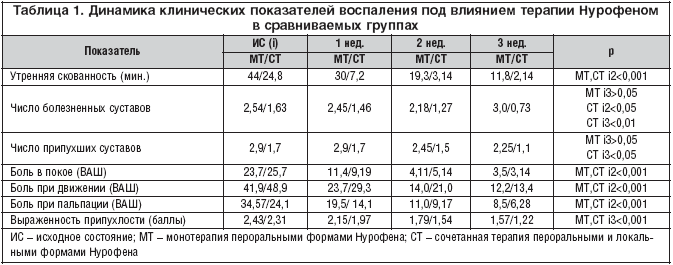
Анализ выраженности клинических проявлений воспаления перед началом исследования свидетельствовал о более значимом характере его исходных признаков у пациентов 1 группы (МТ) в сравнении со 2 (СТ), что нашло отражение в продолжительности утренней скованности (медиана 44 и 24,85), боли при пальпации (медиана 34,57 и 24,17), числе болезненных (медиана 2,54 и 1,53) и припухших суставов (медиана 2,9 и 1,7) (табл. 1).
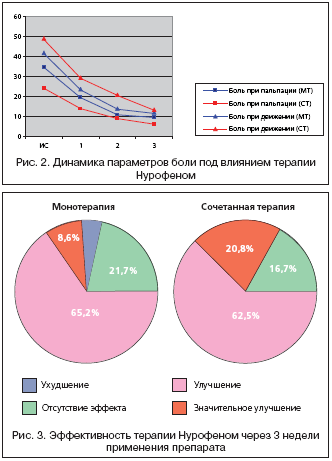
Под влиянием проводимой терапии к концу 3–й недели лечения достигнуты статистически достоверные результаты практически по всем оцениваемым параметрам боли в обеих группах, однако наиболее значимые изменения произошли в отношении боли при движении, в покое и при пальпации пораженных суставов. Достоверная регрессия выраженности боли наблюдалась уже в течение 1 недели (р<0,001), достигнув минимальных значений ко 2–й неделе лечения (табл. 1), однако в дальнейшем в группе пациентов, получавших МТ, эти показатели сохранялись на достигнутом уровне («плато»), в то время как у пациентов с СТ продолжали медленно снижаться.
Несмотря на отсутствие достоверности различий между группами, эта тенденция видна на рисунке 2.
Достаточно отчетливый терапевтический эффект сочетанной терапии получен в отношении припухлости суставов (медиана 3 МТ 1,57, 3 СТ 1,22).
В результате достижения более быстрой регрессии параметров боли и припухлости, отмечено статистически значимое снижение к концу 2–й недели числа болезненных (р<0,05) и 3–й недели припухших суставов (р<0,05) во 2 группе (СТ), в отличие от 1–й (МТ), в которой статистически значимые различия наблюдались только к 6–й неделе лечения [14].
УЗ исследование суставов перед началом и в конце лечения проведено 18 пациентам первой и 19 – второй группы. Результаты УЗ сканирования показали наличие в вовлеченных в патологический процесс суставах избыточного количества жидкости, отека синовиальной оболочки и периартикулярных тканей. Повторное исследование (согласно протоколу) проведено пациентам первой группы на 6–й неделе, а второй группы – в конце 3–й недели лечения [14].
Эффективность лечения препаратами Нурофена оценивалась врачом и пациентом. Необходимо отметить, что в целом мнение врача и пациента совпадало, однако имелась тенденция к более высокой оценке результатов лечения пациентом и его родителями.
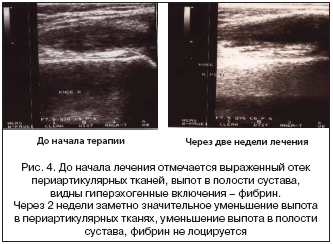
На рисунке 3 представлена эффективность терапии в 1 и 2 группах по мнению врача. Через 3 недели отмечались определенные различия в эффективности лечения в группе с МТ и СТ.
Улучшение отмечено у 73,8% пациентов, получавших монотерапию препаратами Нурофена, и у 83,3% детей, находившихся на сочетанной терапии. Кроме того, имелось достоверное увеличение числа пациентов с отличными результатами лечения во второй группе (8,6% при МТ и 20,8% при СТ соответственно) (р<0,05).
К концу 3–й недели отсутствовал эффект у 21,7% детей первой группы (МТ), во второй группе (СТ) этот процент был несколько меньше – 16,7%.
Несмотря на проводимое лечение, у пациентки 15 лет (МТ) с полиартикулярным поражением суставов, протекавшим с высокой лабораторной активностью, отмечено прогрессирование симптомов болезни, что потребовало усиления методов лечения и расценено как «ухудшение» (4,5%).
Несмотря на различную длительность терапии, положительные сдвиги в динамике УЗ показателей воспаления оказались несколько более выраженными в группе СТ. Так, полная регрессия симптомов воспаления произошла у 22,2% из числа обследованных пациентов первой группы (МТ) и 26,3% из числа второй (СТ); положительная симптоматика в виде снижения количества жидкости в полости суставов, уменьшения выраженности отека синовиальной оболочки и периартикулярных тканей отмечена у 55,5% больных, получавших МТ и 57,8% СТ (рис. 4). Эффект отсутствовал у 6 пациентов (по 3 в каждой группе).
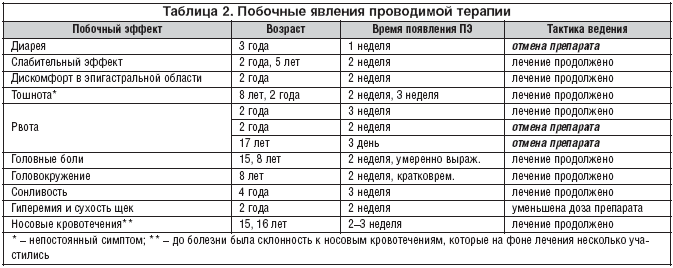
Большое внимание уделялось проблеме переносимости терапии. Переносимость проводимой терапии и регистрация побочных явлений выявлялись активно при каждом визите к врачу, согласно опроснику, включенному в тематическую карту, Нежелательные побочные явления (ПЯ) представлены в таблице 2.
Как видно из представленных данных, ПЯ отмечались у 1/3 пациентов и только у 3 (6,2%) потребовали отмены.
Причинами отмены лечения Нурофеном явились рвота (2) и диарея (1). Так рвота, развившаяся у девочки–подростка 17 лет в первые дни лечения, более вероятно была связана с индивидуальной непереносимостью препарата. У ребенка 2 лет рвота возникла через 2 недели лечения, расценена как вероятный ПЯ, что потребовало прекращения приема препарата раньше срока. У девочки 3 лет симптомы диареи развились в конце 1–й недели лечения, что также потребовало прекращения лечения.
Из прочих гастроэнтерологических жалоб следует отметить непостоянное поташнивание (2), дискомфорт в эпигастральной области (1), слабительный эффект (2). Эти ПЯ были слабо выражены и терапия продолжена.
ПЯ неврологического характера заключались в умеренно выраженных головных болях (2) и сонливости (1), которые имели непостоянный характер и выявлялись только при дополнительном опросе. У 2 подростков отмечено некоторое учащение носовых кровотечений, склонность к которым наблюдалась и раньше. В обоих случаях степень связи побочной реакции с приемом ЛС сомнительна. Необходимо подчеркнуть, что ни у одного ребенка через 3 недели терапии не было отмечено отклонений в лабораторных показателях, которые могли бы свидетельствовать о развитии нарушений со стороны функции почек и печени, что согласуется с рядом клинических исследований [11–13].
В целом, несмотря на довольно большой перечень побочных явлений, переносимость препарата оценивалась врачом и пациентом как хорошая в 50% и удовлетворительная – в 43,8%. У 6,2% детей она признана неудовлетворительной.
Таким образом, проведенное исследование показало, что терапия Нурофеном в дозе 35–40 мг/кг в сутки оказывала достаточно отчетливый противовоспалительный эффект при использовании у пациентов с моно– и олигоартикулярными формами ЮА, протекающими с умеренной степенью активности патологического процесса, при этом наиболее динамичными являлись показатели боли.
Реализация анальгетического действия препарата происходила уже в течение первых двух недель лечения, позволяя добиться быстрого облегчения состояния больных.
Подключение к пероральной терапии Нурофеном его локальных форм пролонгировало противоболевой эффект, ускоряло динамику нивелирования припухлости, что приводило к более быстрому развитию терапевтического эффекта в виде уменьшения числа припухших и болезненных суставов уже на 2 и 3–й неделе лечения.
Переносимость Нурофена расценена как удовлетворительная. Значимые ПЯ в виде рвоты и диареи, потребовавшие отмены препарата, отмечались у 6,5% больных в течение первых дней его использования, что позволяло быстро изменить терапевтическую тактику.
За период наблюдения за больными не зарегистрировано ПЯ, связанных с поражением таких жизненно важных органов, как печень и почки.
Эффект сочетанной терапии препаратами Нурофена в виде ускорения обратного развития симптомов воспаления служит обоснованием для применения тактики «титрования» дозы препарата в сторону ее снижения, что может привести к его лучшей переносимости.
Совокупность терапевтических свойств различных лекарственных форм препарата Нурофен позволяет рекомендовать его, как стартовый препарат в комплексной терапии ЮА, а наличие регламентированного допуска к применению в младших возрастных группах – считать его препаратом выбора в этой возрастной группе.
Литература
1. Насонов Е.Л., Каратеев Д.Е., Применение нестероидных протвовоспалительных препаратов. Клинические рекомендации. РМЖ. Т.14, №25,1769–1777, 2006.
2. Сигидин Я.А., Лукина Г.В. Биологическая терапия в ревматологии. Москва, 2007.
3. Насонов Е.Л., Каратеев Д.Е., Чичасова Н.А., Чемерис Н.А., Современные стандарты фармакотерапии ревматоидного артрита. Клиническая фармакология и терапия, №1, 2005.
4. Белоусов Ю.Б.,.Гуревич К.Г., Клиническая фармакокинетика. Практика дозирования лекарств. М., 2005.
5. Grahame R. Transdermal non–steroidal antiinflamatory agents. BJCP, 1995,49,33–35.
6. Riess W., Schmid K., Botta L. et al. Die percutane Resorption von Diklofenac. Arsneim. Forsch.Drug.Res., 1986, 36, 1092–1096.
7. Brunner M., Dehghanyar P., Seigfried B., et al. Favourabl dermalpenetraition of diclofenacafter administration to the skin using a novel sprey gel formulaition. British Journal of Clinical Pharmacology 60,573.
8. Д.В.Горячев Эффективность и безопасность нестероидных противовоспалительных препаратов в лекарственных формах для наружного применения. //РМЖ, том 14, №25, с.1837–1841. 2006.
9. Zacher J., Burger K.J., Farber L. et al. Сравнение местного применения диклофенка–эмульгеля с принимаемым внутрь ибупрофеном в лечении активного остеоартроза межфаланговых сутавов кистей (узлов Гебердена и Бушара). Двойное слепое, контролируемое, рандомиозированное исследование. Научно–практическая ревматология, №2,36–43, 2007.
10. Tugwell Р.S. et al. Eqvivalence stady of a topical diclofenac solution (PENNSAID) compared with oral diclofenac in the simptomatic treatment of osteoartritis of knee: a randomized controlled study. J. of Rheumatology 2004 31: 2002–2012.
11. Lesko S.M., Mitchell A.B. An assesment of the safety of pediatric ibuprofen // JAMA, 1995. – 273: 929–933.
12. Lesko S.M. The safety of ibuprofen suspension in children // Int.J.Child.Pract. Suppl. 2003. – Apr. – 135 – 50:3.
13. Nicolas Moore et all, Исследование PAIN, Cl. Drug Investigation,1999,08,18(2):89–98.
14. Медынцева Л.Г. Опыт применения препарата нурофен при длительной терапии ювенильных артритов.Cons.Medicum, 2007г, №2, приложение Педиатрия, с. 111–116.
15. Регистр лекарственных средств. 2005.












