–§–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є—П –†–Р —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –њ—А–Њ–і–≤–Є–љ—Г–ї–∞—Б—М –Ј–∞ –њ–Њ—Б–ї–µ–і–љ–Є–µ 10–15 –ї–µ—В. –†–∞–љ–љ—П—П –Є –±–Њ–ї–µ–µ –∞–≥—А–µ—Б—Б–Є–≤–љ–∞—П —Б—В—А–∞—В–µ–≥–Є—П –ї–µ—З–µ–љ–Є—П —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л—Е —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є—Е –±–∞–Ј–Є—Б–љ—Л—Е –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ (—Б––С–Я–Т–Я) –Є –≥–µ–љ–љ–Њ-–Є–љ–ґ–µ–љ–µ—А–љ—Л—Е –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ (–У–Ш–С–Я) –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Є–Ј–Љ–µ–љ–Є—В—М –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ —В–µ—З–µ–љ–Є–µ –†–Р –Є –Ј–∞–Љ–µ–і–ї–Є—В—М –Є–ї–Є –Њ—Б—В–∞–љ–Њ–≤–Є—В—М —А–µ–љ—В–≥–µ–љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Њ–µ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —Ж–µ–ї—М—О –ї–µ—З–µ–љ–Є—П –†–Р —П–≤–ї—П–µ—В—Б—П —А–µ–Љ–Є—Б—Б–Є—П [2] –Є–ї–Є (–µ—Б–ї–Є —Н—В–Њ –љ–µ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В—Б—П –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–Љ, –љ–∞–њ—А–Є–Љ–µ—А, –њ—А–Є –њ–Њ–Ј–і–љ–µ–є —Б—В–∞–і–Є–Є –±–Њ–ї–µ–Ј–љ–Є) –Љ–Є–љ–Є–Љ–∞–ї—М–љ–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В, –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г—П —Б–Є–Љ–њ—В–Њ–Љ—Л, –Њ—Б—В–∞–љ–Њ–≤–Є—В—М –і–µ—Б—В—А—Г–Ї—Ж–Є—О, –њ—А–µ–і–Њ—В–≤—А–∞—В–Є—В—М –Є–љ–≤–∞–ї–Є–і–љ–Њ—Б—В—М –Є —Г–ї—Г—З—И–Є—В—М –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є. –Я—А–Є —Н—В–Њ–Љ –љ–∞–і–Њ –њ–Њ–Љ–љ–Є—В—М, —З—В–Њ —Е–Њ—В—П –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ –Њ–±—А–∞—В–Є–Љ–Њ, –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–µ —Б—Г—Б—В–∞–≤–Њ–≤ (—Б—Г–ґ–µ–љ–Є–µ —Б—Г—Б—В–∞–≤–љ–Њ–є —Й–µ–ї–Є –≤—Б–ї–µ–і—Б—В–≤–Є–µ –і–µ–≥—А–∞–і–∞—Ж–Є–Є —Е—А—П—Й–∞, –Ї–Њ—Б—В–љ—Л–µ —Н—А–Њ–Ј–Є–Є) —П–≤–ї—П–µ—В—Б—П –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ–Њ–±—А–∞—В–Є–Љ—Л–Љ, –њ–Њ—Н—В–Њ–Љ—Г —Б—Г—Й–µ—Б—В–≤—Г–µ—В –њ–Њ—В—А–µ–±–љ–Њ—Б—В—М –≤ –∞–≥—А–µ—Б—Б–Є–≤–љ–Њ–Љ –ї–µ—З–µ–љ–Є–Є —Б —Б–∞–Љ–Њ–≥–Њ –љ–∞—З–∞–ї–∞ –±–Њ–ї–µ–Ј–љ–Є, –і–ї—П —З–µ–≥–Њ –і–Є–∞–≥–љ–Њ–Ј –і–Њ–ї–ґ–µ–љ –±—Л—В—М —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ —А–∞–љ–Њ.
–†–∞–љ–љ—П—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞
–Я–Њ—Б–Ї–Њ–ї—М–Ї—Г –њ—А–Є –†–Р, –Ї–∞–Ї –Є –њ—А–Є –Љ–љ–Њ–≥–Є—Е –і—А—Г–≥–Є—Е –Є–Љ–Љ—Г–љ–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е, –љ–µ —Б—Г—Й–µ—Б—В–≤—Г–µ—В –њ–Њ-–љ–∞—Б—В–Њ—П—Й–µ–Љ—Г –њ–∞—В–Њ–≥–љ–Њ–Љ–Њ–љ–Є—З–љ—Л—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤, –≤–Ї–ї—О—З–∞—П —А–µ–Ј—Г–ї—М—В–∞—В—Л –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–є –Є –Є–љ—Б—В—А—Г–Љ–µ–љ—В–∞–ї—М–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є, —Б 1956 –≥. –њ—А–Є–Љ–µ–љ—П—О—В—Б—П –Ї—А–Є—В–µ—А–Є–∞–ї—М–љ—Л–µ –Љ–µ—В–Њ–і—Л –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є [4]. –Я–Њ—Б–ї–µ–і–љ–Є–є –≤–∞—А–Є–∞–љ—В –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Њ–љ–љ—Л—Е –Ї—А–Є—В–µ—А–Є–µ–≤ –†–Р – —Б–Њ–≤–Љ–µ—Б—В–љ–∞—П —А–∞–Ј—А–∞–±–Њ—В–Ї–∞ –Р–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Њ–є –Ї–Њ–ї–ї–µ–≥–Є–Є —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Њ–≤ (ACR) –Є –Х–≤—А–Њ–њ–µ–є—Б–Ї–Њ–є –ї–Є–≥–Є –њ—А–Њ—В–Є–≤ —А–µ–≤–Љ–∞—В–Є–Ј–Љ–∞ (EULAR) – –±—Л–ї –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ –≤ 2010 –≥. [5]. –≠—В–Є –Ї—А–Є—В–µ—А–Є–Є –Њ—А–Є–µ–љ—В–Є—А–Њ–≤–∞–љ—Л –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М –љ–∞ —А–∞–љ–љ—О—О –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї—Г –†–Р. –Я—А–Є–Њ—А–Є—В–µ—В–љ–Њ–є –Ј–∞–і–∞—З–µ–є –і–ї—П –∞–≤—В–Њ—А–Њ–≤ —П–≤–ї—П–ї–Њ—Б—М –≤—Л—П–≤–ї–µ–љ–Є–µ –±–Њ–ї—М–љ—Л—Е, –љ—Г–ґ–і–∞—О—Й–Є—Е—Б—П –≤ –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –С–Я–Т–Я.
–Я–Њ –Ї—А–Є—В–µ—А–Є—П–Љ ACR/EULAR 2010 –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –њ—А–Њ–≤–Њ–і–Є—В—Б—П –≤ 3 —Н—В–∞–њ–∞:
1. –Ф–Њ–ї–ґ–љ–Њ –±—Л—В—М —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ –љ–∞–ї–Є—З–Є–µ —Г –±–Њ–ї—М–љ–Њ–≥–Њ —Е–Њ—В—П –±—Л –Њ–і–љ–Њ–≥–Њ –њ—А–Є–њ—Г—Е—И–µ–≥–Њ —Б—Г—Б—В–∞–≤–∞ –њ–Њ –і–∞–љ–љ—Л–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ—Б–Љ–Њ—В—А–∞.
2. –°–ї–µ–і—Г–µ—В –Є—Б–Ї–ї—О—З–Є—В—М –і—А—Г–≥–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–≥—Г—В —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—В—М—Б—П –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є —Б—Г—Б—В–∞–≤–Њ–≤ –Є –Є –і–ї—П –Ї–Њ—В–Њ—А—Л—Е –±–Њ–ї–µ–µ —Б–≤–Њ–є—Б—В–≤–µ–љ–љ—Л, —З–µ–Љ –і–ї—П –†–Р, —В–∞–Ї–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П. –Ґ—А–µ–±—Г–µ—В—Б—П –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ–∞—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є, —В–∞–Ї–Є–Љ–Є –Ї–∞–Ї —Б–Є—Б—В–µ–Љ–љ–∞—П –Ї—А–∞—Б–љ–∞—П –≤–Њ–ї—З–∞–љ–Ї–∞, –њ—Б–Њ—А–Є–∞—В–Є—З–µ—Б–Ї–Є–є –∞—А—В—А–Є—В, –њ–Њ–і–∞–≥—А–∞. –Т —Б–ї—Г—З–∞–µ –љ–µ—П—Б–љ–Њ—Б—В–µ–є —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –Ї–Њ–љ—Б—Г–ї—М—В–∞—Ж–Є—П —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–∞-—Н–Ї—Б–њ–µ—А—В–∞.
3. –Э—Г–ґ–љ–Њ –љ–∞–±—А–∞—В—М –Ї–∞–Ї –Љ–Є–љ–Є–Љ—Г–Љ 6 –±–∞–ї–ї–Њ–≤ –Є–Ј 10 –≤–Њ–Ј–Љ–Њ–ґ–љ—Л—Е –њ–Њ 4 –њ–Њ–Ј–Є—Ж–Є—П–Љ, –Њ–њ–Є—Б—Л–≤–∞—О—Й–Є–Љ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –Ї–∞—А—В–Є–љ—Л –±–Њ–ї–µ–Ј–љ–Є —Г –і–∞–љ–љ–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞ (—В–∞–±–ї. 1).
–Я–Њ–і—А–Њ–±–љ–Њ–µ –Њ–њ–Є—Б–∞–љ–Є–µ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Ї—А–Є—В–µ—А–Є–µ–≤ ACR/EULAR 2010 –і–∞–љ–Њ –≤ –љ–∞—И–µ–є –њ—Г–±–ї–Є–Ї–∞—Ж–Є–Є [4]. –Ґ–µ—Б—В–Є—А–Њ–≤–∞–љ–Є–µ –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Њ–љ–љ—Л—Е –Ї—А–Є—В–µ—А–Є–µ–≤ ACR/EULAR –і–ї—П –†–Р –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ –љ–∞ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –Ї–Њ–≥–Њ—А—В–∞—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–∞–љ–љ–Є–Љ –∞—А—В—А–Є—В–Њ–Љ. –Т —Ж–µ–ї–Њ–Љ –љ–Њ–≤—Л–µ –Ї—А–Є—В–µ—А–Є–Є –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є –≤—Л—Б–Њ–Ї—Г—О —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М, –љ–Њ –Њ–±—Б—Г–ґ–і–∞–µ—В—Б—П –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –≥–Є–њ–µ—А–і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є. –Т –љ–∞—И–µ–є –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е —Б –≤–њ–µ—А–≤—Л–µ –≤–Њ–Ј–љ–Є–Ї—И–Є–Љ –∞—А—В—А–Є—В–Њ–Љ (n=413) –±—Л–ї–Є –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ—Л –≤—Л—Б–Њ–Ї–∞—П —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Є —Г–і–Њ–≤–ї–µ—В–≤–Њ—А–Є—В–µ–ї—М–љ–∞—П —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М —Н—В–Є—Е –Ї—А–Є—В–µ—А–Є–µ–≤ (89 –Є 63% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ). –Я–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –љ–∞–Є–±–Њ–ї–µ–µ —Е–Њ—А–Њ—И–Њ –Ї—А–Є—В–µ—А–Є–Є –†–Р 2010 –њ–Њ–Ј–≤–Њ–ї—П—О—В –Њ—Ж–µ–љ–Є—В—М —Б–Њ—Б—В–Њ—П–љ–Є–µ –±–Њ–ї—М–љ—Л—Е –љ–∞ –Њ—З–µ–љ—М —А–∞–љ–љ–µ–є —Б—В–∞–і–Є–Є –±–Њ–ї–µ–Ј–љ–Є (–і–Њ 3 –Љ–µ—Б.), —Б–µ—А–Њ–љ–µ–≥–∞—В–Є–≤–љ—Л—Е –њ–Њ —А–µ–≤–Љ–∞—В–Њ–Є–і–љ–Њ–Љ—Г —Д–∞–Ї—В–Њ—А—Г (–†–§), –∞ —В–∞–Ї–ґ–µ —Б –љ–µ–і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞–љ–љ—Л–Љ –∞—А—В—А–Є—В–Њ–Љ [6, 7].
–Ю—Ж–µ–љ–Ї–∞ –њ—А–Њ–≥–љ–Њ–Ј–∞
–Я–Њ—Б–ї–µ –≤–µ—А–Є—Д–Є–Ї–∞—Ж–Є–Є –і–Є–∞–≥–љ–Њ–Ј–∞ –†–Р –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –≤—Л—П–≤–Є—В—М –љ–∞–ї–Є—З–Є–µ —Д–∞–Ї—В–Њ—А–Њ–≤ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–≥–Њ –њ—А–Њ–≥–љ–Њ–Ј–∞, –Ї–Њ—В–Њ—А—Л–µ –Њ–њ—А–µ–і–µ–ї—П—О—В –≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –∞–≥—А–µ—Б—Б–Є–≤–љ–Њ—Б—В—М —В–µ—А–∞–њ–Є–Є. –Э–∞–ї–Є—З–Є–µ —Б–ї–µ–і—Г—О—Й–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–≥–Њ –њ—А–Њ–≥–љ–Њ–Ј–∞ —Б–ї–µ–і—Г–µ—В –Њ—Ж–µ–љ–Є–≤–∞—В—М –њ—А–Є –њ–µ—А–≤–Є—З–љ–Њ–Љ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Є —Г—З–Є—В—Л–≤–∞—В—М –њ—А–Є –њ—А–Є–љ—П—В–Є–Є —А–µ—И–µ–љ–Є—П –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –ї–µ—З–µ–љ–Є—П: –љ–∞–ї–Є—З–Є–µ –Є —В–Є—В—А –†–§, –љ–∞–ї–Є—З–Є–µ –Є —Г—А–Њ–≤–µ–љ—М –∞–љ—В–Є—В–µ–ї –Ї —Ж–Є–Ї–ї–Є—З–µ—Б–Ї–Њ–Љ—Г —Ж–Є—В—А—Г–ї–ї–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–Љ—Г –њ–µ–њ—В–Є–і—Г (–Р–¶–¶–Я) –Є/–Є–ї–Є –і—А—Г–≥–Є—Е –∞–љ—В–Є—В–µ–ї –Ї —Ж–Є—В—А—Г–ї–ї–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л–Љ –њ–µ–њ—В–Є–і–∞–Љ (–Р–¶–Я), —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П, –±–Њ–ї—М—И–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –њ—А–Є–њ—Г—Е—И–Є—Е –Є –±–Њ–ї–µ–Ј–љ–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤, —А–∞–љ–љ–Є–µ —А–µ–љ—В–≥–µ–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Н—А–Њ–Ј–Є–Є –≤ –Ї–Є—Б—В—П—Е –Є —Б—В–Њ–њ–∞—Е, –∞ —В–∞–Ї–ґ–µ —Н—А–Њ–Ј–Є–Є —Б—Г—Б—В–∞–≤–љ—Л—Е –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–µ–є, –≤—Л—А–∞–ґ–µ–љ–љ—Л–є –Њ—В–µ–Ї –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –њ–Њ –і–∞–љ–љ—Л–Љ –Љ–∞–≥–љ–Є—В–љ–Њ-—А–µ–Ј–Њ–љ–∞–љ—Б–љ–Њ–є —В–Њ–Љ–Њ–≥—А–∞—Д–Є–Є (–Ь–†–Ґ) –Ї–Є—Б—В–µ–є, —Н—А–Њ–Ј–Є–Є –Є –≤—Л—А–∞–ґ–µ–љ–љ—Л–є —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Є–є –і–Њ–њ–њ–ї–µ—А–Њ–≤—Б–Ї–Є–є —Б–Є–≥–љ–∞–ї –њ–Њ –і–∞–љ–љ—Л–Љ –£–Ч–Ш –Ї–Є—Б—В–µ–є, –њ—А–Є–Ј–љ–∞–Ї–Є –≤–љ–µ—Б—Г—Б—В–∞–≤–љ—Л—Е –њ–Њ—А–∞–ґ–µ–љ–Є–є, –≤—Л—Б–Њ–Ї–∞—П —Б–Ї–Њ—А–Њ—Б—В—М –Њ—Б–µ–і–∞–љ–Є—П —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ (–°–Ю–≠) –Є –њ–Њ–≤—Л—И–µ–љ–љ—Л–є —Г—А–Њ–≤–µ–љ—М –°-—А–µ–∞–Ї—В–Є–≤–љ–Њ–≥–Њ –±–µ–ї–Ї–∞ (–°–†–С). –Т—Б–µ —Н—В–Є –њ—А–Є–Ј–љ–∞–Ї–Є –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ—Л —Б –±–Њ–ї–µ–µ –∞–≥—А–µ—Б—Б–Є–≤–љ—Л–Љ —В–µ—З–µ–љ–Є–µ–Љ –±–Њ–ї–µ–Ј–љ–Є –Є –±—Л—Б—В—А—Л–Љ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ–Љ —Б—Г—Б—В–∞–≤–љ–Њ–є –і–µ—Б—В—А—Г–Ї—Ж–Є–Є [8–14]. –Ю—Ж–µ–љ–Ї–∞ —Д–∞–Ї—В–Њ—А–Њ–≤ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–≥–Њ –њ—А–Њ–≥–љ–Њ–Ј–∞ —П–≤–ї—П–µ—В—Б—П –Њ–і–љ–Є–Љ –Є–Ј –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–є –њ–Њ –ї–µ—З–µ–љ–Є—О –†–Р EULAR [15].
–Я—А–Є–љ—Ж–Є–њ—Л –≤–µ–і–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е –Є –Љ–Њ–љ–Є—В–Њ—А–Є–љ–≥
–Ю—Б–љ–Њ–≤–љ—Л–µ –њ—А–Є–љ—Ж–Є–њ—Л –≤–µ–і–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –†–Р –≤ —А–∞–Ј–≤–µ—А–љ—Г—В–Њ–Љ –≤–Є–і–µ, –Њ—Б–љ–Њ–≤–љ—Л–µ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –њ—А–∞–≤–Є–ї–∞ –±—Л–ї–Є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ 2010 –≥. –≤ –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–Њ–є –њ—А–Њ–≥—А–∞–Љ–Љ–µ «Treat to target» (T2T) – «–Ы–µ—З–µ–љ–Є–µ –і–Њ –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —Ж–µ–ї–Є» [16]. –Ю–±—Й–Є–µ –њ—А–Є–љ—Ж–Є–њ—Л –Ґ2–Ґ —Б—Д–Њ—А–Љ—Г–ї–Є—А–Њ–≤–∞–љ—Л —Б–ї–µ–і—Г—О—Й–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ:
–Р. –Ы–µ—З–µ–љ–Є–µ –†–Р —Б–ї–µ–і—Г–µ—В –њ—А–Њ–≤–Њ–і–Є—В—М –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —Б–Њ–≤–Љ–µ—Б—В–љ–Њ–≥–Њ —А–µ—И–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–∞ –Є –≤—А–∞—З–∞-—А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–∞.
B. –Ю—Б–љ–Њ–≤–љ–∞—П —Ж–µ–ї—М –ї–µ—З–µ–љ–Є—П –±–Њ–ї—М–љ–Њ–≥–Њ –†–Р – –Њ–±–µ—Б–њ–µ—З–Є—В—М –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ–µ —Б–Њ—Е—А–∞–љ–µ–љ–Є–µ –≤—Л—Б–Њ–Ї–Њ–≥–Њ –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є, —Б–≤—П–Ј–∞–љ–љ–Њ–≥–Њ —Б —Б–Њ—Б—В–Њ—П–љ–Є–µ–Љ –Ј–і–Њ—А–Њ–≤—М—П, –њ—Г—В–µ–Љ –Ї–Њ–љ—В—А–Њ–ї—П –љ–∞–і —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–Њ–є, –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є—П —Б—В—А—Г–Ї—В—Г—А–љ–Њ–≥–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П —Б—Г—Б—В–∞–≤–Њ–≤, –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–Є —Д—Г–љ–Ї—Ж–Є–Є –Є —Б–Њ—Ж–Є–∞–ї—М–љ—Л—Е –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–µ–є –њ–∞—Ж–Є–µ–љ—В–∞.
C. –Я–Њ–і–∞–≤–ї–µ–љ–Є–µ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П – –≤–∞–ґ–љ–µ–є—И–Є–є —Б–њ–Њ—Б–Њ–± –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —Н—В–Њ–є —Ж–µ–ї–Є.
D. –Ы–µ—З–µ–љ–Є–µ –і–Њ –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —Ж–µ–ї–Є —Б –њ–Њ–Љ–Њ—Й—М—О –Њ—Ж–µ–љ–Ї–Є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–µ–≥–Њ –њ–Њ–і–±–Њ—А–∞ —В–µ—А–∞–њ–Є–Є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –Њ–њ—В–Є–Љ–Є–Ј–∞—Ж–Є–Є –Є—Б—Е–Њ–і–∞ –†–Р.
–Э–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –Њ–±—Й–Є—Е –њ—А–Є–љ—Ж–Є–њ–Њ–≤ –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ—Л–Љ –Ї–Њ–Љ–Є—В–µ—В–Њ–Љ —А–∞–Ј—А–∞–±–Њ—В–∞–љ—Л 10 —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–є –Ґ2–Ґ –њ–Њ –ї–µ—З–µ–љ–Є—О –†–Р –і–Њ –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —Ж–µ–ї–Є, –Њ—Б–љ–Њ–≤–∞–љ–љ—Л—Е –љ–∞ –љ–∞—Г—З–љ—Л—Е –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤–∞—Е –Є –Љ–љ–µ–љ–Є–Є —Н–Ї—Б–њ–µ—А—В–Њ–≤:
1. –Я–µ—А–≤–Є—З–љ–∞—П —Ж–µ–ї—М –ї–µ—З–µ–љ–Є—П –†–Р – –і–Њ—Б—В–Є–ґ–µ–љ–Є–µ —Б–Њ—Б—В–Њ—П–љ–Є—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —А–µ–Љ–Є—Б—Б–Є–Є.
2. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П —А–µ–Љ–Є—Б—Б–Є—П –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –Ї–∞–Ї –Њ—В—Б—Г—В—Б—В–≤–Є–µ –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –Ј–љ–∞—З–Є–Љ–Њ–є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є.
3. –•–Њ—В—П –Њ—Б–љ–Њ–≤–љ–Њ–є —Ж–µ–ї—М—О –Њ—Б—В–∞–µ—В—Б—П –і–Њ—Б—В–Є–ґ–µ–љ–Є–µ —А–µ–Љ–Є—Б—Б–Є–Є, –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –Є–Љ–µ—О—Й–Є—Е—Б—П –љ–∞—Г—З–љ—Л—Е –і–∞–љ–љ—Л—Е –і–Њ–њ—Г—Б—В–Є–Љ–Њ —Б—З–Є—В–∞—В—М –њ—А–Є–µ–Љ–ї–µ–Љ–Њ–є –∞–ї—М—В–µ—А–љ–∞—В–Є–≤–љ–Њ–є —Ж–µ–ї—М—О –ї–µ—З–µ–љ–Є—П –і–Њ—Б—В–Є–ґ–µ–љ–Є–µ –љ–Є–Ј–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –Њ—Б–Њ–±–µ–љ–љ–Њ –њ—А–Є —Б—В–∞–±–Є–ї—М–љ–Њ–Љ —Б–Њ—Б—В–Њ—П–љ–Є–Є –Є –і–ї–Є—В–µ–ї—М–љ–Њ –њ—А–Њ—В–µ–Ї–∞—О—Й–µ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–Є.
4. –Ф–Њ —В–µ—Е –њ–Њ—А, –њ–Њ–Ї–∞ –љ–µ –±—Г–і–µ—В –і–Њ—Б—В–Є–≥–љ—Г—В–∞ —Ж–µ–ї—М –ї–µ—З–µ–љ–Є—П, –њ–µ—А–µ—Б–Љ–Њ—В—А –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П—В—М –љ–µ —А–µ–ґ–µ 1 —А–∞–Ј–∞ –≤ 3 –Љ–µ—Б.
5. –Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —А–µ–≥—Г–ї—П—А–љ–Њ –Њ—Ж–µ–љ–Є–≤–∞—В—М –Є –і–Њ–Ї—Г–Љ–µ–љ—В–Є—А–Њ–≤–∞—В—М –і–∞–љ–љ—Л–µ –Њ–± –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П: —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Г–Љ–µ—А–µ–љ–љ–Њ–є/–≤—Л—Б–Њ–Ї–Њ–є —Б—В–µ–њ–µ–љ—М—О –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є – –µ–ґ–µ–Љ–µ—Б—П—З–љ–Њ, —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б–Њ —Б—В–Њ–є–Ї–Њ–є –љ–Є–Ј–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О –Є–ї–Є –≤ —Б–Њ—Б—В–Њ—П–љ–Є–Є —А–µ–Љ–Є—Б—Б–Є–Є – —А–µ–ґ–µ (1 —А–∞–Ј –≤ 3–6 –Љ–µ—Б.).
6. –Т –Ї–∞–ґ–і–Њ–і–љ–µ–≤–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –і–ї—П –њ—А–Є–љ—П—В–Є—П —А–µ—И–µ–љ–Є–є –Њ –ї–µ—З–µ–љ–Є–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –≤–∞–ї–Є–і–Є—А–Њ–≤–∞–љ–љ—Л–µ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –≤–Ї–ї—О—З–∞—О—Й–Є–µ –Њ—Ж–µ–љ–Ї—Г —Б–Њ—Б—В–Њ—П–љ–Є—П —Б—Г—Б—В–∞–≤–Њ–≤.
7. –Я–Њ–Љ–Є–Љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –њ—А–Є –њ—А–Є–љ—П—В–Є–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —А–µ—И–µ–љ–Є–є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Г—З–Є—В—Л–≤–∞—В—М —Б—В—А—Г–Ї—В—Г—А–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Є –љ–∞—А—Г—И–µ–љ–Є—П —Д—Г–љ–Ї—Ж–Є–Є.
8. –Ц–µ–ї–∞–µ–Љ–∞—П —Ж–µ–ї—М –ї–µ—З–µ–љ–Є—П –і–Њ–ї–ґ–љ–∞ –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—В—М—Б—П –≤ —В–µ—З–µ–љ–Є–µ –≤—Б–µ–≥–Њ –њ–µ—А–Є–Њ–і–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П.
9. –Э–∞ –≤—Л–±–Њ—А (–Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–≥–Њ) –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є —Ж–µ–ї–µ–≤—Л—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ –Љ–Њ–≥—Г—В –њ–Њ–≤–ї–Є—П—В—М —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л–µ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –њ–∞—Ж–Є–µ–љ—В–∞ –Є —А–Є—Б–Ї–Є, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –њ—А–Є–µ–Љ–Њ–Љ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤.
10. –Я–∞—Ж–Є–µ–љ—В –і–Њ–ї–ґ–µ–љ –±—Л—В—М –≤ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –Є–љ—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ –Њ —Ж–µ–ї–Є –ї–µ—З–µ–љ–Є—П –Є –Ј–∞–њ–ї–∞–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —Б—В—А–∞—В–µ–≥–Є–Є –і–ї—П –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —Н—В–Њ–є —Ж–µ–ї–Є –њ–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є–µ–Љ —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–∞.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ–Є –Ґ2–Ґ, –њ—А–Є–љ–Є–Љ–∞—П –±–Њ–ї—М–љ–Њ–≥–Њ —Б –†–Р, –≤—А–∞—З –і–Њ–ї–ґ–µ–љ:
- –Њ—Ж–µ–љ–Є—В—М —В—П–ґ–µ—Б—В—М —Б–Њ—Б—В–Њ—П–љ–Є—П –±–Њ–ї—М–љ–Њ–≥–Њ –Є –њ—А–Њ–≥–љ–Њ–Ј (–∞–Ї—В–Є–≤–љ–Њ—Б—В—М, —Д—Г–љ–Ї—Ж–Є—П, –і–µ—Б—В—А—Г–Ї—Ж–Є—П, –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є). –≠—В–Њ–Љ—Г —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –њ—А–∞–≤–Є–ї—М–љ–∞—П —Д–Њ—А–Љ—Г–ї–Є—А–Њ–≤–Ї–∞ –і–Є–∞–≥–љ–Њ–Ј–∞ —Б–Њ–≥–ї–∞—Б–љ–Њ –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є –†–Р 2007 –≥. [17, 18], –Ї–Њ—В–Њ—А–∞—П –њ–Њ–Ј–≤–Њ–ї—П–µ—В –≤ –Ї–Њ–Љ–њ–∞–Ї—В–љ–Њ–є —Д–Њ—А–Љ–µ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –њ–Њ–і—А–Њ–±–љ–Њ –Њ–њ–Є—Б–∞—В—М –Ї–∞—А—В–Є–љ—Г –±–Њ–ї–µ–Ј–љ–Є —Г –Ї–Њ–љ–Ї—А–µ—В–љ–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞ –Є —Е–Њ—А–Њ—И–Њ –Њ–±–Њ—Б–љ–Њ–≤–∞—В—М —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–є –њ–Њ–і—Е–Њ–і (—В–∞–±–ї. 2);
- –Є—Б—Е–Њ–і—П –Є–Ј —Н—В–Њ–≥–Њ –Њ–њ—А–µ–і–µ–ї–Є—В—М —Ж–µ–ї–Є –ї–µ—З–µ–љ–Є—П;
-
—А–∞–Ј—К—П—Б–љ–Є—В—М –њ–∞—Ж–Є–µ–љ—В—Г –њ—А–Є–љ—Ж–Є–њ—Л –ї–µ—З–µ–љ–Є—П –Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є —А–∞–Ј–љ—Л—Е –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ—Л—Е —Б—А–µ–і—Б—В–≤, –Њ–±—Б—Г–і–Є—В—М –њ–ї—О—Б—Л –Є –Љ–Є–љ—Г—Б—Л —А–∞–Ј–љ—Л—Е —Б—Е–µ–Љ —В–µ—А–∞–њ–Є–Є, –Њ–±—К—П—Б–љ–Є—В—М –Ї–ї—О—З–µ–≤—Л–µ –Љ–Њ–Љ–µ–љ—В—Л:
- –±–Њ–ї—М–љ—Л–µ –†–Р –љ—Г–ґ–і–∞—О—В—Б—П –≤ –∞–Ї—В–Є–≤–љ–Њ–Љ –ї–µ—З–µ–љ–Є–Є, –њ—А–Є —Н—В–Њ–Љ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Є–Ј–±–µ–ґ–∞—В—М «–њ–µ—А–µ–ї–µ—З–Є–≤–∞–љ–Є—П» —В–∞–Ї –ґ–µ, –Ї–∞–Ї –Є «–љ–µ–і–Њ–ї–µ—З–Є–≤–∞–љ–Є—П»;
- –ї–µ—З–µ–љ–Є–µ –†–Р – –љ–µ –Њ–і–љ–Њ—А–∞–Ј–Њ–≤–Њ–µ –Љ–µ—А–Њ–њ—А–Є—П—В–Є–µ, –∞ –њ—А–Њ—Ж–µ—Б—Б, –≤ —В–µ—З–µ–љ–Є–µ –Ї–Њ—В–Њ—А–Њ–≥–Њ —Б—Е–µ–Љ—Л —В–µ—А–∞–њ–Є–Є –Љ–µ–љ—П—О—В—Б—П;
-
—В—А–µ–Ј–≤–Њ –Њ—Ж–µ–љ–Є—В—М –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –У–Ш–С–Я –Є—Б—Е–Њ–і—П –Є–Ј –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –њ—А–Њ–≥–љ–Њ–Ј–∞ —Г –Ї–Њ–љ–Ї—А–µ—В–љ–Њ–≥–Њ –±–Њ–ї—М–љ–Њ–≥–Њ. –°–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л, –≤–Ї–ї—О—З–∞—П –У–Ш–С–Я, —П–≤–ї—П—О—В—Б—П –≤–∞–ґ–љ—Л–Љ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–Љ —Б—В—А–∞—В–µ–≥–Є–Є –ї–µ—З–µ–љ–Є—П, –љ–Њ –Є—Е –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –і–Њ–ї–ґ–љ–Њ –±—Л—В—М —Е–Њ—А–Њ—И–Њ –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–Њ:
- —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М—О –Ї –С–Я–Т–Я –≤ –њ–Њ–ї–љ—Л—Е –і–Њ–Ј–∞—Е;
- —Б–Њ—Е—А–∞–љ–µ–љ–Є–µ–Љ —Г–Љ–µ—А–µ–љ–љ–Њ–є –Є–ї–Є –≤—Л—Б–Њ–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –±–Њ–ї–µ–Ј–љ–Є;
- –љ–∞–ї–Є—З–Є–µ–Љ —Д–∞–Ї—В–Њ—А–Њ–≤ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–≥–Њ –њ—А–Њ–≥–љ–Њ–Ј–∞;
- –Њ—Ж–µ–љ–Є—В—М –љ–∞ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–Љ –≤–Є–Ј–Є—В–µ –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –і–Њ—Б—В–Є–ґ–µ–љ–Є—П –љ–Є–Ј–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ—Б—В—М –Є–љ—В–µ–љ—Б–Є—Д–Є–Ї–∞—Ж–Є–Є —В–µ—А–∞–њ–Є–Є, –≤–Ї–ї—О—З–∞—П –У–Ш–С–Я.
–Т –і–∞–ї—М–љ–µ–є—И–µ–Љ –≤—А–∞—З –і–Њ–ї–ґ–µ–љ –Ї–Њ–љ—В—А–Њ–ї–Є—А–Њ–≤–∞—В—М –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Ї–∞–ґ–і—Л–µ 1–3 –Љ–µ—Б. –і–Њ –і–Њ—Б—В–Є–ґ–µ–љ–Є—П –љ–Є–Ј–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –±–Њ–ї–µ–Ј–љ–Є –Є–ї–Є (–њ—А–µ–і–њ–Њ—З—В–Є—В–µ–ї—М–љ–µ–µ) —А–µ–Љ–Є—Б—Б–Є–Є. –Ю—Б–љ–Њ–≤–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ –Ї–Њ–љ—В—А–Њ–ї—П –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —П–≤–ї—П–µ—В—Б—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Є–љ–і–µ–Ї—Б–∞ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є DAS28 [18] (—В–∞–±–ї. 2). –Т—Б–µ –±–Њ–ї—М—И–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є–µ –њ–Њ–ї—Г—З–∞—О—В —Г–њ—А–Њ—Й–µ–љ–љ—Л–µ –Є–љ–і–µ–Ї—Б—Л – SDAI –Є CDAI [19], –Ї–Њ—В–Њ—А—Л–µ –±–Њ–ї–µ–µ —З–µ—В–Ї–Њ –Њ–њ—А–µ–і–µ–ї—П—О—В —Б–Њ—Б—В–Њ—П–љ–Є–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —А–µ–Љ–Є—Б—Б–Є–Є [20]. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –і–ї—П –Ї–Њ–љ—В—А–Њ–ї—П –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П —Б—Г—Б—В–∞–≤–љ–Њ–є –і–µ—Б—В—А—Г–Ї—Ж–Є–Є —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П —А–µ–љ—В–≥–µ–љ–Њ–≥—А–∞—Д–Є—П –Ї–Є—Б—В–µ–є –Є —Б—В–Њ–њ –Ї–∞–ґ–і—Л–µ 12 –Љ–µ—Б. (–њ—А–Њ–Љ–µ–ґ—Г—В–Ї–Є –Љ–Њ–≥—Г—В –±—Л—В—М –±–Њ–ї—М—И–µ —Г –і–ї–Є—В–µ–ї—М–љ–Њ –±–Њ–ї–µ—О—Й–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б 3–4 —А–µ–љ—В–≥–µ–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —Б—В–∞–і–Є–µ–є). –Ф–ї—П –≤–µ—А–Є—Д–Є–Ї–∞—Ж–Є–Є —Б—В—А—Г–Ї—В—Г—А–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є –≤ —Б—Г—Б—В–∞–≤–∞—Е –Є –Є—Е –і–Є–љ–∞–Љ–Є–Ї–Є –≤ –њ–Њ—Б–ї–µ–і–љ–µ–µ –≤—А–µ–Љ—П –Є—Б–њ–Њ–ї—М–Ј—Г—О—В –£–Ч–Ш –Є –Ь–†–Ґ —Б—Г—Б—В–∞–≤–Њ–≤, —Е–Њ—В—П –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ —Н—В–Є—Е –Љ–µ—В–Њ–і–Њ–≤ –њ–Њ–Ї–∞ –љ–µ–Њ–Ї–Њ–љ—З–∞—В–µ–ї—М–љ–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–Њ.
–Ь–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–∞—П —В–µ—А–∞–њ–Є—П –†–Р
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П —Б–ї–µ–і—Г—О—Й–Є–µ –≥—А—Г–њ–њ—Л –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –і–ї—П –ї–µ—З–µ–љ–Є—П –†–Р:
1. –Э–µ—Б—В–µ—А–Њ–Є–і–љ—Л–µ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л (–Э–Я–Т–Я).
2. –У–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і—Л (–У–Ъ).
3. –°–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є–µ –С–Я–Т–Я.
4. –У–Ш–С–Я.
–°–Њ–≥–ї–∞—Б–љ–Њ –љ–µ–і–∞–≤–љ–Њ –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ–Њ–Љ—Г –њ—А–Њ–µ–Ї—В—Г –≥—А—Г–њ–њ—Л —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В–Њ–≤ EULAR [21], –≤ —Б–≤—П–Ј–Є —Б –њ–Њ—П–≤–ї–µ–љ–Є–µ–Љ –љ–Њ–≤—Л—Е –Ї–ї–∞—Б—Б–Њ–≤ –њ—А–Њ—В–Є–≤–Њ—А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е —Б—А–µ–і—Б—В–≤ –њ—А–µ–і–ї–Њ–ґ–µ–љ–Њ –≤–љ—Г—В—А–Є –≥—А—Г–њ–њ—Л —Б-–С–Я–Т–Я –≤—Л–і–µ–ї—П—В—М «–Њ–±—Л—З–љ—Л–µ» —Б-–С–Я–Т–Я (–Љ–µ—В–Њ—В—А–µ–Ї—Б–∞—В (–Ь–Ґ), –ї–µ—Д–ї—Г–љ–Њ–Љ–Є–і (–Ы–Х–§) –Є –і—А.) –Є —В–∞—А–≥–µ—В–љ—Л–µ —Б––С–Я–Т–Я, –Ї–Њ—В–Њ—А—Л–µ –њ–Њ–Ї–∞ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –µ–і–Є–љ—Б—В–≤–µ–љ–љ—Л–Љ –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ (—В–Њ—Д–∞—Ж–Є—В–Є–љ–Є–± (–Ґ–Ю–§–Р)). –Т–љ—Г—В—А–Є –≥—А—Г–њ–њ—Л –У–Ш–С–Я –њ—А–µ–і–ї–Њ–ґ–µ–љ–Њ –≤—Л–і–µ–ї–Є—В—М –Њ—А–Є–≥–Є–љ–∞–ї—М–љ—Л–µ –У–Ш–С–Я –Є –±–Є–Њ–∞–љ–∞–ї–Њ–≥–Є –У–Ш–С–Я («–±–Є–Њ—Б–Є–Љ–Є–ї—П—А—Л»).
–Э–Я–Т–Я
–Э–Я–Т–Я – –њ–µ—А–≤–∞—П –≥—А—Г–њ–њ–∞ –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –љ–∞–Ј–љ–∞—З–∞—О—В—Б—П –њ—А–Є –∞—А—В—А–Є—В–µ, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –њ–Њ–Ј–≤–Њ–ї—П—О—В –Ї–Њ–љ—В—А–Њ–ї–Є—А–Њ–≤–∞—В—М —Б—Г—Б—В–∞–≤–љ—Г—О –±–Њ–ї—М. –Э–Я–Т–Я –Є–љ–≥–Є–±–Є—А—Г—О—В —Д–µ—А–Љ–µ–љ—В —Ж–Є–Ї–ї–Њ–Њ–Ї—Б–Є–≥–µ–љ–∞–Ј—Г (–¶–Ю–У), –Ї–Њ—В–Њ—А—Л–є –Ї–∞—В–∞–ї–Є–Ј–Є—А—Г–µ—В –≤—Л—А–∞–±–Њ—В–Ї—Г –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤, –≤—Л–Ј—Л–≤–∞—О—Й–Є—Е –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ —А–µ–∞–Ї—Ж–Є–Є (–Њ—В–µ–Ї, –±–Њ–ї—М, —А–∞—Б—И–Є—А–µ–љ–Є–µ —Б–Њ—Б—Г–і–Њ–≤ –Є –і—А.). –¶–Ю–У —Б—Г—Й–µ—Б—В–≤—Г–µ—В –≤ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –Є–Ј–Њ—Д–Њ—А–Љ–∞—Е, –Є–Ј –Ї–Њ—В–Њ—А—Л—Е –¶–Ю–У-1 –Њ—В–≤–µ—З–∞–µ—В –Ј–∞ –љ–µ–Ї–Њ—В–Њ—А—Л–µ –Ј–∞—Й–Є—В–љ—Л–µ —А–µ–∞–Ї—Ж–Є–Є, –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М —Б–Њ —Б—В–Њ—А–Њ–љ—Л –Ц–Ъ–Ґ, –∞ –¶–Ю–У-2 –∞–Ї—В–Є–≤–Є—А—Г–µ—В—Б—П –њ—А–Є –≤–Њ—Б–њ–∞–ї–µ–љ–Є–Є. –Э–Я–Т–Я —Г—Б–ї–Њ–≤–љ–Њ –і–µ–ї—П—В—Б—П –љ–∞ –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ, –Ї–Њ—В–Њ—А—Л–µ –Є–љ–≥–Є–±–Є—А—Г—О—В –¶–Ю–У-1 –Є –¶–Ю–У-2 (–і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї, –∞—Ж–µ–Ї–ї–Њ—Д–µ–љ–∞–Ї, –Є–љ–і–Њ–Љ–µ—В–∞—Ж–Є–љ –Є –і—А.), –∞ —В–∞–Ї–ґ–µ —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ, –Є–љ–≥–Є–±–Є—А—Г—О—Й–Є–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –¶–Ю–У-2, –њ–Њ—Н—В–Њ–Љ—Г –Њ–љ–Є –Є–Љ–µ—О—В –ї—Г—З—И–Є–є –њ—А–Њ—Д–Є–ї—М –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є (—Ж–µ–ї–µ–Ї–Њ–Ї—Б–Є–±, —Н—В–Њ—А–Є–Ї–Њ–Ї—Б–Є–±). –Я—А–Є –≤—Л–±–Њ—А–µ –Э–Я–Т–Я –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Г—З–Є—В—Л–≤–∞—В—М —Д–∞–Ї—В–Њ—А—Л —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Э–Я–Т–Я-–∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ–Њ–є –≥–∞—Б—В—А–Њ–њ–∞—В–Є–Є: –≤—Л—Б–Њ–Ї–Є–µ –і–Њ–Ј—Л –Э–Я–Т–Я, –њ–Њ–ґ–Є–ї–Њ–є –≤–Њ–Ј—А–∞—Б—В, –Є–љ—Д–µ–Ї—Ж–Є—П Helicobacter pylori, «—П–Ј–≤–µ–љ–љ—Л–є –∞–љ–∞–Љ–љ–µ–Ј» –Є –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П –Є–Ј –Ц–Ъ–Ґ –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ, –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –љ–Є–Ј–Ї–Є—Е –і–Њ–Ј –∞—Ж–µ—В–Є–ї—Б–∞–ї–Є—Ж–Є–ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л (–Р–°–Ъ), –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–Њ–≤. –° –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, –Ї–ї–∞—Б—Б-—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–Љ —П–≤–ї—П–µ—В—Б—П –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–µ –љ–µ–≥–∞—В–Є–≤–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –Э–Я–Т–Я –љ–∞ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Г—О —Б–Є—Б—В–µ–Љ—Г, –њ–Њ—Н—В–Њ–Љ—Г –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —В–∞–Ї–ґ–µ —Г—З–Є—В—Л–≤–∞—В—М —Д–∞–Ї—В–Њ—А—Л —А–Є—Б–Ї–∞ —Н—В–Њ–≥–Њ —В–Є–њ–∞ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є: –љ–∞–ї–Є—З–Є–µ —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є, –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–Є [22]. –Т—А–∞—З –і–Њ–ї–ґ–µ–љ –Њ—Ж–µ–љ–Є—В—М –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М —А–Є—Б–Ї–∞ –Є —Б–Њ—З–µ—В–∞–љ–Є–µ —А–∞–Ј–ї–Є—З–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ —Г –Ї–Њ–љ–Ї—А–µ—В–љ–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞ [23]. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –њ—А–Њ—В–Њ–љ–љ–Њ–є –њ–Њ–Љ–њ—Л —Б –Э–Я–Т–Я –Љ–Њ–ґ–µ—В —Г—Б–Є–ї–Є—В—М –Ј–∞—Й–Є—В—Г –≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–Њ–≤ –Ц–Ъ–Ґ. –Я—А–Є —А–Є—Б–Ї–µ –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ —Б–Њ—З–µ—В–∞–љ–Є–µ —Б –љ–Є–Ј–Ї–Є–Љ–Є –і–Њ–Ј–∞–Љ–Є –Р–°–Ъ –Є –і—А—Г–≥–Є–Љ–Є –∞–љ—В–Є–∞–≥—А–µ–≥–∞–љ—В–∞–Љ–Є –Є–ї–Є –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–∞–Љ–Є, –љ–Њ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ –Љ–µ–ґ–і—Г –≤—А–µ–і–Њ–Љ –Є –њ–Њ–ї—М–Ј–Њ–є –і–Њ–ї–ґ–љ–Њ –Њ—Ж–µ–љ–Є–≤–∞—В—М—Б—П –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ. –Ь–Њ–љ–Є—В–Њ—А–Є–љ–≥ –Р–Ф –Љ–Њ–ґ–µ—В –Є–Љ–µ—В—М –Ј–љ–∞—З–µ–љ–Є–µ –њ—А–Є –њ–Њ–і–±–Њ—А–µ —Б—Е–µ–Љ—Л —В–µ—А–∞–њ–Є–Є –Э–Я–Т–Я.
–У–Ъ
–У–Ъ –Љ–Њ–≥—Г—В –±—Л—В—М –љ–∞–Ј–љ–∞—З–µ–љ—Л –Ї–∞–Ї —З–∞—Б—В—М –љ–∞—З–∞–ї—М–љ–Њ–є —Б—В—А–∞—В–µ–≥–Є–Є –ї–µ—З–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –†–Р –і–ї—П –Ї–Њ–љ—В—А–Њ–ї—П –љ–∞–і –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О –±–Њ–ї–µ–Ј–љ–Є. –Ю—Б–љ–Њ–≤–љ—Л–µ –Љ–µ—В–Њ–і–Є–Ї–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –У–Ъ –њ—А–Є –†–Р – –≤–љ—Г—В—А—М –љ–Є–Ј–Ї–Є–µ –і–Њ–Ј—Л (–њ—А–µ–і–љ–Є–Ј–Њ–ї–Њ–љ–∞ 5–10 –Љ–≥/—Б—Г—В –Є–ї–Є –Љ–µ—В–Є–ї–њ—А–µ–і–љ–Є–Ј–Њ–ї–Њ–љ–∞ 4–8 –Љ–≥/—Б—Г—В) –Є –≤–љ—Г—В—А–Є—Б—Г—Б—В–∞–≤–љ–Њ–µ –≤–≤–µ–і–µ–љ–Є–µ –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ (–±–µ—В–∞–Љ–µ—В–∞–Ј–Њ–љ, –Љ–µ—В–Є–ї–њ—А–µ–і–љ–Є–Ј–Њ–ї–Њ–љ –Є —В—А–Є–∞–Љ—Ж–Є–љ–Њ–ї–Њ–љ). –С–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–µ –і–Њ–Ј—Л –У–Ъ –≤–љ—Г—В—А—М –Є–ї–Є –њ—Г–ї—М—Б-—В–µ—А–∞–њ–Є—П –У–Ъ –њ—А–Є–Љ–µ–љ—П—О—В—Б—П –≤–µ—Б—М–Љ–∞ —А–µ–і–Ї–Њ – –њ—А–Є —В—П–ґ–µ–ї—Л—Е —Б–Є—Б—В–µ–Љ–љ—Л—Е –њ—А–Њ—П–≤–ї–µ–љ–Є—П—Е –±–Њ–ї–µ–Ј–љ–Є. –Ш–Љ–µ—О—В—Б—П –і–∞–љ–љ—Л–µ, –і–Њ–Ї–∞–Ј—Л–≤–∞—О—Й–Є–µ, —З—В–Њ —Б–Њ—З–µ—В–∞–љ–Є–µ –љ–Є–Ј–Ї–Њ–є –і–Њ–Ј—Л –У–Ъ –≤–љ—Г—В—А—М —Б –С–Я–Т–Я –њ–Њ–≤—Л—И–∞–µ—В –Ї–ї–Є–љ–Є—З–µ—Б–Ї—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—П –Є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —В–Њ—А–Љ–Њ–ґ–µ–љ–Є—О —Б—Г—Б—В–∞–≤–љ–Њ–є –і–µ—Б—В—А—Г–Ї—Ж–Є–Є [24]. –Т —Б–≤—П–Ј–Є —Б –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –≤—Л—Б–Њ–Ї–Њ–є –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М—О –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —В–µ—А–∞–њ–Є–Є (–Є–љ—Д–µ–Ї—Ж–Є–Є, –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј, –Ј–∞–і–µ—А–ґ–Ї–∞ –ґ–Є–і–Ї–Њ—Б—В–Є, —Б–љ–Є–ґ–µ–љ–Є–µ —В–Њ–ї–µ—А–∞–љ—В–љ–Њ—Б—В–Є –Ї –≥–ї—О–Ї–Њ–Ј–µ –Є –і—А.) —А–µ–Ї–Њ–Љ–µ–љ–і—Г—О—В—Б—П –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Љ–Є–љ–Є–Љ–∞–ї—М–љ–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ—Л—Е –і–Њ–Ј–Є—А–Њ–≤–Њ–Ї –У–Ъ, —Б–Њ–Ї—А–∞—Й–µ–љ–Є–µ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Є—Е –њ—А–Є–µ–Љ–∞ –і–Њ –Љ–Њ–Љ–µ–љ—В–∞ —А–∞–Ј–≤–Є—В–Є—П —Н—Д—Д–µ–Ї—В–∞ –Њ—В –С–Я–Т–Я (—В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ–∞—П «–±—А–Є–і–ґ-—В–µ—А–∞–њ–Є—П»), —В—Й–∞—В–µ–ї—М–љ—Л–є –Ї–Њ–љ—В—А–Њ–ї—М –љ–∞–і —Б–Њ—Б—В–Њ—П–љ–Є–µ–Љ –њ–∞—Ж–Є–µ–љ—В–∞, –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –∞–љ—В–Є–Њ—Б—В–µ–Њ–њ–Њ—А–µ—В–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤.
–°–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є–µ –С–Я–Т–Я
–Я—А–Є–Љ–µ–љ–µ–љ–Є–µ —Б-–С–Я–Т–Я –і–Њ —Б–Є—Е –њ–Њ—А —П–≤–ї—П–µ—В—Б—П –Њ—Б–љ–Њ–≤–Њ–є –Є –Њ–±—П–Ј–∞—В–µ–ї—М–љ—Л–Љ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–Љ –ї–µ—З–µ–љ–Є—П –†–Р. –Ґ—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л–µ –С–Я–Т–Я –Є–Љ–µ—О—В —А–∞–Ј–ї–Є—З–љ—Г—О —Е–Є–Љ–Є—З–µ—Б–Ї—Г—О —Б—В—А—Г–Ї—В—Г—А—Г –Є –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –і–µ–є—Б—В–≤–Є—П. –Ю–љ–Є —Г—Б–ї–Њ–≤–љ–Њ –Љ–Њ–≥—Г—В –±—Л—В—М –њ–Њ–і—А–∞–Ј–і–µ–ї–µ–љ—Л –љ–∞ –њ—А–µ–њ–∞—А–∞—В—Л —Б –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ (–њ—А–Є–Љ–µ–љ—П–µ–Љ—Л–µ –і–ї—П –ї–µ—З–µ–љ–Є—П –†–Р) –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї–Є—А—Г—О—Й–Є–Љ –і–µ–є—Б—В–≤–Є–µ–Љ – –Ь–Ґ, –Ы–Х–§, —Б—Г–ї—М—Д–∞—Б–∞–ї–∞–Ј–Є–љ (–°–°–Ч), –≥–Є–і—А–Њ–Ї—Б–Є—Е–ї–Њ—А–Њ—Е–Є–љ (–У–•), —Ж–Є–Ї–ї–Њ—Б–њ–Њ—А–Є–љ –Р, –∞–Ј–∞—В–Є–Њ–њ—А–Є–љ –Є –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Ж–Є—В–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є–µ –њ—А–µ–њ–∞—А–∞—В—Л (—Ж–Є–Ї–ї–Њ—Д–Њ—Б—Д–∞–Љ–Є–і, —Е–ї–Њ—А–∞–Љ–±—Г—Ж–Є–ї –Є –і—А.), –Ї–Њ—В–Њ—А—Л–µ –ї–Є–±–Њ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –≤—Л—И–ї–Є –Є–Ј —Г–њ–Њ—В—А–µ–±–ї–µ–љ–Є—П, –ї–Є–±–Њ –љ–∞–Ј–љ–∞—З–∞—О—В—Б—П –Њ—З–µ–љ—М —А–µ–і–Ї–Њ –≤ –Њ—Б–Њ–±—Л—Е —Б–ї—Г—З–∞—П—Е (—В—П–ґ–µ–ї—Л–є —А–µ–≤–Љ–∞—В–Њ–Є–і–љ—Л–є –≤–∞—Б–Ї—Г–ї–Є—В, —Б–Є–љ–і—А–Њ–Љ –®–µ–≥—А–µ–љ–∞ –Є –і—А.). –†–∞–љ–µ–µ —И–Є—А–Њ–Ї–Њ –Є–Ј–≤–µ—Б—В–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –Ј–Њ–ї–Њ—В–∞ –Є –њ–µ–љ–Є—Ж–Є–ї–ї–∞–Љ–Є–љ —Б–µ–є—З–∞—Б –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ –њ—А–Є–Љ–µ–љ—П—О—В—Б—П –Є–Ј-–Ј–∞ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–≥–Њ –њ—А–Њ—Д–Є–ї—П –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є.
–Ь–Ґ —П–≤–ї—П–µ—В—Б—П –њ—А–µ–і–њ–Њ—З—В–Є—В–µ–ї—М–љ—Л–Љ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –і—А—Г–≥–Є–Љ–Є —Б-–С–Я–Т–Я –њ–Њ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –Є –і–Њ–ї–ґ–µ–љ –±—Л—В—М –њ–µ—А–≤—Л–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ, –Ї–Њ—В–Њ—А—Л–є –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –†–Р –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є–є. –Э–Є –Њ–і–Є–љ –і—А—Г–≥–Њ–є —Б-–С–Я–Т–Я –Є–ї–Є –Є–љ–≥–Є–±–Є—В–Њ—А —Д–∞–Ї—В–Њ—А–∞ –љ–µ–Ї—А–Њ–Ј–∞ –Њ–њ—Г—Е–Њ–ї–Є-α (–§–Э–Ю-α) –≤ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є –љ–µ –њ—А–µ–≤–Њ—Б—Е–Њ–і–Є—В –Ь–Ґ –њ–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є. –Ф–ї—П –≤—Б–µ—Е –У–Ш–С–Я –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –Є—Е –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П —Б –Ь–Ґ –њ—А–µ–≤–Њ—Б—Е–Њ–і–Є—В –њ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є—О [25]. –Ь–Ґ —В–∞–Ї–ґ–µ —П–≤–ї—П–µ—В—Б—П –Њ–±—П–Ј–∞—В–µ–ї—М–љ—Л–Љ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–Љ [24, 26] —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–љ—Л—Е –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–є —Б-–С–Я–Т–Я (–Ь–Ґ + –°–°–Ч, –Ь–Ґ + –У–•, –Ь–Ґ + –°–°–Ч + –У–•, –Ь–Ґ + —Ж–Є–Ї–ї–Њ—Б–њ–Њ—А–Є–љ –Р). –Я—А–Є–µ–Љ MT —Б–ї–µ–і—Г–µ—В –љ–∞—З–Є–љ–∞—В—М –њ–µ—А–Њ—А–∞–ї—М–љ–Њ –Є–ї–Є –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ (–і–Њ–Ј—Л –Љ–Њ–≥—Г—В –≤–∞—А—М–Є—А–Њ–≤–∞—В—М—Б—П, –Њ–±—Л—З–љ–Њ —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –љ–∞—З–∞–ї—М–љ–∞—П –і–Њ–Ј–∞ 10–15 –Љ–≥/–љ–µ–і.) –Є —В–Є—В—А–Њ–≤–∞—В—М –і–Њ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–є –і–Њ–Ј—Л 25–30 –Љ–≥/–љ–µ–і. –Ю–њ—В–Є–Љ–∞–ї—М–љ—Л–є –≥—А–∞—Д–Є–Ї —Н—Б–Ї–∞–ї–∞—Ж–Є–Є –і–Њ–Ј—Л –Ј–∞–≤–Є—Б–Є—В –Њ—В –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А—В–Є–љ—Л –Є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є –Ь–Ґ —Г –Ї–Њ–љ–Ї—А–µ—В–љ–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞. –Я—А–Њ—Д–Є–ї—М –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –Ь–Ґ –≤ –љ–Є–Ј–Ї–Є—Е –і–Њ–Ј–∞—Е, –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л—Е –і–ї—П –ї–µ—З–µ–љ–Є—П –†–Р –њ—А–Є –µ–ґ–µ–љ–µ–і–µ–ї—М–љ–Њ–Љ –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є, –Є–Ј—Г—З–∞–µ—В—Б—П —Г–ґ–µ –±–Њ–ї–µ–µ 25 –ї–µ—В —Б –Њ—З–µ–љ—М –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л—Е –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ [27]. –£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –љ–µ–∞–і–µ–Ї–≤–∞—В–љ—Л–Љ –Њ—В–≤–µ—В–Њ–Љ –Є–ї–Є –љ–µ–њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М—О –Ь–Ґ per os –і–Њ–ї–ґ–љ–Њ –Њ–±—Б—Г–ґ–і–∞—В—М—Б—П –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞. –Т —Н—В–Њ–Љ —Б–ї—Г—З–∞–µ –љ–∞–Є–ї—Г—З—И–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Љ–Њ–≥—Г—В –±—Л—В—М –њ–Њ–ї—Г—З–µ–љ—Л –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є —Д–Њ—А–Љ—Л –Ь–Ґ –і–ї—П –њ–Њ–і–Ї–Њ–ґ–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П [28], –Ї–Њ—В–Њ—А–∞—П –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –љ–∞–Є–ї—Г—З—И–Є–є —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є–є –њ—А–Њ—Д–Є–ї—М.
–У–Ш–С–Я
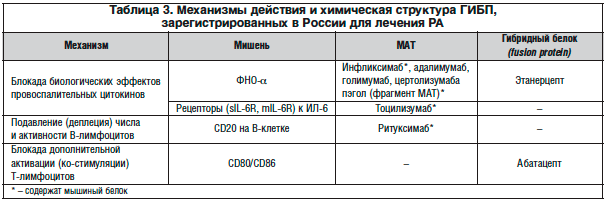
–Ъ –љ–∞—Б—В–Њ—П—Й–µ–Љ—Г –≤—А–µ–Љ–µ–љ–Є 8 –У–Ш–С–Я –±—Л–ї–Є –Њ–і–Њ–±—А–µ–љ—Л –і–ї—П –ї–µ—З–µ–љ–Є—П –†–Р –≤ –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –§–µ–і–µ—А–∞—Ж–Є–Є. –Ю–љ–Є –Њ—В–љ–Њ—Б—П—В—Б—П –Ї —А–∞–Ј–љ—Л–Љ –Ї–ї–∞—Б—Б–∞–Љ –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞ –і–µ–є—Б—В–≤–Є—П, —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є —Б—В—А—Г–Ї—В—Г—А—Л –Є —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –Є–љ–Њ—А–Њ–і–љ–Њ–≥–Њ (–Љ—Л—И–Є–љ–Њ–≥–Њ) –±–µ–ї–Ї–∞ (—В–∞–±–ї. 3). –°—В—А—Г–Ї—В—Г—А–љ—Л–µ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –љ–∞–Є–±–Њ–ї–µ–µ –≤–∞–ґ–љ—Л –і–ї—П –≥—А—Г–њ–њ—Л –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –§–Э–Ю-α, —Б—А–µ–і–Є –Ї–Њ—В–Њ—А—Л—Е —З–∞—Й–µ –≤—Б–µ–≥–Њ –љ–∞–±–ї—О–і–∞–µ—В—Б—П —Д–µ–љ–Њ–Љ–µ–љ –Є–Љ–Љ—Г–љ–Њ–≥–µ–љ–љ–Њ—Б—В–Є (–≤—Л—А–∞–±–Њ—В–Ї–Є –∞–љ—В–Є—В–µ–ї –Ї –њ—А–µ–њ–∞—А–∞—В—Г), –њ—А–Є–≤–Њ–і—П—Й–Є–є –Ї –њ–Њ—В–µ—А–µ —Н—Д—Д–µ–Ї—В–∞. –Ш–Љ–Љ—Г–љ–Њ–≥–µ–љ–љ–Њ—Б—В—М –љ–∞–Є–±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–∞ —Г –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –§–Э–Ю-α, –Њ—В–љ–Њ—Б—П—Й–Є—Е—Б—П –Ї –Љ–Њ–љ–Њ–Ї–ї–Њ–љ–∞–ї—М–љ—Л–Љ –∞–љ—В–Є—В–µ–ї–∞–Љ (–Ь–Р–Ґ) –Є —Б–Њ–і–µ—А–ґ–∞—Й–Є—Е –Љ—Л—И–Є–љ—Л–є –±–µ–ї–Њ–Ї.
–Ґ–µ—А–∞–њ–Є—П –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є –§–Э–Ю-α —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –і–ї—П –ї–µ—З–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –љ–µ–∞–і–µ–Ї–≤–∞—В–љ—Л–Љ –Њ—В–≤–µ—В–Њ–Љ –љ–∞ —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л–µ –С–Я–Т–Я. –Э–µ–∞–і–µ–Ї–≤–∞—В–љ—Л–є –Њ—В–≤–µ—В –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –Ї–∞–Ї —Б–Њ—Е—А–∞–љ–µ–љ–Є–µ —Г–Љ–µ—А–µ–љ–љ–Њ–є –Є–ї–Є –≤—Л—Б–Њ–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Ь–Ґ –Є/–Є–ї–Є –і—А—Г–≥–Є—Е —Б-–С–Я–Т–Я –≤ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є –Є–ї–Є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –≤ —В–µ—З–µ–љ–Є–µ 3–6 –Љ–µ—Б. –њ—А–Є —Г—Б–ї–Њ–≤–Є–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –≤ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–љ—Л—Е –і–Њ–Ј–∞—Е. –Я–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ 1-–≥–Њ —А—П–і–∞ –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є –Љ–Њ–ґ–љ–Њ —Г—Б–њ–µ—И–љ–Њ –њ—А–Є–Љ–µ–љ—П—В—М –Є –У–Ш–С–Я —Б –Є–љ—Л–Љ–Є –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞–Љ–Є –і–µ–є—Б—В–≤–Є—П [15].
–Я–µ—А–µ—Е–Њ–і –љ–∞ –У–Ш–С–Я –њ–Њ—Б–ї–µ –љ–µ—Г—Б–њ–µ—Е–∞ –ї–µ—З–µ–љ–Є—П –Ь–Ґ –±—Л–ї –њ–Њ—Б—В–∞–≤–ї–µ–љ –њ–Њ–і —Б–Њ–Љ–љ–µ–љ–Є–µ –≤ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –љ–µ–і–∞–≤–љ–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ «—В—А–Њ–є–љ–Њ–є —В–µ—А–∞–њ–Є–Є» —Б-–С–Я–Т–Я (–Ь–Ґ + –°–°–Ч + –У–•). O’Dell et al. –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є TEAR [29] –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ —Г –±–Њ–ї—М–љ—Л—Е, –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ –Њ—В–≤–µ—В–Є–≤—И–Є—Е –љ–∞ –ї–µ—З–µ–љ–Є–µ –Ь–Ґ, «—В—А–Њ–є–љ–∞—П —В–µ—А–∞–њ–Є—П» –љ–µ —Г—Б—В—Г–њ–∞–ї–∞ –њ–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–Љ—Г –Њ—В–≤–µ—В—Г –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –Ь–Ґ –Є —Н—В–∞–љ–µ—А—Ж–µ–њ—В–∞. –Ґ–µ –ґ–µ –∞–≤—В–Њ—А—Л –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є RACAT [30] –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М —Г—Б–њ–µ—И–љ–Њ–≥–Њ –њ–µ—А–µ—Е–Њ–і–∞ –љ–µ —В–Њ–ї—М–Ї–Њ —Б «—В—А–Њ–є–љ–Њ–є —В–µ—А–∞–њ–Є–Є» –љ–∞ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—О –Ь–Ґ + –Є–љ–≥–Є–±–Є—В–Њ—А –§–Э–Ю-α, –љ–Њ –Є –љ–∞–Њ–±–Њ—А–Њ—В, –њ—А–Є—З–µ–Љ —А–µ–Ј—Г–ї—М—В–∞—В—Л –±—Л–ї–Є –≤–њ–Њ–ї–љ–µ —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л.
–Ґ–∞—А–≥–µ—В–љ—Л–µ –С–Я–Т–Я
–Ъ —Н—В–Њ–є –љ–Њ–≤–Њ–є –≥—А—Г–њ–њ–µ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤ –і–ї—П –ї–µ—З–µ–љ–Є—П –Є–Љ–Љ—Г–љ–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є (–љ–∞–Ј—Л–≤–∞–µ–Љ–Њ–є –µ—Й–µ «–Љ–∞–ї—Л–µ –Љ–Њ–ї–µ–Ї—Г–ї—Л») –Њ—В–љ–Њ—Б–Є—В—Б—П –њ–Њ–Ї–∞ –µ–і–Є–љ—Б—В–≤–µ–љ–љ—Л–є –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–љ—Л–є –≤ –†–Њ—Б—Б–Є–Є (–∞ —В–∞–Ї–ґ–µ –≤ –°–®–Р, –ѓ–њ–Њ–љ–Є–Є, –®–≤–µ–є—Ж–∞—А–Є–Є –Є —А—П–і–µ –і—А—Г–≥–Є—Е —Б—В—А–∞–љ) –њ—А–µ–њ–∞—А–∞—В —В–Њ—Д–∞—Ж–Є—В–Є–љ–Є–± (–Ґ–Ю–§–Р). –Ю–љ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –љ–Є–Ј–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–є –Є–љ–≥–Є–±–Є—В–Њ—А –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ —Д–µ—А–Љ–µ–љ—В–∞ –ѓ–љ—Г—Б-–Ї–Є–љ–∞–Ј—Л, –Ї–Њ—В–Њ—А—Л–є –≤—Е–Њ–і–Є—В –≤–Њ –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ—Г—О —Б–Є–≥–љ–∞–ї—М–љ—Г—О —Б–Є—Б—В–µ–Љ—Г Jak-STAT, —Б–Њ—Б—В–Њ—П—Й—Г—О –Є–Ј Jak-–Ї–Є–љ–∞–Ј –Є —Б–Є–≥–љ–∞–ї—М–љ–Њ–≥–Њ –±–µ–ї–Ї–∞-—В—А–∞–љ—Б–і—Г–Ї—В–Њ—А–∞ –Є –∞–Ї—В–Є–≤–∞—В–Њ—А–∞ —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Є STAT (Janus Kinases – Signal Transducer and Activator of Transcription). –С–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П —А–Њ–ї—М —Н—В–Њ–є —Б–Є—Б—В–µ–Љ—Л —Б–Њ—Б—В–Њ–Є—В –≤–Њ –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–є –њ–µ—А–µ–і–∞—З–µ —Б–Є–≥–љ–∞–ї–∞ –Њ—В –Љ–µ–і–Є–∞—В–Њ—А–Њ–≤ –Є–Љ–Љ—Г–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л (–љ–∞–њ—А–Є–Љ–µ—А, —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤). –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ —А—П–і —Д–∞—А–Љ–∞–Ї–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –Ґ–Ю–§–Р –Њ–±—К—П—Б–љ—П–µ—В—Б—П –±–ї–Њ–Ї–∞–і–Њ–є –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П –Є–љ—В–µ—А–ї–µ–є–Ї–Є–љ–∞-6 (–Ш–Ы-6), –Є —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–µ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –њ–µ—А–µ—Б–µ–Ї–∞—О—В—Б—П —Б —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞–Љ–Є —В–Њ—Ж–Є–ї–Є–Ј—Г–Љ–∞–±–∞ [31]. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Ґ–Ю–§–Р –≤ 3-–є —Д–∞–Ј–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б–њ—Л—В–∞–љ–Є–є –њ—А–Є –†–Р –±—Л–ї–Є –њ—А–Њ–≤–µ–і–µ–љ—Л –љ–∞ –±–Њ–ї—М—И–Њ–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–Љ –Љ–∞—В–µ—А–Є–∞–ї–µ –≤ —А–∞–Љ–Ї–∞—Е 6-—В–Є –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Б–µ—А–Є–Є ORAL, –Є–Ј—Г—З–∞–≤—И–Є—Е –Њ—Б–љ–Њ–≤–љ—Л–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —Б–Є—В—Г–∞—Ж–Є–Є, –≤ –Ї–Њ—В–Њ—А—Л—Е –Љ–Њ–ґ–µ—В –њ–Њ—В—А–µ–±–Њ–≤–∞—В—М—Б—П –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –љ–Њ–≤–Њ–≥–Њ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ/–Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї–Є—А—Г—О—Й–µ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞. –°—Г–Љ–Љ–∞—А–љ–Њ –≤ —Н—В–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –њ—А–Є–љ—П–ї–Є —Г—З–∞—Б—В–Є–µ 4267 –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Т—Б–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Ґ–Ю–§–Р –і–Њ—Б—В–Є–≥–ї–Є —Б–≤–Њ–Є—Е –њ–µ—А–≤–Є—З–љ—Л—Е –Ї–Њ–љ–µ—З–љ—Л—Е —В–Њ—З–µ–Ї, –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є —Е–Њ—А–Њ—И–Є–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В –њ—А–µ–њ–∞—А–∞—В–∞ –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б —Г–і–Њ–≤–ї–µ—В–≤–Њ—А–Є—В–µ–ї—М–љ–Њ–є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М—О [32]. –Я—А–µ–њ–∞—А–∞—В –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–µ–љ, –Њ—Б–Њ–±–µ–љ–љ–Њ —Г—З–Є—В—Л–≤–∞—П –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –њ—А–Є–µ–Љ–∞ –≤–љ—Г—В—А—М. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –Є–Љ–µ–µ—В—Б—П –љ–∞—Б—В–Њ—А–Њ–ґ–µ–љ–љ–Њ—Б—В—М –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –љ–µ–Ї–Њ—В–Њ—А—Л—Е –∞—Б–њ–µ–Ї—В–Њ–≤ –µ–≥–Њ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є, –∞ –Њ–њ—Л—В –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Н—В–Њ–≥–Њ –љ–Њ–≤–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–µ–љ, —З—В–Њ–±—Л –і–µ–ї–∞—В—М –Ї–Њ–љ–Ї—А–µ—В–љ—Л–µ –≤—Л–≤–Њ–і—Л –Њ –µ–≥–Њ —А–µ–∞–ї—М–љ–Њ–Љ –Љ–µ—Б—В–µ –≤ —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –†–Р.
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є EULAR –њ–Њ –ї–µ—З–µ–љ–Є—О –†–Р
–Т —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е —Г—Б–ї–Њ–≤–Є—П—Е, –Ї–Њ–≥–і–∞ –Є–Љ–µ–µ—В—Б—П –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є—Е –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–µ–є –і–ї—П –ї–µ—З–µ–љ–Є—П –†–Р, –Њ—Б–Њ–±–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –њ—А–Є–Њ–±—А–µ—В–∞—О—В –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є. –Э–∞–Є–±–Њ–ї–µ–µ –∞–≤—В–Њ—А–Є—В–µ—В–љ—Л–Љ–Є —П–≤–ї—П—О—В—Б—П —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є EULAR, –Ї–Њ—В–Њ—А—Л–µ –љ–Њ—Б—П—В –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А –Є –Њ—В–ї–Є—З–∞—О—В—Б—П –≤—Л—Б–Њ–Ї–Њ–є –љ–∞—Г—З–љ–Њ–є –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ–Њ—Б—В—М—О. –Я–Њ—Б–ї–µ–і–љ–Є–є –≤–∞—А–Є–∞–љ—В —Н—В–Є—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–є –њ–Њ –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–Љ—Г –ї–µ—З–µ–љ–Є—О –†–Р –±—Л–ї –њ—А–Є–љ—П—В –≤ 2013 –≥. [15] –Є —Б—А–∞–Ј—Г —Б—В–∞–ї –∞–Ї—В–Є–≤–љ–Њ –Њ–±—Б—Г–ґ–і–∞—В—М—Б—П –≤ –љ–∞—И–µ–є —Б—В—А–∞–љ–µ [25, 33]. –Ъ—А–∞—В–Ї–Њ–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–є EULAR 2013 –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Њ –≤ —В–∞–±–ї–Є—Ж–µ 4.
–†–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –љ–∞—З–Є–љ–∞—О—В—Б—П —Б –Њ—Б–љ–Њ–≤–љ—Л—Е –њ—А–Є–љ—Ж–Є–њ–Њ–≤, –њ–Њ—Б—В—Г–ї–Є—А—Г—О—Й–Є—Е, —З—В–Њ:
A. –Ґ–µ—А–∞–њ–Є—П –±–Њ–ї—М–љ—Л—Е –†–Р –і–Њ–ї–ґ–љ–∞ –±—Л—В—М –љ–∞–њ—А–∞–≤–ї–µ–љ–∞ –љ–∞ –љ–∞–Є–ї—Г—З—И–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –ї–µ—З–µ–љ–Є—П –Ї–∞–Ї —Б–Њ–≤–Љ–µ—Б—В–љ–Њ–µ —А–µ—И–µ–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–∞ –Є —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–∞.
B. –†–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є —П–≤–ї—П—О—В—Б—П —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В–∞–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ –і–Њ–ї–ґ–љ—Л –њ–µ—А–≤–Є—З–љ–Њ –≤–µ—Б—В–Є –±–Њ–ї—М–љ—Л—Е –†–Р.
C. –Ы–µ—З–µ–љ–Є–µ –†–Р –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ—В –≤—Л—Б–Њ–Ї–Є–µ –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л–µ, —Б–Њ—Ж–Є–∞–ї—М–љ—Л–µ –Є –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Є–µ —А–∞—Б—Е–Њ–і—Л, –Ї–Њ—В–Њ—А—Л–µ –і–Њ–ї–ґ–љ—Л —Г—З–Є—В—Л–≤–∞—В—М—Б—П –ї–µ—З–∞—Й–Є–Љ —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Њ–Љ –њ—А–Є –≤–µ–і–µ–љ–Є–Є –±–Њ–ї—М–љ–Њ–≥–Њ.
–≠—В–Є –њ—А–Є–љ—Ж–Є–њ—Л, –љ–µ—Б–Њ–Љ–љ–µ–љ–љ–Њ, –љ–Њ—Б—П—В –Њ—З–µ–љ—М –Њ–±—Й–Є–є —Е–∞—А–∞–Ї—В–µ—А, –љ–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ—В–Љ–µ—В–Є—В—М –≤—Л—Б–Њ–Ї—Г—О –Ј–љ–∞—З–Є–Љ–Њ—Б—В—М —А–∞–±–Њ—В—Л —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В–∞-—А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–∞ –Є –µ–≥–Њ –Ї–Њ–љ—В–∞–Ї—В–Њ–≤ —Б –њ–∞—Ж–Є–µ–љ—В–Њ–Љ.
–Ъ–Њ–љ–Ї—А–µ—В–љ—Л–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ–і—З–µ—А–Ї–Є–≤–∞—О—В –≤–∞–ґ–љ–Њ—Б—В—М –Ь–Ґ –Ї–∞–Ї «—П–Ї–Њ—А–љ–Њ–≥–Њ» –њ—А–µ–њ–∞—А–∞—В–∞ –њ—А–Є –ї–µ—З–µ–љ–Є–Є –†–Р –≤ –Ї–∞—З–µ—Б—В–≤–µ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є –Є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е —Б—Е–µ–Љ –ї–µ—З–µ–љ–Є—П. –°–ї–µ–і—Г–µ—В –Њ–±—А–∞—В–Є—В—М –≤–љ–Є–Љ–∞–љ–Є–µ –љ–∞ —В–Њ, —З—В–Њ —В–µ—А–∞–њ–Є—П –У–Ш–С–Я —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ—В—Б—П —В–Њ–ї—М–Ї–Њ –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б –Ь–Ґ. –Ь–Њ–љ–Њ—В–µ—А–∞–њ–Є—П –У–Ш–С–Я –љ–µ –Њ–±—Б—Г–ґ–і–∞–µ—В—Б—П, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г —Е–Њ—А–Њ—И–Њ –і–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –ї–µ—З–µ–љ–Є–µ –У–Ш–С–Я –≤ –њ–Њ–і–∞–≤–ї—П—О—Й–µ–Љ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ –Њ–њ—А–∞–≤–і–∞–љ–љ–Њ –Є–Љ–µ–љ–љ–Њ –≤ —А–∞–Љ–Ї–∞—Е –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б —Б-–С–Я–Т–Я. –° –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, –љ–Њ–≤–∞—П –≤–µ—А—Б–Є—П —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–є «–і–µ–Љ–Њ–Ї—А–∞—В–Є—З–љ–µ–µ» –њ–Њ–і—Е–Њ–і–Є—В –Ї –≤—Л–±–Њ—А—Г –њ–µ—А–≤–Њ–≥–Њ –У–Ш–С–Я, –і–Њ–њ—Г—Б–Ї–∞—П –њ–Њ–Љ–Є–Љ–Њ –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –§–Э–Ю-α –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —В–∞–Ї–ґ–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Б –Є–љ—Л–Љ–Є –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞–Љ–Є –і–µ–є—Б—В–≤–Є—П. –Т —Ж–µ–ї–Њ–Љ –љ–Њ–≤—Л–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є EULAR (2013 –≥.) —П–≤–ї—П—О—В—Б—П –≤–∞–ґ–љ—Л–Љ –≤–Ї–ї–∞–і–Њ–Љ –≤ –љ–∞—Г—З–љ—Г—О —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є—О –Є –≤ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–µ –Ј–і—А–∞–≤–Њ–Њ—Е—А–∞–љ–µ–љ–Є–µ. –Ш—Е –≤–љ–µ–і—А–µ–љ–Є–µ, –љ–µ—Б–Њ–Љ–љ–µ–љ–љ–Њ, –±—Г–і–µ—В —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞—В—М –њ–Њ–≤—Л—И–µ–љ–Є—О –Ї–∞—З–µ—Б—В–≤–∞ –Њ–Ї–∞–Ј–∞–љ–Є—П –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –њ–Њ–Љ–Њ—Й–Є –±–Њ–ї—М–љ—Л–Љ –†–Р. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Н—В–Є —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –Љ–Њ–≥—Г—В —Б—В–∞—В—М —Е–Њ—А–Њ—И–µ–є –±–∞–Ј–Њ–є –і–ї—П —А–∞–Ј—А–∞–±–Њ—В–Ї–Є –љ–Њ–≤–Њ–є —А–µ–і–∞–Ї—Ж–Є–Є —А–Њ—Б—Б–Є–є—Б–Ї–Є—Е –љ–∞—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–є –њ–Њ –≤–µ–і–µ–љ–Є—О –±–Њ–ї—М–љ—Л—Е –†–Р.
![–Ґ–∞–±–ї–Є—Ж–∞ 1. –Ъ–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Њ–љ–љ—Л–µ –Ї—А–Є—В–µ—А–Є–Є –†–Р ACR/EULAR 2010 –≥. [5]](/data/articles/Image/t22/n7/483-1.gif)