Широкий интерес к проблеме остеоартроза (ОА) обусловлен прежде всего высокой распространенностью этой формы суставного заболевания, которая является одной из главных причин нетрудоспособности и требует значительных финансовых затрат. Кроме того, в нашем понимании произошли определенные изменения патогенетических процессов, происходящих при ОА. Длительное время существовало мнение о том, что хрящ представляет собой ткань, не способную обновляться и восстанавливаться, а остеоартрозный процесс – это следствие старения и дегенерации хряща. Потребовалось 20 лет для того, чтобы клиническое исследование показало, что остеоартрозный хрящ способен к восстановлению [1], тем самым подтвердив на практике полученные более 30 лет назад данные о том, что хондроциты могут деградировать и синтезировать экстрацеллюлярный матрикс суставного хряща [2].
Открытие различных протеолитических ферментов, вызывающих деструкцию хряща, и способность клеток хряща к синтезу основных компонентов экстрацеллюлярного матрикса привели к концепции динамического равновесия в ткани хряща, которое может изменяться под действием различных эндогенных и экзогенных факторов [3].
Суставной хрящ – высокоспециализированная ткань, состоящая из матрикса и погруженных в него хондроцитов [4]. Матрикс содержит две главные макромолекулы, протеогликаны (Пг) и коллаген. Коллагеновые фибриллы, состоящие в основном из коллагена II типа, обеспечивают сопротивление растяжению, тогда как коллагены VI, IX, X и XI типов ответственны за различные взаимодействия в матриксе. Цепи гликозаминогликанов (ГАГ) образуют высокомолекулярные комплексы с гиалуроновой кислотой, которые в свою очередь удерживаются в коллагеновых фибриллах. Способность хряща выдерживать давление обусловлена отрицательно заряженными ГАГ, ограничивающими содержание воды. Высокая концентрация Пг внутри хряща держит коллагеновую сеть под напряжением, таким образом способствуя распределению нагрузки, которая воздействует на хрящ, и обеспечивая восстановление ткани после прекращения действия нагрузки. При потере даже небольшого количества ГАГ сопротивление матрикса хряща к воздействию физической силы уменьшается и поверхность хряща становится чувствительной к повреждению. Однако эта частичная потеря ГАГ может восполняться за счет усиления синтетической активности хондроцитов. На ранних стадиях хрящ толще, чем нормальный, но при прогрессировании ОА развивается истончение суставной поверхности. Хрящ становится мягче и разрыхленнее, могут появляться глубокие язвы, простирающиеся до кости, часто только в одной части сустава – области, несущей нагрузку. Однако даже если хрящ в остальных областях может выглядеть интактным, он биохимически и метаболически не нормален. Изменения в суставном хряще обусловливают развитие характерных клинических и рентгенологических признаков ОА (см. рентгенограмму). Рентгенологическое исследование суставов является основным инструментальным методом диагностики остеоартроза.
Хрящ, подобно другим тканям, ремоделируется в течение роста и развития, иными словами, в нем происходят процессы синтеза и деградации. Физиологическая скорость обмена матрикса хряща очень медленная и различна для разных компонентов матрикса. Хондроциты, по-видимому, играют главную роль и в физиологическом обмене хряща и в деградации матрикса при ОА. Для целостности хряща в течение всей жизни необходимо, чтобы постоянный синтез ГАГ, коллагенов и гиалуроновой кислоты был равен теряемому количеству их в результате естественного обмена. При патологических ситуациях увеличенная катаболическая активность не компенсируется недостаточно возросшей синтетической активностью. Деградация всех компонентов экстрацеллюлярного матрикса зависит от действия нейтральных металлопротеиназ: стромелизина, коллагеназы и желатиназы [5]. Эти эндопептидазы секретируются в латентной проэнзимной форме, активируются экстрацеллюлярно, а активные формы ингибируются путем связывания с тканевыми ингибиторами металлопротеиназ или с a2-макроглобулином. Блокада этих энзимов доксициклином или химически модифицированными тетрациклинами, по крайней мере на моделях животных, может уменьшать тяжесть остеоартрозного поражения [6].
Цитокины, такие как интерлейкин-I (ИЛ-I), которые образуют мононуклеарные клетки ( включая синовиальные линейные клетки ) в суставе и синтезируют хондроциты, и фактор некроза опухоли стимулируют катаболизм матрикса и ингибируют синтез его молекул [7]. Хрящ человека высоко чувствителен к ингибирующему синтез матрикса действию ИЛ-I, и, вполне вероятно, что любое вещество, контролирующее активность ИЛ-I, может в свою очередь иметь выраженное действие на развитие заболевания, что ведет к поиску факторов, которые могут ингибировать синтез цитокинов, их высвобождение и активацию. Другой важный фактор в поддержании целостности хряща – наличие гормонов роста, особенно инсулинподобного фактора роста. Активность этого и подобных ему веществ, по-видимому, фундаментально важны в поддержании равновесия матрикса хряща. Постоянный синтез ГАГ и коллагена зависит от наличия таких веществ, но при очень малых концентрацях ИЛ-I их активность, вероятно, угнетается. Возможно, что in vivo равновесие между цитокинами и факторами роста определяет соотношение синтеза и деградации экстрацеллюлярного матрикса в хряще человека и дает возможность поиска лекарственных препаратов, контролирующих это взаимодействие.
Воздействовать на болезнь можно на разных стадиях ее развития: первичная профилактика, скрининг асимптомной стадии и профилактическое лечение (например, при остеопорозе) или лечение уже развившейся болезни. И хотя благодаря эпидемиологическим, биомеханическим и молекулярным исследованиям есть существенные достижения в понимании патофизиологических процессов при ОА, мы до сих пор включаемся в лечение не на ранней стадии заболевания, а при появлении клинической и рентгенологической симптоматики.
Основная цель лечения ОА заключается в уменьшении боли, функциональной недостаточности суставов, ограничении прогрессирования заболевания и, в конечном счете, улучшении качества жизни больных. Это достигается нефармакологическими, фармакологическими и хирургическими методами, указанными на рисунке [8], которые могут изменяться с появлением, например, препаратов модифицирующих заболевание. Лечение ОА требует не только тщательной диагностики, но и оценки распространенности и тяжести суставного процесса, общего статуса больного и наличия сопутствующих заболеваний для правильного выбора, а возможно и сочетаний методов лечения (например, низкие дозы нестероидных противовоспалительных препаратов – НПВП можно добавлять к парацетамолу, или внутрисуставное введение кортикостероидов к парацетамолу или НПВП).
Нефармакологические методы
Социальная поддержка больных
В последние годы обращается внимание на социальную поддержку и образование больных. Так, различные советы и общества по артритам в Великобритании, США, Канаде издают брошюры, обучающие больных справляться с болью [9], и организуют локальные группы самопомощи. Такие мероприятия должны являться существенной частью любого лечебного плана для больных ОА, тем более что приводятся доказательства эффективности образовательных программ для больных, таких как “Arthtritis Self-Management Course”, в уменьшении боли, числа визитов к врачу, улучшении качества жизни и поддержании функции суставов. Недавно проведенный сравнительный метаанализ образовательных программ и применения НПВП показал, что образовательные программы весьма существенно помогают больным справиться с болью [10].
Популяционные исследования ОА постоянно показывают, что лица с избыточной массой тела имеют более высокий риск развития ОА коленных суставов, чем лица с нормальной массой тела, независимо от того, определен ли ОА рентгенологически или по наличию симптомов. Кроме того, тучные люди имеют более высокий риск развития прогрессирующего заболевания, чем больные без избыточной массы тела. Наоборот, у женщин потеря 5 кг массы тела ассоциируется с 50% уменьшением риска развития манифестного ОА [11].
Мало данных по лечению ОА с помощью снижения массы тела. В небольшом рандомизированном исследовании [12] больных манифестным ОА коленных и тазобедренных суставов, получавших аноректики и плацебо, потеря массы тела в среднем на 3-6 кг коррелировала с уменьшением симптомов болезни, причем корреляция была сильнее для коленных, чем для тазобедренных суставов. Предварительные данные указывают на то, что для женщин с избыточной массой тела, страдающих гонартрозом [13], снижение массы тела связывается с уменьшением боли и улучшением функциональной способности суставов. И последнее, тучные люди чаще подвергаются тотальной артропластике коленных и тазобедренных суставов, которая эффективно уменьшает болевой синдром.
Физическая терапия
Физическая терапия играет важную роль в лечении ОА. Она включает аэробные, двигательные и силовые упражнения для определенных мышечных групп, тепловые методы, ультразвук, чрескожную электростимуляцию нервов (ЧЭСН) и т.д. Так, укрепление четырехглавой мышцы бедра и аэробные упражнения в течение 6 мес уменьшали боль и улучшали функцию коленных суставов. Результаты проведенного W.Ettinger и соавт. многоцентрового исследования [14] длительностью 18 мес показали, что аэробные или изометрические упражнения дают лучший результат, чем комбинация фармакотерапии с образовательными программами у больных с ОА коленных суставов. Данные клинических исследований подтверждают полезность физических упражнений. ЧЭСН применяют для получения анальгетического действия, но результаты двойных слепых исследований ЧЭСН с плацебо [4] и напроксеном неоднозначны. При поражении суставов нижних конечностей для уменьшения нагрузки рекомендуется хождение с палочкой, которая почти на 50% уменьшает нагрузку на тазобедренный сустав, ношение надколенников и супинаторов. Использование подпяточных клиньев полезно при ОА медиального отдела коленного сустава, особенно у больных с легким течением заболевания.
Фармакологическое лечение
Длительное время медикаментозное лечение ОА ограничивалось применением обезболивающих и противовоспалительных препаратов. Использование лекарственных средств других групп, влияющих, возможно, на патогенез ОА, оставалось ограниченным из-за отсутствия убедительных доказательств их эффективности. Расширение и углубление представлений о природе заболевания и тонких механизмах его развития, лучшее понимание процесса суставного повреждения и восстановления привели к пересмотру точки приложения и оценки патогенетической значимости большинства лекарств, применяемых в терапии ОА сегодня, и способствовали разработке новых средств, способных замедлять или останавливать прогрессирование заболевания.
В настоящее время принята классификация противоартрозных препаратов по их фармакологическому действию, включающая в себя 3 класса лекарственных средств [15]. К первому классу относятся симптоматические препараты немедленного действия, а именно анальгетические препараты и НПВП, способные уменьшать боль, припухлость, скованность и улучшать функцию суставов. Ко второму – группа препаратов, модифицирующих структуру сустава, хотя до настоящего времени ни для одного препарата не подтверждено истинное хондропротективное действие у человека. Промежуточное положение занимают симптоматические препараты замедленного действия.
Нестероидные противовоспалительные препараты
Так называемые “простые” анальгетики (например, парацетамол) часто рекомендуются как препараты первого ряда для уменьшения боли при ОА, однако исследований, посвященных таким препаратам, мало. Приводятся данные о снижении боли на фоне парацетамола у 30% больных с гонартрозом, предварительно принимавших НПВП [16]. J. Bradley и соавт. [17] провели 4-недельное слепое сравнительное изучение эффективности применения 4 г парацетамола, 1200 мг ибупрофена и 2400 мг ибупрофена ежедневно и показали их равнозначность. Дополнительный анальгетический эффект отмечен при комбинации парацетамола (4 г в 1 день) с напроксеном по сравнению с монотерапией напроксеном [10]. Механизм действия парацетамола до конца не ясен, хотя приводятся доказательства его прямого действия на ЦНС. Главное преимущество парацетамола заключается, по-видимому, в его низкой токсичности для верхних и нижних отделов желудочно-кишечного тракта (ЖКТ), особенно по сравнению с НПВП, которые часто назначают пожилым людям. Исследования показывают, что пожилые люди часто прекращают прием НПВП и даже спустя 6 мес не возвращаются к их приему. Парацетамол, вероятно, сравним по эффективности с НПВП, если применять его в высоких дозах, или в сочетании с другими НПВП. Однако безопасность его при длительном применении полностью не определена, тем более, что имеются данные о его гепато- и нефротоксичности.
НПВП – наиболее широко применяемые в клинической практике лекарственные средства. Вместе с тем фармакоэпидемиологические данные показывают не только широкое использование НПВП, но часто и неправильное их применение у больных (особенно в старших возрастных группах с сопутствующими заболеваниями, следовательно, имеющих различные побочные реакции).
Противовоспалительное действие НПВП связывают, в первую очередь, с подавлением активности циклооксигеназы (ЦОГ), а открытие двух ее изоформ, ЦОГ-1 и ЦОГ-2, играющих разную роль в регуляции синтеза простагландинов, способствовало новому пониманию механизма действия НПВП. Было показано, что НПВП подавляют активность обеих изоформ ЦОГ, но их противовоспалительная активность, вероятно, связана с ингибированием ЦОГ-2, которая экспрессируется преимущественно в местах тканевого повреждения [18]. Однако большинство НПВП обладают большим ингибирующим действием на ЦОГ-1, присутствующую в клетках различных органов и регулирующую продукцию простагландинов, чем и объясняется, по-видимому, более частое поражение ЖКТ, как это показано, например, для индометацина и пироксикама по сравнению с препаратами, обладающими равным ингибирующим действием или селективно действующими на ЦОГ-2.
Исследования in vitro показали, что НПВП могут оказывать протективное действие на хрящ. J. Dingle и M. Parker [19], учитывая влияние НПВП на синтез компонентов матрикса хряща при ОА, разделили их на 3 группы:
• ингибирующие – индометацин, напроксен, ибупрофен, нимесулид;
• нейтральные – пироксикам, набуметон;
• стимулирующие – тенидап, ацеклофенак.
Результаты многочисленных исследований различных НПВП показали их большую эффективность по сравнению с плацебо и лучшую переносимость более новых препаратов. И поскольку четкого доказательства преимущества одного НПВП перед другим нет, реально оцениваются различия в токсичности препаратов. Описаны патологические изменения крови и тяжелые кожные реакции при назначении практически всех НПВП, у пожилых больных часто отмечаются головокружение, утомляемость [20].
Наиболее частое и серьезное осложнение на фоне лечения НПВП – поражение ЖКТ, примерно у 20% больных развивается изъязвление верхних отделов ЖКТ, часто протекающее бессимптомно и диагностируемое только эндоскопически. Нет абсолютно “безопасного” НПВП, однако в ряде исследований показано, что ибупрофен и диклофенак имеют низкий риск развития поражения ЖКТ [21]. В последние годы постоянно дискутируются вопросы о риске/пользе НПВП при ОА, затратах при гастроэнтерологических побочных реакциях. По-видимому, селективные ингибиторы ЦОГ-2 (нимесулид, целекоксиб) скорее помогут решить эти проблемы, особенно у пожилых больных с высокими факторами риска, чем отказ от НПВП или назначение профилактического лечения аналогами простагландинов, блокаторами Н2-гистаминовых рецепторов или ингибиторами протонного насоса. Все новые селективные НПВП по эффективности сравнимы со “старыми” препаратами, но обладают значительно меньшей токсичностью для ЖКТ [22].
Общие принципы назначения НПВП при ОА заключаются в следующем:
• использование минимальной эффективной дозы препаратов;
• применение НПВП с наименьшим риском развития побочных реакций;
• учет факторов риска возникновения побочных реакций: женский пол, возраст старше 65 лет, “язвенный” анамнез.
В табл. 1 приведены рекомендуемые дозы НПВП при ОА.
Большое количество побочных реакций, особенно у пожилых, многие из которых принимают препараты по поводу сопутствующих заболеваний, что требует учета взаимодействия препаратов, делают привлекательным использование местных средств для лечения ОА. Используются мази, гели, кремы на основе НПВП. Создана форма НПВП в виде пластыря, так диклофенак в пластыре (180 мг) был эффективнее, чем плацебо в 2-недельном исследовании у 155 больных с гонартрозом. При этом была определена низкая концентрация препарата в плазме и синовиальной жидкости [23]. Хотя необходимо достаточно много исследований, чтобы подтвердить эффективность пластыря, эта форма введения НПВП может иметь преимущества и уменьшить потребность в системных препаратах. R. Moore и соавт. проанализировали 86 исследований для оценки эффективности и токсичности местных средств при лечении острой и хронической боли, включая ОА, и пришли к заключению, что эти препараты достаточно эффективны и безопасны [24].
Внутрисуставные введения кортикостероидов для лечения ОА используются давно, главным образом, для коленного сустава при наличии суставного выпота, и по эффективности превосходят плацебо. Однако, несмотря на большой клинический опыт, отдельные аспекты этой терапии остаются противоречивыми: ее относительная эффективность, потенциально повреждающее действие и потенциально структурно-модифицирующее действие, поэтому место длительного применения внутрисуставной кортикостероидной терапии для лечения ОА остается не ясным, необходимы длительные двойные слепые исследования [25]. В настоящее время считается, что число внутрисуставных введений в один сустав не должно превышать 4 на протяжении 1 года.
Хондропротекторы
Медленно действующие симптоматические препараты занимают как бы промежуточное положение, с одной стороны, они обладают выраженным действием на боль и функциональное состояние суставов, как и НПВП, с другой – некоторыми хондропротективными свойствами. Эффективность при ОА для ряда препаратов уже доказана – это хондроитин сульфат, гликозамин сульфат, диацереин для перорального лечения и гиалуроновая кислота, вводимая внутрисуставно (табл. 2). Отличительной особенностью этих препаратов является время наступления эффекта, обычно спустя 2–8 нед от начала лечения, и сохранение эффекта в течение 2–3 мес после прекращения лечения.
Хондроитин сульфат (ХС) – сульфатированный гликозаминогликан, который находится в экстрацеллюлярном матриксе суставного хряща. При пероральном приеме биодоступность препарата составляет 15%. Фармакокинетические исследования показали, что при приеме внутрь он хорошо адсорбируется и обнаруживается в высоких концентрациях в синовиальной жидкости [26, 27]. В исследованиях in vitro получены доказательства, что ХС обладает противовоспалительной активностью, направленной в основном на клеточный компонент воспаления, стимулирует синтез гиалуроновой кислоты и протеогликанов и ингибирует действие протеолитических ферментов [28]. В процессе экспериментальных исследований in vivo было установлено, что введение ХС перорально или внутримышечно кроликам (с дегенерацией хряща, вызванной химопапаином), значительно повышало содержание Пг хряща по сравнению с контрольными животными, что свидетельствуют о том, что ХС защищает хрящ при повреждении и обладает способностью поддерживать ресинтез Пг матрикса [29].
В клинических исследованиях продемонстрирована эффективность ХС в отношении влияния на болевой синдром и функциональное состояние суставов. В 3-месячном двойном слепом рандомизированном исследовании ХС (1200 мг) в сравнении с диклофенаком (4 нед, затем плацебо 2 мес) показано небольшое превышение эффективности последнего, возможно из-за медленного начала действия ХС, но эффективность ХС была выше плацебо и эффект после прекращения лечения держался в течение 6 мес [30]. Результаты многоцентрового двойного слепого плацебо–контролируемого изучения ХС в течение 6 мес у 154 больных с гонартрозом показали, что эффективность 1000 мг препарата была выше плацебо по действию на боль и по количеству применяемых НПВП [31]. Результаты двух метаанализов, объединивших двойные слепые плацебо-контролируемые исследования по изучению эффективности и переносимости ХС у 372 и 404 больных ОА (с преимущественным поражением коленных и тазобедренных суставов) свидетельствуют об эффективности препарата по сравнению с плацебо по влиянию на болевой синдром, уменьшению дозы принимаемых НПВП и анальгетиков, кроме того, отмечена хорошая переносимость ХС [32, 33]. Открытое рандомизированное контролируемое изучение 100 больных гонартрозом, проведенное в Институте ревматологии [34], также подтвердило эффективность и хорошую переносимость ХС, причем терапевтический эффект препарата сохранялся в течение 3 мес после его отмены. Длительное (12 мес) двойное слепое плацебо-контролируемое исследование влияния ХС на прогрессирование ОА коленных суставов [35] показало, что этот препарат оказывал стабилизирующее влияние на ширину суставной щели и метаболические процессы в субхондральной кости и хряще, а тем самым, по-видимому, и на течение заболевания. Дальнейшие длительные исследования с включением большего числа больных подтвердят, возможно, его модифицирующие структуру болезни свойства.
Глюкозамин сульфат (ГС) – также является компонентом суставного хряща. In vitro показано, что ГС, добавленный к культуре хондроцитов, стимулирует синтез Пг [36]. Ранние краткосрочные исследования выявили эффективность ГС при пероральном приеме. Позже в двойном слепом рандомизированном исследовании больных с ОА коленных суставов применение 1500 мг ГС оказалось эффективнее, чем 1200 мг ибупрофена в течение 4 нед лечения [37], в подобном исследовании ГС превосходил по эффективности плацебо [38]. В двойном слепом плацебо-контролируемом рандомизированном исследовании ОА коленных суставов внутримышечное введение ГС в течение 6 нед [39] также оказалось эффективнее плацебо, показана эффективность препарата при ОА шейного и поясничного отделов позвоночника [40].
Диацереин или диацетилреин, антивоспалительное лекарство, не оказывающее эффекта на ЦОГ или липооксигеназу. In vitro он ингибирует продукцию ИЛ-1 и уменьшает содержание металлопротеиназ в остеоартрозном хряще человека [41]. С другой стороны, он стимулирует синтез Пг, ГАГ и гиалуроновой кислоты [42]. In vivo на моделях ОА у животных диацереин эффективно уменьшал синовиальное воспаление и повреждение хряща [43]. В слепом исследовании проведено сравнение диацерина с плацебо, теноксикамом и комбинации диацерина с теноксикамом [44]. Оба препарата были эффективнее плацебо, действие наступало быстрее у теноксикама, у диацерина – через 6 нед от начала лечения. Легкую диарею отметили 37% больных, принимавших диацерин. В другом исследовании сравнивали эффективность диацерина и напроксена (375 мг 2 раза в день) у больных с ОА коленных и тазобедренных суставов в течение 2 мес [45]. Эффективность диацерина была сравнима с напроксеном, но сохранялась через 30 дней после прекращения лечения в отличие от напроксена.
Неомыляющиеся соединения авокадо/сои (НСАС) экстрагируются из авокадо и сои в отношении 1:2. Исследования, проведенные in vitro, показали, что они способны ингибировать ИЛ-1, индуцированную ИЛ-1 продукцию стромелизина, ИЛ-6, ИЛ-8, простагландина Е2 и коллагеназы, а также стимулировать синтез коллагена хондроцитами хряща [46]. Двойные слепые плацебо-контролируемые исследования НСАС в течение 6 мес лечения и последующих 2 мес наблюдения больных с ОА коленных и тазобедренных суставов [47] продемонстрировали превышение их эффективности над плацебо по действию на боль и снижению потребности в НПВП.
Гиалуроновая кислота (ГиК) привлекает особое внимание как физиологическое терапевтическое средство. Ее изготавливают из петушиных гребешков и других источников. ГиК представляет собой полисахарид, состоящий из длинной цепи дисахаридов. Клиническое применение ГиК было обусловлено исследованиями синовиальной жидкости при ОА, показавшими значительное снижение концентрации ГиК, а также укорочение длины цепей. Однако данные по ее применению противоречивы, возможно, из-за использования ГиК разных молекулярных весов и полученных из различных источников.
Низкомолекулярная ГиК оказалась эффективнее плацебо [48], причем боль уменьшалась на срок до 6 мес, лечение хорошо переносилось, за исключением легких преходящих местных реакций. Результаты большого двойного слепого рандомизированного плацебо-контролируемого исследования не показали значимых различий в двух группах, однако после стандартизации по возрасту и тяжести болезни ГиК оказалась эффективнее плацебо у лиц старше 60 лет и с более тяжелым гонартрозом [49].
Высокомолекулярная ГиК, по данным М. Adams и соавт. [50], при сравнении 3 еженедельных инъекций с НПВП или с комбинацией НПВП и ГиК была эффективнее НПВП. Ретроспективное изучение 336 больных с ОА коленных суставов показало хороший ответ у 76% [51] и сохранение эффекта терапии в среднем до 8 мес. Местные побочные реакции наблюдались у 8% больных, от небольших до развития острого синовита с выпотом, требовавшего внутрисуставного введения кортикостероидов или короткого курса НПВП.
Результаты сравнительного исследования высоко- и низкомолекулярной ГиК у 70 больных с ОА коленных суставов (по 3 еженедельных инъекции) выявили более высокую эффективность первого препарата, при равном небольшом числе побочных местных реакций [52]. Вместе с тем применение высоко- и низкомолекулярной ГиК требует дальнейшего исследования для лучшего определения места этой терапии и, особенно, оценки влияния длительного применения на замедление или обратное развитие деградации хряща. В настоящее время ГиК определяется как модифицирующее симптомы лечение и рекомендуется для больных, которые не отвечают на другие виды лечения или не переносят НПВП.
Хирургическое лечение
При неэффективности консервативной терапии рассматривается вопрос о хирургическом лечении, которое включает артроскопические операции, остеотомии и тотальное замещение суставов. Эндопротезирование эффективно почти в 70% случаев, и “выживаемость” искусственного сустава в течение 10 лет наблюдается у 90–95% больных, что способствует улучшению качества жизни больных с тяжелым ОА суставов нижних конечностей.
Кроме того, разрабатываются новые методы хирургического лечения (алло- и аутологичная трансплантация хряща и клеток), направленные скорее на предотвращение развития заболевания, особенно после травмы, чем на лечение поздних стадий болезни.
Таким образом, возобновление интереса к проблеме ОА связано с углублением наших знаний о всех аспектах заболевания, позволивших внедрить в клиническую практику селективные ингибиторы ЦОГ-2, медленно действующие симптоматические препараты, вероятно, влияющие на биохимические и структурные изменения при ОА; различные хирургические методы, которые позволяют надеяться на изменение прогноза и улучшение качества жизни больных.
Список литературы Вы можете найти на сайте http://www.rmj.ru
Диклофенак –
Диклоран (торговое название)
(Unique Pharmaceutical Laboratories)
Диклофенак + Мизопростол –
Артротек (торговое название)
(Searle – Pharmacia & Upjohn)
Литература
1. Nakata K, Bullough PG. The ingury and repair of human articular cartilage: a morphological study of 192 cases of osteoarthritis. J Jpn Orthop Assoc 1986; 60: 763–75.
2. Dingle JT. The role of lysosomes in connective tissue disease. In: Hill AG (ed): Modern trends in rheumatology, London, Butterworth, 1966; 110–20.
3. Dingle JT. Cartilage maintenance in osteoarthritis: interactions of cytokines, NSAID and prostaglandins in articular cartilage damage and repaire. J Rheumat, 1991; 18 (Suppl. 28): 30–7.
4. Hardingham TE, Fosang AJ, Dubhia J. The structure, function and turnover of aggrecan, the large aggregating proteoglycan from cartilage. Aur J Clin Chem Clin Biochem, 1994; 32: 249–57.
5. Docherty AJP, Murphy G. The tissue metalloproteinase family and the inhibitor TIMP: a study using cDNAs and recombinant proteins. Ann Rheum Dis, 1990; 49: 469–79.
6. Ryan ME, Greenwald RA, Golub LM. Potential of tetracyclines to modify cartilage breakdown in osteoarthritis. Curr Opin Rheumatol 1996; 8: 238–47.
7. Lefebvre I, Peeters-Joris C, Vaes G. Modulation by interleukin 1 and tumor necrosis factor-a of production of collagenase, tissue inhibitor of metalloproteinases and collagen types in differentiated and dedifferentiated articular chondrocytes. Biochim Biophys Acta. 1990; 1052: 366–78.
8. Creamer P, Hochberg MC. Osteoarthritis. Lancet, 1997; 350: 503–8.
9. Keefe FJ, Caldwell DS, Baucom D et al. Spouse-assisted coping skills training in the management of osteoarthritic knee pain. Arthritis Care Res, 1996; 9: 279–91.
10. Superio-Cabuslay E, Ward MM, Lorig KR. Patient education interventions in osteoarthritis and rheumatoid arthritis: a meta-analytic comparison with nonsteroidal antiinflammatory drug treatment. Arthritis Care Res, 1996; 9: 292–301.
11. Felson DT, Zhang Y, Anthony JM et al. Weight loss reduces the risk for symptomatic knee osteoarthritis in women. The Framingham Study. Ann Intern Med. 1992; 116: 535–39.
12. Willims RA, Foulsham BM. Weight reduction in osteoarthritis using phentermine. Practitioner, 1981; 225: 231–2.
13. Martin K, Nicklas BJ, Bunyard LB et al. Weight loss and walking improve symptoms of knee osteoarthritis. Arthritis Rheum, 1996; 39: S 225 (Abstract).
14. Ettinger WH, Burns R, Messier SP et al. A randomized trial comparing aerobic exercise and resistance exercise with a health education program in older adults with knee osteoarthritis. JAMA 1997; 277: 25–31.
15. Lequesne M, Brandt K, Bellamy N et al. Guidelines for testing slow acting drugs in osteoarthritis J Rheumatol 1994; 21: 65–73.
16. Dieppe P, Cushnaghan J, Jasani MK, et al. A two-year, placebo-controlled trial of non-steroidal anti-inflammatory therapy in osteoarthritis of the knee joint. Br J Rheumatol, 1993; 32: 595–600.
17. Bradley JD, Brandt KD, Katz BP et al. Comparison of an antiinflammatory dose of ibuprofen, an analgesic dose of ibuprofen, and acetaminophen in the treatment of patients with osteoarthritis of the knee. N Engl J Med. 1991; 325: 87–91.
18. Meade EA, Smith WI, DeWitt DL. Differential inhibition of prostaglandin endoperoxide synthase (cyclooxygenase) isozymes by aspirin and other nonsteroidal anti-inflammatory drugs. J Biol Chem 1993; 268: 6610–4.
19. Dingle JT, Parker M. NSAID Stimulation of Human Cartilage Matrix Synthesis. Clin Drug Invest 1997; 14(5): 353–62.
20. Huskinsson EC, Berry H, Gishen P et al. On behalf of the LINK study group. Effects of anti-inflammatory drugs on the progression of osteoarthritis of the knee. J Rheumatol, 1995; 22: 1941–6.
21. Henry D, Lim LL, Garcia Rodriquez LA et al. Variability in risk of gasrtointestinal complications with individual non-steroidal antiinflammatory drugs: results of a collaborative meta-analysis. BMJ 1996; 312: 1563–6.
22. Distel M, Mueller C, Bluhmki E, Fries J. Safety of meloxicam: a global analysis of clinical trials. Br J Rheumatol, 1996; 35 (Suppl 1): 68–77.
23. Gallacchi G, Marcolongo R. Pharmacokinetics of diclofenac hydroxyethylpyrrolidine plasters in patients with monolateral knee joint effusion. Drugs Exp Clin Res 1993; 19: 95–7.
24. Moore RA, Tramer MR, Carroll D et al. Quantitative systematic review of topically applied non-steroidal anti-inflammatory drugs. BMJ, 1998; 316: 333–8.
25. Creamer P. Intra-articular corticosteroid treatment in osteoarthritis. Curr Opin Rheumatol 1999; Sep 11(5): 417–21.
26. Сonte A, De Bernardi M, Palmieri L et al. Metabolic fate of exogenous chondroitin-sulfate in man. Arzeim-Forch/Drug Res, 1991; 41: 768–72.
27. Palmieri L, Сonte A, Giovannini L et al. Metabolic fate of exogenous chondroitin-sulfate in the experimental animal. Arzeim-Forch/Drug Res, 1990; 40: 319–23.
28. Ronca F,Palmieri Let al. Anti-inflammatory activity of chondroitin sulfate. Osteoarthritis Cartilage 1998; 6 (suppl A): 14–21.
29. Uebelhart D, Thonar E, Zhang J, Williams J. Protective effect of exogenous 4,6-sulfatе in the acute degradation of articular cartilage in the rabbits/ Osteoart.&Cartilage 1998; 6 (supplement A): 6–13.
30. Morreale P, Manopulo R, Galati M et al. Comparison of the anti-inflammatory efficacy of chondroitin-sulfate and diclofenac sodium in patients with knee osteoarthritis. J Rheumatol, 1996; 23: 1385–91.
31. Uebelhart D, Knussel O, Theiler R. Efficacy and tolerability of oral chondroitin-sulfate in painful knee osteoarthritis: a double-blind, placebo-controlled, multicentre 6-month trial. Osteoarthritis Cartilage, 1999; 7 (Suppl A): abstr 144.
32. Leeb BF, Schweitzer H, Montag K, Smolen JS. A meta-analysis of chondroitinsulfate in the treatment of osteoarthritis. Osteoarthritis Cartilage, 1999; 7 (Suppl A): abstr 130.
33. Eugenio-Sarmiento RM, Manapat BHD, Salido EO, The efficacy of chondroitin-sulfate in the treatment of knee osteoarthritis: a meta-analysis. Osteoarthritis Cartilage, 1999; 7 (Suppl A): abstr 139.
34. Алексеева Л.И., Беневоленская Л.И., Насонов Е.Л., Чичасова Н.В., Карякин А.Н. Структум (хондроитин-сульфат) – новое средство для лечения остеоартроза. Тер.архив 1999; 5: 51–3.
35. Uebelhart, Thonar E, Delmas P et al. Effects of oral chondroitin sulfate on the progression of knee osteoarthritis: a pilot study. Osteoarthritis Cartilage 1998; 6 (suppl A): 39–46.
36. Bassleer C, Henrotin Y, Franchimont P. In vitro evaluation of drugs proposed as chondroprotective agents. Int J Tissue React. 1992; 14: 231–41.
37. Muller-Fasbender H, Bach G, Haase W et al. Glucosamine sulfate compared to ibuprofen in osteoarthritis of the knee. Osteoarthritis Cartilage, 1994; 2: 61–9.
38. Noack W, Fisher M, Forster KK et al. Glucosamine sulfate in osteoarthritis of the knee. Osteoarthritis Cartilage, 1994; 2: 51–9.
39. Reichelt A, Forster KK, Fisher M et al. Efficacy and safety of intramuscular glucosamine sulfate in osteoarthritis of the knee. A randomised, placebo-controlled, double-blind study. Arzneimittelforschung, 1994; 44: 75–80.
40. Forster KK, Schmid K, Giacovelli G, Rovati LC. Efficacy and safety glucosamine sulfate in osteoarthritis of the spine. Osteoarthritis Cartilage, 1999; 7 (Suppl A): abstr 125.
41. Cruz TF, Tang J, Pronost S, Pujol JP. Molecular mechanisms implicated in the inhibition of collagenase expression by diacerhein. Rev Prat Ed Fr, 1996; 46: S15–S19.
42. Carney SL, Hicks CA, Tree B, Broadmore RJ. An in vivo investigation of the effect of anthraquinones on the turnover of aggrecans in spontaneous osteoarthritis in the guinea pig. Inflamm Res, 1995; 44: 182–6.
43. Bendele AN, Bendele RA, Hulman JF, Swann BP. Benefical effects of treatment with diacerhein in guinea pigs with osteoarthritis. Rev Prat Ed Fr, 1996; 46: S35–S39.
44. Nguyen M, Dougados M, Berdah L et al. Diacerein in the treatment of osteoarthritis of the hip. Arthritis Rheum 1994; 37: 529–36.
45. Marcolongo R, Fioravanti A, Adami S et al. Efficacy and tolerability of diacerhein in the treatment of osteoarthritis. Curr Therap Res 1988; 43: 878–87.
46. Mauviel A, Daireaux M, Hartmann DJ et al. Effects of unsaponifiable extracts of avocado/soybeans (PIAS) on the production of collagene by cultures of synoviocytes, articular chondrocytes and skin fibroblasts. Rev Rhum Mal Osteoartic, 1989; 56: 207–11.
47. Maheu E, MazieresB, Valat JP et al. Symptomatic efficacy of avocado/soybean unsaponifiables in the treatment of osteoarthritis of the knee and hip: a prospective, randomised, double-blind, placebo-controlled, multicentric clinical trial with a six-month treatment period and a two-month follow-up demonstrating a persistent effect. Arthritis Rheum 1998; 41: 81–91.
48. Dixon AS, Jacoby RK, Berry H, Hamilton. Clinical trial of intra-articular injection of sodium hyaluronate in patients with osteoarthritis of the knee. Curr Ved Res Opin, 1988; 11: 205–13.
49. Lohmander LS, Dalen N, Englund G et al. Intra-articular hyaluronan injections in the treatment of osteoarthritis of the knee: a randomised, double blind, placebo controlled multicentre trial. Hyaluronan Multicentre Trial Group. Ann Rheum Dis, 1996; 55: 424–31.
50. Adams ME, Atkinson MH, et al. The role of viscosupplementation with hylan G-F 20 (Synvisc) in the treatment of osteoarthritis of the knee: a Canadian multicentre trial comparing hylan G-F 20 alone, hylan G-F 20 with non-steroidal anti-inflammatory drugs (NSAIDs) and NSAIDs alone. Osteoarthritis Cartilage, 1995; 3: 213–25.
51. Lussier AJ, Cividino AA, McFarlane CA et al. Viscosupplementation with hylan for the treatment of osteoarthritis: findings from clinical practice in Canada. J Rheumatol, 1996; 23: 1579–85.
52. Wobig M, Bach G, Beks P, et al. The role of elastoviscosity in the efficacy of viscosupplementation for osteoarthritis of the knee: a comparison of hylan G-F 20 and a lower- molecular-weight hyaluronan.
Clin Ther, 1999; Sep; 21(9):1549–62.
| Приложения к статье |
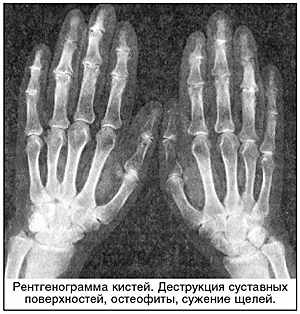
| Рентгенограмма кистей. Деструкция суставных поверхностей, остеофиты, сужение щелей. |


| Рисунок. Рекомендации по лечению ОА (модификация из [8]). |













