–Т–Њ—Б–њ–∞–ї–µ–љ–Є–µ – –Њ–і–љ–∞ –Є–Ј –љ–∞–Є–±–Њ–ї–µ–µ —Г–љ–Є–≤–µ—А—Б–∞–ї—М–љ—Л—Е –Ј–∞—Й–Є—В–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є –Њ—А–≥–∞–љ–Є–Ј–Љ–∞, –≤–Њ–Ј–љ–Є–Ї–∞—О—Й–∞—П –≤ –Њ—В–≤–µ—В –љ–∞ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ —А–∞–Ј–ї–Є—З–љ—Л—Е –њ–Њ–≤—А–µ–ґ–і–∞—О—Й–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤ –Є –љ–∞–њ—А–∞–≤–ї–µ–љ–љ–∞—П –љ–∞ —Г—Б—В—А–∞–љ–µ–љ–Є–µ –њ–Њ—Б–ї–µ–і—Б—В–≤–Є–є —В–∞–Ї–Њ–≥–Њ –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П —А–∞–Ј–≤–Є—В–Є–µ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –љ–µ—А–µ–і–Ї–Њ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–Љ–Є –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є —Б–∞–Љ–Њ—З—Г–≤—Б—В–≤–Є—П, —В—А–µ–±—Г—О—Й–Є–Љ–Є –∞–і–µ–Ї–≤–∞—В–љ–Њ–є –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є –Ї–Њ—А—А–µ–Ї—Ж–Є–Є. –Ъ–ї–∞—Б—Б–Є—З–µ—Б–Ї–Є–µ –њ—А–Є–Ј–љ–∞–Ї–Є –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П (–±–Њ–ї—М, –њ–Њ–Ї—А–∞—Б–љ–µ–љ–Є–µ, –≥–Є–њ–µ—А—В–µ—А–Љ–Є—П, –њ—А–Є–њ—Г—Е–ї–Њ—Б—В—М, –љ–∞—А—Г—И–µ–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–Є) –Є–Ј–≤–µ—Б—В–љ—Л —Б –і—А–µ–≤–љ–µ–є—И–Є—Е –≤—А–µ–Љ–µ–љ, –љ–Њ –ї–Є—И—М –≤ XIX –≤–µ–Ї–µ –њ–Њ—П–≤–Є–ї–∞—Б—М –∞—Ж–µ—В–Є–ї—Б–∞–ї–Є—Ж–Є–ї–Њ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞ – –њ–µ—А–≤—Л–є —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –њ—А–µ–њ–∞—А–∞—В, –њ–Њ–Ј–≤–Њ–ї—П—О—Й–Є–є —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Г–Љ–µ–љ—М—И–∞—В—М –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М —Н—В–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є.
–•–Є–Љ–Є—З–µ—Б–Ї–Њ–µ —Б—В—А–Њ–µ–љ–Є–µ –Є —Б–≤–Њ–є—Б—В–≤–∞ –∞—Ж–µ—В–Є–ї—Б–∞–ї–Є—Ж–Є–ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л —Б—В–∞–ї–Є —В–µ–Љ–Є –Њ—А–Є–µ–љ—В–Є—А–∞–Љ–Є, –њ–Њ –Ї–Њ—В–Њ—А—Л–Љ —Б–Њ–Ј–і–∞–≤–∞–ї–Є—Б—М –љ–Њ–≤—Л–µ –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї–Є —Н—В–Њ–≥–Њ –Ї–ї–∞—Б—Б–∞ –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –њ–Њ–љ–∞—З–∞–ї—Г –њ—А–Є–љ—П—В–Њ –±—Л–ї–Њ –Њ–±–Њ–Ј–љ–∞—З–∞—В—М –Ї–∞–Ї «–∞—Б–њ–Є—А–Є–љ–Њ–њ–Њ–і–Њ–±–љ—Л–µ». –І—А–µ–Ј–≤—Л—З–∞–є–љ–Њ –≤—Л—Б–Њ–Ї–∞—П –њ–Њ—В—А–µ–±–љ–Њ—Б—В—М –≤ —В–∞–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–∞—Е –±—Л–ї–∞ —Е–Њ—А–Њ—И–Є–Љ —Б—В–Є–Љ—Г–ї–Њ–Љ –і–ї—П –∞–Ї—В–Є–≤–љ–Њ–є –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М—Б–Ї–Њ–є —А–∞–±–Њ—В—Л, –Є –≤ —Б–µ—А–µ–і–Є–љ–µ XX –≤–µ–Ї–∞ —Б–Њ–≤–Љ–µ—Б—В–љ—Л–Љ–Є —Г—Б–Є–ї–Є—П–Љ–Є —Е–Є–Љ–Є–Ї–Њ–≤, —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Њ–≤ –Є –Ї–ї–Є–љ–Є—Ж–Є—Б—В–Њ–≤ –±—Л–ї–∞ –њ–Њ–і–≥–Њ—В–Њ–≤–ї–µ–љ–∞ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–∞—П –±–∞–Ј–∞ –і–ї—П —А–∞–Ј—А–∞–±–Њ—В–Ї–Є —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е –љ–µ—Б—В–µ—А–Њ–Є–і–љ—Л—Е –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ (–Э–Я–Т–Я).
–Ъ —Н—В–Њ–Љ—Г –≤—А–µ–Љ–µ–љ–Є –±—Л–ї–Є –њ—А–µ–і–ї–Њ–ґ–µ–љ—Л –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Љ–Њ–і–µ–ї–Є, –њ–Њ–Ј–≤–Њ–ї—П—О—Й–Є–µ –≤–Њ—Б–њ—А–Њ–Є–Ј–≤–µ—Б—В–Є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б –≤ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л—Е —Г—Б–ї–Њ–≤–Є—П—Е –Є –≤—Л–њ–Њ–ї–љ–Є—В—М –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ–µ —В–µ—Б—В–Є—А–Њ–≤–∞–љ–Є–µ –љ–∞ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Є–Ј—Г—З–µ–љ–Є–µ –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–≤, –њ—А–Є–Љ–µ–љ—П–≤—И–Є—Е—Б—П –і–ї—П –њ–Њ–і–∞–≤–ї–µ–љ–Є—П –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ, –і–∞–ї–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –Њ–њ—А–µ–і–µ–ї–Є—В—М —Д–Є–Ј–Є–Ї–Њ–—Е–Є–Љ–Є—З–µ—Б–Ї–Є–µ –њ–∞—А–∞–Љ–µ—В—А—Л, –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–≥–ї–Є –±—Л –Њ–±–µ—Б–њ–µ—З–Є—В—М –њ–Њ–ї—Г—З–µ–љ–Є–µ –Э–Я–Т–Я —Б –Њ–њ—В–Є–Љ–∞–ї—М–љ—Л–Љ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ–Љ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є.
–Т —Е–Њ–і–µ —А–µ–∞–ї–Є–Ј–∞—Ж–Є–Є –њ—А–Њ–≥—А–∞–Љ–Љ—Л –њ–Њ —А–∞–Ј—А–∞–±–Њ—В–Ї–µ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ —Б —Г–ї—Г—З—И–µ–љ–љ—Л–Љ–Є –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М—Б–Ї–Њ–є –ї–∞–±–Њ—А–∞—В–Њ—А–Є–Є —Д–Є—А–Љ—Л –У–µ–є–≥–Є (–≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Э–Њ–≤–∞—А—В–Є—Б) –і–ї—П —Б–Њ–Ј–і–∞–љ–Є—П –Љ–Њ–ї–µ–Ї—Г–ї—Л —Б –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–Љ–Є –њ–∞—А–∞–Љ–µ—В—А–∞–Љ–Є –±—Л–ї–Њ —Б–Є–љ—В–µ–Ј–Є—А–Њ–≤–∞–љ–Њ –±–Њ–ї—М—И–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ 0––∞–Љ–Є–љ–Њ—Г–Ї—Б—Г—Б–љ—Л—Е –Ї–Є—Б–ї–Њ—В [1]. –Я—А–Є —Н—В–Њ–Љ –±—Л–ї–∞ –њ–Њ—Б—В–∞–≤–ї–µ–љ–∞ —Ж–µ–ї—М –њ–Њ–ї—Г—З–Є—В—М —Б–Њ–µ–і–Є–љ–µ–љ–Є–µ —Б –Ї–Њ–љ—Б—В–∞–љ—В–Њ–є –Ї–Є—Б–ї–Њ—В–љ–Њ—Б—В–Є 4–5 –Є –Ї–Њ—Н—Д—Д–Є—Ж–Є–µ–љ—В–Њ–Љ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П –Њ–Ї–Њ–ї–Њ 10, –Є–Љ–µ—О—Й–µ–µ –≤ —Б–≤–Њ–µ–Љ —Б–Њ—Б—В–∞–≤–µ 2 –∞—А–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Ї–Њ–ї—М—Ж–∞, —Б–Ї—А—Г—З–µ–љ–љ—Л—Е –њ–Њ –Њ—В–љ–Њ—И–µ–љ–Є—О –і—А—Г–≥ –Ї –і—А—Г–≥—Г. –Ґ–∞–Ї–Є–µ —В—А–µ–±–Њ–≤–∞–љ–Є—П –±—Л–ї–Є —Б—Д–Њ—А–Љ—Г–ї–Є—А–Њ–≤–∞–љ—Л –њ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –Є–Ј—Г—З–µ–љ–Є—П —Б—В—А—Г–Ї—В—Г—А—Л –Є —Д–Є–Ј–Є–Ї–Њ–—Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е —Б–≤–Њ–є—Б—В–≤ —Д–µ–љ–Є–ї–±—Г—В–∞–Ј–Њ–љ–∞, –Љ–µ—Д–µ–љ–∞–Љ–Є–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л, –Є–љ–і–Њ–Љ–µ—В–∞—Ж–Є–љ–∞.
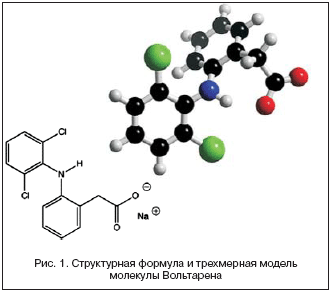
–Я—А–Є –Є–Ј—Г—З–µ–љ–Є–Є –±–Њ–ї–µ–µ 200 –∞–љ–∞–ї–Њ–≥–Њ–≤ –љ–∞–Є–±–Њ–ї–µ–µ –Є–љ—В–µ—А–µ—Б–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ–Њ–Ї–∞–Ј–∞–ї –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї –љ–∞—В—А–Є—П (–Ф–Э) – –љ–∞—В—А–Є–µ–≤–∞—П —Б–Њ–ї—М 0–[(2,6 –і–Є—Е–ї–Њ—А—Д–µ–љ–Є–ї)––∞–Љ–Є–љ–Њ]–—Д–µ–љ–Є–ї–—Г–Ї—Б—Г—Б–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л. –Я—А–µ–њ–∞—А–∞—В –±—Л–ї —Б–Є–љ—В–µ–Ј–Є—А–Њ–≤–∞–љ –≤ 1966 –≥. –Є –њ–Њ–ї—Г—З–Є–ї —Г—Б–ї–Њ–≤–љ–Њ–µ –Њ–±–Њ–Ј–љ–∞—З–µ–љ–Є–µ GP 45840, –∞ –њ–Њ–Ј–і–љ–µ–µ – —В–Њ—А–≥–Њ–≤–Њ–µ –љ–∞–Ј–≤–∞–љ–Є–µ –Т–Њ–ї—М—В–∞—А–µ–љ. –≠—В–Њ—В –њ—А–Њ–і—Г–Ї—В –≤ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є –Љ–µ—А–µ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В —Г–Ї–∞–Ј–∞–љ–љ—Л–Љ –≤—Л—И–µ —Д–Є–Ј–Є–Ї–Њ–—Е–Є–Љ–Є—З–µ—Б–Ї–Є–Љ –њ–∞—А–∞–Љ–µ—В—А–∞–Љ. –Ю–љ –Є–Љ–µ–µ—В –Ї–Њ–љ—Б—В–∞–љ—В—Г –Ї–Є—Б–ї–Њ—В–љ–Њ—Б—В–Є 4,0 –Є –Ї–Њ—Н—Д—Д–Є—Ж–Є–µ–љ—В —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П 13,4 [2]. –†–µ–љ—В–≥–µ–љ–Њ–≤—Б–Ї–Є–є —Б—В—А—Г–Ї—В—Г—А–љ—Л–є –∞–љ–∞–ї–Є–Ј –µ–≥–Њ –Љ–Њ–ї–µ–Ї—Г–ї—Л –њ–Њ–Ї–∞–Ј—Л–≤–∞–µ—В, —З—В–Њ –і–≤–∞ –∞—А–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Ї–Њ–ї—М—Ж–∞ –≤ –љ–µ–є —А–∞–Ј–≤–µ—А–љ—Г—В—Л –Њ–і–љ–Њ –њ–Њ –Њ—В–љ–Њ—И–µ–љ–Є—О –Ї –і—А—Г–≥–Њ–Љ—Г –њ–Њ–і —Г–≥–ї–Њ–Љ 69° (—А–Є—Б. 1).
–Т —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–µ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Ф–Э –Њ—Ж–µ–љ–Є–≤–∞–ї–∞—Б—М –љ–∞ –Љ–Њ–і–µ–ї—П—Е –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П, –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ—А–Є –њ–Њ–Љ–Њ—Й–Є –Є–љ—К–µ–Ї—Ж–Є–є —А–∞—Б—В–≤–Њ—А–∞ –Ї–∞—А–∞–≥–µ–љ–Є–љ–∞ –Є —Б—Г—Б–њ–µ–љ–Ј–Є–Є –Ї–∞–Њ–ї–Є–љ–∞, –∞ —В–∞–Ї–ґ–µ –њ—А–Є –∞–і—К—О–≤–∞–љ—В–љ–Њ–Љ –∞—А—В—А–Є—В–µ. –Э–∞ –≤—Б–µ—Е —В—А–µ—Е –Љ–Њ–і–µ–ї—П—Е –њ—А–µ–њ–∞—А–∞—В –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї —П—А–Ї–Њ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ. –Ю–љ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –њ—А–µ–≤–Њ—Б—Е–Њ–і–Є–ї –њ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –∞—Ж–µ—В–Є–ї—Б–∞–ї–Є—Ж–Є–ї–Њ–≤—Г—О –Ї–Є—Б–ї–Њ—В—Г, –Є–±—Г–њ—А–Њ—Д–µ–љ, –Є–љ–і–Њ–Љ–µ—В–∞—Ж–Є–љ, –љ–∞–њ—А–Њ–Ї—Б–µ–љ –Є —Д–µ–љ–Є–ї–±—Г—В–∞–Ј–Њ–љ [3].
–Я–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –≤–љ—Г—В—А—М, –∞ —В–∞–Ї–ґ–µ –њ—А–Є —А–µ–Ї—В–∞–ї—М–љ–Њ–Љ –≤–≤–µ–і–µ–љ–Є–Є –Ф–Э –њ–Њ–ї–љ–Њ—Б—В—М—О –∞–±—Б–Њ—А–±–Є—А—Г–µ—В—Б—П –Є –і–Њ—Б—В–Є–≥–∞–µ—В –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≤ –њ–ї–∞–Ј–Љ–µ –њ—А–Є–Љ–µ—А–љ–Њ —З–µ—А–µ–Ј 2 —З–∞—Б–∞. –Т –і–∞–ї—М–љ–µ–є—И–µ–Љ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –њ–ї–∞–Ј–Љ–µ –±—Л—Б—В—А–Њ —Б–љ–Є–ґ–∞–µ—В—Б—П, –љ–Њ –≤ —Б–Є–љ–Њ–≤–Є–∞–ї—М–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є –Њ–љ–∞ –Њ—Б—В–∞–µ—В—Б—П —Б—В–∞–±–Є–ї—М–љ–Њ–є –Њ–Ї–Њ–ї–Њ 11 —З–∞—Б–Њ–≤ [4]. –Я—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –Ф–Э –≤ –і–Њ–Ј–µ 25 –Є 50 –Љ–≥ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П —Б–Њ—Б—В–∞–≤–ї—П–ї–∞ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ 0,5 –Є 1 –Љ–Ї–≥/–Љ–ї [5]. –Т –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –њ—А–µ–њ–∞—А–∞—В –≤—Б–µ–≥–і–∞ –љ–∞–Ј–љ–∞—З–∞–µ—В—Б—П –њ–Њ—Б–ї–µ –µ–і—Л. –Т —В–∞–Ї–Є—Е —Г—Б–ї–Њ–≤–Є—П—Е –њ—А–µ–њ–∞—А–∞—В —В–∞–Ї–ґ–µ –∞–±—Б–Њ—А–±–Є—А—Г–µ—В—Б—П –њ–Њ–ї–љ–Њ—Б—В—М—О, –љ–Њ –Љ–µ–і–ї–µ–љ–љ–µ–µ. –Я—А–Є —Н—В–Њ–Љ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —Б–љ–Є–ґ–∞–µ—В—Б—П –Є —А–µ–≥–Є—Б—В—А–Є—А—Г–µ—В—Б—П –≤ –±–Њ–ї–µ–µ –њ–Њ–Ј–і–љ–Є–µ —Б—А–Њ–Ї–Є [6]. –Х—Б–ї–Є –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ–∞—П —Д–Њ—А–Љ–∞ –Ф–Э (—В–∞–±–ї–µ—В–Ї–Є –Т–Њ–ї—М—В–∞—А–µ–љ–∞ —А–µ—В–∞—А–і –њ–Њ 100 –Љ–≥), —В–Њ –≤—Б–∞—Б—Л–≤–∞–љ–Є–µ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –µ—Й–µ –Љ–µ–і–ї–µ–љ–љ–µ–µ –Є –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –≤ –Ї—А–Њ–≤–Є –Љ–Њ–ґ–µ—В –±—Л—В—М –і–Њ—Б—В–Є–≥–љ—Г—В–∞ –њ—А–Є–Љ–µ—А–љ–Њ —З–µ—А–µ–Ј 5–6 —З–∞—Б–Њ–≤ [7].
–Т –Њ—А–≥–∞–љ–Є–Ј–Љ–µ —З–µ–ї–Њ–≤–µ–Ї–∞ –Ф–Э –њ–Њ–і–≤–µ—А–≥–∞–µ—В—Б—П –±–Є–Њ—В—А–∞–љ—Б—Д–Њ—А–Љ–∞—Ж–Є–Є –њ–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ —Д–µ—А–Љ–µ–љ—В–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л —Ж–Є—В–Њ—Е—А–Њ–Љ–∞ P450 —Б –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ–Љ —В—А–µ—Е –њ–µ—А–≤–Є—З–љ—Л—Е –Љ–µ—В–∞–±–Њ–ї–Є—В–Њ–≤ – 3 –≥–Є–і—А–Њ–Ї—Б–Є–і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї–∞, 4 –≥–Є–і—А–Њ–Ї—Б–Є–і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї–∞ –Є 5 –≥–Є–і—А–Њ–Ї—Б–Є–і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї–∞ [8,9]. –Я–µ—А–≤–Є—З–љ—Л–µ –Љ–µ—В–∞–±–Њ–ї–Є—В—Л –Ї–Њ–љ—К—О–≥–Є—А—Г—О—В—Б—П —Б –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ–Љ –і–≤—Г—Е –≤—В–Њ—А–Є—З–љ—Л—Е – 4,5 –і–Є–≥–Є–і—А–Њ–Ї—Б–Є–і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї–∞ –Є 3 –≥–Є–і—А–Њ–Ї—Б–Є–4 –Љ–µ—В–Њ–Ї—Б–Є–і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї–∞ (3,4–У–Ь–Ф). –Т—Б–µ –Љ–µ—В–∞–±–Њ–ї–Є—В—Л –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г—Б—В—Г–њ–∞—О—В –Є—Б—Е–Њ–і–љ–Њ–Љ—Г –њ—А–µ–њ–∞—А–∞—В—Г –њ–Њ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є [10]. –Я–µ—А–Є–Њ–і –њ–Њ–ї—Г–≤—Л–≤–µ–і–µ–љ–Є—П –Ф–Э –Є 4 –Є–Ј 5 –µ–≥–Њ –Њ—Б–љ–Њ–≤–љ—Л—Е –Љ–µ—В–∞–±–Њ–ї–Є—В–Њ–≤ –Ї–Њ–ї–µ–±–ї–µ—В—Б—П –≤ —Б—А–µ–і–љ–µ–Љ –Њ—В 1 –і–Њ 3 —З–∞—Б–Њ–≤, –љ–Њ –і–ї—П 3,4–У–Ь–Ф –і–Њ—Б—В–Є–≥–∞–µ—В 80 —З–∞—Б–Њ–≤ [11]. –Э–∞–ї–Є—З–Є–µ —Г –±–Њ–ї—М–љ–Њ–≥–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є —Д—Г–љ–Ї—Ж–Є–Є –њ–µ—З–µ–љ–Є –Љ–Њ–ґ–µ—В —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞—В—М –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–Љ—Г –Ј–∞–Љ–µ–і–ї–µ–љ–Є—О –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –Ф–Э. –Ґ–∞–Ї–Є–µ –Њ—В–Ї–ї–Њ–љ–µ–љ–Є—П –±—Л–ї–Є –Ј–∞—Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ—Л —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –∞–ї–Ї–Њ–≥–Њ–ї—М–љ—Л–Љ —Ж–Є—А—А–Њ–Ј–Њ–Љ –њ–µ—З–µ–љ–Є, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Ф–Э –≤ –і–Њ–Ј–µ 150 –Љ–≥ [12]. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ –њ—А–µ–њ–∞—А–∞—В–∞ –њ—А–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–Љ –≥–µ–њ–∞—В–Є—В–µ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –љ–µ –Љ–µ–љ—П–ї—Б—П.
–Ф–Э –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –љ–∞ —А–∞–Ј–ї–Є—З–љ—Л–µ –Ј–≤–µ–љ—М—П –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞, –љ–Њ –Ї–ї—О—З–µ–≤–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –і–ї—П —А–µ–∞–ї–Є–Ј–∞—Ж–Є–Є –µ–≥–Њ –ї–µ—З–µ–±–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –Є–Љ–µ–µ—В –њ–Њ–і–∞–≤–ї–µ–љ–Є–µ —Б–Є–љ—В–µ–Ј–∞ –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤ [13]. –≠—В–Є —Б–Њ–µ–і–Є–љ–µ–љ–Є—П —Г—З–∞—Б—В–≤—Г—О—В –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–∞—Е –Є –Њ–±—А–∞–Ј—Г—О—В—Б—П –Є–Ј –∞—А–∞—Е–Є–і–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –Ј–∞ —Б—З–µ—В —Б–Ї–Њ–Њ—А–і–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П —Б–Є—Б—В–µ–Љ—Л —Д–µ—А–Љ–µ–љ—В–Њ–≤. –Ю–і–Є–љ –Є–Ј —Н—В–∞–њ–Њ–≤ —Н—В–Њ–≥–Њ –њ—А–µ–≤—А–∞—Й–µ–љ–Є—П –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ—В—Б—П —Ж–Є–Ї–ї–Њ–Њ–Ї—Б–Є–≥–µ–љ–∞–Ј–Њ–є (–¶–Ю–У), –Ї–Њ—В–Њ—А–∞—П –Є —П–≤–ї—П–µ—В—Б—П –Њ—Б–љ–Њ–≤–љ–Њ–є –Љ–Є—И–µ–љ—М—О –і–ї—П –Э–Я–Т–Я [14]. –Т –љ–∞—З–∞–ї–µ 90–—Е –≥–Њ–і–Њ–≤ –•–• –≤–µ–Ї–∞ –±—Л–ї–Є –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л –і–≤–µ –Є–Ј–Њ—Д–Њ—А–Љ—Л —Н—В–Њ–≥–Њ —Д–µ—А–Љ–µ–љ—В–∞ – –¶–Ю–У–1 –Є –¶–Ю–У–2 [15]. –¶–Ю–У–1 –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –Ї–Њ–љ—Б—В–Є—В—Г—Ж–Є–Њ–љ–∞–ї—М–љ—Л–є —Д–µ—А–Љ–µ–љ—В, –њ—А–Є—Б—Г—В—Б—В–≤—Г—О—Й–Є–є –≤ –љ–Њ—А–Љ–µ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –≤–Њ –≤—Б–µ—Е —В–Ї–∞–љ—П—Е. –¶–Ю–У–2 –≤—Л—А–∞–±–∞—В—Л–≤–∞–µ—В—Б—П –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –њ–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е —Б—В–Є–Љ—Г–ї–Њ–≤ [16].
–Ю–і–љ–∞–Ї–Њ —Б—Г—Й–µ—Б—В–≤—Г–µ—В —А—П–і –Є—Б–Ї–ї—О—З–µ–љ–Є–є –Є–Ј —Н—В–Њ–≥–Њ –њ—А–∞–≤–Є–ї–∞. –¶–Ю–У–2 –Ї–Њ–љ—Б—В–Є—В—Г—Ж–Є–Њ–љ–∞–ї—М–љ–Њ —Н–Ї—Б–њ—А–µ—Б—Б–Є—А—Г–µ—В—Б—П –≤ –Љ–Њ–Ј–≥–µ, –њ–Њ—З–Ї–∞—Е, –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј–µ [17–19]. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –¶–Ю–У–1 –Љ–Њ–ґ–µ—В –Є–≥—А–∞—В—М –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Г—О —А–Њ–ї—М –≤ —А–∞–Ј–≤–Є—В–Є–Є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞. –¶–Ю–У–1 –≤–Љ–µ—Б—В–µ —Б –¶–Ю–У–2 –≤—Л—А–∞–±–∞—В—Л–≤–∞–µ—В—Б—П —Б–Є–љ–Њ–≤–Є–∞–ї—М–љ–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Њ–є –±–Њ–ї—М–љ—Л—Е —А–µ–≤–Љ–∞—В–Њ–Є–і–љ—Л–Љ –∞—А—В—А–Є—В–Њ–Љ (–†–Р) [20]. –Т –Ї—Г–ї—М—В—Г—А–µ –Ї–ї–µ—В–Њ–Ї —Б–Є–љ–Њ–≤–Є–∞–ї—М–љ–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –±–Њ–ї—М–љ—Л—Е –†–Р –Є–љ—В–µ—А–ї–µ–є–Ї–Є–љ 1a –Є–љ–і—Г—Ж–Є—А—Г–µ—В –≤—Л—А–∞–±–Њ—В–Ї—Г –Њ–±–Њ–Є—Е –Є–Ј–Њ—Д–µ—А–Љ–µ–љ—В–Њ–≤ –¶–Ю–У, –Є —Н—В–Њ—В —Н—Д—Д–µ–Ї—В –њ–Њ–і–∞–≤–ї—П–µ—В—Б—П –і–µ–Ї—Б–∞–Љ–µ—В–∞–Ј–Њ–љ–Њ–Љ [21]. –Ф–µ—Д–Є—Ж–Є—В –¶–Ю–У–1 –њ—А–Є –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є –≤—Л—А–∞–±–Њ—В–Ї–µ –¶–Ю–У–2 —Г –Љ—Л—И–µ–є —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –Њ—В–≤–µ—В–∞ –љ–∞ –∞–њ–њ–ї–Є–Ї–∞—Ж–Є–Є –∞—А–∞—Е–Є–і–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л [22].
–Э–Я–Т–Я —Б–≤—П–Ј—Л–≤–∞—О—В –Њ–±–∞ –Є–Ј–Њ—Д–µ—А–Љ–µ–љ—В–∞ –¶–Ю–У –Є –њ—А–µ–њ—П—В—Б—В–≤—Г—О—В –Є—Е –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—О —Б –∞—А–∞—Е–Є–і–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В–Њ–є [23,24]. –≠—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –љ–∞—А—Г—И–µ–љ–Є—О –±–Є–Њ—Б–Є–љ—В–µ–Ј–∞ –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤ –Є —Б–љ–Є–ґ–µ–љ–Є—О –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞. –Т —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Ф–Э –≤ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є—Е –і–Њ–Ј–∞—Е –Њ–Ї–∞–Ј—Л–≤–∞–ї –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –љ–∞ –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –¶–Ю–У–2, —З–µ–Љ —Ж–µ–ї–µ–Ї–Њ–Ї—Б–Є–±, —А–Њ—Д–µ–Ї–Њ–Ї—Б–Є–±, –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ, –Є–±—Г–њ—А–Њ—Д–µ–љ –Є –љ–∞–њ—А–Њ–Ї—Б–µ–љ [25,26]. –Р–Ї—В–Є–≤–љ–Њ—Б—В—М –¶–Ю–У–1 –њ–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ –Ф–Э —В–∞–Ї–ґ–µ —Б–љ–Є–ґ–∞–µ—В—Б—П, –љ–Њ –љ–∞ —Н—В–Њ—В —Д–µ—А–Љ–µ–љ—В –њ—А–µ–њ–∞—А–∞—В –і–µ–є—Б—В–≤—Г–µ—В –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –Љ–µ–љ—М—И–µ, —З–µ–Љ –љ–∞ –¶–Ю–У–2 [27,28]. –Ґ–∞–Ї–Њ–є —Б–±–∞–ї–∞–љ—Б–Є—А–Њ–≤–∞–љ–љ—Л–є —Н—Д—Д–µ–Ї—В –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –≤—Л—Б–Њ–Ї—Г—О —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–Є —Е–Њ—А–Њ—И–µ–є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П.
–Ф–Э —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Б–љ–Є–ґ–∞–ї –≤—Л—А–∞–±–Њ—В–Ї—Г –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–∞ –Х2 (–Я–У–Х2) –≤ –Ї—Г–ї—М—В—Г—А–∞—Е –Ї–ї–µ—В–Њ–Ї —Б–Є–љ–Њ–≤–Є–∞–ї—М–љ–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є —Б—Г—Б—В–∞–≤–Њ–≤ [29–31]. –Я—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –≤–љ—Г—В—А—М –Њ–љ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Я–У–Х2 –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є, –њ—А–Є—З–µ–Љ —Б—В–µ–њ–µ–љ—М —В–∞–Ї–Њ–≥–Њ —Б–љ–Є–ґ–µ–љ–Є—П –њ—А–Њ–њ–Њ—А—Ж–Є–Њ–љ–∞–ї—М–љ–∞ –і–Њ–Ј–µ –њ—А–µ–њ–∞—А–∞—В–∞ [32]. –Ф–ї–Є—В–µ–ї—М–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ –Ф–Э –±–Њ–ї—М–љ—Л—Е –Њ—Б—В–µ–Њ–∞—А—В—А–Њ–Ј–Њ–Љ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–Њ—Б—М —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ –≤—Л—А–∞–±–Њ—В–Ї–Є –Я–У–Х2 –Љ–Њ–љ–Њ–љ—Г–Ї–ї–µ–∞—А–љ—Л–Љ–Є –Є –њ–Њ–ї–Є–Љ–Њ—А—Д–љ–Њ—П–і–µ—А–љ—Л–Љ–Є –Ї–ї–µ—В–Ї–∞–Љ–Є –Ї—А–Њ–≤–Є [33]. –£ –±–Њ–ї—М–љ—Л—Е —Б –∞—А—В—А–Є—В–Њ–Љ –Ф–Э –≤—Л–Ј—Л–≤–∞–ї —А–µ–Ј–Ї–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Я–У–Х2 –Є —В—А–Њ–Љ–±–Њ–Ї—Б–∞–љ–∞ –Т2 –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є —З–µ—А–µ–Ј 4 —З–∞—Б–∞ –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –≤–љ—Г—В—А—М [34]. –Ф–Э –∞–Ї—В–Є–≤–љ–Њ –њ–Њ–і–∞–≤–ї—П–ї –≤—Л—А–∞–±–Њ—В–Ї—Г –Я–У–Х2 –≤ –Ї—Г–ї—М—В—Г—А–∞—Е –Ї–ї–µ—В–Њ–Ї, –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –Є–Ј –≤–Њ—Б–њ–∞–ї–µ–љ–љ—Л—Е —Б—Г–±–∞–Ї—А–Њ–Љ–Є–∞–ї—М–љ—Л—Е —Б—Г–Љ–Њ–Ї –±–Њ–ї—М–љ—Л—Е —Б —Б—Г–±–∞–Ї—А–Њ–Љ–Є–∞–ї—М–љ—Л–Љ –Є–Љ–њ–Є—З–Љ–µ–љ—В–—Б–Є–љ–і—А–Њ–Љ–Њ–Љ [35]. –Ш–љ—В–µ—А–µ—Б–љ–Њ, —З—В–Њ —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ –¶–Ю–У–2 –Є–љ–≥–Є–±–Є—В–Њ—А—Л –≤ —Н–Ї–≤–Є–Љ–Њ–ї—П—А–љ—Л—Е –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П—Е –≤ —Н—В–Њ–Љ —Б–ї—Г—З–∞–µ –±—Л–ї–Є –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ—Л. –Ґ–∞–Ї–Њ–µ –љ–µ—Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–µ –і–∞–ї–Њ –∞–≤—В–Њ—А–∞–Љ –Њ—Б–љ–Њ–≤–∞–љ–Є–µ –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В—М, —З—В–Њ –≤ —А–∞–Ј–≤–Є—В–Є–Є —Б—Г–±–∞–Ї—А–Њ–Љ–Є–∞–ї—М–љ–Њ–≥–Њ –±—Г—А—Б–Є—В–∞ –Ј–∞–Љ–µ—В–љ—Г—О —А–Њ–ї—М –Љ–Њ–ґ–µ—В –Є–≥—А–∞—В—М –¶–Ю–У–1.
–Т —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–µ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –Ф–Э –Љ–Њ–ґ–µ—В –≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є –Љ–µ—А–µ —Б–і–µ—А–ґ–Є–≤–∞—В—М –Љ–Є–≥—А–∞—Ж–Є—О –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–≤ –≤ –Њ—З–∞–≥ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П [36–38]. –≠—В–Њ—В —Н—Д—Д–µ–Ї—В, –њ–Њ––≤–Є–і–Є–Љ–Њ–Љ—Г, –Љ–Њ–ґ–µ—В –±—Л—В—М –Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є–Љ–Є –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞–Љ–Є. Perianin A. –Є —Б–Њ–∞–≤—В. –њ–Њ–ї–∞–≥–∞—О—В, —З—В–Њ –њ—А–µ–њ–∞—А–∞—В —Б–њ–Њ—Б–Њ–±–µ–љ –Њ–Ї–∞–Ј—Л–≤–∞—В—М –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –љ–∞ –ї–Њ–Ї–Њ–Љ–Њ—В–Њ—А–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–≤ [39]. –Я—А–Є —Б—В–Є–Љ—Г–ї—П—Ж–Є–Є –њ–Њ–ї–Є–Љ–Њ—А—Д–љ–Њ—П–і–µ—А–љ—Л—Е –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–≤ —Е–µ–Љ–Њ–∞—В—В—А–∞–Ї—В–∞–љ—В–∞–Љ–Є –≤ –њ—А–Є—Б—Г—В—Б—В–≤–Є–Є –Ф–Э –Њ–љ–Є –љ–∞–±–ї—О–і–∞–ї–Є —Г—Б–Є–ї–µ–љ–Є–µ –њ–Њ–≥–ї–Њ—Й–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –Ї–ї–µ—В–Ї–∞–Љ–Є –Є —Б–љ–Є–ґ–µ–љ–Є–µ –Є—Е —Е–µ–Љ–Њ—В–∞–Ї—Б–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є.
–Ю–≥—А–∞–љ–Є—З–µ–љ–Є–µ –Љ–Є–≥—А–∞—Ж–Є–Є –Љ–Њ–ґ–µ—В –±—Л—В—М —Б–≤—П–Ј–∞–љ–Њ —В–∞–Ї–ґ–µ —Б —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –Љ–Њ–ї–µ–Ї—Г–ї –∞–і–≥–µ–Ј–Є–Є –љ–∞ —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Ї–∞—Е. Sakai A. –љ–∞–±–ї—О–і–∞–ї —Н—В–Њ—В —Д–µ–љ–Њ–Љ–µ–љ –≤ –Ї—Г–ї—М—В—Г—А–µ —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Њ–Ї, —Б—В–Є–Љ—Г–ї–Є—А–Њ–≤–∞–љ–љ—Л—Е –ї–Є–њ–Њ–њ–Њ–ї–Є—Б–∞—Е–∞—А–Є–і–Њ–Љ [40]. –Э–∞ —Н—В–Њ–є –Љ–Њ–і–µ–ї–Є –Ф–Э —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Б–љ–Є–ґ–∞–ї —Н–Ї—Б–њ—А–µ—Б—Б–Є—О –Х–—Б–µ–ї–µ–Ї—В–Є–љ–∞, ICAM–1 –Є VCAM–1. –Х—Й–µ –Њ–і–љ–Є–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ, —Б–і–µ—А–ґ–Є–≤–∞—О—Й–Є–Љ –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–µ –љ–µ–є—В—А–Њ—Д–Є–ї–Њ–≤ –≤ –Њ—З–∞–≥ –њ–Њ—А–∞–ґ–µ–љ–Є—П, –Љ–Њ–ґ–µ—В –±—Л—В—М –њ–Њ–і–∞–≤–ї–µ–љ–Є–µ —Б–µ–Ї—А–µ—Ж–Є–Є —Е–µ–Љ–Њ–Ї–Є–љ–Њ–≤. –Я—А–Є –≤–љ—Г—В—А–Є–Љ—Л—И–µ—З–љ–Њ–Љ –≤–≤–µ–і–µ–љ–Є–Є –Ф–Э –Ї—А–Њ–ї–Є–Ї–∞–Љ —Б –∞—А—В—А–Є—В–Њ–Љ, –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ—Л–Љ –Њ–≤–∞–ї—М–±—Г–Љ–Є–љ–Њ–Љ, –≤ —Б–Є–љ–Њ–≤–Є–∞–ї—М–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є –≤–Њ—Б–њ–∞–ї–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤ –Ј–∞—Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–Њ –Њ—В—З–µ—В–ї–Є–≤–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Є–љ—В–µ—А–ї–µ–є–Ї–Є–љ–∞ 8, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–≤—И–µ–µ—Б—П —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –њ–Њ–ї–Є–Љ–Њ—А—Д–љ–Њ—П–і–µ—А–љ—Л—Е –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–≤ [41]. –Т –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–є –Љ–µ—А–µ –Ф–Э –Љ–Њ–ґ–µ—В –≤–ї–Є—П—В—М –Є –љ–∞ –±–∞–ї–∞–љ—Б —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤, —Б–љ–Є–ґ–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О –Є–љ—В–µ—А–ї–µ–є–Ї–Є–љ–∞ 6 –Є –њ–Њ–≤—Л—И–∞—П —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –Є–љ—В–µ—А–ї–µ–є–Ї–Є–љ–∞ 10 [33,42]. –Ґ–∞–Ї–Њ–µ –Є–Ј–Љ–µ–љ–µ–љ–Є–µ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є—П —Н—В–Є—Е –њ—А–Њ–і—Г–Ї—В–Њ–≤ –±–ї–∞–≥–Њ–њ—А–Є—П—В—Б—В–≤—Г–µ—В –Ј–∞–Љ–µ–і–ї–µ–љ–Є—О —Б–µ–Ї—А–µ—Ж–Є–Є –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤. –£–Љ–µ–љ—М—И–µ–љ–Є–µ –≤—Л—А–∞–±–Њ—В–Ї–Є —Б–≤–Њ–±–Њ–і–љ—Л—Е –Ї–Є—Б–ї–Њ—А–Њ–і–љ—Л—Е —А–∞–і–Є–Ї–∞–ї–Њ–≤, –њ—А–Њ–Є—Б—Е–Њ–і—П—Й–µ–µ –њ–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ –Ф–Э, —В–∞–Ї–ґ–µ –Љ–Њ–ґ–µ—В —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞—В—М —Б–љ–Є–ґ–µ–љ–Є—О –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –Є –Њ–≥—А–∞–љ–Є—З–µ–љ–Є—О –µ–≥–Њ –њ–Њ–≤—А–µ–ґ–і–∞—О—Й–µ–≥–Њ –і–µ–є—Б—В–≤–Є—П –љ–∞ —В–Ї–∞–љ–Є [43,44].
–Ф–Э —Б–њ–Њ—Б–Њ–±–µ–љ –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞—В—М —А–∞–Ј–≤–Є—В–Є–µ –љ–µ–Ї–Њ—В–Њ—А—Л—Е –≤–Є–і–Њ–≤ —В–Ї–∞–љ–µ–≤–Њ–≥–Њ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П, –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –Ї–Њ—В–Њ—А—Л—Е —Г—З–∞—Б—В–≤—Г—О—В –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л. –Ю–љ, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, –њ—А–µ–њ—П—В—Б—В–≤—Г–µ—В –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—О —В–Ї–∞–љ–µ–≤—Л—Е –і–µ—Д–µ–Ї—В–Њ–≤, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –њ—А–µ—Е–Њ–і—П—Й–µ–є –Є—И–µ–Љ–Є–µ–є —В–Ї–∞–љ–Є –њ—А–Є –Њ–њ–µ—А–∞—В–Є–≤–љ—Л—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞—Е [45]. –Э–∞–Ј–љ–∞—З–µ–љ–Є–µ –Ф–Э –±–ї–Њ–Ї–Є—А–Њ–≤–∞–ї–Њ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ –і–µ—Д–µ–Ї—В–Њ–≤ –Љ—Л—И–µ—З–љ–Њ–є —В–Ї–∞–љ–Є, –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ–є —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–є –љ–∞–≥—А—Г–Ј–Ї–Њ–є [46]. –Ф–Э –њ–Њ–і–∞–≤–ї—П–ї —А–∞–Ј–≤–Є—В–Є–µ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞, –≤—Л–Ј–≤–∞–љ–љ–Њ–≥–Њ –Ї–Њ–Љ–њ—А–µ—Б—Б–Є–µ–є –љ–µ—А–≤–љ–Њ–≥–Њ –Ї–Њ—А–µ—И–Ї–∞ –њ—А–Є –≥—А—Л–ґ–µ –і–Є—Б–Ї–∞, –Є –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–ї –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Б–Ї–Њ—А–Њ—Б—В–Є –њ—А–Њ–≤–µ–і–µ–љ–Є—П –≤–Њ–Ј–±—Г–ґ–і–µ–љ–Є—П –њ–Њ –љ–µ—А–≤—Г –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –Ї–Њ–љ—В—А–Њ–ї–µ–Љ [47].
–Я—А–µ–њ–∞—А–∞—В —В–∞–Ї–ґ–µ –≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є —Б—В–µ–њ–µ–љ–Є —Б–і–µ—А–ґ–Є–≤–∞–µ—В –∞–љ–Њ–Љ–∞–ї—М–љ—Г—О –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є—О –≥–ї–∞–і–Ї–Њ–Љ—Л—И–µ—З–љ—Л—Е –Ї–ї–µ—В–Њ–Ї —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б—В–µ–љ–Ї–Є, –Ї–Њ—В–Њ—А–∞—П —П–≤–ї—П–µ—В—Б—П –Њ–і–љ–Є–Љ –Є–Ј –Ј–≤–µ–љ—М–µ–≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П —Б–Њ—Б—Г–і–Њ–≤ [48]. –Т–Њ–Ј–Љ–Њ–ґ–љ–Њ, —А–µ–∞–ї–Є–Ј–∞—Ж–Є–Є —Н—В–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –Ф–Э –Љ–Њ–ґ–µ—В –±–ї–∞–≥–Њ–њ—А–Є—П—В—Б—В–≤–Њ–≤–∞—В—М –µ–≥–Њ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –њ–Њ–і–∞–≤–ї—П—В—М –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –љ–∞—В—А–Є–µ–≤—Л—Е –Ї–∞–љ–∞–ї–Њ–≤ –Љ–Є–Њ–±–ї–∞—Б—В–Њ–≤ [49]. –Я—А–Є –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–Є —Б—Г—Е–Њ–ґ–Є–ї–Є—П, –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –≤ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–µ –њ—А–Є –њ–Њ–Љ–Њ—Й–Є –≤–≤–µ–і–µ–љ–Є—П –Ї–Њ–ї–ї–∞–≥–µ–љ–∞–Ј—Л, –ї–µ—З–µ–љ–Є–µ –Ф–Э —Б–љ–Є–ґ–∞–ї–Њ –љ–∞–Ї–Њ–њ–ї–µ–љ–Є–µ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Ї–ї–µ—В–Њ–Ї (–љ–µ–є—В—А–Њ—Д–Є–ї–Њ–≤ –Є –Љ–∞–Ї—А–Њ—Д–∞–≥–Њ–≤) –≤ –Њ–Ї–Њ–ї–Њ—Б—Г—Е–Њ–ґ–Є–ї—М–љ–Њ–є –Ј–Њ–љ–µ [50].
–Я–Њ–Љ–Є–Љ–Њ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є, –Ф–Э –Њ–±–ї–∞–і–∞–µ—В –Є –Љ–Њ—Й–љ—Л–Љ –∞–љ–∞–ї—М–≥–µ—В–Є—З–µ—Б–Ї–Є–Љ –њ–Њ—В–µ–љ—Ж–Є–∞–ї–Њ–Љ, –љ–µ —Б–≤—П–Ј–∞–љ–љ—Л–Љ —Б –µ–≥–Њ –≤–ї–Є—П–љ–Є–µ–Љ –љ–∞ –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ [51]. –Ю–љ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –љ–∞ —А–∞–Ј–ї–Є—З–љ—Л–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –≤–Њ—Б–њ—А–Є—П—В–Є—П –±–Њ–ї–µ–≤—Л—Е –Њ—Й—Г—Й–µ–љ–Є–є, –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–µ –њ–Њ–і–∞–≤–ї–µ–љ–Є–µ –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ —А–∞–Ј–ї–Є—З–љ–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–Є. –Я—А–µ–њ–∞—А–∞—В –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –Ї–∞–Ї —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–µ, —В–∞–Ї –Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–µ –∞–љ—В–Є–љ–Њ—Ж–Є—Ж–µ–њ—В–Є–≤–љ–Њ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ. –¶–µ–љ—В—А–∞–ї—М–љ–∞—П –∞–љ–∞–ї—М–≥–µ—В–Є—З–µ—Б–Ї–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Ф–Э –Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–∞ –Њ–њ–Є–Њ–Є–і–љ—Л–Љ–Є —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є. –≠—В–Њ—В —Н—Д—Д–µ–Ї—В –±–ї–Њ–Ї–Є—А—Г–µ—В—Б—П –љ–∞–ї–Њ–Ї—Б–Њ–љ–Њ–Љ [52,53]. –Ю–љ, –њ–Њ––≤–Є–і–Є–Љ–Њ–Љ—Г, —Б–≤—П–Ј–∞–љ —Б –≤–ї–Є—П–љ–Є–µ–Љ –Ф–Э –љ–∞ –Њ–±–Љ–µ–љ —В—А–Є–њ—В–Њ—Д–∞–љ–∞. –Я–Њ—Б–ї–µ –≤–≤–µ–і–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –≥–Њ–ї–Њ–≤–љ–Њ–Љ –Љ–Њ–Ј–≥–µ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –њ–Њ–≤—Л—И–∞–µ—В—Б—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –Љ–µ—В–∞–±–Њ–ї–Є—В–Њ–≤ —В—А–µ–њ—В–Њ—Д–∞–љ–∞, —Б–њ–Њ—Б–Њ–±–љ—Л—Е —Г–Љ–µ–љ—М—И–∞—В—М –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В—М –±–Њ–ї–µ–≤—Л—Е –Њ—Й—Г—Й–µ–љ–Є–є [54]. –Э–µ –Є—Б–Ї–ї—О—З–µ–љ–Њ, —З—В–Њ –∞–љ–∞–ї—М–≥–µ—В–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В –Ф–Э –Њ—В—З–∞—Б—В–Є –Њ–±—К—П—Б–љ—П–µ—В—Б—П –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ –љ–∞ –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –≤–Њ–Ј–±—Г–ґ–і–µ–љ–Є—П –љ–∞ —Б–њ–Є–љ–∞–ї—М–љ–Њ–Љ –Є —Б—Г–њ—А–∞—Б–њ–Є–љ–∞–ї—М–љ–Њ–Љ —Г—А–Њ–≤–љ—П—Е [55–57].
–Ь–µ—Б—В–љ—Л–µ –∞–њ–њ–ї–Є–Ї–∞—Ж–Є–Є –Ф–Э –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Б–љ–Є–ґ–∞—О—В –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М –±–Њ–ї–µ–≤—Л—Е –Њ—Й—Г—Й–µ–љ–Є–є –њ—А–Є–Љ–µ—А–љ–Њ —З–µ—А–µ–Ј —З–∞—Б –њ–Њ—Б–ї–µ –љ–∞–љ–µ—Б–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –љ–∞ –њ–Њ—А–∞–ґ–µ–љ–љ—Л–є —Г—З–∞—Б—В–Њ–Ї [58]. –Я—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –Ф–Э –≤–љ—Г—В—А—М –Њ–±–µ–Ј–±–Њ–ї–Є–≤–∞—О—Й–Є–є —Н—Д—Д–µ–Ї—В –±—Л–ї –Ј–∞—Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ —З–µ—А–µ–Ј 1–3 —З. –Ы–Њ–Ї–∞–ї—М–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ —З–µ—А–µ–Ј 1 —З –њ–Њ—Б–ї–µ –µ–≥–Њ –љ–∞–љ–µ—Б–µ–љ–Є—П –љ–∞ –Ї–Њ–ґ—Г –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–ї–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї—Г—О –µ–≥–Њ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О –≤ –Ј–Њ–љ–µ –њ–Њ—А–∞–ґ–µ–љ–Є—П –Є –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–є —Н—Д—Д–µ–Ї—В, —З–µ–Љ –њ—А–Є–µ–Љ –µ–≥–Њ –≤–љ—Г—В—А—М. –Ю–і–љ–∞–Ї–Њ —З–µ—А–µ–Ј 2–2,5 —З –Њ—А–∞–ї—М–љ—Л–є —Б–њ–Њ—Б–Њ–± –≤–≤–µ–і–µ–љ–Є—П —Г–ґ–µ –њ—А–µ–≤–Њ—Б—Е–Њ–і–Є–ї –њ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –ї–Њ–Ї–∞–ї—М–љ—Г—О —В–µ—А–∞–њ–Є—О. –І–µ—А–µ–Ј 3 —З –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –≤–љ—Г—В—А—М –Њ–±–µ–Ј–±–Њ–ї–Є–≤–∞—О—Й–Є–є —Н—Д—Д–µ–Ї—В –Ф–Э –±—Л–ї –≤ 1,7 —А–∞–Ј–∞ —Б–Є–ї—М–љ–µ–µ, —З–µ–Љ –њ—А–Є –Љ–µ—Б—В–љ–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є, —З—В–Њ –Љ–Њ–ґ–µ—В –±—Л—В—М —Б–≤—П–Ј–∞–љ–Њ —Б —Ж–µ–љ—В—А–∞–ї—М–љ—Л–Љ –∞–љ—В–Є–љ–Њ—Ж–Є—Ж–µ–њ—В–Є–≤–љ—Л–Љ –і–µ–є—Б—В–≤–Є–µ–Љ.
–Ы–Њ–Ї–∞–ї—М–љ—Л–є –∞–љ—В–Є–љ–Њ—Ж–Є—Ж–µ–њ—В–Є–≤–љ—Л–є —Н—Д—Д–µ–Ї—В –Ф–Э, –њ–Њ––≤–Є–і–Є–Љ–Њ–Љ—Г, –љ–µ —Б–≤—П–Ј–∞–љ —Б –µ–≥–Њ –≤–ї–Є—П–љ–Є–µ–Љ –љ–∞ —Б–Є–љ—В–µ–Ј –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –љ–∞ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л—Е –Љ–Њ–і–µ–ї—П—Е –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –Љ–µ—Б—В–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —В–∞–Ї–Є—Е –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ —Б–Є–љ—В–µ–Ј–∞ –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤, –Ї–∞–Ї –Є–љ–і–Њ–Љ–µ—В–∞—Ж–Є–љ –Є —Ж–µ–ї–µ–Ї–Њ–Ї—Б–Є–±, –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –Ф–Э, –љ–µ –њ–Њ–Ј–≤–Њ–ї—П–ї–Њ –і–Њ–±–Є—В—М—Б—П –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–≥–Њ –∞–љ–∞–ї—М–≥–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ [59,60]. –Я–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–µ –Њ–±–µ–Ј–±–Њ–ї–Є–≤–∞—О—Й–µ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –Ф–Э –љ–µ —Б–≤—П–Ј–∞–љ–Њ —Б –Њ–њ–Є–Њ–Є–і–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –љ–µ —Г—Б—В—А–∞–љ—П–µ—В—Б—П –љ–∞–ї–Њ–Ї—Б–Њ–љ–Њ–Љ. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —Б–Њ–µ–і–Є–љ–µ–љ–Є–є, –±–ї–Њ–Ї–Є—А—Г—О—Й–Є—Е –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ NO –Є –∞–Ї—В–Є–≤–∞—Ж–Є—О –≥—Г–∞–љ–Є–ї–∞—В—Ж–Є–Ї–ї–∞–Ј—Л, –њ–Њ–і–∞–≤–ї—П–ї–Њ –∞–љ–∞–ї—М–≥–µ—В–Є—З–µ—Б–Ї–Њ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –Ф–Э. –Я–Њ–і–Њ–±–љ—Л–є —Н—Д—Д–µ–Ї—В –і–∞–≤–∞–ї–Є —В–∞–Ї–ґ–µ –Є–љ–≥–Є–±–Є—В–Њ—А—Л —А–∞–Ј–ї–Є—З–љ—Л—Е —В–Є–њ–Њ–≤ –Ї–∞–ї–Є–µ–≤—Л—Е –Ї–∞–љ–∞–ї–Њ–≤ [59,61,62]. –Т –Ї—Г–ї—М—В—Г—А–µ –Ї–ї–µ—В–Њ–Ї –Љ–Њ–Ј–ґ–µ—З–Ї–∞ –Ї—А—Л—Б—Л –Ф–Э —Г—Б–Є–ї–Є–≤–∞–ї –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Ї–∞–ї–Є–µ–≤—Л—Е –Ї–∞–љ–∞–ї–Њ–≤, –њ–Њ–≤—Л—И–∞—П –≤—Л—Е–Њ–і –Ї–∞–ї–Є—П –Є–Ј –Ї–ї–µ—В–Ї–Є [63]. –≠—В–Є —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ–Њ–Ј–≤–Њ–ї—П—О—В –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В—М, —З—В–Њ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є–є –∞–љ—В–Є–љ–Њ—Ж–Є—Ж–µ–њ—В–Є–≤–љ—Л–є —Н—Д—Д–µ–Ї—В –Ф–Э –Љ–Њ–ґ–µ—В –±—Л—В—М —Б–≤—П–Ј–∞–љ —Б –∞–Ї—В–Є–≤–∞—Ж–Є–µ–є –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е —В–Є–њ–Њ–≤ –Ї–∞–ї–Є–µ–≤—Л—Е –Ї–∞–љ–∞–ї–Њ–≤, –њ—А–Њ–Є—Б—Е–Њ–і—П—Й–µ–є —Б —Г—З–∞—Б—В–Є–µ–Љ NO –Є —Ж–Є–Ї–ї–Њ––У–Ь–§. –≠—В–Њ –Љ–Њ–ґ–µ—В –њ—А–Є–≤–Њ–і–Є—В—М –Ї –≥–Є–њ–µ—А–њ–Њ–ї—П—А–Є–Ј–∞—Ж–Є–Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е —В–µ—А–Љ–Є–љ–∞–ї–Њ–≤ –∞—Д—Д–µ—А–µ–љ—В–љ—Л—Е –љ–µ—А–≤–љ—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ.
–Ф–Э –њ–Њ—Б—В—Г–њ–Є–ї –≤ –∞–њ—В–µ—З–љ—Г—О —Б–µ—В—М –≤ 1974 –≥. –С–ї–∞–≥–Њ–і–∞—А—П –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є –Є –∞–љ–∞–ї—М–≥–µ—В–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Њ–љ —Б—А–∞–Ј—Г –њ—А–Є–≤–ї–µ–Ї –≤–љ–Є–Љ–∞–љ–Є–µ –Ї–ї–Є–љ–Є—Ж–Є—Б—В–Њ–≤ –Є –Ј–∞–љ—П–ї –≤–Є–і–љ–Њ–µ –Љ–µ—Б—В–Њ –≤ –ї–µ—З–µ–љ–Є–Є —А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –±–Њ–ї–µ–Ј–љ–µ–є, —Г–≤–µ—А–µ–љ–љ–Њ –њ–Њ—В–µ—Б–љ–Є–≤ –њ—А–Є–Љ–µ–љ—П–≤—И–Є–µ—Б—П –≤ —В–Њ—В –њ–µ—А–Є–Њ–і –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В—Л. –Ч–∞ –≤—А–µ–Љ—П, –њ—А–Њ—И–µ–і—И–µ–µ —Б –Љ–Њ–Љ–µ–љ—В–∞ –µ–≥–Њ –≤–љ–µ–і—А–µ–љ–Є—П –≤ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–µ –Ј–і—А–∞–≤–Њ–Њ—Е—А–∞–љ–µ–љ–Є–µ, –љ–∞–Ї–Њ–њ–ї–µ–љ –Њ–≥—А–Њ–Љ–љ—Л–є –Њ–њ—Л—В –µ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –≤ –ї–µ—З–µ–љ–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –≤–Є–і–∞–Љ–Є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –Њ–њ–Њ—А–љ–Њ––і–≤–Є–≥–∞—В–µ–ї—М–љ–Њ–≥–Њ –∞–њ–њ–∞—А–∞—В–∞. –Т—Л—Б–Њ–Ї–∞—П —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Ф–Э –±—Л–ї–∞ –Ј–∞—Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–∞ –њ—А–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е —Б—Г—Б—В–∞–≤–Њ–≤, –Њ—Б—В–µ–Њ–∞—А—В—А–Њ–Ј–µ, –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е –Њ–Ї–Њ–ї–Њ—Б—Г—Б—В–∞–≤–љ—Л—Е –Љ—П–≥–Ї–Є—Е —В–Ї–∞–љ–µ–є.
–Т –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –Є—Б–њ—Л—В–∞–љ–Є—П—Е –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Ф–Э –±–Њ–ї—М–љ—Л–Љ –†–Р –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –∞—А—В—А–∞–ї–≥–Є–є, —Г—В—А–µ–љ–љ–µ–є —Б–Ї–Њ–≤–∞–љ–љ–Њ—Б—В–Є, –њ—А–Є–њ—Г—Е–ї–Њ—Б—В–Є —Б—Г—Б—В–∞–≤–Њ–≤ –Є –±–Њ–ї–µ–Ј–љ–µ–љ–љ–Њ—Б—В–Є –Є—Е –њ—А–Є –њ–∞–ї—М–њ–∞—Ж–Є–Є [64–66]. –Я–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–∞—П –і–Є–љ–∞–Љ–Є–Ї–∞ —Н—В–Є—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–∞—Б—М –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–Љ —Г–ї—Г—З—И–µ–љ–Є–µ–Љ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ —Б—В–∞—В—Г—Б–∞ –±–Њ–ї—М–љ—Л—Е [67–69]. –Я—А–Є —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–Љ –∞–љ–∞–ї–Є–Ј–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ф–Э –Є –і—А—Г–≥–Є—Е –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Э–Я–Т–Я –±—Л–ї–Є –Ј–∞—Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ—Л –≤ —Ж–µ–ї–Њ–Љ —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л [70–72]. –Я–Њ –љ–µ–Ї–Њ—В–Њ—А—Л–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ –Ф–Э –≤ —Н—В–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –Њ—В—З–µ—В–ї–Є–≤–Њ –њ—А–µ–≤–Њ—Б—Е–Њ–і–Є–ї –њ—А–µ–њ–∞—А–∞—В—Л —Б—А–∞–≤–љ–µ–љ–Є—П [64,73–75].
–£ –±–Њ–ї—М–љ—Л—Е —О–≤–µ–љ–Є–ї—М–љ—Л–Љ —А–µ–≤–Љ–∞—В–Њ–Є–і–љ—Л–Љ –∞—А—В—А–Є—В–Њ–Љ –Ф–Э –њ–Њ–Ј–≤–Њ–ї—П–ї –і–Њ–±–Є—В—М—Б—П —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ —Г–ї—Г—З—И–µ–љ–Є—П –і–∞–ґ–µ –≤ —В–µ—Е —Б–ї—Г—З–∞—П—Е, –Ї–Њ–≥–і–∞ –і—А—Г–≥–Є–µ –Э–Я–Т–Я –±—Л–ї–Є –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ—Л [76]. –•–Њ—А–Њ—И–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –Ф–Э –±–Њ–ї—М–љ—Л–Љ —Б –њ–Њ–і–∞–≥—А–Є—З–µ—Б–Ї–Є–Љ –∞—А—В—А–Є—В–Њ–Љ [77]. –Р–≤—В–Њ—А—Л, –Є–Ј—Г—З–∞–≤—И–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Ф–Э –њ—А–Є –∞–љ–Ї–Є–ї–Њ–Ј–Є—А—Г—О—Й–µ–Љ —Б–њ–Њ–љ–і–Є–ї–Њ–∞—А—В—А–Є—В–µ, –љ–∞–±–ї—О–і–∞–ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Г–ї—Г—З—И–µ–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–Є –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Є–Ї–∞ [78,79,80]. –Я—А–Є —Н—В–Њ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–Є –Ф–Э –њ–Њ–Ї–∞–Ј–∞–ї —В–∞–Ї—Г—О –ґ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М, –Ї–∞–Ї –Є–љ–і–Њ–Љ–µ—В–∞—Ж–Є–љ, –љ–Њ –≤—Л–Ј—Л–≤–∞–ї –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –Љ–µ–љ—М—И–µ –њ–Њ–±–Њ—З–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є.
–£ –њ–Њ–і–∞–≤–ї—П—О—Й–µ–≥–Њ –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –±–Њ–ї—М–љ—Л—Е –Њ—Б—В–µ–Њ–∞—А—В—А–Њ–Ј–Њ–Љ –Ф–Э –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–ї —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–µ –њ–Њ–і–∞–≤–ї–µ–љ–Є–µ –±–Њ–ї–µ–є [81,82,83]. –Ю–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –Њ—В—З–µ—В–ї–Є–≤–Њ–µ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ —Б–њ–∞—Б—В–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є [84,85]. –Э–∞–Ј–љ–∞—З–µ–љ–Є–µ –Ф–Э –њ–Њ–Ј–≤–Њ–ї—П–ї–Њ –≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є –Љ–µ—А–µ —Б–Ї–Њ—А—А–µ–Ї—В–Є—А–Њ–≤–∞—В—М –Є–Љ–µ–≤—И–Є–µ—Б—П —Г –±–Њ–ї—М–љ—Л—Е —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П [84,86,87]. –Ф–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Г–ї—Г—З—И–µ–љ–Є–µ —Д–Є–Ї—Б–Є—А–Њ–≤–∞–ї–Њ—Б—М —В–∞–Ї–ґ–µ –њ–Њ –Љ–љ–µ–љ–Є—О –≤—А–∞—З–∞ –Є –±–Њ–ї—М–љ–Њ–≥–Њ [87,88]. –Я–Њ—Б–ї–µ 3 –Љ–µ—Б—П—Ж–µ–≤ —А–µ–≥—Г–ї—П—А–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –Ф–Э —Г –±–Њ–ї—М–љ—Л—Е –Ю–Р –љ–∞–±–ї—О–і–∞–ї–∞—Б—М –і–Њ—Б—В–Њ–≤–µ—А–љ–∞—П –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–∞—П –і–Є–љ–∞–Љ–Є–Ї–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–Є—Е –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ [89]. –≠—В–Њ—В —Н—Д—Д–µ–Ї—В –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г—Б–Є–ї–Є–≤–∞–ї—Б—П –њ–Њ—Б–ї–µ 6 –Љ–µ—Б—П—Ж–µ–≤ –ї–µ—З–µ–љ–Є—П. –Я—А–Є –Ю–Р –Ф–Э –њ–Њ–Ї–∞–Ј–∞–ї —Е–Њ—А–Њ—И–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Ї–∞–Ї —Г –±–Њ–ї—М–љ—Л—Е —Б –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е —Б—Г—Б—В–∞–≤–Њ–≤, —В–∞–Ї –Є –њ—А–Є –і–µ–≥–µ–љ–µ—А–∞—В–Є–≤–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є—П—Е –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Є–Ї–∞ [82,84,90]. –Я—А–Є —Б—А–∞–≤–љ–µ–љ–Є–Є –Ф–Э —Б –і—А—Г–≥–Є–Љ–Є –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–Љ–Є –Э–Я–Т–Я –≤ –ї–µ—З–µ–љ–Є–Є –Ю–Р –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л –≤ —Ж–µ–ї–Њ–Љ —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л [86,88,91]. –Я—А–Є —Н—В–Њ–Љ –Ф–Э —А–µ–ґ–µ, —З–µ–Љ –і—А—Г–≥–Є–µ –њ—А–µ–њ–∞—А–∞—В—Л –њ—А–Є—Е–Њ–і–Є–ї–Њ—Б—М –Њ—В–Љ–µ–љ—П—В—М –Є–Ј––Ј–∞ –Њ—В—Б—Г—В—Б—В–≤–Є—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Г–ї—Г—З—И–µ–љ–Є—П [81].
–Я–Њ––≤–Є–і–Є–Љ–Њ–Љ—Г, –≤—Л—Б–Њ–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Ф–Э –њ—А–Є –Ю–Р –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–∞ —Б–Њ—З–µ—В–∞–љ–љ—Л–Љ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ –Є –∞–љ–∞–ї—М–≥–µ—В–Є—З–µ—Б–Ї–Є–Љ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ. –Т—В–Њ—А–Є—З–љ—Л–є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б –Є–≥—А–∞–µ—В –±–Њ–ї—М—И—Г—О —А–Њ–ї—М –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –њ—А–Є –Ю–Р [92]. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ, —Б—З–Є—В–∞–ї–Њ—Б—М, —З—В–Њ –њ–∞—А–∞—Ж–µ—В–∞–Љ–Њ–ї, –Њ–±–ї–∞–і–∞—О—Й–Є–є –∞–љ–∞–ї—М–≥–µ—В–Є—З–µ—Б–Ї–Њ–є, –љ–Њ –љ–µ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О, –Љ–Њ–ґ–µ—В –±—Л—В—М –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –≤—Л–±–Њ—А–∞ —Г –±–Њ–ї—М–љ—Л—Е –Ю–Р [93,94]. –Э–µ —В–∞–Ї –і–∞–≤–љ–Њ –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ –±–µ–Ј—Г—Б–ї–Њ–≤–љ–Њ–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ –Ф–Э –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —З–Є—Б—В–Њ –∞–љ–∞–ї—М–≥–µ—В–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–µ–є –≤ –ї–µ—З–µ–љ–Є–Є –Ю–Р [95].
–Я—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –Ф–Э –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ –Њ–Ї–Њ–ї–Њ—Б—Г—Б—В–∞–≤–љ—Л—Е –Љ—П–≥–Ї–Є—Е —В–Ї–∞–љ–µ–є (—Б—Г–±–∞–Ї—А–Њ–Љ–Є–∞–ї—М–љ—Л–Љ –±—Г—А—Б–Є—В–Њ–Љ, —В–µ–љ–і–Є–љ–Є—В–Њ–Љ –≤—А–∞—Й–∞—В–µ–ї—М–љ–Њ–є –Љ–∞–љ–ґ–µ—В–Ї–Є, —Н–њ–Є–Ї–Њ–љ–і–Є–ї–Є—В–Њ–Љ) –љ–∞–±–ї—О–і–∞–ї–∞—Б—М –≤—Л—А–∞–ґ–µ–љ–љ–∞—П –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–∞—П –і–Є–љ–∞–Љ–Є–Ї–∞ –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –Є —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–µ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є [96–98]. –Т —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е —Г –±–Њ–ї—М–љ—Л—Е —Б –њ–µ—А–Є–∞—А—В—А–Є—В–∞–Љ–Є –Њ–љ –±—Л–ї —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ –њ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Б –Є–±—Г–њ—А–Њ—Д–µ–љ–Њ–Љ, –љ–∞–њ—А–Њ–Ї—Б–µ–љ–Њ–Љ, –љ–Є–Љ–µ—Б—Г–ї–Є–і–Њ–Љ [99–101]. –Ф–Э –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ –Ї—Г–њ–Є—А–Њ–≤–∞—В—М –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї—Г—О —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї—Г —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –±–Њ–ї—П–Љ–Є –≤ –љ–Є–ґ–љ–µ–є —З–∞—Б—В–Є —Б–њ–Є–љ—Л [102,103].
–Я—А–Є –Є–Ј—Г—З–µ–љ–Є–Є —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Ф–Э —Г 7438 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–≤—И–Є–Љ–Є—Б—П –±–Њ–ї–µ–≤—Л–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ, –≤ —Г—Б–ї–Њ–≤–Є—П—Е –њ–Њ–≤—Б–µ–і–љ–µ–≤–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–Є –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –≤ –њ–Њ–і–∞–≤–ї—П—О—Й–µ–Љ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ —Н—Д—Д–µ–Ї—В –ї–µ—З–µ–љ–Є—П –±—Л–ї –≤–њ–Њ–ї–љ–µ –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–Љ [104]. –Я—А–Є–Љ–µ—А–љ–Њ –≤ –њ–Њ–ї–Њ–≤–Є–љ–µ —Б–ї—Г—З–∞–µ–≤ –Њ—В–Љ–µ–љ–∞ –Ф–Э –±—Л–ї–∞ —Б–≤—П–Ј–∞–љ–∞ —Б –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–µ–є —Б–∞–Љ–Њ—З—Г–≤—Б—В–≤–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Я–Њ –і–∞–љ–љ—Л–Љ –Љ–µ—В–∞––∞–љ–∞–ї–Є–Ј–∞, –ї–µ—З–µ–љ–Є–µ –Ф–Э –±—Л–ї–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ —Г 77,1% –±–Њ–ї—М–љ—Л—Е —Б –†–Р –Є –Ю–Р [105]. –Т—Л—Б–Њ–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Ф–Э –њ–Њ–Ј–≤–Њ–ї–Є–ї–∞ –µ–Љ—Г –Ј–∞–≤–Њ–µ–≤–∞—В—М —И–Є—А–Њ–Ї–Њ–µ –њ—А–Є–Ј–љ–∞–љ–Є–µ –≤—А–∞—З–µ–є –Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є —Б—В–∞—В—М –Њ–і–љ–Є–Љ –Є–Ј –љ–∞–Є–±–Њ–ї–µ–µ –њ–Њ–њ—Г–ї—П—А–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Б–≤–Њ–µ–≥–Њ –Ї–ї–∞—Б—Б–∞ [106–108].
–Т–њ–Њ–ї–љ–µ –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л –Є –њ—А–Є –∞–љ–∞–ї–Є–Ј–µ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Ф–Э. –•–Њ—А–Њ—И–∞—П –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М, –Њ—В–Љ–µ—З–∞–≤—И–∞—П—Б—П –њ—А–Є —А–µ–≥—Г–ї—П—А–љ–Њ–Љ –њ—А–Є–µ–Љ–µ –њ—А–µ–њ–∞—А–∞—В–∞, –њ–Њ–Ј–≤–Њ–ї—П–ї–∞ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞—В—М –µ–≥–Њ –і–ї—П –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П [109,110]. –Ф–Э –≤—Л–Ј—Л–≤–∞–ї –Љ–µ–љ—М—И–µ –њ–Њ–±–Њ—З–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є, —З–µ–Љ –Є–љ–і–Њ–Љ–µ—В–∞—Ж–Є–љ, –љ–∞–њ—А–Њ–Ї—Б–µ–љ, –∞—Ж–µ—В–Є–ї—Б–∞–ї–Є—Ж–Є–ї–Њ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞ [111–113]. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ, —Г —З–∞—Б—В–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –ї–µ—З–µ–љ–Є–µ –њ—А–Є—Е–Њ–і–Є–ї–Њ—Б—М –њ—А–µ–Ї—А–∞—Й–∞—В—М –Є–Ј––Ј–∞ –њ–Њ–±–Њ—З–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є. –Ъ–∞–Ї –њ—А–∞–≤–Є–ї–Њ, —Н—В–Њ –±—Л–ї–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Б–Њ —Б—В–Њ—А–Њ–љ—Л –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ (–Ц–Ъ–Ґ). –І–∞—Б—В–Њ—В–∞ —В–∞–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–Љ–µ–љ—М—И–∞–ї–∞—Б—М –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –Ф–Э –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –Љ–Є–Ј–Њ–њ—А–Њ—Б—В–Њ–ї–Њ–Љ [114].
–Я–Њ—П–≤–ї–µ–љ–Є–µ —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –¶–Ю–У–2 –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Б–љ–Є–Ј–Є—В—М —А–Є—Б–Ї –њ–Њ—А–∞–ґ–µ–љ–Є—П –Ц–Ъ–Ґ –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є. –Т —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ—Л—Е –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ –¶–Ю–У–2 –Є–љ–≥–Є–±–Є—В–Њ—А—Л —А–µ–ґ–µ –≤—Л–Ј—Л–≤–∞–ї–Є –њ–Њ–±–Њ—З–љ—Л–µ —А–µ–∞–Ї—Ж–Є–Є —Б–Њ —Б—В–Њ—А–Њ–љ—Л –Ц–Ъ–Ґ, —З–µ–Љ –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л, –≤–Ї–ї—О—З–∞—П –Ф–Э [115–117]. –Ю–і–љ–∞–Ї–Њ —Н—В–Є —А–∞–Ј–ї–Є—З–Є—П –≤—Л—П–≤–ї—П–ї–Є—Б—М –љ–µ –≤—Б–µ–≥–і–∞. –Я—А–Є —Б—А–∞–≤–љ–µ–љ–Є–Є –Ф–Э —Б —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–Љ –¶–Ю–У–2 –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–Љ —Н—В–Њ—А–Є–Ї–Њ–Ї—Б–Є–±–Њ–Љ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є –њ–Њ —З–∞—Б—В–Њ—В–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л—Е –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є —Б–Њ —Б—В–Њ—А–Њ–љ—Л –Ц–Ъ–Ґ –Љ–µ–ґ–і—Г –љ–Є–Љ–Є –љ–µ –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М [118,119]. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –њ–Њ–±–Њ—З–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –¶–Ю–У–2 –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –Љ–Њ–ґ–µ—В —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—В—М—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П. –Т–µ—А–Њ—П—В–љ–Њ, —Г —З–∞—Б—В–Є –±–Њ–ї—М–љ—Л—Е —Б–Њ—Е—А–∞–љ–µ–љ–Є–µ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –¶–Ю–У–1 —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –њ–Њ–і–і–µ—А–ґ–∞–љ–Є—О –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–Є. –Ю–±—Л—З–љ–Њ –њ—А–Є —Б—А–∞–≤–љ–µ–љ–Є–Є —Н—Д—Д–µ–Ї—В–∞ –Ф–Э –Є –¶–Ю–У–2 –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –Њ—В–Љ–µ—З–∞–ї–Є—Б—М —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л. –Ю–і–љ–∞–Ї–Њ —А–∞–Ј–ї–Є—З–Є—П –Љ–µ–ґ–і—Г –љ–Є–Љ–Є –Љ–Њ–≥—Г—В –±—Л—В—М –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л –њ—А–Є –≤–Ї–ї—О—З–µ–љ–Є–Є –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±–Њ–ї—М—И–Є—Е –≥—А—Г–њ–њ –±–Њ–ї—М–љ—Л—Е. Hawkey C –Є —Б–Њ–∞–≤—В., —Б–Њ–њ–Њ—Б—В–∞–≤–ї—П–≤—И–Є–µ –Ф–Э –Є –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ –љ–∞ 9323 –њ–∞—Ж–Є–µ–љ—В–∞—Е, –Њ—В–Љ–µ—З–∞—О—В, —З—В–Њ –Ф–Э –±—Л–ї –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–µ–љ –Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —А–µ–ґ–µ –Њ—В–Љ–µ–љ—П–ї—Б—П –Є–Ј––Ј–∞ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є [120].
–Ю—В–µ—З–µ—Б—В–≤–µ–љ–љ—Л–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –Э–Я–Т–Я –њ—А–µ–і—Г—Б–Љ–∞—В—А–Є–≤–∞—О—В –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞–љ–љ—Л–є –њ–Њ–і—Е–Њ–і –Ї –≤—Л–±–Њ—А—Г –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Е–∞—А–∞–Ї—В–µ—А–∞ —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є [121]. –Э–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ –Э–Я–Т–Я –ї—Г—З—И–µ –љ–∞–Ј–љ–∞—З–∞—В—М –њ–∞—Ж–Є–µ–љ—В–∞–Љ, –љ–µ –Є–Љ–µ—О—Й–Є–Љ —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Э–Я–Т–Я––≥–∞—Б—В—А–Њ–њ–∞—В–Є–Є. –Я—А–Є –љ–∞–ї–Є—З–Є–Є —В–∞–Ї–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤ –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л —Б–ї–µ–і—Г–µ—В –њ—А–Є–Љ–µ–љ—П—В—М —В–Њ–ї—М–Ї–Њ –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є –њ—А–Њ—В–Њ–љ–љ–Њ–є –њ–Њ–Љ–њ—Л (–Њ–Љ–µ–њ—А–∞–Ј–Њ–ї–Њ–Љ, –ї–∞–љ—Б–Њ–њ—А–∞–Ј–Њ–ї–Њ–Љ, —Н–Ј–Њ–Љ–µ–њ—А–∞–Ј–Њ–ї–Њ–Љ). –°–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ –¶–Ю–У–2 –Є–љ–≥–Є–±–Є—В–Њ—А—Л —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –≤ –ї–µ—З–µ–љ–Є–Є –±–Њ–ї—М–љ—Л—Е, –Є–Љ–µ—О—Й–Є—Е —Д–∞–Ї—В–Њ—А—Л —А–Є—Б–Ї–∞ –Э–Я–Т–Я––≥–∞—Б—В—А–Њ–њ–∞—В–Є–Є (—П–Ј–≤–µ–љ–љ—Л–є –∞–љ–∞–Љ–љ–µ–Ј, –≤–Њ–Ј—А–∞—Б—В —Б—В–∞—А—И–µ 65 –ї–µ—В, –њ—А–Є–µ–Љ –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј –Э–Я–Т–Я, –і–≤—Г—Е –Є –±–Њ–ї–µ–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Н—В–Њ–є –≥—А—Г–њ–њ—Л, –≤–Ї–ї—О—З–∞—П –љ–Є–Ј–Ї–Є–µ –і–Њ–Ј—Л –∞—Ж–µ—В–Є–ї—Б–∞–ї–Є—Ж–Є–ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л, —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є–є –њ—А–Є–µ–Љ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–Њ–≤ –Є –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–Њ–≤).
–Я–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –≤–љ—Г—В—А—М —В–∞–±–ї–µ—В–Њ–Ї, –њ–Њ–Ї—А—Л—В—Л—Е –Ї–Є—И–µ—З–љ–Њ—А–∞—Б—В–≤–Њ—А–Є–Љ–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Њ–є, –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї –њ–Њ–ї–љ–Њ—Б—В—М—О –≤—Б–∞—Б—Л–≤–∞–µ—В—Б—П –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –Є—Е –њ—А–Њ—Е–Њ–ґ–і–µ–љ–Є—П —З–µ—А–µ–Ј –Ї–Є—И–µ—З–љ–Є–Ї. –•–Њ—В—П –≤—Б–∞—Б—Л–≤–∞–љ–Є–µ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –±—Л—Б—В—А–Њ, –Њ–і–љ–∞–Ї–Њ –µ–≥–Њ –љ–∞—З–∞–ї–Њ –Љ–Њ–ґ–µ—В –±—Л—В—М –Њ—В—Б—А–Њ—З–µ–љ–Њ –Є–Ј-–Ј–∞ –љ–∞–ї–Є—З–Є—П —Г —В–∞–±–ї–µ—В–Ї–Є –Ї–Є—И–µ—З–љ–Њ—А–∞—Б—В–≤–Њ—А–Є–Љ–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є. –Я–Њ—Б–ї–µ –Њ–і–љ–Њ–Ї—А–∞—В–љ–Њ–≥–Њ –њ—А–Є–µ–Љ–∞ 50 –Љ–≥ –њ—А–µ–њ–∞—А–∞—В–∞ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –≤ –њ–ї–∞–Ј–Љ–µ –Њ—В–Љ–µ—З–∞–µ—В—Б—П —З–µ—А–µ–Ј 2 —З–∞—Б–∞ –Є —Б–Њ—Б—В–∞–≤–ї—П–µ—В 1.5 –Љ–Ї–≥/–Љ–ї (5 –Љ–Ї–Љ–Њ–ї—М/–ї). –°—В–µ–њ–µ–љ—М –∞–±—Б–Њ—А–±—Ж–Є–Є –љ–∞—Е–Њ–і–Є—В—Б—П –≤ –њ—А—П–Љ–Њ–є –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –≤–µ–ї–Є—З–Є–љ—Л –і–Њ–Ј—Л. –Т —Б–ї—Г—З–∞–µ –њ—А–Є–µ–Љ–∞ —В–∞–±–ї–µ—В–Ї–Є –њ—А–µ–њ–∞—А–∞—В–∞ –≤–Њ –≤—А–µ–Љ—П –Є–ї–Є –њ–Њ—Б–ї–µ –µ–і—Л, –њ—А–Њ—Е–Њ–ґ–і–µ–љ–Є–µ –µ–µ —З–µ—А–µ–Ј –ґ–µ–ї—Г–і–Њ–Ї –Ј–∞–Љ–µ–і–ї—П–µ—В—Б—П (–њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ—А–Є–µ–Љ–Њ–Љ –љ–∞—В–Њ—Й–∞–Ї), –љ–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –≤—Б–∞—Б—Л–≤–∞—О—Й–µ–≥–Њ—Б—П –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї–∞ –љ–µ –Є–Ј–Љ–µ–љ—П–µ—В—Б—П.
–Ґ.–Ї. –Њ–Ї–Њ–ї–Њ –њ–Њ–ї–Њ–≤–Є–љ—Л –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї–∞ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Є—А—Г–µ—В—Б—П –≤–Њ –≤—А–µ–Љ—П –њ–µ—А–≤–Њ–≥–Њ –њ—А–Њ—Е–Њ–ґ–і–µ–љ–Є—П —З–µ—А–µ–Ј –њ–µ—З–µ–љ—М ("—Н—Д—Д–µ–Ї—В –њ–µ—А–≤–Њ–≥–Њ –њ—А–Њ—Е–Њ–ґ–і–µ–љ–Є—П"), –њ–ї–Њ—Й–∞–і—М –њ–Њ–і –Ї—А–Є–≤–Њ–є «–Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П––≤—А–µ–Љ—П» –≤ —Б–ї—Г—З–∞–µ –њ—А–Є–µ–Љ–∞ –њ—А–µ–њ–∞—А–∞—В–∞ –≤–љ—Г—В—А—М –њ–Њ—З—В–Є –≤ –і–≤–∞ —А–∞–Ј–∞ –Љ–µ–љ—М—И–µ, —З–µ–Љ –≤ —Б–ї—Г—З–∞–µ –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–љ–Њ–є –і–Њ–Ј—Л –њ—А–µ–њ–∞—А–∞—В–∞. –Я–Њ—Б–ї–µ –њ–Њ–≤—В–Њ—А–љ—Л—Е –њ—А–Є–µ–Љ–Њ–≤ –њ—А–µ–њ–∞—А–∞—В–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є–Ї–Є –љ–µ –Є–Ј–Љ–µ–љ—П—О—В—Б—П. –Я–Њ—Н—В–Њ–Љ—Г, –µ—Б–ї–Є —Б–Њ–±–ї—О–і–∞—О—В—Б—П —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ–Љ—Л–µ –Є–љ—В–µ—А–≤–∞–ї—Л –Љ–µ–ґ–і—Г –њ—А–Є–µ–Љ–∞–Љ–Є –Њ—В–і–µ–ї—М–љ—Л—Е –і–Њ–Ј –њ—А–µ–њ–∞—А–∞—В–∞, –Ї—Г–Љ—Г–ї—П—Ж–Є–Є –љ–µ –Њ—В–Љ–µ—З–∞–µ—В—Б—П. –£ –і–µ—В–µ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї–∞ –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–љ—Л—Е –і–Њ–Ј –њ—А–µ–њ–∞—А–∞—В–∞ (–Љ–≥/–Ї–≥ –Љ–∞—Б—Б—Л —В–µ–ї–∞) —Б—Е–Њ–і–љ—Л —Б —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є–Љ–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ–Є —Г –≤–Ј—А–Њ—Б–ї—Л—Е.
–°—Г–і—П –њ–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤—Г –≤—Л–≤–Њ–і–Є–Љ–Њ–≥–Њ —Б –Љ–Њ—З–Њ–є –љ–µ–Є–Ј–Љ–µ–љ–µ–љ–љ–Њ–≥–Њ –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї–∞ –Є –µ–≥–Њ –≥–Є–і—А–Њ–Ї—Б–Є–ї–Є—А–Њ–≤–∞–љ–љ—Л—Е –Љ–µ—В–∞–±–Њ–ї–Є—В–Њ–≤, –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ —В–∞–±–ї–µ—В–Ї–Є –Т–Њ–ї—М—В–∞—А–µ–љ–∞ —А–µ—В–∞—А–і –Є–Ј –љ–µ–µ –≤—Л—Б–≤–Њ–±–Њ–ґ–і–∞–µ—В—Б—П –Є –≤—Б–∞—Б—Л–≤–∞–µ—В—Б—П —В–∞–Ї–Њ–µ –ґ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞, –Ї–∞–Ї –Є –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –Њ–±—Л—З–љ–Њ–є —В–∞–±–ї–µ—В–Ї–Є, –њ–Њ–Ї—А—Л—В–Њ–є –Ї–Є—И–µ—З–љ–Њ—А–∞—Б—В–≤–Њ—А–Є–Љ–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Њ–є. –Ю–і–љ–∞–Ї–Њ —Б–Є—Б—В–µ–Љ–љ–∞—П –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї–∞, –≤—Л—Б–≤–Њ–±–Њ–ґ–і–∞—О—Й–µ–≥–Њ—Б—П –Є–Ј —В–∞–±–ї–µ—В–Њ–Ї —А–µ—В–∞—А–і, —Б–Њ—Б—В–∞–≤–ї—П–µ—В –≤ —Б—А–µ–і–љ–µ–Љ —В–Њ–ї—М–Ї–Њ 82% –Њ—В –Ј–љ–∞—З–µ–љ–Є—П —Н—В–Њ–≥–Њ –ґ–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ —В–∞–±–ї–µ—В–Њ–Ї, –њ–Њ–Ї—А—Л—В—Л—Е –Њ–±–Њ–ї–Њ—З–Ї–Њ–є –≤ —В–Њ–є –ґ–µ –і–Њ–Ј–µ. –≠—В–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ, –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М—О –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї–∞ –≤–Њ –≤—А–µ–Љ—П "–њ–µ—А–≤–Њ–≥–Њ –њ—А–Њ—Е–Њ–ґ–і–µ–љ–Є—П" –Њ—В —Б–Ї–Њ—А–Њ—Б—В–Є –≤—Л–і–µ–ї–µ–љ–Є—П –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞ –Є–Ј –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–є —Д–Њ—А–Љ—Л. –Ґ.–Ї. –∞–Ї—В–Є–≤–љ–Њ–µ –≤–µ—Й–µ—Б—В–≤–Њ –≤—Л–і–µ–ї—П–µ—В—Б—П –Є–Ј —В–∞–±–ї–µ—В–Ї–Є —А–µ—В–∞—А–і –Љ–µ–і–ї–µ–љ–љ–µ–µ, —В–Њ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї–∞ –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є –Љ–µ–љ—М—И–µ, —З–µ–Љ –≤ —Б–ї—Г—З–∞–µ –њ—А–Є–µ–Љ–∞ —В–∞–±–ї–µ—В–Ї–Є, –њ–Њ–Ї—А—Л—В–Њ–є –Ї–Є—И–µ—З–љ–Њ—А–∞—Б—В–≤–Њ—А–Є–Љ–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Њ–є.
–Я–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ —В–∞–±–ї–µ—В–Ї–Є —А–µ—В–∞—А–і, —Б–Њ–і–µ—А–ґ–∞—Й–µ–є 100 –Љ–≥ –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞, —Б—А–µ–і–љ–µ–µ –Ј–љ–∞—З–µ–љ–Є–µ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –µ–≥–Њ –≤ –њ–ї–∞–Ј–Љ–µ –і–Њ—Б—В–Є–≥–∞–µ—В—Б—П –≤ —Б—А–µ–і–љ–µ–Љ —З–µ—А–µ–Ј 4 —З–∞—Б–∞ –Є —Б–Њ—Б—В–∞–≤–ї—П–µ—В 0,5 –Љ–Ї–≥/–Љ–ї (1,6 –Љ–Ї–Љ–Њ–ї—М/–ї). –Я—А–Є–µ–Љ –њ–Є—Й–Є –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ –≤—Б–∞—Б—Л–≤–∞–љ–Є–µ –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞ –Є–Ј —В–∞–±–ї–µ—В–Њ–Ї —А–µ—В–∞—А–і –Є –µ–≥–Њ —Б–Є—Б—В–µ–Љ–љ—Г—О –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М.
–Ю–і–љ–∞–Ї–Њ, –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ —В–∞–±–ї–µ—В–Ї–Є —А–µ—В–∞—А–і, —Б–Њ–і–µ—А–ґ–∞—Й–µ–є 100 –Љ–≥ –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞, —Б—А–µ–і–љ—П—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –µ–≥–Њ –≤ –њ–ї–∞–Ј–Љ–µ, —Б–Њ—Б—В–∞–≤–ї—П—О—Й–∞—П 13 –љ–≥/–Љ–ї (40 –љ–Љ–Њ–ї—М/–ї), —Б–Њ—Е—А–∞–љ—П–µ—В—Б—П –≤ —В–µ—З–µ–љ–Є–µ 24 —З–∞—Б–Њ–≤. –°—В–µ–њ–µ–љ—М –∞–±—Б–Њ—А–±—Ж–Є–Є –љ–∞—Е–Њ–і–Є—В—Б—П –≤ –њ—А—П–Љ–Њ–є –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –≤–µ–ї–Є—З–Є–љ—Л –і–Њ–Ј—Л –њ—А–µ–њ–∞—А–∞—В–∞.
–Ґ–∞–Ї –Ї–∞–Ї –њ—А–Є –њ–µ—А–≤–Њ–Љ –њ—А–Њ—Е–Њ–ґ–і–µ–љ–Є–Є —З–µ—А–µ–Ј –њ–µ—З–µ–љ—М –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Є—А—Г–µ—В—Б—П –Њ–Ї–Њ–ї–Њ –њ–Њ–ї–Њ–≤–Є–љ—Л –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї–∞, –њ–ї–Њ—Й–∞–і—М –њ–Њ–і –Ї—А–Є–≤–Њ–є «–Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П––≤—А–µ–Љ—П» –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ —В–∞–±–ї–µ—В–Њ–Ї —А–µ—В–∞—А–і –њ–Њ—З—В–Є –≤ –і–≤–∞ —А–∞–Ј–∞ –Љ–µ–љ—М—И–µ, —З–µ–Љ –≤ —Б–ї—Г—З–∞–µ –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–љ–Њ–є –і–Њ–Ј—Л –њ—А–µ–њ–∞—А–∞—В–∞.
–Я–Њ—Б–ї–µ –њ–Њ–≤—В–Њ—А–љ—Л—Е –њ—А–Є–µ–Љ–Њ–≤ –њ—А–µ–њ–∞—А–∞—В–∞ —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –љ–µ –Є–Ј–Љ–µ–љ—П—О—В—Б—П. –Я—А–Є —Г—Б–ї–Њ–≤–Є–Є —Б–Њ–±–ї—О–і–µ–љ–Є—П —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ–Љ—Л—Е –Є–љ—В–µ—А–≤–∞–ї–Њ–≤ –Љ–µ–ґ–і—Г –њ–Њ–≤—В–Њ—А–љ—Л–Љ–Є –њ—А–Є–µ–Љ–∞–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞ –Ї—Г–Љ—Г–ї—П—Ж–Є–Є –љ–µ –Њ—В–Љ–µ—З–∞–µ—В—Б—П. –С–∞–Ј–∞–ї—М–љ–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї–∞, –Њ–њ—А–µ–і–µ–ї—П–µ–Љ–∞—П —Г—В—А–Њ–Љ –њ–µ—А–µ–і –њ—А–Є–µ–Љ–Њ–Љ –Њ—З–µ—А–µ–і–љ–Њ–є –і–Њ–Ј—Л, —Б–Њ—Б—В–∞–≤–ї—П–µ—В –Њ–Ї–Њ–ї–Њ 22 –љ–≥/–Љ–ї (70 –љ–Љ–Њ–ї—М/–ї) –≤–Њ –≤—А–µ–Љ—П –ї–µ—З–µ–љ–Є—П –Т–Њ–ї—М—В–∞—А–µ–љ–Њ–Љ —А–µ—В–∞—А–і –≤ –і–Њ–Ј–µ 100 –Љ–≥ 1 —А–∞–Ј –≤ —Б—Г—В–Ї–Є.
–Т—Б–∞—Б—Л–≤–∞–љ–Є–µ –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї–∞ –Є–Ј —А–µ–Ї—В–∞–ї—М–љ—Л—Е —Б—Г–њ–њ–Њ–Ј–Є—В–Њ—А–Є–µ–≤ –љ–∞—З–Є–љ–∞–µ—В—Б—П –±—Л—Б—В—А–Њ, —Е–Њ—В—П —Б–Ї–Њ—А–Њ—Б—В—М –µ–≥–Њ –≤—Б–∞—Б—Л–≤–∞–љ–Є—П –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Љ–µ–љ—М—И–µ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–Љ –њ—А–Є –њ—А–Є–µ–Љ–µ –≤–љ—Г—В—А—М —В–∞–±–ї–µ—В–Њ–Ї, –њ–Њ–Ї—А—Л—В—Л—Е –Ї–Є—И–µ—З–љ–Њ—А–∞—Б—В–≤–Њ—А–Є–Љ–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Њ–є. –Я–Њ—Б–ї–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —А–µ–Ї—В–∞–ї—М–љ–Њ–≥–Њ —Б—Г–њ–њ–Њ–Ј–Є—В–Њ—А–Є—П, —Б–Њ–і–µ—А–ґ–∞—Й–µ–≥–Њ 50 –Љ–≥ –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞, –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –µ–≥–Њ –≤ –њ–ї–∞–Ј–Љ–µ –і–Њ—Б—В–Є–≥–∞–µ—В—Б—П –≤ —Б—А–µ–і–љ–µ–Љ –≤ –њ—А–µ–і–µ–ї–∞—Е 1 —З–∞—Б–∞, –љ–Њ –≤–µ–ї–Є—З–Є–љ–∞ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є, —А–∞—Б—Б—З–Є—В–∞–љ–љ–∞—П –љ–∞ –µ–і–Є–љ–Є—Ж—Г –њ—А–Є–љ–Є–Љ–∞–µ–Љ–Њ–є –і–Њ–Ј—Л, —Б–Њ—Б—В–∞–≤–ї—П–µ—В –њ—А–Є–Љ–µ—А–љ–Њ 2/3 –Њ—В —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–µ–≥–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П, —А–µ–≥–Є—Б—В—А–Є—А—Г—О—Й–µ–≥–Њ—Б—П –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –≤–љ—Г—В—А—М –Ї–Є—И–µ—З–љ–Њ—А–∞—Б—В–≤–Њ—А–Є–Љ–Њ–є —В–∞–±–ї–µ—В–Ї–Є. –°—В–µ–њ–µ–љ—М –∞–±—Б–Њ—А–±—Ж–Є–Є –љ–∞—Е–Њ–і–Є—В—Б—П –≤ –њ—А—П–Љ–Њ–є –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –≤–µ–ї–Є—З–Є–љ—Л –і–Њ–Ј—Л –њ—А–µ–њ–∞—А–∞—В–∞.
–Я—А–Є –њ–Њ–≤—В–Њ—А–љ—Л—Е –љ–∞–Ј–љ–∞—З–µ–љ–Є—П—Е –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –≤–Є–і–µ —Б—Г–њ–њ–Њ–Ј–Є—В–Њ—А–Є–µ–≤ —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –љ–µ –Є–Ј–Љ–µ–љ—П—О—В—Б—П. –Я—А–Є —Г—Б–ї–Њ–≤–Є–Є —Б–Њ–±–ї—О–і–µ–љ–Є—П —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ–Љ—Л—Е –Є–љ—В–µ—А–≤–∞–ї–Њ–≤ –Љ–µ–ґ–і—Г –љ–∞–Ј–љ–∞—З–µ–љ–Є—П–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞ –Ї—Г–Љ—Г–ї—П—Ж–Є–Є –љ–µ –Њ—В–Љ–µ—З–∞–µ—В—Б—П. –£ –і–µ—В–µ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї–∞ –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–љ—Л—Е –і–Њ–Ј –њ—А–µ–њ–∞—А–∞—В–∞ –≤ —Б—Г–њ–њ–Њ–Ј–Є—В–Њ—А–Є—П—Е (–Љ–≥/–Ї–≥ –Љ–∞—Б—Б—Л —В–µ–ї–∞) —Б—Е–Њ–і–љ—Л —Б —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є–Љ–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ–Є —Г –≤–Ј—А–Њ—Б–ї—Л—Е.
–Э–µ–ґ–µ–ї–∞—В–µ–ї—М–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –Э–Я–Т–Я –љ–∞ –Њ—А–≥–∞–љ–Є–Ј–Љ —А–µ–Ј–Ї–Њ –Њ–≥—А–∞–љ–Є—З–Є–≤–∞–µ—В—Б—П, –µ—Б–ї–Є –Њ–љ–Є –њ—А–Є–Љ–µ–љ—П—О—В—Б—П –≤ –≤–Є–і–µ –ї–Њ–Ї–∞–ї—М–љ—Л—Е –∞–њ–њ–ї–Є–Ї–∞—Ж–Є–є. –Ґ–∞–Ї–Њ–є —Б–њ–Њ—Б–Њ–± –ї–µ—З–µ–љ–Є—П –њ–Њ–Ј–≤–Њ–ї—П–µ—В –≤–≤–Њ–і–Є—В—М –њ—А–µ–њ–∞—А–∞—В –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –≤ –Њ—З–∞–≥ –њ–Њ—А–∞–ґ–µ–љ–Є—П. –Я—А–Є —Н—В–Њ–Љ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –љ–∞ –і—А—Г–≥–Є–µ –Њ—А–≥–∞–љ—Л –Є —В–Ї–∞–љ–Є –Њ–Ї–∞–Ј—Л–≤–∞–µ—В—Б—П –Љ–Є–љ–Є–Љ–∞–ї—М–љ—Л–Љ. –Ы–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–∞—П —Д–Њ—А–Љ–∞ –і–ї—П —В–∞–Ї–Њ–є —В–µ—А–∞–њ–Є–Є –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є —Б–Љ–µ—Б—М –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ —Б –Њ—Б–љ–Њ–≤–Њ–є, –Ї–Њ—В–Њ—А–∞—П –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –≤—Б–∞—Б—Л–≤–∞–љ–Є–µ –њ–Њ–і –Ї–Њ–ґ—Г. –Э–∞–Є–±–Њ–ї—М—И–µ–є –њ–Њ–њ—Г–ї—П—А–љ–Њ—Б—В—М—О –њ–Њ–ї—М–Ј—Г—О—В—Б—П –Љ–∞–Ј–µ–≤—Л–µ —Д–Њ—А–Љ—Л. –Ю–љ–Є —Г–і–Њ–±–љ—Л –і–ї—П –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Є –ї–µ–≥–Ї–Њ –і–Њ–Ј–Є—А—Г—О—В—Б—П. –Ь–∞–Ј—М, –љ–∞–љ–µ—Б–µ–љ–љ–∞—П –љ–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В—М –Ї–Њ–ґ–Є, –Є–≥—А–∞–µ—В —А–Њ–ї—М –і–µ–њ–Њ, –Є–Ј –Ї–Њ—В–Њ—А–Њ–≥–Њ –∞–Ї—В–Є–≤–љ–Њ–µ —Б–Њ–µ–і–Є–љ–µ–љ–Є–µ –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ –≤—Б–∞—Б—Л–≤–∞–µ—В—Б—П, –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—П –њ–Њ–і–і–µ—А–ґ–∞–љ–Є–µ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≤ –Њ—З–∞–≥–µ –њ–Њ—А–∞–ґ–µ–љ–Є—П.
–Ф–ї—П –ї–Њ–Ї–∞–ї—М–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Т–Њ–ї—М—В–∞—А–µ–љ –≤—Л–њ—Г—Б–Ї–∞–µ—В—Б—П –≤ –≤–Є–і–µ –Љ–∞–Ј–Є –Т–Њ–ї—М—В–∞—А–µ–љ —Н–Љ—Г–ї—М–≥–µ–ї—М (–Т–≠). –Ф–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї –≤ –љ–µ–є –љ–∞—Е–Њ–і–Є—В—Б—П –≤ –≤–Є–і–µ —Н—В–Є–ї–∞–Љ–Є–љ–∞. –Я–Њ—Б–ї–µ –љ–∞–љ–µ—Б–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –љ–∞ –Ї–Њ–ґ—Г –∞–Ї—В–Є–≤–љ–Њ–µ —Б–Њ–µ–і–Є–љ–µ–љ–Є–µ –љ–∞–Ї–∞–њ–ї–Є–≤–∞–µ—В—Б—П –≤ —А–µ–≥–Є–Њ–љ–∞–ї—М–љ—Л—Е –Љ—П–≥–Ї–Є—Е —В–Ї–∞–љ—П—Е –Є –њ–Њ–њ–∞–і–∞–µ—В –≤ –Ї—А–Њ–≤–Њ—В–Њ–Ї [122]. –І—А–µ—Б–Ї–Њ–ґ–љ–∞—П –∞–±—Б–Њ—А–±—Ж–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –њ–Њ—Б–ї–µ 12–—З–∞—Б–Њ–≤–Њ–є –∞–њ–њ–ї–Є–Ї–∞—Ж–Є–Є —Б–Њ—Б—В–∞–≤–ї—П–ї–∞ –Њ–Ї–Њ–ї–Њ 6%. –°–Њ–і–µ—А–ґ–∞–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –Љ—Л—И—Ж–∞—Е –≤ –Ј–Њ–љ–µ –∞–њ–њ–ї–Є–Ї–∞—Ж–Є–Є –њ—А–Є–Љ–µ—А–љ–Њ –≤ —В—А–Є —А–∞–Ј–∞ –њ—А–µ–≤—Л—И–∞–µ—В –µ–≥–Њ —Г—А–Њ–≤–µ–љ—М –≤ –Њ—В–і–∞–ї–µ–љ–љ–Њ–є –Љ—Л—И–µ—З–љ–Њ–є —В–Ї–∞–љ–Є. –Ъ–Њ–≥–і–∞ –Т–≠ –љ–∞–љ–Њ—Б–Є–ї—Б—П –љ–∞ –Ї–Њ–ґ—Г –≤ –Њ–±–ї–∞—Б—В–Є –Ї–Њ–ї–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤ –±–Њ–ї—М–љ—Л—Е –Ю–Р, –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –≤ —Б–Є–љ–Њ–≤–Є–∞–ї—М–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є –±—Л–ї–∞ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –≤—Л—И–µ, —З–µ–Љ –≤ –Ї–Њ–љ—В—А–∞–ї–∞—В–µ—А–∞–ї—М–љ–Њ–Љ —Б—Г—Б—В–∞–≤–µ, –≥–і–µ –њ—А–Є–Љ–µ–љ—П–ї–Њ—Б—М –њ–ї–∞—Ж–µ–±–Њ [123]. –Я—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є —А–µ–≥—Г–ї—П—А–љ—Л—Е –∞–њ–њ–ї–Є–Ї–∞—Ж–Є–є –Т–≠ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –њ–ї–∞–Ј–Љ–µ —Б—В–∞–±–Є–ї–Є–Ј–Є—А–Њ–≤–∞–ї–∞—Б—М —З–µ—А–µ–Ј 2 –і–љ—П [124]. –Ю–љ–∞ –Њ—Б—В–∞–≤–∞–ї–∞—Б—М –љ–∞ –љ–Є–Ј–Ї–Њ–Љ —Г—А–Њ–≤–љ–µ (10–50 –љ–Љ–Њ–ї—М/–ї), –љ–Њ –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ —Г—Б—В–Њ–є—З–Є–≤–Њ —Б–Њ—Е—А–∞–љ—П–ї–∞—Б—М –≤ —В–µ—З–µ–љ–Є–µ —Б—Г—В–Њ–Ї, —З—В–Њ –Љ–Њ–ґ–µ—В –±—Л—В—М —Б–≤—П–Ј–∞–љ–Њ —Б –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ–Њ–є –∞–±—Б–Њ—А–±—Ж–Є–µ–є –њ—А–µ–њ–∞—А–∞—В–∞ –Є–Ј –Ј–Њ–љ—Л –∞–њ–њ–ї–Є–Ї–∞—Ж–Є–Є. –Т–≠ —И–Є—А–Њ–Ї–Њ –њ—А–Є–Љ–µ–љ—П–µ—В—Б—П –і–ї—П –ї–µ—З–µ–љ–Є—П —А–∞–Ј–ї–Є—З–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є [125–129].
–Т—Л—Б–Њ–Ї–∞—П –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–∞—П –Є –∞–љ–∞–ї—М–≥–µ—В–Є—З–µ—Б–Ї–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Ф–Э –њ—А–Є–Љ–µ–љ—П–µ—В—Б—П –љ–µ —В–Њ–ї—М–Ї–Њ –≤ —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є–Є, –љ–Њ –Є –≤ –і—А—Г–≥–Є—Е –Њ—В—А–∞—Б–ї—П—Е –Љ–µ–і–Є—Ж–Є–љ—Л [130–134]. –Ю–љ —Б —Г—Б–њ–µ—Е–Њ–Љ –њ—А–Є–Љ–µ–љ—П–µ—В—Б—П –і–ї—П –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є—П –±–Њ–ї–Є –≤ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ [135–137]. –Т –≥–Є–љ–µ–Ї–Њ–ї–Њ–≥–Є–Є –Ф–Э –і–∞–µ—В —Е–Њ—А–Њ—И–Є–є –Њ–±–µ–Ј–±–Њ–ї–Є–≤–∞—О—Й–Є–є —Н—Д—Д–µ–Ї—В –њ—А–Є –і–Є—Б–Љ–µ–љ–Њ—А–µ–µ [138]. –С–Њ–ї–Є —Г –±–Њ–ї—М–љ—Л—Е —Б –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є —В–∞–Ї–ґ–µ –Љ–Њ–ґ–µ—В –Ї—Г–њ–Є—А–Њ–≤–∞—В—М—Б—П –Ф–Э [139]. –Т–љ—Г—В—А–Є–Љ—Л—И–µ—З–љ–Њ–µ –≤–≤–µ–і–µ–љ–Є–µ –Ф–Э – —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–є –Љ–µ—В–Њ–і –±–Њ—А—М–±—Л —Б –њ–Њ—З–µ—З–љ–Њ–є –Є –њ–µ—З–µ–љ–Њ—З–љ–Њ–є –Ї–Њ–ї–Є–Ї–Њ–є [140–142].
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Т–Њ–ї—М—В–∞—А–µ–љ —П–≤–ї—П–µ—В—Б—П –њ—А–µ–њ–∞—А–∞—В–Њ–Љ, –њ—А–Њ—П–≤–ї—П—О—Й–Є–Љ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ –Њ–±–µ–Ј–±–Њ–ї–Є–≤–∞—О—Й–µ–µ –Є –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ —Г–ґ–µ –њ–Њ—Б–ї–µ –њ–µ—А–≤–Њ–≥–Њ –њ—А–Є–µ–Љ–∞ –њ—А–Є: –±–Њ–ї–Є –≤ —Б–њ–Є–љ–µ, –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є—П—Е –Є –±–Њ–ї–Є –≤ —Б—Г—Б—В–∞–≤–∞—Е, —В—А–∞–≤–Љ–µ –Є–ї–Є –±–Њ–ї–Є –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–Є, –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е –Њ—А–≥–∞–љ–Њ–≤ –Љ–∞–ї–Њ–≥–Њ —В–∞–Ј–∞. –Т–Њ–ї—М—В–∞—А–µ–љ —В–∞–Ї–ґ–µ –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П –њ—А–Є —А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е –≤–љ–µ—Б—Г—Б—В–∞–≤–љ—Л—Е –Љ—П–≥–Ї–Є—Е —В–Ї–∞–љ–µ–є, –њ—А–Є —В—П–ґ–µ–ї—Л—Е –њ—А–Є—Б—В—Г–њ–∞—Е –Љ–Є–≥—А–µ–љ–Є (—А–µ–Ї—В–∞–ї—М–љ—Л–µ —Б—Г–њ–њ–Њ–Ј–Є—В–Њ—А–Є–Є), –њ—А–Є –њ–Њ—З–µ—З–љ–Њ–є –Є –ґ–µ–ї—З–љ–Њ–є –Ї–Њ–ї–Є–Ї–∞—Е (—А–∞—Б—В–≤–Њ—А –і–ї—П –≤/–Љ –≤–≤–µ–і–µ–љ–Є—П).
–Я–Њ—Б–ї–µ –≤–љ–µ–і—А–µ–љ–Є—П –Т–Њ–ї—М—В–∞—А–µ–љ–∞ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї—Г—О –њ—А–∞–Ї—В–Є–Ї—Г –њ—А–Њ—И–ї–Њ —Г–ґ–µ –±–Њ–ї–µ–µ 30 –ї–µ—В. –Ч–∞ —Н—В–Њ –≤—А–µ–Љ—П –њ–Њ—П–≤–Є–ї–Њ—Б—М –љ–µ–Љ–∞–ї–Њ –љ–Њ–≤—Л—Е –Э–Я–Т–Я. –≠—В–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —А–∞—Б—И–Є—А–Є–ї–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Њ–Ї–∞–Ј–∞–љ–Є—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–є –њ–Њ–Љ–Њ—Й–Є –±–Њ–ї—М–љ—Л–Љ, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–∞—П —А–µ–∞–Ї—Ж–Є—П –љ–∞ –ї–µ—З–µ–љ–Є–µ –≤–µ—Б—М–Љ–∞ –≤–∞—А–Є–∞–±–µ–ї—М–љ–∞. –Ю–і–љ–∞–Ї–Њ –Ф–Э –≤ —Н—В–Њ–Љ –ї–µ—З–µ–±–љ–Њ–Љ –∞—А—Б–µ–љ–∞–ї–µ –Ј–∞–љ–Є–Љ–∞–µ—В –Њ—Б–Њ–±–Њ–µ –Љ–µ—Б—В–Њ. –°–Њ—З–µ—В–∞–љ–Є–µ –≤—Л—Б–Њ–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є, —Е–Њ—А–Њ—И–µ–є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є –Є –Њ–±—И–Є—А–љ–Њ–≥–Њ —Б–њ–µ–Ї—В—А–∞ –њ–Њ–Ї–∞–Ј–∞–љ–Є–є –і–ї—П –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ –µ–Љ—Г —Б—В–∞—В—М –љ–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–Љ –Є–Ј –Э–Я–Т–Я [143,144].
–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. Sallmann AR. The history of diclofenac. Am J Med. 1986 Apr 28;80(4B):29–33.
2. Sallmann A. The chemistry of diclofenac sodium (Voltarol). Rheumatol Rehabil. 1979;Suppl 2:4–10
3. Menasse R, Hedwall PR, Kraetz J, Pericin C, Riesterer L, Sallmann A, Ziel R, Jaques R. Pharmacological properties of diclofenac sodium and its metabolites. Scand J Rheumatol Suppl. 1978;(22):5–16
4. Fowler PD, Shadforth MF, Crook PR, John VA. Plasma and synovial fluid concentrations of diclofenac sodium and its major hydroxylated metabolites during long–term treatment of rheumatoid arthritis. Eur J Clin Pharmacol. 1983;25(3):389–94.
5. Riess W, Stierlin H, Degen P, Faigle JW, Gerardin A, Moppert J, Sallmann A, Schmid K, Schweizer A, Sulc M, Theobald W, Wagner J Pharmacokinetics and metabolism of the anti–inflammatory agent Voltaren. Scand J Rheumatol Suppl. 1978;(22):17–29.
6. Terhaag B, Gramatte T, Hrdlcka P, Richter K, Feller K. The influence of food on the absorption of diclofenac as a pure substance. Int J Clin Pharmacol Ther Toxicol. 1991 Oct;29(10):418–21.
7. Riad LE, Sawchuk RJ, McAlary MM, Chan KK. Effect of Food on the Multiple–Peak Behavior After a Single Oral Dose of Diclofenac Sodium Slow–Release Tablet in Humans. Am J Ther. 1995 Apr;2(4):237–242.
8. Stierlin H, Faigle JW, Sallmann A, Kung W, Richter WJ, Kriemler HP, Alt KO, Winkler T. Biotransformation of diclofenac sodium (Voltaren) in animals and in man. I. Isolation and identification of principal metabolites. Xenobiotica. 1979 Oct;9(10):601–10.
9. Faigle JW, Bottcher I, Godbillon J, Kriemler HP, Schlumpf E, Schneider W, Schweizer A, Stierlin H, Winkler T. A new metabolite of diclofenac sodium in human plasma. Xenobiotica. 1988 Oct;18(10):1191–7
10. Wiesenberg–Boettcher I, Pfeilschifter J, Schweizer A, Sallmann A, Wenk P. Pharmacological properties of five diclofenac metabolites identified in human plasma. Agents Actions. 1991 Sep;34(1–2):135–7.
11. Degen PH, Dieterle W, Schneider W, Theobald W, Sinterhauf U. Pharmacokinetics of diclofenac and five metabolites after single doses in healthy volunteers and after repeated doses in patients. Xenobiotica. 1988 Dec;18(12):1449–55.
12. Lill JS, O’Sullivan T, Bauer LA, Horn JR, Carithers R Jr, Strandness DE, Lau H, Chan K, Thakker K. Pharmacokinetics of diclofenac sodium in chronic active hepatitis and alcoholic cirrhosis. J Clin Pharmacol. 2000 Mar;40(3):250–7.
13. Vane JR. Inhibition of prostaglandin synthesis as a mechanism of action for aspirin–like drugs. Nat New Biol. 1971 Jun 23;231(25):232–5.
14. Smith WL. Prostanoid biosynthesis and mechanisms of action. Am J Physiol. 1992 Aug;263(2 Pt 2):F181–91. Review.
15. Simmons DL, Botting RM, Hla T. Cyclooxygenase isozymes: the biology of prostaglandin synthesis and inhibition. Pharmacol Rev. 2004 Sep;56(3):387–437. Review.
16. Fitzpatrick FA, Soberman R. Regulated formation of eicosanoids. J Clin Invest. 2001 Jun;107(11):1347–51. Review.
17. Yamagata K, Andreasson KI, Kaufmann WE, Barnes CA, Worley PF. Expression of a mitogen–inducible cyclooxygenase in brain neurons: regulation by synaptic activity and glucocorticoids. Neuron. 1993 Aug;11(2):371–86.
18. Harris RC, Breyer MD. Physiological regulation of cyclooxygenase–2 in the kidney. Am J Physiol Renal Physiol. 2001 Jul;281(1):F1–11. Review.
19. Sorli CH, Zhang HJ, Armstrong MB, Rajotte RV, Maclouf J, Robertson RP. Basal expression of cyclooxygenase–2 and nuclear factor–interleukin 6 are dominant and coordinately regulated by interleukin 1 in the pancreatic islet. Proc Natl Acad Sci U S A. 1998 Feb 17;95(4):1788–93.
20. Crofford LJ, Wilder RL, Ristimaki AP, Sano H, Remmers EF, Epps HR, Hla T. Cyclooxygenase–1 and –2 expression in rheumatoid synovial tissues. Effects of interleukin–1 beta, phorbol ester, and corticosteroids. J Clin Invest. 1994 Mar;93(3):1095–101.
21. Onodera M, Horiuchi Y, Nakahama K, Muneta T, Mano Y, Morita I. Induction of cyclooxygenase–1 in cultured synovial cells isolated from rheumatoid arthritis patients. Inflamm Res. 2004 Jun;53(6):217–22.
22. Langenbach R, Morham SG, Tiano HF, Loftin CD, Ghanayem BI, Chulada PC, Mahler JF, Lee CA, Goulding EH, Kluckman KD, Kim HS, Smithies O. Prostaglandin synthase 1 gene disruption in mice reduces arachidonic acid–induced inflammation and indomethacin–induced gastric ulceration. Cell. 1995 Nov 3;83(3):483–92.
23. Mancini JA, Riendeau D, Falgueyret JP, Vickers PJ, O’Neill GP. Arginine 120 of prostaglandin G/H synthase–1 is required for the inhibition by nonsteroidal anti–inflammatory drugs containing a carboxylic acid moiety. J Biol Chem. 1995 Dec 8;270(49):29372–7.
24. Walker MC, Kurumbail RG, Kiefer JR, Moreland KT, Koboldt CM, Isakson PC, Seibert K, Gierse JK. A three–step kinetic mechanism for selective inhibition of cyclo–oxygenase–2 by diarylheterocyclic inhibitors. Biochem J. 2001 Aug 1;357(Pt 3):709–18.
25. Van Hecken A, Schwartz JI, Depre M, De Lepeleire I, Dallob A, Tanaka W, Wynants K, Buntinx A, Arnout J, Wong PH, Ebel DL, Gertz BJ, De Schepper PJ. Comparative inhibitory activity of rofecoxib, meloxicam, diclofenac, ibuprofen, and naproxen on COX–2 versus COX–1 in healthy volunteers. J Clin Pharmacol. 2000 Oct;40(10):1109–20.
26. Hinz B, Dormann H, Brune K. More pronounced inhibition of cyclooxygenase 2, increase in blood pressure, and reduction of heart rate by treatment with diclofenac compared with celecoxib and rofecoxib. Arthritis Rheum. 2006 Jan;54(1):282–91.
27. Kato M, Nishida S, Kitasato H, Sakata N, Kawai S. Cyclooxygenase–1 and cyclooxygenase–2 selectivity of non–steroidal anti–inflammatory drugs: investigation using human peripheral monocytes. J Pharm Pharmacol. 2001 Dec;53(12):1679–85
28. Botting RM. Inhibitors of cyclooxygenases: mechanisms, selectivity and uses. J Physiol Pharmacol. 2006 Nov;57 Suppl 5:113–24.
29. O’Neill LA, Lewis GP. Inhibitory effects of diclofenac and indomethacin on interleukin–1–induced changes in PGE2 release. A novel effect on free arachidonic acid levels in human synovial cells. Biochem Pharmacol. 1989 Nov 1;38(21):3707–11.
30. Meyer FA, Yaron I, Mashiah V, Yaron M. Effect of diclofenac on prostaglandin E and hyaluronic acid production by human synovial fibroblasts stimulated with interleukin–1. Br J Clin Pharmacol. 1989 Aug;28(2):193–6.
31. Moilanen E. Effects of diclofenac, indomethacin, tolfenamic acid and hydrocortisone on prostanoid production in healthy and rheumatic synovial cells. Agents Actions. 1989 Mar;26(3–4):342–9
32. Giagoudakis G, Markantonis SL. Relationships between the concentrations of prostaglandins and the nonsteroidal antiinflammatory drugs indomethacin, diclofenac, and ibuprofen. Pharmacotherapy. 2005 Jan;25(1):18–25.
33. Gonzalez E, de la Cruz C, de Nicolas R, Egido J, Herrero–Beaumont G. Long–term effect of nonsteroidal anti–inflammatory drugs on the production of cytokines and other inflammatory mediators by blood cells of patients with osteoarthritis. Agents Actions. 1994 May;41(3–4):171–8
34. Duffy T, Belton O, Bresnihan B, FitzGerald O, FitzGerald D. Inhibition of PGE2 production by nimesulide compared with diclofenac in the acutely inflamed joint of patients with arthritis. Drugs. 2003;63 Suppl 1:31–6.
35. Knorth H, Wittenberg RH, Dorfmuller P, Lebert R, Schmidt WE, Peskar BM, Wiese M, Heukamp M, Willburger RE. In vitro effects of diclofenac and selective cyclooxygenase–2 inhibitors on prostaglandin release from inflamed bursa subacromialis tissue in patients with subacromial syndrome Orthopade. 2005 Mar;34(3):241–5, 247–9.
36. Martinez LL, Aparecida De Oliveira M, Fortes ZB. Influence of verapamil and diclofenac on leukocyte migration in rats. Hypertension. 1999 Oct;34(4 Pt 2):997–1001.
37. Partsch G, Schwarzer C, Eberl R. The effects of ibuprofen and diclofenac on the chemotaxis and adenosine triphosphate level of polymorphonuclear cells in vitro. J Rheumatol. 1990 May;17(5):583–8.
38. Locatelli L, Sacerdote P, Mantegazza P, Panerai AE. Effect of ibuprofen and diclofenac on the chemotaxis induced by substance P and transforming growth factor–beta on human monocytes and polymorphonuclear cells. Int J Immunopharmacol. 1993 Oct;15(7):833–8.
39. Perianin A, Giroud JP, Hakim J. Stimulation of human polymorphonuclear leukocytes potentiates the uptake of diclofenac and the inhibition of chemotaxis. Biochem Pharmacol. 1990 Nov 1;40(9):2039–45.
40. Sakai A. Diclofenac inhibits endothelial cell adhesion molecule expression induced with lipopolysaccharide. Life Sci. 1996 May 24;58(26):2377–87.
41. Lopez–Armada MJ, Sanchez–Pernaute O, Largo R, Diez–Ortego I, Palacios I, Egido J, Herrero–Beaumont G. Modulation of cell recruitment by anti–inflammatory agents in antigen–induced arthritis. Ann Rheum Dis. 2002 Nov;61(11):1027–30.
42. Perianin A, Gougerot–Pocidalo MA, Giroud JP, Hakim J. Diclofenac binding to human polymorphonuclear neutrophils: effect on respiratory burst and N–formylated peptide binding. Biochem Pharmacol. 1987 Aug 15;36(16):2609–15.
43. Bell AL, Adamson H, Kirk F, McCaigue MD, Rotman H. Diclofenac inhibits monocyte superoxide production ex vivo in rheumatoid arthritis. Rheumatol Int. 1991;11(1):27–30
44. Schmeling DJ, Caty MG, Oldham KT, Guice KS. Cytoprotection by diclofenac sodium after intestinal ischemia/reperfusion injury. J Pediatr Surg. 1994 Aug;29(8):1044–8.
45. O’Grady M, Hackney AC, Schneider K, Bossen E, Steinberg K, Douglas JM Jr, Murray WJ, Watkins WD. Diclofenac sodium (Voltaren) reduced exercise–induced injury in human skeletal muscle. Med Sci Sports Exerc. 2000 Jul;32(7):1191–6.
46. Cornefjord M, Olmarker K, Otani K, Rydevik B. Nucleus pulposus–induced nerve root injury: effects of diclofenac and ketoprofen. Eur Spine J. 2002 Feb;11(1):57–61
47. Brooks G, Yu XM, Wang Y, Crabbe MJ, Shattock MJ, Harper JV. Non–steroidal anti–inflammatory drugs (NSAIDs) inhibit vascular smooth muscle cell proliferation via differential effects on the cell cycle. J Pharm Pharmacol. 2003 Apr;55(4):519–26
48. Fei XW, Liu LY, Xu JG, Zhang ZH, Mei YA. The non–steroidal anti–inflammatory drug, diclofenac, inhibits Na(+) current in rat myoblasts. Biochem Biophys Res Commun. 2006 Aug 11;346(4):1275–83.
49. Marsolais D, Cote CH, Frenette J. Nonsteroidal anti–inflammatory drug reduces neutrophil and macrophage accumulation but does not improve tendon regeneration. Lab Invest. 2003 Jul;83(7):991–9.
50. Bjorkman R. Central antinociceptive effects of non–steroidal anti–inflammatory drugs and paracetamol. Experimental studies in the rat. Acta Anaesthesiol Scand Suppl. 1995;103:1–44.
51. Jurna I, Brune K. Central effect of the non–steroid anti–inflammatory agents, indomethacin, ibuprofen, and diclofenac, determined in C fibre–evoked activity in single neurones of the rat thalamus. Pain. 1990 Apr;41(1):71–80.
52. Bjorkman RL, Hedner T, Hallman KM, Henning M, Hedner J. Localization of the central antinociceptive effects of diclofenac in the rat. Brain Res. 1992 Sep 11;590(1–2):66–73.
53. Edwards SR, Mather LE. Diclofenac increases the accumulation of kynurenate following tryptophan pretreatment in the rat: a possible factor contributing to its antihyperalgesic effect. Inflammopharmacology. 2003;11(3):277–92.
54. Mahdy AM, Galley HF, Abdel–Wahed MA, el–Korny KF, Sheta SA, Webster NR. Differential modulation of interleukin–6 and interleukin–10 by diclofenac in patients undergoing major surgery. Br J Anaesth. 2002 Jun;88(6):797–802.
55. Lee HM, Kim HI, Shin YK, Lee CS, Park M, Song JH. Diclofenac inhibition of sodium currents in rat dorsal root ganglion neurons. Brain Res. 2003 Nov 28;992(1):120–7.
56. Lin Y, Mather LE, Power I, Cousins MJ. The effect of diclofenac on the expression of spinal cord c–fos–like immunoreactivity after ischemia–reperfusion–induced acute hyperalgesia in the rat tail. Anesth Analg. 2000 May;90(5):1141–5.
57. Miranda HF, Sierralta F, Pinardi G. Neostigmine interactions with non steroidal anti–inflammatory drugs. Br J Pharmacol. 2002 Apr;135(7):1591–7.
58. Burian M, Tegeder I, Seegel M, Geisslinger G. Peripheral and central antihyperalgesic effects of diclofenac in a model of human inflammatory pain. Clin Pharmacol Ther. 2003 Aug;74(2):113–20.
59. Tonussi CR, Ferreira SH. Mechanism of diclofenac analgesia: direct blockade of inflammatory sensitization. Eur J Pharmacol. 1994 Jan 14;251(2–3):173–9.
60. Torres–Lopez JE, Ortiz MI, Castaneda–Hernandez G, Alonso–Lopez R, Asomoza–Espinosa R, Granados–Soto V. Comparison of the antinociceptive effect of celecoxib, diclofenac and resveratrol in the formalin test. Life Sci. 2002 Feb 22;70(14):1669–76.
61. Alves DP, Tatsuo MA, Leite R, Duarte ID. Diclofenac–induced peripheral antinociception is associated with ATP–sensitive K+ channels activation. Life Sci. 2004 Apr 2;74(20):2577–91.
62. Ortiz MI, Granados–Soto V, Castaneda–Hernandez G. The NO–cGMP–K+ channel pathway participates in the antinociceptive effect of diclofenac, but not of indomethacin. Pharmacol Biochem Behav. 2003 Aug;76(1):187–95.
63. Liu LY, Fei XW, Li ZM, Zhang ZH, Mei YA. Diclofenac, a nonsteroidal anti–inflammatory drug, activates the transient outward K+ current in rat cerebellar granule cells. Neuropharmacology. 2005 May;48(6):918–26.
64. Mutru O, Penttila M, Pesonen J, Salmela P, Suhonen O, Sonck T. Diclofenac sodium (Voltaren) and indomethacin in the ambulatory treatment of rheumatoid arthritis: a double–blind multicentre study. Scand J Rheumatol Suppl. 1978;(22):51–6.
65. Cardoe N, Fowler PD. Diclofenac sodium (Voltarol): a double–blind comparative study with ibuprofen in patients with rheumatoid arthritis. Rheumatol Rehabil. 1979;Suppl 2:89–99.
66. Siegmeth W, Placheta P. Long–term comparative study: diclofenac (voltaren) and naproxen (proxen) in arthritis. Schweiz Med Wochenschr. 1978 Mar 4;108(9):349–53
67. Abrams GJ, Solomon L, Meyers OL. A long–term study of diclophenac sodium in the treatment of rheumatoid arthritis and osteo–arthrosis. S Afr Med J. 1978 Mar 25;53(12):442–5.
68. McMahon MF, Cash HC. An open assessment of the efficacy and tolerability of diclofenac sodium (Voltarol) in patients with rheumatic disease and a comparative study of diclofenac sodium (Voltarol) with indomethacin in patients with osteoarthritis and rheumatoid arthritis. Rheumatol Rehabil. 1979;Suppl 2:81–8.
69. : Doreen MS, Boardman PL, Fowler PD, Poole PH. Diclofenac (Voltarol) in rheumatoid arthritis: a report of a double–blind trial. Rheumatol Rehabil. 1979;Suppl 2:78–80.
70. Caldwell JR. Efficacy and safety of diclofenac sodium in rheumatoid arthritis. Experience in the United States. Am J Med. 1986 Apr 28;80(4B):43–7.
71. Barnes CG, Berry H, Carter ME, Downie WW, Fowler PD, Moll JM, Perry JD, Sawaf MS, Wright V. Diclofenac sodium (Voltarol) and indomethacin: a multicentre comparative study in rheumatoid arthritis and osteoarthritis. Rheumatol Rehabil. 1979;Suppl 2:135–43.
72. Brooks PM, Hill W, Geddes R. Diclofenac and ibuprofen in rheumatoid arthritis and osteoarthritis. Med J Aust. 1980 Jan 12;1(1):29–30.
73. –¶–≤–µ—В–Ї–Њ–≤–∞ –Х.–°., –°–Є–≥–Є–і–Є–љ –ѓ.–Р. –°—А–∞–≤–љ–Є—В–µ–ї—М–љ–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –љ–Њ–≤—Л—Е –∞–љ—В–Є—А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е —Б—А–µ–і—Б—В–≤. –Ґ–µ—А. –Р—А—Е–Є–≤ 1980, 11, 141–144.
74. Treadwell BL, Tweed JM. Diclofenac in rheumatoid disease. N Z Med J. 1979 Jan 24;89(628):43–5.
75. Cardoe N, Fowler PD. Diclofenac sodium (Voltarol): a double–blind comparative study with ibuprofen in patients with rheumatoid arthritis. Rheumatol Rehabil. 1979;Suppl 2:89–99.
76. Minisola G, Dardano B, Calderazzo L, Avola E. Clinical efficacy of sodium diclofenac in chronic juvenile polyarthritis. Pediatr Med Chir. 1990 Mar–Apr;12(2):169–73.
77. Cheng TT, Lai HM, Chiu CK, Chem YC. A single–blind, randomized, controlled trial to assess the efficacy and tolerability of rofecoxib, diclofenac sodium, and meloxicam in patients with acute gouty arthritis. Clin Ther. 2004 Mar;26(3):399–406.
78. Droste U, Siemens P. Treatment of ankylosing spondylitis with slow–release diclofenac sodium in a single daily dose. Fortschr Med. 1982 Aug 5;100(29):1374–6.
79. Calabro JJ. Efficacy of diclofenac in ankylosing spondylitis. Am J Med. 1986 Apr 28;80(4B):58–63.
80. Khan MA. A double blind comparison of diclofenac and indomethacin in the treatment of ankylosing spondylitis. J Rheumatol. 1987 Feb;14(1):118–23.
81. Ward JR. Efficacy of diclofenac in osteoarthritis. Experience in the United States. Am J Med. 1986 Apr 28;80(4B):53–7
82. Bakshi R, Darekar B, Langdon CG, Rotman H. Efficacy and tolerability of diclofenac dispersible in elderly patients with osteoarthritis. Curr Med Res Opin. 1991;12(7):459–65.
83. Le Loet X, Dreiser RL, Le Gros V, Febvre N. Therapeutic equivalence of diclofenac sustained–released 75 mg tablets and diclofenac enteric–coated 50 mg tablets in the treatment of painful osteoarthritis. Int J Clin Pract. 1997 Sep;51(6):389–93.
84. Arcangeli P, Andreotti L, Palazzini E. Effective treatment of osteoarthritis with a 150 mg prolonged–release of diclofenac sodium. Riv Eur Sci Med Farmacol. 1996 Sep–Dec;18(5–6):217–23.
85. Varese C, Palazzini A. Open study of a diclofenac sodium prolonged–release in patients suffering from coxarthrosis. Eur Rev Med Pharmacol Sci. 1997 Jan–Jun;1(1–3):57–62
86. Ward DE, Veys EM, Bowdler JM, Roma J. Comparison of aceclofenac with diclofenac in the treatment of osteoarthritis. Clin Rheumatol. 1995 Nov;14(6):656–62
87. Bakshi R, Ezzet N, Frey L, Lasry D, Salliere D. Efficacy and tolerability of diclofenac dispersible in painful osteoarthrosis. Clin Rheumatol. 1993 Mar;12(1):57–61.
88. Morgan GJ Jr, Kaine J, DeLapp R, Palmer R. Treatment of elderly patients with nabumetone or diclofenac: gastrointestinal safety profile. J Clin Gastroenterol. 2001 Apr;32(4):310–4.
89. La Montagna G, Tirri G, Cacace E, Perpignano G, Covelli M, Pipitone V, D’Agostino P, Magaro M, Ferraccioli G, Mascia MT, Manzini E, Minari C, Barreca C, Marcolongo R, Paresce E, Colombo B. Quality of life assessment during six months of NSAID treatment [Gonarthrosis and Quality of Life (GOAL) Study]. Clin Exp Rheumatol. 1998 Jan–Feb;16(1):49–54.
90. Baumgartner H, Schwarz HA, Blum W, Bruhin A, Gallachi G, Goldinger G, Saxer M, Trost H. Ibuprofen and diclofenac sodium in the treatment of osteoarthritis: a comparative trial of two once–daily sustained–release NSAID formulations. Curr Med Res Opin. 1996;13(8):435–44.
91. Altman R. International experiences with diclofenac in osteoarthritis. Am J Med. 1986 Apr 28;80(4B):48–52.
92. Benito MJ, Veale DJ, FitzGerald O, van den Berg WB, Bresnihan B. Synovial tissue inflammation in early and late osteoarthritis. Ann Rheum Dis. 2005 Sep;64(9):1263–7.
93. Walker–Bone K, Javaid K, Arden N, Cooper C. Regular review: medical management of osteoarthritis. BMJ. 2000 Oct 14;321(7266):936–40. Review.
94. Recommendations for the medical management of osteoarthritis of the hip and knee: 2000 update. American College of Rheumatology Subcommittee on Osteoarthritis Guidelines. Arthritis Rheum. 2000 Sep;43(9):1905–15.
95. Case JP, Baliunas AJ, Block JA. Lack of efficacy of acetaminophen in treating symptomatic knee osteoarthritis: a randomized, double–blind, placebo–controlled comparison trial with diclofenac sodium. Arch Intern Med. 2003 Jan 27;163(2):169–78.
96. Thumb N, Kolarz G, Scherak O, Mayrhofer F. The efficacy and safety of fentiazac and diclofenac sodium in peri–arthritis of the shoulder: a multi–centre, double–blind comparison. J Int Med Res. 1987 Nov–Dec;15(6):327–34
97. Adebajo AO, Nash P, Hazleman BL. A prospective double blind dummy placebo controlled study comparing triamcinolone hexacetonide injection with oral diclofenac 50 mg TDS in patients with rotator cuff tendinitis. J Rheumatol. 1990 Sep;17(9):1207–10.
98. Labelle H, Guibert R. Efficacy of diclofenac in lateral epicondylitis of the elbow also treated with immobilization. The University of Montreal Orthopaedic Research Group. Arch Fam Med. 1997 May–Jun;6(3):257–62.
99. Huskisson EC, Bryans R. Diclofenac sodium in the treatment of painful stiff shoulder. Curr Med Res Opin. 1983;8(5):350–3
100. Wober W, Rahlfs VW, Buchl N, Grassle A, Macciocchi A. Comparative efficacy and safety of the non–steroidal anti–inflammatory drugs nimesulide and diclofenac in patients with acute subdeltoid bursitis and bicipital tendinitis. Int J Clin Pract. 1998 Apr–May;52(3):169–75.
101. Valtonen EJ. A comparative short–term trial with Voltaren (diclofenac sodium) and naproxen in soft–tissue rheumatism. Scand J Rheumatol Suppl. 1978;(22):69–73
102. Dreiser RL, Marty M, Ionescu E, Gold M, Liu JH. Relief of acute low back pain with diclofenac–K 12.5 mg tablets: a flexible dose, ibuprofen 200 mg and placebo–controlled clinical trial. Int J Clin Pharmacol Ther. 2003 Sep;41(9):375–85.
103. Zerbini C, Ozturk ZE, Grifka J, Maini M, Nilganuwong S, Morales R, Hupli M, Shivaprakash M, Giezek H; The Etoricoxib CLBP Study Group. Efficacy of etoricoxib 60 mg/day and diclofenac 150 mg/day in reduction of pain and disability in patients with chronic low back pain: results of a 4–week, multinational, randomized, double–blind study. Curr Med Res Opin. 2005 Dec;21(12):2037–49.
104. Jones CW. A post–marketing surveillance study of Voltarol 75 mg SR in the primary care setting. Br J Clin Pract. 1996 Oct–Nov;50(7):390–5.
105. Shi W, Wang YM, Cheng NN, Chen BY, Li D. Meta–analysis on the effect and adverse reaction on patients with osteoarthritis and rheumatoid arthritis treated with non–steroidal anti–inflammatory drugs. Zhonghua Liu Xing Bing Xue Za Zhi. 2003 Nov;24(11):1044–8.
106. Cullen DJ, Seager JM, Holmes S, Doherty M, Wilson JV, Garrud P, Garner S, Maynard A, Logan RF, Hawkey CJ. Pharmacoepidemiology of non–steroidal anti–inflammatory drug use in Nottingham general practices. Aliment Pharmacol Ther. 2000 Feb;14(2):177–85.
107. Pincus T, Wang X, Chung C, Sokka T, Koch GG. Patient preference in a crossover clinical trial of patients with osteoarthritis of the knee or hip: face validity of self–report questionnaire ratings. J Rheumatol. 2005 Mar;32(3):533–9.
108. Zochling J, Bohl–Buhler MH, Baraliakos X, Feldtkeller E, Braun J. Nonsteroidal anti–inflammatory drug use in ankylosing spondylitis – a population–based survey. Clin Rheumatol. 2006 Nov;25(6):794–800.
109. Zuckner J. Related International experience with diclofenac in rheumatoid arthritis. Am J Med. 1986 Apr 28;80(4B):39–42.
110. Weisman MH. Double–blind randomized trial of diclofenac sodium versus placebo in patients with rheumatoid arthritis. Clin Ther. 1986;8(4):427–38.
111. McMahon MF, Cash HC. An open assessment of the efficacy and tolerability of diclofenac sodium (Voltarol) in patients with rheumatic disease and a comparative study of diclofenac sodium (Voltarol) with indomethacin in patients with osteoarthritis and rheumatoid arthritis. Rheumatol Rehabil. 1979;Suppl 2:81–8.
112. Kolodny AL. Two double blind trials of diclofenac sodium with aspirin and with naproxen in the treatment of patients with rheumatoid arthritis. J Rheumatol. 1988 Aug;15(8):1205–11.
113. Crowley B, Hamill JJ, Lyndon S, McKellican JF, Williams P, Miller AJ. Controlled–release indomethacin and sustained–release diclofenac sodium in the treatment of rheumatoid arthritis: a comparative controlled clinical trial. Curr Med Res Opin. 1990;12(3):143–50.
114. Bocanegra TS, Weaver AL, Tindall EA, Sikes DH, Ball JA, Wallemark CB, Geis GS, Fort JG. Diclofenac/misoprostol compared with diclofenac in the treatment of osteoarthritis of the knee or hip: a randomized, placebo controlled trial. Arthrotec Osteoarthritis Study Group. J Rheumatol. 1998 Aug;25(8):1602–11.
115. Silverstein FE, Faich G, Goldstein JL, Simon LS, Pincus T, Whelton A, Makuch R, Eisen G, Agrawal NM, Stenson WF, Burr AM, Zhao WW, Kent JD, Lefkowith JB, Verburg KM, Geis GS. Gastrointestinal toxicity with celecoxib vs nonsteroidal anti–inflammatory drugs for osteoarthritis and rheumatoid arthritis: the CLASS study: A randomized controlled trial. Celecoxib Long–term Arthritis Safety Study. JAMA. 2000 Sep 13;284(10):1247–55.
116. McKenna F, Arguelles L, Burke T, Lefkowith J, Geis GS. Upper gastrointestinal tolerability of celecoxib compared with diclofenac in the treatment of osteoarthritis and rheumatoid arthritis. Clin Exp Rheumatol. 2002 Jan–Feb;20(1):35–43
117. Hawkey CJ, Skelly MM. Gastrointestinal safety of selective COX–2 inhibitors. Curr Pharm Des. 2002;8(12):1077–89.
118. Curtis SP, Bockow B, Fisher C, Olaleye J, Compton A, Ko AT, Reicin AS. Etoricoxib in the treatment of osteoarthritis over 52–weeks: a double–blind, active–comparator controlled trial [NCT00242489]. BMC Musculoskelet Disord. 2005 Dec 1;6:58.
119. Zacher J, Feldman D, Gerli R, Scott D, Hou SM, Uebelhart D, Rodger IW, Ozturk ZE; etoricoxib OA study group. A comparison of the therapeutic efficacy and tolerability of etoricoxib and diclofenac in patients with osteoarthritis. Curr Med Res Opin. 2003;19(8):725–36.
120. Hawkey C, Kahan A, Steinbruck K, Alegre C, Baumelou E, Begaud B, Dequeker J, Isomaki H, Littlejohn G, Mau J, Papazoglou S. Gastrointestinal tolerability of meloxicam compared to diclofenac in osteoarthritis patients. International MELISSA Study Group. Meloxicam Large–scale International Study Safety Assessment. Br J Rheumatol. 1998 Sep;37(9):937–45.
121. –Э–∞—Б–Њ–љ–Њ–≤ –Х.–Ы., –Ъ–∞—А–∞—В–µ–µ–≤ –Р.–Х. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –љ–µ—Б—В–µ—А–Њ–Є–і–љ—Л—Е –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є. –†–Ь–Ц 2006, 14, вДЦ 25, 1769–1777.
122. Riess W, Schmid K, Botta L, Kobayashi K, Moppert J, Schneider W, Sioufi A, Strusberg A, Tomasi M. The percutaneous absorption of diclofenac. Arzneimittelforschung. 1986 Jul;36(7):1092–6.
123. Radermacher J, Jentsch D, Scholl MA, Lustinetz T, Frolich JC. Diclofenac concentrations in synovial fluid and plasma after cutaneous application in inflammatory and degenerative joint disease. Br J Clin Pharmacol. 1991 May;31(5):537–41.
124. Sioufi A, Pommier F, Boschet F, Godbillon J, Lavoignat D, Salliere D. Percutaneous absorption of diclofenac in healthy volunteers after single and repeated topical application of diclofenac Emulgel. Biopharm Drug Dispos. 1994 Aug;15(6):441–9.
125. Niethard FU, Gold MS, Solomon GS, Liu JM, Unkauf M, Albrecht HH, Elkik F. Efficacy of topical diclofenac diethylamine gel in osteoarthritis of the knee. J Rheumatol. 2005 Dec;32(12):2384–92.
126. Bouchier–Hayes TA, Rotman H, Darekar BS. Comparison of the efficacy and tolerability of diclofenac gel (Voltarol Emulgel) and felbinac gel (Traxam) in the treatment of soft tissue injuries. Br J Clin Pract. 1990 Aug;44(8):319–20.
127. Spacca G, Cacchio A, Forgacs A, Monteforte P, Rovetta G. Analgesic efficacy of a lecithin–vehiculated diclofenac epolamine gel in shoulder periarthritis and lateral epicondylitis: a placebo–controlled, multicenter, randomized, double–blind clinical trial. Drugs Exp Clin Res. 2005;31(4):147–54.
128. Rosim GC, Barbieri CH, Lancas FM, Mazzer N. Diclofenac phonophoresis in human volunteers. Ultrasound Med Biol. 2005 Mar;31(3):337–43.
129. el–Hadidi T, el–Garf A. Double–blind study comparing the use of Voltaren Emulgel versus regular gel during ultrasonic sessions in the treatment of localized traumatic and rheumatic painful conditions. J Int Med Res. 1991 May–Jun;19(3):219–27.
130. Laurell CG, Zetterstrom C. Effects of dexamethasone, diclofenac, or placebo on the inflammatory response after cataract surgery. Br J Ophthalmol. 2002 Dec;86(12):1380–4.
131. Narvaez J, Krall P, Tooma TS. Prospective, randomized trial of diclofenac and ketorolac after refractive surgery. J Refract Surg. 2004 Jan–Feb;20(1):76–8.
132. Niva M, Biancari F, Valkama J, Juvonen J, Satta J, Juvonen T. Effects of diclofenac in the prevention of pericardial effusion after coronary artery bypass surgery. A prospective, randomized study. J Cardiovasc Surg (Torino). 2002 Aug;43(4):449–53.
133. Handel M, Phillips O, Anders S, Kock FX, Sell S. Dose–dependent efficacy of diclofenac–cholestyramine on pain and periarticular ossifications after total hip arthroplasty: a double–blind, prospective, randomised trial. Arch Orthop Trauma Surg. 2004 Sep;124(7):483–5.
134. Jockheck M, Willms R, Volkmann R, Sell S, Weller S, Kusswetter W. Prevention of periarticular heterotopic ossification after endoprosthetic hip joint replacement by means of diclofenac. Arch Orthop Trauma Surg. 1998;117(6–7):337–40.
135. Silvanto M, Lappi M, Rosenberg PH. Comparison of the opioid–sparing efficacy of diclofenac and ketoprofen for 3 days after knee arthroplasty. Acta Anaesthesiol Scand. 2002 Mar;46(3):322–8.
136. Fayaz MK, Abel RJ, Pugh SC, Hall JE, Djaiani G, Mecklenburgh JS. Opioid–sparing effects of diclofenac and paracetamol lead to improved outcomes after cardiac surgery. J Cardiothorac Vasc Anesth. 2004 Dec;18(6):742–7.
137. Oztekin S, Hepaguslar H, Kar AA, Ozzeybek D, Artikaslan O, Elar Z. Preemptive diclofenac reduces morphine use after remifentanil–based anaesthesia for tonsillectomy. Paediatr Anaesth. 2002 Oct;12(8):694–9.
138. Facchinetti F, Sgarbi L, Piccinini F, Volpe A. A comparison of glyceryl trinitrate with diclofenac for the treatment of primary dysmenorrhea: an open, randomized, cross–over trial. Gynecol Endocrinol. 2002 Feb;16(1):39–43.
139. Pannuti F, Robustelli della Cuna G, Ventaffrida V, Strocchi E, Camaggi CM. A double–blind evaluation of the analgesic efficacy and toxicity of oral ketorolac and diclofenac in cancer pain. The TD/10 recordati Protocol Study Group. Tumori. 1999 Mar–Apr;85(2):96–100.
140. Laerum E, Ommundsen OE, Gronseth JE, Christiansen A, Fagertun HE. Intramuscular diclofenac versus intravenous indomethacin in the treatment of acute renal colic. Eur Urol. 1996;30(3):358–62.
141. Tanko A, Tamas G. Use of sodium diclofenac in acute renal colic. Orv Hetil. 1996 Nov 10;137(45):2523–5.
142. Kumar A, Deed JS, Bhasin B, Kumar A, Thomas S. Comparison of the effect of diclofenac with hyoscine–N–butylbromide in the symptomatic treatment of acute biliary colic. ANZ J Surg. 2004 Jul;74(7):573–6.
143. –У–∞–ї—Г—И–Ї–Њ –Х.–Р., –≠—А–і–µ—Б –®.–§. –Ш–Ј—Г—З–µ–љ–Є–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –≤–Њ–ї—М—В–∞—А–µ–љ–∞ –≤ —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ. –†–Ь–Ц 2006, —В–Њ–Љ 14, вДЦ 4, 282–285.
144. Leman P, Kapadia Y, Herington J. Randomised controlled trial of the onset of analgesic efficacy of dexketoprofen and diclofenac in lower limb injury. Emerg Med J. 2003 Nov;20(6):511–3.












