–С—Л—Б—В—А—Л–є —А–Њ—Б—В —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є —Г—А–Њ–њ–∞—В–Њ–≥–µ–љ–љ–Њ–є Escherichia coli –Ї–Њ —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ–∞–Љ –Њ–±—А–∞—Й–∞–µ—В –љ–∞ —Б–µ–±—П –≤–љ–Є–Љ–∞–љ–Є–µ —Г—З–µ–љ—Л—Е –Є —П–≤–ї—П–µ—В—Б—П –њ–Њ–≤–Њ–і–Њ–Љ –і–ї—П –њ–µ—А–µ–Њ—Ж–µ–љ–Ї–Є –Љ–µ—Б—В–∞ –і–∞–љ–љ–Њ–є –≥—А—Г–њ–њ—Л –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –і–ї—П —В–µ—А–∞–њ–Є–Є –Ш–Ь–Я [4,5]. –Т –њ–Њ—Б–ї–µ–і–љ–Є—Е –њ–µ—А–µ—Б–Љ–Њ—В—А–∞—Е –љ–∞–Є–±–Њ–ї–µ–µ –Є–Ј–≤–µ—Б—В–љ—Л—Е –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ—Л—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–є –њ–Њ —В–µ—А–∞–њ–Є–Є –Ш–Ь–Я – —А—Г–Ї–Њ–≤–Њ–і—Б—В–≤–Њ –Х–≤—А–Њ–њ–µ–є—Б–Ї–Њ–є –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є —Г—А–Њ–ї–Њ–≥–Њ–≤ (EAU, 2011), –°–µ–≤–µ—А–Њ–∞–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Њ–≥–Њ –Њ–±—Й–µ—Б—В–≤–∞ –њ–Њ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–Љ –±–Њ–ї–µ–Ј–љ—П–Љ –Є –Х–≤—А–Њ–њ–µ–є—Б–Ї–Њ–≥–Њ –Њ–±—Й–µ—Б—В–≤–∞ –њ–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Љ–Є–Ї—А–Њ–±–Є–Њ–ї–Њ–≥–Є–Є –Є –∞–љ—В–Є–Љ–Є–Ї—А–Њ–±–љ–Њ–є —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є –њ–Њ –ї–µ—З–µ–љ–Є—О –Њ—Б—В—А–Њ–≥–Њ –љ–µ–Њ—Б–ї–Њ–ґ–љ–µ–љ–љ–Њ–≥–Њ —Ж–Є—Б—В–Є—В–∞ –Є –Њ—Б—В—А–Њ–≥–Њ –њ–Є–µ–ї–Њ–љ–µ—Д—А–Є—В–∞ —Г –ґ–µ–љ—Й–Є–љ (IDSA/ ESCMID, 2010) – –њ–Њ—П–≤–ї—П–µ—В—Б—П –Њ–≥—А–∞–љ–Є—З–µ–љ–Є–µ –њ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—О —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ–Њ–≤ –њ—А–Є –Ш–Ь–Я. –†–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –љ–µ –љ–∞–Ј–љ–∞—З–∞—В—М —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ—Л –њ—А–Є —Г—А–Њ–≤–љ–µ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Ї –љ–Є–Љ —Г—А–Њ–њ–∞—В–Њ–≥–µ–љ–Њ–≤ –≤ –њ–Њ–њ—Г–ї—П—Ж–Є–Є –±–Њ–ї–µ–µ 10% [1,6]. –Т –†–Њ—Б—Б–Є–Є —Г—А–Њ–≤–µ–љ—М —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В–Є —Г—А–Њ–њ–∞—В–Њ–≥–µ–љ–љ–Њ–є E. coli –Ї —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ–∞–Љ, –њ–Њ –і–∞–љ–љ—Л–Љ —А–∞–Ј–ї–Є—З–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –Ї–Њ–ї–µ–±–ї–µ—В—Б—П –Њ—В 4,3 –і–Њ 12,9%, —Б–Њ—Б—В–∞–≤–ї—П—П –≤ —Б—А–µ–і–љ–µ–Љ –Њ–Ї–Њ–ї–Њ 7–8% [7–10]. –Т —Б–≤—П–Ј–Є —Б —З–µ–Љ –Є –і–ї—П –љ–∞—И–µ–є —Б—В—А–∞–љ—Л —Н—В–Њ—В –≤–Њ–њ—А–Њ—Б —Б—В–∞–љ–Њ–≤–Є—В—Б—П –∞–Ї—В—Г–∞–ї—М–љ—Л–Љ.
–Ю–і–љ–∞–Ї–Њ —Г –Љ–љ–Њ–≥–Є—Е —Г—З–µ–љ—Л—Е –≤—Л–Ј—Л–≤–∞–µ—В —Б–Њ–Љ–љ–µ–љ–Є—П –Ї–Њ—А—А–µ–Ї—В–љ–Њ—Б—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –њ–Њ–њ—Г–ї—П—Ж–Є–Њ–љ–љ–Њ–≥–Њ —Г—А–Њ–≤–љ—П —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є —Г—А–Њ–њ–∞—В–Њ–≥–µ–љ–Њ–≤ –Ї–Њ —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ–∞–Љ –і–ї—П –њ—А–Њ–≥–љ–Њ–Ј–Є—А–Њ–≤–∞–љ–Є—П –Є—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є. –Я—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –≤–Њ–Ј–љ–Є–Ї–∞—О—В –≤–Њ–њ—А–Њ—Б—Л –Њ–± –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ–Њ—Б—В–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Њ—В—Б–µ–Ї–∞—О—Й–µ–≥–Њ –Ј–љ–∞—З–µ–љ–Є—П, —А–∞–≤–љ–Њ–≥–Њ 10%. –Ф–ї—П —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В–Њ–≤ –Є–Ј –Ґ–∞–є–≤–∞–љ—П —Г–њ–Њ–Љ—П–љ—Г—В—Л–µ –≤–Њ–њ—А–Њ—Б—Л –њ–Њ—Б–ї—Г–ґ–Є–ї–Є —В–Њ–ї—З–Ї–Њ–Љ –і–ї—П –Њ–±—Б—Г–ґ–і–µ–љ–Є—П –њ—А–Њ–±–ї–µ–Љ—Л –Є —А–∞–Ј—А–∞–±–Њ—В–Ї–Є –љ–∞—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ –Ї–Њ–љ—Б–µ–љ—Б—Г—Б–∞. –Р–≤—В–Њ—А—Л –Ї–Њ–љ—Б–µ–љ—Б—Г—Б–∞ –≤—Л–і–µ–ї–Є–ї–Є –і–ї—П –Њ–±—Б—Г–ґ–і–µ–љ–Є—П –Њ—Б–љ–Њ–≤–љ–Њ–µ –њ—А–Њ—В–Є–≤–Њ—А–µ—З–Є–µ –≤ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ–Њ–≤ –і–ї—П —В–µ—А–∞–њ–Є–Є –Ш–Ь–Я, –Ї–Њ—В–Њ—А–Њ–µ —Б—Д–Њ—А–Љ—Г–ї–Є—А–Њ–≤–∞–ї–Є —Б–ї–µ–і—Г—О—Й–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ – «–†–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М —Г—А–Њ–њ–∞—В–Њ–≥–µ–љ–∞ –Ї–Њ —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ–∞–Љ in vitro –љ–µ –≤—Б–µ–≥–і–∞ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М—О –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ–∞ –і–ї—П —В–µ—А–∞–њ–Є–Є –Ш–Ь–Я, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј, –љ–∞–њ—А–Є–Љ–µ—А –ї–µ–≤–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ–∞ 750 –Љ–≥ 1 —А–∞–Ј/—Б—Г—В.». –Ю—Б–љ–Њ–≤–∞–љ–Є–µ–Љ –і–ї—П —В–∞–Ї–Њ–є –њ–Њ—Б—В–∞–љ–Њ–≤–Ї–Є –≤–Њ–њ—А–Њ—Б–∞ –њ–Њ—Б–ї—Г–ґ–Є–ї–Є –і–∞–љ–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ —Б–Њ–њ–Њ—Б—В–∞–≤–ї–µ–љ–Є—О —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є–Ї–Є –Є —Д–∞—А–Љ–∞–Ї–Њ–і–Є–љ–∞–Љ–Є–Ї–Є —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ–Њ–≤, –∞ —В–∞–Ї–ґ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –і–∞–љ–љ—Л–µ, —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—Й–Є–µ, —З—В–Њ –і–ї—П –Ш–Ь–Я –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —А–∞–Ј—А–∞–±–∞—В—Л–≤–∞—В—М —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–µ –њ–Њ–≥—А–∞–љ–Є—З–љ—Л–µ –Ј–љ–∞—З–µ–љ–Є—П –і–ї—П –Є–љ—В–µ—А–њ—А–µ—В–∞—Ж–Є–Є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, –і–∞–љ–љ—Л–µ –Њ —В–Њ–Љ, —З—В–Њ –љ–µ—В—П–ґ–µ–ї—Л–µ –≤–љ–µ–±–Њ–ї—М–љ–Є—З–љ—Л–µ –Ш–Ь–Я, –≤—Л–Ј–≤–∞–љ–љ—Л–µ —Г—А–Њ–њ–∞—В–Њ–≥–µ–љ–∞–Љ–Є —Б –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –љ–µ–≤—Л—Б–Њ–Ї–Є–Љ–Є –Ј–љ–∞—З–µ–љ–Є—П–Љ–Є –Ь–Я–Ъ (16–32 –Љ–≥/–Љ–ї), –Њ—В–≤–µ—З–∞—О—В –љ–∞ —В–µ—А–∞–њ–Є—О —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ–∞–Љ–Є [3].
–Ґ–Њ—В —Д–∞–Ї—В, —З—В–Њ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М in vitro –≤–ї–Є—П–µ—В –љ–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –∞–љ—В–Є–Љ–Є–Ї—А–Њ–±–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –љ–µ –≤—Л–Ј—Л–≤–∞–µ—В —Б–Њ–Љ–љ–µ–љ–Є—П. –Ю–і–љ–∞–Ї–Њ —Б—В–µ–њ–µ–љ—М —В–∞–Ї–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –Њ—З–µ–љ—М —Б–Є–ї—М–љ–Њ –Ј–∞–≤–Є—Б–Є—В –Њ—В –Ї–Њ–љ–Ї—А–µ—В–љ–Њ–≥–Њ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞, –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є –Є–љ—Д–µ–Ї—Ж–Є–Є –Є –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л—Е –Ї—А–Є—В–µ—А–Є–µ–≤ –Є–љ—В–µ—А–њ—А–µ—В–∞—Ж–Є–Є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —В–Њ–ї—М–Ї–Њ –і–ї—П –Ї–Њ–—В—А–Є–Љ–Њ–Ї—Б–∞–Ј–Њ–ї–∞ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–∞ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ–∞—П —Б–≤—П–Ј—М –Љ–µ–ґ–і—Г —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В—М—О –Ї –љ–µ–Љ—Г —Г—А–Њ–њ–∞—В–Њ–≥–µ–љ–Њ–≤ in vitro –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М—О —В–µ—А–∞–њ–Є–Є. –Я–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ—А–Є –ї–µ—З–µ–љ–Є–Є –≤–љ–µ–±–Њ–ї—М–љ–Є—З–љ—Л—Е –Ш–Ь–Я –Ї–Њ–—В—А–Є–Љ–Њ–Ї—Б–∞–Ј–Њ–ї–Њ–Љ, –≤—Л–Ј–≤–∞–љ–љ–Њ–є —Г—Б—В–Њ–є—З–Є–≤—Л–Љ–Є –Ї –љ–µ–Љ—Г —Г—А–Њ–њ–∞—В–Њ–≥–µ–љ–∞–Љ–Є, –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —В–µ—А–∞–њ–Є–Є —Б–љ–Є–ґ–∞–µ—В—Б—П –і–Њ 50% [11]. –†–µ–Ј—Г–ї—М—В–∞—В—Л –њ–Њ–і–≥–Њ—В–Њ–≤–ї–µ–љ–љ–Њ–≥–Њ –љ–∞–Љ–Є —Б–Є—Б—В–µ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ–±–Ј–Њ—А–∞ –Є –Љ–µ—В–∞––∞–љ–∞–ї–Є–Ј–∞ –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ —В–µ—А–∞–њ–Є—П –Ї–Њ–—В—А–Є–Љ–Њ–Ї—Б–∞–Ј–Њ–ї–Њ–Љ –Ш–Ь–Я, –≤—Л–Ј–≤–∞–љ–љ–Њ–є —Г—Б—В–Њ–є—З–Є–≤—Л–Љ –Ї –Ї–Њ–—В—А–Є–Љ–Њ–Ї—Б–∞–Ј–Њ–ї—Г —И—В–∞–Љ–Љ–Њ–Љ, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —З–∞—Б—В–Њ—В—Л —Н—А–∞–і–Є–Ї–∞—Ж–Є–Є –≤ 1,81 —А–∞–Ј–∞, —Б—В–Њ–є–Ї–Њ–≥–Њ –±–∞–Ї—В–µ—А–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ—В–≤–µ—В–∞ –≤ 1,29 —А–∞–Ј–∞, –≤—Л–Ј–і–Њ—А–Њ–≤–ї–µ–љ–Є—П –≤ 1,65 —А–∞–Ј–∞, –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Ш–Ь–Я, –≤—Л–Ј–≤–∞–љ–љ—Л–Љ–Є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л–Љ–Є —И—В–∞–Љ–Љ–∞–Љ–Є [12]. –Ю–і–љ–∞–Ї–Њ —Н—В–Є –і–∞–љ–љ—Л–µ –Љ–Њ–ґ–љ–Њ –њ—А–Є–Љ–µ–љ—П—В—М —В–Њ–ї—М–Ї–Њ –і–ї—П –Ї–Њ–—В—А–Є–Љ–Њ–Ї—Б–∞–Ј–Њ–ї–∞ –Є –њ–µ—А–µ–љ–Њ—Б–Є—В—М —Н—В–Є—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –љ–∞ –і—А—Г–≥–Є–µ –≥—А—Г–њ–њ—Л –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ –љ–µ–Њ–±–Њ—Б–љ–Њ–≤–∞–љ.
–Т –Ї–Њ–љ—В–µ–Ї—Б—В–µ –Њ–±—Б—Г–ґ–і–µ–љ–Є—П —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є —Г—А–Њ–њ–∞—В–Њ–≥–µ–љ–Њ–≤ –Ї —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ–∞–Љ –≤–∞–ґ–љ—Л–Љ —Д–∞–Ї—В–Њ–Љ —П–≤–ї—П–µ—В—Б—П —В–Њ, —З—В–Њ –Ї—А–Є—В–µ—А–Є–Є –Є–љ—В–µ—А–њ—А–µ—В–∞—Ж–Є–Є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї–µ–є —Б–µ–Љ–µ–є—Б—В–≤–∞ Enterobacteriaceae (–љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В—Л–µ –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–Є –Ш–Ь–Я) –Ї –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ, —А–∞–Ј—А–∞–±–Њ—В–∞–љ–љ—Л–µ CLSI (–Ш–љ—Б—В–Є—В—Г—В –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е —Б—В–∞–љ–і–∞—А—В–Њ–≤, –°–®–Р), –Њ—А–Є–µ–љ—В–Є—А–Њ–≤–∞–љ—Л –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –љ–∞ –ї–µ—З–µ–љ–Є–µ —Б–Є—Б—В–µ–Љ–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є (—Б–µ–њ—Б–Є—Б, –±–∞–Ї—В–µ—А–Є–µ–Љ–Є—П) [13]. –Ґ.–µ. –Ї—А–Є—В–µ—А–Є–Є –Њ—Ж–µ–љ–Ї–Є —И—В–∞–Љ–Љ–∞ –Ї–∞–Ї —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ–≥–Њ –Є–ї–Є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ–≥–Њ –±–∞–Ј–Є—А—Г—О—В—Б—П –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –љ–∞ —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ—Л—Е –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П—Е –њ—А–µ–њ–∞—А–∞—В–∞. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –і–ї—П –Њ—В–і–µ–ї—М–љ—Л—Е —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ–Њ–≤ (–ї–Њ–Љ–µ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ, –Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ, –љ–Њ—А—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ) —А–∞–Ј—А–∞–±–Њ—В–∞–љ—Л —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–µ –Ї—А–Є—В–µ—А–Є–Є –Є–љ—В–µ—А–њ—А–µ—В–∞—Ж–Є–Є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є (CLSI) –і–ї—П –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї–µ–є —Б–µ–Љ–µ–є—Б—В–≤–∞ Enterobacteriaceae –Є Pseudomonas aeruginosa, –Њ—А–Є–µ–љ—В–Є—А–Њ–≤–∞–љ—Л—Е –љ–∞ –ї–µ—З–µ–љ–Є–µ –Ш–Ь–Я. –Ф–ї—П —Ж–Є–њ—А–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ–∞ –Є –ї–µ–≤–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ–∞ —В–∞–Ї–Є–µ –Ї—А–Є—В–µ—А–Є–Є –љ–µ —А–∞–Ј—А–∞–±–Њ—В–∞–љ—Л [13], –≤ —Б–≤—П–Ј–Є —Б —З–µ–Љ –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –±–∞–Ї—В–µ—А–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –ї–∞–±–Њ—А–∞—В–Њ—А–Є–є, –Є—Б–њ–Њ–ї—М–Ј—Г—О—Й–Є–µ –Ї—А–Є—В–µ—А–Є–Є –Є–љ—В–µ—А–њ—А–µ—В–∞—Ж–Є–Є CLSI, –Њ–њ—А–µ–і–µ–ї—П—О—В —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –±–∞–Ї—В–µ—А–Є–є —Б–µ–Љ–µ–є—Б—В–≤–∞ Enterobacteriaceae, –≤—Л–і–µ–ї–µ–љ–љ—Л—Е –Є–Ј –Љ–Њ—З–Є, –Ї –ї–µ–≤–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ—Г –Є —Ж–Є–њ—А–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ—Г, –Є—Б–њ–Њ–ї—М–Ј—Г—П –љ–µ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–µ –Ї—А–Є—В–µ—А–Є–Є –Є–љ—В–µ—А–њ—А–µ—В–∞—Ж–Є–Є.
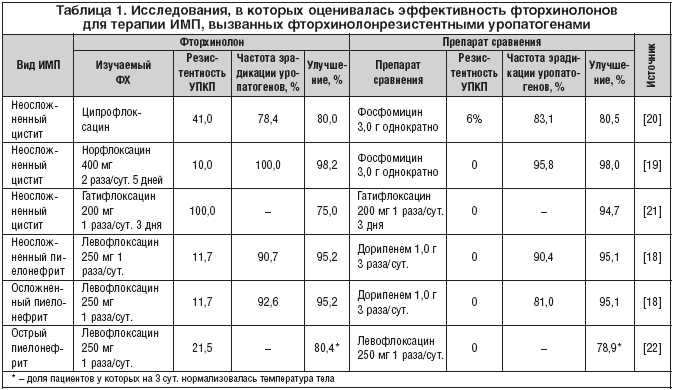
–Ъ –љ–∞—Б—В–Њ—П—Й–µ–Љ—Г –≤—А–µ–Љ–µ–љ–Є –љ–∞–Ї–Њ–њ–ї–µ–љ—Л –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –і–∞–љ–љ—Л–µ, —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—Й–Є–µ, —З—В–Њ –њ—А–Є –њ—А–Є–µ–Љ–µ –ї–µ–≤–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ–∞ –≤ –і–Њ–Ј–µ 500 –Є 750 –Љ–≥ –µ–≥–Њ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –≤ –Љ–Њ—З–µ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 347 –Є 620 –Љ–≥/–ї, —З—В–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –њ—А–µ–≤—Л—И–∞–µ—В –≤–µ–ї–Є—З–Є–љ—Г –Љ–Є–љ–Є–Љ–∞–ї—М–љ–Њ–є –њ–Њ–і–∞–≤–ї—П—О—Й–µ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є (–Ь–Я–Ъ) –і–ї—П –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ —Г—А–Њ–њ–∞—В–Њ–≥–µ–љ–Њ–≤. –С–Њ–ї–µ–µ —В–Њ–≥–Њ, –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –ї–µ–≤–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ, –љ–∞–Ј–љ–∞—З–∞–µ–Љ—Л–є –≤ –і–Њ–Ј–Є—А–Њ–≤–Ї–µ 750 –Љ–≥, –і–µ–є—Б—В–≤—Г–µ—В –±–∞–Ї—В–µ—А–Є—Ж–Є–і–љ–Њ –љ–∞ —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ—А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л–µ —И—В–∞–Љ–Љ—Л —Г—А–Њ–њ–∞—В–Њ–≥–µ–љ–љ–Њ–є E. coli (–Ь–Я–Ъ 4–32 –Љ–≥/–ї) —Г –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ [14,15]. –Э–∞—А—П–і—Г —Б —Н—В–Є–Љ, –≤ –љ–µ–Ї–Њ—В–Њ—А—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е ex vivo –±—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ —Ж–Є–њ—А–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ –≤ –і–Њ–Ј–µ 500 –Љ–≥ 2 —А/—Б—Г—В. —П–≤–ї—П–ї—Б—П —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ —А–µ–ґ–Є–Љ–Њ–Љ –і–ї—П –ї–µ—З–µ–љ–Є—П –Њ—Б—В—А–Њ–≥–Њ —Ж–Є—Б—В–Є—В–∞, –≤—Л–Ј–≤–∞–љ–љ–Њ–≥–Њ —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ—А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л–Љ–Є —И—В–∞–Љ–Љ–∞–Љ–Є —Г—А–Њ–њ–∞—В–Њ–≥–µ–љ–љ–Њ–є E. coli (–Ь–Я–Ъ > 4 –Љ–≥/–ї) [16]. –Ґ–∞–Ї–ґ–µ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Б —Г—З–∞—Б—В–Є–µ–Љ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–Є–µ–ї–Њ–љ–µ—Д—А–Є—В–Њ–Љ –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —Ж–Є–њ—А–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ –Є –ї–µ–≤–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ –њ—А–Є–≤–Њ–і–Є–ї–Є –Ї —Н—А–∞–і–Є–Ї–∞—Ж–Є–Є —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ—А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л—Е —И—В–∞–Љ–Љ–Њ–≤ —Г—А–Њ–њ–∞—В–Њ–≥–µ–љ–љ–Њ–є E. coli –≤ 50 –Є 100% —Б–ї—Г—З–∞–µ–≤, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ (–Ь–Я–Ъ –≤—Л–і–µ–ї–µ–љ–љ—Л—Е —И—В–∞–Љ–Љ–Њ–≤ –і–ї—П –ї–µ–≤–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ–∞ —Б–Њ—Б—В–∞–≤–ї—П–ї–∞ 32 –Љ–≥/–ї, –і–ї—П —Ж–Є–њ—А–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ–∞ 8 –Љ–≥/–ї –Є >32 –Љ–≥/–ї) [17]. –Т –љ–µ–Ї–Њ—В–Њ—А—Л—Е —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –њ—А–Є —Б—А–∞–≤–љ–µ–љ–Є–Є —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ–Њ–≤ —Б –і—А—Г–≥–Є–Љ–Є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ–Є (–і–Њ—А–Є–њ–µ–љ–µ–Љ) –Є–ї–Є –њ—А–Є —Б—А–∞–≤–љ–µ–љ–Є–Є —А–∞–Ј–ї–Є—З–љ—Л—Е —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ–Њ–≤ –њ—А–Є –Ш–Ь–Я –љ–∞–Ї–Њ–њ–ї–µ–љ–∞ –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—П –Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ–Њ–≤ –њ—А–Є –Ш–Ь–Я, –≤—Л–Ј–≤–∞–љ–љ—Л—Е —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ—А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л–Љ–Є —И—В–∞–Љ–Љ–∞–Љ–Є (—В–∞–±–ї. 1). –Э–∞–Є–±–Њ–ї—М—И–Є–є –Є–љ—В–µ—А–µ—Б –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –≤ –Ї–Њ—В–Њ—А–Њ–Љ —Б—А–∞–≤–љ–Є–≤–∞–ї–∞—Б—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –ї–µ–≤–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ–∞ –Є –і–Њ—А–Є–њ–µ–љ–µ–Љ–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ—Б–ї–Њ–ґ–љ–µ–љ–љ–Њ–є –Ш–Ь–Я –Є –Њ—Б—В—А—Л–Љ –њ–Є–µ–ї–Њ–љ–µ—Д—А–Є—В–Њ–Љ. –Т –і–∞–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –ї–µ–≤–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ –љ–µ —Г—Б—В—Г–њ–∞–µ—В –њ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –і–Њ—А–Є–њ–µ–љ–µ–Љ—Г, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ —В–Њ, —З—В–Њ —З–∞—Б—В–Њ—В–∞ –≤—Л–і–µ–ї–µ–љ–Є—П —Г—А–Њ–њ–∞—В–Њ–≥–µ–љ–Њ–≤, —Г—Б—В–Њ–є—З–Є–≤—Л—Е –Ї –ї–µ–≤–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ—Г –Є –і–Њ—А–Є–њ–µ–љ–µ–Љ—Г, —Б–Њ—Б—В–∞–≤–Є–ї–∞ 11,7 –Є 0% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ [18].
–Э–∞–Љ–Є –≤ 2009 –≥. –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–∞ –Њ—Ж–µ–љ–Ї–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –љ–Њ—А—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ–∞ –њ—А–Є –Њ—Б—В—А–Њ–Љ —Ж–Є—Б—В–Є—В–µ –≤ —А–µ–≥–Є–Њ–љ–µ —Б —Г—А–Њ–≤–љ–µ–Љ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є E. coli –Ї —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ–∞–Љ, –њ—А–µ–≤—Л—И–∞—О—Й–Є–Љ 10%. –Т —Е–Њ–і–µ –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤–Њ–≥–Њ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –≤ –Ї–Њ—В–Њ—А–Њ–µ –≤–Ї–ї—О—З–Є–ї–Є 108 –ґ–µ–љ—Й–Є–љ –≤ –≤–Њ–Ј—А–∞—Б—В–µ 18–55 –ї–µ—В —Б –Њ—Б—В—А—Л–Љ –љ–µ–Њ—Б–ї–Њ–ґ–љ–µ–љ–љ—Л–Љ —Ж–Є—Б—В–Є—В–Њ–Љ, —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ —Н—А–∞–і–Є–Ї–∞—Ж–Є—П –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П –Є —Б—В–Њ–є–Ї–Є–є –±–∞–Ї—В–µ—А–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –Њ—В–≤–µ—В –Њ—В–Љ–µ—З–∞–ї–Є—Б—М —Г 100 –Є 95,2% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –љ–Њ—А—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –љ–Њ—А—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ —Б–Њ—Е—А–∞–љ—П–µ—В –Ї–ї–Є–љ–Є—З–µ—Б–Ї—Г—О –Є –Љ–Є–Ї—А–Њ–±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–Є –Њ—Б—В—А–Њ–Љ –љ–µ–Њ—Б–ї–Њ–ґ–љ–µ–љ–љ–Њ–Љ —Ж–Є—Б—В–Є—В–µ –≤ —Г—Б–ї–Њ–≤–Є—П—Е 10%––љ–Њ–є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В–Є —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л—Е —И—В–∞–Љ–Љ–Њ–≤ [19].
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Б—Г—Й–µ—Б—В–≤—Г—О—В –њ—А–µ–і–њ–Њ—Б—Л–ї–Ї–Є –і–ї—П –њ–µ—А–µ—Б–Љ–Њ—В—А–∞ –Ї—А–Є—В–µ—А–Є–µ–≤ –Є–љ—В–µ—А–њ—А–µ—В–∞—Ж–Є–Є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є —Г—А–Њ–њ–∞—В–Њ–≥–µ–љ–Њ–≤ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ–Њ–≤ –≤ —Б–ї—Г—З–∞–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Є—Е –і–ї—П —В–µ—А–∞–њ–Є–Є –Ш–Ь–Я. –Я–Њ –Љ–љ–µ–љ–Є—О —Г—З–∞—Б—В–љ–Є–Ї–Њ–≤ –Ї–Њ–љ—Б–µ–љ—Б—Г—Б–∞ –≤ –Ґ–∞–є–≤–∞–љ–µ, –љ–µ–Њ–±—Е–Њ–і–Є–Љ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞–љ–љ—Л–є –њ–Њ–і—Е–Њ–і –Ї –Є–љ—В–µ—А–њ—А–µ—В–∞—Ж–Є–Є –Ї—А–Є—В–µ—А–Є–µ–≤ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є —Г—А–Њ–њ–∞—В–Њ–≥–µ–љ–Њ–≤, –≤—Л–і–µ–ї–µ–љ–љ—Л—Е –Њ—В –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ш–Ь–Я, –Ї–Њ —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ–∞–Љ. –£—З–Є—В—Л–≤–∞—П —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –ї–µ–≤–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ–∞, –љ–∞–Ј–љ–∞—З–∞–µ–Љ–Њ–≥–Њ –≤ –і–Њ–Ј–Є—А–Њ–≤–Ї–µ 750 –Љ–≥, –µ–≥–Њ –Ь–Я–Ъ –і–ї—П —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л—Е —И—В–∞–Љ–Љ–Њ–≤ —Г—А–Њ–њ–∞—В–Њ–≥–µ–љ–Њ–≤ –і–Њ–ї–ґ–љ–Њ –≤–∞—А—М–Є—А–Њ–≤–∞—В—М –≤ –њ—А–µ–і–µ–ї–∞—Е 16–32 –Љ–≥/–ї, –Њ–і–љ–∞–Ї–Њ –≤ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е CLSI –і–∞–љ–љ–∞—П –≤–µ–ї–Є—З–Є–љ–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В ≤2 –Љ–≥/–ї. –Х—Б–ї–Є –њ—А–Є–љ—П—В—М –≤–Њ –≤–љ–Є–Љ–∞–љ–Є–µ –і–∞–љ–љ—Л–µ –Ј–љ–∞—З–µ–љ–Є—П –Ь–Я–Ъ –і–ї—П –ї–µ–≤–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ–∞, —В–Њ –±–Њ–ї–µ–µ 90% —И—В–∞–Љ–Љ–Њ–≤ —Г—А–Њ–њ–∞—В–Њ–≥–µ–љ–љ–Њ–є E. coli, –≤—Л–і–µ–ї–µ–љ–љ—Л—Е –і–∞–ґ–µ –Њ—В –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –Ю–†–Ш–Ґ, –Њ–Ї–∞–ґ—Г—В—Б—П —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л–Љ–Є –Ї –і–∞–љ–љ–Њ–Љ—Г –њ—А–µ–њ–∞—А–∞—В—Г [3]. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ–Њ –Љ–љ–µ–љ–Є—О —Г—З–∞—Б—В–љ–Є–Ї–Њ–≤ –Ї–Њ–љ—Б–µ–љ—Б—Г—Б–∞, –µ—Б–ї–Є —З–∞—Б—В–Њ—В–∞ –≤—Л–і–µ–ї–µ–љ–Є—П —Г—Б—В–Њ–є—З–Є–≤—Л—Е –Ї –ї–µ–≤–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ—Г —Г—А–Њ–њ–∞—В–Њ–≥–µ–љ–Њ–≤ –≤ –њ–Њ–њ—Г–ї—П—Ж–Є–Є –њ—А–µ–≤—Л—И–∞–µ—В 20%, —В–Њ –і–ї—П —Н–Љ–њ–Є—А–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є –Ш–Ь–Я –і–∞–љ–љ—Л–є –њ—А–µ–њ–∞—А–∞—В –і–Њ–ї–ґ–µ–љ –љ–∞–Ј–љ–∞—З–∞—В—М—Б—П –≤ –і–Њ–Ј–Є—А–Њ–≤–Ї–µ 750 –Љ–≥, —З—В–Њ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –њ—А–µ–Њ–і–Њ–ї–µ–љ–Є—О —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є —Г —И—В–∞–Љ–Љ–Њ–≤ —Г—А–Њ–њ–∞—В–Њ–≥–µ–љ–љ–Њ–є E. coli —Б –Ь–Я–Ъ –Љ–µ–љ–µ–µ 32 –Љ–≥/–ї [3]. –Ю–і–љ–∞–Ї–Њ —Б–ї–µ–і—Г–µ—В –њ—А–Њ—П–≤–ї—П—В—М –љ–∞—Б—В–Њ—А–Њ–ґ–µ–љ–љ–Њ—Б—В—М –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –ї–µ–≤–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ–∞ –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б –Ш–Ь–Я, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–Є–Љ–Є—Б—П –±–∞–Ї—В–µ—А–Є–µ–Љ–Є–µ–є, –Є–ї–Є —Г—А–Њ—Б–µ–њ—Б–Є—Б–Њ–Љ –≤ —Г—Б–ї–Њ–≤–Є—П—Е —И–Є—А–Њ–Ї–Њ–є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В–Є —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ—А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л—Е —Г—А–Њ–њ–∞—В–Њ–≥–µ–љ–Њ–≤ –≤ –њ–Њ–њ—Г–ї—П—Ж–Є–Є.
–Ю—Б–љ–Њ–≤–љ—Л–Љ–Є –≤—Л–≤–Њ–і–∞–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–ґ–љ–Њ —Б–і–µ–ї–∞—В—М –Є—Б—Е–Њ–і—П –Є–Ј –Љ–∞—В–µ—А–Є–∞–ї–Њ–≤ –Ї–Њ–љ—Б–µ–љ—Б—Г—Б–∞, —П–≤–ї—П—О—В—Б—П —Б–ї–µ–і—Г—О—Й–Є–µ.
1. –§—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ—Л, –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –ї–µ–≤–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ, —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л —Г –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ш–Ь–Я, –≤—Л–Ј–≤–∞–љ–љ—Л–Љ–Є —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ—А–µ–Ј–Є—Б—В–µ–љ—Л–Љ–Є —И—В–∞–Љ–Љ–∞–Љ–Є –±–∞–Ї—В–µ—А–Є–є, –µ—Б–ї–Є —Г—А–Њ–≤–µ–љ—М –Ь–Я–Ъ –љ–µ –њ—А–µ–≤—Л—И–∞–µ—В 32 –Љ–≥/–ї. –≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ–Њ–≤ –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –љ–µ —Б—В–Њ–ї—М–Ї–Њ —Г—А–Њ–≤–љ–µ–Љ –њ–Њ–њ—Г–ї—П—Ж–Є–Њ–љ–љ–Њ–є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є, —Б–Ї–Њ–ї—М–Ї–Њ –≤–µ–ї–Є—З–Є–љ–Њ–є –Ь–Я–Ъ.
2. –Я—А–Є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В–Є —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ—А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л—Е —И—В–∞–Љ–Љ–Њ–≤ —Г—А–Њ–њ–∞—В–Њ–≥–µ–љ–Њ–≤ <20% –ї–µ–≤–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ –Љ–Њ–ґ–љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –≤ —Б—В–∞–љ–і–∞—А—В–љ—Л—Е –і–Њ–Ј–Є—А–Њ–≤–Ї–∞—Е, –њ—А–Є –њ—А–µ–≤—Л—И–µ–љ–Є–Є —Н—В–Њ–≥–Њ –њ–Њ—А–Њ–≥–∞, –љ–Њ –њ—А–Є –Ь–Я–Ъ, –љ–µ –њ—А–µ–≤—Л—И–∞—О—Й–µ–Љ 32 –Љ–≥/–ї, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –і–Њ–Ј—Л 750 –Љ–≥ 1 —А–∞–Ј/—Б—Г—В.
3. –Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ—А–Њ—П–≤–ї—П—В—М –Њ—Б—В–Њ—А–Њ–ґ–љ–Њ—Б—В—М –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –ї–µ–≤–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ–∞ –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б –Ш–Ь–Я, —Б –њ–Њ–і–Њ–Ј—А–µ–љ–Є–µ–Љ –љ–∞ –±–∞–Ї—В–µ—А–Є–µ–Љ–Є—О –Є–ї–Є —Г—А–Њ—Б–µ–њ—Б–Є—Б –≤ —Г—Б–ї–Њ–≤–Є—П—Е —И–Є—А–Њ–Ї–Њ–є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В–Є —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ—А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л—Е —Г—А–Њ–њ–∞—В–Њ–≥–µ–љ–Њ–≤ –≤ –њ–Њ–њ—Г–ї—П—Ж–Є–Є.
–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. Grabe, M., T. Bjerklund–Johansen, H. Botto, K. Naber and M. Bishop, Guidelines on urological infections. 2010: European Association of Urology.
2. Gupta, K., T.M. Hooton, K.G. Naber, B. Wullt, R. Colgan, L.G. Miller, G.J. Moran, L.E. Nicolle, R. Raz, A.J. Schaeffer, and D.E. Soper, International clinical practice guidelines for the treatment of acute uncomplicated cystitis and pyelonephritis in women: A 2010 update by the Infectious Diseases Society of America and the European Society for Microbiology and Infectious Diseases. Clin Infect Dis, 2011. 52(5): p. e103–20.
3. Hsueh, P.R., Y.J. Lau, W.C. Ko, C.Y. Liu, C.T. Huang, M.Y. Yen, Y.C. Liu, W.S. Lee, C.H. Liao, M.Y. Peng, C.M. Chen, and Y.S. Chen, Consensus statement on the role of fluoroquinolones in the management of urinary tract infections. J Microbiol Immunol Infect, 2011. 44(2): p. 79–82.
4. Khawcharoenporn, T., S. Vasoo, E. Ward and K. Singh, High rates of quinolone resistance among urinary tract infections in the ED. Am J Emerg Med, 2010.
5. Johnson, L., A. Sabel, W.J. Burman, R.M. Everhart, M. Rome, T.D. MacKenzie, J. Rozwadowski, P.S. Mehler, and C.S. Price, Emergence of fluoroquinolone resistance in outpatient urinary Escherichia coli isolates. Am J Med, 2008. 121(10): p. 876–84.
6. Gupta, K., T.M. Hooton, K.G. Naber, B. Wullt, R. Colgan, L.G. Miller, G.J. Moran, L.E. Nicolle, R. Raz, A.J. Schaeffer, and D.E. Soper, International Clinical Practice Guidelines for the Treatment of Acute Uncomplicated Cystitis and Pyelonephritis in Women: A 2010 Update by the Infectious Diseases Society of America and the European Society for Microbiology and Infectious Diseases. Clinical Infectious Diseases, 2011. 52(5): p. e103–e120.
7. –†–∞—Д–∞–ї—М—Б–Ї–Є–є, –Т.–Т., –Ы.–°. –°—В—А–∞—З—Г–љ—Б–Ї–Є–є, –Я.–Р. –С–∞–±–Ї–Є–љ, –Т.–°. –Т–∞–ї–µ–љ—Б–Ї–∞—П, –Ы.–Р. –У–∞–±–±–∞—Б–Њ–≤–∞, –Ю.–С. –Ф–Љ–Є—В—А–Є–µ–≤–∞, –Ш.–Т. –Х–Љ–µ–ї—М—П–љ–Њ–≤–∞, and –Т.–Э. –Ъ—А—Г–њ–Є–љ, –†–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є –љ–µ–Њ—Б–ї–Њ–ґ–љ–µ–љ–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є –Љ–Њ—З–µ–≤—Л—Е –њ—Г—В–µ–є –≤ –†–Њ—Б—Б–Є–Є –£—А–Њ–ї–Њ–≥–Є—П, 2006(5): p. 34–37.
8. Grude, N., N.I. Potaturkina–Nesterova, A. Jenkins, L. Strand, F.L. Nowrouzian, J. Nyhus, and B.E. Kristiansen, A comparison of phylogenetic group, virulence factors and antibiotic resistance in Russian and Norwegian isolates of Escherichia coli from urinary tract infection. Clin Microbiol Infect, 2007. 13(2): p. 208–11.
9. –У—А–Є–і–љ–µ–≤, –Ю.–Т., –Ъ–ї–Є–љ–Є–Ї–Њ–—Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –∞—Б–њ–µ–Ї—В—Л —А–∞—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ—В–µ—А–∞–њ–Є–Є –Є–љ—Д–µ–Ї—Ж–Є–є –Љ–Њ—З–µ–≤—Л–≤–Њ–і—П—Й–Є—Е –њ—Г—В–µ–є (–Ї–ї–Є–љ–Є–Ї–Њ–—Н–Ї–Њ–љ–Њ–Љ–Є—З–µ—Б–Ї–Њ–µ –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ). 2006: –Ь–Њ—Б–Ї–≤–∞, 2006. p. 124.
10. Schito, G.C., K.G. Naber, H. Botto, J. Palou, T. Mazzei, L. Gualco, and A. Marchese, The ARESC study: an international survey on the antimicrobial resistance of pathogens involved in uncomplicated urinary tract infections. Int J Antimicrob Agents, 2009. 34(5): p. 407–13.
11. Talan, D.A., A. Krishnadasan, F.M. Abrahamian, W.E. Stamm and G.J. Moran, Prevalence and risk factor analysis of trimethoprim–sulfamethoxazole– and fluoroquinolone–resistant Escherichia coli infection among emergency department patients with pyelonephritis. Clin Infect Dis, 2008. 47(9): p. 1150–8.
12. –†–∞—Д–∞–ї—М—Б–Ї–Є–є, –Т.–Т. and –Ы.–Т. –•–Њ–і–љ–µ–≤–Є—З, –Т–ї–Є—П–љ–Є–µ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є –Є–љ—Д–µ–Ї—Ж–Є–є –Љ–Њ—З–µ–≤—Л–≤–Њ–і—П—Й–Є—Е –њ—Г—В–µ–є –љ–∞ –Є—Б—Е–Њ–і—Л –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є. –£—А–Њ–ї–Њ–≥–Є—П, 2008(4): p. 3–9.
13. Clinical and Laboratory Standards Institute, Performance Standards for Antimicrobial Susceptibility Testing; Seventeenth Informational Supplement. CLSI document M100–S17. 2007, 940 West Valley Road, Suite 1400, Wayne, Pennsylvania 19087–1898 USA: Clinical and Laboratory Standards Institute. 182.
14. Stein, G.E., S.L. Schooley and D.P. Nicolau, Urinary bactericidal activity of single doses (250, 500, 750 and 1000 mg) of levofloxacin against fluoroquinolone–resistant strains of Escherichia coli. Int J Antimicrob Agents, 2008. 32(4): p. 320–5.
15. Deguchi, T., K. Nakane, M. Yasuda, T. Shimizu, K. Monden, S. Arakawa, and T. Matsumoto, Microbiological outcome of complicated urinary tract infections treated with levofloxacin: a pharmacokinetic/pharmacodynamic analysis. Int J Antimicrob Agents, 2010.
16. Miller, L.G., R. Mehrotra and A.W. Tang, Does in vitro fluoroquinolone resistance predict clinical failure in urinary tract infections? Int J Antimicrob Agents, 2007. 29(5): p. 605–7.
17. Klausner, H.A., P. Brown, J. Peterson, S. Kaul, M. Khashab, A.C. Fisher, and J.B. Kahn, A trial of levofloxacin 750 mg once daily for 5 days versus ciprofloxacin 400 mg and/or 500 mg twice daily for 10 days in the treatment of acute pyelonephritis. Curr Med Res Opin, 2007. 23(11): p. 2637–45.
18. Naber, K.G., L. Llorens, K. Kaniga, P. Kotey, D. Hedrich and R. Redman, Intravenous doripenem at 500 milligrams versus levofloxacin at 250 milligrams, with an option to switch to oral therapy, for treatment of complicated lower urinary tract infection and pyelonephritis. Antimicrob Agents Chemother, 2009. 53(9): p. 3782–92.
19. –†–∞—Д–∞–ї—М—Б–Ї–Є–є, –Т.–Т., –Ш.–Т. –Ь–∞–ї–µ–≤, –Р.–Т. –Ф–µ—А–µ–≤–Є—Ж–Ї–Є–є, –°.–Э. –Ъ–Њ–Ј–ї–Њ–≤ and –Т.–Т. –У–∞–ї–Ї–Є–љ, –≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –љ–Њ—А—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ–∞ –њ—А–Є –Њ—Б—В—А–Њ–Љ —Ж–Є—Б—В–Є—В–µ –≤ —А–µ–≥–Є–Њ–љ–µ —Б 10% —Г—А–Њ–≤–љ–µ–Љ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є E.coli –Ї —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ–∞–Љ: —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–µ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ. –£—А–Њ–ї–Њ–≥–Є—П, 2009(3): p. 18–21.
20. Ceran, N., D. Mert, F.Y. Kocdogan, I. Erdem, R. Adalati, S. Ozyurek, and P. Goktas, A randomized comparative study of single–dose fosfomycin and 5–day ciprofloxacin in female patients with uncomplicated lower urinary tract infections. J Infect Chemother, 2010.
21. Yamamoto, S., K. Akiyama, T. Yoshimoto, M. Kanokogi, H. Yabumoto, H. Ihara, E. Ishikawa, M. Yoshioka, K. Kokura, and H. Shima, Clinical efficacy of oral administration of 200 mg gatifloxacin once daily for 3 days for the treatment of patients with uncomplicated cystitis. J Infect Chemother, 2009. 15(2): p. 104–7.
22. Kang, S.J., D.R. Chung, S.Y. Park, Y.E. Ha, E.J. Joo, M.K. Joung, C.I. Kang, K.R. Peck, and J.H. Song, Clinical impact of fluoroquinolone resistance in acute pyelonephritis caused by Escherichia coliUrinary tract infections. P1391. Clinical Microbiology and Infection, 2011. 17(Supplement s4): p. S104.












