–Т–≤–µ–і–µ–љ–Є–µ
–Ь–Њ—З–µ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞ (–Ь–Ъ) —П–≤–ї—П–µ—В—Б—П –Ї–Њ–љ–µ—З–љ—Л–Љ –њ—А–Њ–і—Г–Ї—В–Њ–Љ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –њ—Г—А–Є–љ–Њ–≤—Л—Е –Њ—Б–љ–Њ–≤–∞–љ–Є–є, –Є –µ–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –≤ –Ї—А–Њ–≤–Є –Љ–Њ–ґ–µ—В —Г–≤–µ–ї–Є—З–Є–≤–∞—В—М—Б—П —Г –ї—О–і–µ–є, —З–µ–ї–Њ–≤–µ–Ї–Њ–Њ–±—А–∞–Ј–љ—Л—Е –Њ–±–µ–Ј—М—П–љ –Є –љ–µ–Ї–Њ—В–Њ—А—Л—Е –≤–Є–і–Њ–≤ —Б–Њ–±–∞–Ї –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –њ—А–Њ–Є–Ј–Њ—И–µ–і—И–Є—Е –≤ –њ—А–Њ—Ж–µ—Б—Б–µ —Н–≤–Њ–ї—О—Ж–Є–Є –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е –Љ—Г—В–∞—Ж–Є–є [1]. –Я–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Ь–Ъ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –≤—Л—И–µ 7 –Љ–≥/–і–ї (420 –Љ–Ї–Љ–Њ–ї—М/–ї) —Г –Љ—Г–ґ—З–Є–љ –Є –ґ–µ–љ—Й–Є–љ –њ–Њ—Б–ї–µ –Љ–µ–љ–Њ–њ–∞—Г–Ј—Л –Є –≤—Л—И–µ 6 –Љ–≥/–і–ї (360 –Љ–Ї–Љ–Њ–ї—М/–ї) —Г –ґ–µ–љ—Й–Є–љ –і–Њ –Љ–µ–љ–Њ–њ–∞—Г–Ј—Л –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –Ї–∞–Ї –≥–Є–њ–µ—А—Г—А–Є–Ї–µ–Љ–Є—П (–У–£). –£—А–Њ–≤–µ–љ—М –Ь–Ъ –≤ –Ї—А–Њ–≤–Є —А–µ–≥—Г–ї–Є—А—Г–µ—В—Б—П —В—А–µ–Љ—П –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞–Љ–Є: —Н–љ–і–Њ–≥–µ–љ–љ—Л–Љ —Б–Є–љ—В–µ–Ј–Њ–Љ, —Н–Ї—Б–Ї—А–µ—Ж–Є–µ–є –Є —А–µ–∞–±—Б–Њ—А–±—Ж–Є–µ–є –≤ –њ–Њ—З–Ї–∞—Е –Є –Ї–Є—И–µ—З–љ–Є–Ї–µ [2]. –Т —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Г—Б–ї–Њ–≤–Є—П—Е –њ—А–Њ–Є–Ј–≤–Њ–і—Б—В–≤–Њ –Є –≤—Л–≤–µ–і–µ–љ–Є–µ –Ь–Ъ –љ–∞—Е–Њ–і—П—В—Б—П –≤ —Б–Њ—Б—В–Њ—П–љ–Є–Є –±–∞–ї–∞–љ—Б–∞, –∞ –њ—А–Є –µ–≥–Њ –љ–∞—А—Г—И–µ–љ–Є–Є —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –У–£. –У–µ–љ–µ—В–Є—З–µ—Б–Ї–Є –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ–Њ–µ –љ–∞—А—Г—И–µ–љ–Є–µ —А–µ–∞–±—Б–Њ—А–±—Ж–Є–Є [3] –Є–ї–Є —Н–Ї—Б–Ї—А–µ—Ж–Є–Є [4] –Ь–Ъ –Љ–Њ–ґ–µ—В –њ—А–Є–≤–Њ–і–Є—В—М –Ї –≥–Є–њ–Њ- –Є–ї–Є –≥–Є–њ–µ—А—Г—А–Є–Ї–µ–Љ–Є–Є, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г—П –і–≤—Г–љ–∞–њ—А–∞–≤–ї–µ–љ–љ–Њ—Б—В—М —В—А–∞–љ—Б–њ–Њ—А—В–∞ —Г—А–∞—В–Њ–≤ –≤ —Н–њ–Є—В–µ–ї–Є–Є –њ—А–Њ–Ї—Б–Є–Љ–∞–ї—М–љ—Л—Е –Ї–∞–љ–∞–ї—М—Ж–µ–≤ –њ–Њ—З–µ–Ї. –Я—А–Є –њ–Њ–≤—Л—И–µ–љ–Є–Є —Г—А–Њ–≤–љ—П –Ь–Ъ –Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –њ–Њ–і–∞–≥—А–Є—З–µ—Б–Ї–Њ–≥–Њ –∞—А—В—А–Є—В–∞ –У–£ —Б—З–Є—В–∞–µ—В—Б—П –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ–Њ–є. –°–Њ–≥–ї–∞—Б–љ–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ –Р—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Њ–≤ –†–Њ—Б—Б–Є–Є (–Р–†–†) –њ–Њ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –Є –ї–µ—З–µ–љ–Є—О –њ–Њ–і–∞–≥—А—Л [5] –≤—Л–і–µ–ї—П—О—В –і–≤–µ –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ—Л–µ —Б—В–∞–і–Є–Є –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ–Њ–є –У–£ (–С–У–£): –±–µ–Ј –і–µ–њ–Њ–Ј–Є—В–Њ–≤ –Љ–Њ–љ–Њ—Г—А–∞—В–∞ –љ–∞—В—А–Є—П (–Ь–£–Э) –Є —Б –љ–∞–ї–Є—З–Є–µ–Љ –і–µ–њ–Њ–Ј–Є—В–Њ–≤ –Ь–£–Э, –љ–Њ –±–µ–Ј —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Є–ї–Є –∞–љ–∞–Љ–љ–µ–Ј–∞ –њ–Њ–і–∞–≥—А—Л (–Њ—В—Б—Г—В—Б—В–≤–Є–µ –њ—А–Є—Б—В—Г–њ–Њ–≤ –∞—А—В—А–Є—В–∞ –Є —В–Њ—Д—Г—Б–Њ–≤).
–Т –њ–Њ—Б–ї–µ–і–љ–Є–µ –і–µ—Б—П—В–Є–ї–µ—В–Є—П –≤–Њ –Љ–љ–Њ–≥–Є—Е —Б—В—А–∞–љ–∞—Е –Љ–Є—А–∞ –љ–∞–±–ї—О–і–∞–µ—В—Б—П —В–µ–љ–і–µ–љ—Ж–Є—П –Ї —Г–≤–µ–ї–Є—З–µ–љ–Є—О –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є –У–£ [6вАУ11], —З—В–Њ —Б–≤—П–Ј–∞–љ–Њ —Б —А–Њ—Б—В–Њ–Љ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –ґ–Є–Ј–љ–Є –≤ —Н–Ї–Њ–љ–Њ–Љ–Є—З–µ—Б–Ї–Є —А–∞–Ј–≤–Є—В—Л—Е —Б—В—А–∞–љ–∞—Е –Љ–Є—А–∞, —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є, —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ —З–∞—Б—В–Њ—В—Л –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є (–Є–Ј–±—Л—В–Њ—З–љ–Њ–є –Љ–∞—Б—Б—Л —В–µ–ї–∞ –Є –Њ–ґ–Є—А–µ–љ–Є—П, –њ–∞—В–Њ–ї–Њ–≥–Є–Є —Г–≥–ї–µ–≤–Њ–і–љ–Њ–≥–Њ –Є –ї–Є–њ–Є–і–љ–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞), –∞ —В–∞–Ї–ґ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –њ–Њ—В—А–µ–±–ї–µ–љ–Є—П –≤ –њ–Є—Й—Г –њ—А–Њ–і—Г–Ї—В–Њ–≤ –њ–Є—В–∞–љ–Є—П, –±–Њ–≥–∞—В—Л—Е –њ—Г—А–Є–љ–∞–Љ–Є (–Љ—П—Б–Њ –Є –Љ–Њ—А–µ–њ—А–Њ–і—Г–Ї—В—Л), —Б–ї–∞–і–Ї–Є—Е –±–µ–Ј–∞–ї–Ї–Њ–≥–Њ–ї—М–љ—Л—Е –љ–∞–њ–Є—В–Ї–Њ–≤ –Є –∞–ї–Ї–Њ–≥–Њ–ї—П [12вАУ15]. –Т –°–®–Р —Б 1960-—Е –њ–Њ 1990-–µ –≥–Њ–і—Л —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –У–£ –≤—Л—А–Њ—Б–ї–∞ –±–Њ–ї–µ–µ —З–µ–Љ –≤ 2 —А–∞–Ј–∞ –Є –њ—А–Њ–і–Њ–ї–ґ–∞–ї–∞ –љ–µ—Г–Ї–ї–Њ–љ–љ–Њ —А–∞—Б—В–Є –і–Њ 2007вАУ2008 –≥–≥., –і–Њ—Б—В–Є–≥–љ—Г–≤ 21,4% (–љ–∞ 3,2% –≤—Л—И–µ, —З–µ–Љ –≤ 1988вАУ1994 –≥–≥..,), –∞ –њ–Њ –і–∞–љ–љ—Л–Љ –Ј–∞ 2015вАУ2016 –≥–≥.. –Њ–љ–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 20,1% [6]. –Т –Ш—В–∞–ї–Є–Є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –У–£ —Г–≤–µ–ї–Є—З–Є–ї–∞—Б—М —Б 8,54% –≤ 2005 –≥. –і–Њ 11,93% –≤ 2009 –≥. [7]. –Т –ѓ–њ–Њ–љ–Є–Є –Њ–љ–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В –Њ–Ї–Њ–ї–Њ 30% —Б—А–µ–і–Є –Љ—Г–ґ—Б–Ї–Њ–≥–Њ –љ–∞—Б–µ–ї–µ–љ–Є—П, –∞ —Б—А–µ–і–Є –ґ–µ–љ—Й–Є–љ вАФ 1вАУ3% –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –≤–Њ–Ј—А–∞—Б—В–∞ [8]. –Т –Ш—А–ї–∞–љ–і–Є–Є –У–£ –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П —Г 19,9% –љ–∞—Б–µ–ї–µ–љ–Є—П [9]. –Т –Ъ–Є—В–∞–µ, –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —А–∞–є–Њ–љ–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –У–£ –≤—Б—В—А–µ—З–∞–µ—В—Б—П —Б —З–∞—Б—В–Њ—В–Њ–є –Њ—В 5,5% –і–Њ 23,55%, –≤ —Б—А–µ–і–љ–µ–Љ —Б–Њ—Б—В–∞–≤–ї—П—П 13,3% [10]. –†–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –У–£ –≤ –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –§–µ–і–µ—А–∞—Ж–Є–Є —Б–Њ—Б—В–∞–≤–ї—П–µ—В 16,8% (–њ—А–Є–Љ–µ—А–љ–Њ 14,9 –Љ–ї–љ –≤–Ј—А–Њ—Б–ї–Њ–≥–Њ –љ–∞—Б–µ–ї–µ–љ–Є—П). –Я—А–Є —Н—В–Њ–Љ —Б—А–µ–і–Є –Љ—Г–ґ—З–Є–љ –Њ–љ–∞ –≤—Б—В—А–µ—З–∞–µ—В—Б—П –≤ 25,3% —Б–ї—Г—З–∞–µ–≤, –∞ —Б—А–µ–і–Є –ґ–µ–љ—Й–Є–љ вАФ –≤ 11,3%. –£—А–Њ–≤–µ–љ—М –Ь–Ъ –±–Њ–ї–µ–µ 416,5 –Љ–Ї–Љ–Њ–ї—М/–ї –≤—Л—П–≤–ї—П–µ—В—Б—П —Г 9,8% –љ–∞—Б–µ–ї–µ–љ–Є—П –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –§–µ–і–µ—А–∞—Ж–Є–Є [11].
–£–≤–µ–ї–Є—З–µ–љ–Є–µ —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–Њ–≥–Њ —Г—А–Њ–≤–љ—П –Ь–Ъ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П –Љ–љ–Њ–ґ–µ—Б—В–≤–∞ —Д–∞–Ї—В–Њ—А–Њ–≤, —В–∞–Ї–Є—Е –Ї–∞–Ї –њ–Њ–ї, –≤–Њ–Ј—А–∞—Б—В, –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є, –Њ–±—А–∞–Ј –ґ–Є–Ј–љ–Є (–Ю–Ц) (–Ї—Г—А–µ–љ–Є–µ, —Д–Є–Ј–Є—З–µ—Б–Ї–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М, –њ–Є—Й–µ–≤–Њ–µ –њ–Њ–≤–µ–і–µ–љ–Є–µ, —Г–њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –∞–ї–Ї–Њ–≥–Њ–ї—П), –Њ–Ї—А—Г–ґ–∞—О—Й–∞—П —Б—А–µ–і–∞, –љ–∞–ї–Є—З–Є–µ –Ї–Њ–Љ–Њ—А–±–Є–і–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Є –і—А. (—А–Є—Б.. 1) [16].
![–†–Є—Б. 1. –Ю—Б–љ–Њ–≤–љ—Л–µ –њ—А–Є—З–Є–љ—Л –У–£ (–∞–і–∞–њ—В–Є—А–Њ–≤–∞–љ–Њ –Є–Ј [17]) –†–Є—Б. 1. –Ю—Б–љ–Њ–≤–љ—Л–µ –њ—А–Є—З–Є–љ—Л –У–£ (–∞–і–∞–њ—В–Є—А–Њ–≤–∞–љ–Њ –Є–Ј [17])](/upload/medialibrary/f48/24-1.png)
–Ш–Љ–µ–µ—В—Б—П —В–µ–љ–і–µ–љ—Ж–Є—П –Ї —Г–≤–µ–ї–Є—З–µ–љ–Є—О –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є –У–£ —Б—А–µ–і–Є –ґ–µ–љ—Й–Є–љ –њ–Њ—Б–ї–µ –Љ–µ–љ–Њ–њ–∞—Г–Ј—Л, —З—В–Њ —Б–≤—П–Ј–∞–љ–Њ —Б–Њ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —Г—А–Њ–≤–љ—П —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤. –Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –≤—Л—Б–Њ–Ї–Є–є —Г—А–Њ–≤–µ–љ—М —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤ –Љ–Њ–ґ–µ—В —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞—В—М –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–є —Н–Ї—Б–Ї—А–µ—Ж–Є–Є —Г—А–∞—В–Њ–≤ [18]. –Ф–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤–Њ–Љ –≤–ї–Є—П–љ–Є—П –ґ–µ–љ—Б–Ї–Є—Е –њ–Њ–ї–Њ–≤—Л—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤ –љ–∞ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ –Ь–Ъ —Б–ї—Г–ґ–Є—В –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –≤ –Ї–Њ—В–Њ—А–Њ–Љ —Г –Љ—Г–ґ—З–Є–љ, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е —Н—Б—В—А–Њ–≥–µ–љ—Л, –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П —Г—А–∞—В–Њ–≤ –≤ –Ї—А–Њ–≤–Є [19]. –Т —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ–Њ–є –Љ–Њ–і–µ–ї–Є —Н—Б—В—А–∞–і–Є–Њ–ї –Є–≥—А–∞–ї –±–Њ–ї–µ–µ –Ј–љ–∞—З–Є–Љ—Г—О —А–Њ–ї—М –≤ —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –≥–µ–љ–Њ–≤ вАФ —В—А–∞–љ—Б–њ–Њ—А—В–µ—А–Њ–≤ –Ь–Ъ (URAT1, GLUT9 –Є ABCG2) –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ—А–Њ–≥–µ—Б—В–µ—А–Њ–љ–Њ–Љ [20]. –¶–µ–ї—Л–є —А—П–і –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤ –Љ–Њ–ґ–µ—В —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞—В—М —А–∞–Ј–≤–Є—В–Є—О –У–£: –љ–µ–Ї–Њ—В–Њ—А—Л–µ –і–µ–Ј–∞–≥—А–µ–≥–∞–љ—В—Л (–љ–Є–Ј–Ї–Є–µ –і–Њ–Ј—Л –∞—Ж–µ—В–Є–ї—Б–∞–ї–Є—Ж–Є–ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л (–Р–°–Ъ), —В–Є–Ї–∞–≥—А–µ–ї–Њ—А), ќ≤-–∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А—Л, –і–Є—Г—А–µ—В–Є–Ї–Є (—В–Є–∞–Ј–Є–і–љ—Л–µ, –њ–µ—В–ї–µ–≤—Л–µ, –∞–љ—В–∞–≥–Њ–љ–Є—Б—В—Л –Љ–Є–љ–µ—А–∞–ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–љ—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ (—Б–њ–Є—А–Њ–љ–Њ–ї–∞–Ї—В–Њ–љ)). –Э–∞–њ—А–Њ—В–Є–≤, –њ—А–Є–µ–Љ –≥–Є–њ–Њ–ї–Є–њ–Є–і–µ–Љ–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ (–Є–љ–≥–Є–±–Є—В–Њ—А—Л –У–Ь–У-–Ъ–Њ–Р-—А–µ–і—Г–Ї—В–∞–Ј—Л (—Б—В–∞—В–Є–љ—Л), —Д–Є–±—А–∞—В—Л), –ї–Њ–Ј–∞—А—В–∞–љ–∞ –Є —Б–∞—Е–∞—А–Њ—Б–љ–Є–ґ–∞—О—Й–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ (–Є–љ–≥–Є–±–Є—В–Њ—А—Л –љ–∞—В—А–Є–є-–≥–ї—О–Ї–Њ–Ј–љ–Њ–≥–Њ –Ї–Њ—В—А–∞–љ—Б–њ–Њ—А—В–µ—А–∞ 2-–≥–Њ —В–Є–њ–∞ (SGLT-2)) —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —Б–љ–Є–ґ–µ–љ–Є—О —Г—А–Њ–≤–љ—П –Ь–Ъ [21].
–Я—А–Њ–≤–Њ–і–Є–Љ—Л–µ –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –њ–Њ–ї–љ–Њ–≥–µ–љ–Њ–Љ–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–є –њ—А–µ–і—А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ–Њ—Б—В–Є –Ї –љ–∞—А—Г—И–µ–љ–Є—О –њ—Г—А–Є–љ–Њ–≤–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ—Л –≥–µ–љ–Њ–≤, –Ї–Њ–і–Є—А—Г—О—Й–Є—Е —Г—А–∞—В–љ—Л–µ —В—А–∞–љ—Б–њ–Њ—А—В–µ—А—Л –≤ –њ–Њ—З–Ї–∞—Е –Є –Ї–Є—И–µ—З–љ–Є–Ї–µ (SLC2A9, SLC22A12, ABCG2 –Є –і—А..), –Љ–Њ–≥—Г—В –±—Л—В—М –њ—А–Є—З–Є–љ–Њ–є –њ–Њ–≤—Л—И–µ–љ–Є—П —Г—А–Њ–≤–љ—П –Ь–Ъ, —В. –µ. –Ј–љ–∞—З–Є–Љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ —А–Є—Б–Ї–∞ (–§–†) –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –њ–Њ–і–∞–≥—А—Л –Є –У–£ (—А–Є—Б. 2) [22]..
![–†–Є—Б. 2. –Ю–±–Љ–µ–љ –Ь–Ъ –≤ —Н–њ–Є—В–µ–ї–Є–Є –њ—А–Њ–Ї—Б–Є–Љ–∞–ї—М–љ—Л—Е –Ї–∞–љ–∞–ї—М—Ж–µ–≤ –њ–Њ—З–µ–Ї (–∞–і–∞–њ—В–Є—А–Њ–≤–∞–љ–Њ –Є–Ј [22]) –†–Є—Б. 2. –Ю–±–Љ–µ–љ –Ь–Ъ –≤ —Н–њ–Є—В–µ–ї–Є–Є –њ—А–Њ–Ї—Б–Є–Љ–∞–ї—М–љ—Л—Е –Ї–∞–љ–∞–ї—М—Ж–µ–≤ –њ–Њ—З–µ–Ї (–∞–і–∞–њ—В–Є—А–Њ–≤–∞–љ–Њ –Є–Ј [22])](/upload/medialibrary/bb4/24-2.png)
–Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —В–Њ, —З—В–Њ –љ–∞–ї–Є—З–Є–µ –У–£ —П–≤–ї—П–µ—В—Б—П –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–Љ —Г—Б–ї–Њ–≤–Є–µ–Љ –і–ї—П –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –њ–Њ–і–∞–≥—А—Л, –і–∞–ї–µ–Ї–Њ –љ–µ —Г –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ –Ь–Ъ –і–µ–±—О—В–Є—А—Г–µ—В —Б—Г—Б—В–∞–≤–љ–Њ–є —Б–Є–љ–і—А–Њ–Љ. –Ґ–∞–Ї, –њ–Њ –і–∞–љ–љ—Л–Љ –љ–∞–±–ї—О–і–∞—В–µ–ї—М–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, 5-–ї–µ—В–љ—П—П –Ї—Г–Љ—Г–ї—П—В–Є–≤–љ–∞—П –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В—М –њ–Њ–і–∞–≥—А–Њ–є –Љ—Г–ґ—З–Є–љ c –С–У–£ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 18,83% [23]. E.W. Campion et al. [24] –Ї—Г–Љ—Г–ї—П—В–Є–≤–љ—Г—О –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В—М –њ–Њ–і–∞–≥—А–Є—З–µ—Б–Ї–Є–Љ –∞—А—В—А–Є—В–Њ–Љ –Њ—Ж–µ–љ–Є–≤–∞—О—В –≤ 22% –њ—А–Є —Г—А–Њ–≤–љ–µ –Ь–Ъ 9 –Љ–≥/–і–ї (540 –Љ–Ї–Љ–Њ–ї—М/–ї) –Є–ї–Є –±–Њ–ї–µ–µ.. –Т –і—А—Г–≥–Њ–Љ –љ–∞–±–ї—О–і–∞—В–µ–ї—М–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Ј–∞ 7,5 –≥–Њ–і–∞ –љ–∞–±–ї—О–і–µ–љ–Є—П –њ–Њ–і–∞–≥—А–∞ –і–µ–±—О—В–Є—А–Њ–≤–∞–ї–∞ —Г 3,1% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –С–У–£ [25]. –Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —Н—В–Њ, –У–£ –Є–Љ–µ–µ—В —И–Є—А–Њ–Ї–Є–є –і–Є–∞–њ–∞–Ј–Њ–љ –≤–ї–Є—П–љ–Є—П –љ–∞ —А–∞–Ј–≤–Є—В–Є–µ –Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ —Ж–µ–ї–Њ–≥–Њ —А—П–і–∞ –њ–∞—В–Њ–ї–Њ–≥–Є–є —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Д–Є–ї—П.
–Т–ї–Є—П–љ–Є–µ –У–£ –љ–∞ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Г—О —Б–Є—Б—В–µ–Љ—Г
–≠–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –њ–Њ–≤—Л—И–µ–љ–љ—Л–є —Г—А–Њ–≤–µ–љ—М –Ь–Ъ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —А–∞–Ј–≤–Є—В–Є—О —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є (–°–°–Ч), –њ—А–Њ–∞—В–µ—А–Њ–≥–µ–љ–љ—Л–Љ –њ—А–Њ—Ж–µ—Б—Б–∞–Љ, —Б—Г–±–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–Љ—Г –≤–Њ—Б–њ–∞–ї–µ–љ–Є—О, —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є (–≠–Ф) –Є –Њ–Ї–Є—Б–ї–Є—В–µ–ї—М–љ–Њ–Љ—Г —Б—В—А–µ—Б—Б—Г. –Р–Ї—В–Є–≤–љ—Л–µ —Д–Њ—А–Љ—Л –Ї–Є—Б–ї–Њ—А–Њ–і–∞, –њ—А–Њ–і—Г—Ж–Є—А—Г–µ–Љ—Л–µ –њ–Њ—Б–ї–µ –∞–Ї—В–Є–≤–∞—Ж–Є–Є –Ї—Б–∞–љ—В–Є–љ–Њ–Ї—Б–Є–і–∞–Ј—Л (–Ъ–°–Ю), —П–≤–ї—П—О—В—Б—П –Њ–і–љ–Њ–є –Є–Ј –Њ—Б–љ–Њ–≤–љ—Л—Е –њ—А–Є—З–Є–љ, –≤—Л–Ј—Л–≤–∞—О—Й–Є—Е –≠–Ф –Є –њ–Њ—А–∞–ґ–µ–љ–Є–µ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Є—Б—В–µ–Љ—Л [26]. –Ю–њ–Є—Б–∞–љ–Њ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤, –Њ–±—К—П—Б–љ—П—О—Й–Є—Е –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–µ —Г—З–∞—Б—В–Є–µ –Ь–Ъ –≤ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–Є –°–°–Ч. –Ґ–∞–Ї, —А–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П R.J. Johnson et al. [27] –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Ь–Ъ –Љ–Њ–ґ–µ—В –≤—Л–Ј—Л–≤–∞—В—М –≥–ї–Њ–Љ–µ—А—Г–ї–Њ—В—Г–±—Г–ї—П—А–љ—Л–µ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—Й–Є–µ –∞–Ї—В–Є–≤–∞—Ж–Є–Є —А–µ–љ–Є–љ-–∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ-–∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–Њ–≤–Њ–є —Б–Є—Б—В–µ–Љ—Л (–†–Р–Р–°) –Є –њ–Њ–≤—Л—И–µ–љ–Є—О –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П (–Р–Ф), –њ—А–Є —Н—В–Њ–Љ –і–∞–љ–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Љ–Њ–≥—Г—В —А–µ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞—В—М –њ–Њ—Б–ї–µ —Г—Б—В—А–∞–љ–µ–љ–Є—П –У–£.. L.G. Sanchez-Lozada et al. [28] –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є, —З—В–Њ –≤—Л—Б–Њ–Ї–Њ–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –Ь–Ъ –Љ–Њ–ґ–µ—В –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞—В—М –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–µ —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б—В–µ–љ–Ї–Є, –Ї–Њ—В–Њ—А–Њ–µ —А–µ–≥—А–µ—Б—Б–Є—А—Г–µ—В –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞ –∞–ї–ї–Њ–њ—Г—А–Є–љ–Њ–ї.. –С–Њ–ї–µ–µ —В–Њ–≥–Њ, –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –У–£ –≤—Л–Ј—Л–≤–∞–µ—В —Б–њ–∞–Ј–Љ —Б–Њ—Б—Г–і–Њ–≤ –њ–Њ—З–µ–Ї, –њ—А–Њ–≤–Њ—Ж–Є—А—Г—П –∞–Ї—В–Є–≤–∞—Ж–Є—О –†–Р–Р–° [28, 29], –Є —П–≤–ї—П–µ—В—Б—П –Ј–љ–∞—З–Є–Љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –≠–Ф [30]. –Ф—А—Г–≥–Є–µ –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ—Л–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л, —Б –њ–Њ–Љ–Њ—Й—М—О –Ї–Њ—В–Њ—А—Л—Е –У–£ –Є/–Є–ї–Є –њ–Њ–≤—Л—И–µ–љ–љ–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —Д–µ—А–Љ–µ–љ—В–∞ –Ъ–°–Ю –Љ–Њ–≥—Г—В —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞—В—М —Б–Њ—Б—Г–і–Є—Б—В–Њ–Љ—Г –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—О, –≤–Ї–ї—О—З–∞—О—В –∞–і–≥–µ–Ј–Є—О —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤, –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є—О –≥–ї–∞–і–Ї–Њ–Љ—Л—И–µ—З–љ—Л—Е –Ї–ї–µ—В–Њ–Ї —Б–Њ—Б—Г–і–Њ–≤ –Є —Б—В–Є–Љ—Г–ї—П—Ж–Є—О –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ [31]. –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –Ї—А–Є—Б—В–∞–ї–ї—Л –Ь–£–Э –Љ–Њ–≥—Г—В –і–µ–њ–Њ–љ–Є—А–Њ–≤–∞—В—М—Б—П –≤ –∞–Њ—А—В–µ –Є –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е –∞—А—В–µ—А–Є—П—Е, —В–µ–Љ —Б–∞–Љ—Л–Љ —Г—З–∞—Б—В–≤—Г—П –≤ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–Є –±–ї—П—И–µ–Ї –Є –Ї–∞–ї—М—Ж–Є—Д–Є–Ї–∞—Ж–Є–Є —Б–Њ—Б—Г–і–Њ–≤ [32]. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –і–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –Ь–Ъ –Љ–Њ–ґ–µ—В –њ—А–Є–љ–Є–Љ–∞—В—М –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ–µ —Г—З–∞—Б—В–Є–µ –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ —Ж–µ–ї–Њ–≥–Њ —А—П–і–∞ –°–°–Ч –Є –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞.
–≠–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –њ–Њ–≤—Л—И–µ–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Ь–Ъ —П–≤–ї—П–µ—В—Б—П –њ—А–µ–і–Є–Ї—В–Њ—А–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–Є (–Р–У) [33]. –Ф–∞–љ–љ—Л–µ –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј–∞ 18 –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є [34] –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г—О—В —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –љ–∞ 13% —З–∞—Б—В–Њ—В—Л –≤–њ–µ—А–≤—Л–µ –≤–Њ–Ј–љ–Є–Ї—И–µ–є –Р–У –љ–∞ –Ї–∞–ґ–і—Л–є 1% –њ–Њ–≤—Л—И–µ–љ–Є—П —Г—А–Њ–≤–љ—П –Ь–Ъ.. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ PAMELA [35] –њ–Њ–і—В–≤–µ—А–і–Є–ї–Њ, —З—В–Њ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Ь–Ъ –љ–∞ 1 –Љ–≥/–і–ї (60 –Љ–Ї–Љ–Њ–ї—М/–ї) —Б–≤—П–Ј–∞–љ–Њ —Б–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–Љ –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –≤–њ–µ—А–≤—Л–µ –≤–Њ–Ј–љ–Є–Ї—И–µ–є –Р–У. –У–£ —П–≤–ї—П–µ—В—Б—П –Ј–љ–∞—З–Є–Љ—Л–Љ –§–† —А–∞–Ј–≤–Є—В–Є—П –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–µ–Ј–љ–Є —Б–µ—А–і—Ж–∞ (–Ш–С–°), –Њ—Б—В—А–Њ–≥–Њ –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞, –Њ—Б—В—А–Њ–є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є (–°–Э), —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є –Є –Њ–±—Й–µ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є [36вАУ39]. –Ф–≤–µ–љ–∞–і—Ж–∞—В–Є–ї–µ—В–љ–µ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ PIUMA [40], –≤ –Ї–Њ—В–Њ—А–Њ–Љ –њ—А–Є–љ—П–ї–Є —Г—З–∞—Б—В–Є–µ 1720 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Р–У, —В–∞–Ї–ґ–µ –њ–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ —Г—А–Њ–≤–µ–љ—М –Ь–Ъ вАФ —Б–Є–ї—М–љ—Л–є –њ—А–µ–і–Є–Ї—В–Њ—А —Б–Љ–µ—А—В–љ–Њ—Б—В–Є. –Т –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј–µ –і–∞–љ–љ—Л—Е 8776 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ—Б—В—А—Л–Љ –Ї–Њ—А–Њ–љ–∞—А–љ—Л–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ –Є —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є –У–£ –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ –њ–Њ–≤—Л—И–µ–љ–Є–µ —А–Є—Б–Ї–∞ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е —Б–Њ–±—Л—В–Є–є, –Њ–±—Й–µ–є –Є —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –њ–Њ—Б–ї–µ –Ї–Њ—А—А–µ–Ї—В–Є—А–Њ–≤–Ї–Є –љ–∞ –і—А—Г–≥–Є–µ –Є–Ј–≤–µ—Б—В–љ—Л–µ –§–† [41]. –£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –°–Э –±—Л–ї–∞ –њ–Њ–Ї–∞–Ј–∞–љ–∞ –њ—А—П–Љ–∞—П —Б–≤—П–Ј—М –Љ–µ–ґ–і—Г –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —Г—А–Њ–≤–љ—П –Ь–Ъ, —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —Д—А–∞–Ї—Ж–Є–Є –≤—Л–±—А–Њ—Б–∞ –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞ –Є —Г—А–Њ–≤–љ–µ–Љ NT-proBNP [42]. –Т –ї–Є—В–µ—А–∞—В—Г—А–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤–∞ –≤–Ј–∞–Є–Љ–Њ¬≠—Б–≤—П–Ј–Є –У–£ –Є –Њ—Б—В—А–Њ–≥–Њ –љ–∞—А—Г—И–µ–љ–Є—П –Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П (–Ю–Э–Ь–Ъ) [43]. –С–Њ–ї–µ–µ —В–Њ–≥–Њ, —Б—А–µ–і–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –Ю–Э–Ь–Ъ –Є –Є–Љ–µ—О—Й–Є—Е –У–£, –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Б–Љ–µ—А—В–љ–Њ—Б—В–Є [44]. –Э–∞—А—Г—И–µ–љ–Є—П —А–Є—В–Љ–∞ —Б–µ—А–і—Ж–∞ —В–∞–Ї–ґ–µ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ—Л —Б –У–£, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, –Њ–њ–Є—Б–∞–љ—Л –њ—Г—В–Є –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –Ь–Ъ –љ–∞ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ —Д–Є–±—А–Є–ї–ї—П—Ж–Є–Є –њ—А–µ–і—Б–µ—А–і–Є–є [45].
–У–Є–њ–µ—А—Г—А–Є–Ї–µ–Љ–Є—П –Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–µ –љ–∞—А—Г—И–µ–љ–Є—П
–Ф–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –Ь–Ъ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є —В–µ—Б–љ–Њ —Б–≤—П–Ј–∞–љ–∞ —Б –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —Г—А–Њ–≤–љ—П –ї–Є–њ–Є–і–Њ–≤, —В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–Њ–≤, –≥–ї—О–Ї–Њ–Ј—Л –≤ –Ї—А–Њ–≤–Є –Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ (–Ь–°) [46]. –Ш–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М (–Ш–†) –Є –њ–Њ–≤—Л—И–µ–љ–љ—Л–є —Г—А–Њ–≤–µ–љ—М –ї–µ–њ—В–Є–љ–∞ –Љ–Њ–≥—Г—В –±—Л—В—М —Б–≤—П–Ј—Г—О—Й–Є–Љ –Ј–≤–µ–љ–Њ–Љ –Љ–µ–ґ–і—Г –Њ–ґ–Є—А–µ–љ–Є–µ–Љ, –і–Є—Б–ї–Є–њ–Є–і–µ–Љ–Є–µ–є –Є –У–£ [47]. –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–∞ –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є—П –њ–Њ–і–∞–≥—А—Л —Б –Њ–ґ–Є—А–µ–љ–Є–µ–Љ –Є –і–Є—Б–ї–Є–њ–Є–і–µ–Љ–Є–µ–є [48], –њ—А–Є—З–Є–љ–∞–Љ–Є –Ї–Њ—В–Њ—А–Њ–є –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ —П–≤–ї—П—О—В—Б—П –Ш–† –Є –≥–Є–њ–µ—А–Є–љ—Б—Г–ї–Є–љ–µ–Љ–Є—П [49]. –†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П C. Lie et al. [50] –њ–Њ–і—В–≤–µ—А–ґ–і–∞—О—В –њ—А–µ–і–њ–Њ–ї–Њ–ґ–µ–љ–Є–µ –Њ —В–Њ–Љ, —З—В–Њ –Ш–† –Ј–∞–љ–Є–Љ–∞–µ—В —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–µ –Љ–µ—Б—В–Њ –≤ –њ—А–Є—З–Є–љ–љ–Њ-—Б–ї–µ–і—Б—В–≤–µ–љ–љ–Њ–є —Б–≤—П–Ј–Є –Љ–µ–ґ–і—Г –Ь–° –Є –У–£.. –Ш–† –∞—Б—Б–Њ—Ж–Є–Є—А—Г–µ—В—Б—П –љ–µ —В–Њ–ї—М–Ї–Њ —Б –њ–∞—В–Њ–≥–µ–љ–µ–Ј–Њ–Љ –Ь–°, –љ–Њ –Є —Б –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —Б–Є–љ—В–µ–Ј–∞ –њ—Г—А–Є–љ–Њ–≤, –Ї–Њ—В–Њ—А—Л–є —П–≤–ї—П–µ—В—Б—П —А–µ–Ј—Г–ї—М—В–∞—В–Њ–Љ —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞ —Б —Г—З–∞—Б—В–Є–µ–Љ –≥–Є–њ–µ—А—В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–µ–Љ–Є–Є, –Є–≥—А–∞—О—Й–µ–є –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ –і–∞–љ–љ–Њ–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–µ [51]. –Ш–Ј–±—Л—В–Њ—З–љ–∞—П –Љ–∞—Б—Б–∞ —В–µ–ї–∞ –Є —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–µ –Њ–ґ–Є—А–µ–љ–Є–µ —В–µ—Б–љ–Њ —Б–≤—П–Ј–∞–љ—Л —Б –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ —Г—А–Њ–≤–љ–µ–Љ –Ь–Ъ. –С—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –љ–∞—А–∞—Б—В–∞–љ–Є–µ –Є–љ–і–µ–Ї—Б–∞ –Љ–∞—Б—Б—Л —В–µ–ї–∞ –љ–∞ 4 –µ–і–Є–љ–Є—Ж—Л —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В —Г—А–Њ–≤–µ–љ—М –Ь–Ъ –≤ –Ї—А–Њ–≤–Є –љ–∞ 0,5 –Љ–≥/–і–ї (30 –Љ–Ї–Љ–Њ–ї—М/–ї) –Є —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –У–£ –љ–∞ 7,5% [52].
–Т –і–∞–љ–љ—Л–є –Љ–Њ–Љ–µ–љ—В –∞–Ї—В—Г–∞–ї—М–љ–Њ—Б—В—М –њ—А–Њ–±–ї–µ–Љ—Л –љ–µ–∞–ї–Ї–Њ–≥–Њ–ї—М–љ–Њ–є –ґ–Є—А–Њ–≤–Њ–є –±–Њ–ї–µ–Ј–љ–Є –њ–µ—З–µ–љ–Є (–Э–Р–Ц–С–Я) –Ј–∞–Љ–µ—В–љ–Њ –њ–Њ–≤—Л—Б–Є–ї–∞—Б—М.. –Ъ–∞–Ї –њ–Њ–Ї–∞–Ј–∞–ї –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј 13 –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є [53], –У–£ —Б–≤—П–Ј–∞–љ–∞ —Б –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –Э–Р–Ц–С–Я –≤ –∞–Ј–Є–∞—В—Б–Ї–Є—Е –њ–Њ–њ—Г–ї—П—Ж–Є—П—Е.. –Я–Њ –і–∞–љ–љ—Л–Љ –Њ–±–Ј–Њ—А–∞ 5 –љ–∞–±–ї—О–і–∞—В–µ–ї—М–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ–∞—Ж–Є–µ–љ—В—Л —Б –У–£ –Є –Э–Р–Ц–С–Я –Є–Љ–µ–ї–Є –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–є —Г—А–Њ–≤–µ–љ—М –Є–љ–і–µ–Ї—Б–∞ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Э–Р–Ц–С–Я (вЙ•5 –±–∞–ї–ї–Њ–≤), –±–Њ–ї–µ–µ —В–Њ–≥–Њ, –њ–Њ–≤—Л—И–µ–љ–љ—Л–є —Г—А–Њ–≤–µ–љ—М –Ь–Ъ –±—Л–ї —Б–≤—П–Ј–∞–љ —Б –±–Њ–ї–µ–µ —В—П–ґ–µ–ї—Л–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ –њ–µ—З–µ–љ–Є –њ—А–Є –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є [54].
–Т–ї–Є—П–љ–Є–µ –У–£ –љ–∞ –њ–Њ—З–Ї–Є
–У–Є–њ–µ—А—Г—А–Є–Ї–µ–Љ–Є—П —П–≤–ї—П–µ—В—Б—П —Б–Є–ї—М–љ—Л–Љ –љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л–Љ –§–† —А–∞–Ј–≤–Є—В–Є—П —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–µ–Ј–љ–Є –њ–Њ—З–µ–Ї (–•–С–Я) [55вАУ58]. –†–Є—Б–Ї –њ–Њ—А–∞–ґ–µ–љ–Є—П –њ–Њ—З–µ–Ї –±—Л—Б—В—А–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П, –Ї–Њ–≥–і–∞ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –Ь–Ъ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –і–Њ—Б—В–Є–≥–∞–µ—В 7 –Љ–≥/–і–ї (420 –Љ–Ї–Љ–Њ–ї—М/–ї) –Є –±–Њ–ї–µ–µ [59]. –Я–Њ—Б–ї–µ —В–Њ–≥–Њ, –Ї–∞–Ї —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –њ–Њ—А–∞–ґ–µ–љ–Є–µ –њ–Њ—З–µ–Ї, —Г—А–Њ–≤–µ–љ—М –Ь–Ъ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ —Б—В–∞–љ–Њ–≤–Є—В—Б—П –±–Њ–ї–µ–µ –≤–∞—А–Є–∞–±–µ–ї—М–љ—Л–Љ, –Є –љ–µ–Ї–Њ—В–Њ—А—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–Є –њ—А–µ–і–њ–Њ–ї–∞–≥–∞—О—В, —З—В–Њ –У–£ —П–≤–ї—П–µ—В—Б—П –љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л–Љ –њ—А–µ–і–Є–Ї—В–Њ—А–Њ–Љ —Г—Е—Г–і—И–µ–љ–Є—П —В–µ—З–µ–љ–Є—П –•–С–Я [56, 60]. –Ш–Љ–µ—О—В—Б—П —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤–∞ —В–Њ–≥–Њ, —З—В–Њ –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Н—Д—Д–µ–Ї—В—Л –Ь–Ъ, –≤—Л–Ј—Л–≤–∞—О—Й–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ –њ–Њ—З–µ–Ї, –Љ–Њ–≥—Г—В –±—Л—В—М –≤ –±–Њ–ї—М—И–µ–є —Б—В–µ–њ–µ–љ–Є –Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ—Л –µ–µ –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ—Л–Љ–Є —Н—Д—Д–µ–Ї—В–∞–Љ–Є [61]. –Т–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ—Л–µ —Г—А–Њ–≤–љ–Є –Љ–Њ–≥—Г—В –±—Л—В—М –≤—Л—И–µ –≤ —Г—Б–ї–Њ–≤–Є—П—Е —Б—В–Є–Љ—Г–ї—П—Ж–Є–Є —Б–Є–љ—В–µ–Ј–∞ –Ь–Ъ, —З—В–Њ –Љ–Њ–ґ–µ—В –љ–∞–±–ї—О–і–∞—В—М—Б—П –њ—А–Є –≤—Л—Б–Њ–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ъ–°–Ю. –Т —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М, –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Ъ–°–Ю –≤ –Ї—А–Њ–≤–Є —Б–≤—П–Ј–∞–љ–∞ —Б –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ–Љ –•–С–Я –Є —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л–Љ–Є –Є—Б—Е–Њ–і–∞–Љ–Є –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В —Г—А–Њ–≤–љ—П –Ь–Ъ [62, 63].
–°—З–Є—В–∞–µ—В—Б—П, —З—В–Њ –У–£ –≤—Л–Ј—Л–≤–∞–µ—В –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–µ –њ–Њ—З–µ–Ї –Ј–∞ —Б—З–µ—В –Ї–∞–Ї –Ї—А–Є—Б—В–∞–ї–ї–Њ–Ј–∞–≤–Є—Б–Є–Љ—Л—Е, —В–∞–Ї –Є –Ї—А–Є—Б—В–∞–ї–ї–Њ–љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ [63]. –Ъ—А–Є—Б—В–∞–ї–ї–Њ–Ј–∞–≤–Є—Б–Є–Љ—Л–є –њ—Г—В—М –≤–Ї–ї—О—З–∞–µ—В –Њ—В–ї–Њ–ґ–µ–љ–Є–µ –Ї—А–Є—Б—В–∞–ї–ї–Њ–≤ –Ь–£–Э –≤ –Ї–∞–љ–∞–ї—М—Ж–∞—Е –Є–ї–Є –Є–љ—В–µ—А—Б—В–Є—Ж–Є–Є –њ–Њ—З–µ–Ї, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–Љ—Г –≤–Њ—Б–њ–∞–ї–µ–љ–Є—О –Є –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—О –Ї–∞–љ–∞–ї—М—Ж–µ–≤ [63]. –° –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, –њ–Њ–≤—Л—И–µ–љ–љ—Л–є —Г—А–Њ–≤–µ–љ—М –Ь–Ъ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ —Г–Љ–µ—А–µ–љ–љ–Њ –Є –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ —Б–≤—П–Ј–∞–љ —Б –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –Љ–Њ—З–µ–Ї–∞–Љ–µ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є (–Ь–Ъ–С) [64]. –Ш–љ—В–µ—А–µ—Б–љ–Њ, —З—В–Њ –љ–∞–ї–Є—З–Є–µ –Љ–Є–Ї—А–Њ–Ї—А–Є—Б—В–∞–ї–ї–Є—З–µ—Б–Ї–Њ–є –љ–µ—Д—А–Њ–њ–∞—В–Є–Є –љ–µ –±—Л–ї–Њ —Б–≤—П–Ј–∞–љ–Њ —Б –≤—Л—П–≤–ї–µ–љ–Є–µ–Љ –Ї—А–Є—Б—В–∞–ї–ї–Њ–≤ —Г—А–∞—В–Њ–≤ –≤ –Љ–Њ—З–µ–≤–Њ–Љ –Њ—Б–∞–і–Ї–µ, —З—В–Њ –њ–Њ–і—В–≤–µ—А–ґ–і–∞–µ—В –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М –і–≤—Г—Е –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ [65]. –†–∞—Б—В–≤–Њ—А–Є–Љ–∞—П –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–∞—П –Ь–Ъ –Љ–Њ–ґ–µ—В –≤—Л–Ј—Л–≤–∞—В—М –•–С–Я —З–µ—А–µ–Ј –Ї—А–Є—Б—В–∞–ї–ї–Њ–љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л–є –њ—А–Њ—Ж–µ—Б—Б. –≠—В–Њ –Љ–Њ–ґ–µ—В –њ—А–Њ–Є—Б—Е–Њ–і–Є—В—М –ї–Є–±–Њ –Ј–∞ —Б—З–µ—В –њ–Њ–≤—Л—И–µ–љ–љ–Њ–≥–Њ —Г—А–Њ–≤–љ—П –Ь–Ъ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є, –ї–Є–±–Њ –Ј–∞ —Б—З–µ—В —Н–љ–і–Њ–≥–µ–љ–љ–Њ–≥–Њ —Б–Є–љ—В–µ–Ј–∞ [66]. –Ь–µ—Е–∞–љ–Є–Ј–Љ –≤–Ї–ї—О—З–∞–µ—В –њ–Њ–≤—Л—И–µ–љ–Є–µ –Ї–∞–Ї —Б–Є—Б—В–µ–Љ–љ–Њ–≥–Њ, —В–∞–Ї –Є –≤–љ—Г—В—А–Є–Ї–ї—Г–±–Њ—З–Ї–Њ–≤–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –∞—Д—Д–µ—А–µ–љ—В–љ–Њ–є –∞—А—В–µ—А–Є–Њ–ї—П—А–љ–Њ–є –≤–∞–Ј–Њ–Ї–Њ–љ—Б—В—А–Є–Ї—Ж–Є–µ–є –Є –љ–∞—А—Г—И–µ–љ–Є–µ–Љ –њ–Њ—З–µ—З–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞, –Ї–Њ—В–Њ—А–Њ–µ –Њ–њ–Њ—Б—А–µ–і—Г–µ—В—Б—П –∞–Ї—В–Є–≤–∞—Ж–Є–µ–є —Б–Є—Б—В–µ–Љ—Л –†–Р–Р–°, —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В–Є —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–≥–Њ –Њ–Ї—Б–Є–і–∞ –∞–Ј–Њ—В–∞ –Є –Є–љ–і—Г–Ї—Ж–Є–µ–є –Њ–Ї–Є—Б–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ —Б—В—А–µ—Б—Б–∞ [67, 68]. –° –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є—П –≥–ї–∞–і–Ї–Њ–Љ—Л—И–µ—З–љ—Л—Е –Ї–ї–µ—В–Њ–Ї —Б–Њ—Б—Г–і–Њ–≤, –≤—Л–Ј—Л–≤–∞—О—Й–∞—П –∞—А—В–µ—А–Є–Њ–ї–Њ–њ–∞—В–Є—О —Б –љ–∞—А—Г—И–µ–љ–Є–µ–Љ –∞—Г—В–Њ—А–µ–≥—Г–ї—П—Ж–Є–Є, –∞ —В–∞–Ї–ґ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –љ–∞ –Ї–∞–љ–∞–ї—М—Ж—Л, –≤–Ї–ї—О—З–∞—П —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ–Њ-–Љ–µ–Ј–µ–љ—Е–Є–Љ–∞–ї—М–љ—Л–µ –Є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П [69, 70].
–Т –Ї–Њ–љ–µ—З–љ–Њ–Љ –Є—В–Њ–≥–µ –Є—И–µ–Љ–Є—П —Б—В–∞–љ–Њ–≤–Є—В—Б—П –Њ–і–љ–Є–Љ –Є–Ј –Њ—Б–љ–Њ–≤–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –њ–∞—В–Њ–ї–Њ–≥–Є–Є –њ–Њ—З–µ–Ї —Г –ї–Є—Ж, —Б—В—А–∞–і–∞—О—Й–Є—Е –У–£ –Є –њ–Њ–і–∞–≥—А–Њ–є [71].
–Т–ї–Є—П–љ–Є–µ —Г—А–∞—В—Б–љ–Є–ґ–∞—О—Й–µ–є —В–µ—А–∞–њ–Є–Є –љ–∞ —В–µ—З–µ–љ–Є–µ –Ї–Њ–Љ–Њ—А–±–Є–і–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є
–Т–≤–Є–і—Г –Ј–љ–∞—З–Є–Љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –У–£ –љ–∞ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–µ –Є —В–µ—З–µ–љ–Є–µ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є, –љ–µ—Д—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ –і–Њ–≤–Њ–ї—М–љ–Њ –±–Њ–ї—М—И–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л—Е –Є —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –≤–ї–Є—П–љ–Є—П —Г—А–∞—В—Б–љ–Є–ґ–∞—О—Й–µ–є —В–µ—А–∞–њ–Є–Є (–£–°–Ґ) –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є –Ъ–°–Ю, –∞ –Є–Љ–µ–љ–љ–Њ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –∞–ї–ї–Њ–њ—Г—А–Є–љ–Њ–ї, –љ–∞ –Є—Е —В–µ—З–µ–љ–Є–µ (—В–∞–±–ї. 1).
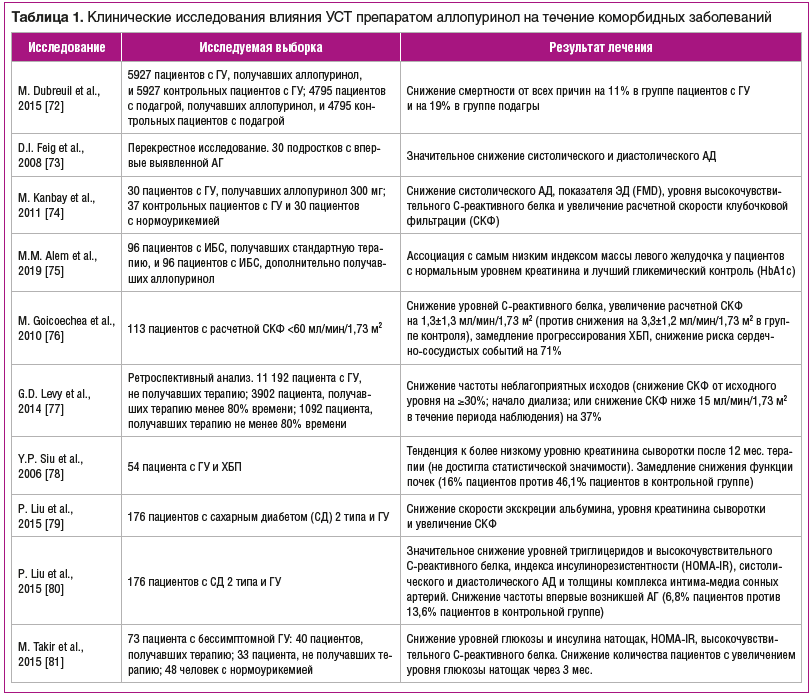
–С–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ–∞—П –У–£ –Є –і–µ–њ–Њ–Ј–Є—В—Л –Ь–£–Э
–°—Г—Й–µ—Б—В–≤—Г–µ—В —В—А–Є –Њ—Б–љ–Њ–≤–љ—Л—Е –њ–∞—В–Њ–ї–Њ–≥–Є–Є, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –і–µ–њ–Њ–љ–Є—А–Њ–≤–∞–љ–Є–µ–Љ –Ї—А–Є—Б—В–∞–ї–ї–Њ–≤ –Ь–£–Э: –њ–Њ–і–∞–≥—А–∞, —Г—А–∞—В–љ–∞—П –љ–µ—Д—А–Њ–њ–∞—В–Є—П –Є –Ь–Ъ–С. –°—В–Њ–є–Ї–∞—П –С–У–£ вАФ —Н—В–Њ –§–† —А–∞–Ј–≤–Є—В–Є—П –≤—Л—И–µ–њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —Б–Њ–±—Л—В–Є–є, –Є —Н—В–Є —А–Є—Б–Ї–Є —Б–≤—П–Ј–∞–љ—Л —Б –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М—О –Є –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М—О –У–£. –Т–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–µ –Ї—А–Є—Б—В–∞–ї–ї–Њ–≤ –Ь–£–Э —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –Ї–ї–µ—В–Ї–∞–Љ–Є —Б—Г—Б—В–∞–≤–∞ –њ—А–Є–≤–Њ–і–Є—В –Ї —Б–Є–љ—В–µ–Ј—Г —И–Є—А–Њ–Ї–Њ–≥–Њ —Б–њ–µ–Ї—В—А–∞ –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤, —В–∞–Ї–Є—Е –Ї–∞–Ї –Є–љ—В–µ—А–ї–µ–є–Ї–Є–љ (–Ш–Ы)-1 [82], —Д–∞–Ї—В–Њ—А –љ–µ–Ї—А–Њ–Ј–∞ –Њ–њ—Г—Е–Њ–ї–Є –∞–ї—М—Д–∞ (–§–Э–Ю-ќ±) [83], –Ш–Ы-8, —Е–µ–Љ–Њ–Ї–Є–љ—Л [84], –Љ–µ—В–∞–±–Њ–ї–Є—В—Л –∞—А–∞—Е–Є–і–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л, —Б—Г–њ–µ—А–Њ–Ї—Б–Є–і–љ—Л–µ –Ї–Є—Б–ї–Њ—А–Њ–і–љ—Л–µ —А–∞–і–Є–Ї–∞–ї—Л, –њ—А–Њ—В–µ–Є–љ–∞–Ј—Л. –Ш–Љ–µ—О—В—Б—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г—О—Й–Є–µ, —З—В–Њ –У–£ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —Б–Є—Б—В–µ–Љ–љ—Л–Љ –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ –њ—А–Њ–і—Г–Ї—Ж–Є–Є –§–Э–Ю-ќ±, –Ш–Ы-6, –Ш–Ы-8, –Љ–Є–Ї—А–Њ–†–Э–Ъ-155, –ї–Њ–Ї–∞–ї—М–љ–Њ–є —Н–Ї—Б–њ—А–µ—Б—Б–Є–µ–є –Љ–Њ–љ–Њ—Ж–Є—В–∞—А–љ–Њ–≥–Њ —Е–µ–Љ–Њ—В–∞–Ї—Б–Є—З–µ—Б–Ї–Њ–≥–Њ –±–µ–ї–Ї–∞ 1 –≤ –њ–Њ—З–Ї–∞—Е –Є —Ж–Є–Ї–ї–Њ–Њ–Ї—Б–Є–≥–µ–љ–∞–Ј—Л 2-–≥–Њ —В–Є–њ–∞ –≤ –Ї—А–Њ–≤–µ–љ–Њ—Б–љ—Л—Е —Б–Њ—Б—Г–і–∞—Е [85].
–°–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Њ–љ–љ—Л–µ –Љ–µ—В–Њ–і—Л –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є, —В–∞–Ї–Є–µ –Ї–∞–Ї —Г–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ (–£–Ч–Ш) –Є –і–≤—Г—Е—Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–∞—П –Ї–Њ–Љ–њ—М—О—В–µ—А–љ–∞—П —В–Њ–Љ–Њ–≥—А–∞—Д–Є—П (–Ф–≠–Ъ–Ґ), –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї—Г—О —Б–≤—П–Ј—М –Љ–µ–ґ–і—Г –У–£ –Є –Њ—В–ї–Њ–ґ–µ–љ–Є–µ–Љ –і–µ–њ–Њ–Ј–Є—В–Њ–≤ –Ь–£–Э –≤ –Њ–њ–Њ—А–љ–Њ-–і–≤–Є–≥–∞—В–µ–ї—М–љ–Њ–Љ –∞–њ–њ–∞—А–∞—В–µ –µ—Й–µ –і–Њ –і–µ–±—О—В–∞ —Б—Г—Б—В–∞–≤–љ–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ [85вАУ95]. –С—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –і–∞–љ–љ—Л–µ –Љ–µ—В–Њ–і—Л –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ—А–µ–і–Њ—Б—В–∞–≤–ї—П—О—В –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –≤—Л—П–≤–ї—П—В—М –і–µ–њ–Њ–Ј–Є—В—Л –Ь–£–Э, —Г—Б—В–∞–љ–∞–≤–ї–Є–≤–∞—В—М –Є—Е –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є—О –Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ, –∞ —В–∞–Ї–ґ–µ –њ—А–Њ–≤–Њ–і–Є—В—М –і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Њ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ –≤–Њ –≤—А–µ–Љ—П –£–°–Ґ. –Т —А—П–і–µ —Б–ї—Г—З–∞–µ–≤ –Њ—В–ї–Њ–ґ–µ–љ–Є—П –Ь–£–Э –≤ –≤–Є–і–µ –≤–Є–і–Є–Љ—Л—Е –Є–ї–Є –≤—Л—П–≤–ї–µ–љ–љ—Л—Е –њ—А–Є –њ–Њ–Љ–Њ—Й–Є –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Њ–љ–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ —В–Њ—Д—Г—Б–Њ–≤ –≤ –Њ–±–ї–∞—Б—В–Є –Ї–Њ–ґ–Є, —Б—Г—Б—В–∞–≤–Њ–≤, —Б—Г—Е–Њ–ґ–Є–ї–Є–є –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –∞—А—В—А–Є—В–∞, –±–µ–Ј–±–Њ–ї–µ–Ј–љ–µ–љ–љ—Л –Є –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ—Л. –Я—А–Є –£–Ч–Ш –Ї—А–Є—Б—В–∞–ї–ї—Л –Ь–£–Э, –њ–Њ–Ї—А—Л–≤–∞—О—Й–Є–µ —Б—Г—Б—В–∞–≤–љ–Њ–є —Е—А—П—Й, –Љ–Њ–≥—Г—В –±—Л—В—М –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л –Ї–∞–Ї —Б–Є–Љ–њ—В–Њ–Љ ¬Ђ–і–≤–Њ–є–љ–Њ–≥–Њ –Ї–Њ–љ—В—Г—А–∞¬ї, —В–Њ—Д—Г—Б—Л (—Б–Ї–Њ–њ–ї–µ–љ–Є–µ –Ї—А–Є—Б—В–∞–ї–ї–Њ–≤ –Ь–£–Э, –Њ–Ї—А—Г–ґ–µ–љ–љ—Л—Е –Њ—А–≥–∞–љ–Є–Ј–Њ–≤–∞–љ–љ—Л–Љ –Ї–ї–µ—В–Њ—З–љ—Л–Љ –Њ–±–Њ–і–Ї–Њ–Љ –Є —Д–Є–±—А–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–є –Ј–Њ–љ–Њ–є) –Є–ї–Є –≤ –≤–Є–і–µ –≥–Є–њ–µ—А—Н—Е–Њ–≥–µ–љ–љ—Л—Е –≤–Ї–ї—О—З–µ–љ–Є–є –≤ –њ–Њ–ї–Њ—Б—В–Є —Б—Г—Б—В–∞–≤–∞ (–≤–Є–і ¬Ђ–Љ–µ—В–µ–ї–Є¬ї) [96]. –Ф–≠–Ъ–Ґ, –Є–Љ–µ—О—Й–∞—П –і–≤–∞ –Є—Б—В–Њ—З–љ–Є–Ї–∞ —А–µ–љ—В–≥–µ–љ–Њ–≤—Б–Ї–Њ–≥–Њ –Є–Ј–ї—Г—З–µ–љ–Є—П –Є –і–≤–∞ –і–µ—В–µ–Ї—В–Њ—А–∞, —Б–њ–Њ—Б–Њ–±–љ–∞ –Њ–њ—А–µ–і–µ–ї—П—В—М, –≤–Ї–ї—О—З–∞–µ—В –ї–Є —Е–Є–Љ–Є—З–µ—Б–Ї–Є–є —Б–Њ—Б—В–∞–≤ –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–є –Њ–±–ї–∞—Б—В–Є –Ї—А–Є—Б—В–∞–ї–ї—Л –Ь–£–Э, –Є —Б –њ–Њ–Љ–Њ—Й—М—О –њ—А–Њ–≥—А–∞–Љ–Љ–љ–Њ–≥–Њ –Њ–±–µ—Б–њ–µ—З–µ–љ–Є—П –Њ—Ж–µ–љ–Є–≤–∞–µ—В –Є—Е –Њ–±—К–µ–Љ.
–Т –њ–Њ–њ—Л—В–Ї–µ –і–Њ–Ї–∞–Ј–∞—В—М –љ–∞–ї–Є—З–Є–µ –і–µ–њ–Њ–Ј–Є—В–Њ–≤ –Ь–£–Э —Г –ї–Є—Ж —Б –С–У–£ –Љ–љ–Њ–≥–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–Є [85вАУ95] –њ—А–Њ–≤–Њ–і–Є–ї–Є –Є–љ—Б—В—А—Г–Љ–µ–љ—В–∞–ї—М–љ–Њ–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –і–∞–љ–љ–Њ–є –Ї–∞—В–µ–≥–Њ—А–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Я–Њ –њ–Њ–ї—Г—З–µ–љ–љ—Л–Љ –і–∞–љ–љ—Л–Љ, —Б—Г–±–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –Њ—В–ї–Њ–ґ–µ–љ–Є—П –і–µ–њ–Њ–Ј–Є—В–Њ–≤ –Ь–£–Э –≤ —Б—В—А—Г–Ї—В—Г—А–∞—Е –Њ–њ–Њ—А–љ–Њ-–і–≤–Є–≥–∞—В–µ–ї—М–љ–Њ–≥–Њ –∞–њ–њ–∞—А–∞—В–∞ –Њ–њ—А–µ–і–µ–ї—П–ї–Є—Б—М —Г 42% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –С–У–£ –њ—А–Є –њ–Њ–Љ–Њ—Й–Є –£–Ч–Ш –Є –Ф–≠–Ъ–Ґ.. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є [86] –Њ—В–ї–Њ–ґ–µ–љ–Є—П –Ь–£–Э –≤ –Њ–±–ї–∞—Б—В–Є —Б—Г—Б—В–∞–≤–Њ–≤ –Є —Б—Г—Е–Њ–ґ–Є–ї–Є–є —Б—В–Њ–њ –њ–Њ –Ф–≠–Ъ–Ґ –љ–∞–±–ї—О–і–∞–ї–Є—Б—М —Г 24% –њ–∞—Ж–Є–µ–љ—В–Њ–≤. P. Wang et al. [87] —Г 15% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ–±–љ–∞—А—Г–ґ–Є–ї–Є –Њ—В–ї–Њ–ґ–µ–љ–Є—П –Ї—А–Є—Б—В–∞–ї–ї–Њ–≤ –Ь–£–Э –њ–Њ –і–∞–љ–љ—Л–Љ –Ф–≠–Ъ–Ґ —Б–Њ —Б—А–µ–і–љ–Є–Љ –Њ–±—Й–Є–Љ –Њ–±—К–µ–Љ–Њ–Љ 0,13¬±0,14 —Б–Љ3. Y. Sun et al. [88] —Б –њ–Њ–Љ–Њ—Й—М—О –Ф–≠–Ъ–Ґ –≤—Л—П–≤–Є–ї–Є 80 –Њ–±–ї–∞—Б—В–µ–є –Њ—В–ї–Њ–ґ–µ–љ–Є–є –і–µ–њ–Њ–Ј–Є—В–Њ–≤ –Ь–£–Э —Б—А–µ–і–Є 19 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –С–У–£, –њ—А–Є —Н—В–Њ–Љ —Б—А–µ–і–љ–µ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —Г—З–∞—Б—В–Ї–Њ–≤ –Њ—В–ї–Њ–ґ–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–Є–ї–Њ 3. –Т —А–∞–±–Њ—В–µ [89] —Б–Є–Љ–њ—В–Њ–Љ ¬Ђ–і–≤–Њ–є–љ–Њ–≥–Њ –Ї–Њ–љ—В—Г—А–∞¬ї –њ—А–Є –£–Ч–Ш –±—Л–ї –≤—Л—П–≤–ї–µ–љ –≤ 25% –њ–µ—А–≤—Л—Е –њ–ї—О—Б–љ–µ—Д–∞–ї–∞–љ–≥–Њ–≤—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤ (1–Я–ї–§–°) —Б—В–Њ–њ –Є 17% —В–∞–Ј–Њ–±–µ–і—А–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤, –∞ –≤–љ—Г—В—А–Є—Б—Г—Б—В–∞–≤–љ—Л–µ —В–Њ—Д—Г—Б—Л –±—Л–ї–Є –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л —Г 16% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –С–У–£. –°–Є–Љ–њ—В–Њ–Љ—Л –Њ—В–ї–Њ–ґ–µ–љ–Є–є –Ь–£–Э –њ–Њ –і–∞–љ–љ—Л–Љ –£–Ч–Ш –±—Л–ї–Є –≤—Л—П–≤–ї–µ–љ—Л —Г 42% –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Є—З–µ–Љ —Г 82% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–∞–ї–Є—З–Є–µ –Ї—А–Є—Б—В–∞–ї–ї–Њ–≤ –Ь–£–Э –±—Л–ї–Њ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Њ –њ—А–Є –њ–Њ–ї—П—А–Є–Ј–∞—Ж–Є–Њ–љ–љ–Њ–є –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Є–Є —Б–Є–љ–Њ–≤–Є–∞–ї—М–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є [90]. J.G. Puig et al. [91] —Г 34% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–Є –£–Ч–Ш –≤—Л—П–≤–Є–ї–Є —В–Њ—Д—Г—Б—Л –≤ –Њ–±–ї–∞—Б—В–Є —Б—Г—Е–Њ–ґ–Є–ї–Є–є, —Б–Є–љ–Њ–≤–Є–∞–ї—М–љ–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –Є–ї–Є –Љ—П–≥–Ї–Є—Е —В–Ї–∞–љ–µ–є, –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–∞—П —А–µ–∞–Ї—Ж–Є—П –≤ –Њ–±–ї–∞—Б—В–Є —В–Њ—Д—Г—Б–Њ–≤ –љ–∞–±–ї—О–і–∞–ї–∞—Б—М —Г 23% –њ–∞—Ж–Є–µ–љ—В–Њ–≤.. M. Andes et al. [92] –њ–Њ –і–∞–љ–љ—Л–Љ –£–Ч–Ш –Ї–Њ–ї–µ–љ–љ—Л—Е, –≥–Њ–ї–µ–љ–Њ—Б—В–Њ–њ–љ—Л—Е –Є 1–Я–ї–§–° –Њ–±–љ–∞—А—Г–ґ–Є–ї–Є –≥–Є–њ–µ—А—Н—Е–Њ–≥–µ–љ–љ—Л–µ –≤–Ї–ї—О—З–µ–љ–Є—П, —Б–Є–Љ–њ—В–Њ–Љ ¬Ђ–і–≤–Њ–є–љ–Њ–≥–Њ –Ї–Њ–љ—В—Г—А–∞¬ї –Є —В–Њ—Д—Г—Б—Л —Г 53,3, 26,7 –Є 10% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –∞ —Г 14,8% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–Є –њ–Њ–ї—П—А–Є–Ј–∞—Ж–Є–Њ–љ–љ–Њ–є –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Є–Є —Б–Є–љ–Њ–≤–Є–∞–ї—М–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є –±—Л–ї–Є –≤—Л—П–≤–ї–µ–љ—Л –Ї—А–Є—Б—В–∞–ї–ї—Л –Ь–Ъ. –Ю—В–ї–Њ–ґ–µ–љ–Є—П –Ь–£–Э –њ–Њ –і–∞–љ–љ—Л–Љ –£–Ч–Ш –Ї–Њ–ї–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤ –Є 1–Я–ї–§–° –њ—А–Є—Б—Г—В—Б—В–≤–Њ–≤–∞–ї–Є —Г 29% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ [93]. M.A. Reuss-Borst et al. [94] –≤—Л—П–≤–Є–ї–Є –њ—А–Є –£–Ч–Ш –≤ 14% –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П (–Є–Ј –љ–Є—Е 8% c —Б–Є–Љ–њ—В–Њ–Љ–Њ–Љ ¬Ђ–і–≤–Њ–є–љ–Њ–≥–Њ –Ї–Њ–љ—В—Г—А–∞¬ї). –Р. Abhishek et al. [95] –Њ–±—Б–ї–µ–і–Њ–≤–∞–ї–Є 131 —З–µ–ї–Њ–≤–µ–Ї–∞ (—Б—Л–љ–Њ–≤—М—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–Њ–і–∞–≥—А–Њ–є): —Г—А–Њ–≤–µ–љ—М –Ь–Ъ –±—Л–ї –љ–µ –Љ–µ–љ–µ–µ 6 –Љ–≥/–і–ї (360 –Љ–Ї–Љ–Њ–ї—М/–ї) —Г 64,1% –Є –љ–µ –Љ–µ–љ–µ–µ 7 –Љ–≥/–і–ї (420 –Љ–Ї–Љ–Њ–ї—М/–ї) —Г 29%, –∞ —Г 29,8% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±—Л–ї–Є –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л –Є–Ј–Љ–µ–љ–µ–љ–Є—П –њ–Њ –£–Ч–Ш –љ–µ –Љ–µ–љ–µ–µ —З–µ–Љ –≤ 1 —Б—Г—Б—В–∞–≤–µ. –Т —А–∞–±–Њ—В–µ [85] —З–∞—Б—В–Њ—В–∞ —Б–Є–љ–Њ–≤–Є—В–∞ –Є —Б–Є–Љ–њ—В–Њ–Љ–∞ ¬Ђ–і–≤–Њ–є–љ–Њ–≥–Њ –Ї–Њ–љ—В—Г—А–∞¬ї –њ—А–Є –£–Ч–Ш —Б–Њ—Б—В–∞–≤–ї—П–ї–∞ 67% –Є 27% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –С–У–£ –Є –њ–Њ–і–∞–≥—А–Њ–є –Є –±—Л–ї–∞ –≤—Л—И–µ, —З–µ–Љ –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ, –∞ –њ–∞—Ж–Є–µ–љ—В—Л —Б –Њ—В–ї–Њ–ґ–µ–љ–Є—П–Љ–Є –і–µ–њ–Њ–Ј–Є—В–Њ–≤ –Ь–£–Э –Є–Љ–µ–ї–Є –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–µ —Г—А–Њ–≤–љ–Є –Ш–Ы-6 –Є –Љ–Є–Ї—А–Њ–†–Э–Ъ-155.
–Я–Њ–і—Е–Њ–і—Л –Ї —В–µ—А–∞–њ–Є–Є –С–У–£
–Т —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е –љ–µ–Ї–Њ—В–Њ—А—Л—Е –њ—А–Њ—Д–µ—Б—Б–Є–Њ–љ–∞–ї—М–љ—Л—Е —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Б–Њ–Њ–±—Й–µ—Б—В–≤ –њ–Њ –≤–µ–і–µ–љ–Є—О –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–Њ–і–∞–≥—А–Њ–є (–ѓ–њ–Њ–љ–Є—П, –Ґ–∞–є–≤–∞–љ—М, –Ъ–Є—В–∞–є –Є –Я–Њ—А—В—Г–≥–∞–ї–Є—П) –≤—Л—Б–Ї–∞–Ј—Л–≤–∞–µ—В—Б—П –Љ–љ–µ–љ–Є–µ, —З—В–Њ –С–У–£ –њ–Њ–і–ї–µ–ґ–Є—В –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–Љ—Г –ї–µ—З–µ–љ–Є—О –њ—А–Є –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –љ–µ—Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Љ–µ—В–Њ–і–Њ–≤ —В–µ—А–∞–њ–Є–Є, –≤—Л—Б–Њ–Ї–Њ–Љ —Г—А–Њ–≤–љ–µ –Ь–Ъ –≤ –Ї—А–Њ–≤–Є –Є –љ–∞–ї–Є—З–Є–Є —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Є—Б—В–µ–Љ—Л, –њ–Њ—З–µ–Ї –Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є [97]. –Ґ–∞–Ї, —Б–Њ–≥–ї–∞—Б–љ–Њ –ѓ–њ–Њ–љ—Б–Ї–Є–Љ –љ–∞—Ж–Є–Њ–љ–∞–ї—М–љ—Л–Љ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ, –њ—А–Є —Г—А–Њ–≤–љ–µ –Ь–Ъ –љ–µ –Љ–µ–љ–µ–µ 9 –Љ–≥/–і–ї (540 –Љ–Ї–Љ–Њ–ї—М/–ї) –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ—Г—О —В–µ—А–∞–њ–Є—О —Б–ї–µ–і—Г–µ—В —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В –Љ–Њ–і–Є—Д–Є–Ї–∞—Ж–Є–Є –Ю–Ц, –Ї—А–Њ–Љ–µ —В–Њ–≥–Њ, –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –£–°–Ґ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ, –Ї–Њ–≥–і–∞ —Г—А–Њ–≤–µ–љ—М –Ь–Ъ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –і–Њ—Б—В–Є–≥–∞–µ—В 8 –Љ–≥/–і–ї (480 –Љ–Ї–Љ–Њ–ї—М/–ї) –Є –±–Њ–ї–µ–µ, –µ—Б–ї–Є —Г –њ–∞—Ж–Є–µ–љ—В–∞ –Є–Љ–µ—О—В—Б—П —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –≤ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –њ–∞—В–Њ–ї–Њ–≥–Є—П –њ–Њ—З–µ–Ї (–•–Я–С, –Ь–Ъ–С) [98]. –Т –Я–Њ—А—В—Г–≥–∞–ї–Є–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Г—А–Њ–≤–љ–µ–Љ —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–Њ–є –Ь–Ъ –љ–µ –Љ–µ–љ–µ–µ 9 –Љ–≥/–і–ї (540 –Љ–Ї–Љ–Њ–ї—М/–ї) —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –ї–µ—З–µ–љ–Є–µ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В –њ–Њ—Б–ї–µ –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ–є –Њ—Ж–µ–љ–Ї–Є —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є—П —А–Є—Б–Ї–∞ –Є –њ–Њ–ї—М–Ј—Л, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є –њ—А–Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –њ–Њ–і–∞–≥—А—Л [99]. A. Brucato et al. [100] —А–µ–Ї–Њ–Љ–µ–љ–і—Г—О—В —Б–ї–µ–і—Г—О—Й–Є–µ –њ–Њ–Ї–∞–Ј–∞–љ–Є—П –Ї –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –∞–ї–ї–Њ–њ—Г—А–Є–љ–Њ–ї–∞: —Б—В–Њ–є–Ї–Є–µ —Г—А–Њ–≤–љ–Є –Ь–Ъ –≤—Л—И–µ 13 –Љ–≥/–і–ї (780 –Љ–Ї–Љ–Њ–ї—М/–ї) —Г –Љ—Г–ґ—З–Є–љ –Є–ї–Є 10 –Љ–≥/–і–ї (600 –Љ–Ї–Љ–Њ–ї—М/–ї) —Г –ґ–µ–љ—Й–Є–љ (—Н—В–Є –Ј–љ–∞—З–µ–љ–Є—П –њ–Њ–≤—Л—И–∞—О—В —А–Є—Б–Ї –љ–µ—Д—А–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В–Є, –∞ –£–°–Ґ –Љ–Њ–ґ–µ—В –Ј–∞–Љ–µ–і–ї—П—В—М –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –њ–Њ—З–µ–Ї –Є –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞—В—М —Н—В–Є —А–Є—Б–Ї–Є); —Н–Ї—Б–Ї—А–µ—Ж–Є—П –Ь–Ъ –њ–Њ—З–Ї–∞–Љ–Є, –њ—А–µ–≤—Л—И–∞—О—Й–∞—П 1100 –Љ–≥/—Б—Г—В (—Н—В–Њ —Б–≤—П–Ј–∞–љ–Њ —Б —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ —А–Є—Б–Ї–∞ –Њ—Б–∞–ґ–і–µ–љ–Є—П –Ь–Ъ –≤ –≤–Є–і–µ –Ї–∞–Љ–љ–µ–є –љ–∞ 50%, –Ї–Њ—В–Њ—А—Л–є –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞–µ—В—Б—П –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ —Б–љ–Є–ґ–µ–љ–Є—П –µ–µ —Н–Ї—Б–Ї—А–µ—Ж–Є–Є –њ–Њ—З–Ї–∞–Љ–Є –і–Њ 800 –Љ–≥/—Б—Г—В); –њ–Њ–і–≥–Њ—В–Њ–≤–Ї–∞ –њ–∞—Ж–Є–µ–љ—В–∞ –Ї –ї—Г—З–µ–≤–Њ–є –Є–ї–Є —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є (–њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –љ–µ—Д—А–Њ–њ–∞—В–Є–Є –Є –і—А—Г–≥–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є —Б–Є–љ–і—А–Њ–Љ–∞ –ї–Є–Ј–Є—Б–∞ –Њ–њ—Г—Е–Њ–ї–Є).
–Ю–і–љ–∞–Ї–Њ –Є–Љ–µ–µ—В—Б—П –Є –њ—А–Њ—В–Є–≤–Њ–њ–Њ–ї–Њ–ґ–љ–∞—П —В–Њ—З–Ї–∞ –Ј—А–µ–љ–Є—П –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –њ—А–Њ–≤–µ–і–µ–љ–Є—П –£–°–Ґ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –С–У–£.. –Ґ–∞–Ї, –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ–Є —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ–Є –Х–≤—А–Њ–њ–µ–є—Б–Ї–Њ–є –∞–љ—В–Є—А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Њ–є –ї–Є–≥–Є (EULAR) [101], –Р–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Њ–є –Ї–Њ–ї–ї–µ–≥–Є–Є —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Њ–≤ (ACR) [102] –Є –Р–†–† [5] –љ–µ —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є —В–µ—А–∞–њ–Є–Є –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б –С–У–£ –≤ –њ–ї–∞–љ–µ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –њ–Њ–і–∞–≥—А—Л, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ —Г—А–Њ–≤–µ–љ—М –Ь–Ъ –Є –љ–∞–ї–Є—З–Є–µ –Є–ї–Є –Њ—В—Б—Г—В—Б—В–≤–Є–µ –Ї–Њ–Љ–Њ—А–±–Є–і–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є.
–Т —А–µ–∞–ї—М–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ, –њ–Њ –і–∞–љ–љ—Л–Љ –У–Њ—А–Њ–і—Б–Ї–Њ–≥–Њ —А–µ–≥–Є—Б—В—А–∞ –°–∞–љ–Ї—В-–Я–µ—В–µ—А–±—Г—А–≥–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–Њ–і–∞–≥—А–Њ–є –Є –С–У–£, —Б—А–µ–і–Є 400 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ—Б—В–µ–Њ–∞—А—В—А–Є—В–Њ–Љ, –С–У–£ –Є –Њ–±—И–Є—А–љ—Л–Љ –њ–µ—А–µ—З–љ–µ–Љ —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є (–Р–У вАФ 84%, –°–Ф вАФ 31,8%, –•–С–Я вАФ 48,8%, –Њ–ґ–Є—А–µ–љ–Є–µ вАФ 45%, –≥–Є–њ–µ—А—Е–Њ–ї–µ—Б—В–µ—А–Є–љ–µ–Љ–Є—П вАФ 65,7% –Є —В. –і.) –£–°–Ґ –њ–Њ–ї—Г—З–∞–ї–Є –ї–Є—И—М 36,8% –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Є –µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –≤—Б–µ–≥–Њ –≤ 20,4% —Б–ї—Г—З–∞–µ–≤ [103].
–°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е –Х–≤—А–Њ–њ–µ–є—Б–Ї–Њ–≥–Њ –Њ–±—Й–µ—Б—В–≤–∞ –Ї–∞—А–і–Є–Њ–ї–Њ–≥–Њ–≤ (ESC, 2018) [104] –Є –†–Њ—Б—Б–Є–є—Б–Ї–Њ–≥–Њ –Ї–∞—А–і–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ–±—Й–µ—Б—В–≤–∞ (–†–Ъ–Ю, 2020) [105] –њ–Њ –≤–µ–і–µ–љ–Є—О –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Р–У –Њ–±–Њ–Ј–љ–∞—З–µ–љ–Њ, —З—В–Њ –Ь–Ъ —П–≤–ї—П–µ—В—Б—П –Ј–љ–∞—З–Є–Љ—Л–Љ –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ –њ—А–Є –і–∞–љ–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є, –∞ —В–∞–Ї–ґ–µ –Њ—В–Љ–µ—З–∞–µ—В—Б—П –љ–∞–ї–Є—З–Є–µ –і–Њ–Ї–∞–Ј–∞–љ–љ–Њ–є —Б–≤—П–Ј–Є –Љ–µ–ґ–і—Г –У–£ –Є –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є, –≤ —Б–≤—П–Ј–Є —Б —З–µ–Љ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ –µ–µ —Г—А–Њ–≤–љ—П –≤ –Ї—А–Њ–≤–Є —П–≤–ї—П–µ—В—Б—П –Њ–±—П–Ј–∞—В–µ–ї—М–љ—Л–Љ –і–ї—П –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —Б—В—А–∞–і–∞—О—Й–Є—Е –Р–У (—Г—А–Њ–≤–µ–љ—М —Г–±–µ–і–Є—В–µ–ї—М–љ–Њ—Б—В–Є —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–є (–£–£–†) A; —Г—А–Њ–≤–µ–љ—М –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ—Б—В–Є –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤ (–£–Ф–Ф) 2).
–С–Њ–ї–µ–µ —В–Њ–≥–Њ, —Н–Ї—Б–њ–µ—А—В–∞–Љ–Є –≤ –Њ–±–ї–∞—Б—В–Є –Ї–∞—А–і–Є–Њ–ї–Њ–≥–Є–Є –Х–≤—А–Њ–њ—Л (C. Borghi et al.) –Є –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –§–µ–і–µ—А–∞—Ж–Є–Є (–†–Ь–Ю–Р–У) –±—Л–ї –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ –Ї–Њ–љ—Б–µ–љ—Б—Г—Б –њ–Њ –≤–µ–і–µ–љ–Є—О –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –У–£ –Є –≤—Л—Б–Њ–Ї–Є–Љ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л–Љ —А–Є—Б–Ї–Њ–Љ (–°–°–†), —А–µ–Ї–Њ–Љ–µ–љ–і—Г—О—Й–Є–є –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –£–°–Ґ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –∞–ї–ї–Њ–њ—Г—А–Є–љ–Њ–ї –њ—А–Є –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –љ–µ–Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –ї–µ—З–µ–љ–Є—П [27, 106, 107]. –°–Њ–≥–ї–∞—Б–љ–Њ –і–∞–љ–љ–Њ–Љ—Г –і–Њ–Ї—Г–Љ–µ–љ—В—Г —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –њ—А–Є–і–µ—А–ґ–Є–≤–∞—В—М—Б—П —Б–ї–µ–і—Г—О—Й–µ–≥–Њ –њ–Њ—И–∞–≥–Њ–≤–Њ–≥–Њ –∞–ї–≥–Њ—А–Є—В–Љ–∞ –і–µ–є—Б—В–≤–Є–є [27]:
–®–∞–≥ 1. –Ю—Ж–µ–љ–Є—В—М —Г—А–Њ–≤–µ–љ—М –Ь–Ъ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є, —Б—З–Є—В–∞—В—М –≤—Л—Б–Њ–Ї–Є–Љ —Г—А–Њ–≤–µ–љ—М –±–Њ–ї–µ–µ 360 –Љ–Ї–Љ–Њ–ї—М/–ї (–≤ –њ–µ—А–µ—Б–Љ–Њ—В—А–µ C. Borghi et al. –Њ—В 2021 –≥. [107]: —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –љ–∞–ї–Є—З–Є–µ–Љ –Љ–Є–љ–Є–Љ—Г–Љ –і–≤—Г—Е –Є–Ј —Б–ї–µ–і—Г—О—Й–Є—Е –§–†: –Р–У, –°–Ф, –і–Є—Б–ї–Є–њ–Є–і–µ–Љ–Є—П, –њ–Њ—А–∞–ґ–µ–љ–Є–µ –Њ—А–≥–∞–љ–Њ–≤-–Љ–Є—И–µ–љ–µ–є –Є–ї–Є –њ–µ—А–µ–ґ–Є—В—Л–µ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л–µ —Б–Њ–±—Л—В–Є—П вАФ –±–Њ–ї–µ–µ 300 –Љ–Ї–Љ–Њ–ї—М/–ї).
–®–∞–≥ 2. –Ю—Ж–µ–љ–Є—В—М –љ–∞–ї–Є—З–Є–µ —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –≤—Л—Б–Њ–Ї–Є–Љ –°–°–† —Ж–µ–ї–µ–≤—Л–Љ —Б—З–Є—В–∞—В—М —Г—А–Њ–≤–µ–љ—М –Ь–Ъ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –љ–Є–ґ–µ 300 –Љ–Ї–Љ–Њ–ї—М/–ї
(–≤ –њ–µ—А–µ—Б–Љ–Њ—В—А–µ C. Borghi et al. –Њ—В 2021 –≥. [107]: —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –љ–∞–ї–Є—З–Є–µ–Љ –Љ–Є–љ–Є–Љ—Г–Љ –і–≤—Г—Е –Є–Ј —Б–ї–µ–і—Г—О—Й–Є—Е –§–†: –Р–У, –°–Ф, –і–Є—Б–ї–Є–њ–Є–і–µ–Љ–Є—П, –њ–Њ—А–∞–ґ–µ–љ–Є–µ –Њ—А–≥–∞–љ–Њ–≤-–Љ–Є—И–µ–љ–µ–є –Є–ї–Є –њ–µ—А–µ–ґ–Є—В—Л–µ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л–µ —Б–Њ–±—Л—В–Є—П вАФ –Љ–µ–љ–µ–µ 300 –Љ–Ї–Љ–Њ–ї—М/–ї, —Г –Є–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ вАФ –Љ–µ–љ–µ–µ 360 –Љ–Ї–Љ–Њ–ї—М/–ї).
–®–∞–≥ 3. –Ш–љ—Д–Њ—А–Љ–Є—А–Њ–≤–∞—В—М –њ–∞—Ж–Є–µ–љ—В–∞ –Њ —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Д–∞–Ї—В–Њ—А–∞—Е, –≤–ї–Є—П—О—Й–Є—Е –љ–∞ –У–£, —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е –Є —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –§–†. –†–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞—В—М –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Ю–Ц, –і–Є–µ—В—Л (–≤ –њ–µ—А–µ—Б–Љ–Њ—В—А–µ C. Borghi et al. –Њ—В 2021 –≥. [107]: –Њ–≥—А–∞–љ–Є—З–µ–љ–Є–µ –њ–Њ—В—А–µ–±–ї–µ–љ–Є—П –њ—Г—А–Є–љ–Њ–≤, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –Ї—А–∞—Б–љ–Њ–≥–Њ –Љ—П—Б–∞, –Љ–Њ—А–µ–њ—А–Њ–і—Г–Ї—В–Њ–≤, –њ—А–Њ–і—Г–Ї—В–Њ–≤ —Б –≤—Л—Б–Њ–Ї–Є–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ —Д—А—Г–Ї—В–Њ–Ј—Л, —Б–∞—Е–∞—А–Њ—Б–Њ–і–µ—А–ґ–∞—Й–Є—Е –±–µ–Ј–∞–ї–Ї–Њ–≥–Њ–ї—М–љ—Л—Е –љ–∞–њ–Є—В–Ї–Њ–≤ –Є –∞–ї–Ї–Њ–≥–Њ–ї—П; —А–µ–≥—Г–ї—П—А–љ–∞—П —Д–Є–Ј–Є—З–µ—Б–Ї–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М; —Г–њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –Ї–Њ—Д–µ, –Љ–Њ–ї–Њ—З–љ–Њ–Ї–Є—Б–ї—Л—Е –њ—А–Њ–і—Г–Ї—В–Њ–≤, –≤–Є—И–љ–Є –Є –∞—Б–Ї–Њ—А–±–Є–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –Є —Б–љ–Є–ґ–µ–љ–Є–µ –Љ–∞—Б—Б—Л —В–µ–ї–∞, –∞ —В–∞–Ї–ґ–µ —Б—В—А–Њ–≥–∞—П –њ—А–Є–≤–µ—А–ґ–µ–љ–љ–Њ—Б—В—М —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ–Љ–Њ–Љ—Г –ї–µ—З–µ–љ–Є—О. –Ю—В–Љ–µ–љ–Є—В—М –њ–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В—Л, –≤–ї–Є—П—О—Й–Є–µ –љ–∞ —Г—А–Њ–≤–µ–љ—М –Ь–Ъ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є (–≤ –њ–µ—А–µ—Б–Љ–Њ—В—А–µ C. Borghi et al. –Њ—В 2021 –≥. [107]: —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –ї–Њ–Ј–∞—А—В–∞–љ–∞; –њ–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Њ—В–Љ–µ–љ–∞/–Ј–∞–Љ–µ–љ–∞ –і–Є—Г—А–µ—В–Є–Ї–Њ–≤, –љ–Є–Ј–Ї–Є—Е –і–Њ–Ј –Р–°–Ъ (–њ—А–Є –њ–µ—А–≤–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –°–°–Ч); –≤ —В–Њ –ґ–µ –≤—А–µ–Љ—П –љ–µ —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –њ–µ—А–µ—Е–Њ–і —Б –і—А—Г–≥–Є—Е –±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–∞ –љ–∞ –ї–Њ–Ј–∞—А—В–∞–љ; –њ—А–µ–Ї—А–∞—Й–µ–љ–Є–µ –њ—А–Є–µ–Љ–∞ –љ–Є–Ј–Ї–Є—Е –і–Њ–Ј –Р–°–Ъ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б–Њ –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Њ–є –°–°–Ч; –њ–µ—А–µ—Е–Њ–і —Б–Њ —Б—В–∞—В–Є–љ–Њ–≤ –љ–∞ —Д–µ–љ–Њ—Д–Є–±—А–∞—В).
–®–∞–≥ 4. –Э–∞—З–∞—В—М —В–µ—А–∞–њ–Є—О –∞–ї–ї–Њ–њ—Г—А–Є–љ–Њ–ї–Њ–Љ –≤ –і–Њ–Ј–Є—А–Њ–≤–Ї–µ 100 –Љ–≥ —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є —В–Є—В—А–∞—Ж–Є–µ–є –і–Њ 300вАУ600 –Љ–≥/—Б—Г—В, –і–Њ –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —Ж–µ–ї–µ–≤–Њ–≥–Њ —Г—А–Њ–≤–љ—П –Ь–Ъ (–≤ –њ–µ—А–µ—Б–Љ–Њ—В—А–µ C. Borghi et al. –Њ—В 2021 –≥. [107]: вАФ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П –і–Њ–Ј–∞ 900 –Љ–≥/—Б—Г—В).
–®–∞–≥ 5. –Ъ–Њ–љ—В—А–Њ–ї–Є—А–Њ–≤–∞—В—М —Г—А–Њ–≤–µ–љ—М –Ь–Ъ –≤ –Ї—А–Њ–≤–Є –љ–µ —А–µ–ґ–µ 2 —А–∞–Ј –≤ –≥–Њ–і. –£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Р–У, –Ш–С–°, –Ю–Э–Ь–Ъ –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ, –°–Ф –Є –•–С–Я, –љ–µ –і–Њ—Б—В–Є–≥—И–Є—Е —Ж–µ–ї–µ–≤–Њ–≥–Њ —Г—А–Њ–≤–љ—П –Ь–Ъ, —А–∞—Б—Б–Љ–Њ—В—А–µ—В—М –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є (–∞–ї–ї–Њ–њ—Г—А–Є–љ–Њ–ї + –њ—А–µ–њ–∞—А–∞—В —Б —Г—А–Є–Ї–Њ–Ј—Г—А–Є—З–µ—Б–Ї–Є–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ) (–≤ –њ–µ—А–µ—Б–Љ–Њ—В—А–µ
C. Borghi et al. –Њ—В 2021 –≥. [107]: –њ—А–Є –і–Њ—Б—В–Є–ґ–µ–љ–Є–Є —Ж–µ–ї–µ–≤—Л—Е –Ј–љ–∞—З–µ–љ–Є–є –Ь–Ъ –љ–µ –њ—А–µ–Ї—А–∞—Й–∞—В—М –ї–µ—З–µ–љ–Є–µ).
–Ъ–Њ–љ—Б–µ–љ—Б—Г—Б –Ю–±—К–µ–і–Є–љ–µ–љ–љ–Њ–є –∞–Ї–∞–і–µ–Љ–Є–Є —Н–љ–і–Њ–Ї—А–Є–љ–Њ–ї–Њ–≥–Є–Є –Є –і–Є–∞–±–µ—В–∞ (IDEA) [108] —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В –љ–∞—З–Є–љ–∞—В—М –£–°–Ґ –њ—А–Є –С–У–£ –і–Њ —Г—А–Њ–≤–љ—П –Ь–Ъ 9 –Љ–≥/–і–ї (540 –Љ–Ї–Љ–Њ–ї—М/–ї) —Б –љ–∞–ї–Є—З–Є–µ–Љ —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є –•–С–Я IIIвАУIV —Б—В–∞–і–Є–Є –Є/–Є–ї–Є –Ь–Ъ–С, –њ—А–Є —Н—В–Њ–Љ —В–µ—А–∞–њ–Є—П –∞–ї–ї–Њ–њ—Г—А–Є–љ–Њ–ї–Њ–Љ —В–∞–Ї–ґ–µ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–∞ –њ—А–Є —Г—А–Њ–≤–љ–µ –Ь–Ъ –≤—Л—И–µ 9 –Љ–≥/–і–ї (540 –Љ–Ї–Љ–Њ–ї—М/–ї) –Є –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –њ–Њ—З–µ–Ї (—Ж–µ–ї–µ–≤–Њ–є —Г—А–Њ–≤–µ–љ—М вАФ –Љ–µ–љ–µ–µ 360 –Љ–Ї–Љ–Њ–ї—М/–ї).
–Т –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е –Р—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є –љ–µ—Д—А–Њ–ї–Њ–≥–Њ–≤ –†–Њ—Б—Б–Є–Є (2021) –њ–Њ –≤–µ–і–µ–љ–Є—О –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–С–Я [109] –≤—Б–µ–Љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б –і–∞–љ–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–µ–є —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Є –Љ–Њ–љ–Є—В–Њ—А–Є—А–Њ–≤–∞–љ–Є–µ —Г—А–Њ–≤–љ—П –Ь–Ъ –≤ –Ї—А–Њ–≤–Є, –Ї–Њ—В–Њ—А–Њ–µ –њ—А–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –і–Њ–ї–ґ–љ–Њ –±—Л—В—М –і–Њ–њ–Њ–ї–љ–µ–љ–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ–Љ —Г—А–Њ–≤–љ—П –Ь–Ъ –≤ –Љ–Њ—З–µ –Є —А–∞—Б—З–µ—В–Њ–Љ –µ–µ —Б—Г—В–Њ—З–љ–Њ–є —Н–Ї—Б–Ї—А–µ—Ж–Є–Є –і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П –Є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –У–£, –Њ—Ж–µ–љ–Ї–Є –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л—Е —А–Є—Б–Ї–Њ–≤ –Є –≤—Л–±–Њ—А–∞ —В–µ—А–∞–њ–Є–Є (–£–£–† вАФ A, –£–Ф–Ф вАФ 1). D. Viggiano et al. [110] –њ—А–µ–і–ї–∞–≥–∞—О—В –≤ –Ї–∞—З–µ—Б—В–≤–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є–і–µ–љ—В–Є—Д–Є—Ж–Є—А–Њ–≤–∞—В—М –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –•–С–Я —Г—А–∞—В–љ–Њ–≥–Њ –≥–µ–љ–µ–Ј–∞ –њ—Г—В–µ–Љ –∞–љ–∞–ї–Є–Ј–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Љ–Њ—З–µ–≤–Њ–≥–Њ –Њ—Б–∞–і–Ї–∞ (–љ–∞ –њ—А–µ–і–Љ–µ—В –љ–∞–ї–Є—З–Є—П –Ї—А–Є—Б—В–∞–ї–ї–Њ–≤ —Г—А–∞—В–Њ–≤), –£–Ч–Ш –Њ–њ–Њ—А–љ–Њ-–і–≤–Є–≥–∞—В–µ–ї—М–љ–Њ–≥–Њ –∞–њ–њ–∞—А–∞—В–∞ (–љ–∞ –њ—А–µ–і–Љ–µ—В –љ–∞–ї–Є—З–Є—П –і–µ–њ–Њ–Ј–Є—В–Њ–≤ –Ї—А–Є—Б—В–∞–ї–ї–Њ–≤ –Ь–£–Э) –Є –і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П –Ј–∞ —Д—Г–љ–Ї—Ж–Є–µ–є –њ–Њ—З–µ–Ї. –Я–Њ –Љ–љ–µ–љ–Є—О –Ї–Њ–ї–ї–µ–Ї—В–Є–≤–∞ –∞–≤—В–Њ—А–Њ–≤, –£–°–Ґ —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ –љ–∞—З–Є–љ–∞—В—М –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б –љ–∞–ї–Є—З–Є–µ–Љ –Ї—А–Є—Б—В–∞–ї–ї–Њ–≤ —Г—А–∞—В–Њ–≤ –≤ –Њ—Б–∞–і–Ї–µ –Љ–Њ—З–Є –Є –і–µ–њ–Њ–Ј–Є—В–Њ–≤ –Ь–£–Э –≤ –Њ–±–ї–∞—Б—В–Є –Њ–њ–Њ—А–љ–Њ-–і–≤–Є–≥–∞—В–µ–ї—М–љ–Њ–≥–Њ –∞–њ–њ–∞—А–∞—В–∞, –∞ —В–∞–Ї–ґ–µ –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ–є –і–Є–љ–∞–Љ–Є–Ї–Њ–є —А–∞—Б—З–µ—В–љ–Њ–є –°–Ъ–§ –Ј–∞ 6 –Љ–µ—Б.
–Я–Њ –і–∞–љ–љ—Л–Љ –∞–Ї—В—Г–∞–ї—М–љ—Л—Е –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–є, –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –њ–µ—А–≤–Њ–є –ї–Є–љ–Є–Є –і–ї—П –£–°–Ґ –њ—А–Є –њ–Њ–і–∞–≥—А–µ –Є –С–У–£ —П–≤–ї—П–µ—В—Б—П –Є–љ–≥–Є–±–Є—В–Њ—А –Ъ–°–Ю –∞–ї–ї–Њ–њ—Г—А–Є–љ–Њ–ї (–Ь–Є–ї—Г—А–Є—В¬Ѓ, ¬Ђ–≠–У–Ш–°¬ї). –Ь–Є–ї—Г—А–Є—В¬Ѓ вАФ –µ–і–Є–љ—Б—В–≤–µ–љ–љ—Л–є –≤ –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –§–µ–і–µ—А–∞—Ж–Є–Є –њ—А–µ–њ–∞—А–∞—В, –Є–Љ–µ—О—Й–Є–є –≤ –Ї–∞—З–µ—Б—В–≤–µ –Њ—Д–Є—Ж–Є–∞–ї—М–љ–Њ–≥–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Є—П –Ї –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –љ–µ —В–Њ–ї—М–Ї–Њ –њ–Њ–і–∞–≥—А—Г, –љ–Њ –Є —А–∞–Ј–ї–Є—З–љ—Л–µ –≤–Є–і—Л –У–£. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –∞–ї–ї–Њ–њ—Г—А–Є–љ–Њ–ї–∞ –±–Њ–ї–µ–µ –њ—А–µ–і–њ–Њ—З—В–Є—В–µ–ї—М–љ–Њ –і–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–°–†, —В–∞–Ї –Ї–∞–Ї, –њ–Њ –і–∞–љ–љ—Л–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П CARES (Goutand Cardiovascular Morbidities), —И–∞–љ—Б—Л —Б–Љ–µ—А—В–Є –Њ—В –≤—Б–µ—Е –њ—А–Є—З–Є–љ –Є –Њ—В –°–°–Ч –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –∞–ї–ї–Њ–њ—Г—А–Є–љ–Њ–ї–∞ –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б —Д–µ–±—Г–Ї—Б–Њ—Б—В–∞—В–Њ–Љ –љ–Є–ґ–µ –љ–∞ 22% –Є 34% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ [111].
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Э–µ –≤—Л–Ј—Л–≤–∞–µ—В —Б–Њ–Љ–љ–µ–љ–Є–є —В–Њ—В —Д–∞–Ї—В, —З—В–Њ –У–£ —Б–ї—Г–ґ–Є—В –Ї–ї—О—З–µ–≤—Л–Љ –§–† –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –њ–Њ–і–∞–≥—А—Л. –Ю–і–љ–∞–Ї–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –£–°–Ґ –њ—А–Є –С–У–£, –њ—А–Њ—В–µ–Ї–∞—О—Й–µ–є –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –Ъ–Ч, –і–Њ —Б–Є—Е –њ–Њ—А —П–≤–ї—П–µ—В—Б—П –њ—А–µ–і–Љ–µ—В–Њ–Љ –і–Є—Б–Ї—Г—Б—Б–Є–є.. –Э–∞—А—П–і—Г —Б —Н—В–Є–Љ –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –і–Њ–Ї–∞–Ј–∞–љ—Л –њ—А—П–Љ—Л–µ –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ —Б–≤—П–Ј–Є –У–£ —Б —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ–Љ –Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ–Љ –њ–∞—В–Њ–ї–Њ–≥–Є–Є —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Є—Б—В–µ–Љ—Л, –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ –Њ–њ–Њ—А–љ–Њ-–і–≤–Є–≥–∞—В–µ–ї—М–љ–Њ–≥–Њ –∞–њ–њ–∞—А–∞—В–∞, –±–Њ–ї–µ–Ј–љ—П–Љ–Є –њ–Њ—З–µ–Ї –Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ. –Ш–Љ–µ–љ–љ–Њ –њ–Њ—Н—В–Њ–Љ—Г –≤ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е –†–Ь–Ю–Р–У, IDEA –Є —А—П–і–µ –і—А—Г–≥–Є—Е –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Є—Е —Б–Њ–Њ–±—Й–µ—Б—В–≤ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –њ–Њ–Ї–∞–Ј–∞–љ–Є—П –і–ї—П –Є–љ–Є—Ж–Є–∞—Ж–Є–Є –£–°–Ґ –њ—А–Є –С–У–£, –≤ –њ–µ—А–µ—З–µ–љ—М –Ї–Њ—В–Њ—А—Л—Е –≤—Е–Њ–і—П—В –≤—Л—Б–Њ–Ї–Є–µ —А–Є—Б–Ї–Є —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е —Б–Њ–±—Л—В–Є–є –≤ –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Р–У –Є –Ш–С–°, –∞ —В–∞–Ї–ґ–µ –•–С–Я –Є –Ь–°. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ –љ–∞–Ј—А–µ–ї–∞ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –≤ —А–∞–Ј—А–∞–±–Њ—В–Ї–µ –Љ–µ–ґ–і–Є—Б—Ж–Є–њ–ї–Є–љ–∞—А–љ–Њ–≥–Њ –Ї–Њ–љ—Б–µ–љ—Б—Г—Б–∞ –њ–Њ –≤–µ–і–µ–љ–Є—О –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –С–У–£ –Є –љ–∞–ї–Є—З–Є–µ–Љ –Ї–Њ–Љ–Њ—А–±–Є–і–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –Ї–Њ—В–Њ—А—Л–є –±–∞–Ј–Є—А–Њ–≤–∞–ї—Б—П –±—Л –љ–∞ —А–µ–Ј—Г–ї—М—В–∞—В–∞—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Є –∞–љ–∞–ї–Є–Ј–µ –і–∞–љ–љ—Л—Е –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ—Л—Е –Є –Ј–∞—А—Г–±–µ–ґ–љ—Л—Е —А–µ–≥–Є—Б—В—А–Њ–≤.
–С–ї–∞–≥–Њ–і–∞—А–љ–Њ—Б—В—М
–Р–≤—В–Њ—А—Л –Є —А–µ–і–∞–Ї—Ж–Є—П –±–ї–∞–≥–Њ–і–∞—А—П—В –Ю–Ю–Ю ¬Ђ–≠–У–Ш–°-–†–£–°¬ї –Ј–∞ –њ—А–µ–і–Њ—Б—В–∞–≤–ї–µ–љ–Є–µ –њ–Њ–ї–љ—Л—Е —В–µ–Ї—Б—В–Њ–≤ –Є–љ–Њ—Б—В—А–∞–љ–љ—Л—Е —Б—В–∞—В–µ–є, —В—А–µ–±–Њ–≤–∞–≤—И–Є—Е—Б—П –і–ї—П –њ–Њ–і–≥–Њ—В–Њ–≤–Ї–Є –і–∞–љ–љ–Њ–є –њ—Г–±–ї–Є–Ї–∞—Ж–Є–Є.








.gif)



